Beratung - Inhalation
Werbung
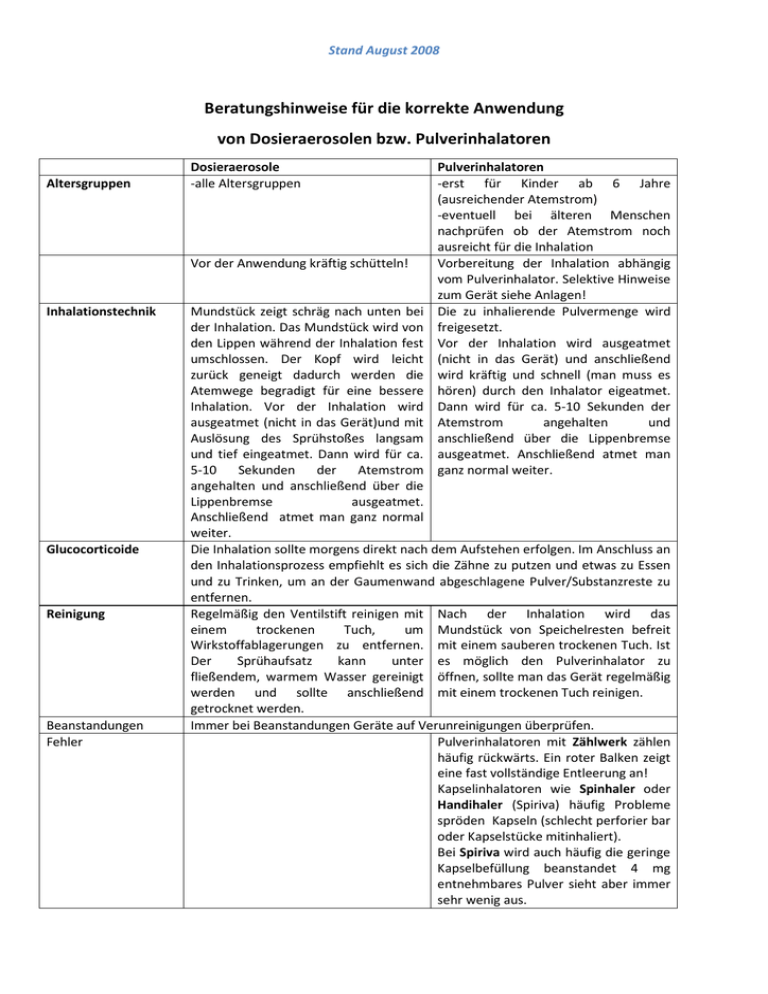
Stand August 2008 Beratungshinweise für die korrekte Anwendung von Dosieraerosolen bzw. Pulverinhalatoren Altersgruppen Dosieraerosole -alle Altersgruppen Vor der Anwendung kräftig schütteln! Inhalationstechnik Glucocorticoide Reinigung Beanstandungen Fehler Pulverinhalatoren -erst für Kinder ab 6 Jahre (ausreichender Atemstrom) -eventuell bei älteren Menschen nachprüfen ob der Atemstrom noch ausreicht für die Inhalation Vorbereitung der Inhalation abhängig vom Pulverinhalator. Selektive Hinweise zum Gerät siehe Anlagen! Die zu inhalierende Pulvermenge wird freigesetzt. Vor der Inhalation wird ausgeatmet (nicht in das Gerät) und anschließend wird kräftig und schnell (man muss es hören) durch den Inhalator eigeatmet. Dann wird für ca. 5-10 Sekunden der Atemstrom angehalten und anschließend über die Lippenbremse ausgeatmet. Anschließend atmet man ganz normal weiter. Mundstück zeigt schräg nach unten bei der Inhalation. Das Mundstück wird von den Lippen während der Inhalation fest umschlossen. Der Kopf wird leicht zurück geneigt dadurch werden die Atemwege begradigt für eine bessere Inhalation. Vor der Inhalation wird ausgeatmet (nicht in das Gerät)und mit Auslösung des Sprühstoßes langsam und tief eingeatmet. Dann wird für ca. 5-10 Sekunden der Atemstrom angehalten und anschließend über die Lippenbremse ausgeatmet. Anschließend atmet man ganz normal weiter. Die Inhalation sollte morgens direkt nach dem Aufstehen erfolgen. Im Anschluss an den Inhalationsprozess empfiehlt es sich die Zähne zu putzen und etwas zu Essen und zu Trinken, um an der Gaumenwand abgeschlagene Pulver/Substanzreste zu entfernen. Regelmäßig den Ventilstift reinigen mit Nach der Inhalation wird das einem trockenen Tuch, um Mundstück von Speichelresten befreit Wirkstoffablagerungen zu entfernen. mit einem sauberen trockenen Tuch. Ist Der Sprühaufsatz kann unter es möglich den Pulverinhalator zu fließendem, warmem Wasser gereinigt öffnen, sollte man das Gerät regelmäßig werden und sollte anschließend mit einem trockenen Tuch reinigen. getrocknet werden. Immer bei Beanstandungen Geräte auf Verunreinigungen überprüfen. Pulverinhalatoren mit Zählwerk zählen häufig rückwärts. Ein roter Balken zeigt eine fast vollständige Entleerung an! Kapselinhalatoren wie Spinhaler oder Handihaler (Spiriva) häufig Probleme spröden Kapseln (schlecht perforier bar oder Kapselstücke mitinhaliert). Bei Spiriva wird auch häufig die geringe Kapselbefüllung beanstandet 4 mg entnehmbares Pulver sieht aber immer sehr wenig aus. Beratungswissen Peak-Flow Das Gerät ist ein Medizinprodukt zur Kontrolle der Asthmatherapie durch den Patienten selbst. Dabei wird in das Peak-Flow Gerät kräftig ausgeatmet. Der Messwert wird notiert in einem Therapietagebuch. Bei optimaler Therapie erhöht sich das Atemvolumen des Patienten. Es handelt sich dabei immer um Vergleichsmessungen zum vor der Therapie bestimmten Bestwert des Patienten. Die Messung erfolgt immer in aufrechter Sitzposition. Dann wird das Peak-Flow-Meter auf Null gesetzt und waagerecht vor den Mund gehalten. Der Patient soll tief einatmen, dann das Mundstück mit den Lippen umschließen und anschließend schnell und mit aller Kraft in einem Atemstoß ausatmen. Anschließend kann der Messwert abgelesen werden. Es handelt sich dabei immer um Vergleichsmessungen. COPD- Chronisch Obstruktive Bronchitis Die COPD gehört zu den weltweit am häufigsten auftretenden Erkrankungen. Nach Schätzungen der Weltgesundheitsorganisation wird COPD bis zum Jahr 2020 die dritthäufigste Erkrankung nach Herzerkrankung oder Schlaganfall sein. Bei der chronisch obstruktiven Bronchitis handelt es sich, um eine lebenslang bestehende Krankheit mit oder ohne Lungenemphysem. Die typischen Symptome sind exzessive Schleimproduktion, Husten und Atemnot. COPD kann nicht geheilt werden, aber in Ihrem Verlauf beeinflusst werden. Kennzeichen der Erkrankung ist die Zerstörung der Alveolen durch exogene Noxen und/oder chronischen Entzündungsvorgänge, welche wenigsten 3 Monate über 2 Jahre bestehen. Die COPD ist charakterisiert durch Atemwegsobstruktionen, welche nicht vollständig reversibel sind. Die Atemwegsobstruktion zeigt häufig einen fortschreitenden Verlauf, durch den es zu einer zunehmenden Verschlechterung der Lebensqualität und der Leistungsfähigkeit kommt. Sie ist verbunden mit einer abnormen Entzündungsreaktion, welche durch Partikel in Stäuben, Rauch oder durch Gase ausgelöst wird. Hauptursache einer COPD ist das Rauchen, rezidivierende bronchiale Infekte oder in seltenen ein Mangel an α1-Antitrypsin. Der Mangel an α1-Antitrypsin führt dazu, dass einer Zerstörung des Lungengewebes durch Lungen-Proteasen nicht entgegengewirkt wird und das Lungengewebe. Hauptproblem der COPD ist die Zerstörung des Lungenparenchyms. Dadurch reduziert sich nach und nach die Fläche für den Gasaustausch verfügbar ist. Es entwickelt sich eine alveoläre Hypoventilation. Die Erkrankung führt zu einem Verlust der Elastizität und zu Mikrozerstörungen der Bronchiolen, welche infolge dessen kollabieren. Die COPD-Pathologie ist permanent, fortschreitend und unumkehrbar. Es gilt daher die Krankheit möglichst frühzeitig therapeutisch zum Stillstand zu bringen. Die COPD tritt häufig zusammen mit anderen Erkrankungen auf, wie der KHK, Herzinsuffizienz oder metabolisch-endokrinen Störungen wie Diabetes, Kachexie oder Osteoporose, sowie Depressionen. Dabei muss man bei der Wahl der Medikamente immer auf diese Begleiterkrankung Rücksicht nehmen. Die Klassifikation der COPD erfolgt nach Empfehlungen des sogenannten Gold-Komitees, dazu werden nicht nur die Messungen der Lungenfunktion (Spirometrie) berücksichtigt, sondern auch die jährlichen Exazerbationen und die klinischen Symptome. Es gilt zwei Exazerbationen pro Jahr vermindern die Lebenserwartung. Fünf Jahre nach einer schweren Exazerbation sind 55% der Patienten verstorben. Therapie: Umfasst Prävention, Physiotherapie, medikamentöse Therapie, körperliches Training, Ernährungsberatung etc. Zur Prävention gehört als vorrangiges Ziel der Verzicht auf das Tabakrauchen. Dabei können Raucherentwöhnungsprogramme und eine Pharmakotherapie zur Behandlung der Nikotinabhängigkeit die Erfolgsquoten der Entwöhnungsprogramme steigern. Handelt es sich um eine berufsbedingte COPD kann der Schweregrad durch die Reduktion von inhalativen Noxen vermindert werden. Schutzimpfungen Patienten mit COPD sollten jährlich eine Influenzaschutzimpfung erhalten, da sie zu einer erheblichen Reduktion der Morbidität führt und das Auftreten von Sekundärpneumonien reduziert. Weiterhin wird die Pneumokokkenschutzimpfung für alle COPD Patienten empfohlen, dabei erfolgt die Auffrischungsimpfung dann 5-6 Jahre nach der Erstimpfung. Medikamentöse Therapie Bronchodilatatoren (Anticholinergika, β2-Sympathomimetika und Theophyllin) sind Basismedikamente zur Linderung der Beschwerden bei COPD. Die Wahl zwischen Anticholinergika und β2-Sympathomimetika hängt vom individuellen Ansprechen der Patienten und eventueller Nebenwirkungen ab. Bronchodilatoren reduzieren den Muskeltonus und damit den Atemwegswiderstand und führen durch die Abnahme der Lungenüberblähung zur Symptomlinderung. Die Therapie der COPD mit inhalativen Medikamenten ist immer einer oralen Applikation vorzuziehen, da eine orale Einnahme immer mit stärken Nebenwirkungen verbunden sein kann. Die meisten COPD Patienten sollten wegen einer Vielzahl von unerwünschten Effekten nicht dauerhaft mit systemischen Glukokortikoiden behandelt werden. Erst für Patienten mit einer postbronchodilatorisch Einsekunden-Lungen-Kapazität unter 50 % ist eine inhalative Dauertherapie mit Glukokortikoiden sinnvoll. Patienten mit COPD profitieren von körperlichem Training hinsichtlich ihrer Belastbarkeit und Ermüdung. Ebenfalls positiv für die Prognose von COPD Patienten mit einer respiratorischen Insuffizienz ist die Langzeitsauerstofftherapie. Asthma bronchiale Beim Asthma bronchiale handelt es sich um eine sehr häufig auftretende Erkrankung der Atemwege mit chronisch entzündlichem Verlauf. Aufgrund der Erkrankung kann es anfallsweise zu Atemnot mit eingeschränkter Ausatmung kommen. Die Atemwege zeigen eine verstärkte Reaktion des Bronchialsystems. Die häufigsten Asthmaanfälle treten in den frühen Morgenstunden oder während der Nacht auf. Typische Symptome sind pfeifende und giemende Geräusche als Zeichen der erschwerten Ausatmung, sowie Kurzatmigkeit und das Abhusten von zähem glasigem Schleim. Durch die Erkrankung ist die körperliche Leistungsfähigkeit eingeschränkt. Es gibt verschiedene Auslöser für asthmatische Beschwerden. Je nach Ursache unterteilt man in allergisches oder extrinsisches Asthma und intrinsisches oder nicht-allergisches Asthma, wobei auch Mischformen auftreten können. Asthma betrifft häufiger Kinder mit 10 % als Erwachsene mit 5 %. Es wird vermutet, dass es sich um eine Entwicklungs- oder Anpassungsstörung handelt, welche sich im Rahmen der körperlichen Auseinandersetzung mit der Umwelt vollzieht. Asthma manifestiert sich als Funktionsstörung der Lunge. Ursächlich gestört ist jedoch das lokale pulmonale Immunsystem, nicht die Lunge. Durch die Störung des pulmonalen Immunsystems kommt zu einer „Überreaktivität“ der Lunge, was sich durch Entzündungen, übermäßige Schleimproduktion und verstärkte Kontraktionsneigung der Bronchen äußert. Allergisches (extrinsisches) Asthma Ursächlich wird eine genetische Disposition oder eine Überreaktion des Immunsystems mit Beteiligung der Typ-2-T-Helferzellen angenommen. Die Typ-2-T-Helferzellen regen die Einwanderung und Aktivierung von Immunzellen im Lungengewebe an. Die Initialisierung erfolgt durch eine Provokation von IgE ausgelöst z.B. durch verschiedene Allergene (wie Pollen, Hausstaubmilben oder Tierhaare). Nach dem Erstkontakt kommt es zu einer verstärkten IgE-vermittelten Freisetzung von Entzündungsmediatoren aus Mastzellen und anderen Immunzellen wie Granulozyten. Die Mastzellen werden auf der Intrinsisches Asthma Diese Asthmaform wird häufig durch Infekte der Atemwege ausgelöst. Es lassen sich jedoch im Vergleich zum allergischen Asthma keine Allergene oder IgE-Antikörper nachweisen. Entscheidender pathogener Ausgangpunkt ist hier jedoch ebenfalls die „Überreaktivität“. Intrinsisches Asthma kann nicht nur durch Infekte sondern auch durch Tabakrauch, Kaltluft, Nebel, körperliche Anstrengung oder Medikamente ausgelöst werden. Bronchialschleimhaut aktiviert und schädigen zunächst das Bronchialepithel. Später dringen sie in tiefere Zellschichten des Lungengewebes ein und aktivieren tiefer liegende Immun- und Entzündungszellen. Die Entzündungsreaktionen schreiten fort und das Eindringen von Allergenen wird erleichtert. Es kommt zur klassischen Immunreaktion mit der Bildung von spezifischen TZellen. Es kommt zum selbstverstärkten Fortschreiten von Zerstörung und Entzündung und damit zu den typischen Asthma-Symptomen aus Bronchokonstriktion, Schleimproduktion sowie Mukosaödemen. Es gibt fließende Übergänge zwischen intrinsischen und allergischem Asthma sowie der COPD. So kann eine anfänglich allergische Asthmaerkrankung später durch ein stärkeres intrinsisches Asthma überlagert werden. Desweiteren kann auch durch verschiedene Medikamente ein Asthma ausgelöst werden. Asthmaanfälle treten stärker zur Nacht auf und zeigen ein Maximum gegen vier Uhr morgens. Dieser Effekt lässt sich dadurch erklären, dass die Freisetzung verschiedener körpereigener Stoffe einem TagesNacht-Rhythmus folgt. Gegen vier Uhr morgens zeigen Stoffe, welche gegen Asthma schützen bzw. die Bronchen weitern (Cortison oder Catecholamine) ein Minimum und Asthma stimulierende Faktoren ihr zirkadianes Maximum (Acetylcholin, Histamin). Die Klassifizierung von Asthma erfolgte bis vor kurzen nach Schwergeraden. Diese Einteilung war Grundlage für die Therapie-Stratifizierung, welche jedoch nur sinnvoll ist bei Patienten die keine Asthmamedikamente einnehmen. Für die Verlaufskontrolle bei Asthma ist die Einteilung nicht geeignet. Wirkstoffe gegen Asthma und COPD Medikamente gegen Asthma unterdrücken entweder die Entzündung wie die Glucocorticoide (sog. Controller) oder bewirken eine Bronchodilatation (Reliever) z.B. die β2-Mimetika. β2-Mimetika kurz wirksam Fenoterol Reproterol Salbutamol Terbutalin lang wirksam Bambuterol Clenbuterol Formoterol Indacaterol Salmeterol Anticholinergika Aclidiniumbromid Glycopyrronium Ipratropium Tiotropium Glucocorticoide Beclometasondipropionat Budesonid Ciclesonid Fluticason Mometason Adenosin-Rezeptor-Antagonist Berotec Bronchospasmin Sultanol Bricanyl Bambec Spiropent Foradil Onbrez Aeromax Eklira, Genuair Seebri Breezhaler Atrovent Spiriva Ventolair Pulmicort Alvesco Flutide Asmanex Theophyllin Leukotrien-Rezeptor-Antagonisten Montelukast Mastzellstabilisatoren Cromoglicinsäure IgE-Antikörper Omalizumab PDE-4-Inhibitor Roflumilast Kombipräparate Formoterol+Beclometason Formoterol+Budenosid Formoterol+Fluticason Salmeterol+Fluticason Feneterol+Ipatropium Salbutamol+Ipatropium Reproterol-Cromoglicinsäure Bronchoretard Singulair Intal Xolair Daxas Foster Symbicort Flutiform Viani Berodual Ipramol Teva Aarane Anticholinergika bewirken durch die Hemmung von muskarinergen M3-Acetylcholin-Rezeptoren eine Entspannung der glatten Bronchialmuskulatur. Da beim Asthma die Rolle des Parasympathikus relativ gering ist werden Anticholinergika nur bei leichten asthmatischen Beschwerden eingesetzt. Anticholinergika sind jedoch bei der Therapie der COPD ein Standard und werden verwendet um die Bronchien zu erweitern, die Schleimsekretion zu reduzieren, das Dyspnoeempfinden und die Leistungsfähigkeit zu verbessern. Bei der Therapie obstruktiver Lungenerkrankungen werden hauptsächlich Wirkstoffe verwendet, welche nicht ins ZNS übertreten können. Dabei kommt es nach inhalativer Anwendung von Ipratropiumbromid zu einem schnellen Wirkungseintritt mit längerer Wirkung, als der von kurzwirksamen β2-Sympathomimetika. Tiotropium ist ein bevorzugter M3-Antagonist mit langer Wirkdauer, welcher eigentlich nur für die COPD zugelassen ist, aber wegen seiner guten symptomatischen Wirkung off Label bei Asthma Anwendung findet. In letzter Zeit wurden zwei weitere langwirksame Anticholinergika für die Therapie der COPD zugelassen. Aclidiniumbromid ist ein M3-Rezeptorantagonist mit zweimal täglicher Anwendung und geringen systemischen Nebenwirkungen. Desweiteren wurde Glucopyrronium als langwirksames (30-40 h)inhalierbares Anticholinergikum auf den Markt gebracht, nachdem es schon mehrere Jahre für die intravenöse bzw. intramuskuläre Gabe in der Anästhesie zur Verfügung stand. β2-Sympathomimetika sind in inhalativer Form Basistherapeutika gegen akute Atemnot sogenannte Reliever, da sie die glatte Muskulatur relaxieren. Dabei finden sowohl kurzwirksame β2Sympathomimetika wie Salbutamol oder Fenoterol Anwendung, als auch rasch und langwirksame Wirkstoffe wie Formoterol. Sowohl Formoterol als auch Salmeterol führen zu einer effektiven Reduktion der Atemnot am Tage und in der Nacht und zu einer Besserung der Lungenfunktion einschließlich einer Abnahme der Überblähung der Lunge. Da sich β2-Rezeptoren auch auf den Immunzellen befinden kommt es neben der Bronchodilatation auch zu einer anti-inflammatorischen Wirkung. Weitere zu beobachtende Effekte sind die Anregung der Flimmerbewegung der Zilien und damit die Verbesserung der mukoziliären Clearance, sowie der Reduktion der Extravasation und der Ödembildung. Leider zeigt sich bei den beschriebenen Effekten auch eine Toleranzentwicklung bei der Dauerstimulation von β-Rezeptoren. Als Folge der dauerhaften Verwendung von Agonisten kommt es zu einer Herunterregulation der β-Rezeptoren-Expression und der Entkoppelung der Signaltransduktion vom Rezeptor. Es kommt unter einer chronischen Monotherapie bei allen β2Sympathomimetika zu einem antiasthmatischen Wirkverlust. Als unerwünschte Wirkung können vor allem Herzrhythmusstörungen auftreten. Daher sind β2Sympathomimetika bei Patienten mit Herzinsuffizienz und koronarer Herzerkrankung sowie einer Neigung zu Arrhythmien nur unter sorgfältiger Kontrolle zu verwenden. Medikament Dosieraerosol/ Vernebler (mg) Tabletten (mg) Wirkdauer (h) 20-40/200 18 0,25-0,5 - - 6-8 24 100-200 100-200 500 6-24 50-100 Kombi Cromoglicinsäure - 0,2-0,4 1,25-2,5 2,5-10 - 4-8 2,5-7,5 10 - 4-6 4-6 4-6 24 12 12 1,5 - - Pulverinhalator (µg) Anticholinergika Ipratropiumbromid Tiotropiumbromid β2Sympathomimetika Fenoterol Salbutamol Terbutalin Bambuterol Formoterol Salmeterol Reproterol (auch i.v.) Clenbuterol Indacaterol (nur COPD) Methylxanthine Theophyllin Kombipräparte Fenoterol+Ipatropium 50/20-100/40 - 0,05/0,0250,1/0,05 12-15 24 100-500 Variabel (<24) 6-8 Theophyllin hat schwächere bronchodilatatorische Eigenschaften als die Anticholinergika und die β2Sympathomimetika. Jedoch besitzt Theophyllin nicht nur Eigenschaften eines Relievers sondern hemmt die Entzündungsprogression und die Hyperreagibilität. Dabei inhibiert Theophyllin Adenosin-Rezeptoren, welche sonst eine Kontraktion der Bronchialmuskulatur, sowie die Histaminfreisetzung von Leukozyten stimuliert. Neben der Weitung der Bronchen kann durch die Gabe von Theophyllin bei COPD Patienten eine Steigerung der Atemmuskelkraft und die Zunahme der Auswurffraktion des rechten Ventrikels beobachtet werden. Ist eine Langzeittherapie mit Theophyllin vorgesehen, dann sollten möglichst Retardpräparate verwendet werden. Für Theophyllinpräparate ist eine Dosistitration entsprechend der Serumkonzentration (10-15mg/l) und in Abhängigkeit unerwünschter Effekte notwendig, da der Wirkstoff eine sehr enge therapeutische Breite hat. Die Theophyllinclearance ist abhängig von einer ganzen Reihe verschiedener Einflußfaktoren, z.B. steigern Tabakrauchen oder Proteinreiche Kost und einige Medikamente. Inhalative Glucocorticoide bilden die Basistherapie bei asthmatischen Erkrankungen. Die Glucocorticoide wirken gegen entzündliche Reaktionen, Schleimbildung und die Zerstörung des Lungenepithels. Zusätzlich verstärken die Glucocorticoide die Wirksamkeit der β2-Sympathomimetika über eine Zunahme der Empfindlichkeit der β2-Rezeptoren und sie reduzieren die Toleranzentwicklung. Empfohlen wird daher die Glucocorticoide so früh wie möglich einzusetzen. Um die systemischen Nebenwirkungen so weit wie möglich zu reduzieren wurden Glucocorticoide entwickelt welche durch den inhalativen Einsatz überwiegend auf der Lunge wirken. Dazu gibt es zwei Wege, wie die On-site Aktivierung (der eigentliche Wirkstoff wird auf der Lunge aus einem Prodrug gebildet) oder modifizierte Wirkstoffe (Steroidgerüst ist so verändert das der Wirkstoff bei fehlerhafter Applikation nicht gastrointestinal resorbiert wird oder bei systemischer Verfügbarkeit einem schnellen Abbau durch die Leber unterliegt). Die inhalativen Glucocorticoide zeigen eine sehr hohe Affinität zu den Glucocorticoid-Rezeptoren, welche 20-mal höher ist als die der stärksten systemisch verfügbaren Glucocorticoide wie Dexamethason bzw. Betamethason. Systemische Glucocorticoide wie oral oder intravenös applizierte Wirkstoffe werden hauptsächlich zur Langzeittherapie, Akuttherapie und im Status asthmaticus verwendet. Da die anti-asthmatische Wirkung stark dosisabhängig, aber die Dosis-Wirkungskurve flach verläuft sind je nach Krankheitsstufe Dosisverdoppelungen notwendig. Die Wirklatenz systemischer Glucocorticoide beträgt einige Tage bis eventuell sogar zwei Wochen. Mastzellstabilisatoren wie Cromoglicinsäure stabilisiert die Mastzellen und verhindert so eine Freisetzung von Entzündungsmediatoren. Sie schwächt prophylaktisch inflammatorische Sofort- und Spätreaktionen ab. Da Cromoglicinsäure sehr Polar ist und eine geringe Lipophilie besitzt wird sie kaum intestinal resorbiert und kann daher nur inhalativ für die Asthmatherapie eingesetzt werden. Cromoglicinsäure wirkt erst mit einer Verzögerung von zwei bis sechs Wochen, d.h. bei allergischem Asthma muss sie schon frühzeitig einige Wochen vor dem Beginn des Pollenfluges verwendet werden. Leukotrien-Rezeptor-Antagonisten Leukotriene (LTd4 sind eine Gruppe von verschiedenen Entzündungsmediatoren, welche an der Lunge stark bronchokonstriktorisch wirken. Ihre Wirkung erzielen die Leukotriene über Leukotrien-Rezeptoren (LT). Leukotrien-Rezeptor-Antagonisten (Montelukast) hemmen kompetetiv den Rezeptor und verhindern so Leukotrien gestützte Enzündungsmechanismen auf den Bronchen und erleichtern die Atmung. Es gibt es Asthmaformen bei denen Leukotriene nicht am Entzündungsgeschehen beteiligt sind, für diese Patienten ist diese Zusatztherapie ohne Nutzen. Montelukast ist für die Therapie bei Kindern ab 6 Monaten zugelassen. IgE-Antikörper sind wesentliche Vermittler von Allergischen Reaktionen. Es gibt seit einigen Jahren einen IgE-Antikörper, welcher an freies IgE bindet und so die allergische Reaktionskaskade unterbindet. Eingesetzt wird der Wirkstoff Omalizumab bei moderatem bis schwerem persistierendem allergischem Asthma, welches schon mit Glucocorticoiden und β2-Sympathomimetika behandelt wird. Dabei erfolgt die Dosierung des Wirkstoffes (75-375 mg subcutan) anhand des IgE-Spiegels und des Körpergewichtes alle 2-4 Wochen. Die Anwendung ist für Erwachsene und Kinder ab 12 Jahren zugelassen. Sollte die Therapie innerhalb von 16 Wochen keinen Erfolg erzielen, wird empfohlen die Behandlung abzubrechen. Unter der Verwendung von Omalizumab kann es zu schweren allergischen Reaktionen mit anaphylaktischen Schock kommen. Auch das Tumorrisiko ist erhöht. PDE-4-Inhibitor Der Wirkstoff Roflumilast, ein Stoff aus der Gruppe der Phosphodiesterase-4-hemmer, wird für die Dauertherapie bei chronischer Bronchitis und schwerer COPD zusätzlich zu bronchodilatorischen Wirkstoffen eingesetzt. Die Behandlung mit Roflumilast verbessert die Lungenfunktion und senkt die Exazerbationsrate, wird jedoch nach der bisherigen Studienlage nicht für die Therapie empfohlen. Die Hemmung der Phosphodiesterase führt zu einer Reduktion von Entzündungsmediatoren und zu einem verminderten Einstrom von Neutrophilen und Eosinophilen in die Atemwege. Häufigste Nebenwirkung sind Magen-Darm-Beschwerden und psychische Störungen.











