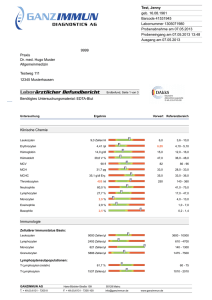
Neue Impfstrategien auf der Basis von Fusionsproteinen zur
Werbung

Neue Impfstrategien auf der Basis von Fusionsproteinen zur zielgerichteten Antigenaufnahme und Stimulation von dendritischen Zellen Dissertation Zur Erlangung des Grades eines Doktors der Naturwissenschaft an der Fakultät für Chemie und Biochemie der Ruhr-Universität Bochum angefertigt in der Abteilung für molekulare und medizinische Virologie, Fakultät für Medizin, Ruhr-Universität Bochum Leiter: Prof. Dr. K. Überla vorgelegt von Matthias Tenbusch aus Bottrop Bochum, Mai 2007 Inhaltsverzeichnis Inhaltsverzeichnis INHALTSVERZEICHNIS ....................................................................................................................................I ABKÜRZUNGSVERZEICHNIS .......................................................................................................................IV 1. ZUSAMMENFASSUNG................................................................................................................................... 1 2. EINLEITUNG ................................................................................................................................................... 3 2.1 HIV/AIDS..................................................................................................................................................... 3 2.1.1 Infektion und natürliche Immunreaktion............................................................................................... 3 2.1.2 Impfstoffentwicklung ............................................................................................................................. 5 2.2 GENETISCHE IMPFSTOFFE .............................................................................................................................. 7 2.3 DENDRITISCHE ZELLEN (DZ)....................................................................................................................... 10 2.3.1 Kontrolle des Immunsystems............................................................................................................... 10 2.3.1 Gezielte Rezeptor-vermittelte Antigenaufnahme durch DZ als Vakzin-Strategie................................ 12 2.4 GENETISCHE ADJUVANTIEN......................................................................................................................... 14 2.4.1 Granulozyten-Makrophagen-koloniestimulierender Faktor (GM-CSF) ............................................. 14 2.4.2 CD40 Ligand (CD40L) ....................................................................................................................... 16 2.5 ZIELSETZUNG DER ARBEIT .......................................................................................................................... 17 3.MATERIAL ...................................................................................................................................................... 18 3.1 VERSUCHSTIERE, ZELLLINIEN UND BAKTERIENSTÄMME ............................................................................. 18 3.1.1 Versuchstiere ...................................................................................................................................... 18 3.1.2 Zelllinien ............................................................................................................................................. 18 3.1.3 Bakterienstämme................................................................................................................................. 18 3.2 NUKLEINSÄUREN ......................................................................................................................................... 19 3.2.1 Plasmide.............................................................................................................................................. 19 3.2.2 Oligonukleotide................................................................................................................................... 20 3.3 PEPTIDE ....................................................................................................................................................... 21 3.4 ANTIKÖRPER................................................................................................................................................ 21 3.5. ENZYME...................................................................................................................................................... 21 3.5.1 Restriktionsendonukleasen.................................................................................................................. 21 3.5.2 Weitere Enzyme................................................................................................................................... 22 3.6 REAGENZIEN................................................................................................................................................ 22 3.7 MEDIEN, PUFFER UND LÖSUNGEN ............................................................................................................... 23 3.7.1 Medien für Bakterienkultur................................................................................................................. 23 3.7.2 Puffer und Lösungen für molekularbiologische Arbeiten ................................................................... 23 3.7.2.1 Lösungen für DNA-Gelelektrophorese..........................................................................................................23 3.7.3 Puffer und Lösungen für proteinbiochemische Arbeiten..................................................................... 24 3.7.3.1 Lösungen für SDS-PAGE und Western Blot.................................................................................................24 3.7.3.2 Lösungen für Ni2+-Aufkonzentrierung ..........................................................................................................24 3.7.4 Medien und Lösungen für Zellkultur................................................................................................... 25 3.7.4.1 Medien...........................................................................................................................................................25 3.7.4.2 Lösungen für die Zellkultur...........................................................................................................................26 3.7.4.3 Lösungen für Transfektionen.........................................................................................................................26 3.7.4.4 Lösungen für MTT-Proliferationstest............................................................................................................26 3.7.4.5 Lösungen für Lymphozyten-Isolation ...........................................................................................................26 3.7.4.6 Lösungen für Immunassays...........................................................................................................................26 3.8 STANDARDS ................................................................................................................................................. 27 3.8.1 DNA-Längenstandards ....................................................................................................................... 27 3.8.2 Protein-Größenstandard..................................................................................................................... 27 3.9 REAGENZSYSTEME ...................................................................................................................................... 27 3.10 VERBRAUCHSMATERIALIEN ....................................................................................................................... 28 3.11 GERÄTE / TECHNISCHE AUSSTATTUNG ...................................................................................................... 28 4. METHODEN ................................................................................................................................................... 30 4.1 MOLEKULARBIOLOGISCHE METHODEN ....................................................................................................... 30 4.1.1 Plasmidisolation aus Bakterien .......................................................................................................... 30 4.1.1.1 Analytischer Maßstab (Minipräparation).......................................................................................................30 4.1.1.2 Quantitativer Maßstab (Maxi- bzw. Gigapräparation)...................................................................................30 4.1.2 Konzentrationsbestimmung von DNA ................................................................................................. 30 4.1.3 Spaltung von DNA mittels Restriktionsendonukleasen ....................................................................... 31 I Inhaltsverzeichnis 4.1.4 Agarose-Gelelektrophorese ................................................................................................................ 31 4.1.5 DNA-Extraktion aus Agarose-Gelen................................................................................................... 31 4.1.6 PCR (polymerase chain reaction)....................................................................................................... 32 4.1.7 Ligation............................................................................................................................................... 32 4.1.8 Chemische Transformation von Bakterien.......................................................................................... 33 4.1.9 Ethanolfällung von DNA..................................................................................................................... 33 4.1.10 RNA-Isolation aus Maus-Lymphozyten............................................................................................. 33 4.1.11 cDNA-Synthese ................................................................................................................................. 34 4.1.12 TOPO-TA-Klonierung....................................................................................................................... 34 4.1.13 Herstellung von elektrokompetenten Zellen und Elektroporation..................................................... 34 4.1.14 Homologe Rekombination................................................................................................................. 35 4.2 PROTEINBIOCHEMISCHE METHODEN ........................................................................................................... 35 4.2.1 SDS Polyacrylamid-Gelelektorphorese (SDS-PAGE)......................................................................... 35 4.2.2 Western Blot........................................................................................................................................ 36 4.2.3 Konzentrierung von His6-markierten Proteinen (Ni2+ batch purification).......................................... 37 4.3 ZYTOLOGISCHE METHODEN ........................................................................................................................ 37 4.3.1 Kultivierung von Zelllinien ................................................................................................................. 37 4.3.2 Zellen einfrieren bzw. auftauen........................................................................................................... 38 4.3.3 Transiente Transfektion mittels Calcium-Phosphat Kopräzipitation.................................................. 38 4.3.4 Virus-Anzucht, -Produktion und –Aufreinigung.................................................................................. 39 4.3.5 Bestimmung der optischen und infektiösen Viruspartikel ................................................................... 40 4.3.6 MTT-Proliferationstest für GM-CSF abhängige Zelllinien ................................................................ 40 4.3.7 Nachweis der Bindungsaktivität von Einzelkettenantikörper-Fusionsproteinen an den Zielrezeptor Dec205......................................................................................................................................................... 41 4.3.8 Expressionsanalyse von Oberflächenproteinen mittels Durchflusszytometrie.................................... 41 4.3.9 Generierung von myeloiden Dendritischen Zellen (mDC) aus Knochenmark-Vorläuferzellen.......... 42 4.3.10 Nachweis Antigenspezifischer T-Zellproliferation über CFSE (Carboxyfluorescein Diacetat, Succinimidylester)-Verdünnungsassay ........................................................................................................ 42 4.4 IMMUNOLOGISCHE METHODEN ................................................................................................................... 43 4.4.1 Immunisierung von C57BL/6-Mäusen ................................................................................................ 43 4.4.2 Blutentnahme und Plasmaisolierung .................................................................................................. 44 4.4.3 Isolierung von Lymphozyten aus der Milz........................................................................................... 44 4.4.4 Identifikation antigenspezifischer CD8+ T-Zellen mittels Tetramerfärbung...................................... 44 4.4.5 Intrazelluläre Zytokinfärbung (ICS) ................................................................................................... 45 4.4.6 ELISA (enzyme-linked immunosorbent assay) zur Antikörperbestimmung aus Mausserum............... 45 4.4.7 Bestimmung neutralisierender α-GM-CSF Antikörper in Immunseren .............................................. 46 4.4.8 Antigenspezifisches Tumormodell....................................................................................................... 46 4.4.9 Retrovirales Infektionsmodell mit dem Friend-Viruskomplex (FV) .................................................... 47 5. ERGEBNISSE ................................................................................................................................................. 48 5.1. HERSTELLUNG UND CHARAKTERISIERUNG DER AUF GM-CSF-FUSIONSPROTEINEN BASIERENDEN VAKZINVEKTOREN ........................................................................................................................................................ 48 5.1.1 Klonierung der Expressionsvektoren .................................................................................................. 48 5.1.2 Aufreinigung des Fusionsproteins GM-OVA ...................................................................................... 51 5.1.3 Einfluss von GM-OVA auf die DZ-Entwicklung und Antigenpräsentation ......................................... 52 5.2 IMMUNISIERUNGSSTUDIEN MIT GM-OVA FUSIONSKONSTRUKTEN ............................................................. 53 5.2.1 Einfluss von GM-OVA auf die Immunogenität in Einzelinjektions- oder Prime/Boost-Experimenten 53 5.2.1.1 Einfluss von GM-OVA auf die zelluläre Immunantwort...............................................................................54 5.2.1.2 Einfluss von GM-OVA auf die humorale Immunantwort .............................................................................56 5.2.1.3 Einfluss von GM-OVA in einem antigenspezifische Tumormodell ..............................................................58 5.2.2 Stimulation der CD8+ T-Zellantwort durch bicistronische Vektoren oder biologisch inaktive Fusionsproteine ........................................................................................................................................... 59 5.2.3 Vergleich der humoralen Immunantworten nach Immunisierung mit den unterschiedlichen GM-CSFund OVA-exprimierenden Vektoren ............................................................................................................. 62 5.2.4 Induktion neutralisierender Antikörper gegen GM-CSF .................................................................... 63 5.2.5 Einfluss der GM-CSF-neutralisierenden Antikörper auf die Immunantwort und virale Replikation während einer retroviralen Infektion ........................................................................................................... 65 5.2.6 Vergleich der Adjuvanteffekte von GM-CSF auf die primäre bzw. sekundäre Immunantwort während DNA/Adeno Prime/Boost-Immunisierungen ................................................................................................ 67 5.3. HERSTELLUNG BICISTRONISCHER ADENOVIRALER VEKTOREN ZUR EXPRESSION VON FUSIONSPROTEINEN AUS ΑDEC205-EINZELKETTENANTIKÖRPERN UND OVALBUMIN IN KOMBINATION MIT DZ-STIMULI ............... 69 5.3.1 Klonierung der Expressionsvektoren .................................................................................................. 70 II Inhaltsverzeichnis 5.3.2 Bindungsfähigkeit der Fusionsproteine an DEC205 und Antigenpräsentation durch DZs ................ 72 5.4 IMMUNISIERUNGSSTUDIEN MIT ΑDEC205 FUSIONSKONSTRUKTEN ............................................................. 73 5.4.1 Einfluss von zielgerichteter Antigenaufnahme und GM-CSF Koexpression....................................... 73 5.4.2 Vergleich der immunstimulierenden Wirkung von sCD40L und GM-CSF ......................................... 76 6. DISKUSSION .................................................................................................................................................. 79 7. LITERATURVERZEICHNIS ....................................................................................................................... 87 8. DANKSAGUNG ............................................................................................................................................ 102 9. LEBENSLAUF .............................................................................................................................................. 103 III Abkürzungsverzeichnis Abkürzungsverzeichnis % (v/v) % (w/v) °C Volumenprozent Gewichtsprozent Grad Celcius AIDS Amp APC AS ATP aquired immunodeficiency syndrome Ampicillin Antigen-präsentierende Zelle Aminosäuren Adenosintriphosphat bp BSA Basenpaare bovine serum albumin CFSE ConA Carboxyfluorescein Diacetat, Succinimidylester Concanavalin A DZ DNA dNTP dendritische Zelle Desoxyribonukleinsäure Desoxyribonukleotidtriphosphat E E.coli ECL EDTA env EtBr Extinktion Eschericha coli enhanced chemiluminescence Ethylendiamintetraessigsäure envelope Etidiumbromid F FACS FKS Farad fluorescence activated cell sorter fötales Kälberserum g GM-CSF Gramm Granulozyten-Makrophagen Kolonie-stimulierender Faktor Glykoprotein gp h HBS HEPES HIV HRP Stunde HEPES buffered saline 2-[4-(2-Hydroxyethyl)-1piperazinyl]-Ethansulfon-säure human immunodeficiency virus horseradish peroxidase i.p. ICL ICS IFN Ig IL ITR intraperitoneal interchain linker Intrazelluläre Zytokinfärbung Interferon Immunglobulin Interleukin inverted terminal repeat Kan kb kD KDS Kanamycin Kilobasen Kilodalten Kaliumdodecylsulfat λ l LB LYS Wellenlänge Liter Luria Bertani Lysat µg µl m MCS mg MHC min ml Mikrogramm Mikroliter Murin Multiple cloning site Milligramm major histocompatibility complex Minute Milliliter nm Ω OD ori OVA Nanometer Ohm optische Dichte origin of replication Ovalbumin P/S PAGE PBS PCR pg Penicillin/Streptomycin Polyacrylamid Gelelektrophorese phosphate buffered saline polymerase chain reaction Pikogramm rh RNA rpm RT Rhesus Ribonukleinsäure revolutions per minute Raumtemperatur s.c. SDS SIV Subkutan Natriumdodecylsulfat simian immunodeficiency virus TAE TBE TE Tris-Acetat-EDTA Tris-Borat-EDTA Tris-EDTA ÜN ÜS über Nacht Überstand V Vol. Volt Volumen WB Western Blot IV Zusammenfassung 1. Zusammenfassung Dendritische Zellen (DZ) spielen eine zentrale Rolle in der Induktion von Immunantworten gegen virale oder bakterielle Infektionen. In dieser Arbeit wurde daher untersucht, ob die Immunogenität genetischer Impfstoffe durch eine zielgerichtete Antigenaufnahme durch Dendritischen Zellen und kostimulatorische Signale gesteigert werden kann. Zunächst wurde ein Ansatz gewählt, bei dem die zielgerichtete Antigenaufnahme und die Aktivierung durch das immunstimulatorische Protein GM-CSF erfolgen sollte. Aufgrund seiner Immunogenität im Mausmodell wurde Ovalbumin (OVA) als Antigen gewählt. Fusionsproteine aus diesen beiden Komponenten (GM-OVA) zeigten in vitro eine gesteigerte Aktivierung antigenspezifischer CD8+ T-Zellen. Immunisierungsstudien, die sowohl DNA, adenovirale Vektoren als auch Kombinationen aus beiden als Impfstoffe beinhalteten, konnte dies jedoch nicht bestätigt. Im Gegensatz zu den in vitro Experimenten induzierten die Vektoren, die für das Fusionsprotein kodierten, sogar geringere antigenspezifische CD8+ T-Zellantworten als die Kontrollvektoren, die nur das Antigen übertrugen. Die Immunantwort wurde mittels Tetramer- und intrazellulären Zytokinfärbungen (ICS) bestimmt. Diese Reduktion war am deutlichsten nach Prime/Boost-Immunisierungen zu beobachten, bei denen auf eine initiale DNA-Injektion eine Gabe des korrespondierenden adenoviralen Vektors folgte. Unter diesen Bedingungen ging die Reduktion der zellulären Immunantwort mit der Induktion neutralisierender Autoantikörper gegen GM-CSF einher, die nach der zweiten Injektion detektiert werden konnte. In einem retroviralen Infektionsmodell mit dem murinen Friend Virus (FV) konnte allerdings gezeigt werden, dass durch die Präsenz der neutralisierenden Antikörper keine generelle Suppression zellulärer Immunantworten gegenüber nachfolgenden Infektionen ausgelöst wurde. Dennoch weisen die beschriebenen Beobachtungen auf die besondere Vorsicht hin, die bei einem Einsatz solcher Fusionsproteine aus körpereigenen und -fremden Proteinbestandteilen geboten sein sollte. Weitere Experimente zeigten jedoch auch, dass eine unabhängige Expression von GM-CSF und dem Antigen durch bicistronische Vektoren zu einer verbesserten CD8+ Antwort führte, ohne dabei eine ähnliche Autoimmunität wie die Fusionsproteine zu erzeugen. Dies drückte sich hauptsächlich in einer verstärkten Induktion polyfunktionaler T-Zellen aus, die sowohl positiv für den Degranulationsmarker CD107a waren, als auch die Zytokine IFN-γ und IL-2 produzierten. Daher wurde im zweiten Teil untersucht, ob diese Verbesserung in Kombination mit einer anderen Strategie zur zielgerichteten Antigenaufnahme weiter verstärkt werden 1 Zusammenfassung konnte. Die Antigenaufnahme sollte durch Fusionen aus Einzelkettenantikörpern gegen den DZ-Oberflächenrezeptor DEC205 (α-DEC205) und dem Antigen zielgerichtet verlaufen. Analog zu den GM-CSF-Fusionsproteinen führte auch der Einsatz dieser Fusionsproteine in vitro zu einer gesteigerten Aktivierung antigenspezifischer CD8+ T-Zellen durch verstärkte Präsentation durch Dendritische Zellen. In diesen Experimenten wurden adenovirale Vektoren getestet, die unter der Kontrolle eines bidirektionalen Promotors die Fusionsproteine in Kombination mit den DZ-Stimuli GM-CSF oder sCD40L, eine lösliche Form des CD40L, exprimierten. Die Kontrollvektoren kodierten für eine Isotypkontrolle des Einzelkettenantikörpers, die somit zu keiner zielgerichteten Antigenaufnahme führen sollte. Interessanter Weise ähnelten die Ergebnisse denen, die man nach Immunisierung mit den GM-OVA Fusionsproteinen erhielt. Die zielgerichtete Antigenaufnahme führte erneut zu einer reduzierten Induktion der zellulären CD8+ T-Zellantwort. Dennoch konnte auch hier die Aktivierung der polyfunktionalen T-Zellen, CD8+ als auch CD4+ T-Zellen, durch eine Koexpression von GM-CSF verbessert werden, wohingegen die Koexpression von sCD40L nahezu keinen Effekt zeigte. Des Weiteren war die humorale Immunantwort durch die Art der Antigenaufnahme beeinflusst. Die zielgerichtete Variante führte zu einer signifikanten Erhöhung des IgG1/IgG2a-Verhältnis, die bereits in den Studien mit den GM-OVA Fusionsproteinen zu beobachten war und möglicherweise ein Indiz für eine verstärkte Induktion einer TH2-Immunantwort ist. Zusammenfassend zeigten diese beiden Ansätze, dass die Koexpression von GM-CSF in genetischen Immunisierungen, scheinbar einen positiven Einfluss auf die Induktion polyfunktionaler T-Zellantworten besitzt. Im Gegensatz scheint der Einsatz zielgerichteter Antigene die Immunantwort eher in Richtung einer TH2-Antwort zu verschieben, wobei der Einsatz der GM-OVA Fusionsproteine zusätzlich Autoantikörper induzierte. Die Qualität dieser Immunmodulationen muss demnach in geeigneten Infektionsmodellen weiter untersucht werden. 2 Einleitung 2. Einleitung 2.1 HIV/AIDS 2.1.1 Infektion und natürliche Immunreaktion Die Infektion mit dem humanen Immundefizienz-Virus 1 (HIV-1) und die daraus resultierende Immunerkrankung AIDS [1] gehören zu den größten Bedrohungen der menschlichen Gesundheit. Dieses Virus gehört, genau wie das analoge Affenvirus SIV (simian immunodeficiency virus), zu der Familie der Retroviren. Laut WHO/UNAIDS leben geschätzte 40 Millionen Menschen weltweit (Ende 2005) mit der HIV-1 Infektion und es gibt pro Jahr ca. 5 Millionen Neuinfektionen. Die HIV-Infektion ist trotz fortschreitender Entwicklung antiretroviraler Therapeutika (ART), die zudem für den Großteil der Bevölkerung der Entwicklungsländer aufgrund der hohen Kosten nicht zugänglich sind, nicht heilbar [2]. Daher ist die Entwicklung eines präventiven Impfstoffs von herausragender Bedeutung. HIV-1 wird sowohl durch sexuellen Kontakt als auch über kontaminierte Injektionsnadeln oder Blutprodukte übertragen. Dies zeigt eine Besonderheit des Virus, da es sowohl über eine mukosale Barriere als auch über eine direkte Infektion von haematopoetischen Zellen in den Kreislauf geraten kann [3]. Aufgrund der Rezeptorspezifität seines Hüllproteins gp120 infiziert das Virus vorwiegend CD4+ T-Zellen [4], wobei zur Verschmelzung der Virusmembran mit der Zellmembran eine weitere Bindung an den Chemokinrezeptor CCR5 erfolgen muss [5]. Dieser Zelltyp, der CD4 und CCR5-Rezeptoren exprimiert, stellt die Population der Gedächtnis-CD4 Lymphozyten dar und ist somit das primäre Ziel einer HIV-1 Infektion. Die Infektion und Zerstörung dieser wichtigen Komponente des Immunsystems ist eine weitere Besonderheit dieses Virus und ist verantwortlich für das Auftreten opportunistischer Infektionen, welche häufig die Todesursache für HIV/AIDS-Patienten sind. Zusätzlich sind HIV-spezifische CD4+ T-Zellen besonders empfänglich für HIV-Infektionen, wodurch das Virus wiederum effektiv seine direkten Gegenspieler eliminieren kann [6]. Nach der Erstinfektion repliziert das Virus in den ersten Wochen sehr stark [7] und kann erst durch die Induktion HIV-spezifischer, zytotoxischer CD8+ T-Lymphozyten (CTL) teilweise kontrolliert werden [8], obwohl während des gesamten Infektionsverlaufs Virusreplikation detektiert werden kann [9] (Abb.2.1). 3 Einleitung Abb. 2.1: Verlauf einer HIV-1 Infektion und folgende Immunreaktionen Hier sind schematisch die zeitlichen Verläufe der Virusbeladung im Blut (schwarze Linie) und der Veränderung der CD4+ T-Zellpopulation (rot) gezeigt. Zusätzlich ist das Auftreten der HIV-spezifischen CTLs und der neutralisierenden Antikörper zeitlich gekennzeichnet. T=Tag, W=Woche, M=Monat, J=Jahr Es konnte noch nicht gezeigt werden, welche Rolle das angeborene Immunsystem bei der frühen Virusbekämpfung übernimmt und ob es überhaupt zu einer Kontrolle der Infektion beitragen kann. Da virusneutralisierende Antikörper erst zu einem späteren Zeitpunkt (2-3 Monate nach Infektion) detektiert werden können [10], spielen diese bei der frühen Reduzierung der Viruslast eine untergeordnete Rolle. Im Affenmodell wurde sogar gezeigt, dass nach B-Zelldepletion durch monoklonale Antikörper die frühen Stadien der Infektion und deren Kontrolle nicht beeinträchtigt sind [11]. Die Kontrolle des Virus und somit die Krankheits-Progression scheint daher stark abhängig von der Qualität der induzierten zellulären Immunantwort zu sein. Diese Korrelation zwischen der CTL-Antwort und dem klinischen Status chronisch infizierter Individuen wurde in einigen Studien bestätigt [12-15]. In diesem Zusammenhang konnte gezeigt werden, dass Rhesusaffen, deren CD8+ Zellen über Antikörper depletiert wurden, die primäre SIV-Infektion nicht kontrollieren konnten und deren Krankheitsverlauf dramatisch beschleunigt war [16;17]. Doch das Virus kann das adaptive Immunsystem durch seine hohe Mutationsrate umgehen. Die virale Reverse Transkriptase besitzt keinen Korrektur-Mechanismus, so dass es während der Transkription neuer viraler Genome zu Basenaustauschen kommt, die wiederum Veränderungen in der Aminosäure-Sequenz zu Folge haben können. So werden in einem Wirt ständig neue „Quasispezies“ des Virus produziert, die antigenetisch unterschiedlich sind [18]. Durch den hohen Selektionsdruck, den das Immunsystem ausübt, replizieren verstärkt die 4 Einleitung Varianten, die gleichzeitig dem Immunsystem entgehen und nur geringe Verluste in ihrer Vermehrungsfähigkeit zeigen. Das Problem der natürlichen Immunreaktion ist folglich, dass es gegenüber der Virusentwicklung im Rückstand ist und das Virus ständig neue Varianten produziert, um der veränderten Immunreaktion erneut aus dem Wege zu gehen. Durch präventive Immunisierungen soll nun das Immunsystem auf so einen Wettkampf besser vorbereitet werden, so dass eine erste Immunantwort schon zum Zeitpunkt der Infektion vorhanden ist. Diese frühe Immunantwort soll wiederum eine Kontrolle der Virusreplikation ermöglichen. 2.1.2 Impfstoffentwicklung Die angesprochenen Eigenschaften von HIV-1 machen die Entwicklung eines präventiven Impfstoffes zu einer großen wissenschaftlichen Herausforderung, da klassische Ansätze zur Immunisierung, z.B. inaktivierte Viren oder Proteinimpfstoffe, nicht wirksam waren [19;20]. Des Weiteren ist die Entwicklung dadurch erschwert, dass HIV-1 nur in Menschen repliziert und zu einem Krankheitsbild führt, und somit keine relevanten Kleintiermodelle existieren, die die Komplexität der Virusinfektion berücksichtigen können. Daher sind die meisten Impfstudien auf die SIV-Infektion im Affenmodell ausgerichtet, welche zu einem ähnlichen Krankheitsbild führt, wie es für HIV im Menschen beobachtet werden kann [21]. Die eingesetzten Proteinimpfstoffe verwendeten das Hüllprotein gp120 als Antigen, um neutralisierende Antikörper zu induzieren. Zwar konnte gezeigt werden, dass eine passive Immunisierung von Rhesusaffen mit neutralisierenden Immunglobulinen zu reduzierten Infektionsraten bei SIV bzw. dem Hybridvirus SHIV führte [22-24], die Impfstoffe jedoch keine ausreichenden Titer an neutralisierenden Antikörpern in vivo induzieren konnten [25]. In zwei klinischen Studien zeigte ein auf gp120 basierender Proteinimpfstoff (Vaxgen) keinen Schutz vor nachfolgender HIV-Infektion [26;27]. Da diese Art der Impfstoffe in der Regel kaum zur Induktion zellulärer Immunantworten durch Präsentation auf MHC-I Molekülen führt, wurden neue Strategien entwickelt, um diese Art der HIV-spezifischen Immunantwort zu verbessern. Durch den Einsatz genetischer Impfstoffe (Abs. 2.2) sollte die endogene Antigenexpression erreicht werden, um so gute CTL-Antworten zu induzieren. Sowohl reine DNA-Impfstoffe also auch virale Vektorsysteme zur Übertragung des Antigens sind besonders in den Fokus geraten. 5 Einleitung Obwohl DNA-Impfstoffe in verschiedenen Tiermodellen gute CTL-Antworten und auch humorale Immunantworten induzieren konnten [28-32], waren die erzielten zellulären Immunantworten sowohl im Affen [33] als auch im Menschen [34;35] äußerst gering. Auch der Einsatz auf Pockenviren basierender Vektorsystemen, z.B. modifizierte Vaccinia Viren (MVA) oder Geflügelpockenviren, führte nur zu einer geringen Verbesserung der primären zellulären Immunantworten in klinischen Phase I Studien [36;37]. Dennoch erzielte man mit Kombinationen aus den verschiedenen Vektoren viel versprechende Ergebnisse. Im Moment sind auch Kombinationen aus DNA und rekombinanten, adenoviralen Systemen unter Evaluierung in klinischen Studien, welche im Affenmodell zu sehr guten antigenspezifischen Immunantworten führten [33;38]. In den meisten dieser Studien werden Vektoren kombiniert, die unterschiedliche HIVProteine (gag, pol, env oder nef) übertragen können, um eine möglichst breite Immunantwort zu induzieren, die dann für das Virus durch Mutationen schwierig zu umgehen ist. Des Weiteren wird versucht die Immunogenität der vorhandenen Impfstoffe durch den Einsatz neuartiger Applikationsformen zu erhöhen, z.B. in vivo Elektroporation von DNAImpfstoffen [39]. Um die klonale Expansion und auch die Funktionalität der induzierten antigenspezifischen Immunantwort zu beeinflussen, wurden bestimmte Zytokine, z.B. IL-2, IL-12, IL-15 oder GM-CSF, als genetische Adjuvantien für DNA Impfstoffe getestet [40-42]. In diesen Studien konnten sowohl die zellulären als auch die humoralen Immunantworten gesteigert werden. Besonders die Funktionalität und somit die Qualität (Phenotyp, Zytokinproduktion, Proliferationskapazität) der induzierten CTL-Antworten, die zu einer guten Kontrolle des Virus führen, gilt es noch näher zu bestimmen, was durch den Einsatz polychromatischer Durchflusszytometrie jedoch erheblich verbessert werden konnte [43]. So wurde gezeigt, dass polyfunktionale T-Zellen, die nach antigenspezifischer Stimulation nicht nur IFN-γ produzieren, sondern auch IL-2 und TNF-α, und zusätzlich starke Proliferation zeigen, für die Kontrolle chronischer Infektionen, wie CMV oder EBV, wichtig sind [44;45]. Eine gute präventive Immunisierung muss demnach eine Immunantwort induzieren, die sowohl gegen möglichst viele virale Strukturen gerichtet, als auch von hoher Funktionalität geprägt ist. 6 Einleitung 2.2 Genetische Impfstoffe Neue Ansätze für die Entwicklung präventiver Impfstoffe gegen virale Infektionen basieren, wie oben beschrieben, häufig auf der Verabreichung genetischer Impfstoffe, um eine breite zelluläre Immunantwort gegen die in vivo exprimierten Antigene zu erzeugen. Nachdem Wolff et al. beschreiben konnten, dass die Injektion „nackter“ Plasmid-DNA zu einer Expression der verwendeten Reporterproteine in den Wirtszellen führte [28] und diese auch über einen längeren Zeitraum (ca. 1 Jahr) detektierbar blieb [46], trat der DNA-Impfstoff ins Interesse der Vakzinentwicklung. Seitdem gezeigt wurde, dass die endogene Antigen-Expression Immunantworten im Mausmodell induzieren konnte [29], folgten viele Studien für verschiedene Infektions- und Tumormodelle, die dies bestätigen und sowohl humorale als auch zelluläre Immunantworten detektieren konnten[30-32;47]. Die Verabreichung der Plasmid-Impfstoffe erfolgte meist über intramuskuläre Injektionen oder über den Beschuss der Haut mit DNA-beladenen Goldpartikeln mittels einer so genannten gene gun. Die resultierende Immunantwort ist stark davon abhängig, welche Zelltypen transduziert werden, und somit das Antigen exprimieren [48]. In Abb.2.2 sind drei mögliche Mechanismen dargestellt, wie die Antigenpräsentation und die Aktivierung der Immunzellen erfolgen könnten. Durch die intramuskuläre Injektion werden Myozyten direkt transfiziert und präsentieren anschließend die Antigene über MHC-I Moleküle [30]. Da dieser Zelltyp keine costimulatorischen Oberflächenproteine (CD80/CD86) exprimieren, kann keine direkte Aktivierung naiver T-Zellen von diesen Zellen ausgehen (Abb. 2.2A). Ähnliches gilt für die transfizierten Keratinozyten in der Haut nach gene gun Immunisierungen. Diese Zelltypen können allerdings bereits existierende Effektorzellen stimulieren und tragen somit als Antigenreservoir zur Regulation der Immunantwort bei [48;49]. Die zweite Möglichkeit zur Induktion zellulärer und humoraler Immunantworten liegt in der direkten Transfektion von antigen-präsentierenden Zellen (APC) an der Injektionsstelle (Abb. 2.2B) [50;51]. Nach intramuskulärer Injektion konnte die Plasmid-DNA in professionellen APCs, wie Langerhans-Zellen, Makrophagen oder auch DZ (Abschnitt 2.3), nachgewiesen werden [52;53]. Dieser geringfügige Anteil der transduzierten Zellen stimuliert effektiv naive, antigenspezifische CD4+ T-Zellen, CD8+ T-Zellen und B-Zellen [50-52;54]. 7 Einleitung Zusätzlich können Proteine, die von primär transduzierten Muskelzellen sekretiert werden, von DZ aufgenommen und über MHC-II Moleküle präsentiert werden, so dass die humorale Immunantwort durch die Aktivierung spezifischer T-Helferzellen induziert wird (Abb. 2.2C). Neben dieser „klassischen“ Präsentation exogener Antigene besitzen APCs die Fähigkeit des so genannten „cross priming“, wonach die aufgenommenen Strukturen auch über die MHC-I Moleküle präsentiert werden können [55-58]. Abb. 2.2: Antigenpräsentation nach DNA-Injektion A: B: C: transfizierte Muskelzelle präsentiert endogen synthetisiertes Antigen auf MHC I-Molekülen, costimulatorisches Signal (CD80) für naive T-Zellen fehlt APC nimmt direkt Plasmid-DNA auf; Antigenpräsentation über MHC I-Moleküle; naive CD8+-TZellen können über costimulatorische Signale effektiv aktiviert werden transfizierte Muskelzelle sezerniert synthetisiertes Antigen; APC nimmt Antigen über Endozytose auf; Präsentation über MHC II-Moleküle; Aktivierung naiver CD4+-T-Zellen 8 Einleitung Der zugrunde liegende Mechanismus ist noch nicht geklärt, jedoch wird diesem Weg der Antigenpräsentation eine entscheidende Rolle für die Induktion spezifischer Immunantworten nach DNA-Immunisierungen zugewiesen. Denn selbst Plasmid-DNA, deren Transgen unter der Kontrolle eines muskelspezifischen Promotors exprimiert wird, induziert über diese Art des cross-priming CTL-Antworten im Mausmodell [59]. Da die DNA-Impfstoffe bisher nur in Kleintiermodellen zu guten Immunantworten führten und in ersten klinischen Studien nur geringe Erfolgen zeigten, wurden alternative Methoden gesucht, die ebenfalls die oben beschriebenen Wege der Antigenexpression und –präsentation nutzen. In diesem Zusammenhang wurden virale Vektoren getestet, die nun effektiv die gewünschte DNA in die Zellen einschleusen können. Besondere Aufmerksamkeit erhalten dabei modifizierte Pockenviren und replikationsdefekte Adenoviren. Letztere induzieren sehr hohe zelluläre Immunantworten im Affenmodell [33] und werden zur Zeit intensiv in klinischen Studien getestet. Die meisten adenoviralen Vektoren basieren auf dem humanen Serotyp 5 (AdV-5) und weisen Deletionen in den E1- und E3-Regionen des Genoms auf. Sie werden nach dem Prinzip von He et. al [60] in komplementierenden Produktionszelllinien hergestellt, die die zur Replikation benötigten Genprodukte in trans zur Verfügung stellen. Auf diese Weise können relativ einfach Viruspräparationen mit sehr hohen Titern (1012-1013) aufgereinigt werden, die ein breites Spektrum an Wirtszellen infizieren können [61]. Zusätzlich zur effektiven Transduktion der Zielzellen mit der viralen DNA, ist das adenovirale Vektorpartikel ein starker Stimulator des angeborenen Immunsystems [62] und steigert somit die Immunogenität des Impfstoffes [63;64]. In einer Studie zur Immunisierung mit Lipoproteinen wurde gezeigt, dass nicht nur der virale Vektor als Adjuvant dienen kann, sondern sogar das Hexon-Protein allein [63]. Dies zeigt, dass auch nicht infektiöse Partikel einen Einfluss auf die Immunantwort haben können, obwohl sie kein Transgen übertragen können. Gleichzeitig stellt die anti-Vektor Immunantwort eine Einschränkung für die Nutzung dar, da besonders in den Entwicklungsländern eine hohe Prävalenz an anti-AdV Immunität besteht, die die Induktion der Transgen-spezifischen Immunantwort negativ beeinträchtigen kann [65-67]. Dies erschwert ebenfalls eine mehrmalige Gabe eines homologen Vektors, so dass besonders heterologe Prime/Boost-Immunisierungen viel versprechende Ansätze lieferten. Dabei können Vektoren verwendet werden, die auf selteneren Serotypen (z.B. Ad35 oder 48) basieren [67;68], oder auch Kombinationen mit DNA-Impfstoffen [33;69;70]. Eine Kombination aus einer primären DNA Injektion und einem adenoviralen Vektorboost steigert 9 Einleitung nicht nur die Quantität der induzierten Immunantwort im Vergleich zu Immunisierungen, die nur jeweils eine der Komponenten verwendet haben, sondern erhöht auch das Spektrum der antigenspezifischen Epitope, die von den CD4+ bzw. CD8+ T-Zellen erkannt werden [71]. Da diese Kombination im Primatenmodell sogar einen Schutz vor einer nachfolgenden Infektion mit dem Ebola-Virus erzeugt [72], ist dies möglicherweise auch ein vielversprechender Ansatz zur HIV-Prophylaxe, wobei die Immunogenität beider Vektoren noch verbessert werden könnte. 2.3 Dendritische Zellen (DZ) 2.3.1 Kontrolle des Immunsystems Wie im vorangegangenen Abschnitt erwähnt, nehmen die dendritischen Zellen in ihrer Funktion als antigenpräsentierende Zellen eine entscheidende Rolle in der Initiierung einer primären Immunantwort ein [50]. Unreife Vorläuferzellen aus dem Knochenmark wandern in peripheres Gewebe ein und liegen dort für einen längeren Zeitraum vor. Die in der Haut residierenden Langerhans-Zellen sind ein Beispiel für einen solchen Vorläufertyp, der bereits früh charakterisiert wurde (Katz). Über Phagozytose [73-76] und Pinozytose [77] nehmen diese Zellen viele Antigene und Partikel in ihrer engsten Umgebung auf und präsentieren diese anschließend auf MHCMolekülen. Zusätzlich besitzen die unreifen DZs zahlreiche Oberflächenproteine, die zu einer rezeptorvermittelten Endozytose und anschließender Antigenpräsentation führen. Zu diesen Proteinen zählen besonders die C-Typ Lektin Rezeptoren, wie der Makrophagen-MannoseRezeptor (MMR) [77] und DEC205 [78], und Fc-Rezeptoren des Typs Fcγ und Fcε [79]. Eine weitere Voraussetzung für die Induktion einer zellulären Immunantwort durch die DZ liegt in ihrer Differenzierung oder Reifung nach Antigenaufnahme. Dies kann über eine Vielfalt an Stress- oder Gefahrensignalen erfolgen, wobei zwei Rezeptortypen auf der DZOberfläche, Toll-like Rezeptoren (TLR) [54;80;81] und Tumor-Nekrose-Faktor (TNF)Rezeptoren [82-84], entscheidend involviert sind. So können Dendritische Zellen in vitro über bakterielle Lipopolysaccharide (LPS) [79], inflammatorische Zytokine (z.B. TNF-α) [85;86] oder CD40/CD40L-Interaktionen zu reifen APCs differenziert werden. Durch diesen Prozess verändern die DZ nicht nur ihre Strukturen, sondern verlieren auch ihre Fähigkeit Antigen aufzunehmen [50]. Im reifen Stadium werden die Antigene verstärkt auf MHC-Molekülen an der Oberfläche präsentiert [87], während diese im unreifen Zustand hauptsächlich intrazellulär vorliegen. Zusätzlich zeigen die reifen DZs eine verstärkte 10 Einleitung Expression von kostimulatorischen Molekülen (z.B. CD80, CD86, CD40) [88] und erhöhte Produktion an Zytokinen, wie IL-2 oder IL-12, die die T-Zellaktivierung unterstützen [89;90]. So ausgestattet sind DZ die bisher einzig bekannten Zellen, die naive T-Zellen stimulieren können (Abb. 2.2). Dies geschieht in den T-Zellarealen in den Lymphknoten, wohin die reifen DZ einwandern können [91;92]. Abb.2.3: Dendritische Zellen- Immunantwort und periphere Toleranz Es ist schematisch gezeigt, wie dendritische Zellen in der Peripherie als unreife Vorläufer Antigen aufnehmen und anschließend präsentieren können. Im Falle einer Ausreifung aktivieren diese DZ naive, antigenspezifische CD4+ und CD8+ T-Lymphozyten, was zu einer langlebigen Immunität führen kann (links). Periphere Toleranz wird jedoch möglicherweise durch die Antigenpräsentation von unreifen DZ induziert (rechts). Zwei Modelle sind dabei denkbar, wobei entweder regulatorische T-Zellen induziert werden können oder die aktivierten TZellen nach anfänglicher Proliferation sterben und so depletiert werden. 11 Einleitung CD8+ T-Zellen können direkt über die Interaktion zwischen TZR und einem Peptid/MHC-IKomplex aktiviert und so zu zytotoxischen T-Lymphozyten differenziert werden [55-58]. Einen indirekten Einfluss auf diesen Prozess besitzt auch die Ausbildung der THelferzellantwort, die sich in TH1 oder TH2 unterteilen lässt, und stark davon abhängt in welcher Mikroumgebung (z.B. Zytokinmilieu) die Aktivierung durch die APCs erfolgt [93;94]. In der Gegenwart von erhöhten IL-12 Spiegeln differenzieren die CD4+ T-Zellen bevorzugt zu einem IFN-γ produzierenden TH1 Phenotyp, der wiederum die Entwicklung der CTLs begünstigt und Makrophagen aktivieren kann. Der TH2-Subtyp bildet sich jedoch in Gegenwart von IL-4 und begünstigt durch die Produktion von IL-4 und IL-5 seinerseits die humorale Immunantwort [95]. Neben der Initiation einer primären Immunantwort sind DZ wohl auch an der Aufrechterhaltung der Immuntoleranz gegen Selbstantigene beteiligt. Dies gilt sowohl für die negative Selektion der autoreaktiven T-Zellen im Thymus (zentrale Toleranz) [96;97], als auch für die periphere Toleranz in lymphatischen Geweben [83]. Ein mögliches Modell liegt in der Präsentation der Selbstantigene durch unreife DZs, wodurch die Aktivierung der T-Zellen nicht vollständig erfolgen kann (Abb.2.3). Die CD4+ T-Zellen sterben entweder nach der primären Expansion oder werden anergisch [82]. Die Induktion von regulatorischen T-Zellen könnte ebenfalls die Folge einer solchen Antigenpräsentation sein. In gesunden Patienten induzierten ex vivo generierte DZ, die mit einem Influenza Matrixpeptid beladen wurden, eine Reduktion der IFN-γ Produktion der Influenza-spezifischen CD8+ Gedächtniszellen. Gleichzeitig wurde ein erhöhter Anteil an IL10 produzierenden CD4+ T-Zellen detektiert, der spezifisch auf dieses Matrixpeptid reagiert [98]. Im Gegensatz dazu induzierten DZ, die auf gleiche Art expandiert wurden, aber zusätzlich mit inflammatorischen Zytokinen ausgereift wurden, starke T-Zellantworten [99;100]. Daher muss man für die Entwicklung eines DZ-basierenden Impfstoffes (Abs. 2.3.1) sowohl die Antigenaufnahme berücksichtigen, als auch die ausreichende Stimulation der antigenpräsentierenden Zellen. 2.3.1 Gezielte Rezeptor-vermittelte Antigenaufnahme durch DZ als Vakzin-Strategie Aufgrund des oben beschriebenen Potentials, starke Immunantworten zu induzieren, wird die Manipulation von Dendritischen Zellen in der Impfstoffentwicklung intensiv untersucht und getestet. Dabei basierten die ersten Ansätze zumeist auf isolierten PBMC aus Patienten, die 12 Einleitung anschließend ex vivo expandiert und differenziert werden. Diese Zellen wurden mittels verschiedener Techniken (z.B. Peptidbeladung [101], virale Infektionen [102], oder RNATransfektionen [103]) mit Antigenen beladen und in den Patienten zurück injiziert. Obwohl diese Strategie zu guten und teilweise auch protektiven Immunantworten in verschiedenen Tumor [101;103;104]- und Infektionsmodellen [99;100;102] führt, ist sie für eine weit angewendete präventive Immunisierung zu aufwendig hinsichtlich der Zeit, des Arbeitsaufwandes und der Kosten. Neuere Ansätze versuchen die rezeptorvermittelte Endozytose der APC zu nutzen, indem die Antigene so modifiziert werden, dass sie spezifisch an die entsprechenden Rezeptoren binden können und so aufgenommen werden. Dazu werden die Antigen (Proteine oder Peptid) an Strukturen gekoppelt, die spezifisch an einen Rezeptor auf der Oberfläche der APC binden, wie z.B. natürliche Liganden oder spezifische Antikörper. Ein häufiger Zielrezeptor ist der Mannose-Rezeptor (MR), der von DZ und Makrophagen exprimiert wird und Zuckerstrukturen (z.B. Mannose oder Glukose) auf der Oberfläche von Pathogenen, wie Bakterien oder Hefen, erkennt [105]. Durch anschließende Endozytose und Phagozytose werden die Antigene aufgenommen und auf MHC-Molekülen präsentiert [106108]. So werden mannosilierte Peptide und Proteine effektiver durch humane DZ aufgenommen und präsentiert als ihre unmodifizierten Äquivalente [107;108]. Ebenso erhöhte sich die Immunogenität einer HIV-spezifischen DNA-Vakzine durch die Anhängung von Mannan an die kationischen Liposomen, die zum Transfer der DNA eingesetzt wurden. Dies resultierte in erhöhten CTL-Antworten und einer TH1-Helferzellantwort [109]. Ein weiterer Rezeptor ist DC-SIGN, der wie der MR zur Klasse der C-Typ Lektine gehört und zur Internalisierung von Antigen dient [110-112]. Ein für den Rezeptor spezifischer Antikörper wurde mit dem Modellantigen KLH komplexiert und mit humanen DZ inkubiert. Im Vergleich zu ungekoppeltem KLH verstärkt sich die T-Zellaktivierung. Es können so geringere Mengen des Antigens verwendet werden, um primäre T-Zellantworten, sowohl MHC-I als auch MHC-II restringiert, zu induzieren [113]. Das integrale Membranprotein DEC205 bindet analog zu dem MR Zuckerstrukturen und vermittelt Endozytose [78]. Nach Bindung eines DEC205-spezifischen Antikörpers ist jedoch die Präsentation desselbigen auf MHC-II Molekülen effektiver (30-100 fach), als die Präsentation eines MR-spezifischen Antikörpers [114]. Im Mausmodell erweist sich daher die zielgerichtete Antigenaufnahme über diesen Rezeptor als sehr effektive Methode, um zelluläre und humorale Immunantworten gegen das gewünschte Antigen zu erzielen. Durch 13 Einleitung chemische Kopplung des Modellantigens Ovalbumin (OVA) an einen DEC205-spezifischen Antikörper wird sowohl die Präsentation des Antigens auf MHC-I, als auch die auf MHC-II Molekülen verbessert [83]. Diese Studie zeigt jedoch auch, dass die induzierte Immunantwort davon abhängig, ob ein Kostimulus zur Ausreifung der Zellen präsent ist. In Gegenwart eines α-CD40 Antikörpers wird eine starke CTL-Antwort induziert, die auch als langlebige Gedächtnisantwort erhalten bleibt, während ohne Kostimulus die aktivierten T-Zellen depletiert werden und dies periphere Toleranz zur Folge hat. In verschieden Modellen konnte so gezeigt werden, dass es möglich ist die T-Helferzellantwort [115-117], die CTL-Antwort [83;118;119] und auch die humorale Immunantwort [115] zu verbessern. Des Weiteren wurden Einzelkettenantikörper generiert, die spezifisch an DEC205 binden können [120]. Diese bestehen aus einer genetischen Verknüpfung der spezifischen, variablen Regionen der beiden Antikörperketten über eine flexible Linker-Struktur. In dieser Form können sie an die kodierenden Sequenzen eines Antigens fusioniert und für genetische Immunisierungen eingesetzt werden. Dies führt im Mausmodell zu einer geseigerten humoralen und zellulären Immunantwort [120] und ist daher vielversprechend für die Verbesserung genetischer Impfstoffe. Alternative Studien zur zielgerichteten Antigenbeladung von DZs verwenden verschiedenste Ziele auf den APCs, wie z.B. TLR [121;122], Fc-Rezeptoren [123] oder ChemokinRezeptoren [124]. Die Vielfalt der Studien und die Immunogenität der einzelnen Impfstoffe verdeutlichen das Potential dieser DZ-basierenden Immunisierungsstrategien. 2.4 Genetische Adjuvantien 2.4.1 Granulozyten-Makrophagen-koloniestimulierender Faktor (GM-CSF) GM-CSF gehört zu der Familie der Zytokine und ist somit an der Ausbildung einer Immunantwort beteiligt. Das menschliche Protein besteht aus 127 Aminosäuren und besitzt ein Molekulargewicht von 14,4 kD. In vivo wird es jedoch glykosyliert und hat dann ein Molekulargewicht von etwa 22-24 kD [125]. Es ist ein haematopoetischer Wachstumsfaktor und aktiviert die Bildung von Granulozyten und Makrophagen. Interessant wurde GM-CSF, als man erkannte, dass es an der Reifung dendritischer Zellen beteiligt ist. Es ist gelungen, eine hohe Anzahl reifer DZs aus Knochenmarkzellen zu gewinnen, indem man den Kulturen GM-CSF zugesetzt hat [126]. 14 Einleitung Daraufhin begann man, GM-CSF und seine Rolle in der Aktivierung des Immunsystems genauer zu untersuchen. Besonders im Bereich der Entwicklung neuer DNA-basierter Impfstoffe wurde das immunmodulatorische Zytokin ausgiebig getestet [40-42;127-130]. Hierbei konnte in diversen viralen Modellen, darunter HIV-1 [41;42;127], Hepatitis C [128;129] und HSV-2 [130], gezeigt werden, dass die zusätzliche Injektion eines GM-CSFexprimierenden Vektors eine erhöhte Immunantwort gegen das jeweilige Antigen induzierte. In diesen Studien waren zumeist sowohl die zelluläre T-Helferzellantwort als auch die Antikörperproduktion erhöht, wohingegen der Einfluss auf die induzierten CTL-Antworten eher gering war. Es wird angenommen, dass dies auf einen direkten Einfluss des GM-CSF auf die APC zurückzuführen ist. So zeigten Curiel-Lewandrowski et al. (1999) eine potentielle Steigerung der antigen-präsentierenden Kapazität von DCs. Unreife Vorläuferzellen aus dem Knochenmark wurden mit GM-CSF transfiziert und anschließend im Vergleich mit nicht transfizierten Zellen auf die Fähigkeit zur Antigenpräsentation hin untersucht. Des Weiteren führt die hohe lokale Expression des Zytokins zu einer effektiven Migration von DZ und Makrophagen zur Injektionsstelle [131;132]. Es erhöht sich jedoch nicht nur die Anzahl der APCs, sondern der Aktivierungsstatus derer wird ebenfalls beeinflusst [133], wobei die zeitliche und lokale Koexpression von Zytokin und Antigen entscheidend sind [134]. Neben der Gabe als zwei unabhängige Proteine, wurden auch Fusionsproteine zwischen GM-CSF und dem Antigen untersucht. Dies führt sowohl bei Proteinimpfstoffen [135] als auch bei DNA basierenden Vakzinen [136;137] zu erhöhten Antikörperantworten und einer verbesserten Immuntherapie im Tumormodell. In diesen Fällen führt die kovalente Verknüpfung von Antigen und Zytokin möglicherweise zu einer verstärkten Antigenaufnahme und –präsentation durch die Bindung an GM-CSFRezeptoren der APC, wie es bereits für die MR [107-109] und DEC205 [114-119]Rezeptoren beschrieben ist. Um die Funktion von GM-CSF genauer zu analysieren, haben Wada et al. GM-CSFKnockout Mäuse untersucht [138]. Diese haben sie auf spezifische Immunantworten gegen allogene und exogene Antigene getestet. Es zeigte sich, dass die GM-CSF defizienten Mäuse nicht fähig sind, eine cytotoxische T-Zellantwort gegen exogene Antigene hervorzurufen. Ebenfalls wurde eine Senkung der Antikörpertiter (hauptsächlich IgG2a) festgestellt. Diese Studien zeigen die Bedeutung von GM-CSF auf die Entwicklung des Immunsystems und die Einsatzmöglichkeiten als genetisches Adjuvants für die Impfstoffentwicklung. 15 Einleitung 2.4.2 CD40 Ligand (CD40L) Die Interaktion zwischen CD40L und seinem Gegenpart, dem CD40-Rezeptor, ist einer der entscheidenden Aktivierungswege von APC. CD40 wird hauptsächlich von B-Zellen, DZ, und Makrophagen exprimiert und ist ein transmembrales Glykoprotein [139]. Der CD40Ligand wird hingegen zumeist auf der Oberfläche von aktivierten T-Zellen exprimiert [140]. Eine Interaktion dieser beiden Moleküle führt zu einer Aktivierung von B-Zellen hinsichtlich ihrer klonalen Expansion, des Isotyp-Wechsels und der Ausbildung von langlebigen Plasmazellen [141]. Prozesse der Autoimmunität als auch der Induktion primärer Immunantworten werden ebenfalls durch diese Interaktion reguliert. In diesem Zusammenhang wurde gezeigt, dass die Stimulation von APC über den CD40Rezeptor zu einer Ausreifung, einer verlängerten Lebensdauer und einer länger anhaltenden Antigenpräsentation führt [87;142]. Die resultierende Expression von kostimulatorischen Molekülen (CD80, CD86) und Produktion von pro-inflammatorischen Zytokinen (IL-12, TNF-α) führen zur Induktion von CTL- und TH1-Helferantworten [143-147]. Daher ist die CD40/CD40L Interaktion Gegenstand unterschiedlicher Impfstrategien, um die zelluläre und humorale Immunantworte zu verstärken. Mit monoklonalen Antikörpern, die gegen CD40 gerichtet und somit CD40L-Agonisten sind, konnten die Immunantworten gegen infektiöse Krankheiten [148;149] und in Krebstherapien [150;151] verbessert werden. In Impfstudien zur zielgerichteten Antigenaufnahme über DEC205-Rezeptoren wurden diese Antikörper in Kombination mit TLR-Liganden eingesetzt, um die Ausreifung der APC zu bewirken. Dies führte zur Ausbildung starker zellulärer und humoraler Immunantworten [115;117;118]. Für genetische Immunisierungen hingegen ist der natürliche CD40L interessant, da dieser so von einem zweiten Vektor exprimiert und zu den antigen-exprimierenden Vektoren zugegeben werden kann. In einer derartigen DNA-Impfstudie wurde neben einer erhöhten Antikörperproduktion (IgG2a) auch eine starke zelluläre Immunantwort, die sich in IFN-γ und cytolytischen T-Zellen ausdrückte, induziert [152]. In einem murinen Infektionsmodell mit dem Respiratorischen Syncitial Virus (RSV) bewirkt die Koexpression von CD40L ebenfalls eine erhöhte Antikörperproduktion und eine RSV-spezifische TH1-Helferzellantwort [153]. Neben der membranständigen Form des CD40L wurde eine lösliche Variante charakterisiert, die durch proteolytische Abspaltung der extrazellulären Domäne (AS 113-260) entsteht und als Trimer ebenfalls biologisch aktiv ist [154;155]. 16 Einleitung Die Fusion dieser löslichen CD40L-Form an ein Tumor-assoziertes Antigen (TAA) verstärkt die Immunogenität eines solchen Proteinimpfstoffes und erhöht die Lebenserwartung der immunisierten Tiere in einem homologen Tumormodell [156]. Bei der Entwicklung einer prophylaktischen HIV-Vakzine führte die Koexpression des löslichen CD40L-Trimers zu einer gesteigerten Immunogenität im Mausmodell. Im Gegensatz zu den membranständigen CD40 Liganden sind hier besonders die gag-spezifischen CD8+ T-Zellantworten erhöht, wohingegen kaum ein Einfluss auf die CD4+ Antwort zu beobachten ist [157]. Daher sind diese Immunstimulatoren ebenso geeignete Zusätze für genetische Impfstoffe wie Zytokine. 2.5 Zielsetzung der Arbeit Im Rahmen dieser Arbeit wurde versucht, die Immunogenität genetischer Impfstoffe zu verbessern. In diesem Zusammenhang sollten sowohl Plasmid-DNA, als auch adenovirale Vektoren zur Übertragung der jeweiligen Transgene im Mausmodell getestet werden. Um zunächst prinzipielle Hypothesen zu überprüfen, wurde das Modellantigen OVA gewählt. Dies eignet sich, da immundominante Epitope in der C57BL/6 Maus gut charakterisiert sind und somit eine Reihe an Reagenzien (z.B. Peptide, Tetramere) und Modellen (T-Zellrezeptor transgene Mäuse) zur Charakterisierung der Immunantworten verfügbar sind. In erster Linie sollte untersucht werden, ob die Fusionierung dieses Antigens an das Zytokin GM-CSF zu einer gesteigerten Antigenaufnahme durch DZ führen kann. Die Immunogenität dieser Fusionsproteine sollte in Immunisierungsstudien untersucht werden, die sowohl DNA, adenovirale Vektoren als auch Kombinationen dieser beiden beinhalten. Durch bicistronische Vektoren sollte differenziert werden, in wie weit die Zytokinexpression oder die gerichtete Antigenaufnahmen für die zu beobachtenden Ergebnisse verantwortlich ist. In einem zweiten Ansatz sollte eine zielgerichtete Antigenaufnahme durch Fusionsproteine erzielt werden, die aus einem Einzelkettenantikörper gegen DEC205 und dem besagten Modellantigen bestehen. Da diese als Proteinimpfstoffe viel versprechende Ergebnisse erzielen konnten, sollte deren Einfluss auf eine Immunisierung mit adenoviralen Vektoren untersucht werden. Zusätzlich sollten diese Vektoren die genetischen Adjuvantien GM-CSF oder sCD40L übertragen, und deren unterschiedlichen Einflüsse auf zelluläre und humorale Immunantworten bestimmt werden. Die Arbeit beschäftigt sich daher mit der Optimierung genetischer Impfstoffe unter Berücksichtigung DNA/Adenovirus Prime/Boost Strategien, zielgerichteter Antigenaufnahme durch APCs und Koexpression von Immunmodulatoren, wie GM-CSF und sCD40L. 17 Material 3.Material 3.1 Versuchstiere, Zelllinien und Bakterienstämme 3.1.1 Versuchstiere Weibliche C57BL/6 Mäuse (6-8 Wochen alt) wurden von Janvier (Frankreich) bezogen. 3.1.2 Zelllinien 293A-Zellen: Humane Nierenepithelzellen, die mit Adenovirus Typ 5 transformiert wurden [158] 293T-Zellen: Humane Nierenepithelzellen, die mit Adenovirus Typ 5 transformiert wurden und das große T-Antigen des SV40 (Simian Virus 40) exprimieren [159] TF-1-Zellen: humane erythroleukämische Zellen, wachstumsabhängig von unterschiedlichen haemotopoetischen Wachstumsfaktoren, u.a. IL-3 und GM-CSF [160] FDCP-1-Zellen: Rückenmarkstammzellen aus der B6D2F1- Maus, wachstumsabhängig von IL-3 bzw. GM-CSF [161] WEHI-3B-Zellen: murine myeloische Leukämiezellen, produziert IL-3 [162] 3.1.3 Bakterienstämme Alle verwendeten Bakterienstämme sind Subtypen von Escherichia .coli DH5α supE44 ∆lacU169 (φ80lacZ∆M15) hsdR17 recA1 endA1 gyrA96 thi-1 relA1 18 Material DH10B (Invitrogen) mcrA ∆(mrr-hsdRMS-mcrBC) φ80lacZ∆M15 ∆lacX74 recA1 endA1 ara∆139 ∆(ara,leu)7697 galU galK λ- rpsL (StrR) nupG BJ5183 (Stratagene) endA1 sbcBC recBC galK met thi-1 bioT hsdR (StrR) 3.2 Nukleinsäuren 3.2.1 Plasmide pCR2.1-TOPO (Invitrogen) dient zur direkten Klonierung von PCR-Produkten über Thymidin-Adenosin-Komplentierung pcDNA3.1 (Invitrogen) eukaryotisches Expressionsplasmid; Transgenexpression reguliert durch einen CMVPromotor und dem BGH poly Adenylierungssignal pSC-OVA (zur Verfügung gestellt von Dr. Nchinda, AG Überla) enthält eine Expressionskassette für Ovalbumin (OVA), welches mit einem MycHis-Tag fusioniert ist pSC-DEC-OVA (zur Verfügung gestellt von Dr. Nchinda, AG Überla) kodiert für ein Fusionsprotein aus dem Einzelketten-Antikörper gegen DEC205 und Ovalbumin (OVA), welches mit einem MycHis-Tag fusioniert ist pSC-GL117-OVA (zur Verfügung gestellt von Dr. Nchinda, AG Überla) kodiert für ein Fusionsprotein aus einer Isotypkontrolle des Einzelketten-Antikörpers und Ovalbumin (OVA), welches mit einem MycHis-Tag fusioniert ist pShuttle-CMV [60] Plasmid zur Expression von Proteinen unter der Kontrolle eines CMV-Promotors, verwendet zur homologen Rekombination bei der Herstellung adenoviraler Vektoren 19 Material pAdEasy-1 [60] enthält das Genom des Adenovirus Ad5 mit Deletionen in der E1 und der E3-Region, verwendet zur Herstellung rekombinanter Vektoren pSCMV-rhGMCSF-p27 (hergestellt während Diplomarbeit, AG Überla) kodiert für ein Fusionsprotein aus dem Zytokin GM-CSF des Rhesusaffens und des SIVgag Proteins p27, basiert auf dem pShuttle-CMV pSCMV-∆GMCSF-p27 (hergestellt während Diplomarbeit, AG Überla) kodiert für das SIVgag Proteins p27, welches lediglich das Exportsignal des GM-CSF besitzt, basiert auf dem pShuttle-CMV pDP-CMV-pAd (zur Verfügung gestellt von Dr. Kuate, AG Überla) enthält einen bidirektionalen CMV-Promotor, wodurch zwei Transgene unabhängig voneinander unter Kontrolle des gleichen Promotors exprimiert werden können, zusätzlich stehen die Expressionskassetten unter einer Tetracyclin-Regulation pShuttle-rtenvco (zur Verfügung gestellt von Dr. Kuate, AG Überla) exprimiert eine sekretorische und kodon-optimierte Form des SIV env Hüllproteins, welches das Exportsignal des tPA (tissue type plasmimogen activator)-Proteins enthält AAV-CD40L (zur Verfügung gestellt von Prof. Dr. Hallek) Kodiert für den murinen CD40 Liganden, gehört zu einem Expressionssystem zur Herstellung AAV-Vektoren 3.2.2 Oligonukleotide Die verwendeten Oligonukleotide wurden von den Firmen Sigma oder Biomers bezogen. m-GMs: m-GMa: Nhe-mGMs: Not-ICL-mGMa: Kpn-mGMs: Hind-HISa: GGCTAAGGTCCTGAGGAGGATG GATTCAGAGCTGGCCTGGGCTTC GCTGGCTAGCCACCATGTGGCTGCAGAATTTACT TGGTGCGGCCGCTGGATCCGCCGCCACCGCTCCCACCACCTC CTGAGCCACCGCCTCCGGATTTTTGGCCTGGTTTTTTGCATTC ATCTGGTACCACCATGTGGCTGCAGAATTTACT CTAGAAGCTTCAATGGTGATGGTGATGATGACCGGT 20 Material DP-mGMs DP-mGMa DP-OVAs DP-OVAa Nhe-DO2s Xba-DOa shCD40Ls CD40La DP-CD40Ls DP-CD40La GCTAGCGGCCGCACCATGTGGCTGCAGAATT GCCGCGATCGTCATTTTTGGCCTGGTTTTTTGC CTTAGCTAGCACCATGGGCTCCATCGGC GCGACTCGAGTCAAGGGGAAACACATCTGCCAAAG GCTGGCTAGCCACCATGGGATGGTCATGT GACCTCTAGATCAAGGGGAAACACATCTGCCA CGGAAGCTAGCATGCAAAGAGGTGATGAGG AGCGGATATCTAGAGTTTGAGTAAGCCAA CAAAGCGGCCGCAAGTAAGTGAATTCGCCAC GATCCGATCGGTGGATCGGATATCTAGAG 3.3 Peptide OT I OVA257-264 (SIINFEKL), Genaxxon 3.4 Antikörper AB1225 Kaninchen anti-Ovalbumin Chemicon Ziege anti-Kaninchen IgG-HRP Sigma Biotinylierter α-mausCD40L Sigma Streptavidin-HRP BD Bioscience AKP- bzw. HRP-gekoppelter α-mausIgG1 BD Bioscience AKP- bzw. HRP-gekoppelter α-mausIgG2a BD Bioscience α-mausCD3 BD Bioscience α-mausCD28 BD Bioscience Floureszenzmarkierte Antikörper gegen murine Proteine für FACS-Analyse: CD4-FITC, CD4-APC, CD8-FITC, CD8-PerCP, CD8-APC, CD107a-FITC, IFN-PE, IL2APC, CD11c-APC, CD80-FITC, CD86-FITC (alle BD Bioscience), CD83-PE (eBioscience) 3.5. Enzyme 3.5.1 Restriktionsendonukleasen Alle verwendeten Restriktionsendonukleasen und deren entsprechenden Puffersysteme wurden von New England Biolabs (NEB) oder von MBI Fermentas bezogen. 21 Material 3.5.2 Weitere Enzyme Expand-High-Fidelity DNA-Polymerase Roche Taq-Polymerase Amersham Pharmacia Biotech Inc. 3.6 Reagenzien 2-Butanol Acrylamid Agar Ammoniumpersulfat (APS) Ampicillin β-Mercaptoethanol Borsäure Bovines Serum Albumin Bromphenolblau Caesiumchlorid Calciumchlorid Concanavalin A Coomassie Brilliant Blau R250 Dietyhlether Dimetyhlformamid (DMF) Dimethylsulfoxid (DMSO) dNTP-Mix EDTA Essigsäure Ethanol Ethidiumbromid Glycin Glycerin Hefeextrakt HEPES Imidazol Isopropanol J.T.Baker Merck AppliChem Roth Roth Sigma J.T. Baker Sigma Fluka Fluka J.T.Baker Sigma Serva AppliChem AppliChem AppliChem Pharmacia Sigma J.T.Baker Riedel-deHaen Roth Biomol J.T.Baker AppliChem Biomol Sigma Merck Kaliumacetat Kaliumchlorid Kanamycin Magermilchpulver Magnesiumchlorid Methanol Natriumacetat Natriumchlorid Natriumdodecylsulfat (SDS) Natriumhydroxid Ni2+-NTA-Agarose Ovalbumin Paraformaldehyd Rek. humanes GMCSF Rek. murines GMCSF Rek. murines IL-4 Salzsäure Saponin SeaKem-Agarose Streptomycinsulfat TEMED Thiazolylblau (MTT) Tris Trypton Tween 20 Wasser J.T.Baker J.T.Baker Bio 101,Inc. Spinnrad J.T.Baker J.T.Baker J.T.Baker J.T.Baker AppliChem J.T.Baker Qiagen Sigma Sigma Roche Biomol Biomol J.T.Baker Sigma Biozym AppliChem Sigma AppliChem AppliChem AppliChem AppliChem Braun 22 Material 3.7 Medien, Puffer und Lösungen 3.7.1 Medien für Bakterienkultur LB-Medium: 1 % (w/v) Trypton, 0.5 % (w/v) Hefeextrakt, 170 mM NaCl, pH 7.2 -7.5 LB-Agar: 1,5 % (w/v) Agar in LB-Medium Zu den autoklavierten Medien wird je nach Verwendungszweck Ampicillin (100 µg/ml), Kanamycin (50 µg/ml) oder Streptomycin (30 µg/ml) als Selektionsmarker zugegeben. S.O.C.-Medium (Invitrogen): 2 % (w/v) Trypton, 0,5 % (w/v) Hefeextrakt, 10 mM NaCl, 2,5 mM KCl, 10 mM MgCl2, 10 mM MgSO4 20 mM Glukose 3.7.2 Puffer und Lösungen für molekularbiologische Arbeiten 3.7.2.1 Lösungen für DNA-Gelelektrophorese TAE-Puffer (50x) (AppliChem) 2,0 M Tris 0,05 M Na2.EDTA 1 M Essigsäure TBE-Puffer (10x) 0,89 M Tris 0,2 M Na2.EDTA 0,89 M Borsäure Bei der Elektrophorese werden die Puffer in einfacher Konzentration verwendet. DNA-Probenpuffer (6x) 0,25 % (w/v) Bromophenolblau 0,25 % (w/v) Xylol 30 % (v/v) Glycerin Ethidiumbromid-Stocklösung: 10 mg/ml Ethidiumbromid in Aqua dest. 23 Material 3.7.3 Puffer und Lösungen für proteinbiochemische Arbeiten 3.7.3.1 Lösungen für SDS-PAGE und Western Blot SDS-PAGE Probenpuffer (2x) 150 mM Tris.Cl pH=6.8 30 % (v/v) Glycerin 1.2 % (v/v) SDS 0.0018 % (w/v) Bromophenolblau 15 % (v/v) ß-Mercaptoethanol Laufpuffer (10x) 0.25 M Tris 1.9 M Glycin 1 % SDS Coomassie-Färbelösung: 0,1 % (w/v) Coomassie Bril. Blau R250 50 % (v/v) Methanol 10 % (v/v) Essigsäure Entfärber: 10 % (v/v) Methanol 10 % (v/v) Essigsäure Transferpuffer: 0,02 M Tris 0,15 M Glycin 20 % (v/v) Methanol PBS-T (Waschpuffer) 0,1 % (v/v) Tween 20 in PBS (1x) Blockpuffer 5 % (w/v) Magermilchpulver in PBS-T 3.7.3.2 Lösungen für Ni2+-Aufkonzentrierung Äquilibrierungspuffer (5x): 250 mM NaH2PO4· H2O 750 mM NaCl 50 mM Imidazol, pH 8,0 24 Material Lysispuffer: 50 mM NaH2PO4· H2O 300 mM NaCl 10 mM Imidazol 0,05 % Tween 20 pH 8,0 50 mM NaH2PO4· H2O Waschpuffer: 300 mM NaCl 20 mM Imidazol 0,05 % Tween 20 pH 8,0 Elutionspuffer: 50 mM NaH2PO4· H2O 300 mM NaCl 250 mM Imidazol 0,05 % Tween 20 pH 8,0 3.7.4 Medien und Lösungen für Zellkultur 3.7.4.1 Medien Als Grundmedien für die Zellkultur werden Fertigmedien der Firma Invitrogen/Gibco verwendet: - Dulbecco´s modified Eagle´s Medium (DMEM) - RPMI 1640 - DMEM, ohne Phenolrot - AIM-V (serumfrei) Zusätze - Fetales Kälberserum (FKS) von Biochrom KG - Penicillin G (End-Konz.:100 Units/ml); Streptomycin (End-Konz.:100 µg/ml) von Invitrogen/Gibco - L-Glutamin, Antibiotic/Antimycotic, HEPES, ß-Mercaptoethanol (Invitrogen/Gibco) 25 Material 3.7.4.2 Lösungen für die Zellkultur Trypsin/EDTA (10X): 0,05 % (w/v) Trypsin,0,02 % (w/v) EDTA in PBS; (Biochrom KG) PBS (10x) 1,37 M NaCl 0,027 M KCl 0,043 M Na2HPO4,7H2O 0,014 M KH2PO4 in H2O, pH 7.4 3.7.4.3 Lösungen für Transfektionen HBS (2X) 1,4 M NaCl, 250 mM HEPES, 10 mM Na2HPO4 in H2O, pH 7,12; sterilfiltriert 3.7.4.4 Lösungen für MTT-Proliferationstest MTT-Lösung: 5 mg/ml MTT in PBS, sterilfiltriert Extraktionspuffer: 20 % (w/v) SDS 50 % (v/v) DMF in H2O, pH 4,7 3.7.4.5 Lösungen für Lymphozyten-Isolation Hanks´ gepufferte Salzlösung (HBSS) Gibco/Invitrogen ACK Lysispuffer Bio Whitaker 3.7.4.6 Lösungen für Immunassays CFSE-Stammlösung 5 mM CFSE in DMSO PBS-T0,05 0,05 % (v/v) Tween 20 in PBS(1x) FACS-Puffer 0,5 % (w/v) BSA, 1 mM NaN3 in PBS 4 % Paraformaldehyd 4 g Paraformaldehyd in 100 ml PBS (1x) Permeabilisierungspuffer 0,1 % (w/v) Saponin in FACS-Puffer 26 Material 3.8 Standards 3.8.1 DNA-Längenstandards DNA 1 kb Leiter Invitrogen (Größen in bp: 506, 1018, 1636, 2036, 3054, 4072, 5090,6108, 7126, 8144, 9162, 10180, 11198, 12216) DNA 100bp Leiter Invitrogen (Größen in bp: 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 2072) 3.8.2 Protein-Größenstandard Prestained Precision Protein Standard Biorad (Größen in kD: 10, 15, 20, 25, 37, 50, 75, 100, 150, 250) 3.9 Reagenzsysteme Geneclean® III Kit Qbiogene TaKaRa-DNA-Ligation-Kit BioWhittaker Europe Qiagen® Plasmid Purification Kit (Mini, Maxi, Gigaendofree) ® Qiagen QIAquick Gel Extraction Kit Qiagen RNeasy® Mini Kit Qiagen Jetstar® Plasmid Maxi Kit Genomed ThermoScriptTM RT-PCR System (Platinum® Taq) Invitrogen TOPO®-TA-Cloning Kit Invitrogen ECL Chemiglow Alpha Innotech AdenoPak 20 Purification Vivascience/Sartorius 27 Material 3.10 Verbrauchsmaterialien Zellkulturflaschen (25 cm², 75 cm²,175cm²) Nunc 96-Mikrotiterplatten Nunc Zellkulturflaschen (300 cm²) TPP Sterilfilter (0,22 µm, 0,45 µm) Roth, Sarstedt Nitrocellulose Membran Schleicher & Schuell Gel-Blot-Papier Schleicher & Schuell Filterpapier (Falten-, Rundfilter) Schleicher & Schuell Plastikwaren Sarstedt, Starlab, Nunc, Eppendorf Cell strainer Falcon 3.11 Geräte / technische Ausstattung Brutschrank HS 12 Heraeus Dampfsterilisatoren 75 S / 135 S H+P Labortechnik GmbH Elektrophoresesystem PowerPac 300 Biorad PerfectBlueTM Electrophoresis System 40-1214 PeqLab FACS Calibur ® BD Bioscienses Geldokumentationskammer Biozym Luminometer Hamamatsu Photonics Lichtmikroskop TMS Nikon Magnetrührer IKA-Combimag RET Janke & Kunkel Mikrotiterplatten-Washer Thermo Labsystems Pipetten ABIMED Pipettierhilfe Pipetus® akku Hirschmann Laborgeräte GHPR 1400A Digital-pH Meter Greisinger electronic Biophotometer Eppendorf Elisa-Plattenreader Tecan Rotoren Festwinkelrotor NVT 100 Beckman SW 28 Beckman SW 41 Beckman Ausschwenkrotor GH 3.7 Beckman 28 Material Schüttelapparat Rockomat Technomara Thermomixer comfort Eppendorf Peltier Thermal Cycler PTC-200 MJ Research Corporation Tiefkühlschrank (–80 °C) MDF-U50V Sanyo Waage SPB 63 SCALTEC Präzisionswaage SBA 31 SCALTEC Vortex Genie 2 Scientific Industries Zellzähler Z2 Beckman Coulter Zentrifugen Tischzentrifuge Centrifuge 5415D Eppendorf Avanti™ J-25 Centrifuge Beckman GPR Centrifuge (Zellkultur) Beckman GK15 Laboratory Centrifuge Sigma Ultrazentrifuge Optima L-70K Beckman 29 Methoden 4. Methoden 4.1 Molekularbiologische Methoden Die molekularbiologischen Methoden wurden, soweit nicht anders gekennzeichnet, nach Maniatis et al. [163]durchgeführt. 4.1.1 Plasmidisolation aus Bakterien 4.1.1.1 Analytischer Maßstab (Minipräparation) Zur Analyse der Plasmide verschiedener Bakterien-Klone wurde das Qiaprep Spin Mini Kit verwendet. Dabei folgte man den Richtlinien des Herstellers. Diese Art der Isolation basiert auf dem Prinzip einer alkalischen Lyse der Bakterien und einer anschließenden Säulenchromatographischen Aufreinigung der Plasmid-DNA. Anschließend wurden die Plasmide mittels Restriktionsanalysen charakterisiert. 4.1.1.2 Quantitativer Maßstab (Maxi- bzw. Gigapräparation) Um Plasmidmengen bis zu 500 µg zu erhalten, wurden ca. 1,5 ml einer Minipräp.Bakterienkultur in 100-250 ml LB-Medium mit entsprechendem Antibiotikum für 16-20 h bei 37 °C unter Schütteln inkubiert. Anschließend wurde die Plasmid-DNA mit dem Plasmid Maxi Kit (Qiagen) oder dem Jetstar® Plasmid Maxi Kit (Genomed) isoliert. Plasmide, die als DNA-Impfstoffe in Tierexperimenten eingesetzt wurden, wurden mit dem EndoFree Plasmid Giga Kit (Qiagen) isoliert. Hierzu wurde aus einer 10 ml Vorkultur eine Bakterienkultur mit einem Gesamtvolumen von 2,5 L angesetzt, welche eine Ausbeute von ca. 10 mg Plasmid-DNA ermöglichte. In allen Fällen wurde die Plasmidisolierung nach den jeweiligen Anweisungen des Herstellers durchgeführt. 4.1.2 Konzentrationsbestimmung von DNA Um die Konzentration einer DNA-Lösung zu bestimmen, bestimmt man die Absorption der Probe bei einer Wellenlänge von 260 nm. Es gilt dabei folgende Umrechnung: 1 OD260 = 50 µg/ml doppelsträngige DNA 30 Methoden 4.1.3 Spaltung von DNA mittels Restriktionsendonukleasen Mit Hilfe der Restriktionsendonukleasen lassen sich Plasmide in Fragmente schneiden. Diese Enzyme erkennen dabei spezifische Basensequenzen innerhalb des Plasmids und schneiden dort die doppelsträngige DNA. Die Inkubationsbedingungen und Puffersysteme wurden nach den empfohlenen Anweisungen des Herstellers gewählt. Für analytische Überprüfungen von Plasmid-Präparationen wurden etwa 0,5 µg DNA in 10 µl Ansätzen mit den entsprechenden Enzymmengen verdaut. Die Inkubation erfolgte für 2-3 h bei der für die jeweiligen Enzyme optimalen Temperatur (meistens 37 °C). Um größere DNA-Mengen zu spalten, z.B. für Ligationen oder Linearisierungen, wurden 510 µg DNA in 50 µl Ansätzen eingesetzt. In diesen Fällen wurde die Inkubation über Nacht durchgeführt. 4.1.4 Agarose-Gelelektrophorese Zur Auftrennung von DNA-Fragmenten entsprechend ihrer Größe wird die Methode der GelElektrophorese verwendet. Hierzu wird der Elektrophorese-Puffer (TAE bzw. TBE) mit dem entsprechenden Anteil (0,8-2 %) an Agarose aufgekocht, bis die Agarose vollständig gelöst ist. Die Lösung wird ein wenig abgekühlt und mit Ethidiumbromid (Endkonz. 1 µg/ml) versehen, welches später in die DNA interkaliert und sie so unter UV-Licht sichtbar macht. Danach wird die Agarose-Lösung in die Elektrophorese-Kammer gegossen. Die Proben werden mit Probenpuffer versehen und in die Taschen gefüllt. Die Elektrophorese erfolgte bei einer konstanten Spannung von 120-140 Volt. Zusätzlich zu den Proben trägt man einen Längenstandard als Marker auf. 4.1.5 DNA-Extraktion aus Agarose-Gelen Nachdem man die gewünschte Bande in einem oben beschriebenem Gel unter schwachem UV-Licht (λ=365 nm) identifiziert hat, kann man sie mit einem Skalpell aus dem Gel herausschneiden und die DNA mit einem Extraktionskit (GenecleanIII bzw. QIAquick® Gel Extraction Kit) aufreinigen. Dabei folgte man den Anweisungen des Herstellers. 31 Methoden 4.1.6 PCR (polymerase chain reaction) Diese Methode verwendet man um gezielt DNA-Fragmente zu vervielfältigen. Man setzt dazu spezifische Oligonukleotid-Primer ein, deren Sequenzen komplementär zu den Enden der gewünschten Sequenz gewählt werden. Diese lagern sich im Annealing-Schritt an die denaturierten DNA-Einzelstränge und bilden den Ausgangspunkt für die DNA-Polymerase, welche den Primer im Elongation-Schritt komplementär zur Einzelstrangvorlage verlängert. Es werden dabei zwei Primer eingesetzt, ein antisense- und ein sense-Primer, so dass das Fragment von beiden Seiten begrenzt ist. PCR-Ansatz: 1 µl Template-DNA 5 µl PCR-Puffer (10x) 1 µl dNTP-Mix (je 10 µM) 5 µl sense-Primer (10 µM) 5 µl antisense-Primer (10 µM) 0,2 µl Taq-Polymerase bzw. 0.5 µl Expand HiFi-Pol. ad 50 µl H2O In einem PCR-Programm werden die Proben zunächst bei 94 °C denaturiert. Anschließend folgen 30-40 Zyklen der Abfolge Denaturierung (94 °C), Annealing (55-65 °C) und Elongation (72 °C). Nach dem letzten Zyklus erfolgt eine abschließende Elongationsphase, um Fragmente der vollständigen Länge zu erhalten. Die Zeiten der Einzelschritte in den Zyklen hängen von der Größe des zu amplifizierenden Fragments ab, wobei man die Geschwindigkeit der Taq-Polymerase mit 1000 bp/min abschätzt. Die Annealing-Temperatur hingegen richtet sich nach der Basenzusammensetzung der Primer. 4.1.7 Ligation Die Ligationen wurden mit dem Takara Ligations Kit durchgeführt. Es wurden Vektor und Insert in einem molaren Verhältnis von 1:4 eingesetzt. Dieser Mischung wurden 5 µl des Ligationsmix (enthält T4-Ligase) zu einem Gesamtvolumen von 10 µl zugesetzt. Man inkubierte den Ansatz für ca.1 h bei 16 °C 32 Methoden 4.1.8 Chemische Transformation von Bakterien In einem Transformationsansatz wurden 20 µl kompetente Zellen (XL2blue, DH5α) mit 1,53 µl des Ligationsansatzes für 20 min auf Eis inkubiert. Anstelle des Ligationsansatzes kann man auch direkt Plasmid-DNA einsetzen, um eine Retransformation durchzuführen. Auf die Inkubation folgte ein Hitzeschock für 45-55 sec bei 42 °C. Anschließend erfolgte eine weitere Inkubation auf Eis für 2 min. Dann wurden 250 µl S.O.C.-Medium zugegeben und der Ansatz bei 37 °C auf einem Schüttler für 1 h inkubiert. Zuletzt plattierte man den Transfektionsansatz auf einer Agar-Platte aus, die mit dem gewünschten Antibiotikum versehen war, und inkubierte über Nacht (16-20 h). 4.1.9 Ethanolfällung von DNA Bei der Ethanolfällung wird der DNA die Hydrathülle durch den zugesetzten Alkohol und das entsprechende Salz entzogen und so gefällt. Die Salze werden anschließend mit 70%igen Ethanol ausgewaschen. Man gab zu seinem Ansatz 1/10 Vol. 3 M NaAc-Lösung und das 2,5fache Volumen eiskalten Ethanol (96-100 %), vortexte sofort und zentrifugierte dann 60 min bei 13.000 rpm und 4 °C. Das so erhaltene Präzipitat wurde dreimal mit kaltem 70 %igen Ethanol gewaschen, wobei man jeweils 5 min zentrifugierte. Nach dem dritten Waschprozess wurde der Überstand abgenommen und das Präzipitat für 10 min bei RT getrocknet. Das trockene DNA-Sediment wurde anschließend in einer entsprechenden Menge des gewünschten Lösungsmittels aufgenommen (z.B. H2O, TE-Puffer) und die Konzentration bestimmt. 4.1.10 RNA-Isolation aus Maus-Lymphozyten Es wurde die Gesamt-RNA von Concanavalin A stimulierten Maus-Lymphozyten, die aus der Milz gewonnenen wurden (4.4.3), isoliert. Hierzu wurde das RNeasy Mini Kit (Qiagen) verwendet. Die Isolation erfolgte analog zu den Angaben des Herstellers. Zuletzt wurde die RNA mit 40 µl RNase-freiem Wasser eluiert. 33 Methoden 4.1.11 cDNA-Synthese Zur cDNA-Synthese von der isolierten RNA wurde das ThermoScriptTM RT-PCR System (Invitrogen) nach Angaben des Herstellers verwendet. Hierbei findet eine reverse Transkription unter Verwendung von Oligo-dT-Primern statt. Nach Beendigung der Reaktion wird der RNA-Strang des entstandenen Hybrids durch einen RNaseH-Verdau entfernt und die cDNA steht für weitere Experimente zur Verfügung. 4.1.12 TOPO-TA-Klonierung Zur direkten Klonierung von PCR-Produkten, die mit der Taq-Polymerase amplifiziert wurden, wurde das TOPO®-TA-Cloning Kit (Invitrogen) verwendet. Ein Teil der PCRProdukte trägt aufgrund der Transferaseaktivität der Taq-Polymerase einen 3´-terminalen Adenosin-Rest. Verwendet man bei der PCR eine proofreading-Polymerase, muss dieses Adenosin in einem nachfolgenden Schritt angehängt werden. Hierzu wurde das PCRFragment für 15 min bei 72 °C mit einer Taq-Polymerase in Gegenwart von dATP inkubiert. Der lineare TOPO®-Vektor besitzt an seinen 5´-Enden einen einzelnen Thymidin-Rest, an dessen 3-Phosphat kovalent eine Topoisomerase gebunden ist. Durch Basenpaarung des freien Adenosins des PCR-Fragmentes mit dem Thymidin des Vektors kommt es zur Spaltung der Bindung zwischen Topoisomerase und Thymidin. Die dabei freiwerdende Energie wird zur Bildung einer Phosphodiesterbindung zwischen Thymidin und Adenosin verwendet. Die Reaktion wurde gemäß den Angaben des Herstellers durchgeführt. 4.1.13 Herstellung von elektrokompetenten Zellen und Elektroporation Von einer 10 ml Vorkultur E.coli-BJ 5183 wurde 1 ml in 250 ml LB-Medium (30 µg/ml Streptomycin) überführt und bei 37 °C unter Schütteln inkubiert, bis eine OD600 von 0,6 bis 0,8 erreicht war. Es folgte eine Inkubation für eine Stunde bei 4 °C. Danach wurde zentrifugiert (2.600 rpm, 4 °C, 10 min). Die Zellen wurden zweimal mit 1 l kaltem 10 %igen Glycerin gewaschen (30 min, 2.600 rpm, 4 °C). Nachdem zweiten Waschvorgang wurden die Bakterien in 2-3 ml 10 %igem Glycerin resuspendiert und in 100 µl Aliqouts bei –80 °C gelagert. Zur Transformation wurden 50 µl der kompetenten Bakterien auf Eis aufgetaut und mit den entsprechenden DNA-Mengen versetzt. Dieser Ansatz wurde in eine gekühlte 34 Methoden Elektroporationsküvette überführt, in der die Bakterien einem Puls (2500 V, 25 µF, 200 Ω) von einem Elektroporator ausgesetzt wurden. Nach der Elektroporation wurden die Bakterien sofort mit 300 µl SOC Medium versetzt und für 20 min bei 37 °C unter Schütteln inkubiert. Der Transformationsansatz wurde auf LB Platten, die das zur Selektion der transformierten DNA benötigte Antibiotikum enthielten, ausgestrichen und über Nacht bei 37 °C inkubiert. 4.1.14 Homologe Rekombination Diese Methode wird zur Herstellung von rekombinanten adenoviralen Vektoren eingesetzt. Es werden ein linearisierter Shuttle-Vektor und ein adenoviraler Vektor mittels Elektroporation cotransformiert. Aufgrund homologer Arme in den Plasmiden erfolgt eine Rekombination in den Bakterien, welche ihnen eine Kanamycin-Resistenz verleiht. Somit können positive Klone auf einer LBKan-Agarplatte selektioniert werden. In einem Ansatz wurden 50 µl BJ 5183-Bakterien mit etwa 100 ng Plasmid-DNA des adenoviralen Vektors und etwa 1 µg des Shuttle-Plasmids cotransformiert. Von den gewachsenen Klonen wurde die DNA in analytischem Maßstab isoliert und überprüft. Bei positiver Rekombination wurde diese in DH 10B Bakterien transformiert, um weitere Rekombinationsereignisse zu verhindern. 4.2 Proteinbiochemische Methoden 4.2.1 SDS Polyacrylamid-Gelelektorphorese (SDS-PAGE) In diesem Verfahren trennt man Proteine in einem polymerisierten Acrylamidgel ihrer Größe nach auf. Für eine 10 %ige SDS-PAGE wurden die Gele nach Tab. 4.1 gegossen, wobei TEMED und APS als radikale Kettenstarter für die Polymerisierung dienten. Tab. 4.1: Zusammensetzung einer 10 %igen SDS-PAGE Protogel (30%) 0,5M Tris pH 6,8 2M Tris pH 8,8 H2O SDS (10%) APS (4 °C) TEMED Sammelgel Trenngel 560 µl 2 ml 1,4 ml 40 µl 40 µl 6 µl 4 ml 6 ml 1,8 ml 120 µl 120 µl 10 µl 35 Methoden Die Proben wurden vor der SDS-PAGE für 15 min bei 95 °C in Probenpuffer denaturiert. Nachdem die Proben (5-20 µl) und der Marker (5 µl) aufgetragen wurden, legte man eine konstante Spannung von 150 V für einen Zeitraum von etwa 2 h an, bis die Lauffront aus dem Gel ausgetreten war. Nun konnten die Proteine mittels einer Coomassie-Färbung sichtbar gemacht werden oder das Gel direkt für einen Western Blot verwendet werden. Für die Coomassie-Färbung wurde das Gel bis zu einer intensiven Blaufärbung in die Färbelösung gelegt. Anschließend wurde das Gel in Entfärber-Lösung gewaschen, bis die Proteinbanden deutlich sichtbar wurden. Die Entfärber-Lösung wurde mehrmals gewechselt Nun konnte das Gel zur Dokumentation getrocknet werden. 4.2.2 Western Blot Der Western Blot ist eine Methode zum spezifischen Proteinnachweis und basiert auf einer Antikörperbindung. Hierzu werden die aufgetrennten Proteine nach der SDS-PAGE unter erneutem Anlegen einer konstanten Spannung auf eine Nitrocellulose-Membran transferiert. In einer Blotapparatur wurden (ausgehend von der Anode) ein Schwamm, Gel-Blot-Papier, Nitrocellulosemembran, Gel, Gel-Blot-Papier und Schwamm übereinander gelegt. Alle Komponenten des Blots wurden zunächst mit Transferpuffer durchtränkt. Der Transfer erfolgte bei einer Spannung von 100 V in einem Zeitraum von einer Stunde. Anschließend wurde die Membran in Blockpuffer inkubiert (30 min-12 h), um unspezifische Bindungen der Antikörper an freie Bindestellen zu verhindern. Nun erfolgte die Inkubation mit dem in Blockpuffer verdünnten Primär-Antikörper für 5-12 h. Bevor man den sekundären Antikörper hinzugeben konnte, musste der Blot mit PBS-T gewaschen werden (4 x 10 min). Der Enzym-gekoppelte Zweitantikörper wurde ebenfalls für 1-2 h auf der Membran inkubiert. Bevor die Detektion erfolgte, wurde die Membran erneut, wie oben beschrieben, gewaschen. In diesem Fall sind alle Sekundär-Antikörper mit HRP (horseradish peroxidase), einer Peroxidase aus Meerrettich, gekoppelt und wurden mit dem ECL Chemiglow Kit nachgewiesen. Die spezifische Chemilumineszenz wurde in dem Hamamatsu-Luminometer sichtbar gemacht. 36 Methoden 4.2.3 Konzentrierung von His6-markierten Proteinen (Ni2+ batch purification) Diese Methode wird eingesetzt, um Proteine mit einem His6-Anhang über die Bindung an Ni2+-NTA Agarose aus einem Proteingemisch zu trennen. Hier wurde die Technik angewandt, um die Fusionsproteine aus einem Transfektionsüberstand zu isolieren. Es wurden 293T-Zellen wie unten beschrieben transfiziert. Nach 16 h wurde das Medium durch serumfreies Medium (DMEM, ohne Phenolrot, 5 % AIM-V) ersetzt. 48 h nach Transfektion wurde der Überstand abgenommen und mit 5x-Äquilibrierungspuffer versetzt. Die eingesetzte Ni-NTA-Agarose wurde unterdessen zweimal mit Lysispuffer gewaschen. Die Agarose wurde dabei jeweils 5 min bei 500 rpm sedimentiert. Zu 20 ml Transfektionsüberstand gab man 100 µl der gewaschenen Agarose-Kügelchen. Dieser Ansatz wurde unter Schütteln über Nacht bei 4 °C inkubiert. Nun wurde die Agarose erneut sedimentiert und zweimal mit 1 ml Waschpuffer gewaschen. Die Elution der Proteine erfolgte in zwei Schritten mit jeweils 200 µl Elutionspuffer. Die Zentrifugationsschritte erfolgten alle für 5 min bei 500 rpm und 4 °C. Die einzelnen Fraktionen wurden anschließend in einer SDS-PAGE und einem Western Blot auf das gewünschte Protein hin analysiert. 4.3 Zytologische Methoden 4.3.1 Kultivierung von Zelllinien Alle Zelllinien wurden in 75 cm²-Zellkulturflaschen kultiviert. Je nach Zelldichte wurden sie 2-3 mal pro Woche passagiert. Dabei wurden die Zellen in der Regel 1:10 in dem entsprechenden Medium verdünnt. Die notwendigen Medien für die einzelnen Zelllinien sind in Tab. 2 aufgelistet. Bei den adhärenten Zelllinien (293 T/A) wurden die Zellen bei ca. 80 %iger Konfluenz einmal mit PBS gewaschen, bevor sie mit 1,5 ml Trypsin/EDTA-Lösung versetzt und für 25 min im Brutschrank inkubiert wurden. Durch das Trypsin lösen sich die Zellen vom Boden der Zellkulturflasche ab und können nun in frischem Medium resuspendiert werden. Man verwendete 10 ml Medium zum Resuspendieren der Zellen und überführte anschließend 1 ml in eine neue Flasche. Diese wurde nun auf die üblichen 20 ml Kulturmedium aufgefüllt. Die Suspensionszellen hingegen wurden mit dem Medium entfernt und abzentrifugiert (10 min, 1.000 rpm). Anschließend wurde mit ihnen genauso verfahren wie mit den adhärenten Zellen. 37 Methoden Tab. 4.2: Verwendete Zellkulturmedien Zelllinie Medium 293 T, 293 A, B16-OVA TF-1 FDCP-1 DC-Kulturen DMEM, 10 % FKS, 1 % P/S RPMI, 10 % FKS, 1 % P/S, 10 mM HEPES,2 ng/ml hGM-CSF RPMI, 10 % FKS, 1 % P/S, 10 mM HEPES, 50 ng/ml mGM-CSF RPMI, 10 % FKS, 1 % P/S, 50 µM ß-Mercaptoethanol, 4 mM LGlutamin RPMI, 10 % FKS, 1 % Antibiotic/Antimycotic, 50 µM ßMercaptoethanol, 2 mM L-Glutamin Lymphozyten-Kulturen 4.3.2 Zellen einfrieren bzw. auftauen Für eine längere Lagerung können die Zelllinien in flüssigem Stickstoff konserviert werden. Die Zellen wurden zunächst abtrypsiniert und sedimentiert (1.000 rpm, 10 min, 4 °C). Anschließend wurden die Zellen in Zellukulturmedium, versetzt mit 10 % DMSO, resuspendiert und in Aliquots bei zunächst -80 °C und später in flüssigem Stickstoff gelagert. Sollten Zellen reaktiviert werden, wurden diese bei 37 °C aufgetaut und in frischem Medium aufgenommen. Um das DMSO, welches toxisch für gewisse Zelllinien ist, zu entfernen, wurden die Zellen sedimentiert, bevor sie in Medium resuspendiert und in eine Zellkulturflasche (25 cm²) überführt wurden. 4.3.3 Transiente Transfektion mittels Calcium-Phosphat Kopräzipitation Bei der Transfektion von DNA in eukaryotische Zelllinien wurde die Methode der CalciumPhosphat Kopräzipitation gewählt, wobei die DNA über Salzkomplexe an die Zellmembran bindet und aufgenommen wird. Hier wurden 293 T-Zellen in Zellkulturflaschen so ausplattiert, so dass sie zum Zeitpunkt der Transfektion eine Konfluenz von ca. 70 % aufwiesen. 2-4 h vor der Transfektion wurde das Medium erneuert. Die Zusammensetzung typischer Transfektionsansätze ist in Tab. 4.3 aufgelistet, wobei zuerst das CaCl2 vorgelegt wurde, bevor man sukzessive die DNA und das Wasser zugeben hat. Diesen Ansatz tröpfelte man nun unter ständigem Mixen langsam zur bereitgestellten, kalten 2x-HBS-Lösung. Der gesamte Ansatz wurde direkt auf die Zellen gegeben. 38 Methoden Tab. 4.3: Ansätze zur transienten Transfektion mittels Calcium-Phosphat Präzipitation 25 cm²-Flasche 75 cm²-Flasche Zellen 1 x 106 3,5 x 106 DNA-Mix: 2M CaCl2 DNA H2O 31 µl 15 µg ad 250 µl 93 µl 30 µg ad 750 µl 2x-HBS-Lösung 250 µl 750 µl Nach 12-16 h Inkubation wurde nochmals das Medium gewechselt, da das CaCl2 toxisch auf die Zellen wirken kann. Nach 48 h wurden die Überstände abgenommen und die Zellen lysiert. Beide Fraktionen wurden anschließend für Expressionsanalysen eingesetzt. 4.3.4 Virus-Anzucht, -Produktion und –Aufreinigung Zur adenoviralen Vektorproduktion wurden 293A-Zellen mit den linearisierten Vektorgenomen, die aus der homologen Rekombination (4.1.14) hervorgegangen sind, transifiziert. Die Zellen wurden in 25 cm² Zellkulturflaschen kultiviert bis der Zellrasen zu ca. 50 % konfluent gewachsen. Anschließend wurden 4 µg des linearisierten Vektorgenoms mit dem Transfektionsreagenz Polyfect der Firma Qiagen nach Herstellerangaben transfiziert. Nach 10-14 Tagen konnte ein zythopatischer Effekt (CPE) beobachtet werden. Die Zellen wurden nun durch wiederholte Zyklen (3-4) von Frieren (-198 °C)/Tauen (37 °C) aufgeschlossen und die freigesetzten Viren zusammen mit dem Überstand zusammen für neue Infektionen eingesetzt. In dieser Art und Weise konnten nun schrittweise größere Mengen an Zellen infiziert und somit höhere Virustiter erzielt werden. Zur Aufreinigung adenoviraler Partikel wurden in dieser Arbeit zwei Methoden eingesetzt; zum einen eine Aufreinigung über CsCl Gradientenzentrifugation oder über ein Kit-System der Firma Vivascience, welches auf einer Adsorbtion der Partikel an eine Membran basiert. Für die Gradientenzentrifugation wurden 11 ml einer leichten CsCl-Lösung (1,25 g/ml) mit 6 ml einer schweren Lösung (1,45 g/ml) unterschichtet, bevor das virushaltige Zelllysat vorsichtig auf den Gradienten gegeben wurde. Dieser Gradient wurde im Rotor SW-28 (Beckman) für 90 min bei 28.000 rpm zentrifugiert. Die Viruspartikel sammelten sich zwischen den beiden CsCl-Lösungen und wurden mit einer Spritze abgezogen. Diese Fraktion wurde mit 1,5 ml der schweren CsClLösung versehen und im NVT100 Rotor zentrifugiert (ÜN, 4 °C, 55.000 rpm). 39 Methoden Die so erhaltene Virusfraktion wurde erneut mit einer Spritze abgezogen und abschließend dialysiert, um das CsCl für weitere Anwendung zu entfernen. Die aufgereinigten Virusstocks wurden bei –80 °C gelagert. 4.3.5 Bestimmung der optischen und infektiösen Viruspartikel Die Virusstocks wurden 1:20 in Lysis-Puffer (0,1 % SDS, 1 mM EDTA, 10 mM Tris-Cl) verdünnt und für 10 min bei 56 °C unter Schütteln inkubiert. Von diesem Ansatz wurde die optische Dichte bestimmt und die optischen Partikeleinheiten (OPU) nach folgender Formel berechnet: OPU (Part / ml ) = E 260 × 20 9,09 × 10 −13 Die Anzahl der infektiösen Viruspartikel wurde mit der TCID50(tissue culture infectious dose) -Methode bestimmt. Hierzu wurden 293A-Zellen in 96-Mikrotiterplatten mit seriellen, logarithmischen Verdünnungen des jeweiligen Virusstocks infiziert. Nach einem Beobachtungszeitraum von 10-14 Tagen wurden die Ansätze gezählt, die einen CPE aufwiesen, und ein Quotient für die jeweilige Verdünnungsstufe ermittelt. Den Wert der TCID50 wurde nach folgender Formel errechnet. TCID50 / ml = 10 2+ d ( S −0,5) mit d = log 10 der Verdünnung , S = Summe der Quotienten 4.3.6 MTT-Proliferationstest für GM-CSF abhängige Zelllinien Diese Methode [164;165](Mosmann, 1983, Hansen et al., 1989) basiert auf einer colorimetrisch bestimmbaren Umsetzung eines Tetrazoliumsalzes durch mitochondriale Dehydrogenasen. Da diese nur in lebenden Zellen funktionsfähig sind, kann man einen Zusammenhang der colorimetrischen Reaktion und dem Anteil der lebenden Zellpopulation erstellen. In diesem Fall wurde der Test verwendet, um die Bioaktivität des Zytokinanteils der Fusionsproteine zu demonstrieren. Dabei wurden GM-CSF-abhängige Zelllinien in Gegenwart von Transfektionsüberständen kultiviert und anschließend die Umsetzung des Farbstoffs beobachtet. In 96-Mikrotiterplatten wurden die zu testenden Proteinpräparationen und die entsprechenden Kontrollen in einem Volumen von 50 µl vorgelegt. Die entsprechenden Zellen, TF-1 für rhesus GM-CSF und FDCP-1 für murines GM-CSF, wurden dreimal mit zytokinfreiem 40 Methoden Medium gewaschen. Pro Ansatz wurden 2x104 Zellen zu gegeben und anschließend für 48 h im Brutschrank (37 °C, 5 % CO2) inkubiert. Nun erfolgte die Zugabe von 25 µl MTT-Lösung (5 mg/ml in PBS) und eine weitere Inkubation von etwa vier Stunden. Es bildeten sich blaue Kristalle bei der Umsetzung des Farbstoffs, welche durch den Zusatz von 100 µl Extraktionspuffer gelöst wurden. Hierzu wurde der Ansatz über Nacht in den Brutschrank gestellt, um eine homogene Lösung zu erhalten. Zuletzt wurde die Extinktion bei einer Wellenlänge von 550 nm bestimmt. 4.3.7 Nachweis der Bindungsaktivität von Einzelkettenantikörper-Fusionsproteinen an den Zielrezeptor Dec205 Für diesen Nachweis wurde eine CHO-Zelllinie (CHODec) verwendet, die stabil den Dec205Rezeptor auf ihrer Oberfläche exprimiert. Als Kontrollzelllinie wurden CHOneo-Zellen kultiviert, die lediglich das Neomycin-Resistenzgen exprimieren. Diese Zelllinien wurden für den Nachweis der Bindung des Einzelkettenantikörpers mit 0,53 mM EDTA-Lösung vom Boden der Zellkulturflasche abgelöst und mit einer Dichte von 5x105 Zellen/Ansatz in 96Mikrotiterplatten verteilt. Anschließend wurden die Zellen mit den zu untersuchenden Proteinpräparationen (100-200 µl) bei 4 °C für 30 min inkubiert. Nachdem die Antikörper gebunden hatten, wurden die Zellen sedimentiert (3 min, 2000 rpm) und ungebundenes Material zweimal mit 200 µl FACS-Puffer ausgewaschen. Es folgte die Inkubation mit einem Antikörper (α-OVA, 1-2000 Verd.), der den Antigen-Teil des Fusionsproteins bindet, für 30 min bei 4 °C. Nach zwei weiteren Waschschritten, wurden die Zellen zur abschließenden Detektion mit einem FITC-markierten Sekundärantikörper (α-Kaninchen, 1-500 Verd.) inkubiert. Die Analyse der Bindung erfolgte nach zwei finalen Waschschritten mittels FACSAnalyse. 4.3.8 Expressionsanalyse von Oberflächenproteinen mittels Durchflusszytometrie Um verschiedene Zellpopulation anhand ihrer charakteristischen Oberflächenstruktur differenzieren zu können, werden häufig die Proteine auf der Oberfläche mit fluoreszierenden Antikörpern markiert und anschließend in einem Durchflusszytometer untersucht. In dieser Arbeit wurden diese Färbungen ausschließlich in 96-Rundböden-Mikrotiterplatten durchgeführt. Nachdem die Zellen in den Platten sedimentiert wurden (3 min, 2000 rpm) und der Überstand verworfen wurde, wurden die Zellen mit 200 µl FACS-Puffer gewaschen. Die Antikörper-Markierung erfolgte in einem Volumen von 100 µl FACS-Puffer. 41 Methoden Die eingesetzte, optimale Verdünnung wurde für jeden fluoreszierenden Antikörper in individuellen Titrationsexperimenten bestimmt. Die Inkubation erfolgte bei allen Oberflächenfärbungen lichtgeschützt für 20 min bei RT. Nach zwei weiteren Waschschritten mit FACS-Puffer, wurden die Zellen in 200 µl FACS-Puffer resuspendiert und in FACSRöhrchen überführt. Die Analyse erfolgte nach Zugabe von weiteren 200 µl FACS-Puffer an dem Durchflusszytometer FACSCaliburTM der Firma BD Bioscience. Hier folgte man den Anweisungen des Herstellers. 4.3.9 Generierung von myeloiden Dendritischen Zellen (mDC) aus KnochenmarkVorläuferzellen Um ausreichende Mengen an mDCs für in vitro Assays zu erhalten, wurden Monozyten aus dem Knochenmark nach beschriebenem Protokoll [126] ausdifferenziert. Es wurden hierzu die Knochen des Ober- und Unterschenkel der Hinterpfoten einer C57BL/6 Maus aufgeschnitten und das Knochenmark mit einer mit Medium (siehe Tab. 4.2) gefüllten Kanüle herausgespült. Anschließend entwickeln sich die Monozyten für 7-10 Tage in Gegenwart von rmGM-CSF (5 ng/ml) und rmIL-4 (1 ng/ml) in Petrischalen zu unreifen mDC. Nach dieser Inkubation wurden die Zellen, die sich in Suspension befanden, abzentrifugiert und für nachfolgende Anwendungen eingesetzt werden. Der DC-Gehalt dieser Zellpopulation wurde über die Expression des typischen Oberflächenmarker CD11c in einer FACS-Analyse bestimmt. Um reife mDCs zu erhalten, wurden die Zellen am Tag 8 für 24h mit LPS (1 µg/ml) oder entsprechenden aktivierenden Substanzen wie z.B. Transfektionsüberständen inkubiert. Die Analyse des Reifestadiums erfolgte wiederum mittels FACS-Analyse. Hierzu wurden die mDCs mit αCD11c-APC Antikörpern markiert und des Weiteren die Expression von spezifischen. Aktivierungsmarkern mit αCD80-FITC, αCD83-PE und αCD86-FITC Antikörpern analysiert (4.3.8). 4.3.10 Nachweis Antigenspezifischer T-Zellproliferation über CFSE (Carboxyfluorescein Diacetat, Succinimidylester)-Verdünnungsassay Lymphozyten von transgenen OT-I Mäusen, deren CD8+ T-Zellen exklusiv einen TZellrezeptor exprimieren, der SIINFEKL/H2-Kb Komplexe erkennt, wurden nach bekannter Methode mit CFSE markiert [166]. Die Lymphozyten wurden, wie unter 4.4.3 beschrieben, aus der Milz isoliert und anschließend in PBS auf eine Zelldichte von 8x107 Zellen/ml eingestellt. 42 Methoden Zu dieser Suspension gab man ein äquivalentes Volumen einer 6 µM CFSE-Lösung und inkubierte den gesamten Ansatz unter leichtem Vortexen für 6 min bei RT. Durch die Zugabe von einem äquivalentem Volumen FCS (4 °C) wurde die Reaktion gestoppt. Die Zellen wurden nun zweimal mit PBS gewaschen, bevor sie in R10-Medium zu einer Zelldichte von 1x107Zellen/ml aufgenommen wurden. Je 100 µl dieser Zellsuspension wurden pro Ansatz in eine 96-Mikrotiterplatte überführt und anschließend mit den entsprechenden Peptiden bzw. Proteinpräparationen für 4 Tage stimuliert. Bei jeder Teilung verlieren die Zellen die Hälfte ihre Fluoreszenzintensität und geben diese an ihre Tochterzellen weiter. Diesen Prozess der Farbstoff-Verdünnung kann man in einer FACS-Analyse beobachten. Hierzu wurden die stimulierten Lymphozyten zusätzlich mit einem αCD8-APC Antikörper markiert, um die Analyse auf die CD8+ T-Zellen zu beschränken. 4.4 Immunologische Methoden Die Haltung der Mäuse erfolgte in der Zentralen Versuchstierhaltung der Medizinischen Fakultät der RUB nach den Richtlinien der Zentralen Versuchstierhaltung. 4.4.1 Immunisierung von C57BL/6-Mäusen In allen Immunisierungsexperimenten wurden 6-8 Wochen alte, weibliche Mäuse des Stammes C57BL/6N@Rj (Janvier) verwendet. Die Injektionen erfolgten alle subkutan in die Hinterpfoten. Hierzu wurde die jeweilige Vakzine, sowohl die DNA als auch die adenoviralen Vektoren, in einem Gesamtvolumen von 100 µl PBS verteilt auf die zwei Hinterpfoten verabreicht. Die DNA-Immunisierungen erfolgten mit einer Plasmidmenge von 50 µg DNA pro Tier, wohingegen die eingesetzte Partikelzahl für die adenoviralen Impfstoffe bei 5x109 Partikel/Tier betrug. Alle Impfstoffpräparationen wurden zuvor auf ihren Endotoxin-Gehalt überprüft. Dies geschah mit dem quantitativen Detektion Kit QCL-1000® (Cambrex) und bestätigte für alle Präparationen einen Endotoxingehalt, der niedriger als 0,1 EU/Dosis war und somit den Richtlinien für Impfstoffen entspricht. Die Analyse der Immunantwort erfolgte 8-14 Tage nach der letzten Injektion durch Blut- und Milzentnahme. Im Falle von prime-boost Immunisierungen wurde den Tieren 4 Wochen nach der ersten Injektion Blut entnommen, um die Antikörperantwort vor der 2. Injektion zu messen, und die Booster-Immunisierung erfolgte an Tag 35. Alternativ wurde 8 Tage nach der letzten Immunisierung ein Tumorchallenge (4.4.8) durchgeführt. 43 Methoden 4.4.2 Blutentnahme und Plasmaisolierung An den angegebenen Tagen wurde den Tieren unter Äther-Narkose retroorbital Blut entnommen. Ca. 250 µl Blut wurden über ein heparinisiertes Mikro-Haematokritröhrchen in ein Eppendorf-Reaktionsgefäß überführt. Zur Plasmagewinnung wurde das heparinisierte Blut für 5 min bei 5000 rpm zentrifugiert. Das erhaltene Plasma (Überstand) wurde bis zur Antikörper-Bestimmung bei –20 °C gelagert. 4.4.3 Isolierung von Lymphozyten aus der Milz Die Mäuse wurden durch cervikale Dislokation getötet, bevor die Milz entnommen wurde. Die Milzen wurden in Hanks´ gepufferter Salzlösung (HBSS) durch ein Zellsieb (cell strainer, BD Bioscience) gerieben. Die Zellen wurden anschließend sedimentiert (10 min, 1.000 rpm) und dann zur Lyse der Erythozyten in 2ml ACK-Lysispuffer (BioWhitaker) resuspendiert. Die Lyse erfolgte für 8 min bei Raumtemperatur, bevor die Reaktion durch Zugabe von HBSS gestoppt wurde. Die Lymphozyten wurden erneut sedimentiert, bevor man sie in R10-Medium aufnahm und auf die gewünschte Zelldichte einstellte. 4.4.4 Identifikation antigenspezifischer CD8+ T-Zellen mittels Tetramerfärbung Zur Analyse von antigenspezifischen T-Zellen wurde die Technik der Tetramer-Färbung entwickelt [167], die darauf basiert, dass fluoreszierende Tetramere von MHC-I/PeptidKomplexen an antigenspezifische T-Zellrezeptoren der T-Zellen binden. Somit ist eine Identifikation der T-Zellen möglich, die ein bestimmtes Epitop erkennen, welches auf dem zugehörigen MHC-I Molekül präsentiert wird. In dieser Studie wurden Tetramere eingesetzt, die aus dem Komplex des Peptids SIINFEKL (OT-I) aus dem Protein Ovalbumin mit H2-Kb Molekülen bestehen. Für jeden Ansatz wurden 1x106 Lymphozyten der immunisierten Tiere in 96-Mikrotiterplatten ausplattiert. Nachdem die Zellen sedimentiert und mit 200 µl FACS-Puffer gewaschen wurden, färbte man die Lyphozyten, analog zu einer Oberflächenfärbung, in einem Gesamtvolumen von 100 µl FACS-Puffer mit 2 µl SIINFEKL/H2-Kb-APC Tetrameren (Sanquin) an. Die Inkubation erfolgte für 45 min lichtgeschützt bei RT. Im Anschluss wurden die Zellen erneut zentrifugiert und in einem weiteren Schritt mit αCD8-FITC Antikörper markiert. In einigen Experimenten wurde zur zusätzlichen phänotypischen Charakterisierung ebenfalls die 44 Methoden Expression des Oberflächenmarkers CD62L mit einem αCD62L-PE Antikörper untersucht. Nun folgte man dem Protokoll für die Oberflächenfärbung und analysierte die Population der antigenspezifischen CD8+ T-Zellen im Durchflusszytometer. Um tote Zellen von der Analyse ausschließen zu können, wurden die Zellen vor der Messung für 5 min mit 3 µl 7-AminoActinomycin D (7-AAD) inkubiert. 4.4.5 Intrazelluläre Zytokinfärbung (ICS) Mit dieser Methode wird analysiert, ob immunmodulatorischen Zytokine von Lymphozyten nach Antigen-Kontakt ausgeschüttet werden. Dabei werden die Milzzellen der immunisierten Tiere in vitro mit spezifischen Peptiden restimuliert. Während dieser Stimulation wird durch Monensin-Zugabe die Ausschüttung von Zytokinen unterbunden, und die akkumulierten Zytokine können mittels fluoreszierender Antikörper intrazellulär nachgewiesen werden. In dieser Studie wurden jeweils 1x106 Zellen für 6h in Gegenwart von 2 µM Monensin mit R10-Medium, OT-I Peptid (2 µg/ml) oder einer Kombination aus αCD3/αCD28-Antikörpern (2 µg/ml bzw. 1 µg/ml) inkubiert. Das Gesamtvolumen der Ansätze betrug 200 µl R10, wobei in jedem Ansatz zur Untersuchung der CD8+ T-Zellen 1 µl αCD107a-FITC Antikörper enthalten war, um die Zellen zu markieren, die degranulieren [168]. Nach der Inkubation erfolgte eine Färbung der Oberflächenmarker mit entweder αCD8-PerCP oder αCD4-FITC Antikörpern nach bekanntem Protokoll. Nun wurden die Zellen in PBS resuspendiert und in 2 % Formaldehyd fixiert (20 min, RT), gewaschen (2x200 µl FACS-Puffer) und über Nacht bei 4 ° aufbewahrt. Zur Permeabilisierung wurden die Zellen in 150 µl Perm-Puffer aufgenommen, wobei gleichzeitig mögliche Fc-Rezeptoren mit 0,5 µl Fc-Block(BD Bioscience) abgesättigt wurden. Nach 10 min wurden die Zellen zentrifugiert und in 100 µl Antikörper-Lösung resuspendiert. Die Antikörper αIFN-γ-PE und αIL-2-APC wurden in Perm-Puffer verdünnt und für 30 min mit den permeabilisierten Zellen inkubiert. Es folgten zwei weitere Waschschritte mit Perm-Puffer und einer mit FACS-Puffer, bevor die Lymphozyten in der Durchflusszytometrie analysiert werden konnten. 4.4.6 ELISA (enzyme-linked immunosorbent assay) zur Antikörperbestimmung aus Mausserum Die Seren der immunisierten Tiere wurden mittels dieser Methode auf die Präsenz von antigenspezifischen Antikörpern untersucht. Das Antigen Ovalbumin (5 µg/ml) wurde über 45 Methoden Nacht in einem Volumen von 100 µl Coating-Puffer an die Oberfläche einer Mikrotiterplatte (MaxiSorb, Nunc) gebunden. Um unspezifische Bindungsstellen an der Oberfläche zu blockieren, wurden die Ansätze anschließend mit einer Magermilchpulver-Lösung (5% MMP in PBS-T0,05) für 1 h bei RT inkubiert. Nun wurden die Seren in 2% MMP in PBS-T0,05 verdünnt und 100 µl pro Ansatz eingesetzt. Nach 1 h bei RT, wurde mit 4 x 200 µl PBS-T0,05 gewaschen, bevor die Enzym-gekoppelten Sekundärantikörpern in 100 µl 2% MMP in PBST0,05 zugegeben wurden. Es wurden Immunglobuline der Klassen IgG1 oder IgG2a detektiert. Nachdem die ungebundenen Sekundärantikörper ebenfalls ausgewaschen wurden, erfolgte die Detektion entweder mit pNPP-Substrat und einer nachfolgenden Bestimmung der optischen Dichte oder über eine Chemilumineszenz-Reaktion mit ECL-Substrat. Bei der zweiten Variante wurden die relativen Lichteinheiten (RLU) in einem Luminometer bestimmt. Durch die Umstellung auf dieses System konnte die Linearität der Messwerte um 1-2 logarithmische Einheiten erhöht werden. 4.4.7 Bestimmung neutralisierender α-GM-CSF Antikörper in Immunseren Um zu überprüfen, ob die immunisierten Tiere neutralisierende Antikörper gegen GM-CSF entwickelt haben, wurde der unter 4.3.x beschriebene MTT-Proliferationstest eingesetzt. Hierzu wurden die Seren in zwei Verdünnungen (1-20 bzw. 1-100) mit dem GM-CSFhaltigen Medium (2,5 ng/ml rmGM-CSF) 30 min im Brutschrank prä-inkubiert, bevor 1x104 GM-CSF-wachstumsabhängige FDCP-1 Zellen zu jedem Ansatz in die 96-Mikrotiterplate pipettiert wurden. Als positive Kontrolle diente ein Ansatz, der ohne Serum inkubiert wurde, während die Negativkontrolle aus Medium ohne GM-CSF bestand. Nun folgte man dem oben beschriebenem Protokoll des MTT-Proliferationsassays. Bei Anwesenheit von neutralisierenden Antikörpern wurde ein verringertes Wachstum der Zellen erwartet. 4.4.8 Antigenspezifisches Tumormodell Um die Qualität der induzierten Immunantwort zu überprüfen, wurden die Tiere mit einem OVA-exprimierenden Tumormodell belastet. Hierzu wurden 2x106 B16-OVA [118] Melanomzellen in 100 µl PBS subkutan injiziert und das Tumorwachstum verfolgt. Das Tumorvolumen wurde jeden 3. Tag nach der Belastung mit folgender Formel berechnet [169]. ⎛ B × L2 Tumorvolumen = ⎜⎜ ⎝ 2 ⎞ ⎟⎟ ⎠ mit B = Breite, L = Länge 46 Methoden 4.4.9 Retrovirales Infektionsmodell mit dem Friend-Viruskomplex (FV) Mit diesem Modell sollte überprüft werden, ob die Präsenz neutralisierender Autoantinkörper einen Einfluss auf die Bekämpfung einer nachfolgenden Virusinfektion hat. Der Infektionsversuch und die folgende Charakterisierung der Immunantworten erfolgten in Zusammenarbeit mit der Arbeitsgruppe von Prof. Dittmer (Inst. für Virologie, Uniklinikum Essen). Die Infektion erfolgte intravenös mit 3000 SFFU (spleen focus forming units) in 0,5 ml PBS zwei Wochen nach der letzten Immunisierung. Der Virus-Stock wurde von Prof. Dittmer zur Verfügung gestellt und, wie beschrieben [170], aus Milzhomogenisaten gewonnen. Die Analyse der Friend-spezifischen Immunantwort erfolgte 11 Tage nach der Infektion durch Milz- und Blutentnahme. Aus den Milzkulturen bestimmte man sowohl die antigenspezifischen CD4+ und CD8+ T-Zellen mittels Tetramerfärbung [171], als auch die infektiösen Zentren pro Milz. Hierzu wurden die Milzzellen in logarithmischen Verdünnungsstufen mit empfänglichen Mus dunnis Zellen für 5 Tage inkubiert. Anschließend wurden die Kulturen mit Ethanol fixiert, mit dem FMuLV env-spezifischen monoklonalen Antikörper 720 markiert und die infektiösen Zentren mit Peroxidase-konjugierten α-Maus Antikörpern und Aminoethylcarbazol detektiert. Zusätzlich wurde die Infektionsrate der Blutzellen durch Anfärbung des Gag-Proteins mit dem spezifischen Antikörpers AB34 untersucht. Die Analyse der Zellen erfolgte mittels Durchflusszytometrie [172] 47 Ergebnisse 5. Ergebnisse 5.1. Herstellung und Charakterisierung der auf GM-CSF-Fusionsproteinen basierenden Vakzin-Vektoren 5.1.1 Klonierung der Expressionsvektoren Im ersten Teil dieser Arbeit sollte untersucht werden, ob die Fusionierung des Modellantigens Ovalbumin an das Zytokin GM-CSF eine gesteigerte Antigenaufnahme durch Dendritische Zellen und somit eine erhöhte zelluläre Immunantwort induzieren kann. Hierzu wurde zunächst der offene Leserahmen für das Zytokin mittels PCR amplifiziert und in den pCRTOPO2.1-Vektor kloniert. Als DNA-Vorlage für die spezifische PCR mit den Primern mGMs und mGMa diente eine cDNA, die aus der mRNA stimulierter Milzzellen einer Balb/c-Maus über Reverse Transkription hergestellt wurde. Nachdem die korrekte Sequenzabfolge des offenen Leserahmens im pCR2.1-mGM-CSF mittels Sequenzierungen bestätigt worden war, wurde dieser erneut in einer PCR mit den Primern Nhe-mGMs und Not-ICL-mGMa amplifiziert. Die Sequenz des murinen GM-CSF wurde nun über NheI/NotI- Restriktionsstellen in das Plasmid pSC-DecOVA eingefügt, wobei es die Sequenz, die für den Einzelketteantikörper kodiert, ersetzt. Der daraus resultierende Vektor, pcGM-OVA (Abb. 5.1A), basiert auf dem pcDNA3.1 Expressionsvektor (Invitrogen) und kodiert nun für ein Fusionsprotein aus GM-CSF und Ovalbumin, das zusätzlich mit einem HIS6-Anhang zur späteren Aufreinigung versehen ist. Als Kontrollvektor, der nur das Ovalbumin exprimiert, wurde das Plasmid pcOVA (Abb. 5.1A) eingesetzt. Im weiteren Verlauf wurden die Vektoren pS-GM-DP-OVA, pS-∆GM-OVA und pS-GMrhOVA auf der Basis des Vektors pShuttle-CMV hergestellt, welche ebenfalls in Abb. 4.1 A dargestellt sind. Der Vektor pS-GM-DP-OVA enthält einen bicistronischen CMV-Promotor, der es ermöglicht, das Zytokin und das Antigen unabhängig voneinander zu exprimieren. Die beiden kodierenden Sequenzen für Ovalbumin (Primer: DP-OVAs, DP-OVAa) und GM-CSF (DP-GMs, DP-GMa) wurden in separaten PCR-Reaktionen amplifiziert und in den Vektor pDP-CMV-pAD eingesetzt. Um den Einfluss des GM-CSF-Fusionsproteins näher zu charakterisieren, wurde ein zweites Fusionsprotein hergestellt, in dem das biologisch aktive murine GM-CSF durch ein inaktives GM-CSF, welches aus dem Rhesusaffen stammt, ersetzt wurde. Hierzu wurde die Sequenz des Ovalbumins mit NotI und XbaI aus dem Vektor pcGMOVA herausgeschnitten und anstelle des SIVp27 Proteins in die Vektoren pS-GMrh-p27 bzw. 48 Ergebnisse pS-∆GM-p27 eingesetzt. Die resultierenden Vektoren pS-GMrh-OVA bzw. pS-∆GM-OVA kodieren nun entweder für das Fusionsprotein GMrh-OVA oder ein Kontrollprotein ∆GMOVA, welches nur das Sekretionssignal des GM-CSF, aber keinen biologisch relevanten Teil der Zytokinsequenz trägt. Alle eingesetzten Vektoren sind in Abb. 4.1A schematisch dargestellt. Alle Plasmide, die auf dem pShuttle-CMV (pS-X) basieren, wurden zur homologen Rekombination mit dem Vektor pAdEasy-1 eingesetzt, um die oben beschriebenen Expressionskassetten in adenovirale Vektoren zu überführen. Zur Herstellung des fehlenden Plasmids pS-GM-OVA wurde die Sequenz des Fusionsproteins mittels PCR (Primer: KpnmGMs, Hind-HISa) aus dem Vektor pcGM-OVA amplifiziert und in pShuttle-CMV eingesetzt. Die Virusproduktion erfolgte nach Transfektion der linearisierten, adenoviralen Vektorplasmide in 293A Zellen. Nach mehreren Infektionszyklen wurden die Viren durch Zelllyse freigesetzt und über eine CsCl-Gradientenzentrifugation aufgereinigt. Mit Ausnahme der bicistronischen Expressionskassette im Vektor pS-GM-DP-OVA, werden alle Transgene unter der Kontrolle eines CMV-Promotors und der Polyadenylierungssequenz des bovinen Wachstumshormons (BGHpAd) exprimiert. 293 T-Zellen wurden mit den entsprechenden Plasmiden transient transfiziert und die Proteinexpressionen mittels Western Blot Analyse verglichen (Abb. 5.1B). Diese zeigt, dass die Fusionsproteine GM-OVA und GMrh-OVA eine Größe von etwa 75 kD besitzen, während OVA und ∆GM-OVA eine Größe von ca. 50 kD aufweisen. Abb. 5.1.: Vakzin-Vektoren Die Expressionskassetten (A) wurden in den Vektor pcDNA3.1 für DNA-Immunisierungen bzw. in den pShuttle-CMV zur Herstellung adenoviraler Vektoren kloniert. Mit Ausnahme des Vektors GM-DP-OVA werden alle Proteine unter der Kontrolle eines CMV Promotors exprimiert und enthalten einen C-terminalen ) getrennt. HIS6-Tag. Die einzelnen Abschnitte der Fusionsproteine sind durch einen Ser4Gly12 Linker ( Abk.: L-GM: Leitsequenz von GM-CSF, m=murine, rh=rhesus. Die Proteinexpression wurde in Überständen nach transienter Transfektion von 293T-Zellen mittels einer Western Blot Analyse nachgewiesen (B). In diesem Fall wurde das Ovalbumin über einen spezifischen Antikörper detektiert. 49 Ergebnisse Die Expressionsspiegel der Proteine waren mit Ausnahme der bicistronischen Vektorvariante vergleichbar hoch. Nach der Transfektion mit dem bicistronischen Plasmid produzierten die Zellen geringer Mengen des Antigens, was bei der späteren Analyse berücksichtigt werden muss. Die Expressionsspiegel, die man nach Infektionen mit den entsprechenden adenoviralen Vektoren beobachten konnte, waren vergleichbar zu den oben gezeigten (Daten nicht gezeigt). Zusätzlich zur Bestimmung der Expression durch Nachweis des Antigens, wurde die Expression des biologisch aktiven GM-CSF indirekt nachgewiesen (Abb.5.2). In diesem Fall wurden 293A-Zellen mit den adenoviralen Vektoren Ad-GM-OVA, Ad-∆GM-OVA, Ad-GMDP-OVA und Ad-GMrh-OVA infiziert. Die Überstände wurden 24 h nach der Infektion abgenommen und in einem MTT-Proliferationstest mit GM-CSF-wachstumsabhängigen FDCP-1 Zellen auf die Anwesenheit von biologisch aktiven GM-CSF getestet. Abb. 5.2: Nachweis der GM-CSF-Expression Es wurden 293A-Zellen mit je 1x108 Partikel des jeweiligen adenoviralen Vektors infiziert. 24 h nach Infektion wurden die Überstände entnommen und auf Anwesenheit von GM-CSF getestet. Hierzu wurde ein MTTProliferationstest mit FDCP-1 Zellen durchgeführt, wobei die Überstände in logarithmischen Verdünnungsstufen eingesetzt wurden. Die Zellen wurden für 48 h inkubiert und anschließend die Umsetzung des MTT-Farbstoffs detektiert. Ein Anstieg der Extinktionswerte symbolisiert Proliferation der FDCP-1 Zellen. Dieser Versuch zeigt, dass GM-CSF sowohl als Fusionsprotein (GM-OVA) als auch in der von dem bicistronischen Vektor getrennt exprimierten Form biologisch aktiv sind. Auch hier sind Unterschiede in den Expressionsleveln zu beobachten. Des Weiteren konnte belegt werden, dass das analoge Affen-Fusionsprotein GMrh-OVA ebenso wenig biologisch aktiv im Maussystem ist, wie das Kontrollprotein ∆GM-OVA. Testete man hingegen das Wachstum von TF-1 Zellen, welche humanes GM-CSF zur Proliferation benötigen, waren die Beobachtungen, wie erwartet, umgekehrt. In diesem Experiment zeigte GMrh-OVA vollständige Aktivierung des Zellwachstums, während die murine Variante GM-OVA keinerlei Aktivität zeigte (Daten nicht gezeigt). 50 Ergebnisse 5.1.2 Aufreinigung des Fusionsproteins GM-OVA Um die Eigenschaften des Fusionsproteins näher beschreiben zu können, wurde es mittels Ni2+-NTA Agarose aus Transfektionsüberständen aufgereinigt. Es wurden 293T-Zellen über die CaPO4-Präzipitations-Methode mit dem Vektor pcGM-OVA transfiziert, nach 12 h zu serumfreiem Medium gewechselt und nach weiteren 36 h die Überstände geerntet. Die Fusionsproteine wurden nun mit Ni2+-NTA Agarose aus dem Überstand gebunden und nach einigen Waschschritten durch Imidazol-Elution in aufgereinigter und biologisch aktiver Form wieder gewonnen (Abb. 5.3) Abb. 5.3: Aufreinigung des biologisch aktiven Fusionsproteins GM-OVA 293T-Zellen wurden mit dem Vektor pcGM-OVA transfiziert und das Fusionsprotein anschließend aus dem Überstand mittels Ni2+-NTA Agarose aufgereinigt. A zeigt eine Western Blot Analyse der unterschiedlichen Aufreinigungsfraktionen, in der spezifisch der Ovalbumin-Anteil des Fusionsproteins nachgewiesen wurde. Die Reinheit der aufgereinigten Proteine wurde anschließend in einer Coomassie-Färbung untersucht (B). Zuletzt wurde die biologische Aktivität des Fusionsproteins (GM-OVA) mit der eines Überstandes (GM-ÜS) verglichen, der eine definierte Menge an GM-CSF enthielt. Dies geschah erneut mit einem MTT-Proliferationstest mit FDCP-1 Zellen (C). Die einzelnen Fraktionen der Proteinaufreinigung wurden zuerst in einer OVA-spezifischen Western Blot Analyse getestet, ob sie das gewünschte Protein enthielten. Es zeigte sich, dass die Proteine sowohl effektiv an die Ni2+-NTA Agarose gebunden wurden, da kein Produkt im Überstand nach der Inkubation zu detektieren war, als auch anschließend wieder in konzentrierter Form von der Agarose gelöst werden konnten (Abb. 5.3A). Zur Überprüfung der Reinheit wurden die Fraktionen erneut in einer SDS-PAGE aufgetragen und die Proteine anschließend in einer Coomassie-Färbung sichtbar gemacht (Abb. 5.3B). Die Fusionsproteine können in den Fraktionen der ersten und zweiten Elution als eine einzelne Bande detektiert werden, wohingegen in den vorherigen Fraktionen noch starke Verunreinigungen durch zelluläre Proteine zu erkennen sind. Die Proteinmenge der aufgereinigten Proteinfraktion (erste Elution) wurde anschließend in einer Messung nach Bradford bestimmt. Um zu zeigen, dass die Fusionsproteine nach der Aufreinigung biologisch aktiv sind, wurde erneut ein MTTProliferationstest mit FDCP-1 Zellen durchgeführt. In diesem Fall wurde GM-OVA mit 51 Ergebnisse einem Überstand von 3T3-GM-CSF Zellen verglichen, der eine über ELISA quantifizierte Menge an GM-CSF enthielt. In Abb. 4.3C sieht man, dass gleiche Mengen an GM-OVA oder GM-CSF zu vergleichbaren MTT-Umsätzen (E550) führten. Man hatte nun ein aufgereinigtes Fusionsprotein mit bestätigter Aktivität, welches für weitere in vitro-Experimente eingesetzt werden konnte. 5.1.3 Einfluss von GM-OVA auf die DZ-Entwicklung und Antigenpräsentation In dieser Arbeit sollte untersucht werden, ob Fusionsproteine bestehend aus GM-CSF und einem Antigen einen direkten Einfluss auf Dendritische Zellen besitzen und so die Antigenpräsentation verbessern könnten. Da GM-CSF ein wichtiges Zytokin in der Differenzierung von DZs aus Knochenmark-Vorläuferzellen ist, wurde zunächst untersucht, ob die aufgereinigten Fusionsproteine in gleicher Weise wie rekombinates murines GM-CSF (rek.GM-CSF) diesen Prozess induzieren können. Abb. 5.4 : Einfluss von GM-OVA auf DZ-Differenzierung und Antigenpräsentation Es wurde der Einfluss des Fusionsproteins auf die Fähigkeit DZs aus Knochenmark-Vorläuferzellen zu generieren, untersucht. Die Knochenmark-Kulturen wurden 8 Tage in Gegenwart von entweder GM-OVA oder rek. GM-CSF (je 5 ng/ml) und IL-4 (1 ng/ml) inkubiert, wobei ein Teil der DZs für 24 h mit LPS (1 µg/ml) aktiviert wurde. Anschließend wurde der DZ-Phenotyp über die Expression der Oberflächenmarker CD11c, CD80, CD83 und CD86 in einer FACS-Analyse bestimmt (A). Um zu überprüfen, ob GM-OVA zu einer erhöhten Antigenpräsentation und T-Zellaktivierung führen kann, wurden CFSE-markierte (3 µM) Lymphozyten einer OT-I transgenen Maus mit entsprechenden Mengen an GM-OVA oder rek. OVA inkubiert und die Proliferation der CD8+ T-Zellen nach 72 h an Hand der CFSE-Verdünnung bestimmt (B). Als Positivkontrolle wurde das entsprechende OT-I Peptid verwendet, welches von den transgenen CD8+ Lymphzyten erkannt wird. Hierfür wurden Monozyten aus dem Knochenmark einer C57Bl/6 Maus in Gegenwart von IL4 (1 ng/ml) und entweder GM-OVA (5 ng/ml) oder rek.GM-CSF (5 ng/ml) für 7-8 Tage kultiviert. Die daraus resultierenden DZ-Populationen wurden in einer FACS-Analyse untersucht. Beide GM-CSF Präparationen führten zu einer Ausbildung des typischen Phenotyps unreifer DZs (CD80lo, CD83lo, CD86lo). All diese Oberflächenmarker wurden 52 Ergebnisse jedoch nach LPS-Stimulation hochreguliert, wodurch gezeigt wurde, dass die Fähigkeit zur Ausreifung auch durch den Einsatz des Fusionsproteins erhalten blieb (Abb. 5.4A). Nachdem man keinen negativen Einfluss von GM-OVA auf die Entwicklung von DZs beobachten konnte, sollte nun untersucht werden, ob eine stärkere T-Zellaktivierung, möglicherweise durch verstärkte Antigenaufnahme bzw. -präsentation, induziert werden konnte. Hierzu wurden Lymphozyten aus der Milz einer T-Zellrezeptor-transgenen OT-I Maus isoliert, deren CD8+ T-Zellen einen T-Zellrezeptor (TZR) exprimieren, der das OT-I-Peptid (SIINFEKL) aus dem Ovalbumin Protein im Komplex mit dem H-2Kb MHC-Molekül erkennt. Diese Lymphozyten wurden mit dem Farbstoff CFSE markiert und in Gegenwart unterschiedlicher Konzentrationen von GM-OVA, rek. OVA oder dem OT-I Peptid für 72 h inkubiert. Der Anteil der proliferierenden CD8+ T-Zellen wurde über die Ausdünnung des CFSE-Farbstoffes in einer FACS-Analyse bestimmt (Abb. 5.4B). Dies gibt nun indirekt Aufschluss darüber, ob die eingesetzten Proteine von APCs aufgenommen und präsentiert wurden, und dies zu einer Aktivierung der OT-I spezifischen CD8+ T-Zellen führte. Betrachtet man die Messungen bei einer eingesetzten Konzentration von 500 ng/ml pro Protein, erkennt man einen erhöhten Anteil an aktivierten T-Zellen für GM-OVA (72 % aller CD8+) im Vergleich zum Antigen OVA (14 %) allein. Wurden nur noch 50 ng/ml eingesetzt, konnte man für GM-OVA immerhin noch einen Anteil von 15 % proliferierender Zellen nachgewiesen werden, während OVA alleine zu keiner spezifischen Aktivierung mehr führte. Um auszuschließen, dass diese verstärkte Aktivierung allein in der Gegenwart des GM-CSF begründet ist, wurde in einem weiteren Experiment zu den Proben mit dem rekombinanten OVA die entsprechende Menge an rek. GM-CSF zugesetzt (nicht gezeigt). Doch auch unter diesen Bedingungen führte GMOVA zu einer erhöhten T-Zellproliferation, was möglicherweise durch eine verstärkte Antigenaufnahme bzw. –präsentation von APCs über GM-CSF Rezeptoren begründet werden kann. Somit unterstützen diese in vitro-Experimente die Theorie, dass durch den Einsatz von GM-CSF-Fusionsproteinen die Immunogenität eines Impfstoffes verbessert werden kann. 5.2 Immunisierungsstudien mit GM-OVA Fusionskonstrukten 5.2.1 Einfluss von GM-OVA auf die Immunogenität in Einzelinjektions- oder Prime/Boost-Experimenten In den ersten Immunisierungsexperimenten sollte untersucht werden, ob sich die positiven Effekte, die man in vitro beobachtet hatte, auch in einer gesteigerten Immunantwort in vivo 53 Ergebnisse widerspiegeln. Untersucht wurde dieser Einfluss sowohl für DNA-Impfstoffe, als auch für adenovirale Vektoren und Kombinationen aus diesen Beiden. Das Immunisierungsprotokoll und die jeweiligen Gruppen sind der Abb. 5.5 bzw. Tab. 5.1 zu entnehmen. 1.Injektion Tag 2.Injektion 35 28 1 Serum T-Zellanalyse bzw. Tumorchallenge 42 43 Serum Abb. 5.5: Immunisierungsprotokoll Alle Injektionen erfolgten subkutan in einem Volumen von 100 µl PBS, verteilt auf die beiden hinteren Pfoten. Die Blutentnahmen fanden retro-orbital unter Ether-Narkose statt. Zur T-Zellanalyse wurden die Lymphozyten aus den Milzen der Tiere isoliert. Im Falle des Tumorchallenge wurden 2x106 B16-OVA Melanomzellen subkutan in eine Flanke des Tieres injiziert. Tab. 5.1: Gruppenverteilung und verabreichte Impfstoffe Gruppenname 1.Injektion 2. Injektion PBS 100 µl PBS 100 µl PBS OVA -/D --- pcOVA (50 µg) GM-OVA -/D --- pcGM-OVA (50 µg) OVA -/A --- Ad-∆GM-OVA (5x109 Part) GM-OVA -/A --- Ad-GM-OVA (5x109 Part) OVA D/D pcOVA (50 µg) pcOVA (50 µg) GM-OVA D/D pcGM-OVA (50 µg) pcGM-OVA (50 µg) OVA D/A pcOVA (50 µg) Ad-∆GM-OVA (5x109 Part) GM-OVA D/A pcGM-OVA (50 µg) Ad-GM-OVA (5x109 Part) 5.2.1.1 Einfluss von GM-OVA auf die zelluläre Immunantwort Um den Einfluss von GM-OVA auf die induzierte zelluläre Immunantwort zu bestimmen, wurden die OVA-spezifischen CD8+ T-Zellen nach der Immunisierung ex vivo bestimmt. Zunächst wurde der prozentuale Anteil dieser antigenspezifischen Lymphozyten über eine Tetramer-Färbung bestimmt. Die fluoreszenzmarkierten Tetramere stellen einen Komplex aus MHC-Molekülen des Typs H-2Kb mit dem OVA-spezifischen OT-I Peptid dar, und binden daher die CD8+ T-Zellen, die einen TZR spezifisch für dieses Epitop tragen. Diese müssen 54 Ergebnisse folglich durch die Immunisierung induziert worden sein und stellen somit ein Maß für die Immunogenität des Impfstoffes dar. Wie das Beispiel in Abb. 5.6 zeigt, wurden für die Analyse lediglich die Zellen berücksichtigt, die die typische Lymphozyten-Morphologie (FSC/SSC) aufwiesen und zudem CD8+ waren. Da diese Methode nur eine quantitative Angabe zur induzierten CD8-Antwort zulässt, wurden die isolierten Milzzellen zusätzlich für 6 h in vitro restimuliert und in einer intrazellulären Zytokinfärbung (ICS) auf die Produktion von IFN-γ hin untersucht. Abb. 5.6: Analyse der durch die Immunisierungen induzierten zellulären Immunantworten Die Milzsuspensionen der immunisierten Tiere wurden mittels Durchflusszytometrie analysiert. A zeigt ein Beispiel für die Auswertung solcher Messungen, wobei zuerst die Population auf die Morphologie (FSC/SSC) und auf die Expression von CD8+ Zellen begrenzt wurde. Anschließend wurde innerhalb dieser Population der Anteil an Tetramer-positven Zellen (oben) oder der (CD107a+IFN-γ)+-Zellen (unten) bestimmt. Die Tiere wurden nach dem Schema in Tab. 4.1 immunisiert. Die Analyse der induzierten zellulären Immunantwort erfolgte durch Tetramer-Färbung (B) bzw. intrazelluläre Zytokinfärbung nach 6 h in vitro-Stimulation mit OT-I Peptid (2µg/ml) (C). Dargestellt sind jeweils die Mittelwerte mit dem zugehörigen Standard-Fehler (SEM), wobei zwei individuelle Experimente mit je drei Tieren pro Gruppe durchgeführt wurden. Nur die Unterschiede, die in einem ANOVA-Test eine statistische Signifikanz (p<0,05) erzielten, wurden entsprechend gekennzeichnet. 55 Ergebnisse Als zusätzlicher Marker für zytotoxische T-Lymphozyten (CTL) wurde das Protein CD107a angefärbt, welches auf der inneren Membranseite von zytotoxischen Granula lokalisiert ist und nur an die Oberfläche gelangt, wenn deren zytotoxischer Inhalt (Perforin, Granzym) ausgeschüttet wird. Zur Bestimmung der antigen-spezifschen Zytokinproduktion wurden die Zellen mit dem OT-I Peptid stimuliert und mit nicht stimulierten Ansätzen verglichen (Abb. 5.6A). Die Immunisierungen mit den Vektoren, die für das Fusionsprotein kodieren, zeigten nicht die erwartete Verstärkung der zellulären Immunantwort. Innerhalb der Gruppen, die eine einzelne Injektion erhielten, zeigten nur die Tiere eine detektierbare CTL-Antwort, die mit einem adenoviralen Vektor immunisiert wurden. Der Anteil der Tet+/CD8+ T-Zellen (Abb. 5.6B) war dabei jedoch für die Gruppe, die mit dem Fusionsprotein vakziniert wurde, mit einem Mittelwert von 4,6 % nicht signifikant unterschiedlich zu den Tieren die OVA allein erhalten hatten (6,9 %). Diese Ergebnisse wurden in der ICS bestätigt. Während die DNAImmunisierungen zu keiner detektierbaren Antwort (< 0,1 %) führten, zeigten die beiden adenoviralen Gruppen OVA -/A (7,6 %) und GM-OVA -/A (6,5 %) vergleichbare Werte für die Anzahl der (CD107a + IFN-γ)+/CD8+ T-Zellen (Abb. 5.6C). In den Prime/Boost-Immunisierungen zeigte sich, dass die induzierte Immunantwort durch eine zusätzliche Injektion mit dem Plasmid-Vektor pcOVA weiter gesteigert werden konnte. In diesem Fall führte sogar eine reine DNA-Immunisierung mit zwei Injektionen von pcOVA zu detektierbaren Leveln an Tet+/CD8+ T-Zellen (0,3 %) und (CD107a + IFN-γ)+/CD8+ TZellen (0,4 %). Diese beiden Werte lagen hingegen für die DNA-Immunisierung mit dem Fusionsprotein weiterhin bei 0,1 %, was dem Wert der unstimulierten Kontrollen entspricht. Signifikante Unterschiede traten jedoch in den heterologen DNA/Adeno-Immunisierungen auf. Während der Prozentsatz der CTLs für die Gruppe OVA D/A mit 12,5 % aller CD8+ TZellen durch die zusätzliche DNA Injektion weiter anstieg, lag dieser für die Gruppe, die mit den Fusionsproteinen behandelt wurden, lediglich noch bei 3,8 %. Dieser Unterschied war sowohl für die Tetramerfärbung als auch für die ICS statistisch signifikant (p<0,01). 5.2.1.2 Einfluss von GM-OVA auf die humorale Immunantwort Um die humorale Immunantwort zu charakterisieren, wurden die Immunseren der Tiere auf OVA-spezifische Antikörper der Subklassen IgG1 und IgG2a in einem ELISA untersucht (Abb. 5.7). Da nach einer einzelnen Injektion keine Antikörper zu diesem frühen 56 Ergebnisse Bebachtungszeitpunkt detektierbar waren, sind nur die Ergebnisse nach der 2. Injektion aus den Prime/Boost-Immunisierungen gezeigt. Abb. 5.7: Einfluss von GM-CSF auf die humorale Immunantwort Die Tiere wurden nach dem Schema in Abb. 4.5/Tab. 4.1 immunisiert. Die Seren wurden 1 Woche nach der letzten Injektion gewonnen und in einem ELISA auf OVA-spezifische Antikörper der Subklassen IgG1 und IgG2a untersucht. Die Seren wurden hierzu 1-100 (IgG1) bzw. 1-10 (IgG2a) verdünnt. Gezeigt sind die Mittelwerte der OD405 mit zugehörigem SEM von jeweils 6 Tieren pro Gruppe, die wiederum aus zwei unabhängigen Experimenten (2 x 3 Tiere) stammten. Die Werte wurden in einem ANOVA-Test auf statistische Signifikanz untersucht und diese gegebenenfalls gekennzeichnet. Neben den Unterschieden in den zellulären Immunantworten ergaben sich auch bei der Betrachtung der OVA-spezifischen Antikörper signifikante Unterschiede für die Gruppen, die mit dem Fusionsprotein behandelt wurden, im Vergleich zu den Gruppen, die das Antigen allein injiziert bekamen. So wiesen die Gruppen GM-OVA D/D bzw. D/A erhöhte IgG1-Titer auf, zeigten jedoch keine Induktion an OVA-spezifischen Antikörpern des Subtyps IgG2a. Diese IgG1/IgG2a-Verteilung war dabei unabhängig von der Kombination der verabreichten genetischen Impfstoffe, lediglich die Menge der induzierten Antikörper variierte. Analog zu der Induktion der zellulären Immunantwort scheint auch hier die Kombination aus DNA und adenoviralen Vektoren effektiver zu sein als eine reine DNA Immunisierung. Diese Beobachtung galt auch für die Immunisierungen mit den Vektoren, die nur Ovalbumin exprimerten, jedoch waren hier besonders die Antikörpertiter des Subtyps IgG2a stark erhöht. Da zusätzlich IgG1-Antikörper detektierbar waren, scheint die humorale Antwort insgesamt ausgeglichener gewesen zu sein. Ob diese quantitativen Unterschiede der zellulären und humoralen Immunantworten auch ein Maß für die Qualität der induzierten Immunantwort darstellt, sollte in einem antigenspezifischen Tumormodell untersucht werden. 57 Ergebnisse 5.2.1.3 Einfluss von GM-OVA in einem antigenspezifische Tumormodell In diesem Modell wurden B16-Melanomzellen eingesetzt, welche genetisch so verändert wurden, dass sie Ovalbumin exprimieren und somit die Peptide des Proteins präsentieren können. 2x106 dieser Zellen wurden den Tieren sowohl nach einmaliger Immunisierung (Abb. 5.8A) als auch nach den Prime/Boost-Immunisierungen (Abb. 5.8B) subkutan in die Flanke injiziert und das Tumorwachstum im Verlauf der Zeit protokolliert. ┼ ┼ Abb. 5.8: Einfluss von GM-OVA in einem antigenspezifischen Tumormodell Nach den etablierten Immunisierungsprotokollen wurde den Tieren 2x106 B16-OVA Melanomzellen subkutan in die Flanke injiziert und das Tumorwachstum protokolliert. Angegeben ist das Tumorvolumen, welches nach der Formel TV= (B x L²)/2 berechnet wurde. A und B zeigen das Tumorwachstum in Abhängigkeit der Zeit nach der Injektion der Zellen. Gezeigt ist das mittlere Tumorvolumen für jeweils 6 Tiere pro Gruppe zu den angegebenen Zeitpunkten. In C sind die Mittelwerte mit den zugehörigen SEM für den Tag 18 nach der Tumorinjektion dargestellt und statistische Signifikanzen gegenüber der Kontrollgruppe (p<0,05) mit einem * gekennzeichnet. Wenn das Tumorvolumen einen Wert von 4000 mm³ überschritten hatte, wurden die Tiere aus dem Versuch genommen und in den Graphen mit einem ┼ vermerkt. Die Tumorprogression unter diesen Bedingungen war in der PBS-behandelten Gruppe so dramatisch, dass der Großteil der Tiere bereits nach 18-21 Tagen die maximal zulässige Tumorgröße erreicht hatte und so aus dem Versuch genommen werden musste. Hingegen 58 Ergebnisse zeigten alle immunisierten Tiere ein signifikant verzögertes Tumorwachstum, unabhängig von der Wahl des Vektors bzw. des Antigen. Betrachtet man das mittlere Tumorvolumen der einzelnen Gruppen an Tag 18 nach der Injektion der Zellen(Abb. 5.8C), sieht man lediglich die Tendenz, dass eine einzelne DNA-Immunisierung nicht so effektiv ist, wie die anderen gewählten Immunisierungsstrategien. Dass diese einzelne DNA-Injektion dennoch zu einer signifikanten Verzögerung des Tumorwachstum führte, war ein überraschender Befund, da zu diesem Zeitpunkt keinerlei OVA-spezifische Immunantwort, weder CTLs noch Antikörper, im Rahmen unserer Testsensitivitäten detektiert werden konnten. Des Weiteren konnte beobachtet werden, dass die Tumorprogression in den immunisierten Tieren unabhängig von der vorhandenen Anzahl der zytotoxischen T-Zellen zu sein schien, da alle Tiere nach der Prime/Boost Immunisierung in vergleichbarer Weise geschützt waren, obwohl die Anzahl der OVA-spezifischen CD8+ T-Zellen deutlich variierten (Abb. 5.6). So war auch das spätere Tumorwachstum (nach Tag 21) dieser Tiere nicht auf einen Verlust der CTLs zurückzuführen. Dies wurde exemplarisch an jeweils drei Tieren pro Gruppe getestet, die nach der einmaligen Immunisierung und dem nachfolgenden Tumorchallenge (Tag 21) auf OVA-spezifische CD8+ T-Zellen in den bekannten Test untersucht wurden. In den Tieren, die mit den adenoviralen Vektoren Ad-∆GM-OVA oder Ad-GM-OVA behandelt wurden, waren zu diesem Zeitpunkt noch ca. 8 % aller CD8+ T-Zellen spezifisch für das OT-I Peptid und produzierten nach in vitro-Restimulation ebenfalls IFN-γ (Daten nicht gezeigt). Mit diesem Modell konnte man somit keine Korrelation zwischen den induzierten Immunantworten und den Mechanismen der verzögerten Tumorprogression herstellen. 5.2.2 Stimulation der CD8+ T-Zellantwort durch bicistronische Vektoren oder biologisch inaktive Fusionsproteine Basiert die geringere Induktion der zellulären Immunantwort durch die Vektoren, die für das Fusionsprotein kodieren, allein auf der Anwesenheit des biologisch aktiven GM-CSF, so sollten diese Effekte auch nach unabhängiger Expression von GM-CSF und Ovalbumin von einem bicistronischen Vektor (GM-DP-OVA) beobachtet werden. Da die Unterschiede zwischen Fusionsprotein und Antigen allein in der DNA/Adeno Prime/Boost Immunisierung stärker zu beobachten waren als in den Einzelinjektionsexperimenten, wurden diese Vektoren ebenfalls nach diesem Schema (Abb. 5.5) verabreicht. Die zelluläre Immunantwort wurde erneut durch Tetramerfärbung und intrazellulärer Zytokinfärbung charakterisiert. Zusätzlich zur Produktion von IFN-γ, wurde diesmal auch die Produktion von IL-2 detektiert (Abb. 5.9). 59 Ergebnisse Abb. 5.9: Vakzin-induzierte CD8+ T-Zellantworten Die Tiere wurden nach angegebenem Schema (Abb. 4.5) mit den jeweiligen Vektoren immunisiert. Repräsentative Dot-Blots der Tetramerfärbung (links), der intrazellulären Färbungen für (CD107a+IFNγ)+/CD8+ T-Zellen (mitte) bzw. für (IFN-γ+IL-2)+/CD8+ T-Zellen (rechts) sind für individuelle Tiere der Gruppen GM-DP-OVA D/A (A) und OVA D/A (B) gezeigt. Die Mittelwerte mit den zugehörigen SEM aller Tiere sind für die jeweilige Untersuchung in C dargestellt. Die Mittelwerte der Gruppen PBS, OVA, GM-OVA basieren auf 9 Tieren aus drei individuellen Experimenten, während die der Gruppen GMrh-OVA und GM-DPOVA jeweils die Werte von 6 Tieren aus einem Experiment darstellen. Relevante Statistische Signifikanzen aus einem ANOVA-Test sind entsprechend symbolisiert. Im Gegensatz zu den Vektoren, die für das Fusionsprotein kodieren, induzierten die bicistronischen Vektoren eine gesteigerte CD8+ T-Zellantwort, das sich durch eine durchschnittlich erhöhte Anzahl sowohl an Tetramer-positven (27,8 %) als auch IFN-γ produzierenden (28,8 %) CD8+ T-Zellen ausdrückte. Signifikant erhöht war auch der Anteil der CD8+ Subpopulation, die neben IFN-γ auch das proliferationsfördernde Zytokin IL-2 ausschüttet. Diese als polyfunktional bezeichnete T-Zellfraktion stellte nach der Immunisierung mit den bicistronischen Vektoren 1,9 % aller CD8+ T-Zellen, während die 60 Ergebnisse Immunisierung mit dem Antigen allein nur zu einer Induktion von 0,26 % dieses Zelltypen führte (Abb. 5.9C, rechts). Diese Beobachtungen widersprechen der Hypothese, dass die reduzierte CD8+ T-Zellantwort, die nach Gabe des Fusionsproteins beobachtet wurde, in der generellen Anwesenheit des Zytokins begründet liegt, und unterstützen den Einsatz von GMCSF als genetisches Adjuvants. Des Weiteren wurde in diesem Experiment untersucht, ob die biologische Aktivität des Fusionsproteins für diese Effekte relevant ist oder, ob die veränderte Struktur des Antigens durch die Fusionierung ausreichend ist. In letzterem Fall sollte die Immunisierung mit dem biologisch inaktiven Fusionsprotein GMrh-OVA ebenfalls zu einer Reduktion der CD8+ T-Zellantwort im Vergleich zum Antigen allein hervorrufen. Dies war jedoch in keinem der vorliegenden Experimente zu beobachten. Sowohl in der Quantität (Tetramer) als auch in Funktionalität (ICS) der induzierten CD8+ T-Zellantwort konnten keine Unterschiede zwischen den Gruppen OVA D/A und GMrh-OVA D/A beobachtet werden (Abb. 5.9C). Diese Ergebnisse sind somit ein Indiz dafür, dass die Aktivität des murinen Fusionsproteins einen Einfluss auf die induzierte Immunantwort besitzt. Jedoch zeigten alle antigenspezifischen CD8+ T-Zellen, unabhängig vom Vakzinvektor, vergleichbare Funktionalitäten hinsichtlich ihrer Fähigkeiten zu degranulieren und IFN-γ zu produzieren. Die Regulation der Expression von CD62L (L-Selektin), einem wichtigen Oberflächenmolekül für das Migrationsverhalten der Lymphozyten, scheint ebenso nicht beeinflusst zu sein (Abb. 5.10). Ist dieser Marker auf naiven Lymphozyten stark exprimiert, so wird er nach Aktivierung der T-Zellen runterreguliert, um den Eintritt in den Blutkreislauf zu ermöglichen [173]. Auch bei dieser Analyse konnten keine signifikanten Unterschiede zwischen den Gruppen detektieren werden, denn in allen Gruppen waren 80-95 % der antigenspezifischen CD8+ T-Zellen (Tetpos) negativ für die Expression von CD62L (Abb. 5.10D). In den Tetneg-Populationen der immunisierten Tiere war im Vergleich zu den naiven Tieren ebenfalls ein erhöhter Prozentsatz dieser aktivierten Zellen zu finden. Diese Effektorzellen konnten in ihrer Spezifität nicht weiter charakterisiert werden, sind aber vermutlich gegen andere Epitope des Antigens oder des adenoviralen Vektors gerichtet. Der Einfluss des Fusionsproteins auf die Induktion der zellulären Immunantwort scheint daher eher quantitativer als qualitativer Natur zu sein. 61 Ergebnisse Abb.5.10: Charakterisierung der CD8+ T-Zellen hinsichtlich ihrer CD62L-Expression Milzzellen der immunisierten Tiere wurden in einer Tetramer-Färbung (A) analysiert und die Subpopulation Tetpos (B) und Tetneg (C) bezüglich ihrer CD62L Expression charakterisiert. Der Anteil der CD62L runterregulierten Zellen (CD62Llo) in der Tetpos Fraktion ist für drei Tiere exemplarisch dargestellt (D). Angegeben ist wiederum der Mittelwert mit den zugehörigen SEM. 5.2.3 Vergleich der humoralen Immunantworten nach Immunisierung mit den unterschiedlichen GM-CSF- und OVA-exprimierenden Vektoren Nachdem für die zelluläre Komponente des Immunsystems deutliche Unterschiede für die gewählten Impfstoffvarianten beobachtet werden konnten, wurde nun überprüft, ob sich diese auch in unterschiedlichen Antikörpertitern ausdrückten. Eine Woche nach der Boost-Injektion wurden IgG1- und IgG2a-Titer im Serum der immunisierten Tiere bestimmt. Wie schon in den ersten Experimenten beobachtet, waren auch hier die IgG1 Titer (Abb. 5.11A) nach Behandlung mit den aktiven Fusionsproteinen (GM-OVA) signifikant erhöht, während die Anzahl der IgG2a Antikörper reduziert war (Abb. 4.11B). Dieser Effekt scheint analog zu den Ergebnissen der zellulären Immunantworten von der biologischen Aktivität des Fusionsproteins abzuhängen, da die inaktive Affenvariante des Fusionsproteins (GMrh-OVA) nicht zu einer derartigen Verschiebung im Verhältnis IgG1/IgG2a führte. 62 Ergebnisse In diesem Fall waren die Titer nicht signifikant unterschiedlich zu denen, die man in den Tieren detektieren konnte, die mit dem Antigen allein (OVA) behandelt wurden. Abb. 5.11: Vergleich der humoralen Immunantworten Die Tiere wurden nach dem Schema in Abb. 4.5/Tab. 4.1 immunisiert. Die Seren wurden 1 Woche nach der letzten Injektion gewonnen und in einem ELISA auf OVA-spezifische Antikörper der Subklassen IgG1 und IgG2a untersucht. Die Seren wurden hierzu 1-100 (IgG1) bzw. 1-10 (IgG2a) verdünnt. Gezeigt sind die Mittelwerte der OD405 mit zugehörigem SEM von jeweils 6 Tieren pro Gruppe. Die Werte wurden in einem ANOVA-Test auf statistische Signifikanz untersucht und diese gegebenenfalls gekennzeichnet. Eine Antigen-unabhängige Expression von GM-CSF durch die bicistronischen Vektoren (GM-DP-OVA) reichte ebenfalls nicht aus, um die humorale Immunantwort in diesem Sinne zu beeinträchtigen. Im Gegensatz zu der verstärkten Induktion der zellulären Immunantwort zeigte die zusätzliche Expression von GM-CSF weder einen Einfluss auf die Intensität noch auf die Spezifität der humoralen Immunantwort. 5.2.4 Induktion neutralisierender Antikörper gegen GM-CSF Da die Reduktion der CD8+ T-Zellantwort erst nach Prime/Boost-Immunisierungen und nicht nach Einzelinjektionen mit den GM-OVA kodierenden Vektoren zu beobachten waren (Abb. 5.6), beeinflusst womöglich die mit der ersten Injektion induzierte Immunantwort den Effekt der Boost-Immunisierung. Es wurden die Seren der immunisierten Tiere auf Antikörper gegen GM-CSF untersucht, da solche in früheren Studien mit rekombinanten GMCSF Proteinen beschrieben wurden. Zur Bestimmung neutralisierender Antikörper wurde GM-CSF-haltiges Medium mit den Seren inkubiert, bevor es in einem Proliferationstest an FDCP-1 Zellen eingesetzt wurde (Abb. 5.12). 63 Ergebnisse Enthalten die Seren neutralisierende Antikörper gegen GM-CSF, sollten die Zellen eine reduzierte Proliferationsfähigkeit aufweisen. Abb. 5.12: Nachweis neutralisierender Antikörper gegen GM-CSF Die Tiere wurden mit den angegebenen Vektoren nach dem Prime/Boost Protokoll immunisiert. Die Seren wurden eine Woche nach der Injektion der adenoviralen Vektoren in einem Proliferationstest auf die Anwesenheit neutralisierender Antikörpern getestet. GM-CSF-wachstumsabhängige FDCP-1 Zellen wurden mit GM-CSF-Medium (2,5 ng/ml) inkubiert, welches zuvor mit den Seren vorinkubiert worden war. Die Seren wurden sowohl in einer 1/20 (weiße Säulen) als auch in einer 1/100 (schwarze Säulen) Verdünnung getestet GM-CSF-Medium ohne Vorinkubation diente als positive Wachstumskontrolle, während GM-CSF-freies Medium die negativ Kontrolle bildete. Die Graphen zeigen die Mittelwerte von jeweils drei repräsentativen Tieren pro Gruppe. Sowohl vier Wochen nach der DNA-Injektion als auch eine Woche nach der adenoviralen Boost-Injektion wurden die Seren getestet. Zum erstgenannten Zeitpunkt waren alle Seren negativ und die Zellen zeigten uneingeschränkte Proliferation (Daten nicht gezeigt). Im Gegensatz dazu zeigten alle Seren der Gruppe GM-OVA D/A nach der Boost-Immunisierung GM-CSF-neutralisierende Aktivität. In beiden Verdünnungsstufen wurde die Proliferation der FDCP-1 Zellen auf das Level der nicht-stimulierten Kontrolle reduziert (Abb. 5.12). Interessanterweise induzierte die bicistronische Vektorvariante keine vergleichbare Aktivität der Seren. Diese, wie auch alle Seren der übrigen Gruppen, zeigten keine inhibitorische Wirkung auf das Zellwachstum. Aufgrund dieser Beobachtungen wurden ebenfalls die Seren der ersten Versuchsreihe untersucht. Diese bestätigten, dass lediglich die biologisch aktiven Fusionsproteine eine neutralisierende Immunantwort gegen GM-CSF induzierten. Auch in den Seren nach zwei Injektionen mit dem Plasmid pcGM-OVA konnte GM-CSFneutralisierende Aktivität beobachtet werden, die von der Intensität jedoch deutlich unterhalb 64 Ergebnisse der Seren lag, die man nach DNA/Adeno Prime/Boost-Immunisierung gewonnen hatte (Daten nicht gezeigt). Dies zeigte jedoch, dass die Induktion der Autoimmunität lediglich von der Art des Antigens abhing und nicht auf den adenoviralen Vektor beschränkt war. 5.2.5 Einfluss der GM-CSF-neutralisierenden Antikörper auf die Immunantwort und virale Replikation während einer retroviralen Infektion Da das Auftreten der neutralisierenden Antikörper gegen GM-CSF in den vorherigen Experimenten mit einer reduzierten antigenspezifischen CD8+ T-Zellantwort einherging, sollte mit diesem Versuch untersucht werden, ob diese autoreaktiven Antikörper eine generelle Suppression der zellulären Immunantwort bezüglich nachfolgender Infektionen auslösen können. Zu diesem Zweck wurden Tiere nach bekanntem DNA/Adeno Prime/Boost Protokoll mit dem Fusionsprotein GM-OVA immunisiert, um GM-CSF-neutralisierende Antikörper zu induzieren. Als Kontrollen wurden die Gruppen PBS, OVA D/A und GM-DPOVA D/A mitgeführt. Nachdem die Präsenz der Autoantikörper bestätigt wurde, wurden die Tiere 14 Tage nach der adenoviralen Injektion mit dem retroviralen Friend Virus (FV) infiziert. Wie erwartet, zeigten lediglich die Seren der Tiere, die mit den Fusionsproteinen behandelt wurden, GM-CSF-neutralisierende Aktivität (Abb. 5.13A). Abb. 5.13: Nachweis GM-CSF-neutralisierender Antikörper vor bzw. während der FV Infektion Die Tiere wurden wie angegeben immunisiert. Von den 6 Tieren der Gruppen GM-OVA D/A und GM-DP-OVA D/A wurden jeweils die Seren 7 Tage vor der FV Infektion (A) bzw. 11 Tage nach der Infektion auf neutralisierende Antikörper getestet. Hierzu wurde erneut die Proliferation der GM-CSF-abhängigen FDCP-1 Zelllinie unter den oben beschriebenen Bedingungen bestimmt. Da zur Kontrolle dieses Virus laut Literatur sowohl spezifische Antikörper, CD4+ als auch CD8+ Zellen notwendig sind, würde man bei einer supprimierten CD8+ T-Zellantwort einen drastischeren Infektionsverlauf erwarten. 65 Ergebnisse Um den Verlauf der Infektion und der dadurch ausgelösten Immunantwort zu charakterisieren, wurden 11 Tage nach der FV Infektion einerseits die Viruslast in der Milz bzw. im Blut ermittelt und zusätzlich die antigenspezifischen CD8+ bzw. CD4+ T-Zellen mittels Tetramerfärbungen bestimmt (Abb. 5.14). Außerdem wurde zu diesem Zeitpunkt ein weiteres Mal die Präsenz der GM-CSF-neutralisierenden Antikörper in den Seren bestätigt, um ausschließen zu können, dass diese ein temporäres Phänomen war und die Titer zum Zeitpunkt der Analyse bereits abgeklungen waren (Abb. 5.13B). Abb. 5.14: Beeinträchtigung der Kontrolle der FV Infektion durch GM-CSF Autoantikörper Durch Prime/Boost Immunisierung mit den GM-OVA exprimierenden Vektoren wurden neutralisierende Antikörper gegen GM-CSF induziert, bevor die Tiere 14 Tage nach der letzten Injektion mit 3000 SFFU FV infiziert wurden. Die Kontrolltiere wurden mit PBS oder mit den Vektoren behandelt, die entweder das Antigen allein oder beide Proteine unabhängig voneinander exprimierten. Die FV-spezifische Immunantwort wurde über MHC I- (A, links) bzw. MHC II (A, rechts)-Tetramerfärbungen bestimmt. Die FV-infizierten Blutzellen wurden mittels gag-spezifischen Färbung (AK34) zytometrisch detektiert (B, links). Zusätzlich wurden die infektiosen Zentren in den Milzen bestimmt (B, rechts). Gezeigt sind jeweils die Mittelwerte mit zugehörigen SEM für 6 Tiere. Obwohl die Autoantikörper während der gesamten Infektionsphase in der Gruppe GM-OVA D/A detektierbar waren, zeigte sich in den untersuchten immunologischen Parametern kein Unterschied zu den anderen Gruppen. 66 Ergebnisse Die Viruslasten waren sowohl im Blut als auch in der Milz für alle Gruppen ebenso vergleichbar (Abb. 5.14B), wie es auch die Anzahl der antigenspezifischen CD4+ T-Zellen war. Lediglich die Bestimmung der FV-spezifischen CD8+ T-Zellantwort führte zu einer interessanten Beobachtung. Die Werte unterschieden sich zwar kaum für die eingesetzten Vakzin-Vektoren (1,6-2,8%), jedoch waren sie gegenüber der PBS-Kontrolle (6,1 %) signifikant reduziert. Dies lässt vermuten, dass die starke Vakzin-induzierte, OVA-spezifische CD8+ T-Zellantwort mit der Induktion der FV-spezifischen Immunantwort interferiert. Insgesamt konnte jedoch kein Zusammenhang zwischen der Präsenz der GM-CSFAutoantikörper und einem veränderten Infektionsverlauf der retroviralen FV Infektion beobachtet werden. 5.2.6 Vergleich der Adjuvanteffekte von GM-CSF auf die primäre bzw. sekundäre Immunantwort während DNA/Adeno Prime/Boost-Immunisierungen Nachdem die Fusion des Antigens an das GM-CSF nicht zur gewünschten Verbesserung der zellulären Immunantwort geführt, jedoch die Koexpression des Zytokins scheinbar die Immunogenität der Vakzine erhöht hatte, wurde in einem weiteren Experiment untersucht, ob es einen Unterschied macht, ob der bicistronische Vektor in der DNA Injektion oder der folgenden adenoviralen Immunisierung eingesetzt wurde. Dafür wurden die Tiere nach dem bekannten Protokoll (Abb. 5.5) immunisiert und in die Gruppen aus Tab. 5.2 eingeteilt. Es wurden 6 Tiere pro Gruppe behandelt, wobei die PBS-Kontrollgruppe nur aus 3 Tieren bestand. Tab. 5.2: Gruppenverteilung und verabreichte Impfstoffe Gruppenname 1.Injektion 2. Injektion PBS 100 µl PBS 100 µl PBS OVA/OVA D/A pcOVA (50 µg) Ad-∆GM-OVA (5x109 Part) OVA/GM D/A pS-GM-DP-OVA (50 µg) Ad-GM-DP-OVA (5x109 Part) GM/GM D/A pcOVA (50 µg) Ad-GM-DP-OVA (5x109 Part) GM/OVA D/A pS-GM-DP-OVA (50 µg) Ad-∆GM-OVA (5x109 Part) Zusätzlich zu den Tetramerfärbungen und der intrazellulären Zytokinfärbung für die CD8+ TZellen, wurde diesmal auch die IFN-γ Produktion von CD4+ T-Zellen in einer intrazellulären Färbung bestimmt (Abb. 5.15). 67 Ergebnisse Die in vitro Stimulation erfolgte in diesem Fall nicht antigenspezifisch, sondern TZellrezeptor abhängig über eine Antikörperkombination (αCD3/αCD28), wodurch induzierte CD4+-Zellen restimuliert werden können, hingegen naive kaum. Abb 5.15: Vergleich der zellulären Immunantwort nach GM-CSF Koexpression in Prime/Boost Vakzinierung Die Tiere wurden mit den jeweiligen Vektoren (Tab. 4.2) immunisiert und die zelluläre Immunantwort eine Woche nach der letzten Injektion mittels Tetramer-Färbung (A) und intrazellulärer Zytokinfärbungen für CD8+ (B, C) bzw. CD4+ T-Zellen (D) bestimmt. Für die ICS wurden die Zellen mit OT-I Peptid (2µg/µl) (B, C) bzw. mit der Kombination αCD3/αCD28 (2µg/ml bzw. 1µg/ml) (D) 6h in vitro restimuliert. Gezeigt sind jeweils Mittelwerte mit zugehörigem SEM von jeweils 6 Tieren pro Gruppe. Die Werte wurden in einem ANOVA-Test auf statistische Signifikanz untersucht und diese gegebenenfalls gekennzeichnet. Entgegen den Beobachtungen aus den ersten Experimenten ergaben sich keine Unterschiede in der quantitativen Anzahl der antigenspezifischen CD8+ T-Zellen in der Tetrameranalyse für die einzelnen Gruppen. Die Mittelwerte variierten hier lediglich geringfügig für die Gruppen zwischen OVA/GM (16,97 %) und GM/OVA (21,96 %), während die anderen beiden Gruppen mit 20,07 % bzw. 20,14 % dazwischen lagen. Obwohl auch die prozentualen Werte für die (CD107a/IFN-γ)+/CD8+ T-Zellen in diesem Experiment nicht signifikant unterschiedlich waren, zeigte sich erneut die Tendenz, dass die Koexpression einen positiven 68 Ergebnisse Einfluss auf die Induktion von diesen hat. Lag der Mittelwert für die Immunisierung ohne GM-CSF bei 16,14 % aller CD8+ T-Zellen, so stieg er für die Gruppe, die bei beiden Injektionen mit den bicistronischen Vektoren behandelt wurden (GM/GM D/A) auf 21,86 % an. Die Tiere, die nur zu einem Zeitpunkt den bicistronischen Vektor injiziert bekamen, lagen erwartungsgemäß dazwischen mit 18,75 % (OVA/GM) bzw. 21,13 % (GM/OVA). Die Unterschiede wurden statistisch signifikant, wenn man die Population der IFN-γ und IL-2 produzierender CD8+ T-Zellen betrachtet. Diese Population war signifikant auf 1,76 % erhöht, wenn GM-CSF während beiden Phasen der Immunisierung präsent war. Aber auch wenn das Zytokin nur bei der DNA Immunisierung (0,9 %) bzw. bei der adenoviralen Injektion (1,0 %) zugegen war, war die Anzahl dieser polyfunktionalen Zellen gegenüber der Injektion ohne GM-CSF (0,55 %) erhöht. Ähnliche Unterschiede waren für die Induktion der IFN-γ produzierenden CD4+ T-Helferzellen zu beobachten. Die bicistronische Prime/Boost Immunisierung resultierte in einem Mittelwert von 20,29 % aller CD4+ Zellen, was wiederum signifikant erhöht war im Vergleich zu allen anderen Gruppen. In diesem Fall scheint die Koexpression besonders bei der adenoviralen Boost-Injektion vorteilhaft gewesen zu sein, denn mit einem Mittelwert von 13,96 % induzierte OVA/GM eine stärkere Helferzellantwort als die Variationen GM/OVA (5,73 %) und OVA/OVA (6,18 %). Insgesamt sah es so aus, dass die Adjuvanteffekte von GM-CSF am stärksten auftraten, wenn das Zytokin bei beiden Immunisierungsphasen zugegeben wurde. 5.3. Herstellung bicistronischer adenoviraler Vektoren zur Expression von Fusionsproteinen aus αDEC205-Einzelkettenantikörpern und Ovalbumin in Kombination mit DZ-Stimuli Nachdem die GM-CSF Fusionsproteine, die in vitro einen positiven Einfluss (Abb. 5.4) auf die Antigenpräsentation gezeigt hatten, in den Immunisierungsstudien autoreaktive Antikörper und eine reduzierte Induktion der zellulären Immunantwort hervorgerufen hatten, sollte im zweiten Teil der Arbeit die zielgerichtete Antigenaufnahme von DZ durch Fusionsproteine eines Einzelkettenantikörpers, der gegen den DZ-Rezeptor DEC205 gerichtet ist, und dem Antigen erreicht werden. Die Expression der Fusionsproteine erfolgte in vivo durch Transduktion mit adenoviralen Vektoren, die über eine bicistronische Expressionskassette verfügen und somit gleichzeitig genetische Adjuvantien exprimieren können. In diesem Fall wurde die Co-Expression von GM-CSF oder einem löslichen CD40 Liganden untersucht. 69 Ergebnisse 5.3.1 Klonierung der Expressionsvektoren Zur Herstellung der bicistronischen adenoviralen Vektoren mussten die in Abb. 5.16 dargestellten Expressionskassetten in den pShuttle Vektor kloniert werden, bevor diese später mit dem adenoviralen Genomvektor AdEasy-1 zu den entsprechenden adenoviralen Vektoren rekombiniert werden konnten. Abb. 5.16: Expressionskassetten der bicistronischen Vektoren Diese Expressionskassetten wurden zur späteren Herstellung adenoviraler Vektoren in das pShuttle-Plasmid kloniert. Alle Transgene werden unter der Kontrolle eines bicistronischen CMV-Promotors exprimiert. Als DZStimuli wurden eine lösliche Form des CD40L (sCD40L) und GM-CSF ausgewählt. DEC-OVA (DO) stellt ein Fusionsprotein aus dem Antigen Ovalbumin und dem Einzelkettenantikörper gegen DEC205 dar, während GL117-OVA (GO) eine entsprechende nicht-bindende Isotypkontrolle des Einzelkettenantikörpers ist. Hierzu wurden die offenen Leserahmen der Fusionsproteine DEC-OVA bzw. GL117-OVA per PCR amplifiziert. Als DNA-Vorlage dienten die Plasmide pSC-DEC-OVA bzw. pSCGL117-OVA und die verwendeten Primer waren Nhe-DO2s und Xba-DOa. Die PCRProdukte wurden über die NheI und XbaI-Schnittstellen in den Vektor pS-GM-DP-OVA eingesetzt, wobei die Fusionsproteine die kodierende Sequenz des Ovalbumins ersetzt haben. So entstanden die Vektoren pS-GM-DP-DO bzw. pS-GM-DP-GO. Wurden die PCRFragmente auf dieselbe Weise in den Vektor pDP-CMV-pAd kloniert, so entstanden die Kontrollvektoren pS-DP-DO bzw. pS-DP-GO, die nur für die Fusionsproteine kodieren. Die lösliche Form des CD40 Liganden wurde so aufgebaut, dass dem Exportsignal des tPA(tissue type plasminogen activator)-Protein die Aminosäureabfolge der extrazellulären Dömane des CD40L nach dessen proteolytischer Spaltung (AS 113-260) angehängt wurde. Hierzu wurde zunächst die entsprechende Nukleotidsequenz des CD40L mittels PCR amplifiziert. Als DNA-Vorlage diente das Plasmid AAV-CD40L und die eingesetzten Primer waren shCD40Ls und CD40La. Das PCR-Produkt wurde über die EcoRV und NheI Schnittstellen in den Vektor pShuttle-rtenvco, so dass nun die Sequenz des CD40L in einem Leserahmen mit der tPA-Exportsequenz exprimiert werden konnte. Zur weiteren Herstellung der bicistronischen Shuttle-Vektoren pS-CD40L-DP-DO bzw. pS-CD40L-DP-GO wurde der 70 Ergebnisse gesamte Leserahmen, der nun tPA- und CD40L-Sequenzen enthielt, mit den Primer DPCD40Ls und DP-CD40La erneut amplifiziert und über die PvuI und NotI Schnittstellen an die Stelle der kodierenden Sequenz des GM-CSFs in die Vektoren pS-GM-DP-DO bzw. pS-GMDP-GO kloniert. Nachdem alle Shuttle-Plasmide konstruiert waren, wurden die adenoviralen Plasmide zur Vektorproduktion über homologe Rekombinationen mit dem Genomvektor AdEasy-1 erzeugt. Die Produktion der adenoviralen Vektoren erfolgte in 293A-Zellen und die Aufreinigung aller hier verwendeten Vektoren geschah mittels dem AdenoPak20-Kit der Firma Vivascience. Zum Nachweis der Transgenexpression nach adenoviraler Transduktion wurden 293A-Zellen mit identischen Partikelzahlen der einzelnen Vektoren infiziert und die Anwesenheit der Proteine in den Kulturüberständen 24 h nach Infektion überprüft (Abb. 5.17). Abb. 5.17: Expressionsnachweis der Transgene nach adenoviraler Infektion 293A-Zellen wurden mit 5x108 Partikeln des jeweiligen adenoviralen Vektors infiziert und die Expression der Fusionsproteine im Kulturüberstand 24 h nach der Infektion in einem OVA-spezifischen WB nachgewiesen (A). Die Expression der DZ-Stimuli wurde für sCD40L ebenfalls per WB (B) bestätigt, während die GM-CSFExpression anhand der eines MTT-Proliferationstest an FDCP-1 Zellen quantifiziert wurde. Die Fusionsproteine wurden dabei in einer OVA-spezifischen WB Analyse nachgewiesen, in der auch vergleichbare Expressionslevel für die einzelnen Vektoren bestätigt werden konnten (Abb. 5.17A). Diese Beobachtung traf ebenfalls für die Expression der DZ-Stimuli zu, welche einerseits für CD40L über eine weitere WB Analyse (Abb. 5.17B) oder im Falle des GM-CSF über die Aktivierung der Proliferation von FDCP-1 Zellen (Abb. 5.17C) bestätigt werden konnte. Dieser Nachweis, dass alle Bausteine der Impfstoffe in vitro in vergleichbaren Mengen produziert werden, ermöglicht nun einen Vergleich des Einflusses der unterschiedlichen Vektoren auf die Induktion der zellulären bzw. humoralen Immunantworten in vivo. Zuvor musste jedoch noch die erhaltene Spezifität der Einzelkettenantikörper-Fusionsproteine für DEC205 bestätigt werden. 71 Ergebnisse 5.3.2 Bindungsfähigkeit der Fusionsproteine an DEC205 und Antigenpräsentation durch DZs Die Bestätigung, dass die Fusionsproteine, deren Expression unter 5.3.1 beschrieben worden ist, wirklich an ihr Zielmolekül DEC205 binden, wurden die oben beschriebenen Infektionsüberstände mit CHO-Zellen inkubiert, die stabil diesen Rezeptor an der Oberfläche exprimieren (CHODEC). Im Falle einer Bindung, konnten die Fusionsproteine an der Oberfläche über Antikörper gegen den OVA-Anteil nachgewiesen werden. Dies geschah über FITC-markierte Sekundär-Antikörper und anschließender FACS-Analyse (Abb. 5.18A). Abb. 5.18 Bindung der Fusionsproteine an DEC205 und Antigenaufnahme durch DZs Die Bindungsfähigkeit der Fusionsproteine wurde ebenfalls aus den in Abb. 4.17 beschriebenen Infektionsüberständen bestimmt. CHODEC-Zellen, die stabil DEC205 auf der Oberfläche exprimieren, wurden mit den Überständen inkubiert und die gebundenen Fusionsproteine mit OVA-spezifischen, fluoreszierenden Antikörpern detektiert. Die Histogramme zeigen die Zellen bezüglich ihrer Fluoreszenzintensität für die Proben (rote Linien) und für unbehandelten CHODEC-Zellen (schwarz)(A, oben). Als Kontrolle für unspezifische Bindung wurden CHOneo-Zellen mit denselben Überständen parallel behandelt (A, unten). Um zu überprüfen, ob DEC-OVA verstärkt durch DZs aufgenommen und präsentiert wurde, wurden DZs aus der Milz isoliert und mit Infektionsüberständen der Vektoren Ad-DP-GO und Ad-DP-DO inkubiert (2 h), bevor sie mit transgenen OT-I CD8+ T-Zellen vermischt wurden. Diese waren CFSE-markiert, so dass die Proliferation nach 96 h in einer FACS-Analyse bestimmt werden konnte. Die Infektionsüberstände wurden diesmal von B-16 Zellen geerntet, die 72 h zuvor mit 1x1010 Partikeln des jeweiligen Vektors infiziert worden waren. Die Histogramme zeigen die Abnahme der CFSE-Intensität (B). Alle Ansätze, in denen DEC-OVA Überstände eingesetzt wurden, zeigten eine Verschiebung der Histogramm-Kurven zu höheren Intensitäten (rote Linien) im Vergleich zu unbehandelten CHODEC-Zellen, was auf Bindung der Fusionsproteine an die CHODEC-Zellen schließen ließ. 72 Ergebnisse Im Gegensatz dazu wiesen alle Proben, die GL117-OVA Proteine enthielten, einen identischen Kurvenverlauf wie die Kontrollansätze auf. Des Weiteren zeigte die parallele Behandlung von CHOneo-Zellen, die bis auf die Expression des DEC205 identischen Ursprungs sind, dass die Bindung der DO-Proteine spezifisch für den Rezeptor war, da hier alle Histogramm-Kurven identisch mit den Kontrollen verliefen. Im nächsten Schritt sollte untersucht werden, ob diese Bindung an DEC205 bei Dendritischen Zellen zu einer gesteigerten Antigenaufnahme und -präsentation führt. In diesem Fall wurden B16-Mauszellen mit den Vektoren Ad-DP-DO bzw. Ad-DP-GO infiziert und die Kulturüberstände 72 h nach einem Mediumwechsel entnommen, um die Kontamination mit viralen Partikeln zu vermeiden. Diese Überstände wurden nun für 2 h mit DZ inkubiert, bevor diese gewaschen und anschließend mit transgenen, CFSE-markierten OT-I CD8+ T-Zellen gemischt wurden. Die Proliferation dieser antigenspezifischen Zellen zeigte an, wie gut die DZ das Antigen aufgenommen und anschließend präsentiert hatten (Abb. 5.18B). Man sah eine deutlich gesteigerte Proliferationsrate bei den Zellen (89 %), die mit den DZ inkubiert wurden, die zuvor mit dem DEC-OVA Fusionsprotein beladen wurden. Im Gegensatz dazu konnten die DZ, die mit den Isotypkontrollproteinen inkubiert wurden, nur 39 % der OT-I TZellen zur Proliferation stimulieren, was nicht unterschiedlich von dem negativen Kontrollansatz war, in dem unbeladene DZ mit den T-Zellen gemischt wurden. Nachdem in vitro ein positiver Effekt, analog zu den GM-CSF-Fusionsproteinen, hinsichtlich der zielgerichteten Antigenaufnahme zu beobachten war, galt es die Effizienz der Vektoren in Immunisierungsstudien zu untersuchen. 5.4 Immunisierungsstudien mit αDEC205 Fusionskonstrukten 5.4.1 Einfluss von zielgerichteter Antigenaufnahme und GM-CSF Koexpression Nachdem im ersten Teil der Arbeit eine Koexpression von GM-CSF zu einer verbesserten zellulären Immunantwort geführt hatte, wurde in diesem Experiment untersucht, ob dies auch in Kombination mit zielgerichteter Antigenaufnahme durch αDEC205-OVA Fusionsproteine zu beobachten ist. Um gleichzeitig den Effekt der zielgerichteten Antigenaufnahme bestimmen zu können, wurden adenovirale Vektoren zur Immunisierung verwendet, die nur das Antigenfusionsprotein (DO) bzw. die nicht bindende Isotypkontrolle (GO) übertrugen. Es wurden pro Gruppe 6 Tiere mit einer einzelnen Injektion von je 5x109 Partikeln der Vektoren Ad-DP-DO, Ad-DP-GO, Ad-GM-DP-DO bzw. Ad-GM-DP-GO immunsiert. Die 3 Tiere der 73 Ergebnisse Kontrollgruppe wurden mit Ad-GFP behandelt. 13 Tage nach der Injektion wurde den Tieren Blut entnommen und die Antikörper-Titer im Serum bestimmt (Abb. 5.20), während die zelluläre Immunantwort mit beschriebenen Methoden am Tag 14 detektiert wurde (Abb. 5.19). Abb. 5.19: Modulation der zellulären Immunantwort durch αDEC205 Fusionsproteine nach adenoviraler Immunisierung Es wurden Tiere mit je 5x109 Partikeln von Ad-GFP (n=3), Ad-DP-GO, Ad-DP-DO, Ad-GM-DP-GO bzw. AdGM-DP-DO (alle n=6) immunisiert. Zwei Wochen nach der Injektion wurden die Lymphozyten der Milz auf antigenspezifische CD8+ T-Zellen mittels Tetramer-Färbung (A) und ICS (B,C) untersucht. Zusätzlich wurden (IFN-γ + IL-2)+ CD4+ T-Zellen nach TZR-spezifischer Restimulation durch die Antikörperkombination αCD3/αCD28 gemessen (D). Es sind Mittelwerte mit SEM sowie statistische Signifikanzen aus einem ANOVATest angegeben. In diesem Experiment war die Induktion der antigenspezifischen CD8+ T-Zellantworten für die Vektoren, die zur zielgerichteten Antigenaufnahme führen sollten, reduziert im Vergleich zu den eingesetzten Isotypkontrollen (Abb. 5.19A). Denn sowohl die Gruppe DP-DO zeigte mit einem Prozentsatz von 5,4 % Tet+/CD8+ T-Zellen eine geringere Immunantwort als die entsprechende Kontrollgruppe DP-GO (7,1 %), als auch die analogen Gruppen GM-DP-DO (5,2 %) und GM-DP-GO (7,2 %), die zusätzlich GM-CSF exprimierten, wiesen diesen Trend auf. Somit konnte ebenfalls kein Einfluss der Zytokin-Koexpression auf die Quantität der 74 Ergebnisse induzierten CD8+ T-Zellantwort beobachtet werden. Diese Tendenzen wurden durch die intrazelluläre Färbung teilweise bestätigt. Betrachtete man die Anzahl der Zellen, die positiv für die Anfärbung von CD107a und IFN-γ waren, konnte man die oben geschilderten Beobachtungen wieder finden (Abb. 5.19B). Auch hier lagen die Mittelwerte für die zielgerichteten Vektoren DP-DO (4,6 %) und GM-DP-DO (4,3 %) unter denen, die mit den Kontrollvektoren DP-GO (6,0 %) und GM-DP-GO (6,1 %) erzielt wurden. Der positive Einfluss der GM-CSF Koexpression drückte sich erneut in der verstärkten Induktion der polyfunktionalen T-Zellen aus, die neben IFN-γ auch IL-2 produzierten (Abb. 5.19C). Für die zielgerichteten Vektoren DP-DO (0,14 %) und GM-DP-DO (0,43 %) detektierte man diesen Trend ebenso wie für die Vektoren DP-GO (0,36 %) und GM-DP-GO (0,8 %). Aber auch bei dieser Betrachtung ist die Induktion für die zielgerichteten Vektoren im Vergleich zu den Isotypkontrollen reduziert. Die zuvor beschriebene, verstärkte Induktion von (IFN-γ + IL-2)-produzierenden CD4+ TZellen durch die Koexpression von GM-CSF konnte ebenfalls bestätigt werden (Abb. 5.19D). Der erhöhte Anteil dieser Zellpopulation wurde dabei lediglich nach GM-CSF Expression detektiert und schien unabhängig von der zielgerichteten Antigenaufnahme durch die DO Fusionsproteine zu sein. So waren die Mittelwerte sowohl für GM-DP-DO (2,8 %) im Vergleich zu DP-DO (2,1 %) erhöht, als auch die Werte für GM-DP-GO (2,9 %) im Vergleich zu DP-GO (1,9 %). Im Falle der Isotypkontrollen war dieser Unterschied statistisch signifikant. Neben der zellulären Immunantwort wurde auch der Einfluss der zielgerichteten Antigenaufnahmen auf die humorale Immunantwort bestimmt (Abb. 5.20). Abb. 5.20: Modulation der humoralen Immunantwort durch αDEC205 Fusionsproteine nach adenoviraler Immunisierung Es wurden Tiere mit je 5x109 Partikeln von Ad-GFP (n=3), Ad-DP-GO, Ad-DP-DO, Ad-GM-DP-GO bzw. AdGM-DP-DO (alle n=6) immunisiert. Die OVA-spezifischen IgG1 bzw. IgG2a Antikörpertiter wurden 13 Tage nach der Injektion im Serum detektiert. Die angegebenen relativen Titer beziehen sich auf ein Referenz-Serum. Es sind Mittelwerte mit SEM sowie statistische Signifikanzen aus einem ANOVA-Test angegeben. 75 Ergebnisse Neben der reduzierten CD8+ T-Zellantwort führte die zielgerichtete Antigenaufnahme zu signifikanten Unterschieden in der Induktion OVA-spezifischer Antikörper. Diese zeigten sich in erhöhten IgG1-Titern für die Vektoren DP-DO und GM-DP-DO im Vergleich zu den entsprechenden Kontrollvektoren DP-GO bzw. GM-DP-GO, wobei dieser Unterschied für die GM-CSF-exprimierenden Vektoren statistische Signifikanz erzielte. In umgekehrter Weise traf diese Beobachtung für die Induktion der IgG2a-Antikörper zu. In dieser Subklasse waren die mittleren Antikörper-Titer für die Vektoren erhöht, die keine zielgerichtete Antigenaufnahme zur Folge hatten. Dies ist wiederum unabhängig davon, ob GM-CSF präsent ist oder nicht. Somit konnte auf humoraler Ebene kein signifikanter Einfluss des Zytokins detektiert werden, wohingegen die αDEC205-Fusionsproteine ein erhöhtes IgG1/IgG2a-Verhältnis induzierten. 5.4.2 Vergleich der immunstimulierenden Wirkung von sCD40L und GM-CSF In einem zweiten Experiment mit den Vektoren zur zielgerichteten Antigenaufnahme sollte untersucht werden, ob die beobachteten Effekte durch die Wahl eines anderen Kostimulus moduliert werden konnten. In diesem Zusammenhang wurde eine lösliche Variante des CD40 Liganden (sCD40L) getestet, um möglicherweise eine gesteigerte Aktivierung der Dendritischen Zellen zu erreichen. Die adenoviralen Vektoren Ad-CD40L-DP-DO und Ad-CD40L-DP-GO wurden in dieser Studie direkt mit den GM-CSF-exprimierenden Vektoren hinsichtlich ihres Einflusses auf die Induktion zellulärer als auch humoraler Immunantworten untersucht. Nach dem in 5.4.1 beschriebenen Protokoll wurden wiederum 6 Tiere pro Gruppe mit 5x109 Partikeln der entsprechenden Vektoren behandelt und die Immunantworten wie beschrieben analysiert. Den Tieren der Negativkontrolle wurde PBS injiziert. Bei der Analyse der antigenspezifischen CD8+ T-Zellantwort mittels Tetramer-Färbung (Abb. 5.21A) bestätigte sich die Beobachtung des ersten Experiments, dass die zielgerichteten Vektoren CD40L-DP-DO (5,9 %) und GM-DP-DO (5,4 %) zu reduzierten Immunantworten im Vergleich zu den Isotypkontrollen CD40L-DP-GO (8,4 %) und GM-DP-GO (7,7 %) führten. Bei der Betrachtung der (CD107a + IFN-γ)-positiven CD8+ T-Zellen ergab sich jedoch ein leicht verändertes Bild (Abb. 5.21B). In diesem Experiment zeigten die Tiere, die mit dem Vektor GM-DP-DO behandelt wurden, ebenso hohe Immunantworten (10,25 %) wie die Tiere der Kontrollgruppen GM-DP-GO (9,7 %) und CD40L-DP-GO (9,2 %). 76 Ergebnisse Dies war jedoch die einzige Diskrepanz zwischen den beiden Immunisierungsexperimenten, denn die Tiere der Gruppe CD40L-DP-DO zeigten bei der Betrachtung dieser Zellpopulation einen signifikant reduzierten Mittelwert von 5,2 % aller CD8+ T-Zellen, was im Einklang mit den vorherigen Beobachtungen stand. Dies bedeutet, dass auch die Koexpression von sCD40L keinen positiven Einfluss auf die Induktion der CD8+ T-Zellantwort hatte. Abb. 5.21: Modulation der zellulären Immunantwort durch sCD40L bzw. GM-CSF in Kombination mit αDEC205-OVA Es wurden Tiere mit je 5x109 Partikeln von Ad-CD40L-DP-GO, Ad-CD40L-DP-DO, Ad-GM-DP-GO bzw. AdGM-DP-DO (alle n=6) immunisiert. Den drei Kontrolltiere wurde PBS injiziert. Zwei Wochen nach der Injektion wurden die Lymphozyten der Milz auf antigenspezifische CD8+ T-Zellen mittels Tetramer-Färbung (A) und ICS (B,C) untersucht. Zusätzlich wurden (IFN-γ + IL-2)+ CD4+ T-Zellen nach TZR-spezifischer Restimulation durch die Antikörperkombination αCD3/αCD28 gemessen (D). Es sind Mittelwerte mit SEM sowie statistische Signifikanzen aus einem ANOVA-Test angegeben. Dies wurde auch in der Betrachtung der polyfunktionalen CD8+ und CD4+ T-Zellen bestätigt. In beiden Fällen induzierten die GM-CSF-exprimierenden Vektoren höhere Immunantworten als die Vektoren, die zusätzlich sCD40L exprimierten. Für die polyfunktionalen CD8+ TZellen lagen die Mittelwerte hier für GM-DP-GO und GM-DP-DO bei 0,8 % bzw. 0,7 %, während diese bei CD40L-DP-GO und CD40L-DP-DO lediglich 0,4 % bzw. 0,13 % erreichten (Abb. 5.21C). 77 Ergebnisse Wie bereits im ersten Versuch gezeigt wurde, war die Anzahl der (IFN-γ + IL-2)produzierenden Zellen auch diesmal durch die GM-CSF Koexpression signifikant erhöht (Abb. 5.21D). Unabhängig von der Spezifität des Einzelkettenantikörpers induzierten die Vektoren GM-DP-DO (3,2 %) und GM-DP-GO (2,8 %) signifikant stärkere CD4+ Immunantworten als CD40L-DP-DO (1,4 %) und CD40L-DP-GO (1,5 %). Diese Spezifität war hingegen für die Induktion der humoralen Immunantwort entscheidend. Auch hier konnten die Ergebnisse aus dem ersten Versuch bestätigt werden, da die zielgerichteten Vektoren wiederum zu einer Erhöhung des IgG1/IgG2a-Verhältnisse im Vergleich zu den Isotypkontrollen führten (Abb. 5.22). Abb. 4.22: Modulation der humoralen Immunantwort durch sCD40L bzw. GM-CSF in Kombination mit αDEC205-OVA Es wurden Tiere mit je 5x109 Partikeln von Ad-CD40L-DP-GO, Ad-CD40L-DP-DO, Ad-GM-DP-GO bzw. AdGM-DP-DO (alle n=6) immunisiert. Den drei Kontrolltiere wurde PBS injiziert Die OVA-spezifischen IgG1 bzw. IgG2a Antikörpertiter wurden 13 Tage nach der Injektion im Serum detektiert. Die angegebenen relativen Titer beziehen sich auf ein Referenz-Serum. Es sind Mittelwerte mit SEM sowie statistische Signifikanzen aus einem ANOVA-Test angegeben. Unabhängig von der Wahl des Kostimulus waren die IgG1-Titer nach Immunisierung mit einem der zielgerichteten Vektoren signifikant erhöht, während die IgG2a-Titer reduziert waren. Im Vergleich der Koexpression des sCD40L zu der des GM-CSF ließen sich nur geringfügige Unterschiede detektieren. Aufgrund der erhöhten Induktion der polyfunktionalen T-Zellpopulationen scheint daher die Koexpression von GM-CSF eher eine Verbesserung solcher adenoviraler Vektorsysteme zu sein als die Verwendung des sCD40L. Die Qualität dieser Immunantworten sowie die Auswirkungen der veränderten humoralen Antwort durch die zielgerichtete Antigenaufnahme muss jedoch noch in einem geeigneten Infektionsmodell untersucht werden. 78 Diskussion 6. Diskussion Nachdem Studien gezeigt hatten, das GM-CSF ein geeignetes Adjuvants für genetische Impfstoffe ist, um zelluläre und humorale Immunantworten zu induzieren, wurde dies hier vergleichend für DNA-Impfstoffe und adenovirale Vektoren untersucht. In verschiedenen Prime/Boost-Immunisierungen wurden dabei Vektoren eingesetzt, die entweder Fusionsproteine (GM-OVA) oder GM-CSF und das Modellantigen Ovalbumin bicistronisch exprimierten. Es konnte gezeigt werden, dass die biologische Aktivität des GM-CSF durch die Anhängung des Antigens nicht beeinträchtigt wurde, was in früheren Studien bereits gezeigt werden konnte [136;137]. In aufgereinigter Form behielt es ebenso die Fähigkeit, FDCP-1 Zellen zur Proliferation anzuregen, wie die Generation von Dendritischen Zellen aus KnochenmarkVorläufern zu bewirken. Nachdem APC mit dem Fusionsprotein inkubiert wurden, induzierten diese eine verstärkte Proliferation antigenspezifischer CD8+ T-Zellen. Dies zeigt, dass durch die Fusion eine Antigenpräsentation über MHC I-Moleküle erfolgen kann, die für ein lösliches rekombinantes Ovalbumin nur nach Einsatz einer 10-fach höheren Konzentration detektiert wurde. Somit stellt die Antigenaufnahme über GM-CSF-Rezeptoren möglicherweise eine alternative Strategie zur zielgerichteten Antigenbeladung von DZ in vivo dar, wie es für z.B. die C-Typ Lektin Rezeptoren beschrieben ist [107-109;114-119]. Dennoch induzierten die GM-OVA exprimierenden Vektoren, sowohl die Plasmid-DNA als auch der adenovirale Vektor, weder nach einer einzelnen Injektion noch nach kombinierten Prime/Boost-Immunisierungen eine stärkerer CTL-Antwort als die OVA-exprimierenden Vektoren. Unabhängig von der Art des Vektors erhöhte die Expression des Fusionsproteins das IgG1/IgG2a-Verhältnis im Vergleich zu dem Antigen allein, was ein Indiz für eine stärkere Induktion der TH2-Helferantwort sein mag [95]. In dem hier eingesetzten OVAspezifischen Tumormodell vermittelten jedoch alle Impfansätze eine verzögerte Progression des Tumorwachstums. Dies bestätigt Ergebnisse, die in DNA-Immunsierungen mit GM-CSFTAA Fusionsproteinen erzielt wurden [137]. Es konnte jedoch keine Korrelation zwischen den induzierten Immunantworten und dem reduzierten Tumorwachstum hergeleitet werden. Dies war aufgrund der sehr unterschiedlichen CTL-Antworten unerwartet. Es wurden auch zu Zeitpunkten der fortschreitenden Tumorprogression in den imunnisierten Mäusen noch hohe OVA-spezifische T-Zellantworten detektiert werden. Dies lässt vermuten, dass andere Mechanismen der Immunantwort für die Kontrolle des Tumorwachstums verantwortlich sind. 79 Diskussion Dennoch erschien eine einzelne DNA-Injektion weniger effektiv zu sein als die einmalige Injektion adenoviraler Vektoren bzw. Prime/Boost-Immunisierungen. In den Prime/Boost-Immunisierungen induzierten hingegen die Vektoren, die GM-OVA exprimieren, geringere CD8+ T-Zellantworten als es für OVA-exprimierende Vektoren zu beobachten war. Die antigenspezifischen T-Zellen besitzen in beiden Fällen ähnliche Funktionalitäten hinsichtlich ihrer Zytokinproduktion (IFN-γ/IL-2) und ihrer Expression von CD107a, einem Marker für Degranulation [168]. Zeitgleich mit der Reduktion der CTL werden jedoch neutralisierende α-GM-CSF Autoantikörper in den Tieren detektierbar, die die GM-OVA exprimierenden Vektoren injiziert bekamen Diese können eine mögliche Erklärung für diese Beobachtung darstellen. Diese Autoimmunität gegen GM-CSF wurde bereits nach Proteinimmunisierungen mit rekombinantem GM-CSF oder GM-CSF-Fusionsproteinen sowohl im Mausmodell als auch im humanen System beobachtet werden [137;174-176]. Da die rekombinanten Proteine zumeist in E.coli oder Hefen hergestellt wurden, sind Unterschiede in der posttranslationalen Modifizierung der Proteine (z.B. Glykosylierungen) als mögliche Ursache für das Entstehen solcher Autoimmunreaktionen postuliert worden [174;176]. Betrachtet man hingegen die Induktion dieser autoreaktiven Antikörper nach genetischen Immunisierungen mit Antigen-Fusionsproteinen, muss ein alternativer Mechanismus zugrunde liegen, da die GM-CSF Proteine von der Wirtszelle selbst produziert werden. In diesem Fall könnten kreuzreaktive T-Helferzellen für die klonale Expansion von GM-CSFspezifischen Plasmazellen verantwortlich sein. So könnten B-Zellen, deren Immunglobuline spezifisch für körpereigenes GM-CSF sind, das Fusionsprotein aufnehmen und degenerierte OVA-Peptide auf MHC-II Molekülen präsentieren. Die OVA/MHC-II Komplexe würden nun von OVA-spezifischen T-Helferzellen erkannt, wodurch die Aktivierung der B-Zelle und somit die Produktion GM-CSF-spezifischer Antikörper erfolgen kann. Dies stünde im Einklang mit einer früheren Hypothese zur Entstehung von autoreaktiven Antikörpern [177] und Beobachtungen aus Experimenten mit anderen zellulären Fusionsproteinen [178;179]. Die Konsequenzen dieser α-GM-CSF Autoantikörper für den Wirt sind nicht vollständig bekannt. So erfolgte in Mäusen die Rekonstitution weißer Blutzellen nach einer Knochenmarks-Transplantation in unveränderter Weise trotz vorhandener Autoantikörper. Ebenso entwickeln diese Tiere eine normale Immunantwort gegen einen Proteinimpfstoff [180]. Dennoch haben Studien an GM-CSF -/- Knock-out Mäusen gezeigt, dass die Induktion einer CD8+ T-Zellantwort gegen eine Peptid-basierte Vakzine inhibiert ist. In diesem Modell wurde auch eine verzögerte Produktion von IgG2a Antikörpern detektiert [138]. 80 Diskussion Obwohl diese Beobachtungen mit den OVA-spezifischen Immunantworten der GM-OVA behandelten Tieren übereinstimmten, konnte keine generelle Beeinträchtigung durch die Vakzin-induzierten Autoantikörper auf den Verlauf nachfolgender Infektionen bestimmt werden. Der Infektionsverlauf des hier eingesetzten murinen Retrovirus (FV) war ebenso unabhängig von der Präsenz der neutralisierenden α-GM-CSF Antikörper wie die induzierte virus-spezifische, zelluläre Immunantwort. In Krebspatienten konnten bislang ebenfalls keine pathologischen Veränderungen mit dieser Autoimmunität assoziiert werden [174]. Dennoch können Langzeitfolgen nicht ausgeschlossen werden, so wird beispielsweise die pulmonale Alveolarproteinose auf eine Autoimmunität gegen GM-CSF zurückgeführt[181;182]. Da die hier eingesetzten und andere Fusionsproteine zwischen körpereigenen und Fremdproteinen [178;179] zeigen, dass es möglich ist, die immunologische Toleranz zu durchbrechen, sollte deren Einsatz in genetischen Impfstoffen kritisch hinsichtlich möglicher Konsequenzen durch Autoimmunitäten betrachtet werden. Durch den Einsatz eines bicistronischen Vektors konnte diese Autoimmunität umgangen werden. Obwohl die GM-CSF-Aktivität von diesem Vektor sogar erhöht ist im Vergleich zur GM-CSF-Aktivität des Fusionsproteins (~10-fach), konnten keine αGM-CSF Autoantikörper detektiert werden. Dies unterstützt die Hypothese, dass die Fusion für den Verlust der Toleranz verantwortlich ist, und die OVA-spezifischen T-Helferzellen die αGM-CSFProduktion stimulieren. Lima et al. [137] konnten ebenfalls zeigen, dass eine Koexpression von GM-CSF und TAA nicht zu einer Autoimmunität führt, während die entsprechenden Fusionsproteine es taten. Somit scheint nicht allein die Überexpression des Zytokins für die Induktion der Autoantikörper verantwortlich zu sein. Die bicistronische Expression von GM-CSF beeinflusst im Gegensatz zu den Fusionsproteinen nicht das Verhältnis der OVA-spezifischen Antikörper. Im Vergleich zu den OVA-exprimierenden Vektoren sind sowohl die IgG1- als auch IgG2a-Titer kaum verändert. Aufgrund früherer Studien waren diese Beobachtungen unerwartet. So führt die Koexpression von GM-CSF und dem Amyloid-beta Protein von intranasal verabreichten adenoviralen Vektoren zu einer verstärkten humoralen und TH2 Antwort [183]. Des weiteren bewirkte die Koexpression von GM-CSF in zahlreichen DNA-Immunisierungen einen Anstieg der antigenspezifischen Antikörperproduktion [40;42;128-130;177]. Diese unterschiedlichen Ergebnisse zeigen, dass die immunmodulatorischen Eigenschaften von GM-CSF von der Form des Antigens, der Injektionsroute und der Art des verwendeten Vektors abhängig sein können. Daher sind auch die Ergebnisse hinsichtlich der Aktivierung von CD8+ T-Zellantworten durch GM-CSF-Koexpression sehr unterschiedlich. 81 Diskussion So zeigen einige Studien zu DNA-Immunisierungen eine erhöhte CTL-Aktivierung [41;184], während andere kaum einen Einfluss detektieren konnten [127;185]. In dieser Studie induziert die bicistronische Expression von GM-CSF nach dem Prime/Boost Protokoll eine erhöhte CTL-Antwort im Vergleich zum Antigen allein. Aufgrund der Beschaffenheit des bicistronischen Promotors liegt die OVA-Expression unterhalb derer, die von den anderen Vektoren beobachtet werden. Dennoch ist der Anteil der induzierten CTLAntwort mit ca. 25 % OT-I spezifischer CD8+ T-Zellen deutlich höher als für die OVAexprimierenden Vektoren (ca.11 %) und ist in dieser Höhe zuvor noch nicht beschrieben worden. Die GM-CSF Koexpression führt auch zu einer verstärkten Aktivierung der polyfunktionalen CD8+ T-Zellen, die neben IFN-γ und dem cytotoxischen Marker CD107a auch das proliferations-stimulierende Zytokin IL-2 produzieren. Dieser Zellpopulation wird eine wichtige Bedeutung bei der Ausbildung langlebiger Gedächtnisantworten zugeschrieben. Die Kontrolle chronischer, viraler Infektionen, wie CMV, EBV oder in HIV LTNP scheint von diesen ebenfalls abhängig zu sein [45]. Es konnte gezeigt werden, dass es diesbezüglich von Vorteil ist, die bicistronischen Vektoren sowohl in der initialen DNA-Injektion als auch in der adenoviralen Boost-Immunisierung einzusetzen. Verwendet man sie nur in einem der Immunisierungsschritte und ersetzt sie in dem anderen durch OVA-exprimierende Vektoren, ist die Induktion der polyfunktionalen CD8+ T-Zellen geringer. Diese Beobachtung geht mit einer erhöhten Aktivierung IFN-γ produzierender CD4+ T-Zellen einher. Nach Injektion der bicistronischen Vektoren und einer TCR-spezifischen in vitro-Restimulation ist der Anteil der zytokinproduzierenden CD4+ T-Zellen höher als nach Injektion der OVA-exprimierenden Vektoren. Dies lässt auf eine verstärkte TH1-Helferantwort schließen, die wiederum die Entwicklung und Qualität der CTL-Antworten beeinflussen kann, wie es bereits für andere Immunreaktionen beschrieben ist [186-188]. Somit scheint GM-CSF ein geeignetes Adjuvants für Prime/Boost-Strategien mit PlasmidDNA und adenoviralen Vektoren zu sein, was die Induktion polyfunktionaler T-Zellen begünstigt. Hingegen führt der Einsatz der Fusionsproteine nicht zu der erwarteten Immunogenitätssteigerung. Die beobachtete Suppression der CTL-Antwort ist dabei offenbar eine Konsequenz der biologischen Aktivität des Fusionsproteins, da dieses Phänomen für ein nicht aktives Fusionsprotein, basierend auf rhesusGM-CSF, nicht zu beobachten ist. Ebenso induziert die nicht-aktive Variante keine Verschiebung des IgG1/IgG2a-Verhältnisse, obwohl die beiden Fusionsproteine denselben strukturellen Aufbau besitzen und in vergleichbarer Stärke exprimiert werden. Demnach resultieren diese Phänomene entweder aus der induzierten Autoimmunität oder durch die rezeptorvermittelte Antigenaufnahme in vivo 82 Diskussion kommt es zu einer veränderten Antigenpräsentation, die wiederum eine Verschiebung der induzierten Immunantwort in Richtung TH2 zur Folge hat. Obwohl die GM-OVA Fusionsproteine in vitro eine erhöhte Aktivierung von OT-Ispezifischen CD8+ T-Zellen induzierten, führte diese Strategie zur zielgerichteten Antigenaufnahme in vivo zu gegensätzlichen Ergebnissen. Daher wurde ein alternativer Ansatz zur zielgerichteten Antigenaufnahme im adenoviralen System untersucht. In dieser Studie wurde ein Einzelkettenantikörper, der gegen den DZ-Rezeptor DEC205 gerichtet ist, an das Ovalbumin fusioniert. Analog zu den GM-OVA Fusionsproteinen führten diese in vitro im Vergleich zu einer DZ-unspezifischen Isotypkontrolle des Einzelkettenantikörpers zu einer gesteigerten Antigenpräsentation durch DZ und einer anschließenden Aktivierung transgener OT-I spezifischer T-Zellen. Dass Fusionsproteine aus DEC205-spezifischen Antikörpern und Antigenen zu einer Präsentation auf MHC I Molekülen in vitro und in vivo führen, wurde bereits für die vollständigen Immunglobuline [114-119], aber auch für Einzelkettenantikörper gezeigt [120]. Letztere zeigten auch nach Expression von PlasmidDNA eine erhöhte Induktion zellulärer und humoraler Immunantworten im Vergleich zu unfusionierten Antigenen oder Fusionsproteinen deren Antikörperanteil gegen CD11c, ein weiteres Oberflächenprotein von Dendritischen Zellen, gerichtet ist [120]. Es bleibt jedoch festzuhalten, dass in der zitierten Studie keine Aufspaltung in CD4+ oder CD8+-Antworten erfolgte und nur die Gesamtmenge an IgG-Antikörpern bestimmt wurde. Im Gegensatz dazu, induzieren in dieser Studie die adenoviralen Vektoren, die die Fusionsproteine aus der unspezifischen Isotypkontrolle und dem Antigen exprimieren, eine stärkere CTL-Antwort als es für die DEC-OVA exprimierenden Vektoren zu beobachten war. Dies zeigt deutlich die Abhängigkeit der Immunantwort von der gewählten Applikationsform der Vakzine. Als Proteinimpfstoff induziert die Isotypkontrolle sogar in Gegenwart starker DZ-Aktivatoren (αCD40-Antikörper plus Poly IC) keine detektierbare CTL-Antwort, während die zielgerichtete Form des Antigens eine starke zelluläre Immunantwort auslöst [117;118]. Der adenovirale Vektor hingegen ist selbst so immunogen [62;63], dass er zusammen mit der resultierenden endogenen Antigenexpression eine starke CD8+ TZellantwort auslösen kann [189]. Möglicherweise wird dadurch der eigentlich positive Effekt, den man von der zielgerichteten Antigenaufnahme aufgrund der Proteinstudien erwartet, abgeschwächt. Dennoch bewirkt die Fusion an den DEC205-spezifischen Einzelkettenantikörper eine veränderte Immunreaktion gegen das Antigen. 83 Diskussion Neben der reduzierten CTL-Antwort ist auch die Verteilung der antigenspezifischen Antikörper zu einem erhöhten IgG1/IgG2a-Verhältnis verschoben, was wiederum auf eine verstärkte TH2-Antwort schließen lässt. Diese Beobachtungen sind analog zu den Ergebnissen der genetischen Immunisierungen mit den GM-OVA Fusionsproteinen, die ebenfalls in vitro eine zielgerichtete Antigenaufnahme vermittelten. Daher tritt möglicherweise in beiden Fällen eine veränderte Antigenaufnahme der sezernierten Proteine in vivo auf, die zu einer veränderten T-Zellaktivierung (TH2) führen. Des Weiteren könnte die zielgerichtete Antigenaufnahmen auch zur Induktion von regulatorischen T-Zellen führen, die somit der CTL-Antwort entgegen wirken würde [98]. Es müssen auch die Wahl des Vektorsystems und die Applikationsroute berücksichtigt werden, die sich von den bisherigen Studien unterscheiden. Fehlende Kostimulatoren, wie αCD40-Antikörper oder TLR-Liganden, haben in Studien mit derartigen Proteinimpfstoffen gezeigt, dass eine periphere Toleranz gegen das Antigen induziert werden konnte [83]. Daher sollte untersucht werden, ob die simultane Expression von Immunmodulatoren, sCD40L oder GM-CSF, einen Einfluss auf die oben beschriebenen Effekte hat. Keiner dieser Kostimulatoren zeigte einen Einfluss auf die Polarisation der induzierten Immunantwort in Richtung einer TH2-Helferantwort. In beiden Fällen war eine reduzierte CTL-Antwort für die zielgerichtete Antigenvariante zu beobachten und die dominante IgG1Antikörperproduktion blieb erhalten. Die Koexpression des sCD40L zeigte keine Effekte hinsichtlich der Induktion der zellulären Immunantworten (CD4+ als auch CD8+). Dies wiederum steht im Gegensatz zu Beobachtungen früherer DNA-Immunisierungen, wo die Koexpression eines löslichen CD40L-Trimers zu einer verbesserten zellulären als auch humoralen Immunantwort führte [152]. In dieser Studie war lediglich die humorale Immunantwort geringfügig erhöht, wobei dies unabhängig von der Wahl des Antigenfusionsproteins war. Diese Unterschiede könnten wiederum auf die eingesetzten genetischen Vektoren zurückzuführen, die unterschiedlich hohe Mengen des kostimulatorischen Moleküls in vivo produzieren können. Ein weiterer Unterschied besteht in der Form des sCD40L. Während der hier eingesetzte lediglich aus einer Exportsequenz und dem Anteil der extrazellulären Domäne des CD40Liganden (AS113260), enthält das DNA-Konstrukt zusätzlich einen so genannten Leucin-Zipper, der die Stabilität des Trimers erhöhen soll [152]. Die Stabilität dieser Trimere scheint entscheidend für die Verstärkung der induzierten Immunantworten zu sein. In diesem Zusammenhang zeigen auch stabilere Formen des CD40Liganden, darunter Dimere oder Tetramere des Trimers, eine stärkere Aktivierung als es für einfache Trimere beobachtet wird [157;190]. 84 Diskussion Daher sind diese Konstrukte eine mögliche Alternative zu dem hier eingesetzten sCD40L und sollten in weiteren Studien hinsichtlich ihrer Adjuvantwirkung im adenoviralen System untersucht werden. Im Gegensatz zu dem sC40L konnte mit der Koexpression von GM-CSF eine Verstärkung der Immunantworten gezeigt werden. In dieser Studie zeigte sich allerdings kein qualitativer Unterschied in der antigenspezifischen CD8+ T-Zellantwort. Dennoch war der Anteil der polyfunktionalen CD8+ und CD4+ T-Zellen erhöht, wie es auch im ersten Teil der Arbeit zu beobachten war. Dies galt unabhängig von der Spezifität des Fusionsproteins. Insgesamt bestätigt diese Arbeit, dass Prime/Boost-Immunisierungen mit Plasmid-DNA und adenoviralen Vektoren sehr effizient zelluläre und humorale Immunantworten induzieren. Dies wurde bereits gezeigt für das Mausmodell, nicht-humane Primaten und das humane System. Eine weitere Verbesserung dieses System durch den Einsatz des genetischen Adjuvants GM-CSF ist daher eine interessante Beobachtung. Da gezeigt wurde, dass gerade die polyfunktionalen T-Zellen ein entscheidendes Maß für die Qualität der Immunantwort bei chronischen Infektionen darstellen [45], ist die Anreicherung dieser Zellpopulation nach GM-CSF Koexpression von besonderer Bedeutung. Des Weiteren stellt die verstärkte Aktivierung der CD4+ T-Zellen eine Verbesserung da, die hinsichtlich einer präventiven Vakzinierung gegen HIV vorteilhaft sein kann. In diesem Zusammenhang wird es interessant zu sehen sein, ob ebenfalls das Spektrum der Epitope, die von CD4+ und CD8+ T-Zellen nach Immunisierung erkannt werden, erweitert ist. Aufgrund der Variabilität des Virus ist dies ebenfalls von großem Interesse [71;191]. Die zielgerichtete Antigenaufnahme, sowohl durch GM-CSF Fusionsproteine als auch über fusionierte Einzelkettenantikörper, führte nicht zu der erhofften Verstärkung der CTLAntwort, lieferte dennoch eine starke detektierbare zelluläre Immunantwort. Zusätzlich lässt sich an Hand der Antikörperverteilung eine verstärkte TH2-Helferantwort vermuten. In diesem Fall gilt es zu untersuchen, ob die Effekte der zielgerichteten Antigenaufnahme bei weniger immunogenen Vektoren oder geringeren Dosen anders sind und eher den berichteten Studien entsprechen [114-120]. Insgesamt ist die unterschiedliche Qualität der hier induzierten Immunantworten in geeigneten Infektionsmodellen zu bestätigen, wobei auch die Anforderungen für verschiedene Infektionen zu berücksichtigen sind. So könnte die zielgerichtete Antigenaufnahme, wie sie hier eingesetzt wurde, für Impfstoffe gegen parasitäre Infektionen geeignet sein, deren Schutz auf einer guten TH2-Antwort oder auf IgG1-Antikörpern basiert [192;193]. 85 Diskussion In weiteren Studien sollen nun die Auswirkungen der hier vorgestellten Ansätze zur Verbesserung der Immunogenität genetischer Impfstoffe in einem SIV-Modell untersucht werden Dies soll sowohl im Maus- als auch im Primatenmodell getestet werden, um möglicherweise bessere Korrelationen für den Einsatz bei einer HIV-Vakzinierung zu erhalten. 86 Literaturverzeichnis 7. Literaturverzeichnis [1] Barre-Sinoussi F. HIV as the cause of AIDS. Lancet 1996 Jul 6;348(9019):31-5. [2] Schwartlander B, Stover J, Walker N, et al. AIDS. Resource needs for HIV/AIDS. Science 2001 Jun 29;292(5526):2434-6. [3] Valentin A, Albert J, Fenyo EM, Asjo B. Dual tropism for macrophages and lymphocytes is a common feature of primary human immunodeficiency virus type 1 and 2 isolates. J Virol 1994 Oct 1;68(10):6684-9. [4] Wyatt R, Sodroski J. The HIV-1 envelope glycoproteins: fusogens, antigens, and immunogens. Science 1998 Jun 19;280(5371):1884-8. [5] Berger EA, Murphy PM, Farber JM. Chemokine receptors as HIV-1 coreceptors: roles in viral entry, tropism, and disease. Annu Rev Immunol 1999;17:657-700. [6] Douek DC, Brenchley JM, Betts MR, et al. HIV preferentially infects HIV-specific CD4+ T cells. Nature 2002 May 2;417(6884):95-8. [7] Daar ES, Moudgil T, Meyer RD, Ho DD. Transient high levels of viremia in patients with primary human immunodeficiency virus type 1 infection. N Engl J Med 1991 Apr 4;324(14):961-4. [8] Borrow P, Lewicki H, Hahn BH, Shaw GM, Oldstone MB. Virus-specific CD8+ cytotoxic T-lymphocyte activity associated with control of viremia in primary human immunodeficiency virus type 1 infection. J Virol 1994 Sep 1;68(9):6103-10. [9] Pantaleo G, Fauci AS. IMMUNOPATHOGENESIS OF HIV INFECTION1. Annual Review of Microbiology 1996;50(1):825-54. [10] Safrit JT, Andrews CA, Zhu T, Ho DD, Koup RA. Characterization of human immunodeficiency virus type 1-specific cytotoxic T lymphocyte clones isolated during acute seroconversion: recognition of autologous virus sequences within a conserved immunodominant epitope. J Exp Med 1994 Feb 1;179(2):463-72. [11] Schmitz JE, Kuroda MJ, Santra S, et al. Effect of Humoral Immune Responses on Controlling Viremia during Primary Infection of Rhesus Monkeys with Simian Immunodeficiency Virus. J Virol 2003 Feb 1;77(3):2165-73. [12] Koup RA, Safrit JT, Cao Y, et al. Temporal association of cellular immune responses with the initial control of viremia in primary human immunodeficiency virus type 1 syndrome. J Virol 1994 Jul 1;68(7):4650-5. [13] Musey L, Hughes J, Schacker T, Shea T, Corey L, McElrath MJ. Cytotoxic-T-Cell Responses, Viral Load, and Disease Progression in Early Human Immunodeficiency Virus Type 1 Infection. N Engl J Med 1997 Oct 30;337(18):1267-74. [14] Yasutomi Y, Reimann KA, Lord CI, Miller MD, Letvin NL. Simian immunodeficiency virus-specific CD8+ lymphocyte response in acutely infected rhesus monkeys. J Virol 1993 Mar 1;67(3):1707-11. 87 Literaturverzeichnis [15] Ogg GS, Jin X, Bonhoeffer S, et al. Quantitation of HIV-1-Specific Cytotoxic T Lymphocytes and Plasma Load of Viral RNA. Science 1998 Mar 27;279(5359):2103-6. [16] Schmitz J, Kuroda MJ, Santra S, et al. Control of Viremia in Simian Immunodeficiency Virus Infection by CD8+ Lymphocytes. Science 1999 Feb 5;283(5403):857-60. [17] Jin X, Bauer DE, Tuttleton SE, et al. Dramatic rise in plasma viremia after CD8(+) T cell depletion in simian immunodeficiency virus-infected macaques. J Exp Med 1999 Mar 15;189(6):991-8. [18] Malim MH, Emerman M. HIV-1 sequence variation: drift, shift, and attenuation. Cell 2001 Feb 23;104(4):469-72. [19] Connor RI, Korber BT, Graham BS, et al. Immunological and Virological Analyses of Persons Infected by Human Immunodeficiency Virus Type 1áwhile Participating in Trials of Recombinant gp120 Subunit Vaccines. J Virol 1998 Feb 1;72(2):155276. [20] Chen YH, Xiao Y, Yu T, Dierich MP. Epitope vaccine: a new strategy against HIV1. Immunol Today 1999 Dec;20(12):588-9. [21] Letvin NL, King NW. Immunologic and pathologic manifestations of the infection of rhesus monkeys with simian immunodeficiency virus of macaques. J Acquir Immune Defic Syndr 1990;3(11):1023-40. [22] Haigwood NL, Montefiori DC, Sutton WF, et al. Passive Immunotherapy in Simian Immunodeficiency Virus-Infected Macaques Accelerates the Development of Neutralizing Antibodies. J Virol 2004 Jun 1;78(11):5983-95. [23] Mascola JR, Lewis MG, Stiegler G, et al. Protection of Macaques against Pathogenic Simian/Human Immunodeficiency Virus 89.6PD by Passive Transfer of Neutralizing Antibodies. J Virol 1999 May 1;73(5):4009-18. [24] Mascola JR, Stiegler G, VanCott TC, et al. Protection of macaques against vaginal transmission of a pathogenic HIV-1/SIV chimeric virus by passive infusion of neutralizing antibodies. Nat Med 2000 Feb;6(2):207-10. [25] Cohen J. PUBLIC HEALTH: AIDS Vaccine Trial Produces Disappointment and Confusion. Science 2003 Feb 28;299(5611):1290-1. [26] Pitisuttithum P, Berman PW, Phonrat B, et al. Phase I/II study of a candidate vaccine designed against the B and E subtypes of HIV-1. J Acquir Immune Defic Syndr 2004 Sep 1;37(1):1160-5. [27] Desrosiers RC. Prospects for an AIDS vaccine. Nat Med 2004 Mar;10(3):221-3. [28] Wolff JA, Malone RW, Williams P, et al. Direct gene transfer into mouse muscle in vivo. Science 1990 Mar 23;247(4949 Pt 1):1465-8. [29] Tang DC, DeVit M, Johnston SA. Genetic immunization is a simple method for eliciting an immune response. Nature 1992 Mar 12;356(6365):152-4. 88 Literaturverzeichnis [30] Ulmer JB, Donnelly JJ, Parker SE, et al. Heterologous protection against influenza by injection of DNA encoding a viral protein. Science 1993 Mar 19;259(5102):1745-9. [31] Gurunathan S, Klinman DM, Seder RA. DNA vaccines: immunology, application, and optimization*. Annu Rev Immunol 2000;18:927-74. [32] Garmory HS, Brown KA, Titball RW. DNA vaccines: improving expression of antigens. Genet Vaccines Ther 2003 Sep 16;1(1):2. [33] Shiver JW, Fu TM, Chen L, et al. Replication-incompetent adenoviral vaccine vector elicits effective anti-immunodeficiency-virus immunity. Nature 2002 Jan 17;415(6869):331-5. [34] MacGregor RR, Ginsberg R, Ugen KE, et al. T-cell responses induced in normal volunteers immunized with a DNA-based vaccine containing HIV-1 env and rev. AIDS 2002 Nov 8;16(16):2137-43. [35] Graham BS, Koup RA, Roederer M, et al. Phase 1 safety and immunogenicity evaluation of a multiclade HIV-1 DNA candidate vaccine. J Infect Dis 2006 Dec 15;194(12):1650-60. [36] Vuola JM, Keating S, Webster DP, et al. Differential immunogenicity of various heterologous prime-boost vaccine regimens using DNA and viral vectors in healthy volunteers. J Immunol 2005 Jan 1;174(1):449-55. [37] Edupuganti S, Weber D, Poole C. Cytotoxic T-lymphocyte responses to canarypox vector-based HIV vaccines in HIV-seronegative individuals: a meta-analysis of published studies. HIV Clin Trials 2004 Sep;5(5):259-68. [38] Robinson HL, Amara RR. T cell vaccines for microbial infections. Nat Med 2005 Apr;11(4 Suppl):S25-S32. [39] Otten GR, Schaefer M, Doe B, et al. Potent immunogenicity of an HIV-1 gag-pol fusion DNA vaccine delivered by in vivo electroporation. Vaccine 2006 May 22;24(21):4503-9. [40] Xiang Z, Ertl HC. Manipulation of the immune response to a plasmid-encoded viral antigen by coinoculation with plasmids expressing cytokines. Immunity 1995 Feb;2(2):129-35. [41] Okada E, Sasaki S, Ishii N, et al. Intranasal immunization of a DNA vaccine with IL-12- and granulocyte-macrophage colony-stimulating factor (GM-CSF)expressing plasmids in liposomes induces strong mucosal and cell-mediated immune responses against HIV-1 antigens. J Immunol 1997 Oct 1;159(7):3638-47. [42] Kim JJ, Simbiri KA, Sin JI, et al. Cytokine molecular adjuvants modulate immune responses induced by DNA vaccine constructs for HIV-1 and SIV. J Interferon Cytokine Res 1999 Jan;19(1):77-84. [43] Perfetto SP, Chattopadhyay PK, Roederer M. SEVENTEEN-COLOUR FLOW CYTOMETRY: UNRAVELLING THE IMMUNE SYSTEM. Nat Rev Immunol 2004 Aug;4(8):648-55. 89 Literaturverzeichnis [44] Younes SA, Yassine-Diab B, Dumont AR, et al. HIV-1 Viremia Prevents the Establishment of Interleukin 2-producing HIV-specific Memory CD4+ T Cells Endowed with Proliferative Capacity. J Exp Med 2003 Dec 15;198(12):1909-22. [45] Zimmerli SC, Harari A, Cellerai C, Vallelian F, Bart PA, Pantaleo G. HIV-1specific IFN-gamma/IL-2-secreting CD8 T cells support CD4-independent proliferation of HIV-1-specific CD8 T cells. Proc Natl Acad Sci U S A 2005 May 17;102(20):7239-44. [46] Wolff JA, Ludtke JJ, Acsadi G, Williams P, Jani A. Long-term persistence of plasmid DNA and foreign gone expression in mouse muscle. Hum Mol Genet 1992 Sep 1;1(6):363-9. [47] Robinson HL, Hunt LA, Webster RG. Protection against a lethal influenza virus challenge by immunization with a haemagglutinin-expressing plasmid DNA. Vaccine 1993;11(9):957-60. [48] Torres CA, Iwasaki A, Barber BH, Robinson HL. Differential dependence on target site tissue for gene gun and intramuscular DNA immunizations. J Immunol 1997 May 15;158(10):4529-32. [49] Agadjanyan MG, Kim JJ, Trivedi N, et al. CD86 (B7-2) Can Function to Drive MHC-Restricted Antigen-Specific CTL Responses In Vivo. J Immunol 1999 Mar 15;162(6):3417-27. [50] Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature 1998 Mar 19;392(6673):245-52. [51] Pardoll DM, Beckerleg AM. Exposing the immunology of naked DNA vaccines. Immunity 1995 Aug;3(2):165-9. [52] Casares S, Inaba K, Brumeanu TD, Steinman RM, Bona CA. Antigen Presentation by Dendritic Cells after Immunization with DNA Encoding a Major Histocompatibility Complex Class II-restricted Viral Epitope. J Exp Med 1997 Nov 3;186(9):1481-6. [53] Chattergoon MA, Robinson TM, Boyer JD, Weiner DB. Specific Immune Induction Following DNA-Based Immunization Through In Vivo Transfection and Activation of Macrophages/Antigen-Presenting Cells. J Immunol 1998 Jun 15;160(12):570718. [54] Akbari O, Panjwani N, Garcia S, Tascon R, Lowrie D, Stockinger B. DNA Vaccination: áTransfection and Activation of Dendritic Cells as Key Events for Immunity. J Exp Med 1999 Jan 4;189(1):169-78. [55] Falo LD, Jr., Kovacsovics-Bankowski M, Thompson K, Rock KL. Targeting antigen into the phagocytic pathway in vivo induces protective tumour immunity. Nat Med 1995 Jul;1(7):649-53. [56] Harding CV, Song R. Phagocytic processing of exogenous particulate antigens by macrophages for presentation by class I MHC molecules. J Immunol 1994 Dec 1;153(11):4925-33. 90 Literaturverzeichnis [57] Staerz UD, Karasuyama H, Garner AM. Cytotoxic T lymphocytes against a soluble protein. Nature 1987 Oct 1;329(6138):449-51. [58] Udono H, Srivastava PK. Heat shock protein 70-associated peptides elicit specific cancer immunity. J Exp Med 1993 Oct 1;178(4):1391-6. [59] Loirat D, Li Z, Mancini M, Tiollais P, Paulin D, Michel ML. Muscle-specific expression of hepatitis B surface antigen: no effect on DNA-raised immune responses. Virology 1999 Jul 20;260(1):74-83. [60] He TC, Zhou S, da Costa LT, Yu J, Kinzler KW, Vogelstein B. A simplified system for generating recombinant adenoviruses. Proc Natl Acad Sci U S A 1998 Mar 3;95(5):2509-14. [61] Wilson JM. Adenoviruses as Gene-Delivery Vehicles. N Engl J Med 1996 May 2;334(18):1185-7. [62] Muruve DA. The Innate Immune Response to Adenovirus Vectors. Human Gene Therapy 2004;15(12):1157-66. [63] Molinier-Frenkel V, Lengagne R, Gaden F, et al. Adenovirus Hexon Protein Is a Potent Adjuvant for Activation of a Cellular Immune Response. J Virol 2002 Jan 1;76(1):127-35. [64] Ruzek MC, Kavanagh BF, Scaria A, Richards SM, Garman RD. Adenoviral Vectors Stimulate Murine Natural Killer Cell Responses and Demonstrate Antitumor Activities in the Absence of Transgene Expression. Mol Ther 2002 Feb;5(2):115-24. [65] Kostense S, Koudstaal W, Sprangers M, et al. Adenovirus types 5 and 35 seroprevalence in AIDS risk groups supports type 35 as a vaccine vector. AIDS 2004 May 21;18(8):1213-6. [66] Sumida SM, Truitt DM, Lemckert AAC, et al. Neutralizing Antibodies to Adenovirus Serotype 5 Vaccine Vectors Are Directed Primarily against the Adenovirus Hexon Protein. J Immunol 2005 Jun 1;174(11):7179-85. [67] Barouch DH, Pau MG, Custers JH, et al. Immunogenicity of recombinant adenovirus serotype 35 vaccine in the presence of pre-existing anti-Ad5 immunity. J Immunol 2004 May 15;172(10):6290-7. [68] Roberts DM, Nanda A, Havenga MJE, et al. Hexon-chimaeric adenovirus serotype 5 vectors circumvent pre-existing anti-vector immunity. Nature 2006 May 11;441(7090):239-43. [69] Casimiro DR, Chen L, Fu TM, et al. Comparative Immunogenicity in Rhesus Monkeys of DNA Plasmid, Recombinant Vaccinia Virus, and Replication-Defective Adenovirus Vectors Expressing a Human Immunodeficiency Virus Type 1 gag Gene. J Virol 2003 Jun 1;77(11):6305-13. [70] Yang ZY, Wyatt LS, Kong WP, Moodie Z, Moss B, Nabel GJ. Overcoming immunity to a viral vaccine by DNA priming before vector boosting. J Virol 2003 Jan;77(1):799-803. 91 Literaturverzeichnis [71] Wu L, Kong Wp, Nabel GJ. Enhanced Breadth of CD4 T-Cell Immunity by DNA Prime and Adenovirus Boost Immunization to Human Immunodeficiency Virus Env and Gag Immunogens. J Virol 2005 Jul 1;79(13):8024-31. [72] Sullivan NJ, Sanchez A, Rollin PE, Yang Zy, Nabel GJ. Development of a preventive vaccine for Ebola virus infection in primates. Nature 2000 Nov 30;408(6812):605-9. [73] Inaba K, Inaba M, Naito M, Steinman RM. Dendritic cell progenitors phagocytose particulates, including bacillus Calmette-Guerin organisms, and sensitize mice to mycobacterial antigens in vivo. J Exp Med 1993 Aug 1;178(2):479-88. [74] Moll H, Fuchs H, Blank C, Rollinghoff M. Langerhans cells transport Leishmania major from the infected skin to the draining lymph node for presentation to antigenspecific T cells. Eur J Immunol 1993 Jul;23(7):1595-601. [75] Reis e Sousa, Stahl PD, Austyn JM. Phagocytosis of antigens by Langerhans cells in vitro. J Exp Med 1993 Aug 1;178(2):509-19. [76] Svensson M, Stockinger B, Wick MJ. Bone marrow-derived dendritic cells can process bacteria for MHC-I and MHC-II presentation to T cells. J Immunol 1997 May 1;158(9):4229-36. [77] Sallusto F, Cella M, Danieli C, Lanzavecchia A. Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: downregulation by cytokines and bacterial products. J Exp Med 1995 Aug 1;182(2):389-400. [78] Jiang W, Swiggard WJ, Heufler C, et al. The receptor DEC-205 expressed by dendritic cells and thymic epithelial cells is involved in antigen processing. Nature 1995 May 11;375(6527):151-5. [79] Sallusto F, Lanzavecchia A. Efficient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor alpha. J Exp Med 1994 Apr 1;179(4):1109-18. [80] De Smedt T, Pajak B, Muraille E, et al. Regulation of dendritic cell numbers and maturation by lipopolysaccharide in vivo. J Exp Med 1996 Oct 1;184(4):1413-24. [81] Sparwasser T, Vabulas RM, Villmow B, Lipford GB, Wagner H. Bacterial CpGDNA activates dendritic cells in vivo: T helper cell-independent cytotoxic T cell responses to soluble proteins. Eur J Immunol 2000 Dec;30(12):3591-7. [82] Hawiger D, Inaba K, Dorsett Y, et al. Dendritic Cells Induce Peripheral T Cell Unresponsiveness Under Steady State Conditions In Vivo. J Exp Med 2001 Sep 17;194(6):769-80. [83] Bonifaz L, Bonnyay D, Mahnke K, Rivera M, Nussenzweig MC, Steinman RM. Efficient Targeting of Protein Antigen to the Dendritic Cell Receptor DEC-205 in the Steady State Leads to Antigen Presentation on Major Histocompatibility Complex Class I Products and Peripheral CD8+ T Cell Tolerance. J Exp Med 2002 Dec 16;196(12):1627-38. 92 Literaturverzeichnis [84] Liu K, Iyoda T, Saternus M, Kimura Y, Inaba K, Steinman RM. Immune Tolerance After Delivery of Dying Cells to Dendritic Cells In Situ. J Exp Med 2002 Oct 21;196(8):1091-7. [85] Romani N, Reider D, Heuer M, et al. Generation of mature dendritic cells from human blood. An improved method with special regard to clinical applicability. J Immunol Methods 1996 Sep 27;196(2):137-51. [86] Bender A, Sapp M, Schuler G, Steinman RM, Bhardwaj N. Improved methods for the generation of dendritic cells from nonproliferating progenitors in human blood. J Immunol Methods 1996 Sep 27;196(2):121-35. [87] Inaba K, Turley S, Iyoda T, et al. The Formation of Immunogenic Major Histocompatibility Complex Class II-Peptide Ligands in Lysosomal Compartments of Dendritic Cells Is Regulated by Inflammatory Stimuli. J Exp Med 2000 Mar 13;191(6):927-36. [88] Inaba K, Witmer-Pack M, Inaba M, et al. The tissue distribution of the B7-2 costimulator in mice: abundant expression on dendritic cells in situ and during maturation in vitro. J Exp Med 1994 Nov 1;180(5):1849-60. [89] Sousa CR, Hieny S, Scharton-Kersten T, et al. In Vivo Microbial Stimulation Induces Rapid CD40 Ligand-independent Production of Interleukin 12áby Dendritic Cells and their Redistribution to T Cell Areas. J Exp Med 1997 Dec 1;186(11):181929. [90] Granucci F, Vizzardelli C, Pavelka N, et al. Inducible IL-2 production by dendritic cells revealed by global gene expression analysis. Nat Immunol 2001 Sep;2(9):8828. [91] Kitajima T, Ariizumi K, Bergstresser PR, Takashima A. A novel mechanism of glucocorticoid-induced immune suppression: the inhibiton of T cell-mediated terminal maturation of a murine dendritic cell line. J Clin Invest 1996 Jul 1;98(1):142-7. [92] Barratt-Boyes SM, Zimmer MI, Harshyne LA, et al. Maturation and Trafficking of Monocyte-Derived Dendritic Cells in Monkeys: Implications for Dendritic CellBased Vaccines. J Immunol 2000 Mar 1;164(5):2487-95. [93] Kapsenberg ML. DENDRITIC-CELL CONTROL OF PATHOGEN-DRIVEN TCELL POLARIZATION. Nat Rev Immunol 2003 Dec;3(12):984-93. [94] O'Garra A. Cytokines induce the development of functionally heterogeneous T helper cell subsets. Immunity 1998 Mar;8(3):275-83. [95] Janeway CA TPWMS. Immunologie. 5.Auflage ed. Spektrum Verlag, 2002. [96] Brocker T, Riedinger M, Karjalainen K. Targeted Expression of Major Histocompatibility Complex (MHC) Class II Molecules Demonstrates that Dendritic Cells Can Induce Negative but Not Positive Selection of Thymocytes In Vivo. J Exp Med 1997 Feb 3;185(3):541-50. 93 Literaturverzeichnis [97] Laufer TM, DeKoning J, Markowitz JS, Lo D, Glimcher LH. Unopposed positive selection and autoreactivity in mice expressing class II MHC only on thymic cortex. Nature 1996 Sep 5;383(6595):81-5. [98] Dhodapkar MV, Steinman RM, Krasovsky J, Munz C, Bhardwaj N. Antigenspecific Inhibition of Effector T Cell Function in Humans after Injection of Immature Dendritic Cells. J Exp Med 2001 Jan 16;193(2):233-8. [99] Dhodapkar MV, Steinman RM, Sapp M, et al. Rapid generation of broad T-cell immunity in humans after a single injection of mature dendritic cells. J Clin Invest 1999 Jul 15;104(2):173-80. [100] Dhodapkar MV, Krasovsky J, Steinman RM, Bhardwaj N. Mature dendritic cells boost functionally superior CD8+ T-cell in humans without foreign helper epitopes. J Clin Invest 2000 Mar 15;105(6):R9-14. [101] Wierecky J, Muller MR, Wirths S, et al. Immunologic and Clinical Responses after Vaccinations with Peptide-Pulsed Dendritic Cells in Metastatic Renal Cancer Patients. Cancer Res 2006 Jun 1;66(11):5910-8. [102] Xiang M, Eisenbach C, Lupu CM, Ernst E, Stremmel W, Encke J. Induction of antigen-specific immune responses in vivo after vaccination with dendritic cells transduced with adenoviral vectors encoding hepatitis C virus NS3. Viral Immunol 2006;19(2):210-9. [103] Zhang HM, Zhang LW, Ren J, Fan L, Si XM, Liu WC. Induction of alphafetoprotein-specific CD4- and CD8-mediated T-cell response using RNA-transfected dendritic cells. Cell Immunol 2006 Feb;239(2):144-50. [104] Lesterhuis WJ, de Vries IJM, Schuurhuis DH, et al. Vaccination of colorectal cancer patients with CEA-loaded dendritic cells: antigen-specific T cell responses in DTH skin tests. Ann Oncol 2006 Jun 1;17(6):974-80. [105] Apostolopoulos V, McKenzie IF. Role of the mannose receptor in the immune response. Curr Mol Med 2001 Sep;1(4):469-74. [106] Ezekowitz RA, Sastry K, Bailly P, Warner A. Molecular characterization of the human macrophage mannose receptor: demonstration of multiple carbohydrate recognition-like domains and phagocytosis of yeasts in Cos-1 cells. J Exp Med 1990 Dec 1;172(6):1785-94. [107] Engering AJ, Cella M, Fluitsma DM, Hoefsmit EC, Lanzavecchia A, Pieters J. Mannose receptor mediated antigen uptake and presentation in human dendritic cells. Adv Exp Med Biol 1997;417:183-7. [108] Tan MC, Mommaas AM, Drijfhout JW, et al. Mannose receptor-mediated uptake of antigens strongly enhances HLA class II-restricted antigen presentation by cultured dendritic cells. Eur J Immunol 1997 Sep;27(9):2426-35. [109] Toda S, Ishii N, Okada E, et al. HIV-1-specific cell-mediated immune responses induced by DNA vaccination were enhanced by mannan-coated liposomes and inhibited by anti-interferon-gamma antibody. Immunology 1997 Sep;92(1):111-7. 94 Literaturverzeichnis [110] Geijtenbeek TB, Kwon DS, Torensma R, et al. DC-SIGN, a dendritic cell-specific HIV-1-binding protein that enhances trans-infection of T cells. Cell 2000 Mar 3;100(5):587-97. [111] Geijtenbeek TB, Torensma R, van Vliet SJ, et al. Identification of DC-SIGN, a novel dendritic cell-specific ICAM-3 receptor that supports primary immune responses. Cell 2000 Mar 3;100(5):575-85. [112] Engering A, Geijtenbeek TBH, van Vliet SJ, et al. The Dendritic Cell-Specific Adhesion Receptor DC-SIGN Internalizes Antigen for Presentation to T Cells. J Immunol 2002 Mar 1;168(5):2118-26. [113] Tacken PJ, de Vries IJ, Gijzen K, et al. Effective induction of naive and recall T-cell responses by targeting antigen to human dendritic cells via a humanized anti-DCSIGN antibody. Blood 2005 Aug 15;106(4):1278-85. [114] Mahnke K, Guo M, Lee S, et al. The Dendritic Cell Receptor for Endocytosis, DEC205, Can Recycle and Enhance Antigen Presentation via Major Histocompatibility Complex Class II-positive Lysosomal Compartments. J Cell Biol 2000 Oct 30;151(3):673-84. [115] Boscardin SB, Hafalla JCR, Masilamani RF, et al. Antigen targeting to dendritic cells elicits long-lived T cell help for antibody responses. J Exp Med 2006 Mar 20;203(3):599-606. [116] Charalambous A, Oks M, Nchinda G, Yamazaki S, Steinman RM. Dendritic Cell Targeting of Survivin Protein in a Xenogeneic Form Elicits Strong CD4+ T Cell Immunity to Mouse Survivin. J Immunol 2006 Dec 15;177(12):8410-21. [117] Trumpfheller C, Finke JS, Lopez CB, et al. Intensified and protective CD4+ T cell immunity in mice with anti-dendritic cell HIV gag fusion antibody vaccine. J Exp Med 2006 Mar 20;203(3):607-17. [118] Bonifaz LC, Bonnyay DP, Charalambous A, et al. In vivo targeting of antigens to maturing dendritic cells via the DEC-205 receptor improves T cell vaccination. J Exp Med 2004 Mar 15;199(6):815-24. [119] Bozzacco L, Trumpfheller C, Siegal FP, et al. DEC-205 receptor on dendritic cells mediates presentation of HIV gag protein to CD8+ T cells in a spectrum of human MHC I haplotypes. PNAS 2007 Jan 23;104(4):1289-94. [120] Demangel C, Zhou J, Choo AB, Shoebridge G, Halliday GM, Britton WJ. Single chain antibody fragments for the selective targeting of antigens to dendritic cells. Mol Immunol 2005 May;42(8):979-85. [121] Wille-Reece U, Wu Cy, Flynn BJ, Kedl RM, Seder RA. Immunization with HIV-1 Gag Protein Conjugated to a TLR7/8 Agonist Results in the Generation of HIV-1 Gag-Specific Th1 and CD8+ T Cell Responses. J Immunol 2005 Jun 15;174(12):7676-83. [122] Huleatt JW, Jacobs AR, Tang J, et al. Vaccination with recombinant fusion proteins incorporating Toll-like receptor ligands induces rapid cellular and humoral immunity. Vaccine 2007 Jan 8;25(4):763-75. 95 Literaturverzeichnis [123] de Jong JM, Schuurhuis DH, Ioan-Facsinay A, et al. Murine Fc receptors for IgG are redundant in facilitating presentation of immune complex derived antigen to CD8+ T cells in vivo. Mol Immunol 2006 May;43(13):2045-50. [124] Schjetne KW, Gundersen HT, Iversen JG, Thompson KM, Bogen B. Antibodymediated delivery of antigen to chemokine receptors on antigen-presenting cells results in enhanced CD4+ T cell responses. Eur J Immunol 2003 Nov;33(11):31018. [125] Walter MR, Cook WJ, Ealick SE, Nagabhushan TL, Trotta PP, Bugg CE. Threedimensional structure of recombinant human granulocyte-macrophage colonystimulating factor. J Mol Biol 1992 Apr 20;224(4):1075-85. [126] Inaba K, Inaba M, Romani N, et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J Exp Med 1992 Dec 1;176(6):1693-702. [127] Barouch DH, Santra S, Tenner-Racz K, et al. Potent CD4+ T cell responses elicited by a bicistronic HIV-1 DNA vaccine expressing gp120 and GM-CSF. J Immunol 2002 Jan 15;168(2):562-8. [128] Geissler M, Gesien A, Tokushige K, Wands JR. Enhancement of cellular and humoral immune responses to hepatitis C virus core protein using DNA-based vaccines augmented with cytokine-expressing plasmids. J Immunol 1997 Feb 1;158(3):1231-7. [129] Lee SW, Cho JH, Sung YC. Optimal induction of hepatitis C virus envelope-specific immunity by bicistronic plasmid DNA inoculation with the granulocyte-macrophage colony-stimulating factor gene. J Virol 1998 Oct;72(10):8430-6. [130] Sin JI, Kim JJ, Ugen KE, Ciccarelli RB, Higgins TJ, Weiner DB. Enhancement of protective humoral (Th2) and cell-mediated (Th1) immune responses against herpes simplex virus-2 through co-delivery of granulocyte-macrophage colony-stimulating factor expression cassettes. Eur J Immunol 1998 Nov;28(11):3530-40. [131] Bowne WB, Wolchok JD, Hawkins WG, et al. Injection of DNA encoding granulocyte-macrophage colony-stimulating factor recruits dendritic cells for immune adjuvant effects. Cytokines Cell Mol Ther 1999 Dec;5(4):217-25. [132] Haddad D, Ramprakash J, Sedegah M, et al. Plasmid vaccine expressing granulocyte-macrophage colony-stimulating factor attracts infiltrates including immature dendritic cells into injected muscles. J Immunol 2000 Oct 1;165(7):377281. [133] Miller G, Pillarisetty VG, Shah AB, Lahrs S, Xing Z, DeMatteo RP. Endogenous granulocyte-macrophage colony-stimulating factor overexpression in vivo results in the long-term recruitment of a distinct dendritic cell population with enhanced immunostimulatory function. J Immunol 2002 Sep 15;169(6):2875-85. [134] Kusakabe K, Xin KQ, Katoh H, et al. The timing of GM-CSF expression plasmid administration influences the Th1/Th2 response induced by an HIV-1-specific DNA vaccine. J Immunol 2000 Mar 15;164(6):3102-11. 96 Literaturverzeichnis [135] Tao MH, Levy R. Idiotype/granulocyte-macrophage colony-stimulating factor fusion protein as a vaccine for B-cell lymphoma. Nature 1993 Apr 22;362(6422):755-8. [136] Maecker HT, Umetsu DT, DeKruyff RH, Levy S. DNA vaccination with cytokine fusion constructs biases the immune response to ovalbumin. Vaccine 1997 Oct;15(15):1687-96. [137] Lima J, Jenkins C, Guerrero A, Triozzi PL, Shaw DR, Strong TV. A DNA vaccine encoding genetic fusions of carcinoembryonic antigen (CEA) and granulocyte/macrophage colony-stimulating factor (GM-CSF). Vaccine 2005 Jan 26;23(10):1273-83. [138] Wada H, Noguchi Y, Marino MW, Dunn AR, Old LJ. T cell functions in granulocyte/macrophage colony-stimulating factor deficient mice. Proc Natl Acad Sci U S A 1997 Nov 11;94(23):12557-61. [139] van KC, Banchereau J. Functions of CD40 on B cells, dendritic cells and other cells. Curr Opin Immunol 1997 Jun;9(3):330-7. [140] Klaus GG, Choi MS, Lam EW, Johnson-Leger C, Cliff J. CD40: a pivotal receptor in the determination of life/death decisions in B lymphocytes. Int Rev Immunol 1997;15(1-2):5-31. [141] Garside P, Ingulli E, Merica RR, Johnson JG, Noelle RJ, Jenkins MK. Visualization of Specific B and T Lymphocyte Interactions in the Lymph Node. Science 1998 Jul 3;281(5373):96-9. [142] Frleta D, Lin JT, Quezada SA, et al. Distinctive maturation of in vitro versus in vivo anti-CD40 mAb-matured dendritic cells in mice. J Immunother 2003 Jan;26(1):7284. [143] Ridge JP, Di Rosa F, Matzinger P. A conditioned dendritic cell can be a temporal bridge between a CD4+ T-helper and a T-killer cell. Nature 1998 Jun 4;393(6684):474-8. [144] Bennett SRM, Carbone FR, Karamalis F, Flavell RA, Miller JFAP, Heath WR. Help for cytotoxic-T-cell responses is mediated by CD40 signalling. Nature 1998 Jun 4;393(6684):478-80. [145] Schoenberger SP, Toes REM, van der Voort EIH, Offringa R, Melief CJM. T-cell help for cytotoxic T lymphocytes is mediated by CD40-CD40L interactions. Nature 1998 Jun 4;393(6684):480-3. [146] Koch F, Stanzl U, Jennewein P, et al. High level IL-12 production by murine dendritic cells: upregulation via MHC class II and CD40 molecules and downregulation by IL-4 and IL-10 [published erratum appears in J Exp Med 1996 Oct 1;184(4):following 1590]. J Exp Med 1996 Aug 1;184(2):741-6. [147] Cella M, Scheidegger D, Palmer-Lehmann K, Lane P, Lanzavecchia A, Alber G. Ligation of CD40 on dendritic cells triggers production of high levels of interleukin12 and enhances T cell stimulatory capacity: T-T help via APC activation. J Exp Med 1996 Aug 1;184(2):747-52. 97 Literaturverzeichnis [148] Chaussabel D, Jacobs F, de Jonge J, et al. CD40 Ligation Prevents Trypanosoma cruzi Infection through Interleukin-12 Upregulation. Infect Immun 1999 Apr 1;67(4):1929-34. [149] Edelmann KH, Wilson CB. Role of CD28/CD80-86 and CD40/CD154 Costimulatory Interactions in Host Defense to Primary Herpes Simplex Virus Infection. J Virol 2001 Jan 15;75(2):612-21. [150] Diehl L, den Boer AT, Schoenberger SP, et al. CD40 activation in vivo overcomes peptide-induced peripheral cytotoxic T-lymphocyte tolerance and augments antitumor vaccine efficacy. Nat Med 1999 Jul;5(7):774-9. [151] Sotomayor EM, Borrello I, Tubb E, et al. Conversion of tumor-specific CD4+ T-cell tolerance to T-cell priming through in vivo ligation of CD40. Nat Med 1999 Jul;5(7):780-7. [152] Gurunathan S, Irvine KR, Wu Cy, et al. CD40 Ligand/Trimer DNA Enhances Both Humoral and Cellular Immune Responses and Induces Protective Immunity to Infectious and Tumor Challenge. J Immunol 1998 Nov 1;161(9):4563-71. [153] Tripp RA, Jones L, Anderson LJ, Brown MP. CD40 Ligand (CD154) Enhances the Th1 and Antibody Responses to Respiratory Syncytial Virus in the BALB/c Mouse. J Immunol 2000 Jun 1;164(11):5913-21. [154] Wykes M, Poudrier J, Lindstedt R, Gray D. Regulation of cytoplasmic, surface and soluble forms of CD40 ligand in mouse B cells. Eur J Immunol 1998 Feb;28(2):54859. [155] Mazzei GJ, Edgerton MD, Losberger C, et al. Recombinant soluble trimeric CD40 ligand is biologically active. J Biol Chem 1995 Mar 31;270(13):7025-8. [156] Huang HI, Wu PY, Teo CY, et al. Improved immunogenicity of a self tumor antigen by covalent linkage to CD40 ligand. Int J Cancer 2004 Feb 20;108(5):696-703. [157] Stone GW, Barzee S, Snarsky V, et al. Multimeric soluble CD40 ligand and GITR ligand as adjuvants for human immunodeficiency virus DNA vaccines. J Virol 2006 Feb;80(4):1762-72. [158] Graham FL, Smiley J, Russell WC, Nairn R. Characteristics of a human cell line transformed by DNA from human adenovirus type 5. J Gen Virol 1977 Jul;36(1):5974. [159] DuBridge RB, Tang P, Hsia HC, Leong PM, Miller JH, Calos MP. Analysis of mutation in human cells by using an Epstein-Barr virus shuttle system. Mol Cell Biol 1987 Jan;7(1):379-87. [160] Kitamura T, Tojo A, Kuwaki T, et al. Identification and analysis of human erythropoietin receptors on a factor-dependent cell line, TF-1. Blood 1989 Feb;73(2):375-80. [161] Dexter TM, Garland J, Scott D, Scolnick E, Metcalf D. Growth of factor-dependent hemopoietic precursor cell lines. J Exp Med 1980 Oct 1;152(4):1036-47. 98 Literaturverzeichnis [162] Warner NL, Moore MA, Metcalf D. A transplantable myelomonocytic leukemia in BALB-c mice: cytology, karyotype, and muramidase content. J Natl Cancer Inst 1969 Oct;43(4):963-82. [163] Maniatis T SJFE. Molecular cloning-A laboratory manual. Cold Spring Harbor Laboratory Press, 1989. [164] Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods 1983 Dec 16;65(12):55-63. [165] Hansen MB, Nielsen SE, Berg K. Re-examination and further development of a precise and rapid dye method for measuring cell growth/cell kill. J Immunol Methods 1989 May 12;119(2):203-10. [166] Lyons AB, Parish CR. Determination of lymphocyte division by flow cytometry. J Immunol Methods 1994 May 2;171(1):131-7. [167] Altman JD, Moss PA, Goulder PJ, et al. Phenotypic analysis of antigen-specific T lymphocytes. Science 1996 Oct 4;274(5284):94-6. [168] Betts MR, Brenchley JM, Price DA, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods 2003 Oct 1;281(1-2):65-78. [169] Tomayko MM, Reynolds CP. Determination of subcutaneous tumor size in athymic (nude) mice. Cancer Chemother Pharmacol 1989;24(3):148-54. [170] Hasenkrug KJ, Brooks DM, Robertson MN, Srinivas RV, Chesebro B. Immunoprotective determinants in friend murine leukemia virus envelope protein. Virology 1998 Aug 15;248(1):66-73. [171] Zelinskyy G, Robertson SJ, Schimmer S, Messer RJ, Hasenkrug KJ, Dittmer U. CD8+ T-cell dysfunction due to cytolytic granule deficiency in persistent Friend retrovirus infection. J Virol 2005 Aug;79(16):10619-26. [172] Dittmer U, Peterson KE, Messer R, Stromnes IM, Race B, Hasenkrug KJ. Role of interleukin-4 (IL-4), IL-12, and gamma interferon in primary and vaccine-primed immune responses to Friend retrovirus infection. J Virol 2001 Jan;75(2):654-60. [173] Wherry EJ, Teichgraber V, Becker TC, et al. Lineage relationship and protective immunity of memory CD8 T cell subsets. Nat Immunol 2003 Mar;4(3):225-34. [174] Ragnhammar P, Friesen HJ, Frodin JE, et al. Induction of anti-recombinant human granulocyte-macrophage colony- stimulating factor (Escherichia coli-derived) antibodies and clinical effects in nonimmunocompromised patients. Blood 1994 Dec 15;84(12):4078-87. [175] Eisenblatter M, Stahl-Hennig C, Kuate S, et al. Induction of neutralising antibodies restricts the use of human granulocyte/macrophage colony stimulating factor for vaccine studies in rhesus macaques. Vaccine 2004 Sep 3;22(25-26):3295-302. 99 Literaturverzeichnis [176] Gribben JG, Devereux S, Thomas NS, et al. Development of antibodies to unprotected glycosylation sites on recombinant human GM-CSF. Lancet 1990 Feb 24;335(8687):434-7. [177] Adelstein S, Pritchard-Briscoe H, Anderson TA, et al. Induction of self-tolerance in T cells but not B cells of transgenic mice expressing little self antigen. Science 1991 Mar 8;251(4998):1223-5. [178] Stevenson FK, Rice J, Ottensmeier CH, Thirdborough SM, Zhu D. DNA fusion gene vaccines against cancer: from the laboratory to the clinic. Immunol Rev 2004 Jun;199:156-80. [179] Hertz M, Mahalingam S, Dalum I, et al. Active vaccination against IL-5 bypasses immunological tolerance and ameliorates experimental asthma. J Immunol 2001 Oct 1;167(7):3792-9. [180] Chen TT, Levy R. Induction of autoantibody responses to GM-CSF by hyperimmunization with an Id-GM-CSF fusion protein. J Immunol 1995 Apr 1;154(7):3105-17. [181] Thomassen MJ, Yi T, Raychaudhuri B, Malur A, Kavuru MS. Pulmonary alveolar proteinosis is a disease of decreased availability of GM-CSF rather than an intrinsic cellular defect. Clin Immunol 2000 May;95(2):85-92. [182] Kitamura T, Tanaka N, Watanabe J, et al. Idiopathic pulmonary alveolar proteinosis as an autoimmune disease with neutralizing antibody against granulocyte/macrophage colony-stimulating factor. J Exp Med 1999 Sep 20;190(6):875-80. [183] Kim HD, Cao Y, Kong FK, et al. Induction of a Th2 immune response by coadministration of recombinant adenovirus vectors encoding amyloid beta-protein and GM-CSF. Vaccine 2005 Apr 27;23(23):2977-86. [184] Iwasaki A, Stiernholm BJ, Chan AK, Berinstein NL, Barber BH. Enhanced CTL responses mediated by plasmid DNA immunogens encoding costimulatory molecules and cytokines. J Immunol 1997 May 15;158(10):4591-601. [185] McKay PF, Barouch DH, Santra S, et al. Recruitment of different subsets of antigenpresenting cells selectively modulates DNA vaccine-elicited CD4+ and CD8+ T lymphocyte responses. Eur J Immunol 2004 Apr;34(4):1011-20. [186] Bennett SRM, Carbone FR, Karamalis F, Miller JFAP, Heath WR. Induction of a CD8+ Cytotoxic T Lymphocyte Response by Cross-priming Requires Cognate CD4+ T Cell Help. J Exp Med 1997 Jul 7;186(1):65-70. [187] Janssen EM, Lemmens EE, Wolfe T, Christen U, von Herrath MG, Schoenberger SP. CD4+ T cells are required for secondary expansion and memory in CD8+ T lymphocytes. Nature 2003 Feb 20;421(6925):852-6. [188] Xiang J, Huang H, Liu Y. A New Dynamic Model of CD8+ T Effector Cell Responses via CD4+ T Helper-Antigen-Presenting Cells. J Immunol 2005 Jun 15;174(12):7497-505. 100 Literaturverzeichnis [189] Yang TC, Dayball K, Wan YH, Bramson J. Detailed Analysis of the CD8+ T-Cell Response following Adenovirus Vaccination. J Virol 2003 Dec 15;77(24):13407-11. [190] Stone GW, Barzee S, Snarsky V, et al. Macaque multimeric soluble CD40 ligand and GITR ligand constructs are immunostimulatory molecules in vitro. Clin Vaccine Immunol 2006 Nov;13(11):1223-30. [191] McMichael AJ. HIV vaccines. Annu Rev Immunol 2006;24:227-55. [192] Dimier-Poisson I, Aline F, Mevelec MN, Beauvillain C, Buzoni-Gatel D, Bout D. Protective Mucosal Th2 Immune Response against Toxoplasma gondii by Murine Mesenteric Lymph Node Dendritic Cells. Infect Immun 2003 Sep 1;71(9):5254-65. [193] Michels C, Goyal P, Nieuwenhuizen N, Brombacher F. Infection with Syphacia obvelata (pinworm) induces protective Th2 immune responses and influences ovalbumin-induced allergic reactions. Infect Immun 2006 Oct;74(10):5926-32. 101 Danksagung 8. Danksagung Herrn Prof. Dr. K. Überla danke ich sehr herzlich für die Überlassung des Themas, sein stetes Interesse am Fortgang der Forschungsarbeiten und seine Unterstützung bei der Umsetzung eigener Ideen zum Fortgang des Projekts. Ich danke weiterhin Herrn Professor Dr. B. Hovemann für die Übernahme des Zweitgutachtens dieser Arbeit. Herrn Dr. S. Kuate danke ich für die freundliche Betreuung, die vielen wissenschaftlichen Ratschläge und die damit einhergehende unermüdliche Hilfsbereitschaft. Der Deutschen Forschungsgesellschaft danke ich für die finanzielle Unterstützung meines Projektes und für die Möglichkeit, als Teil des Graduiertenkollegs 1045/1 Einblicke in vielfältige Bereiche aktueller Forschung erhalten zu haben. Für die Unterstützung bei zahlreichen Tierversuchen danke ich besonders Dr. S. Kuate, Dr. T. Grunwald, Dr. D. Hoffmann, C. Großmann, K. Engelhardt und A. Fernandes. Mein besonderer Dank gilt R. Bütermann für die vielen, vielen Plasmidpräparationen, die sie mir freundlicherweise abgenommen hat. Ebenso gilt mein Dank B. Tippler für die Durchführung von vielen ELISA. Ich möchte der gesamten Abteilung für das mehr als freundliche Arbeitsklima danken, dass das Arbeiten an diesem Lehrstuhl so angenehm gemacht hat. Besonders erwähnt seien an dieser Stelle Dr. T. Grunwald, Dr. D Hoffmann, W. Bayer, Dr. S. Brandt, B. Grewe, M. Blißenbach, C. Großmann, Dr. A.Stang, N.Ghulam, Dr. N. Ternette und K. Engelhardt. Unendlich großen Respekt zolle ich meinen direkten Labornachbarn während dieser Zeit, die es sicher nicht immer leicht hatten: Dr.H. Monse, S.E. Dudek, D. Kamdemt und K. Sure. Bei Letzterem hoffe ich auch weiterhin auf tatkräftige Unterstützung in Zeiten des absoluten Koffeinentzugs. Ich bedanke mich bei der Arbeitsgruppe von Prof. U. Dittmer für die Kooperation während dieser Arbeit und Anleitung in neue Methoden. Zu erwähnen sind hier insbesondere F. Krux, S Schimmer und N. Gerlach. Ich bedanke mich bei den Korrekturlesern dieser Arbeit, Dr. N. Ternette und Dr. A. Stang, der mich, wie so oft, mit seinen geistreichen Kommentaren schwer erheitert hat. Meiner Familie danke ich für die moralische Unterstützung während der gesamten Doktorarbeit und dafür, dass sie mir überhaupt die Ausbildung in dieser Weise ermöglicht hat. Zuletzt möchte ich meiner Freundin danken, dass sie stets an mich geglaubt hat und mich unterstützt hat. Obwohl sie Einiges an alltäglichem Forscherfrust zu erdulden hatte, war sie immer für mich da und hat mich bestärkt, nicht aufzugeben. Vielen Dank 102 Lebenslauf 9. Lebenslauf Persönliche Daten Name: Matthias Tenbusch Geburtstag: 25.Oktober 1978 Geburtsort: Bottrop Nationalität: Deutsch Schulische Ausbildung 1985-89 St. Ludgerus Grundschule in Bottrop 1989-1998 Josef-Albers Gymnasium in Bottrop Zivildienst 10/98 - 11/99 Caritas Kinderdorf am Köllnischen Wald in Bottrop Studium und Promotion WS99/00 - SS 04 Studium der Biochemie an der Ruhr-Universität Bochum Mai 04 Diplomarbeit an der Abt. für Mol. und Med. Virologie, Prof. Dr. K. Überla: „Entwicklung von Immundefizienz-Viren-Impfstoffen auf der Basis viraler GMCSF-Fusionsproteinen“ seit Juli 04 Promotion an der Abt. für Mol. Und Med. Virologie, Prof. Dr. K Überla Stipendium 07/04 – 07/07 DFG-Doktoranden-Stipendium im Rahmen des Graduiertenkollegs 1045/1 „Modulation von Wirtszellfunktionen für die Behandlung viraler und bakterieller Infektionen“ 103