PDF anzeigen
Werbung
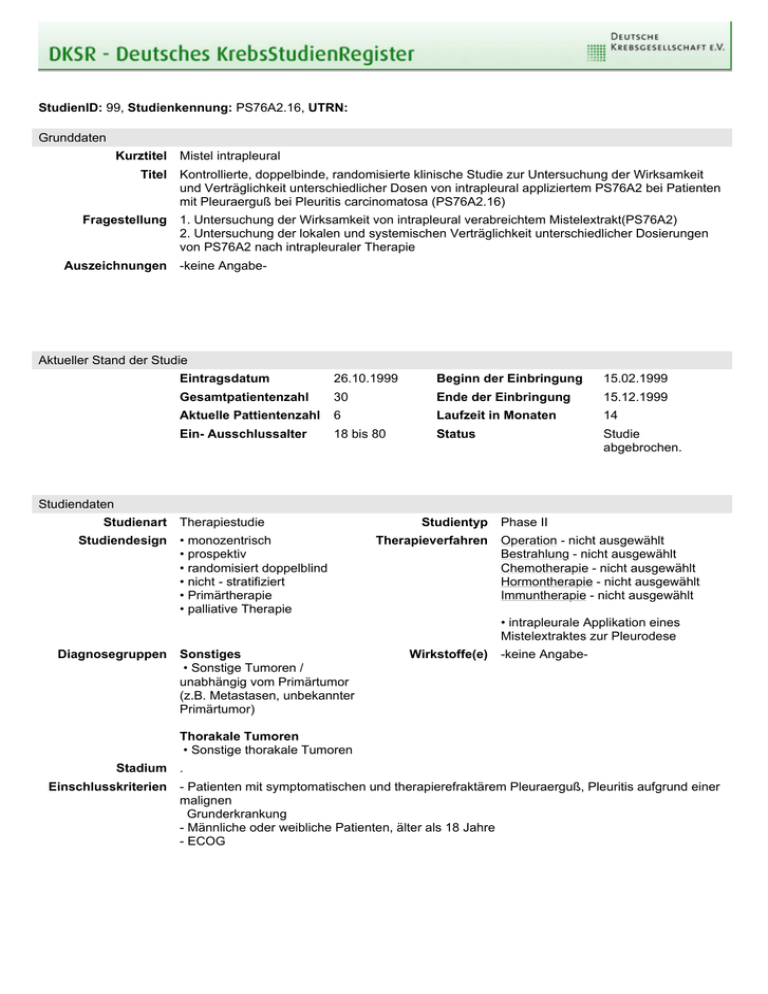
StudienID: 99, Studienkennung: PS76A2.16, UTRN: Grunddaten Kurztitel Titel Fragestellung Auszeichnungen Mistel intrapleural Kontrollierte, doppelbinde, randomisierte klinische Studie zur Untersuchung der Wirksamkeit und Verträglichkeit unterschiedlicher Dosen von intrapleural appliziertem PS76A2 bei Patienten mit Pleuraerguß bei Pleuritis carcinomatosa (PS76A2.16) 1. Untersuchung der Wirksamkeit von intrapleural verabreichtem Mistelextrakt(PS76A2) 2. Untersuchung der lokalen und systemischen Verträglichkeit unterschiedlicher Dosierungen von PS76A2 nach intrapleuraler Therapie -keine Angabe- Aktueller Stand der Studie Eintragsdatum 26.10.1999 Beginn der Einbringung 15.02.1999 Gesamtpatientenzahl 30 Ende der Einbringung 15.12.1999 Aktuelle Pattientenzahl 6 Laufzeit in Monaten 14 Ein- Ausschlussalter 18 bis 80 Status Studie abgebrochen. Studiendaten Studienart Studiendesign Therapiestudie • monozentrisch • prospektiv • randomisiert doppelblind • nicht - stratifiziert • Primärtherapie • palliative Therapie Studientyp Therapieverfahren Phase II Operation - nicht ausgewählt Bestrahlung - nicht ausgewählt Chemotherapie - nicht ausgewählt Hormontherapie - nicht ausgewählt Immuntherapie - nicht ausgewählt • intrapleurale Applikation eines Mistelextraktes zur Pleurodese Diagnosegruppen Sonstiges • Sonstige Tumoren / unabhängig vom Primärtumor (z.B. Metastasen, unbekannter Primärtumor) Wirkstoffe(e) -keine Angabe- Thorakale Tumoren • Sonstige thorakale Tumoren Stadium Einschlusskriterien . - Patienten mit symptomatischen und therapierefraktärem Pleuraerguß, Pleuritis aufgrund einer malignen Grunderkrankung - Männliche oder weibliche Patienten, älter als 18 Jahre - ECOG Ausschlusskriterien Stratifizierung - Vorangegangene Pleurodeseverfahren innerhalb der letzten 8 Wochen vor Aufnahme in die Studie - Gekammerter Erguß - Bronchusobliterierender Tumor mit Atelektase - Neu aufgenommene systemische antitumorale Therapie innerhalb der letzten 6 Wochen vor der ersten Pleurainstillation - Blutgerinnungsstörungen (Quick -keine Angabe- Studienziele Hauptziel(e) • Ansprechrate Nebenziel(e) • Nebenwirkungen • Andere • klinische Symptomatik, Lungenfunktion, Ergußvolumen Die Studie wird in folgenden Ländern durchgeführt Bundesland • Baden-Württemberg Land Publikationen -keine Angabe- Kontaktadressen Studienleiter Herr Dr. Jann Arends Klinik für Tumorbiologie Breisacher Str. 117 79106 Freiburg im Br., Deutschland 1. Sponsor Herr Dr. Uwe Phillip Madaus Ostmerheimer Str. 198 51109 Köln, Deutschland Telefon 0761 206 1801 0761 206 1890 Fax 0761 206 1892 Email [email protected] Telefon 0221 8998 367 0221 8998 367 Fax 0221 8998 725 Email [email protected] Stand: 21.03.2012, 10:57 Uhr Nutzungsbedingungen Die über die Website abrufbaren Inhalte und Dokumente dürfen gespeichert, weitergegeben und vervielfältigt werden. Sie dürfen jedoch nicht verändert, verfälscht oder aus dem Zusammenhang herausgenommen dargestellt werden. Die Weitergabe oder Vervielfältigung ist nur unter deutlicher Angabe der Quelle zulässig. Haftungsbeschränkung Die Studiendaten dieser Website werden mit größtmöglicher Sorgfalt zusammengestellt, die Deutsche Krebsgesellschaft e.V. ist bemüht, die bereitgestellten Informationen stetig zu erweitern und zu aktualisieren. Hinsichtlich Aktualität, Vollständigkeit und Richtigkeit der abrufbaren Inhalte und Dokumente wird jedoch keine Gewähr übernommen. Haftungsansprüche gegen die Deutsche Krebsgesellschaft e.V., deren Mitarbeiter bzw. den Verantwortlichen dieser Website für Schäden materieller oder immaterieller Art, die direkt oder indirekt durch die Nutzung dieser Website entstehen, sind ausgeschlossen, soweit diese nicht auf Vorsatz oder grober Fahrlässigkeit beruhen. Die Haftung der Deutsche Krebsgesellschaft e.V. für Schäden aus der Verletzung des Lebens, des Körpers oder der Gesundheit, die auf einer fahrlässigen Pflichtverletzung der Deutsche Krebsgesellschaft e.V. oder einer vorsätzlichen oder fahrlässigen Pflichtverletzung deren Mitarbeitern bzw. den Verantwortlichen dieser Website beruhen, bleiben hiervon unberührt.











