StudienID: 604, Studienkennung: EudraCT Nr.: 2009-010093
Werbung

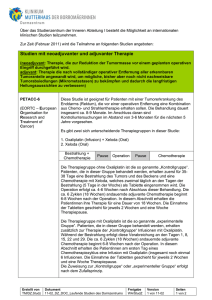
StudienID: 604, Studienkennung: EudraCT Nr.: 2009-010093-38, UTRN: Grunddaten Kurztitel Titel Fragestellung Auszeichnungen HyRec Trial Multi-institutional Phase I/II Study:<br /> Neoadjuvant chemoradiation with 5-FU (or capecitabine) and oxaliplatin combined with deep regional hyperthermia in locally advanced or recurrent rectal cancer (HyRec Trial) Überprüfung der Durchführbarkeit und Verträglichkeit einer multimodalen Behandlung mit Radiochemotherapie kombiniert mit regionaler Tiefenhyperthermie beim lokal fortgeschrittenen oder rezidivierten Rektumkarzinom. Gütesiegel A der Deutschen Krebsgesellschaft Aktueller Stand der Studie Eintragsdatum 29.09.2011 Beginn der Einbringung 01.01.2012 Gesamtpatientenzahl 59 Ende der Einbringung 31.12.2013 Aktuelle Pattientenzahl 0 Laufzeit in Monaten 84 Ein- Ausschlussalter 18 bis 12 Status geplant Studiendaten Studienart Studiendesign Diagnosegruppen Stadium Therapiestudie • nicht - stratifiziert • nicht - randomisiert • prospektiv • multizentrisch • kurativer Therapieansatz • Folgetherapie Gastrointestinale Tumoren • Rektumkarzinom Studientyp Therapieverfahren Wirkstoffe(e) Histologically confirmed, locally recurrent (any recurrence of tumor within the lesser pelvis; rese Phase II Operation - Nein Bestrahlung - neoadjuvant Chemotherapie - neoadjuvant • 5-Fluorouracil • Capecitabin • Oxaliplatin Einschlusskriterien Ausschlusskriterien Stratifizierung Studienziele • Age &#8805; 18 years • Histologically confirmed, locally recurrent (any recurrence of tumor within the lesser pelvis; resectable or non-resectable) or locally advanced adenocarcinoma of the rectum (UICC stage IIB-IV); distant metastases may be present. • ECOG-performance status < 2 • Sufficient bone marrow function: WBC > 3,5 x 109/l Neutrophil granulocytes > 1,5 x 109/l Platelets > 100 x 109/l Hemoglobin > 10 g/dl • Sufficient liver function: Bilirubin < 2,0 mg% SGOT, SGPT, alkaline phosphatase, gGT less than 3 times upper limit of normal • Serum creatinine < 1,5 mg%, glomerular filtration rate > 50 ml/min • Signed study-specific consent form prior to therapy • Fertile patients must use effective contraception during and for 6 months after study treatment • Considered fit for oxaliplatin and 5-FU-containing combination chemotherapy. • Pelvic radiotherapy during the last 12 months • Pregnant or lactating/nursing women • Drug addiction • On-treatment participation on other trials • Active intractable or uncontrollable infection • Prior or concurrent malignancy (&#8804; 5 years prior to enrolment in study) except rectal cancer or nonmelanoma skin cancer or cervical carcinoma FIGO stage 0-1 if the patient is continuously disease-free • Chronic diarrhea (> NCI CTC-Grad 1) • Chronic inflammatory disease of the intestine • Collagen vascular disease • The presence of congenital diseases with increased radiation sensitivity, for example ataxia teleangiectatica, or similar • Pre-existing uncontrolled cardiac disease, signs of cardiac failure, or rhythm disturbances requiring therapy • Myocardial infarction within the past 12 months • Congestive heart failure • Complete bundle branch block • New York Heart Association (NYHA) class III or IV heart disease • Known allergic reactions on study medication • Cardiac pacemaker • Disease that would preclude chemoradiation or deep regional hyperthermia • Any metal implants (with exception of non-clustered marker clips) • Psychological, familial, sociological, or geographical condition that would preclude study compliance • Patients deemed technically unsatisfactory for deep regional hyperthermia • Cardiac symptoms (> NCI CTC Grade 1) due to pretreatment with fluoropyrimidines • Neurological symptoms (> NCI CTC Grade 1) due to pre-treatment with oxaliplatin entfällt Hauptziel(e) • Andere • • Feasibility rate (i.e. rate of patients not experiencing doselimiting toxicity [DLT]) • Number of hyperthermia applications by patient Nebenziel(e) • Andere • • Local progression-free survival • Distant metastasis-free survival (excluding M1 patients) • Overall survival (excluding M1 patients) • Response rate (RECIST criteria) • Rate of curative resections (R0) • Rate of acute and late toxicity according to NCI CTC, and postoperative morbidity Die Studie wird in folgenden Ländern durchgeführt Bundesland Land • Baden-Württemberg • Bayern • Nordrhein-Westfalen • Deutschland Publikationen -keine Angabe- Kontaktadressen Studienleiter Frau Oliver Ott Universitätsklinikum Erlangen Strahlenklinik Universitätsstr. 27 91054 Erlangen, Deutschland Studienleiter Herr Priv. Doz. Dr. Oliver Ott Universitätsklinikum Erlangen Strahlenklinik Universitätsstr. 27 91054 Erlangen, Deutschland Telefon 09131 8532976 09131 8532976 Fax 09131 8535969 Email [email protected] Telefon 09131 8532976 09131 8532976 Fax 09131 8535969 Email [email protected] Stand: 21.03.2012, 14:03 Uhr Nutzungsbedingungen Die über die Website abrufbaren Inhalte und Dokumente dürfen gespeichert, weitergegeben und vervielfältigt werden. Sie dürfen jedoch nicht verändert, verfälscht oder aus dem Zusammenhang herausgenommen dargestellt werden. Die Weitergabe oder Vervielfältigung ist nur unter deutlicher Angabe der Quelle zulässig. Haftungsbeschränkung Die Studiendaten dieser Website werden mit größtmöglicher Sorgfalt zusammengestellt, die Deutsche Krebsgesellschaft e.V. ist bemüht, die bereitgestellten Informationen stetig zu erweitern und zu aktualisieren. Hinsichtlich Aktualität, Vollständigkeit und Richtigkeit der abrufbaren Inhalte und Dokumente wird jedoch keine Gewähr übernommen. Haftungsansprüche gegen die Deutsche Krebsgesellschaft e.V., deren Mitarbeiter bzw. den Verantwortlichen dieser Website für Schäden materieller oder immaterieller Art, die direkt oder indirekt durch die Nutzung dieser Website entstehen, sind ausgeschlossen, soweit diese nicht auf Vorsatz oder grober Fahrlässigkeit beruhen. Die Haftung der Deutsche Krebsgesellschaft e.V. für Schäden aus der Verletzung des Lebens, des Körpers oder der Gesundheit, die auf einer fahrlässigen Pflichtverletzung der Deutsche Krebsgesellschaft e.V. oder einer vorsätzlichen oder fahrlässigen Pflichtverletzung deren Mitarbeitern bzw. den Verantwortlichen dieser Website beruhen, bleiben hiervon unberührt.