PDF anzeigen
Werbung
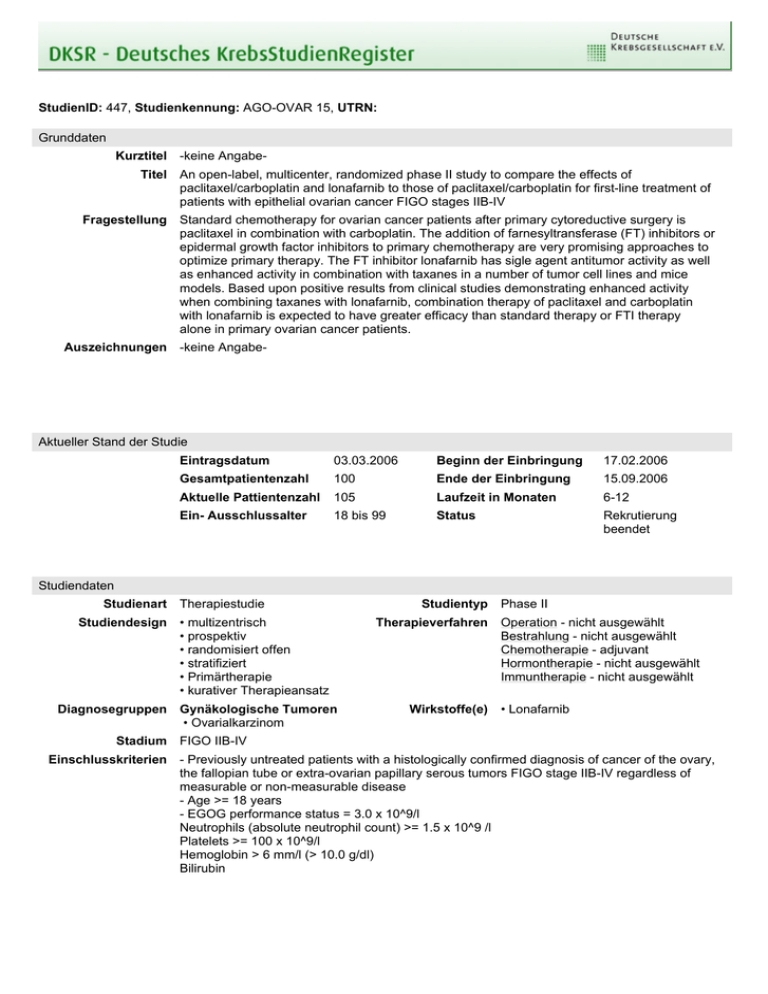
StudienID: 447, Studienkennung: AGO-OVAR 15, UTRN: Grunddaten Kurztitel Titel Fragestellung Auszeichnungen -keine AngabeAn open-label, multicenter, randomized phase II study to compare the effects of paclitaxel/carboplatin and lonafarnib to those of paclitaxel/carboplatin for first-line treatment of patients with epithelial ovarian cancer FIGO stages IIB-IV Standard chemotherapy for ovarian cancer patients after primary cytoreductive surgery is paclitaxel in combination with carboplatin. The addition of farnesyltransferase (FT) inhibitors or epidermal growth factor inhibitors to primary chemotherapy are very promising approaches to optimize primary therapy. The FT inhibitor lonafarnib has sigle agent antitumor activity as well as enhanced activity in combination with taxanes in a number of tumor cell lines and mice models. Based upon positive results from clinical studies demonstrating enhanced activity when combining taxanes with lonafarnib, combination therapy of paclitaxel and carboplatin with lonafarnib is expected to have greater efficacy than standard therapy or FTI therapy alone in primary ovarian cancer patients. -keine Angabe- Aktueller Stand der Studie Eintragsdatum 03.03.2006 Beginn der Einbringung 17.02.2006 Gesamtpatientenzahl 100 Ende der Einbringung 15.09.2006 Aktuelle Pattientenzahl 105 Laufzeit in Monaten 6-12 Ein- Ausschlussalter 18 bis 99 Status Rekrutierung beendet Studiendaten Studienart Studiendesign Diagnosegruppen Stadium Einschlusskriterien Therapiestudie • multizentrisch • prospektiv • randomisiert offen • stratifiziert • Primärtherapie • kurativer Therapieansatz Gynäkologische Tumoren • Ovarialkarzinom Studientyp Therapieverfahren Wirkstoffe(e) Phase II Operation - nicht ausgewählt Bestrahlung - nicht ausgewählt Chemotherapie - adjuvant Hormontherapie - nicht ausgewählt Immuntherapie - nicht ausgewählt • Lonafarnib FIGO IIB-IV - Previously untreated patients with a histologically confirmed diagnosis of cancer of the ovary, the fallopian tube or extra-ovarian papillary serous tumors FIGO stage IIB-IV regardless of measurable or non-measurable disease - Age >= 18 years - EGOG performance status = 3.0 x 10^9/l Neutrophils (absolute neutrophil count) >= 1.5 x 10^9 /l Platelets >= 100 x 10^9/l Hemoglobin > 6 mm/l (> 10.0 g/dl) Bilirubin Ausschlusskriterien - Ovarian tumors of low malignant potential (borderline tumors) - Non-epithelial ovarian or mixed epithelial/nonepithelial tumors (e.g. mixed Mullerian tumors) - Patients who have received previous chemotherapy or radiotherapy - Prior treatment with FT inhibitors - Patients with a prior diagnosis of any malignancy not cured by surgery alone less than 5 years before study entry (except in situ carcinoma of the cervix or adequately treated basal cell carcinoma of the skin) - Complete bowel obstruction or the presence of symptomatic brain metastases - Concurrent severe medical problems unrelated to malignancy which would significantly limit full compliance with the study or expose the patient to extreme risk or decreased life expectancy - Patients with a history of seizure disorder or central nervous system disorders; pre-existing motor or sensory neurologic pathology or symptoms > NCI grade 1 - History of congestive heart failure (NYHA Classification > 2), even if medically controlled - History of atrial or ventricular arrhythmias (>= LOWN II) - Patients with significant Fridericia QTc (QTcF) prolongation at Baseline (ie. QTcF >= 470 msec) - Patients with severe active infection - Patients with a history of severe hypersensitivity reactions to products containing Cremophor EL (cylosporin or vitamin K) and/or patients with known hypersensitivity to compounds chemically related to carboplatin and paclitaxel Stratifizierung Stratum 1: FIGO stage IIB-IIIC and residual tumor 10 mm or FIGO IV (suboptimally debulked advanced disease or FIGO IV) Studienziele Hauptziel(e) • Krankheitsfreie Überlebensrate Nebenziel(e) • Gesamtüberlebensrate • Ansprechrate • - Duration of response - Safety based on nature, frequency and severity of adverse events - Predose lonafarnib concentrations - PD activity Die Studie wird in folgenden Ländern durchgeführt Bundesland • Baden-Württemberg • Bayern • Berlin • Brandenburg • Bremen • Hamburg • Hessen • MecklenburgVorpommern • Niedersachsen • Nordrhein-Westfalen • Rheinland-Pfalz • Saarland • Sachsen • Sachsen-Anhalt • Thüringen • Schleswig-Holstein Land Publikationen -keine Angabe- Kontaktadressen Studienleiter Herr Prof. Dr. Werner Meier Ev. Krankenhaus Düsseldorf Frauenklinik Kirchfeldstraße 40 40217 Düsseldorf, Deutschland Telefon 0211 - 919 1405 Fax 0211 - 919 1423 Email [email protected] Studienkoordinator Frau G. Elser AGO Studienzentrale Telefon Fax Kaiser-Friedrich-Ring 71 65185 Wiesbaden, Deutschland Monitor Herr Peter Schantl Schantl Pharma Service GmbH Herderstr. 16 65185 Wiesbaden, Deutschland Biometrisches Zentrum Herr Jörn Rau Koordinierungszentrum für Klinische Studien Philipps-Universität Marburg Email (0611) 880 467 0 (0611) 880 467 67 [email protected] Telefon (0611) 1666 1485 Fax (0611) 1666 1486 Email peter.schantl@schantlpharmaservice. de Telefon (06421) 286 5792 Fax (06421) 286 6517 Email [email protected] Karl-von-Frisch-Str. 4 35034 Marburg, Deutschland Stand: 21.03.2012, 13:30 Uhr Nutzungsbedingungen Die über die Website abrufbaren Inhalte und Dokumente dürfen gespeichert, weitergegeben und vervielfältigt werden. Sie dürfen jedoch nicht verändert, verfälscht oder aus dem Zusammenhang herausgenommen dargestellt werden. Die Weitergabe oder Vervielfältigung ist nur unter deutlicher Angabe der Quelle zulässig. Haftungsbeschränkung Die Studiendaten dieser Website werden mit größtmöglicher Sorgfalt zusammengestellt, die Deutsche Krebsgesellschaft e.V. ist bemüht, die bereitgestellten Informationen stetig zu erweitern und zu aktualisieren. Hinsichtlich Aktualität, Vollständigkeit und Richtigkeit der abrufbaren Inhalte und Dokumente wird jedoch keine Gewähr übernommen. Haftungsansprüche gegen die Deutsche Krebsgesellschaft e.V., deren Mitarbeiter bzw. den Verantwortlichen dieser Website für Schäden materieller oder immaterieller Art, die direkt oder indirekt durch die Nutzung dieser Website entstehen, sind ausgeschlossen, soweit diese nicht auf Vorsatz oder grober Fahrlässigkeit beruhen. Die Haftung der Deutsche Krebsgesellschaft e.V. für Schäden aus der Verletzung des Lebens, des Körpers oder der Gesundheit, die auf einer fahrlässigen Pflichtverletzung der Deutsche Krebsgesellschaft e.V. oder einer vorsätzlichen oder fahrlässigen Pflichtverletzung deren Mitarbeitern bzw. den Verantwortlichen dieser Website beruhen, bleiben hiervon unberührt.











