Script 23. Oktober 2006
Werbung

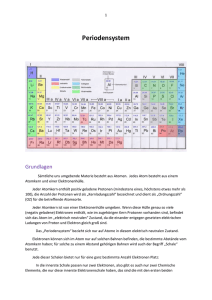
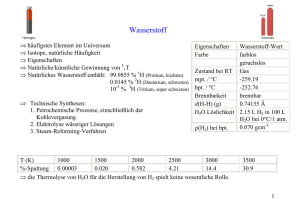
Anorganische Chemie I 23.10.2006 Literatur + Allgemeine Bemerkungen “Anorganische Chemie” – Catherine E. Housecroft, Alan G. Sharpe, Pearson Studium (2006) “Lehrbuch der Anorganischen Chemie” – Holleman – Wiberg, DeGruyter. Programm Periodensystem Stoffchemie Tendenzen Gruppen 1,2,13-18 Grundlegende Begriffe – Definition der Anorganischen Chemie Alles ausser Kohlenstoff! Grundlegende Begriffe – Das Periodensystem Das Periodensystem (Eigenschaften der Elemente sind eine periodische Funktion ihrer Atomgewichte) wurde in seiner ursprünglichen Version von Mendeleev und Meyer entwickelt. Modifizierte Sichtweise: Eigenschaften werden durch die Änderungen der Elektronenkonfiguration definiert. Blöcke werden durch Auffüllung der entsprechenden Orbitale (s, p, d, f) gebildet. Grundlegende Begriffe – Das Periodensystem (Aufbauprinzip) Die Orbitale werden nach folgenden Regeln aufgefüllt: 1. Orbitale werden in der Reihenfolge ihres Energiezustandes aufgefüllt, d.h. Orbitale mit niedriger Energie werden zuerst mit Elektronen besetzt. 2. 1. Hund’sche Regel: Enartete Orbitale werden solange NICHT mit gepaarten Elektronen besetzt, bis jedes Orbital ein Elektron enthält; Elektronen in einfach besetzten entarteten Orbitalen besitzen parallele Spins. 3. Pauli-Ausschlussprinzip: Es gibt keine Elektronen im Atom, deren 4 Quantenzahlen n, l, ml, ms völlig übereinstimmen – daraus folgt, dass jedes Orbital maximal 2 Elektronen mit unterschiedlichem ms aufnehmen kann. Beispiel: 75 33As 33 Elektronen sind zu verteilen! He 1s2 Ne [He] 2s2 2p6 Ar [Ne] 3s2 3p6 As [Ar] 3d10 4s2 4p3 Grundlegende Begriffe – Das Periodensystem Tendenzen im Periodensystem (Ionisierungenergien, metallische Eigenschaften, Ionenradii usw.) sind beobachtbar. Sie sind jedoch weder strikt noch stetig! Abweichungen von der Periodizität ergeben sich durch den Einschub der Übergangsmetalle und der f-Block Elemente (Lanthanidenkontraktion). Konsequenz der Lanthanidenkontraktion: Zr und Hf haben fast identische Eigenschaften. Grundlegende Begriffe – Das Periodensystem (Atomradien) •Radien steigen innerhalb einer Gruppe von oben nach unten• •Radien sinken innerhalb einer Periode von links nach recht• •Unterschiede zwischen Atom-, Ionen-, Kovalenz-und Metallradius (Bindungscharakter nicht immer eindeutig!) •Abhängigkeit von Koordinationszahl •Bestimmungsmethode →welches Bezugssystem? Grundlegende Begriffe – Das Periodensystem (Ioniesierungsenergien) Die erste Ionisierungsenergie ist definiert als Änderung der inneren Energie bei Abspaltung des ersten Elektrons (Xg X+ (g) + e-) bei 0K. Periodizität der Ionisierungsenergie Abnahme innerhalb der Gruppe. Zunahme innerhalb der Periode. Aber: Innerhalb eine Periode kommt es zu Abweichungen: 1. Halbbesetzte Schalen sind sehr stabil (e.g. Stickstoffgruppe d.h. P schwerer zu ionisieren als S). 2. Vollbesetzte Schalen weisen auch eine sehr stabile Konfiguration auf (e.g. Be schwerer zu Ionisieren als B) Grundlegende Begriffe – Das Periodensystem (Metallischer Charakter) Metallischer Charakter nimmt innerhalb einer Gruppe zu und innerhalb einer Periode ab: Grobe Korrelation mit Ionisierungsenergien! Beispiele : F ist bei Raumtemperatur ein nicht-metallisches Gas, während Iod schon stark metallische Eigenschaften (Leitfähigkeit, Biegsamkeit...) hat. Von Na über Al bis zum Ar geht sämtlicher Metallcharakter verloren. I II III IV V VI VII VIII 1. 1 H 2 He 2. 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne 3. 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar 4. 19 K 20 Ca 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr 5. 37 Rb 38 Sr 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe 6. 55 Cs 56 Ba 81 Tl 82 Pb 83 Bi 84 Po 85 At 86 Rn 7. 87 Fr 88 Ra Metalle Halbmetalle (Halbleiter) Nichtmetalle Edelgase Charakteristisch für Metalle ist eine lockere Bindung der Valenzelektronen an das Atom und damit verbunden eine geringe Ionisierungsenergie. Innerhalb einer Gruppe nimmt die Atomgröße mit steigender Ordnungszahl zu. Dadurch bedingt ist eine zunehmend lockere Bindung der Valenzelektronen an das Atom, was eine Abnahme der Ionisierungsenergie mit steigender Ordnungszahl zur Folge hat. So nimmt generell der Metallcharakter der Elemente innerhalb einer Gruppe von oben nach unten zu. Von den Halogenen sind Fluor, Chlor und Brom typische Nichtmetalle. Iod erinnert in seinem Aussehen (metallisch glänzende Schuppen) schon deutlich an ein Metall. Grundlegende Begriffe – Das Periodensystem (Elektronegativität) Die Elektronegativität steigt innerhalb des Periodensystems von links unten nach rechts oben (aber: d-Block-Kontraktion; Übergangsmetalle). Bestimmung der Elektronegativität nach Pauling χP: 1) “Ideale” Bindungsenthalpie: D(X-Y) = ½ (D(X-X) + D(Y-Y)) 2) Abweichung von D(X-Y) (in eV): ∆D(X-Y) = D(X-Y)exp D(X-Y)ideal 3) Berechnung der relativen Elektronegativitäten: ∆χ = χP(Y) - χP(X) = ∆D H 2,2 Li 1,0 Be 1,6 B 2,0 C 2,6 N 3,0 O 3,4 F 4,0 Na 0,9 Mg 1,3 Al(III) 1,6 Si 1,9 P 2,2 S 2,6 Cl 3,2 K 0,8 Ca 1,0 Ga(III) 1,8 Ge(IV) 2,0 As(III) 2,2 Se 2,6 Br 3,0 Rb 0,8 Sr 0,9 In(III) 1,8 Sn(II) 1,8 Sn(IV) 2,0 Sb 2,1 Te 2,1 I 2,7 Cs 0,8 Ba 0,9 Tl(I) 1,6 Tl(III) 2,0 Pb(II) 1,9 Pb(IV) 2,3 Bi 2,0 Po 2,0 At 2,2 d-BlockElemente Grundlegende Begriffe – Das Periodensystem (Elektronegativität) Elektronegativität nach Mulliken, χM χM = (IE1 + EA1)/2 Elektronegativität nach Allred-Rochow, χAR χAR (3590 × Z eff rkov 2 ) + 0.744 (Zeff) = elektrostatische Kraft nach Slater Tendenzen stimmen “mehr oder weniger” bei allen 3 Elektronegativitätsdefinitionen überein. Grundlegende Begriffe – Das Periodensystem (Basizität) •Mit dem metallischen Charakter des Elements wächst die Basizität der Oxide/Hydroxide. •Innerhalb einer Periode sinkt basischer Charakter stark (NaOH→HClO4). •Innerhalb einer Gruppe steigt der basische Charakter schwächer (H3BO3→Tl(OH)3). •Abhängigkeit der Basizitätvom Oxidationszustand (z.B. Pb(OH)2vs. Pb(OH)4). •„Polarität der E-O-Bindung“. •Hydrolyseneigung der Chloride steigt mit abnehmender Basizität der korrespondierenden Hydroxide (z.B. NaCl→PCl5; Kovalenzanteil der E-O-Bindung). I II III IV V VI VII VIII 1. 1 H 2. 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne 3. 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar 4. 19 K 20 Ca 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr 5. 37 Rb 38 Sr 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe 6. 55 Cs 56 Ba 81 Tl 82 Pb 83 Bi 84 Po 85 At 86 Rn 7. 87 Fr 88 Ra Basenbildner 2 He amphoter Säurebildner Grundlegende Begriffe – Das Periodensystem (“Schrägbeziehungen”) Ähnliches Verhältnis Ladung/Radius bedingt häufig ähnliches chemisches Verhalten →Paare Li/Mg, Be/Al und B/Si chemisch verwandt. Weitere Schrägbeziehungen werden auch durch ähnliche Elektronegativitäten verdeutlicht: H 2,2 Li 1,0 Be 1,6 B 2,0 C 2,6 N 3,0 O 3,4 F 4,0 Na 0,9 Mg 1,3 Al(III) 1,6 Si 1,9 P 2,2 S 2,6 Cl 3,2 K 0,8 Ca 1,0 Ga(III) 1,8 Ge(IV) 2,0 As(III) 2,2 Se 2,6 Br 3,0 Rb 0,8 Sr 0,9 In(III) 1,8 Sn(II) 1,8 Sn(IV) 2,0 Sb 2,1 Te 2,1 I 2,7 Cs 0,8 Ba 0,9 Tl(I) 1,6 Tl(III) 2,0 Pb(II) 1,9 Pb(IV) 2,3 Bi 2,0 Po 2,0 At 2,2 d-BlockElemente Grundlegende Begriffe – Das Periodensystem (“Schrägbeziehungen”) Beispiel B/Si: •Beides hochschmelzende, harte und spröde Halbmetalle (Al: duktiles Metall mit relativ niedrigem Schmelzpunkt von 660 °C). •Wasserstoffverbindungen sind flüchtig (AlH3 polymer und fest). •Chloride BCl3 und SiCl4 flüssig (AlCl3 fest). •Oxide bilden schwer zu kristallisierende Gläser. •B(OH)3 und Si(OH)4 sind schwache Säuren, die zu Aggregation neigen (Al(OH)3: amphoteres Hydroxid). H Li Be Na Mg d-BlockElemente B C N O F Al Si P S Cl Ga Ge As Se Br K Ca Rb Sr In Sn Sb Te I Cs Ba Tl Pb Bi Po At Grundlegende Begriffe – Das Periodensystem (“Oxidationsstufen”) Wertigkeit / Oxidationsstufen •maximaleWertigkeit ≡ Gruppennummer. •minimaleWertigkeit:-ab 4. HG: 8 -Gruppennummer (z.B. S: 8 -6 = 2) bei Metallen häufig nicht eindeutig. •dazwischen häufig 2er Schritte (z.B. SF6→SF4→SF2) →„Effekt des inertenElektronenpaares“. •Oxidationskraft der höchsten Ox-Stufesteigt von oben nach unten in der HG aber: „Sprung“in der 4. Periode →„d-Block-Kontraktion“: abgeschlossene d-Schale schirmt kernnahe s-Elektronen nur unvollständig ab. •d-Elemente: Stabilität der höchsten Oxidationsstufe nimmt zu den höheren Homologen hin zu. Wasserstoff - H Geschichte: Entdeckt wurde elementarer, gasförmiger Wasserstoff (H2) von Henry Cavendish im Jahre 1766. Wasserstoff Physikalische Eigenschaften: Chemische Eigenschaften: Vorkommen: •Gasförmig bei Raumtemperatur. •Schmelzpunkt: 13,66 K. •Siedepunkt: 20,13 K. •Sehr geringe Dichte: 0.0899 g/l (Luft: 1.29 g/l). •Farb- und Geruchlos. •Explosiv in Kontakt mit Sauerstoff. •Im festen Zustand hexagonal dichteste Kugelpackung. •Isotopenverteilung: 99,9855 % 11H, 0,0145 % 2 H (Deuterium), 1*10-5 % 3 H (Tritium). 1 1 •Oxidationsstufen –I und +I – je nach Partner. •Hydride nennt man Verbindungen des Wasserstoffs mit der Oxidationsstufe –I. •Reaktion mit fast allen Elementen (z.B. H2 + Cl2 2HCl ...) •5*10-<5 Vol-% in Erdatmosphäre. •100 % in 100 km Höhe. •Hauptsächlich gebun<den in Wasser (jedes 6. Atom in der Erdrinde). •Sonne besteht aus 80 Atom% aus Wasserstoff. Wasserstoff Binäre Hydride: -I H •Metallische Hydride. •Saline oder salzartige Hydride. •Molekulare Hydride. •Polymere Hydride. Metallische Einlagerungshydride Wasserstoffatome sind klein genug, um sich in die Hohlräume von Metallgittern zu “quetschen”. Die führt zu nichtstöchiometrischen Einlagerungsverbindungen. z.B. TiH1,7; HfH1,98 Wasserstoff Salzartige Hydride Z.B. LiH, NaH, MgH2 Hochschmelzende Feststoffe Synthese: Durch Erhitzen der der Metalle mit H2. Salzartige Hydride werden als Reduktionsmittel verwendet. 4NaH + B(OMe)3 Na(BH4) + 3NaOMe Wichtiges Reduktionsmittel z.B. zur Herstellung von Au-Nanopartikeln. Wasserstoff Nickelmetallhydrid-Batterien: eEntladung eEntladung Ladung Ladung e- e- Entla dung g un d a tl En Ladung M + H2O + e Entladung Ladung Ni(OH)2 + NiO(OH) + H2O + e- [OH]Entladung Anode: Kathode Ladung Gesamt: NiO(OH) + MH Ni(OH)2 + M Entladung MH + [OH]- Wasserstoff Molekulare Hydride Mit allen Elementen der Gruppen 13-17. Ausnahme: Bi und Al. Synthesebeispiel: ECl4 Li(AlH4 ) EH4 Die Strukturen von (a) [CoH5]4–, (b) [FeH6]4–, (c) [ReH9]2– (d) [Pt2H9]5–. Borhydride: Wasserstoff Polymere Hydride: BeH2 und AlH3 (polymere Kettenstruktur) Wasserstoff Diwasserstoff - Herstellung: 1) In-Situ Herstellung bei Hydrierungen (Synthesegas): CH4 + H2O CO + H2O 1200 K, Ni- Katalysator 700 K, Eisenoxid-Katalysator CO + 3H2 (Wassergasreaktion) CO2 + 3H2 (Wassergasreaktion) 2) Chemische Wasserspaltung: M(OH)n + n/2 H2 (M = Metalle der I. – III. Hauptgruppe) M + n H2O (Problem der Passivierung) Kippscher Apparat 3) Elektrolyse von sauren Lösungen: 2H2O 2H2 + O2 (285.83 kJ mol-1) Halbreaktionen: 2H2O + 2 e- H2 + 2OH2H2O O2 + 4 e- + 4 H+ 4-Elektronen notwendig für O2- Bildung!! 4) Photochemische Zersetzung von Wasser Wasserstoff H2O + 2A(Ox) hν ½ O2 + 2H+ +2A(red) Künstliche Photosynthese 2H+ + 2A(Red) H2 + 2A(Ox) Das Hauptproblem bei der photokatalytischen Wasserspaltung ist der Bedarf von 4 Elektronen zur Erzeugung von Disauerstoff. Bei der Lichtanregung wird immer nur ein Elektron in einen angeregten Zustand gebracht. Somit müssen Elektronen gespeichert und auch der Wasseroxidation gleichzeitig zur Verfügung gestellt werden. Wasserstoff Herstellung mit der Hilfe von Halbleitern: A H2O H2O (reduction) (reduction) ECB ECB H2O H2O Eg EVB hν (oxidation) (oxidation) EVB O2 O2 TiO2 (Electrode) A Pt (CounterElectrode) Pt TiO2 Schottky Barrier B Wasserstoff Verwendung: •Treibstoff in Brennstoffzellen. •Hydrierung in der organischen Synthese (CO + 2H2 CH3OH – Cu/ZnO-Kat; 550 K, 50 bar). •Autogenes Schweissen. •Früher: Füllgas für Zeppeline – Abbrennen der Hindenburg. •Treibstoff für Spaceshuttle ...primäre Ursache waren allerdings die Feststoffraketen und nicht der Wasserstoff/Sauerstoff-Tank. Wasserstoff Die Brennstoffzelle: Als Katalysator an den Elektroden wird hauptsächlich Platin benutzt. Der Elektrolyt kann sowohl ein Polymer (Proton Exchange Membrane Fuel Cell, PEMFC) als auch keramisches Material sein (Solid Oxide Fuel Cell, SOFC). Wasserstoff Die Speicherung von Wasserstoff: Die Energie von Wasserstoff in flüssiger Form ist pro Masseneinheit sehr gross. Aber: Die Energiedichte pro Volumeneinheit sehr viel kleiner als von z.B. Benzin. Daraus ergibt sich ein Problem für den Einsatz von Wasserstoff in Autos hinsichtlich der Grösse des Tanks. Herausforderung: Erhöhung der Energiedichte pro Volumeneinheit mit Hilfe von anderen Speicherformen. Alternative Wasserstoffspeicher in der Entwicklung: •Kohlenstoffnanoröhrchen (Physisorption). •Aktivkohle (Physisorption). •Hydride •Mischformen (z.B. PdH0,7). Wasserstoff Die momentan interessantesten Metallhydride zur Wasserstoffspeicherung: Die Energiedichte ist auch bei diesen Hydridwasserstoffspeichen immer noch nicht hoch genug, um genügend Energie bei akzeptablem Gewicht zu liefern. Ausserdem: Viele Metallhydride in der obigen Tabelle besitzen seltene Metalle, die sowohl teuer als auch “selten” sind.