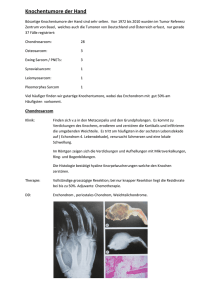
Maligne Tumoren des muskuloskelettalen Systems
Werbung

Maligne Tumoren des muskuloskelettalen Systems Maligne Tumoren des muskuloskelettalen Systems P.−U. Tunn Department Tumororthopädie, Sarkomzentrum Berlin−Brandenburg, Klinik für Orthopädie und orthopädische Rheumatologie, HELIOS Klinikum Berlin−Buch Zu den malignen Tumoren des muskuloskelettalen Systems gehören n die primär malignen Knochen− und Weichgewebe− tumoren (Sarkome), n die Knochenmetastasen, n die malignen Systemerkrankungen (z. B. multiples Myelom, Lymphom des Knochens). Die Knochen− und Weichgewebesarkome sind per defini− tionem nichtepitheliale Malignome und machen nur einen Anteil von 2 % aller malignen Neubildungen aus. Dement− sprechend selten werden Orthopäden, Unfallchirurgen, Kinderärzte, Allgemeinmediziner usw. mit dieser Krank− heitsentität konfrontiert. Treten die primär hochmalignen Knochensarkome vorwiegend im Kindes− und Jugendalter auf, so werden Weichgewebesarkome insbesondere in der 2. Lebenshälfte diagnostiziert. Die Schwellung, begleitet von mehr oder minder ausgeprägten Schmerzen, ist die führende klinische Symptomatik. Vor jeder chirurgischen Intervention ist ein standardisiertes diagnostisches Kon− zept zu verfolgen, um den hohen Anteil an ¹ungeplanten“ Resektionen oder falsch durchgeführten Biopsien bei Patienten mit Knochen− und Weichgewebesarkomen zu reduzieren. Erst nach Abschluss des Stagings kann eine stadien− und damit prognoseorientierte Therapie, stets interdisziplinär abgestimmt, eingeleitet werden. Die primär malignen Knochentumoren wie das Osteo− sarkom und die Gruppe der Ewing−Sarkome werden in sog. Therapieoptimierungsstudien behandelt, beim Chondro− sarkom (eher 2. Lebenshälfte) ist mit Ausnahme des de− differenzierten Chondrosarkoms die Behandlung meist chirurgisch. Die chirurgische Therapie von Weichgewebe− sarkomen ist im Erwachsenenalter im nichtmetastasierten Stadium der Erkrankung (Stadium I ± III, UICC) die Therapie der Wahl unter kurativer Intention. Die R0−Resektion in Kombination mit einer adjuvanten Radiotherapie gilt hier− bei als Standard bei primär resektablen Weichgewebesar− komen. Sollte die Resektion nur mit einem mutilierenden oder ablativen Verfahren möglich sein, sind neoadjuvante Therapieoptionen (z. B. isolierte hypertherme Extremitä− tenperfusion mit TNF−alpha und Melphalan, Strahlen− therapie, systemische Chemotherapie mit/ohne Hyper− thermie) in das interdisziplinäre Behandlungskonzept einzuschließen. Unter Vorhaltung dieser Konzeption und Anwendung von rekonstruktiven Verfahren können mehr als 80 % der Patienten mit Knochen− und Weichgewebe− sarkomen extremitätenerhaltend behandelt werden. Sekundär maligne Knochentumoren ± Knochenmetasta− sen (epithelialer Ursprung) ± stellen bei Weitem die häu− figste Manifestationsform von Malignomen am Bewe− gungsapparat dar. Vor allem bei Bronchial−, Mamma−, Schilddrüsen−, Nierenzell− und Prostatakarzinomen treten je nach Stadium in bis zu 80 % der Fälle ossäre Metastasen auf. Gerade durch die Verbesserung der Primärtumorbe− handlung und systemischer Optionen erleben immer mehr Patienten das Stadium der ossären Metastasierung und der daraus resultierenden Probleme, die geprägt sind durch den Schmerz, die pathologische Fraktur und neurologi− sche Komplikationen. Gerade hier ist ein standardisiertes therapeutisches Vorgehen unter Berücksichtigung der Prognose, der Tumorart, der Metastasenlokalisation usw. zu fordern. Besteht die Indikation zur operativen Kno− chenmetastasentherapie, so ist diese so zu wählen, dass operative Folgeeingriffe bei meist limitierter Lebenserwar− tung vermieden werden sollten. Eine primär belastungs− stabile Rekonstruktion des betroffenen Skelettabschnittes ist das definierte Ziel, um die Lebensqualität positiv zu beeinflussen. Auf die gesonderte Darstellung der Diagnostik und The− rapie des multiplen Myeloms und des Lymphoms des Knochens wurde bewusst verzichtet, da es sich um inter− nistische Krankheitsbilder aus orthopädisch−unfallchirur− gischer Sicht handelt. Die operativen Richtlinien sind mit denen der Knochenmetastasentherapie vergleichbar. Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 êDOI 10.1055/s−2008−1077699 317 Systemerkrankungen Primär maligne Knochentumoren Epidemiologie Primär maligne Knochentumoren machen etwa 0,2 % der gesamten humanen Malignome aus. Seit Ende der 70er−Jahre konnten durch die Einführung und Etablie− rung einer systemischen Chemotherapie, durch eine Verbesserung der bildgebenden Diagnostik, insbeson− dere der Magnetresonanztomografie und einer Weiter− entwicklung rekonstruktiver Operationstechniken vor allem bei den häufig betroffenen Kindern die Amputa− tionsrate gesenkt und das Überleben von 10 ± 15 % auf 60 ± 80 %, je nach Stadium, erhöht werden. Die Ätiologie ist bei den meisten Entitäten nicht geklärt. Die häufigs− ten primär malignen Knochentumoren sind n das Osteosarkom (35 %), n das Chondrosarkom (25 %), n die Tumoren der Gruppe der Ewing−Sarkome (16 %), n das Chordom. Im Kindesalter beträgt der Anteil der Knochensarkome etwa 3,4 % aller malignen kindlichen Neoplasien (60 % Osteosarkom, 25 % Gruppe der Ewing−Sarkome). In der Altersverteilung sind 2 Gipfel zu beobachten: n der erste im Kindesalter bis zum Ende der zweiten Dekade (Osteosarkome und Gruppe der Ewing− Sarkome), n der zweite Häufigkeitsgipfel nach der 5. Lebens− dekade. In dieser Altersgruppe treten insbesondere Chondro− sarkome, seltener Osteosarkome auf. Männer sind etwas häufiger betroffen als Frauen (Dorfman 2002). Diagnostik n Klinik Die klinische Symptomatik eines primär malignen Kno− chentumors ist im Bereich der Extremitäten durch eine progrediente Schmerzsymptomatik und Schwellung, selten eine pathologische Fraktur, charakterisiert. Im Bereich der Extremitäten beträgt das Intervall von den ersten Beschwerden bis zur Diagnosestellung im Mittel 2 Monate. Bei stamm− oder stammnahen Lokalisatio− nen, insbesondere im Becken und der Wirbelsäule, ist die Symptomatik vergleichsweise uncharakteristisch. Hier werden häufig radikuläre oder ischialgiforme Symptome berichtet, diagnostiziert und primär thera− piert. Dementsprechend resultieren meist wesentlich längere Intervalle vom Zeitpunkt der ersten Beschwer− den bis zur Diagnosestellung. 318 Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 Abb. 1 n Röntgenbild des linken distalen Femurs eines 14−jährigen Mädchens in 2 Ebenen mit positiver Schmerzanamnese und pro− gredienter Schwellung seit 6 Wochen. Es handelt sich um einen lokal destruktiv, permeativ wachsenden Knochentumor mit Destruktion der Kortikalis, Weichteilinfiltration, partiell osteolytisch als auch osteoblas− tisch. Nachweisbares Codman−Dreieck. Röntgenologische Klassifikation der Wachstumstendenz nach Lodwick: Grad III. Unter Berücksichtigung des Alters, der Topik im Knochen (metaphysär), der Anamnese und der Bildgebung ist der Verdacht auf ein Osteosarkom zu äußern. " Häufigste primäre Symptomatik: progrediente Schmerzsymptomatik und Schwellung. Ungewollte Gewichtabnahme, Nachtschweiß, Leistungsknick und Anämie sind bei primär malignen Knochentumoren in der Regel Spätsymptome. Die Anamnese sollte sowohl speziell auf den Beginn und die Art sowie die Dauer der derzeitigen Symptome als auch auf eine mögliche familiäre oder genetische Kom− ponente Bezug nehmen. Inspektion und Palpation sind zum Erkennen der Ausdehnung sowie Beschreiben der Konsistenz einer Schwellung und deren Beziehung zu den Nachbarstruk− turen unumgänglich. Bei gelenknahen Tumoren ist die Beurteilung einer Funktionseinschränkung (Neutral− Null−Methode) sowie eines intraartikulären Ergusses erforderlich. Sensomotorische Einschränkungen erfor− dern einen speziellen neurologischen Status. n Bildgebende Verfahren Röntgen. Die native Röntgenaufnahme der betroffenen Region in 2 Ebenen mit den angrenzenden Gelenken ist als erster diagnostischer Schritt nach Erhebung der Anamnese und der klinischen Untersuchung obligat. Sie besitzt hinsichtlich der Einschätzung der Dignität und Maligne Tumoren des muskuloskelettalen Systems Abb. 2 n Röntgenbild des linken distalen Femurs einer 18−jährigen jungen Frau mit einer zunehmenden Schwellung seit 4 Wochen, keine Funktionseinschränkung, nur belastungsabhängige Schmer− zen. Laborchemisch gering erhöhte LDH. Röntgenmorphologisch han− delt es sich um einen diaphysär lokalisierten Tumor mit destruktivem Wachstumsmuster, spikulaartiger Komponente und reaktiver Knochen− bildung distal und proximal der Läsion. Alter und Lokalisation machen einen primär malignen Knochentumor wahrscheinlich. Diagnose: Ewing−Sarkom des linken Femurs. Abb. 3 n Beckenübersicht einer 59−jähri− gen Patientin. Schmerzen seit mehr als 3 Jahren. Zunächst Verdacht auf degenerativ bedingte Beschwerden und konservative Therapie ohne Beschwerdelinderung. Anhand der Röntgenaufnahme ist ein destruktiv wachsender Tumor des linken Os ilium mit Matrixossifikationen und stippchenartigen Entität von Knochentumoren unter Berücksichtigung der klinischen Symptome, des Alters des Patienten, der Topografie der Läsion und der strukturellen Besonder− heiten die größte Aussagefähigkeit. Durch die Analyse der Röntgenaufnahmen kann oft mit großer Sicherheit auf den Tumor und sein biologisches Verhalten ge− schlossen werden. Unterstützend ist für die Einschät− zung der Aggressivität der Läsion die röntgenologische Klassifikation der Wachstumstendenz nach Lodwick (1980) heranzuziehen (Abb. 1 ± 3). Allein die Röntgen− aufnahme berechtigt zur Entscheidung über die Not− wendigkeit weiterer bildgebender Verfahren. Tumors genau beurteilt werden und ggf. vorhandene Skip−Läsionen im selben Kompartment detektiert werden. Sonografie. Bei einem vermuteten Weichteilanteil, einem Hämatom oder einem intraartikulären Erguss kann die Sonografie wichtige Zusatzinformationen liefern. MRT. Besteht der Verdacht auf einen malignen Kno− chentumor, so ist die Magnetresonanztomografie (MRT) in den verschiedenen Gewichtungen mit Kontrastmittel unverzichtbar. Hierbei werden der gesamte betroffene Knochenabschnitt und die angrenzenden Kompart− mente untersucht. Neben der Beschreibung der Weich− teilinfiltration kann die Markraumausdehnung des Verkalkungen zu beschreiben. Aufgrund des Alters, der Lokalisation und des Röntgenbil− des muss der Verdacht auf ein Chondrosar− kom geäußert werden. Histologisch wurde die Verdachtsdiagnose eines Chondrosar− koms bestätigt. Röntgenologische Klassifika− tion der Wachstumstendenz nach Lodwick: Grad II. CT. Im Gegensatz zur MRT liegt der besondere Vorteil der Computertomografie (CT) in der Darstellung der kortikalen Strukturen. Der Nachweis einer Destruktion der Kortikalis kann in einigen Fällen dem Röntgenbild entgehen, der CT nicht. Gerade bei chondrogenen Tu− moren liefert die CT wichtige Zusatzinformationen über das Ausmaß der Kalzifikation und kortikalen Destruk− tion (Abb. 4). Szintigrafie. Die Szintigrafie ist bei Verdacht auf einen primär malignen Knochentumor als Ganzkörperkno− chenszintigrafie notwendig: n einerseits, um mittels des lokalen Speicherfaktors die biologische Aktivität des regionalen Prozesses zu bestimmen n andererseits, um eine eventuell systemische Kom− ponente (z. B. Knochenmetastasen) oder Zweit− bzw. multiple Primärläsionen (z. B. multifokales Osteo− sarkom) zu diagnostizieren. Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 319 Systemerkrankungen " Cave. Die Szintigrafie kann bei chondrogenen Neo− plasien falsch−negativ sein und ein hoch pathologischer Befund ist keinesfalls als sicherer Hinweis für einen malignen Prozess zu werten ± z. B. aneurysmatische Knochenzyste. Angiografie. Die Angiografie hat im klinischen Alltag nur noch selten eine Indikation. Bei plastischen Re− konstruktionen, z. B. mit einer freien Fibula oder freier Lappendeckung, kann eine Angiografie zur Identifizie− rung des Gefäßstatus und möglicher Spendergefäße gelegentlich hilfreich sein. PET. Die Positronenemissionstomografie (PET) hat derzeit außerhalb von Studien noch keinen klinischen Stellenwert. n Abb. 4 n Chondrosarkom des Os ilium rechts nativröntgenologisch (a) und in der CT (b). In der CT sind die Tumorausdehnung, die Größe der Knorpelkappe und die intratumoralen Ver− kalkungen wesentlich besser zu erfassen und damit für die OP−Planung unverzichtbar. Präsen− tation des Resektates (c) sowie der Präparateradiografie (d) in derselben Schnittführung. Hintergrund Richtlinien für die offene Biopsie (Inzisionsbiopsie). n n n 320 Die Wahl des Biopsiezugangs sollte im Verlauf des späteren definitiven Zu− gangs liegen. Der die Biopsie durchfüh− rende Operateur muss die Möglichkeit und Art der definitiven Versorgung reflektieren können. An den Extremitäten werden aus− schließlich längs verlaufende Schnitte gesetzt. Es ist der kürzeste, direkte Weg zum Tumor zu wählen, ohne ein weiteres Kompartment zu eröffnen (d. h. mit Tumorzellen zu kontaminieren). Ein Sicherheitsabstand zu Gelenken, großen Gefäßen und Nerven ist zu wahren. n n Eine exakte Blutstillung ist erforderlich, um eine Tumorzellverschleppung durch ein Hämatom zu vermeiden. Bei hyper− vaskularisierten Tumoren hat sich ein Verschluss des Knochenfensters mit einer Zementplombe bewährt. Eine Drainage ist obligat, diese wird direkt aus der Wunde oder in unmittelbarer Nähe des Wundwinkels ausgeleitet. Die Operationstechnik hat so atrauma− tisch wie möglich zu erfolgen. Gewebe− quetschungen oder großzügiges Präpa− rieren und Darstellen des Tumors sind zu vermeiden. Die Hautnaht wird in in− trakutaner Technik durchgeführt; groß− zügige Rückstichnähte sind obsolet. Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 Labordiagnostik Tumorantigenspezifische Screeningtests sind bei pri− mären Knochentumoren derzeit nicht aussagekräftig. Allgemeine Parameter wie Blutbild, BSR, CRP, Kalzium im Serum, alkalische Phosphatase, LDH und Gesamtei− weiß können Hinweise auf pathologische Befunde des lokalen Knochenumbaus, eine Entzündung oder eine systemische Komponente geben. Die alkalische Phos− phatase kann beim Osteosarkom erhöht sein. In diesen Fällen kann sie als Parameter unter der systemischen Therapie und in der Nachsorge herangezogen werden; bei der Gruppe der Ewing−Sarkome kann selbiges für die LDH gelten. n Histologische Diagnostik Besteht nach Erhebung der Anamnese, der klinischen Untersuchung und nach Abschluss der Bildgebung der Verdacht auf einen malignen Knochentumor oder Unklarheit über die Art und Dignität der knöchernen Läsion, ist eine Biopsie zwingend indiziert, um eine his− topathologische Untersuchung des Gewebes zu ermög− lichen. Hierbei setzt die Biopsie bereits eine interdis− ziplinäre Konzeption voraus. Mit dem Radiologen und Pathologen ist die Bildgebung zu besprechen und die Region der Biopsie festzulegen. Es ist die Möglichkeit der Schnellschnittdiagnostik durch einen entsprechend erfahrenen Pathologen vorzuhalten. Im intraoperativen Schnellschnitt ist mitzuteilen, ob repräsentatives Tumorgewebe vorliegt. Weiterhin müssen dem Ope− rateur die aktuellen Therapieoptimierungsstudien (EURAMOS−1, EURO−B.O.S.S., EURO−E.W.I.N.G.−99) be− kannt sein, um z. B. bei einem Tumor der Ewing−Sar− komgruppe Frischgewebe des Tumors für die moleku− largenetische Untersuchung zu asservieren und eine Beckenkammpunktion beidseits in gleicher Sitzung durchzuführen. Maligne Tumoren des muskuloskelettalen Systems Grundsätzlich wird bei der Biopsie zwischen geschlos− senen Verfahren (z. B. Stanzbiopsie) und offenen Ver− fahren (Inzisionsbiopsie) unterschieden. Bei der Pri− märdiagnostik eines primär malignen Knochentumors ist die offene Inzisionsbiopsie den geschlossenen Ver− fahren vorzuziehen. Die Vorteile einer repräsentativen Biopsie mit dem Ziel der präzisen Diagnosestellung und zügigen Therapieeinleitung liegen auf der Hand. " Cave. Eine fehlerhaft durchgeführte Biopsie kann im ungünstigsten Fall zu einer Amputation der betroffe− nen Extremität führen. Hier sind insbesondere falsche Schnittführungen und eine Tumorkontamination unbeteiligter Kompartmente zu erwähnen (Abb. 5). Klassifikation Während das Grading den Differenzierungsgrad eines malignen Tumors bestimmt, ist das Staging Grundvo− raussetzung für die Therapieplanung. Ist die Diagnose eines primär malignen Knochentumors bestätigt, sind folgende Untersuchungen erforderlich, wenn sie nicht schon vor der Biopsie durchgeführt worden sind: n CT des Thorax sowie bei beckennahen Tumoren CT des Beckens n MRT lokal sowie des betroffenen und des angren− zenden Kompartmentes n Ganzkörperknochenszintigrafie Die Stadieneinteilung erfolgt im deutschsprachigen Raum meist nach dem TNM−Schema der UICC (Tab. 1, 2 a, 2 b, 3). Ziel ist es, die lokale Tumorausdeh− nung exakt zu bestimmen und Fernmetastasen nach− zuweisen oder auszuschließen. Im klinischen Alltag wird meist zusätzlich das chirurgische Stagingsystem nach Enneking (Tab. 4) genutzt, da es z. B. nicht zwi− schen Lymphknoten− und Lungenmetastasen differen− ziert (ist für die Prognose und Therapie kaum relevant) und praktikabel ist. Abb. 5 n Vermeidbare Fehler bei der Biopsie. a Falsch gewählte, quer verlaufende Schnitt− führung bei einem Osteosarkom des distalen Femurs. b Falsch gewählte, transartikuläre und durch die Sehne des Rectus femoris ziehende Biopsie bei einem Osteosarkom des distalen Femurs. n n Therapie n Therapeutisches Konzept n Wird die Diagnose eine Osteosarkoms oder eines Tumors der Ewing−Sarkomgruppe gestellt, so werden die Patienten in standardisierten Therapieoptimie− rungsstudien behandelt, in denen die Erfahrungen der interdisziplinär abgestimmten Konzeption, insbeson− dere der systemischen Chemotherapie und der Strah− lentherapie (Gruppe der Ewing−Tumoren), fokussiert sind: Im Falle des Osteosarkoms erfolgt die Therapie bei Patienten bis einschließlich des 40. Lebensjahres im Rahmen der ersten transatlantischen Therapieopti− mierungsstudie, der ¹European and American Osteo− sarcoma Study Group“ (EURAMOS−1−Protokoll). Jenseits des 40. Lebensjahres werden die Patienten in der ¹EUROpean−Bone Over 40 Sarcoma Study“ (EURO−B.O.S.S.) therapiert, wobei neben dem Osteo− sarkom alle anderen hochmalignen Knochensarko− me (z. B. malignes fibröses Histiozytom) bis hin zum dedifferenzierten Chondrosarkom eingeschlossen werden können. Die meist jungen Patienten mit Tumoren der Ewing− Sarkomgruppe werden standardisiert im EURO− E.W.I.N.G.−99−Protokoll behandelt. " Eine Therapie außerhalb dieser Therapieoptimie− rungsstudien ist im Interesse der Patienten heute nicht mehr zu akzeptieren. Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 321 Systemerkrankungen 322 Tabelle 1 Tabelle 2 a TNM−Klassifikation der primär malignen Knochentumoren (UICC 2003). Gradingsystem (UICC 2003). Klassifikation Beschreibung TX Primärtumor kann nicht beurteilt werden T0 kein Primärtumor T1 Tumor £ 8 cm T2 Tumor > 8 cm T3 diskontinuierlich primär befallener Knochen NX regionale Lymphknoten können nicht beurteilt werden Grading Beschreibung GX histologisches Grading kann nicht beurteilt werden G1 hoch differenziert G2 mäßig differenziert G3 schlecht differenziert G4 undifferenziert Tabelle 2 b N0 keine regionalen Lymphknotenmetastasen N1 regionale Lymphknotenmetastasen TNM MX Vorhandensein von Fernmetastasen kann nicht beurteilt werden Zweistufiges System Dreistufiges System Vierstufiges System M0 keine Fernmetastasen niedriggradig G1 G1 G2 M1a Lungenmetastasen hochgradig M1b andere Fernmetastasen G2 G3 G3 G4 Varianten des histopathologischen Gradingsystems. Tabelle 3 Tabelle 4 Stadienklassifikation primär maligner Knochentumoren (UICC 2003). Chirurgisches Staging maligner Knochentumoren nach Enneking (1986). Stadium IA T1, N0, NX, M0, niedriggradig Staging Beschreibung Stadium IB T2, N0, NX, M0, niedriggradig IA niedriggradig, intrakompartmental Stadium IIA T1, N0, NX, M0, hochgradig IB niedriggradig, extrakompartmental Stadium IIB T2, N0, NX, M0, hochgradig IIA hochgradig, intrakompartmental Stadium III T3, N0, NX, M0, jeder Grad IIB hochgradig, extrakompartmental Stadium IVA jedes T, N0, NX, M1a, jeder Grad III jeder Grad, Metastasen Stadium IVB jedes T, N1, jedes M, jeder Grad jedes T jedes N, M1b, jeder Grad Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 Maligne Tumoren des muskuloskelettalen Systems In diesen Therapieoptimierungsstudien, insbesondere im EURAMOS−1− und EURO−E.W.I.N.G.−99−Protokoll, wird nach der Diagnosesicherung primär eine Induk− tionschemotherapie durchgeführt. Ziel ist es, ein lokales Tumoransprechen zu erreichen und gleichzeitig okkulte Metastasen/zirkulierende Tumorzellen zu devitalisie− ren. Nach einem mehrwöchigen Intervall folgt dann in der Regel die Resektion des Primärtumors. In Abhängig− keit vom Ansprechen (Tab. 5) auf die neoadjuvante Chemotherapie (bei Patienten mit hochmalignen Os− teosarkomen und der Gruppe der Ewing−Sarkome) und unter Berücksichtigung der Risikoeinschätzung (bei Patienten mit Tumoren der Ewing−Sarkomgruppe) ist postoperativ, also adjuvant, eine Stratifizierung der systemischen Chemotherapie in verschiedenen Thera− piearmen obligat. n Tabelle 5 Histologische Regressionsgrade von Knochentumoren nach Chemotherapie nach Salzer−Kuntschik (1983). Regressionsgrad Effekt I keine vitalen Tumorzellen Responder II einzelne vitale Tumorzellen oder eine vitale Tumorinsel < 0,5 cm Responder III weniger als 10 % vitales Tumorgewebe Responder IV 10 ± 50 % vitales Tumorgewebe Non−Responder V mehr als 50 % vitales Tumorgewebe Non−Responder VI kein Effekt der Chemotherapie Non−Responder Patientenaufklärung Diese Aufgabe hat in der Behandlung der meist jungen Patienten einen sehr wichtigen Stellenwert. Bei extre− mitätenerhaltenden Operationsverfahren, insbesondere der Tumorendoprothetik, müssen die Patienten als auch die Eltern darüber aufgeklärt werden, dass es sich um kein dauerhaftes Rekonstruktionsverfahren handelt. Revisionen werden nach Heilung der Erkrankung auf− treten und ein Wechsel der Tumorendoprothese ist nicht beliebig oft durchführbar. Komplikationen wie Infektionen, Ermüdungsbrüche, Verschleiß, Lockerung treten häufig auf. Ebenso kann im Verlauf bei noch nicht ausgewachsenen Patienten eine Beinlängendifferenz resultieren. Die Belastungsfähigkeit der betroffenen Körperregion bleibt in der Regel dauerhaft einge− schränkt, sodass Limitationen z. B. bei der sportlichen Betätigung resultieren können. Noch wesentlich anspruchsvoller ist die Aufklärung im Falle einer nicht zu vermeidenden Amputation, sei es unter kurativer oder palliativer Intention. Hier müssen der Patient und die Angehörigen frühzeitig in diesen Bewältigungsprozess einbezogen werden. Nur so bleibt die Zeit, die Entscheidung zu verarbeiten, zu akzeptie− ren, für die Zukunft zu planen und sein Umfeld darauf vorzubereiten. Diese Phase kann hilfreich durch aus− führliche Informations− und Aufklärungsgespräche un− ter Einbeziehung des psychosozialen Dienstes, ggf. der Orthopädietechnik und Kontakte zu bereits amputier− ten Patienten unterstützt werden. Keinesfalls sollte bei der primären Diagnosestellung ein Extremitätenerhalt zu optimistisch favorisiert werden, um im Falle einer dann doch notwendigen Amputation, z. B. aufgrund ei− nes Tumorprogresses unter der neoadjuvanten Chemo− therapie oder einer pathologischen Fraktur, das Ver− trauen in die Behandlung und die behandelnde Klinik nicht zu verlieren. Tabelle 6 Chirurgische Resektionsgrenzen nach Enneking. n Typ Resektionsebene intraläsional in der Läsion marginal in der reaktiven Zone extrakapsulär weit außerhalb der reaktiven Zone im gesunden Gewebe radikal außerhalb des Kompartmentes Operative Therapie Die operative Therapie maligner Knochentumoren wird von den Faktoren Entität, Grading, Ausdehnung und Lokalisation, anderseits auch von generellen Faktoren wie z. B. dem Vorhandensein einer Metastasierung, dem Alter des Patienten, seinem Allgemeinzustand und der Prognose bestimmt. Grundsätzlich wird ein kurativer Ansatz bei Osteosarkomen und Sarkomen der Ewing− Gruppe selbst im Fall einer bereits vorhandenen Metas− tasierung angestrebt. Das Ziel ist die Entfernung des primär malignen Knochentumors im Gesunden, d. h. die R0−Resektion. In den meisten Fällen wird eine weite, seltener eine radikale Resektion durchgeführt. Margi− nale und intraläsionale Resektionen sind bei primär malignen Knochentumoren aufgrund der resultieren− den hohen Rezidivrate inadäquat (Tab. 6). Um eine weite/radikale Resektion realisieren zu können, ist eine optimierte präoperative Planung der Resektion als auch der Rekonstruktion des resultieren− den Defektes erforderlich. Für diese Planung bleibt dem operativen Team meist ein zeitliches Intervall von mehr als 10 Wochen, der Phase der neoadjuvanten Therapie Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 323 Systemerkrankungen Abb. 6 n Osteosarkom der linken proxi− malen Tibia. a Röntgenologi− sche Darstellung. b Demonstration des Präparates. Die Resektion er− folgte nach Ab− schluss der neo− adjuvanten Poly− chemotherapie. c Intraoperativer Situs nach Implantation einer Tumorendoprothese ¹proximaler Tibiaersatz“. Funktionelle Rekonstruktion des Streckapparates des Kniegelenkes mittels eines Anbindungsschlauches sowie eines medialen Gastrocnemius−Flaps, der ventralisiert und mit dem Lig. patellae am Anbin− dungsschlauch fixiert wird. Postoperativ darf die Beugung im Kniegelenk erst nach 4 ± 6 Wochen geübt werden. d Postoperatives Ergebnis im Rönt− genbild. entsprechend. Hier kann abgewogen werden, ob in Ab− hängigkeit von der Tumorlokalisation, der Tumorgröße, dem Patientenalter, dem Ansprechen auf die neoadju− vante Chemotherapie, der Prognose und nicht zuletzt der Compliance des Patienten die Rekonstruktion mit− tels Tumorendoprothesen, Allografts, den verschiede− nen Möglichkeiten der biologischen Verfahren oder in seltenen Fällen doch eine Amputation mit dem Ziel der lokalen Tumorkontrolle indiziert ist. Derzeit können in den entsprechenden Zentren (siehe Verzeichnis des Operationspanels des EURAMOS−1−Protokolls) mehr 324 Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 als 85 % der Patienten extremitätenerhaltend operiert werden. " Die Indikation zur Amputation sollte erst nach Ein− holung einer Zweitmeinung erfolgen, insbesondere um den betroffenen Patienten die Sicherheit zu geben, dass diese Empfehlung korrekt ist. Die Indikation zur Ampu− tation ist dann kein Versagen der Therapie oder ein Un− vermögen des Operateurs, sondern eine reelle Chance auf eine Heilung der malignen Erkrankung im Prozess der multimodalen Therapie. Maligne Tumoren des muskuloskelettalen Systems e Klinisches Bild mit einem guten funktionellen Er− gebnis. Weite Resektion Diese Strategie gilt als Standard der operativen Therapie maligner Knochentumoren. Eine Schicht gesunden Ge− webes muss den Tumor allseits bedecken. Der Biopsie− kanal wird inklusive der Redon−Austrittsstelle ge− schlossen mitreseziert. Im Bereich des spongiösen Knochens ist eine Sicherheitszone von maximal 3 cm gesunden Gewebes ausreichend. Über die Beutung der offenen Wachstumsfuge als sichere Grenze bzw. den Abstand zu ihr gibt es keinen Konsens. Wissenschaftlich validierte Daten, die exakt einen onkologisch erforder− lichen Sicherheitsabstand definieren können, fehlen weitgehend. Dementsprechend ist die R0−Resektion das Ziel der operativen Therapie von Tumoren des musku− loskelettalen Systems. Radikale Resektion Diese Form der operativen Therapie bei Knochentumo− ren ist heutzutage aufgrund der präzisen Bildgebung nur selten indiziert. Die radikale Resektion wäre z. B. die Resektion eines Osteosarkoms des distalen Femurs un− ter Mitnahme des gesamten Femurs. Amputationen In den letzten 2 Jahrzehnten ist die Zahl der Amputa− tionen deutlich gesunken, hat jetzt jedoch eine Plateau− phase erreicht. Mögliche Indikationen zur Amputation: n ausgedehnte Sarkome mit Infiltration von Gelenk− strukturen und des Gefäß−Nerven−Bündels n exulzerierte Tumoren n Progression unter neoadjuvanter Therapie n eine pathologische Fraktur n seltene distale Tumorlokalisationen Gerade im Bereich des Unterschenkels sind die Funktion und die Lebensqualität nach einer Amputation ver− gleichbar mit einem Zustand nach einer aufwendigen Rekonstruktion. Rekonstruktive Verfahren Bei primär malignen Knochentumoren resultiert in Abhängigkeit von der Tumorlokalisation die Notwen− digkeit zur Rekonstruktion des resezierten Skelettab− schnittes. Ausnahmen können Tumormanifestationen der proximalen Fibula, der Skapula, der Thoraxwand und partiell des Beckens sein, die keiner ossären Rekonstruktion bedürfen. Insbesondere im Bereich der statisch belasteten Extremitäten ist auf eine Defekt− rekonstruktion meist nicht zu verzichten. Stellenwert der Tumorendoprothetik. Die Tumorendo− prothetik wird auch zukünftig bei der Rekonstruktion gelenknaher Defekte nach Resektion primär maligner Knochentumoren dominieren. Die 5− bzw. 10−Jahres− Standzeiten von Tumorendoprothesen liegen bei 67 ± 87 % resp. 55 ± 71 %. Da es sich überwiegend um junge Patienten handelt, sind Revisionseingriffe bei anhaltender Tumorfreiheit eine unerwünschte und nicht zu vermeidende Folge. Insbesondere Infektionen, Lockerungen, Verschleiß der Gelenkkomponenten und Ermüdungsbrüche sind Anlass zur Revision bzw. zum Wechseleingriff. Jeder Wechseleingriff erhöht das Risiko einer neuen Komplikation, sodass als ultima ratio der Verlust der betroffenen Extremität drohen kann. Dieses Problem ist den jungen Patienten bewusst. Der Vorteil der Tumorendoprothetik liegt in der hohen Primärstabilität und guten Funktionalität. Die Fixation der verbliebenen Band− und Muskelstrukturen an der Endoprothese wird unter Anwendung eines sog. Anbin− dungsschlauches und einer myoplastischen Rekons− truktion angestrebt (Abb. 6). Es können ossäre Defekte Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 325 Systemerkrankungen Abb. 7 n Hochmalignes Osteosarkom der rechten proximalen Tibia. a Röntgenbild. b Demonstration des Allografts (vor dem Zuschnitt) und des Resektates. c Postoperatives Röntgenbild nach Rekonstruktion der proximalen Tibia mit einem osteoartikulärem Allograft. nicht zu umgehen ist und nicht selten vom Kind selbst gefordert wird. des Humerus, des Femurs, der Tibia und partiell des Beckens endoprothetisch rekonstruiert werden. Die besten funktionellen Ergebnisse werden mit der Im− plantation eines distalen Femurersatzes, gefolgt vom proximalen Tibiaersatz erzielt. Limitationen der endo− prothetischen Rekonstruktionsmöglichkeiten liegen insbesondere im Patientenalter. Gerade bei Kindern ist trotz einiger ermutigender Ergebnisse nach Implanta− tion von Tumorendoprothesen, sog. ¹Wachstumsendo− prothesen“, die Indikation stets kritisch und keinesfalls zu großzügig zu stellen. Unter einem Patientenalter von 8 Jahren ist eher Zurückhaltung angezeigt. Hier ist im Bereich der unteren Extremität die Umkehrplastik eine solide und dauerhafte Alternative, die dem Kind mehr nutzt als die spätere Enttäuschung der Eltern, wenn in− folge von Komplikationen (Infektion, Beinverkürzung, stets wiederkehrende Hospitalisierung) die Amputation 326 Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 Stellenwert des Allografts. Der Vorteil der Allografts liegt in der Konzeption, einen Skelettabschnitt, insbesondere im Bereich der Extremitäten, anatomisch gerecht mit einem autoklavierten Fremdknochen (Abb. 7), ggf. in Kombination mit einer Endoprothese (Composite−Allo− graft), zu rekonstruieren und die Möglichkeit der Rein− tegration des Transplantates, sowohl ossär als auch in den Weichteilen, zu nutzen. Zum Ende der Tumorresek− tion wird das Allograft in einer Ringerlaktat−Lösung (60 8C) aufgetaut, präpariert und zugeschnitten. An− schließend wird das Allograft in den resultierenden De− fekt eingepasst, der Kapsel−Band−Apparat rekonstruiert und mit einer Osteosynthese stabilisiert. Nach einer mehrwöchigen Immobilisierung im Gipsverband er− folgt der stetige Belastungsaufbau in Abhängigkeit vom röntgenologischen Ergebnis. Beim Versagen dieses Re− konstruktionsverfahrens bleibt als Alternative die Im− plantation einer Tumorendoprothese bestehen. Primär hohe Komplikationsraten wie Infektionen (11 %), Frak− turen (19 %), Pseudarthrosen (35 %), die fehlende primä− re Belastungsstabilität und das begrenzte Angebot aus entsprechenden Knochenbanken führte im deutsch− Maligne Tumoren des muskuloskelettalen Systems Abb. 8 n a Postoperatives Röntgenbild eines 10−jährigen Mädchens nach Resektion eines Ewing−Sarkoms der linken distalen Tibia (und Z.n. neoadjuvanter Chemotherapie im Rahmen des EURO−E.W.I.N.G.−99−Protokolls). Der knöcherne Defekt wurde im Sinne einer biologischen Rekonstruktion mit einem bilateralen Fibulainterponat rekons− truiert. Das ipsilaterale Transplantat wurde eingeschwenkt, das kontralaterale als freies, gefäßgestieltes Fibulatransplantat und mit einer Osteosynthese stabilisiert. b Bereits 4 Monate postoperativ ist eine beginnende knöcherne Einheilung röntgenmorphologisch nachzuweisen. c Röntgenbild 12 Monate postoperativ mit gutem Rekonstruktionsergebnis. Die Vollbelastung des Beines wurde nach Abschluss des 8. postoperativen Monats freigegeben. sprachigen Raum zu einer eher seltenen klinischen An− wendung. Stellenwert der biologischen Rekonstruktionen. Biologi− sche Rekonstruktionen ossärer Defekte erheben den Anspruch einer dauerhaften Versorgung. Unilaterale gefäßgestielte als auch nichtgefäßgestielte Fibulatrans− planate werden für die verschiedensten Rekonstruktio− nen der oberen und unteren Extremität verwandt. Der Vorteil der gefäßgestielten Implantate wurde tierexpe− rimentell und anhand klinischer Studien eindeutig nachgewiesen. An der unteren Extremität wird unter funktionellen Aspekten eine frühzeitige Belastungssta− bilität angestrebt. Die Fibula kann dementsprechend als unilaterales Transplantat zur Rekonstruktion der langen Röhrenknochen der unteren Extremität diese Aufgabe nur bedingt oder erst nach einem langen zeitlichen In− tervall, in dem eine Hypertrophie des unilateralen Fi− bulatransplantates eingetreten ist, erfüllen. Je jünger die Patienten sind, desto schneller ist das ossäre Remo− deling zu erwarten. Bei malignen Tumoren der Tibia kann daher bei jungen Patienten die ipsilaterale Fibula als ¹Fibula pro Tibia“ für die Rekonstruktion ausrei− chend sein, da eine Hypertrophie des Fibulainterpona− tes zu erwarten ist. Im unmittelbar postoperativen Ver− lauf ist eine längerfristige Entlastung bzw. Teilbelastung des betroffenen Beines in Kauf zu nehmen. Dieser nicht zu umgehende Kompromiss kann weitere Komplikatio− nen wie die muskuläre Insuffizienz, Demineralisierung des originären Knochens als auch des Transplantates und pathologische Frakturen nach sich ziehen. Neben dem Manteltransplantat, das eine Kombina− tion aus einem autologen Fibulatransplantat und einem Allograft darstellt, kann auch ohne ein körperfremdes Implantat eine Verbesserung der Primärstabilität und damit eine Verkürzung der Rekonvaleszenz durch ein bilaterales Fibulatransplantat (Fibula pro Tibia + freies Fibulainterponat der kontralateralen Seite für tibiale Defekte oder bilaterales freies Interponat für femorale Defekte) erreicht werden. Dieses Rekonstruktionsver− fahren ist im Vergleich zur Tumorendoprothetik und dem unilateralen Fibulainterponat operationstechnisch aufwendiger. Im Bereich der Tibia wird die unilaterale Fibula in den ossären Defekt eingeschwenkt, sodass nur die Gefäße der kontralateralen Fibula mikrochirurgisch anastomosiert werden müssen (Abb. 8). Bei der Re− konstruktion von femoralen Defekten kann mittels ei− nes bilateralen freien Fibulainterponates die primäre Stabilität erhöht und der Belastungsaufbau beschleu− nigt werden. Die Osteosynthese gewährleistet eine pri− märe Übungsstabilität, bei winkelstabilen Implantaten auch eine partielle Belastungsfähigkeit. Unter Berück− Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 327 Systemerkrankungen Der Belastungsaufbau wird in Abhängigkeit von der knöchernen Reintegration des Fibulatransplantates in− dividuell vorgenommen. Eine Limitation des bilateralen Fibulainterponates wird einerseits durch die Lokalisa− tion des Tumors und andererseits durch die Ausdeh− nung desselben vorgenommen. Für die bilaterale Fibu− lainterposition sind Tumorlokalisationen in der Diaphyse und im metadiaphysären Übergang der lan− gen Röhrenknochen der unteren Extremität zu favori− sieren. Bei ossären Defekten von weniger als 10 cm im Bereich der Metadiaphysen der langen Röhrenknochen der unteren Extremität kann bei Jugendlichen und Er− wachsenen neben der Defektrekonstruktion mittels der unilateralen Fibulainterposition, dem Manteltransplan− tat und der Tumorendoprothetik auch die sog. ¹double barrel fibula“ zur Anwendung kommen. Wenn immer möglich, sind biologische Rekonstruk− tionen ossärer Defekte anzustreben. Im Bereich der oberen Extremität kann ein unilaterales, gefäßgestieltes Fibulainterponat für die Ulna, den Radius als auch den Humerus genutzt werden. Ein spezielles Verfahren bei kleinen, proximalen Humerustumoren stellt das Re− konstruktionsverfahren ¹Clavicula pro Humeri“ dar. Hier wird die Klavikula in den resultierenden Defekt eingeschwenkt und mit einer speziellen Plattenosteo− synthese fixiert. Pseudarthrosen werden nicht selten beobachtet. Weitere Operationstechniken der biologischen Rekonstruktion sind n die Hüftverschiebeplastik, n der Tibiaspan, n der Beckenspan (ggf. gefäßgestielt). Abb. 9 n a Klinisches Ergebnis nach Umkehrplastik (Typ IA) eines 8−jährigen Jungen aufgrund eines Osteosarkoms des linken distalen Femurs ohne Prothese. Das linke Sprunggelenk (um 1808 gedrehter Unterschenkel) befindet sich in Höhe des rechten Kniegelenkes. Vorausset− zung für diese OP−Technik ist der Erhalt des N. ischiadicus, um die Funktion im Sprunggelenk als ¹Neo−Kniegelenk“ ermöglichen zu können. b Klinisches Ergebnis mit angelegter Prothese (1 Jahr postoperativ), funktionell und kosmetisch akzeptabel. Es handelt sich in der Regel um eine einmalige Operation mit einem dauerhaften Rekonstruktionsergebnis und geringer Komplikationsrate. sichtigung der Tatsache, dass die Patienten im Rahmen der Therapieoptimierungsstudien eine postoperative Chemotherapie erhalten (bei der Gruppe der Ewing− Sarkome ggf. zusätzlich Radiotherapie), ist eine innere Fixierung (Plattenosteosynthese, Kirschner−Draht usw.) einem Fixateur externe vorzuziehen. Das Ziel besteht in der Reduktion des Infektionsrisikos in den Phasen der Panzytopenie. Ein weiterer Grund für die innere Fixie− rung ist in der nicht generell notwendigen Entfernung des Osteosynthesematerials zu sehen. 328 Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 Modifizierte Amputationen. Modifizierte Amputationen wie die Umkehrplastik haben vor allem im Kindesalter ihren festen Stellenwert im orthopädisch−onkologi− schen Operationsspektrum. Bei dieser Technik wird unter Erhalt des N. ischiadicus der tumortragende Ex− tremitätenabschnitt reseziert. Danach wird der Unter− schenkel um 1808 gedreht und je nach Resektionstyp (Winkelmann 1993) am Femur oder am Becken fixiert (Abb. 9). Es handelt sich hier um eine sinnvolle Alterna− tive zur Amputation mit einem deutlich besseren funk− tionellen Outcome als dauerhaftes Rekonstruktionser− gebnis. Der Nachteil liegt im kosmetischen Ergebnis, der mehr für die Eltern als für die jungen Patienten im Vor− dergrund steht. Ziele der Kinder sind Funktionalität, n Sicherheit, n Dauerhaftigkeit, n möglichst wenig Krankenhausaufenthalte. n Maligne Tumoren des muskuloskelettalen Systems Zu dieser Gruppe der operativen Techniken, die zu einer Verkürzung der betroffenen Extremität führen, kann auch die Resektion nach Tikhoff−Linberg gezählt wer− den. Bei schultergelenküberschreitenden Tumoren unter Einbeziehung von proximalem Humerus und der Skapula kann bei Erhalt des Gefäß−Nerven−Bündels nach der Resektion des tumortragenden Areals der ver− kürzte Arm am Rumpf refixiert werden. Vorteile sind der Erhalt der Ellenbogen− und insbesondere der Hand− funktion. Abb. 10 n Silberbeschich− tetes Implantat ¹distaler Tibia− ersatz“ mit dem Ziel der Infekt− prävention. a Intraoperative Darstellung. b Postoperatives Röntgenbild. Nachsorge Die Nachsorge von Patienten mit Osteosarkomen und der Gruppe der Ewing−Tumoren wird entsprechend der Empfehlungen der Therapieoptimierungsstudien vor− genommen. Neben der lokalen und systemischen Tu− mor−Kontrolle sind zunehmend auch Aspekte des funk− tionellen Outcome, der Lebensqualität, der Häufigkeit von Sekundärmalignomen und therapiebedingter Langzeitkomplikationen (z. B. Schwerhörigkeit, Herz− insuffizienz, Niereninsuffizienz) in den Mittelpunkt des klinischen Interesses der meist jungen Patienten getreten. Komplikationen und Komplikationsmanage− ment nach Tumorendoprothesen In der orthopädischen Tumorchirurgie gelten die glei− chen postoperativen Regeln wie in der Standardendo− prothetik. Neben der medikamentösen und physiothe− rapeutischen Thromboseprophylaxe sollten die peri− und postoperative Infektprophylaxe nach Tumorresek− tionen und anschließender Rekonstruktion für 3 ± 7 Tage appliziert werden. Drainagen im Bereich von Tumorendoprothesen sollten am 3. ± 5. Tag entfernt und nachfolgende Serome unter sterilen Bedingungen punktiert werden. Die Gründe für die erhöhte Kom− plikationsrate nach Implantation von Tumorendopro− thesen liegen in n der Immunsuppression während der Chemotherapie, n der oft nur geringen Weichteildeckung nach ausge− dehnten Resektionen, n dem vielfach fehlenden Bandapparat, n der erhöhten Beanspruchung aufgrund des oftmals jugendlichen Alters der Patienten. Die am schwierigsten zu behandelnde Komplikation ist die Infektion. Bei Tumorendoprothesen im Bereich des Kniegelenkes liegen die Infektionsraten bei fast 18 %, während aseptische Lockerungen noch häufiger auftre− ten. Bei Frühinfektionen wird der Versuch unternom− men, durch eine (ggf. wiederholte) Jet−Lavage sowie ei− ner kalkulierten Antibiose die Endoprothese in situ zu belassen. Bei Spätinfektionen führt dieses Vorgehen nicht zum Erfolg. Hier sind in der Regel die komplette Entfernung der Endoprothese inklusive eines sorgfälti− gen DØbridements notwendig, um zweizeitig nach Aus− heilung des Infektes eine erneute Endoprothesenim− plantation anstreben zu können. Gerade in diesen Situationen sowie bei schlechter Weichgewebedeckung wie im Bereich der distalen Tibia scheint sich die An− wendung von silberbeschichteten Implantaten zuneh− mend zu bewähren (Abb. 10). Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 329 Systemerkrankungen 330 Prognose Perspektiven Die Prognose der primär malignen Knochentumore, insbesondere des Osteosarkoms und der Gruppe der Ewing−Sarkome, hat sich nach Einführung der systemi− schen Chemotherapie und dank der kontinuierlichen Arbeit der pädiatrischen und medizinischen Onkologen deutlich verbessert. Konnte Ende der 70er−Jahre nur kasuistisch über die Heilung eines Patienten mit einem Osteosarkom nach sofortiger Amputation berichtet werden, so ist derzeit im Rahmen der Therapieoptimierungsstudien ein 5−Jahres−Überleben beim lokalisierten, hochmalignen Osteosarkom der Extremitäten im Alter bis 40 Jahre von 71,2 % zu erreichen. Die wichtigsten prognostischen Faktoren sind hierbei das Ansprechen auf die neoadju− vante Chemotherapie, das Tumorvolumen, das Lokal− rezidiv und damit einhergehend die Metastasierung. Ausschließlich hoch differenzierte (G1) Osteosarkome werden alleinig operativ behandelt. Bei den Patienten der Gruppe der Ewing−Sarkome ist die Prognose trotz eines ebenfalls multimodalen Therapiekonzeptes etwas schlechter. Die Tumoren der Ewing−Gruppe sind ausnahmslos per definitionem hochmaligne (G4) und als Systemerkrankung zu wer− ten. Das entspricht auch der Kenntnis, dass ein Patient mit einem Ewing−Sarkom mit einer alleinigen Opera− tion nicht heilbar ist. Das 5−Jahres−Überleben liegt im Rahmen der Therapieoptimierungsstudie (EURO− E.W.I.N.G.−99−Protokoll) bei 60 % im primär nicht (nachweisbar) metastasierten Stadium der Erkrankung. Der Stellenwert der systemischen Chemotherapie und der Strahlentherapie steht in dieser Konzeption außer Frage. In neueren Untersuchungen konnte aufgezeigt werden, dass die Resektion des Primärtumors (meist in Kombination mit der Strahlentherapie) mit einer Ver− besserung des Überlebens im Vergleich zur alleinigen Strahlentherapie des Primärtumors um etwa 10 % ein− hergeht. Dementsprechend ist, wenn operationstech− nisch möglich, die R0−Resektion stets anzustreben. Bei Patienten mit einem Chondrosarkom variiert die Prognose stark in Abhängigkeit vom Grading. So liegt die 5−Jahres−Überlebensrate bei G1−Tumoren über 90 % und beim dedifferenzierten Chondrosarkom deutlich unter 20 %. Gerade hier wird der Stellenwert der Che− motherapie, trotz des meist höheren Patientenalters, im Rahmen des Therapieprotokolls für Patienten mit hochmalignen Knochentumoren nach dem 40. Lebens− jahr (EURO−B.O.S.S.) im Verlauf der nächsten Jahre ab− zuwarten sein. Während die Chemotherapie bei Patienten mit Osteo− sarkomen und der Gruppe der Ewing−Sarkome die Überlebensrate deutlich steigern konnte, sind bisher für Chordome und Chondrosarkome (außer dedifferen− zierte Chondrosarkome ± EURO−B.O.S.S.) keine syste− mischen Therapiekonzepte etabliert. Aufgrund der Sel− tenheit dieser Tumoren können diese Fragestellungen nur in multizentrischen Studien evaluiert werden. Ge− rade beim Chordom ist der Stellenwert der systemi− schen Chemotherapie (insbesondere Methotrexat) und der Therapie mit Imatinib Gegenstand aktueller und zukünftiger Studien. Die Positronenemissionstomografie (PET) ist bei pri− mär malignen Knochentumoren sowohl bei der primä− ren Diagnostik, bei der Evaluation des Ansprechens auf eine neoadjuvante Therapie als auch der Verlaufskon− trolle nur in klinischen Studien gerechtfertigt. Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 Weichgewebesarkome Epidemiologie Weichgewebesarkome sind mit einer Inzidenz von 2 ± 3 Neuerkrankungen pro 100 000 Einwohnern und Jahr selten und machen 1 ± 2 % aller malignen Neoplasien im Erwachsenenalter aus. In Deutschland sind etwa 2500 Neuerkrankungen im Erwachsenenalter pro Jahr zu erwarten. Der Erkrankungsgipfel liegt in der zweiten Lebenshälfte und Frauen erkranken etwas häufiger als Männer. Am häufigsten tritt das Weichgewebesarkom im Bereich der unteren Extremität (ca. 45 %), gefolgt von der oberen Extremität (15 %), dem Stamm und dem Re− troperitoneum auf. 2/3 der Tumoren sind extrakompart− mental und 1/3 intrakompartmental lokalisiert (Campa− nacci 1990). Weichgewebesarkome stellen eine sehr heterogene Gruppe von malignen Tumoren dar. Sie schließen alle Tumoren des nichtepithelialen Gewebes (Muskulatur, Fettgewebe, Bindegewebe, Gefäße usw.) ein. Etwa 50 verschiedene Entitäten können immun− histologisch differenziert werden. Das Liposarkom ist der häufigste Vertreter mit mehr als 20 %. Die Ätiologie der Weichgewebesarkome ist weitgehend unbekannt. Zum Zeitpunkt der primären Diagnostik weisen etwa 30 % der Patienten ein Stadium I (UICC 2003), 30 % ein Stadium II, 20 % ein Stadium III und 20 % ein Stadium IV auf. Maligne Tumoren des muskuloskelettalen Systems Diagnostik n Klinik Das häufigste primäre Symptom eines Weichgewebe− sarkoms der Extremitäten ist die indolente Schwellung. Schmerzen und eine resultierende Funktionseinschrän− kung sind meist erst infolge einer ausgedehnten Tumor− manifestation zu beobachten. Dementsprechend wer− den auch heute nicht selten Primärtumore in einer maximalen Ausdehnung von mehr als 30 cm diagnosti− ziert. Im Bereich des Retroperitoneums, des Abdomens und des Thorax können die Symptome stark variieren und sind meist unspezifisch, sodass diagnostische und insbesondere therapeutische Fehleinschätzungen auftreten, die zu einer Verzögerung einer adäquaten Behandlung führen können. Da die Ursachen einer Schwellung vielfältig sind, wird häufig nicht an die Dif− ferenzialdiagnose eines Weichgewebesarkoms gedacht. Folgen sind ungeplante Operationen von Weichgewebe− sarkomen unter der Verdachtsdiagnose Lipom, Fibrom oder posttraumatisches Hämatom, die eine Therapie− verzögerung und im ungünstigen Fall eine Verschlech− terung der Prognose nach sich ziehen können. " Häufigstes primäres Symptom: indolente Schwellung. Hintergrund Diagnostische Kaskade. n n n Anamnese körperliche Untersuchung Sonografie n n MRT Histologie grenzung zu Nachbarstrukturen (glatt begrenzt, infil− trativ wachsend), die Binnenstruktur (zystisch, solide, gemischt) und den regionalen Lymphknotenstatus dar− zustellen. Weitere Vorteile bestehen in der Wiederhol− barkeit der Untersuchung und damit der exakten Ver− laufsbeurteilung. MRT. Die MRT ist derzeit die sensitivste Untersu− chungsmethode bei der Beurteilung eines Weichgewe− betumors. Sie ermöglicht im Vergleich zur CT eine deutlich detailgenauere und kontrastreichere Darstel− lung der Weichteile. So können mit der MRT einzelne Muskelgruppen sowie Gefäß− und Nervenstränge abge− grenzt werden, sodass präoperativ eine genauere Zu− ordnung der extra− und intrakompartmentalen Aus− breitung ermöglicht wird. Des Weiteren kann durch die freie Wahl der Abbildungsebenen in der MRT die Tu− morausbreitung in allen Raumebenen beurteilt werden. Die Heterogenität der Weichteilsarkome kann anhand kontrastmittelgestützter Aufnahmen sicher beurteilt werden. Grundsätzlich sollte die MRT mit einer für die Körperregion geeigneten Oberflächenspule zur besse− ren Auflösung durchgeführt werden. Insbesondere für den Ober− und Unterarm sowie den Unterschenkel soll− ten flexible Oberflächenspulen gewählt werden. Das Untersuchungsprotokoll sollte neben nativen T1− und T2−Sequenzen auch T1−Sequenzen nach intravenöser Kontrastmittelapplikation beinhalten, entsprechend der Leitlinien der Bundesärztekammer und der EORTC. PET. Die Positronenemissionstomografie (PET) als funk− tionell−metabolische Bildgebung hat derzeit außerhalb von klinischen Studien keine Relevanz. n Die Erhebung der Anamnese und die körperliche Unter− suchung stellen einen Eckpfeiler des diagnostischen Algorithmus dar. Sind die folgenden 5 Kriterien n Alter des Patienten > 50 Jahre, n Tumorgröße > 8 cm, n schnelle Größenprogression, n Schmerzen, n tiefe subfasziale Lokalisation erfüllt, so ist die Wahrscheinlichkeit, dass es sich um ein Weichgewebesarkom handelt, sehr hoch. n Histologische Diagnostik Nach Abschluss der klinischen und bildgebenden Diag− nostik erfolgt bei dem Verdacht auf einen malignen Weichgewebetumor obligat die histologische Siche− rung. Ausschließlich kleine (< 3 cm) und oberflächlich lokalisierte Tumoren können primär ohne funktionelle Einschränkungen weit reseziert werden. Alle anderen Tumoren werden primär bioptiert. Die Biopsie setzt be− reits ein interdisziplinäres Konzept voraus. Feinnadel− biopsien führen zu einer korrekten Diagnose (Typisie− rung und Grading) in 72 %, Stanzbiopsien in 91 % und die offene Biopsie in etwa 98 %. Bildgebende Verfahren Sonografie. Die Sonografie ist eine schnell durchführba− re und hoch effektive Untersuchungsmethode bei der Beurteilung einer Weichgewebeschwellung und sollte der klinischen Untersuchung unmittelbar folgen. Sie ist in der Lage, die Größe der Läsion, die Lokalisation (tief, oberflächlich, Kompartmentzugehörigkeit), die Ab− Die offene Biopsie bietet mehrere Vorteile: n Sie ist am ergiebigsten hinsichtlich des gewonnenen Tumorvolumens und ermöglicht neben der intra− operativen Schnellschnittdiagnostik auch die Asser− vierung von Gewebe für die Tumorbank (molekular− genetische Diagnostik). Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 331 Systemerkrankungen Tabelle 7 TNM−Klassifikation der Weichgewebesarkome (UICC 2003). Abb. 11 n Klinischer Befund einer falsch durchgeführten Inzisionsbiopsie bei einem Liposarkom des linken Oberschenkels, proximal−ventral. Der Hautschnitt ist zu lang, die Redon−Drainagen sind zu weit vom Hautschnitt ausgeleitet worden, sodass der gesamte ventrale Oberschenkel als tumorkontaminiert anzusehen ist. Vor der Biopsie erfolgte zudem keine bildgebende Diagnostik. Der operative Eingriff wurde unter der Verdachtsdiagnose eines Hämatoms durchgeführt. n n Die Schnellschnittdiagnostik gibt vor allem darüber Auskunft, ob repräsentatives Tumorgewebe vorhan− den ist, sodass letztendlich eine exakte Diagnostik in fast 100 % der Fälle resultiert. Weiterhin kann die Schnellschnittpathologie in den meisten Fällen die Frage beantworten, ob es sich um ein Sarkom, Karzinom, Lymphom oder einen inflam− matorischen Prozess handelt. Der Nachteil der offenen Biopsie liegt definitionsgemäß in der Invasivität des Verfahrens begründet. Die Biopsie ist von dem onkologischen Chirurgen/Orthopäden so zu planen, dass der Tumor auf dem kürzesten Weg erreicht und die definitive Tumorresektion nicht behin− dert wird. Offene Biopsien werden an den Extremitäten ohne Ausnahme mit einem längs verlaufenden Haut− schnitt durchgeführt. Der Hautverschluss sollte intra− kutan erfolgen, die Einlage einer Wunddrainage im Schnittverlauf ist obligat. Bei Stanzbiopsien ist eine genaue anatomische Be− schreibung, besser eine Tätowierung vorzunehmen, damit bei der definitiven Tumorresektion, die ggf. erst nach einer neoadjuvanten Therapie vorgenommen wird, der Biopsiekanal im Resektat liegen kann. " Eine falsch durchgeführte Biopsie kann die definitive Resektion nicht nur erschweren, sie kann im ungünstigen Fall sogar einen mutilierenden operativen Eingriff bis hin zur Amputation initiieren (Abb. 11). 332 Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 Klassifikation Beschreibung TX Primärtumor kann nicht beurteilt werden T0 kein Primärtumor T1a Tumor £ 5,0 cm, oberflächlich T1b Tumor £ 5,0 cm, tief T2a Tumor > 5,0 cm, oberflächlich T2b Tumor > 5,0 cm, tief NX regionale Lymphknoten können nicht beurteilt werden N0 keine regionalen Lymphknotenmetastasen N1 regionale Lymphknotenmetastasen MX Vorhandensein von Fernmetastasen kann nicht beurteilt werden M0 keine Fernmetastasen M1 Fernmetastasen Tabelle 8 Stadien−Klassifikation (UICC 2003). Stadium I T1a, T1b, T2a, T2b, N0, M0, niedriggradig Stadium II T1a, T1b, T2a, N0, M0, hochgradig Stadium III T2b, N0, M0, hochgradig Stadium IV jedes T, N1, M0, jedes G jedes T, jedes N, M1, jedes G Klassifikation Erst nach Abschluss der Diagnostik können das Tumor− stadium (Tab. 7, 8) ermittelt und die therapeutischen Konsequenzen abgeleitet werden (Tunn 2004). Maligne Tumoren des muskuloskelettalen Systems Abb. 12 n Ausgedehnte Weichgewebe− schwellung des rechten Ober− schenkels im Bereich des M. quadriceps femoris. a Dokumentation des klinischen Befundes. Die Läsion ist laut Angabe des Patienten in einem Zeitraum von etwa einem Jahr gewachsen und führte erst in den letzten Wochen zu einem Spannungsgefühl im Oberschenkel. b In der MRT zeigt sich ein lipogener Tumor, nahezu komplett den M. qua− driceps femoris infiltrierend. Histologisch handelt es sich um ein Liposarkom. c Bei fehlendem Anhalt für eine Fernmetastasierung erfolgte die kom− partmentorientierte Resektion des M. quadriceps femoris rechts. Demonstration des Resektates. d Intraoperativer Status nach Durchführung einer Strecksehnenersatzplastik mittels einer Transposition des M. biceps femoris auf die Rektussehne. Trotz des plastisch−rekonstruktiven Verfahrens re− sultiert eine persistierende Funktionseinschränkung. Therapie n Therapeutisches Konzept Die chirurgische Therapie ist die Basis der lokalen Tu− morkontrolle bei Patienten, die an einem Weichgewe− besarkom erkrankt sind. Die Behandlungsstrategie wird vom Tumorstadium und der Lokalisation wesentlich bestimmt. Das definierte Ziel im Stadium I ± III ist die R0−Resek− tion. Die primär operative Therapie eines Weichgewe− besarkoms kann bei etwa 45 % der Patienten durchge− führt werden, ca. 35 % werden neoadjuvant therapiert und anschließend reseziert und ca. 20 % erhalten im primär metastasierten Stadium eine palliative systemi− sche Therapie. " Unter kurativer Zielstellung ist unabhängig vom Resektionsverfahren ausschließlich die R0−Situation anzustreben. Hintergrund Definition der Resektionen (R−Klassifikation). R0: Tumor ist makroskopisch und histologisch im Gesunden entfernt (Kompartmentresektion, weite Resektion, Amputation) R1: Tumor ist histologisch randbildend (marginale Resektion entlang der Pseudotumorkapsel) R2: intraläsionale Tumorresektion Intrakompartmental lokalisierte Weichgewebesarkome werden als Kompartmentresektion oder ± häufiger ± kompartmentorientiert operiert (Abb. 12). Die Resek− tion erfolgt stets unter Mitnahme des Biopsiekanals und der Drainageausleitung. Eine Kompartmentresektion, d. h. Resektion des Muskels/der Muskelgruppe vom Ursprung bis Ansatz, ist nur bei einer Tumorkontami− nation des gesamten Kompartmentes indiziert. Liegen Ursprung und Ansatz des Muskels weit vom Tumor entfernt, können sie erhalten bleiben und für die Re− konstruktion unter funktionellen Aspekten verwandt werden. Ein Benefit der Kompartmentresektion im Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 333 Systemerkrankungen sitiv zu beeinflussen ist. Der Anteil extremitätenerhal− tender Eingriffe ist unter Berücksichtigung der vorhan− denen multimodalen Therapieansätze mit deutlich mehr als 80 % zu realisieren. Plastisch−rekonstruktive Verfahren sind in mehr als 25 % der operativ therapier− ten Weichteilsarkome erforderlich. n Abb. 13 n Darstellung eines pleomorphen Weichgewebesarkoms des proximalen Unterschenkels in der MRT. Der Tumor ist im Beugekompartieent lokalisiert. Das Weichgewebesarkom ist von einem peritu− moralen Ödem umgeben. Die sog. Tumor− kapsel ist die aktive Wachstumsfront des Weichgewebesarkoms. Im peritumoralen Ödem sind in bis zu 2/3 der Fälle vitale Tumor− zellen nachweisbar. Hiermit ist die hohe Lokalrezidivrate nach marginaler/R1−Resek− tion zu erklären. Vergleich zur kompartmentorientierten Resektion ist unter onkologischen Gesichtspunkten nicht belegt. Extrakompartmental lokalisierte Weichgewebesarko− me werden weit reseziert. Auch hier ist ein Sicherheits− abstand von 2±3 cm gefordert, der jedoch häufig zur Faszie, zum Knochen und auch zu Gefäß− und Nerven− strukturen nicht realisiert werden kann und nicht realisiert werden muss. Unter Ausnutzung additiver Therapieverfahren kann durch die Mitresektion gesun− der Hüllschichten (z. B. Muskelfaszie, Periost, Knochen− lamelle, Epineurektomie, Gefäßadvetitia) eine R0− Resektion erreicht werden. Bislang gibt es keine eindeutig belegbare und kli− nisch nachvollziehbare Definition des Begriffes ¹weite Resektion“. Die Frage ist weniger, was ist ¹weit“, son− dern was ist onkologisch ¹sicher“. Für die Klinik ist der− zeit, unabhängig ob intra− oder extrakompartmentale Tumorlokalisation, die R−Klassifikation führend, um eine Vergleichbarkeit der Ergebnisse zu ermöglichen. Marginale (entlang der Pseudotumorkapsel) oder gar intraläsionale Resektionen sind onkologisch inadäquat und durch additive Therapieverfahren in der Regel nicht zu kompensieren (Abb. 13). Die Indikation zur Amputation, sowohl unter kurati− ver als auch palliativer Intention, ist nur nach Aus− schöpfung aller multimodalen Therapieoptionen und Einholung einer Zweitmeinung zu erwägen, da die Prognose durch eine Amputation in der Regel nicht po− 334 Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 Patientenaufklärung Die operative Therapie von Patienten mit Weichgewe− besarkomen der Extremitäten ist überwiegend extre− mitätenerhaltend möglich. In Abhängigkeit von der Tu− morlokalisation und der Tumorgröße sind funktionelle Einschränkungen nicht vermeidbar, die auch durch re− konstruktive Techniken nicht immer zu kompensieren sind. Gerade bei tiefer Tumorlokalisation und nach Re− sektionen des Streckkompartmentes der betroffenen Extremität sind funktionelle Defizite nicht vermeidbar. Im Bereich der unteren Extremität ist die Resektion des N. ischiadicus orthopädietechnisch und funktionell besser zu kompensieren als die Resektion des N. femo− ralis. Im Falle einer applizierten Strahlentherapie treten Komplikationen überdurchschnittlich häufig auf. Nach einer präoperativen Strahlentherapie sind postoperati− ve Infektionen/Wundheilungsstörungen in etwa 35 % zu erwarten. Die Wundheilung verläuft deutlich verzögert, sodass eine Entfernung der Hautfäden nicht vor dem Abschluss der 3. postoperativen Woche erfolgen sollte, da ansonsten das Risiko einer Wunddehiszenz groß ist. Im Falle einer postoperativen Strahlentherapie sind ins− besondere Ödeme, Fibrosen und damit einhergehende Funktionseinschränkungen die wesentlichen klinischen Probleme. Jeder Patient ist auch darüber zu informieren, dass selbst nach einer extremitätenerhaltenden Operation Phantombeschwerden auftreten können. Überwiegend werden diese funktionellen Defizite von den Patienten akzeptiert, da als zu vermeidende Alternative der Verlust der betroffenen Extremität als ultima ratio resultieren würde. Andererseits ist jeder Patient auch so zu informieren, dass eine Amputation weder ein Versagen der Therapie ist, noch per se mit einer Verschlechterung der Lebensqualität und der Prognose einhergehen muss. Die Therapie ist alleinig abhängig von der Diagnose, der Tumorlokalisation, der Tumorausdehnung und dem Ansprechen auf neoadju− vante Konzepte. Eine funktionslose Extremität nach er− folgter Tumorresektion ist weniger anzustreben als eine funktionell kompensierte Extremität nach einer guten prothetischen Versorgung. Gerade hier ist ein erfahre− ner Operateur im interdisziplinären Team gefordert. Häufig (und zwingend erforderlich) ist der zeitliche Aufwand für die Patientenaufklärung aufwendiger als die Operation selbst. Maligne Tumoren des muskuloskelettalen Systems Abb. 14 n Lokal rezidivier− tes und exulze− riertes Weichge− webesarkom des linken proxima− len Unterarmes. Mit dem Ziel des Extremitätenerhaltes wurde bei nicht nachweisbarer Fernmetastasierung unter kurativer Intention die Indikation zur isolierten hyperthermen Extremitätenperfusion (ILP) mit TNF−alpha und Melphalan gestellt. a Klinisches Bild. b MRT−Dokumentation. c Nach einem Intervall von 6 Wochen erfolgte die Tumorresektion (R0). d Klinisches Ergebnis 6 Monate nach Meshgraft−Plastik des Weichteildefektes. n Neoadjuvante Therapiekonzepte Bei lokal fortgeschrittenen Weichgewebesarkomen (ca. 35 % der Patienten), die primär nicht R0−resektabel sind, ist vor mutilierenden oder ablativen operativen Verfahren stets die Durchführung neoadjuvanter, d. h. präoperativer, Therapiekonzeptionen zu prüfen (z. B. isolierte hypertherme Extremitätenperfusion, systemi− sche Chemotherapie, Radiotherapie). Ziel ist es, durch eine lokale Tumorremission bessere Voraussetzungen für eine sich daran anschließende Resektion zu ermög− lichen. Werden ausschließlich Extremitätenlokalisatio− nen betrachtet, so können unter Berücksichtigung dieses therapeutischen Algorithmus, auch unter Aus− nutzung plastisch−rekonstruktiver Verfahren, mehr als 80 % der Patienten mit Weichgewebesarkomen arm− und beinerhaltend behandelt werden. n Die isolierte hypertherme Extremitätenperfusion (ILP) mit TNF−alpha und Melphalan hat sich in mehreren klinischen Studien als effektive Induktionstherapie beim lokal fortgeschrittenen und primär nicht R0−extremitätenerhaltend resektablen Weichgewe− besarkom erwiesen. Es handelt sich um eine ein− malige Therapie. Die Ansprechrate liegt zwischen n 75 ± 80 % (komplette Remission: 20 ± 30 %, partielle Remission ca. 50 %). Nach einem Intervall von 6 ± 8 Wochen folgt die Tumorresektion (Abb. 14). Die systemische Chemotherapie ist im Kindesalter bei der Behandlung der Weichgewebesarkome im Rah− men von Therapieoptimierungsstudien standardi− siert und etabliert (derzeit CWS−2004−Protokoll). Im Erwachsenenalter ist die neoadjuvante Chemothera− pie nach wie vor Gegenstand klinischer Studien. Bis− lang besteht kein Konsens, welche Patienten in wel− chem Stadium (außer Stadium IV) mit welcher Tumorentität primär von einer systemischen Che− motherapie profitieren. Die Ursachen sind vielge− staltig und liegen beispielsweise im höheren Patien− tenalter, der Komorbidität usw. begründet. Die Responseraten liegen zwischen 30 ± 42 %. Dement− sprechend ist die Durchführung einer neoadjuvanten systemischen Chemotherapie nur innerhalb von Stu− dienprotokollen (z. B. EORTC) zu rechtfertigen. Sie kommt bei lokal fortgeschrittenem Weichgewebe− sarkom zu klinischen Anwendung und hat das Ziel, sowohl ein lokales Ansprechen zu erreichen als auch das Risiko der Metastasierung zu reduzieren. Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 335 Systemerkrankungen n n Die neoadjuvante Radiotherapie wird ebenso mit dem Ziel der lokalen Tumorremission und Verbesserung der Resektabilität eingesetzt. Ob sie einen Einfluss auf die Fernmetastasierung hat, ist nicht belegt. Im Vergleich zur adjuvanten Radiotherapie sind nach einer neoadjuvanten Radiotherapie häufiger Wund− heilungsstörungen zu erwarten. Der Vorteil der neo− adjuvanten Radiotherapie liegt in dem kleineren Strahlenfeld (klar definierbare Tumorgröße) und der geringeren Dosierung. Regel nicht zu beeinflussen. Zu beeinflussen ist jedoch die R−Klassifikation. Patienten, die R0−reseziert sind, haben eine signifikant bessere Prognose, als R1− und R2−resezierte Patienten. Die Lokalrezidivrate ist nach einer R1−Resektion erwartungsgemäß wesentlich höher und das Lokalrezidiv führt zu einer Verschlechterung der Prognose. Dementsprechend ist vor der Primärthe− rapie neben einem kompletten Staging die interdiszip− linäre Therapieplanung mit dem Ziel der R0−Resektion zu fordern. Adjuvante Therapiekonzepte Perspektiven Als adjuvante Therapie, d. h. nach der operativen Be− handlung eines Weichgewebesarkoms, hat sich die Ra− diotherapie bei hochmalignen Tumoren bewährt. Sie hat das Ziel, das Lokalrezidivrisiko, welches per se mit einer schlechteren Prognose einhergeht, zu reduzieren. Der Stellenwert einer adjuvanten Chemotherapie, un− abhängig, ob systemisch oder lokal, ist bislang nicht sicher belegt und außerhalb von Studien nicht gerecht− fertigt. Nachsorge Für Patienten mit Weichgewebesarkomen wird nach Abschluss der Therapie eine regelmäßige Nachsorge empfohlen. Innerhalb der ersten 2±3 Jahre treten 80 % aller Rückfälle auf. Dementsprechend sind innerhalb der ersten 2,5 Jahre im 3−monatigen Intervall neben der klinischen Untersuchung eine Sonografie der Primärtu− morregion als auch des regionalen Lymphabflusses, ggf. MRT mit dem Ziel der Detektion eines lokalen Progres− ses zu empfehlen. Aufgrund der häufigen hämatogenen Metastasierung in die Lunge sind ebenso röntgenologi− sche Verlaufskontrollen/CT des Thorax indiziert. An− schließend sind die Kontrolluntersuchungen im 6−mo− natigen Intervall und nach 5 tumorfreien Jahren im jährlichen Intervall zu favorisieren. Bei den Low−grade− Weichgewebesarkomen sind längere Nachsorgeinter− valle akzeptiert. Bislang wurden Patienten mit Weichgewebesarkomen unabhängig von der Tumorentität nahezu konform the− rapiert, wobei die operative Therapie weiterhin im Mit− telpunkt steht. Als effektivste Lokaltherapie der fortge− schrittenen Extremitätensarkome hat sich die isolierte hypertherme Extremitätenperfusion klinisch bewährt und durchgesetzt. Zukünftig sind neue Innovationen durch target− orientierte Therapien, meist systemisch, unter Berück− sichtigung der immunhistologischen und molekular− genetischen Besonderheiten der einzelnen Weich− gewebesarkome zu erwarten. Hierzu zählen bereits heute unter anderem: n Imatinib in der Therapie des gastrointestinalen Stromatumors und dem Dermatofibrosarcoma protuberans n Taxane und Sorafenib beim Angiosarkom, n Gemcitabin und Docetaxel bei Leiomyosarkomen (Uterus) n Trabectedin bei Leiomyosarkomen und Liposarko− men n Aromatasehemmer bei rezeptorpositiven Uterus− sarkomen und low−grade−endometrialen Stroma− tumoren n Topoisomerase−I−Inhibitoren bei Rhabdomyosarko− men und Tumoren der Ewing−Sarkomgruppe Knochenmetastasen Prognose Epidemiologie Werden alle Patienten mit Weichgewebesarkomen be− rücksichtigt, unabhängig von der Tumorentität und dem Stadium der Erkrankung, so liegt das 5−Jahres−Ge− samtüberleben zwischen 50 und 55 %. Die wichtigsten Prognosefaktoren sind das Grading, die Metastasierung, die Tumorgröße, die R−Klassifikation und das lokale Tu− morrezidiv. Selbst die Tumorentität hat einen Einfluss auf die Prognose. So haben Patienten mit einem Lipo− sarkom eine deutlich bessere Prognose als mit einem malignen peripheren Nervenscheidentumor. Das Gra− ding, die Tumorgröße und die Tumorentität sind in der 336 Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 Etwa 80 % aller malignen Knochenläsionen sind durch Metastasen bedingt. Die häufigsten Karzinome, die eine operative Therapie von Knochenmetastasen erfordern, sind Patienten mit einem Mammakarzinom, Nieren− zellkarzinom und Bronchialkarzinom. In Autopsiestu− dien konnte aufgezeigt werden, dass in 25 ± 85 % der Karzinompatienten Knochenmetastasen nachzuweisen sind. In Deutschland besteht eine Inzidenz von etwa 40 000 neuen Patienten pro Jahr bei einer Prävalenz von etwa 80 000 Patienten pro Jahr aufgrund des längeren Maligne Tumoren des muskuloskelettalen Systems Überlebens. Das Kernproblem der Knochenmetastasie− rung im Vergleich zur viszeralen Metastasierung ist, dass Knochenmetastasen meist mit einem längeren Überleben, aber mit einer höheren Morbidität und Be− schwerdesymptomatik einhergehen. Knochenmetasta− sen treten allein beim Mammakarzinom in etwa 80 %, beim Bronchialkarzinom und Prostatakarzinom in etwa 60 % und beim Nierenzellkarzinom in etwa 35 % der Fäl− le auf. Insbesondere osteolytische Metastasen können aufgrund der resultierenden Instabilität des betroffenen Skelettabschnittes zu einer operativen Konsequenz in− folge einer pathologischen Fraktur, einer drohenden pathologischen Fraktur oder einer neurologischen Komplikation führen. Typische Metastasenlokalisatio− nen der operativen Versorgung sind die Wirbelsäule, das Becken und die Extremitäten. Knochenmetastasen eines Prostatakarzinoms sind zwar vergleichsweise häufig, jedoch aufgrund des meist osteoblastischen Charakters und der effektiven systemischen und radio− therapeutischen Therapieoptionen nur selten operativ zu behandeln. Diagnostik n Klinik Die führenden Symptome von Knochenmetastasen sind der progrediente Schmerz, der akute Schmerz infolge einer pathologischen Fraktur, die Funktionseinschrän− kung und die neurologisch bedingte Symptomatik beim Befall der Wirbelsäule. Diese Symptomatik kann pro− longiert als auch akut auftreten. Ist eine maligne Grunderkrankung bekannt, so fällt die diagnostische Abklärung meist leicht. In etwa 20 % stellt die ossäre Metastasierung jedoch die primäre Symptomatik einer bereits disseminierten Erkrankung dar. n Bildgebende Verfahren Röntgen. In Analogie zu den primär malignen Knochen− tumoren ist die röntgenologische Untersuchung der symptomatischen Region stets großzügig sowie obligat in 2 Ebenen zu stellen und als Basisdiagnostik zu for− dern. Sie ist in der Lage, benigne Läsionen meist sicher auszuschließen. Weiterhin ist anhand der röntgenolo− gischen Untersuchung unter Hinzuziehung der klini− schen Symptomatik das Risiko einer pathologischen Fraktur im Bereich der langen Röhrenknochen anhand des Mirels−Scores abzuschätzen (Tab. 9). Liegt ein Punk− tewert von 9 vor, so besteht ein hohes pathologisches Frakturrisiko und die Indikation zur operativen Stabili− sierung ist gegeben. Für Wirbelsäulenmanifestationen stehen weitere Score−Systeme (z. B. Tomita−Score) zu Verfügung, um unter Berücksichtigung der Prognose Tabelle 9 Mirels−Score zu Beurteilung des Risikos der pathologischen Frakturgefahr der langen Röhrenknochen (Mirels 1989). Variable Punktwert 1 2 3 Lokalisation obere Extremität untere Extremität peritrochantär Art der Läsion osteoblastisch gemischtförmig osteolytisch Größe in Relation zum Diameter der Kortikalis < 1/3 1 /3 ± 2/3 > 2/3 Schmerzprofil gering mäßig ständig den Umfang der therapeutischen Optionen abwägen zu können. Skelettszintigrafie. Der Stellenwert der Ganzkörperske− lettszintigrafie bei der Diagnostik von Knochenmetas− tasen tritt zunehmend in den Hintergrund, da nur selten therapeutische Konsequenzen bei einem beschwerde− freien Patienten resultieren und die Prognose in der Re− gel kaum beeinflusst werden kann. Weiterhin ist bei den meist älteren Patienten diese sehr sensitive Unter− suchung wenig spezifisch. MRT. Erfolg versprechender ist die MRT bei der Diag− nostik von Knochenmetastasen, insbesondere im Be− reich der Wirbelsäule, da hier unmittelbar therapeuti− sche Konsequenzen in Kombination mit der klinischen Symptomatik resultieren können. Gerade beim Plasmo− zytom wurde die röntgenologische Untersuchung im sog. ¹Pariser Schema“ von der wesentlich sensitiveren Ganzkörper−MRT abgelöst. n Labordiagnostik Neben der bildgebenden Diagnostik ist die Labordiag− nostik ein wesentlicher Bestandteil in der Primär− als auch Verlaufsdiagnostik im metastasierten Stadium der Erkrankung. Ein Paradebeispiel ist die Bestimmung des sog. Tumormarkers PSA im Serum beim Prostatakarzi− nom. Beim Mammakarzinom können das CA 15−3, beim Bronchialkarzinom die NSE ± um nur einige zu nennen ± in die Beurteilung der Tumorprogression und/oder des Therapieansprechens mit einbezogen werden. Im Vor− dergrund steht nach wie vor die klinische Symptomatik im metastasierten Stadium der Erkrankung, insbeson− dere bei der Beurteilung des Therapieansprechens. Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 337 Systemerkrankungen Therapie n Therapeutisches Konzept Die Therapie von Patienten mit Knochenmetastasen ist bis auf wenige Ausnahmen palliativ, wobei die Prognose entscheidend vom Primärtumor bestimmt wird. Therapieziele Knochenmetastasen n n n n n Schmerzlinderung Therapie einer pathologischen Fraktur Stabilisierung einer drohenden pathologischen Fraktur Therapie neurologischer Komplikationen beim metastatischen Befall der Wirbelsäule Operative Prinzipien Die operative Therapiestrategie von Knochenmetasta− sen ist abhängig von der Gesamtprognose, der Lokali− sation, der Metastasengröße, dem Vorhandensein viszeraler Metastasen, der Effektivität additiver Thera− pieoptionen (z. B. Radiotherapie) und daher stets inter− disziplinär zu entscheiden. Viel zu häufig wird nach wie vor die Indikation zur operativen Therapie einer Kno− chenmetastase erst nach einer pathologischen Fraktur gestellt. Eine pathologische Fraktur geht mit höheren intra− und postoperativen Komplikationen einher, ein korrektes präoperatives Staging ist aufgrund der Schmerzhaftigkeit kaum möglich und der Leidensdruck der Patienten erheblich. " Das Ziel ist es, vor der pathologischen Fraktur (zumin− dest im Bereich der Extremitäten) zu operieren und die Belastungsfähigkeit sowie die Funktionalität des betrof− fenen Skelettabschnittes für die verbleibende Lebenszeit mit einer Reduktion der Schmerzsymptomatik zu erhal− ten. sen. Voraussetzung ist, dass ein ausreichender Abstand zum Gelenk für eine sichere Fixierung besteht (Abb. 15). Bei gelenknahen Metastasenlokalisationen und aus− gedehnten osteolytischen Läsionen ist die Verbund− osteosynthese/Doppelplattenverbundosteosynthese eine Methode, die Belastungsfähigkeit der betroffenen Extremität wiederherzustellen. Insbesondere bei Pa− tienten mit einem ossär metastasierten Bronchialkarzi− nom sind diese Verfahren zu favorisieren. Bei günstiger Prognose und osteolytischen Destruk− tionen sind resezierende Verfahren mit anschließender Rekonstruktion (z. B. Tumorendoprothetik, Wirbelkör− perersatz) zu erwägen. Nur in seltenen Fällen ist eine alleinige Resektion (z. B. Skapula, Becken, proximale Fibula) möglich. Amputationen sind selten (z. B. exulze− rierte, therapieresistente Metastasen). Vor der operativen Therapie einer hypervaskulari− sierten Knochenmetastase (meist bei Nierenzellkarzi− nom und Schilddrüsenkarzinom) ist bei stammnahen Lokalisationen die Indikation zur präoperativen Embo− lisierung der tumorversorgenden Gefäße sehr groß− zügig zu stellen. In jedem Fall, unabhängig vom Operationsverfahren, ist Tumorgewebe für die histopa− thologische Diagnostik zu gewinnen und die Ver− dachtsdiagnose zu bestätigen. Nach resezierenden Verfahren können die resultie− renden Defekte mittels Tumorendoprothese (Abb. 16) und in seltenen Fällen bei solitären Befunden und guter Prognose auch mit biologischen Rekonstruktionsver− fahren rekonstruiert werden. Auch hier besteht das Ziel in einer schnellen Rehabilitation. Resezierende Verfah− ren treten in den Vordergrund bei Nierenzell−, Schild− drüsen− und ggf. Mammakarzinommetastasen. n Stellenwert der Radiotherapie Die Radiotherapie gehört zum festen Bestandteil der interdisziplinären Therapie von Karzinompatienten. 10 ± 20 % aller in der Radiotherapie behandelten Patien− ten sind Patienten mit Knochenmetastasen extraske− lettaler Primärtumoren. Therapieziele Bei Patienten mit einer schlechten Prognose sind eher alleinig stabilisierende (z. B. Verriegelungsnagel) und intraläsionale Verfahren (z. B. Verbundosteosynthese, Vertebroplastie) zu erwägen. In diesen Fällen ist eine postoperative Radiotherapie obligat, um eine lokale Tumorprogression zu vermeiden, die mit Reeingriffen und einer Zunahme der Beschwerdesymptomatik ein− hergehen können. Zu den alleinig stabilisierenden Verfahren zählen die verschiedenen Formen der Osteosythesen, unabhängig ob intramedullär oder in Form von Plattenosteosynthe− 338 Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 Radiotherapie n n n n Schmerzlinderung Verbesserung der Funktionalität Remineralisierung des betroffenen Skelettabschnit− tes (meist über ein mehrmonatiges Intervall) Reduktion des Risikos eines Metastasenprogresses nach einer operativen Therapie Maligne Tumoren des muskuloskelettalen Systems Abb. 15 n a Röntgenbild eines rechten proximalen Humerus in 2 Ebenen mit Nachweis einer permeativ wachsenden osteolytischen Destruktion. Anamnestisch ist ein metastasiertes Bronchialkarzinom bekannt. Der Mirels−Score beträgt 9 Punkte (obere Extremität: 1 Punkt, Dauerschmerz: 3 Punkte, osteolytische Läsion: 3 Punkte, Größe der Läsion: 2 Punkte). Indikation zur operativen Therapie. b Aufgrund der limitierten Prognose und der Lokalisation wurde eine Nagelosteosynthese mit einem expandiblen System vorgenommen. Die postoperative Strahlentherapie ist obligat. In Abhängigkeit vom Fraktionierungskonzept (Einzeit− bestrahlung, Hypofraktionierung, konventionelle Be− strahlung) werden Dosen zwischen 8 und 40 Gy appli− ziert. Die Effektivität der Schmerzreduktion ist in vielen Studien belegt. Von etwas mehr als 70 % der Patienten wird über eine Schmerzlinderung berichtet, ca. 40 % ge− ben eine komplette Schmerzbeseitigung an. Der Effekt der Radiotherapie tritt nach 1 ± 4 Wochen ein (meist unabhängig von der Fraktionierung und Dosierung). Pathologische Frakturen werden häufiger nach Einzeit− bestrahlungen mit hoher Dosierung beobachtet. Der Ef− fekt der Schmerzlinderung infolge der Radiotherapie wird auf eine Elektrolytverschiebung an den peripheren Nervenendigungen, eine Umwandlung der Gewebeazi− dose in eine Alkalose, den zytotoxischen Effekt auf die Tumorzellen und die Größenreduktion der Knochen− metastase zurückgeführt. Zusammenfassend ist die Schmerzlinderung weitgehend dosisunabhängig. Eine Remineralisierung ist vor allem bei teils osteoly− tisch/teils osteoblastischen Knochenmetastasen zu er− warten. Hierzu zählen insbesondere Mammakarzinom− (Remineralisierung in 62 %) und Prostatakarzinom− metastasen (Remineralisierung in 57 %). Bei Knochen− metastasen von Nierenzell−, Schilddrüsen− und Bron− chialkarzinomen tritt dieser Effekt deutlich seltener auf und liegt nur zwischen 10 ± 28 %. Im Vergleich zur Schmerzlinderung ist die Remineralisierung dosis− abhängig, abhängig von der Fraktionierung und der Tumorentität, sie tritt im Mittel erst 2 ± 6 Monate nach der Radiotherapie ein. " Die postoperative Radiotherapie ist nach allen intra− läsionalen Operationsverfahren zu fordern, da hierdurch sowohl die Funktionalität des betroffenen Skelettab− schnittes verbessert als auch das Risiko eines operativen Zweiteingriffes deutlich reduziert wird. n Stellenwert systemischer Optionen Die systemische Chemotherapie hat bei der Behandlung von Karzinommetastasen des Knochens kaum eine klinische Relevanz. Bisphosphonate können zwar die Prognose kaum beeinflussen, jedoch treten die Symp− tome als auch die Komplikationen einer Skelettmetas− tasierung signifikant später auf. Eindrucksvoll konnte diese Erkenntnis bei der Therapie des ossär metasta− sierten Mammakarzinoms demonstriert werden. Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 339 Systemerkrankungen Abb. 16 n a Röntgenbild eines linksseitigen Kniegelenkes eines 72−jäh− rigen Patienten. Es besteht der Zustand nach Implantation einer Knie− endoprothese aufgrund einer Gonarthrose, weiterhin Zustand nach Tu− mornephrektomie. Röntgenmorphologisch zeigt sich eine ausgedehnte osteolytische Destruktion ohne Matrixverkalkungen der linken distalen Femurepimetaphyse mit pathologischer Fraktur. b Auswärts wurde die pathologische Fraktur mit einem winkelstabilen Implantat versorgt. Schmerz und Instabilität bestanden postoperativ fort. c Die Lösung des Problems war aufgrund der Lokalisation die Metastasenresektion und Implantation einer Tumorendoprothese ¹distaler Femurersatz“, zemen− tiert. nen und einer progredienten Schmerzsymptomatik liegt, ist die Nachsorge stets symptombezogen unter Berücksichtigung der Grunderkrankung und der Prog− nose durchzuführen. Regelmäßige röntgenologische Kontrollen sind bei einem stationären klinischen Be− fund nicht indiziert. Prognose Bisphosphonate gehören heute neben der Therapie der tumorbedingten Hyperkalzämie zur Basistherapie der Knochenmetastasierung. Die ablative Radiojodtherapie hat nach wie vor ihren klinischen Stellenwert beim os− sär metastasierten Schilddrüsenkarzinom. Gerade bei dieser Tumorentität kann ein langfristiges Überleben durch eine Kombination aus operativer und nuklear− medizinischen Therapie erreicht werden. Nachsorge Da die operative Behandlung von Knochenmetastasen vorwiegend in der Prophylaxe bzw. Therapie von pa− thologischen Frakturen, neurologischen Komplikatio− 340 Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 Die Prognose im metastasierten Stadium der Erkran− kung hängt entscheidend vom Primärtumor und dem Metastasierungsmuster ab. Eine gute Prognose haben Patienten, die nach einem langzeitlichen Intervall Kno− chenmetastasen entwickeln. Weiterhin ist die Prognose von Patienten mit Knochenmetastasen eines Mamma− und Nierenzellkarzinoms deutlich besser im Vergleich zum Bronchialkarzinom. Liegen zusätzlich viszerale− oder Hirnmetastasen vor, so verschlechtert sich die Prognose relevant. Maligne Tumoren des muskuloskelettalen Systems Literatur Korrespondenzadresse Dr. med. Per−Ulf Tunn Campanacci M. Bone and soft tissue tumors. New York: Springer, 1990 Leiter Department Tumororthopädie Dorfman HD, Czerniak B, Kotz R, Vanel D, Park YK, Unni K. WHO classi− fication of tumours of bone: Introduction. In: Fletcher DM, Unni K, Sarkomzentrum Berlin−Brandenburg Klinik für Orthopädie und orthopädische Rheumatologie Mertens F, eds. World Health Organization Classification of Tumours. HELIOS Klinikum Berlin−Buch Pathology & Genetics. Tumours of Soft Tissue and Bone. Lyon: Schwanebecker Chaussee 50 IARCPress, 2002: 226 ± 232 Enneking WF. A System of Staging Musculoskeletal Neoplasms. Clin Orthop Rel Res 1986; 204: 9 ± 24 Lodwick GS, Wilson AJ, Farrell C, Virtama P, Dittrich F. Determining growth rates of focal lesions of bone from radiographs. Radiology 13125 Berlin Telefon: 030/940152300 Telefax: 030/940152309 E−Mail: per−ulf.tunn@helios−kliniken.de 1980; 134: 577 ± 583 Mirels H. Metastatic disease in long bones: a proposed scoring system for diagnosing impending pathological fractures. Clin Orthop Rel Res 1989; 249: 256 ± 264 Salzer−Kuntschik M, Brand G, Delling G. Bestimmung des morphologi− schen Regressionsgrades nach Chemotherapie bei malignen Kno− chentumoren. Pathologe 1983; 4: 135 ± 141 TNM Classification of Malignant Tumours (UICC); 2003 Tunn PU, Gebauer B, Fritzmann J, Hünerbein M, Schlag PM. Aktuelle multimodale Diagnostik als Basis einer differenzierten operativen Therapie von Weichteilsarkomen. Chirurg 2004; 75: 1165 ± 1173 Winkelmann W. Die Umdrehplastiken. Orthopäde 1993; 22: 152 ± 159 Connective Tissue Oncology Society. Im Internet: www.ctos.org European Musculo−Skeletal Oncology Society. Im Internet: www.em− sos.org European Organisation for Research and Treatment of Cancer. Im Inter− net: www.eortc.be International Society of Limb Salvage. Im Internet: www.isols.org Musculoskeletal Tumor Society. Im Internet: www.msts.org US National Cancer Institute. Im Internet: www.nci.nih.gov The Internet Society of Orthopaedic Surgery and Trauma. Im Internet: www.orthogate.com Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 341 Maligne Tumoren des muskuloskelettalen Systems CME−Fragen Die folgenden Fragen beziehen sich auf den vorangehenden Beitrag. Sie können uns die entsprechenden Antworten entweder online unter http://cme.thieme.de oder durch das CME−Teilnahmeheft hinten in dieser Zeitschrift zukommen lassen. Jeweils eine Antwort ist richtig. Die Vergabe von CME−Punkten ist an die korrekte Beantwortung der Multiple−Choice−Fragen gebunden. Welche klinische Symptomatik ist bei einem Patienten mit einem Knochen− oder Weichgewebesarkom primär zu erwarten? Welche Bildgebung hat bei der Beurteilung eines Knochentumors die höchste Aussage bezüglich der Dignität und Entität? Welche Aussage ist bei der offenen Biopsie eines Knochentumors falsch? Welche Antwort ist falsch? Die Prognose von Patienten mit einem Osteosarkom ist weit− gehend unabhängig von Wann ist nach einer operativen Therapie von Knochenmetastasen eine postoperative Strahlentherapie nicht indiziert? 1 A B C D E Anämie, Leistungsknick Gewichtsverlust, Nachtschweiß Schwellung, Schmerz Anstieg der Tumormarker Pathologische Fraktur 2 A B C D E Röntgen, nativ Knochenszintigrafie MRT CT PET 3 A Die Wahl des Biopsiezugangs sollte im Verlauf des späteren definitiven Zugangs liegen. Der die Biopsie durchführende Operateur muss die Möglichkeit und Art der definitiven Versorgung kennen. B Es ist der kürzeste, direkte Weg zum Tumor zu wählen, ohne ein weiteres Kompartment zu eröffnen. C Eine Drainage ist obligat, diese wird direkt aus der Wunde oder in unmittelbarer Nähe des Wundwinkels ausgeleitet. D An den Extremitäten werden ausschließlich quer verlaufende Schnitte gesetzt. E Die Operationstechnik hat so atraumatisch wie möglich zu erfolgen. Gewebe− quetschungen oder großzügiges Präparieren und Darstellen des Tumors sind zu vermeiden. Die Hautnaht wird in intrakutaner Technik durchgeführt; großzügige Rückstichnähte sind obsolet. 4 A B C D E 5 A Nach intraläsionaler Resektion und Verbundosteosynthese B Bei guter Prognose C Nach belastungsstabiler Marknagelung einer pathologischen Fraktur einer Mamma− karzinommetastase und begleitender antihormoneller Therapie und der Gabe von Bisphosphonaten D Nach R0−Resektion der Knochenmetastase E Bei Nierenzellkarzinommetastasen, unabhängig vom Operationsverfahren, da ein schlechtes Ansprechen auf eine Strahlentherapie bekannt ist der R−Klassifikation. dem histopathologischen Regressionsgrad. dem Tumorvolumen. einer Metastasierung. dem Geschlecht. Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344 343 Systemerkrankungen 6 A Geschlecht, Dauer der Schmerzen, Mammakarzinom in der Anamnese, Ausdehnung der Metastase B Lokalisation der Metastase, Schmerzintensität, Ausmaß der Destruktion der Kortikalis, Art der Läsion (osteolytisch, osteoblastisch) C Alter, Lokalisation der Metastase, Schmerzmitteldosierung, Notwendigkeit der Nutzung orthopädietechnischer Hilfsmittel D Größe der Metastase, Primärerkrankung, Alter, Mobilitätsindex E Schmerzprofil, begleitende Osteoporose, weibliches Geschlecht, osteolytische Metastase 7 A bereits fortgeschrittener viszeraler Metastasierung und multiplen Knochenläsionen eines Patienten mit einem Bronchialkarzinom. B hohem Patientenalter und Immobilisierung. C Multimorbidität und Magenkarzinom. D bekanntem Primärtumor und langem krankheitsfreien Intervall. E szintigrafisch solitärer Läsion beim Mammakarzinom. 8 A jungen Patienten, progredienter Schwellung, B−Symptomatik, Lokalisation im Bereich der unteren Extremität, positiver Familienanamnese. B Alter in der 2. Lebenshälfte, tiefer Tumorlokalisation, progredienter Schmerz− symptomatik, Tumor > 8 cm. C rezidivierendem Trauma, zunehmender Schwellung, Funktionseinschränkung, weiblichem Geschlecht, Tumor > 20 cm. D männlichem Geschlecht, Alter in der 2. Lebenshälfte, Schwellung an der oberen Extremität, Anamnese weniger als 1 Monat, Alkoholabusus. E Tumorerkrankung in der Anamnese, Nikotinabusus, Funktionseinschränkung und Schwellung der betroffenen Extremität, Anstieg des PSA, Nachtschweiß. 9 A B C D E Strahlentherapie Systemische Chemotherapie Isolierte hypertherme Extremitätenperfusion Systemische Chemotherapie mit regionaler Hyperthermie Bisphosphonate in Kombination mit einer antihormonellen Therapie 10 A B C D E Amputation. radikalen Resektion. neoadjuvanten Therapie. adjuvanten Strahlentherapie. R0−Resektion. Welche Parameter dienen zur Einschätzung des Risikos einer patho− logischen Fraktur infolge einer Karzinom− metastase im Bereich der langen Röhren− knochen? Die histologische Sicherung einer ver− meintlichen Knochen− metastase ist nicht indiziert bei Die Wahrscheinlichkeit, dass es sich um ein Weichgewebesarkom handelt, ist hoch bei Welche neoadjuvante Therapie hat beim lokal fortgeschrittenen Weichgewebesarkom der Extremitäten im Erwachsenenalter mit dem Ziel der Vermeidung einer Amputation die höchste Responserate: Eine lokale Tumor− kontrolle ist bei einem Patienten mit einem Weich− gewebesarkom der Extremitäten nur zu realisieren mit einer 344 Orthopädie und Unfallchirurgie up2date 3 ê2008 ê317 ± 344