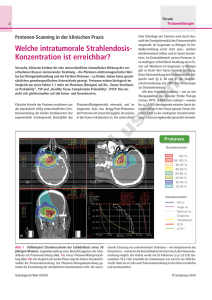
VIERTER JAHRESBERICHT 2013
Werbung

RINECKER PROTON THERAPY CENTER DAS DEUTSCHE PROTONen THERAPIE ZENTRUM Vierter JAhresbericht THE STATE OF THE ART IN RADIO ONCOLOGY Die Erfahrungen aus der Behandlung der ersten 1.500 Patienten Inhalt RINECKER PROTON THERAPY CENTER DAS DEUTSCHE PROTONen THERAPIE ZENTRUM Vierter JAhresbericht STATE OF THE ART IN RADIO ONCOLOGY DasTHE Deutsche Protonen Therapie-Zentrum Die Erfahrungen aus der Behandlung der ersten 1.500 Patienten Jahresbericht April 2012 - März 2013 4 Vorwort 7 Der Weg des Patienten im Center 21 DAS TEAM 22 Wachwechsel: Von Prof. Herbst zu Prof. Bachtiary 24 Unser Leitungsteam 32 Unser Wissenschaftlicher Beirat 41 DIE TECHNIK 42 Die Welt des Protonen-Scannings - 2013 52 Wie oft muss der Patient bestrahlt werden? 56 Problem: Krebs als Folge einer Strahlentherapie 63 DIE THERAPIE 64 Übersicht Behandlungen am RPTC 70 Bestrahlung von Kindern am RPTC 76 Ergebnisse aus 500 bestrahlten Prostatakarzinomen 86 Ergebnisse der neuartigen Protonenbestrahlung des Pancreas 92 Fallbeispiele aus dem RTPC 110 Kontakt / Impressum 3 Vorwort Vorwort EUROPAS MODERNE KREBSBESTRAHLUNG: DAS VIERTE JAHR Das vierte Betriebsjahr war für die ProHealth AG und das RPTC ein Erfolg. Die Leistung, sowohl im Hinblick auf die Fallzahlen, als auch auf die technische Qualität, konnte gesteigert werden. Trotz der herausfordernden gesundheitspolitischen Lage konnten wir Verbesserungen bei der Einbindung des RPTC als Leistungserbringer in das deutsche Gesundheitssystem erreichen und somit die Protonentherapie mehr Patienten zugänglich machen. Wir freuen uns, dass die Vorteile der Protonentherapie sowohl von Patienten als auch Krankenkassen und Ärzten immer mehr erkannt und genutzt werden. Insbesondere, da Krebs nach Herzkreislauferkrankungen die zweithäufigste Todesursache weltweit ist, Tendenz steigend. Waren es 1981 in Deutschland noch 269.000 Neuerkrankungen, so betrug die Zahl 2012 bereits 495.000 bei etwa gleichbleibender Bevölkerungszahl. Die Krankheit ist jedoch nicht nur ein soziologisches Problem. Kosten im Zusammenhang mit Krebs belasten das Gesundheitssystem und andere Bereiche der Volkswirtschaft in Europa jährlich mit rund 120 Milliarden Euro. Jedoch entfallen lediglich 36% dieser Kosten auf die Behandlung an sich. Weitere 36% entstehen durch Einkommensausfälle aufgrund starker Therapienebenwirkungen. Es besteht also, sowohl soziologisch als auch ökonomisch, ein hoher Bedarf an effektiveren und schonenderen Krebstherapien, die bessere Heilungserfolge erbringen und gleichzeitig die ökonomische Belastung von Krebserkrankungen reduzieren. Ein entscheidender Schritt in diese Richtung ist die Protonentherapie. Anders als Röntgenstrahlen geben Protonen auf ihrem Weg zum Tumor nur wenig Energie ab. Ihre maximale Dosis, die für die Zerstörung der Tumorzellen verantwortlich ist, wird erst freigesetzt, wenn die Protonen stoppen (im Bragg-Peak). Dieser Ort, und somit der Ort des Dosismaximums, ist mittels ihrer Geschwindigkeit (Energie) präzise dreidimensional bestimmbar. Die Geschwindigkeit wird so gewählt, dass die Protonen exakt an einer vorab berechneten Stelle im Tumor stoppen. Das gesunde Gewebe hinter dem Tumor bleibt strahlungsfrei, das vor dem Tumor wird wesentlich weniger belastet als bei Röntgen. Insgesamt kann die Strahlenbelastung im Gesunden mit Protonen um über zwei Drittel (gegenüber Röntgen) verringert werden, bei gleicher oder höherer Tumordosis. Die Protonentherapie ermöglicht somit nicht nur höhere Heilungschancen, sondern mindert durch Reduzierung der Akut- und Spätnebenwirkungen sowie des Risikos von Sekundärtumoren auch die Folgebelastungen der Strahlentherapie. Am Beispiel des Prostatakarzinoms bedeutet dies neben hervorragenden medizinischen Ergebnissen eine Reduzierung der Behandlungsdauer um fast 50%, eine Reduzierung der Akut- und Spätnebenwirkungen und in der Regel den Wegfall einer Reha-Behandlung nach der Therapie. Höhere Behandlungskosten werden somit durch reduzierte Nebenkosten aufgefangen. Obwohl die Eigenschaften von Protonenstrahlen bereits Anfang des 20ten Jahrhunderts entdeckt und erste medizinische Tests ab Mitte der 1950er Jahre unter anderem in Harvard USA durchgeführt wurden, entstand 4 die erste vollklinische Protonentherapieanlage erst 1990. Um diese hochpräzise Therapie optimal einsetzen zu können mussten erst die bildgebenden Diagnostikverfahren weit genug entwickelt sein. Denn anders als bei einer Bestrahlung mit Röntgen, bei der Präzision aufgrund des „Durchschuss-Charakters“ der Röntgenstrahlen nur zweidimensional gefordert ist, muss bei der Protonentherapie dreidimensional geplant werden. Erst mit der heutigen Technologie ist das optimal möglich. Seitdem sind bereits über 95.000 Menschen weltweit mit Protonen behandelt worden. Die Therapie gilt mittlerweile in immer mehr Bereichen als Gold Standard, so zum Beispiel bei der Bestrahlung von Kindern und Tumoren der Schädelbasis. Auch die Weltführer in der Krebstherapie betreiben bereits Protonentherapieanlagen (MD Anderson, Massachusetts General Hospital (Harvard)), oder bauen Protonen-Center (Mayo Clinics 2 Anlagen, Sloan-Kettering, John Hopkins u.a.). Auch der arabische Raum hat die Bedeutung dieser Therapie erkannt. Nur Europa hinkt der Entwicklung spürbar hinterher und riskiert den Anschluss an die Weltspitze zu verpassen. Das RPTC in München, Europas erste vollklinische Protonen-Serienanlage, ist mit 4 vollbeweglichen Gantries sowie einem Fixed-Beam für Tumore am Auge ausgestattet. Es ist zudem neben dem MD Anderson-Center, der weltweiten Nummer Eins in der Krebstherapie, die einzige klinische Anlage, die Protonentherapie in ihrer durchentwickelten Form, dem Scanning-Verfahren, anbietet. Das RPTC macht somit nicht nur Deutschland zu einem Weltführer in der Krebstherapie, es ist mit über 1.500 behandelten Patienten seit 2009 auch das Zentrum mit der weltweit größte Erfahrung im Protonen-Scanning, und ist so bereits zur Behandlungswahl für Patienten aus über 44 Nationen geworden. Seit Betriebsbeginn besteht ein die Kostenübernahme sichernder Versorgungsvertrag mit der AOK Bayern, seit 2011 mit der Debeka, Deutschlands größtem privaten Krankenversicherer. Gespräche mit weiteren Kassen laufen, um auch hier die Kostenbewilligungen zu beschleunigen. Tun wir etwas, um das unermessliche Leid, das die Krebserkrankungen den Menschen auferlegen, zu lindern. Hans Rinecker PD Dr. med. Dr. med. habil. Aufsichtsratsvorsitzender 5 RINECKER PROTON THERAPY CENTER DER WEG DEs PATIENTEN IM CENTER 8 Empfang und Wartebereich 10 Diagnostik und Zielplanung 12 TumorBoard 12Arztgespräch 14Patientenmanagement 15Bestrahlungsvorbereitung 16 Die Bestrahlung in der Gantry 18Gästehaus 7 DER WEG DES PATIENTEN IM CENTER DER WEG DES PATIENTEN IM CENTER Empfang und Wartebereich Am Empfang des RPTC erhalten die Patienten bei ihrer Ankunft alle Informationen, damit sie sich im RPTC zurecht finden. Auch während der Zeit der Behandlung ist der Empfang eine Anlaufstelle für Fragen. 8 9 DER WEG DES PATIENTEN IM CENTER DER WEG DES PATIENTEN IM CENTER Diagnostik und Zielplanung In den ersten Tagen am RPTC werden eine sorgfältige Diagnostik und Therapieplanung durchgeführt: Bei einer Staging-Untersuchung wird der gesamte Körper nach Tumormanifestationen und Metastasen abgesucht. Dies wird mit einer Ganzkörper-Kernspintomografie (MRT), mitunter in Verbindung mit einem PET–CT (Positronen-Emissionstomografie), völlig schmerzfrei durchgeführt. Falls erforderlich, werden weitere Untersuchungen wie Endoskopie, 10 Ultraschall oder Angiografie vorgenommen. Für die darauffolgende Zielplanung wird eine hochauflösende Computertomografie (CT) durchgeführt. Sämtliche dafür erforderlichen Einrichtungen sind im RPTC vorhanden, um den Ablauf für die Patienten so mühelos wie möglich zu gestalten. Zudem wird jedem Patienten ein Dosisvergleich für eine Röntgen-Bestrahlung angeboten, um zu demonstrieren, dass die Bestrahlung mit Protonen eine überlegene Dosisverteilung liefert. 11 DER WEG DES PATIENTEN IM CENTER DER WEG DES PATIENTEN IM CENTER Tumorboard Da sich die Onkologie auf viele verschiedene Spezialgebiete verteilt, beziehen wir Spezialisten in den jeweiligen Gebieten in die Behandlung mit ein. Dazu verfügt das RPTC über ein sogenanntes Tumorboard aus Fachärzten für Radiotherapie, Radiodiagnostik, Chirurgie, Onkologie der Inneren Medizin, Urologie sowie für Pathologie. Das Tumorboard überprüft die jeweilige Therapieentscheidung und wird in die Zielplanung mit eingebunden. Je nach Fall werden weitere Spezialisten und, soweit möglich, der einweisende Arzt mit einbezogen. Arztgespräch In einem ersten Arztgespräch wird mit dem Patienten ausführlich gesprochen. Es werden ihm die Therapiemöglichkeiten, die Indikation zur Protonentherapie, deren Nebenwirkungen sowie der Behandlungsablauf im Einzelnen erläutert. 12 13 DER WEG DES PATIENTEN IM CENTER DER WEG DES PATIENTEN IM CENTER 14 Patientenmanagement Bestrahlungsvorbereitung Nachdem der Patient sich für die Protonentherapie entschieden hat, werden im Patientenmanagement die Bestrahlungstermine festgelegt und mögliche verbleibende Fragen des Patienten beantwortet. Der Patient erhält hier seinen individuellen Bestrahlungskalender, Informationen zum Behandlungsablauf und sein persönliches Armband als zusätzliche Identifikation während der Behandlung. Auf diesem Armband befinden sich patientenspezifische Daten. Diese Informationen werden vor jeder Bestrahlung elektronisch abgelesen, um Verwechslungen auszuschließen. Um die hohe Präzision der Protonentherapie ideal nutzen zu können, ist es wichtig, dass sich der Tumor bei jeder Bestrahlung an derselben Stelle befindet. Hierfür kommen unsere Patienten vor der ersten Bestrahlung in die sogenannte Moulageanpassung. Zur Immobilisation erhält der Patient eine eigens an ihn angepasste Liege, die es dank eines Vakuumsystems möglich macht, den Patienten bei jeder Bestrahlung wieder in die gleiche Position zu bringen. 15 DER WEG DES PATIENTEN IM CENTER DER WEG DES PATIENTEN IM CENTER Die Bestrahlung in der Gantry Die Bestrahlung findet in einer der sogenannten „Gantries“ statt. Diese wiegen 150 Tonnen, haben einen Durchmesser von 11 Metern und können innerhalb einer Minute um 360° sub-millimetergenau um den Patienten gedreht werden. Der Patient kann so aus medizinisch optimalen Richtungen bestrahlt werden. Im Gegensatz zur Röntgenbestrahlung wird hier mit äußerster Präzision in allen drei Raumdimensionen gezielt. Der Strahl kann mit Abweichungen von weniger als 1 Millimeter hochpräzise geführt werden. Für die Protonenbestrahlung verwendet das RPTC ein spezielles „Voxel-to-Voxel-Modulated“-Scanning-Verfahren, das die modernste Form der Protonentherapie darstellt, um den Tumor punktgenau rasterartig – mit bis zu 25.000 Zielpunkten im Tumor – abzufahren. Die Eindringtiefe des Strahls wird über die variierbare Protonengeschwindigkeit gesteuert. Dieses Verfahren erlaubt als einziges, die Therapiedosis – also die Höchstdosis – streng auf den Tumor zu begrenzen. Die Anzahl der Bestrahlungen richtet sich nach der Art und Größe des Tumors. Durchschnittlich ist mit circa 16 Sitzungen insgesamt (Mo-Sa, eine pro Tag) zu rechnen. Der komplette Bestrahlungsvorgang nimmt typischerweise nur 15-20 Minuten in Anspruch, wobei die Bestrahlung an sich nur etwa 60-90 Sekunden dauert und völlig schmerzfrei ist. Pro Therapiesitzung sind im Normalfall einschließlich Vorbereitung nicht mehr als 30 bis 45 Minuten einzuplanen. In manchen Fällen werden Diagnostik und Bestrahlung in einer leichten Kurznarkose durchgeführt – etwa bei Kindern, denen das Stillhalten meist schwerfällt. Bei Tumoren der Lunge und der Leber spielen außerdem Atembewegungen eine erhebliche Rolle. Hier wird während einer Kurznarkose die Lunge durch Sauerstoffzufuhr in einen kontrolliert stabilen Zustand gebracht, der eine exakte Bestrahlung des Tumors erlaubt. Ein Sauerstoffmangel tritt nicht auf. 16 17 DER WEG DES PATIENTEN IM CENTER DER WEG DES PATIENTEN IM CENTER Gästehaus Für maximalen Komfort haben unsere ambulanten Patienten die Möglichkeit eines der schönen Einund Zweibettzimmer oder eine der Suiten im angrenzenden GÄSTEHAUS AM RPTC zu buchen. Das Gästehaus, welches sich in einer Grünanlage direkt neben dem RPTC befindet, bietet den Komfort eines gehobenen 3-4 Sternehotels mit zahlreichen Möglichkeiten zur Entspannung wie einer ruhigen Terrasse, der Hotelbar, oder einem hellen Wintergarten. An der Lobby stehen kostenfreie Magazine und die aktuellsten Zeitungen zur Verfügung. Zudem bietet das Gästehaus einen Fitnessraum, Spielplatz und ein Kinderspielzimmer. Das Internet ist kostenfrei. 18 19 RINECKER PROTON THERAPY CENTER Das Team 22 Wachwechsel: Von Prof. Herbst zu Prof. Bachtiary 24 Unser Leitungsteam 32 Unser Wissenschaftlicher Beirat 21 Wachwechsel Wachwechsel MAnfred Herbst Prof. Dr. med. Aufsichtsrat Medizin ProHealth AG WACHWECHSEL: VON PROF. HERBST ZU PROF. BACHTIARY Der Ärztliche Direktor unserer „Gründungszeit“, Prof. Dr. med. Manfred Herbst ist in unseren Aufsichtsrat gewechselt. Seine Nachfolgerin als Ärztlicher Vorstand ist Frau Prof. Dr. med. Barbara Bachtiary. Das RINECKER PROTON THERAPY CENTER war damals die erste zur Patientenversorgung, nicht zu Studien- und Experimentalzwecken gebaute ProtonenScanning-Anlage in Europa. In den USA sind ähnliche Vorläuferanlagen zwar schon seit Jahren in Betrieb, in Deutschland aber lagen keine klinischen Erfahrungen mit derartigen Therapiegeräten vor. Die Einstellung von amerikanischen Chefärzten aber scheiterte an behördlichen Vorschriften; das Verständnis des deutschen Strahlenschutzgesetzes wird behördlicherseits Fremdsprachigen nicht zugetraut. Vielerorts in Deutschland gab es immerhin schon universitäre Projekte für Protonentherapieanlagen. Im Jahr 2000 lehnte die Bayerische Landesregierung die Errichtung universitärer Protonenanlagen ab: technisch zu komplex, anscheinend nicht in die Personalstrukturen hiesiger Öffentlicher Einrichtungen passend. Zu den in ihren Zukunftsvisionen daher gescheiterten universitären Protonen-Visionären gehörte in vorderster Linie auch Herr Prof. Dr. med. Manfred Herbst. Wir hatten das große Glück, ihn nach seiner Emeritierung als Ordinarius für Strahlenheilkunde der Universität Regensburg für uns als Ärztlichen Direktor und Vorstand Medizin gewinnen zu können. 22 Er beriet uns während des Endteils des Aufbaus des Centers, oft genug führte er unsere Hand, wenn es darum ging, die Anlage auf die praktischen Belange eines radioonkologischen Klinikbetriebs hin zu tunen. Prof. Herbst therapierte den ersten, mit einem vollelektronischen, endentwickelten Protonen-ScanningSystem behandelten Patienten in Europa: an unserer Anlage am 16. März 2009. Sein Engagement, seine große klinische Erfahrung im Bestrahlungsbereich und seine souveräne Intellektualität beim Einsatz dieser fortgeschrittenen Methode prägt unsere Klinik für lange. Die hohe Strahlpräzision der Anlage, die überlegene Leistungsfähigkeit veränderte den klinischen Betrieb gegenüber allen konventionellen Röntgenbestrahlungsmethoden mehr als im Voraus geahnt: Die Möglichkeiten, mit dieser extrem exakten Bestrahlung besser zu helfen als bisher, waren kaum vorauszusehen. Noch heute sind ein Viertel unserer Patienten Krebskranke, bei denen vorher eine Röntgenbestrahlung erfolglos geblieben war (aber wegen Aufsättigung der Umgebung nicht wiederholt werden konnte) oder die andernorts für eine Bestrahlung als letztes wirksames Therapeutikum aus technischen Gründen abgelehnt werden mussten. Prof. Herbst verlässt uns nicht; obwohl an Körper und Geist ewig jung erscheinend, zog er sich im August 2012 in unseren Aufsichtsrat zurück. Wir sind sehr glücklich, ihn weiterhin an unserer Seite zu haben. Seine Nachfolgerin ist Frau Prof. (Univ. Wien) Dr. med. MSc. Barbara Bachtiary. Prof. Bachtiary stammt Barbara Bachtiary Prof. Dr. med. Vorstand Medizin ProHealth AG aus einem der größten radioonkologischen Behandlungscentren Europas am Allgemeinen Krankenhaus Wien (AKH). Sie ist eine erfahrene Radioonkologin, die für sich persönlich den Sprung zu der Fortentwicklung Protonen-Scanning gewählt hat. Ihre Aufgabe zentriert sich nach mittlerweile 1.500 mit ProtonenScanning am RPTC behandelten Krebspatienten jetzt auf die Einbindung dieser Protonentherapie in das gesamte Spektrum der Radioonkologie. Nicht zuletzt unsere kollegialen Außenbeziehungen und wissenschaftlichen Kooperationen, wie auch die Arbeit mit unserem Wissenschaftlichen Beirat sind hier wichtig. Gleichzeitig mit dieser Neubesetzung haben wir die Chefarztstruktur der Klinik geändert. Erfahrungen im praktischen Betrieb zeigten, dass die Wartungszeiten dieser Anlage sich als erfreulich kurz erwiesen haben. Das heißt, die Anlage kann täglich und wöchentlich deutlich länger betrieben werden, als dies der Arbeitszeit eines einzelnen verantwortlichen Chefarztes zuzumuten ist. Einen zeitlich präformierten Ersatz des Chefarztes durch nur nachgeordnete Ärzte wollten wir nicht anstreben. Wir haben daher das Center in zwei selbstständige Kliniken aufgeteilt, unter den Radioonkologen Dr. med. Alfred Haidenberger und Dr. med. Marc Walser. In beiden Kliniken muss das Gesamtspektrum unserer Bestrahlungsmöglichkeiten gepflegt werden; gewisse Spezialisierungen der Chefärzte sind dennoch natürlich. In dieser Konstruktion ist es entscheidend wichtig, über diesen beiden Kliniken eine verbindende Leitung zu haben: Frau Prof. Bachtiary ist als Vorstand Medizin für die Koordination bezüglich Indikationskonzepten, Qualitätskontrollen und Prozeduren zwischen den beiden Abteilungen verantwortlich. Dem entspricht die Aufnahme von Prof. Bachtiary in den Vorstand unserer ProHealth AG, wo sie zudem auch die Vertretung ärztlicher Belange in der Geschäftsführung sichert. Die ersten Monate mit dieser Struktur haben gezeigt, dass sie funktioniert und über die gesamte Anlagenbetriebszeit täglich/wöchentlich eine hohe Behandlungsqualität sichert. Hans Rinecker PD Dr. med. Dr. med. habil. Aufsichtsratsvorsitzender ProHealth AG Barbara Bachtiary Prof. Dr. med. Vorstand Medizin ProHealth AG 23 LEITUNGSTEAM LEITUNGSTEAM UNSER LEITUNGSTEAM Qualität hat bei uns oberste Priorität. Daher haben wir nicht nur eine Anlage mit der besten derzeit verfügbaren Bestrahlungstechnologie, sondern, neben unserem Wissenschaftlichen Beirat für die wissenschaftliche Begleitung unserer Arbeit, auch ein Team von erfahrenen Spezialisten aus den Gebie- ten der Radioonkologie, Diagnostik, Medizinphysik, Anästhesie und Qualitätssicherung. Technik, wissenschaftliche Beratung und hochkompetente Ärzte und Physiker arbeiten Hand in Hand, um den Patienten des RPTC die bestmögliche Therapie zukommen zu lassen. Lernen Sie unser Leitungsteam kennen: Ao. Univ.-Prof. Dr. Barbara Bachtiary Medizinischer Vorstand ProHealth AG Frau Prof. Dr. med. Barbara Bachtiary ist seit 2012 Ärztlicher Vorstand der ProHealth AG. Nach dem Studium der Biologie und der Humanmedizin an der Universität Wien wurde Prof. Bachtiary 2003 von der Universitätsklinik für Strahlentherapie der Medizinischen Universität Wien zum Facharzt für Strahlentherapie-Radioonkologie ernannt. Im Anschluss folgte ein Forschungsaufenthalt in Kanada bis 2005 und eine darauffolgende Stelle als Oberärztin für Radioonkologie an der Abteilung für Strahlentherapie der Medizinischen Universität Wien. 2006 erfolgten die Habilitation und die Ernennung zur „Außerordentliche Universitätsprofessorin“, 2008 wurde Prof. Bachtiary die Leitung der Ambulanz für HNO-Tumore an der Abteilung für Strahlentherapie der medizinischen Universität Wien übertragen bevor sie 2011 ans RPTC wechselte. 2012 hat Prof. Bachtiary die Protonenfachkunde erhalten. 1997 - 2003 Universitätsklinik für Strahlentherapie der Medizinischen Universität Wien seit 01/2003 Fachärztin für Strahlentherapie 2003 - 2005 Clinical Research Fellow, Department of Radiation Oncology, Princess Margaret Hospital, Ontario, Kanada 2005 - 2011 Oberärztin für Radioonkologie an der Medizinischen Universität Wien seit 2008 Leitung der Ambulanz für HNO- Tumore seit 06/2011 am RPTC in München seit 04/2012 Protonenfachkunde seit 2012 24 Ärztlicher Vorstand der ProHealth AG 25 LEITUNGSTEAM LEITUNGSTEAM Dr. med. Alfred Haidenberger Leitung Klinik I Dr. med. Marc Walser Leitung Klinik II Dr. med. Alfred Haidenberger ist seit Juli 2012 Chefarzt und Leiter der Strahlenklinik I am RPTC. Seine Ausbildung mit dem Abschluss zum Facharzt für Strahlentherapie hat er an der Universitätsklinik Innsbruck absolviert. Nachdem er als Oberarzt langjährige Erfahrung im Bereich der herkömmlichen Strahlentherapie gesammelt hat, erarbeitete sich Dr. Haidenberger im Jahre 2010 die Fachkunde für Protonentherapie, die ihm von der Bayerischen Ärztekammer verliehen wurde. Dr. med. Marc Walser arbeitet seit November 2010 als Strahlentherapeut am RPTC und ist dort seit Juli 2012 Leiter der Strahlenklinik II. Nach seinem Medizinstudium an der Universität Zürich absolvierte Dr. Walser seine Ausbildung zum Facharzt für Strahlentherapie am Universitätsklinikum Erlangen und am Universitätsspital Zürich. Bevor er ans RPTC wechselte, arbeitete er in der Strahlentherapie in Amberg als Oberarzt und Chefarztstellvertreter. Im Mai 2011 erlangte er die Fachkunde für Protonentherapie. Medizinstudium in Innsbruck, 1999 MD 1999 - 2005 Universitätsklinik für Radioonkologie Dr. Haidenberger war in Österreich in mehreren wissenschaftlichen Gremien und Expertenteams aktiv tätig, war 9 Jahre Vorstandsmitglied der Österreichischen Gesellschaft für Strahlentherapie/Radioonkologie (ÖGRO), Gründungsmitglied beim Tiroler Arbeitskreis Experimentelle Onkologie (TEXO) und ist seit 2010 Präsident des Vereines Zukunftsorientierte Radioonkologie (ZORO). 2003 - 2006 Klinik und Poliklinik für Strahlentherapie Innsbruck seit 12/2005 Facharzt für Strahlentherapie Universität Erlangen 2006 - 2007 Klinik für Radioonkologie Universitäts- spital Zürich 2005 - 2007 Oberarzt für Radioonkologie an der Universitätsklinik Innsbruck 2007 - 2009 Klinik und Poliklinik für Strahlentherapie Universität Erlangen 2007 - 2008 Oberarzt für Radioonkologie im Krankenhaus Wiener Neustadt 2008 - 2010 Oberarzt für Radioonkologie im seit 11/2009 Facharzt für Strahlentherapie 2009 - 2010 Strahlentherapie am Gesundheitszent- Krankenhaus Vöcklabruck seit 07/2010 am RPTC in München 26 Medizinstudium an der Universität Zürich, 2002 Diplom rum St. Marien Amberg seit 11/2010 am RPTC in München seit 02/2011 Fachkunde für Protonentherapie seit 05/2011 Fachkunde für Protonentherapie seit 2012 Leitung Klinik I am RPTC seit 2012 Leitung Klinik II am RPTC 27 LEITUNGSTEAM LEITUNGSTEAM Dr. med. Christian Zechmann Leitung Diagnostik Dr. med. Morten Eckermann Leitung Anästhesie Dr. med. Christian Zechmann ist seit 2013 Leiter der Diagnostik am RPTC. Nach seiner Ausbildung zum medizinisch technischen Radiologie-Assistenten studierte Dr. Zechmann Humanmedizin an den Universitäten Heidelberg und Mannheim. Nach Abschluss des 3. Staatsexamens folgte die Facharztweiterbildung für Radiologie an der Fakultät für Klinische Medizin Mannheim, der Universität Heidelberg sowie dem Deutschen Krebsforschungszentrum in Heidelberg. Bei letzterem war er zuletzt als Oberarzt tätig. Anschließend wechselte Dr. Zechmann in die Abteilung Nuklearmedizin der Universität Heidelberg, wo er seinen Schwerpunkt in der Diagnostik des Prostatakarzinoms um die Techniken der PET/CT (Cholin und Gallium-PSMA) vertiefen konnte. Nach Erlangung der Fachkunde Nuklearmedizin übernahm Herr Dr. Zechmann die Leitung der Diagnostik am RPTC. Durch seine Arbeit an den Universitäten Mannheim und Heidelberg und dem Deutschen Krebsforschungszentrum bringt er eine umfassende Erfahrung im Bereich der Onkologischen Radiologie mit. Dr. med. Morten Eckermann leitet seit 2009 die Anästhesieabteilung am RPTC. Nach seinem Studium an der Universität Regensburg und der Technischen Universität München und mehrjähriger Assistenzarztzeit in der Chirurgie erfolgte die Facharztausbildung zum Anästhesisten im Verbund der Städtischen Krankenhäuser in München. 2004 Universitätsklinikum Mannheim (Institut für Klinische Radiologie) 2004 - 2006 Abteilung Radiologie am Deutschen Krebsforschungszentrum Heidelberg 2005 - 2006 Rotation an die Abteilung Radiologie an der Universitätsklinik Heidelberg in die konventionelle Röntgendiagnostik und Angiographie Seit 1999 arbeitete er als Oberarzt in der Anästhesieabteilung der CHIRURGISCHEN KLINIK DR. RINECKER, bevor er 2009 die Leitung der Anästhesie am RPTC übernahm. Mit seinem Team hat er hier mehr als 2.700 Narkosen durchgeführt, die Technik und Ergebnisse der weltweit nur im RPTC realisierten Protonenbestrahlung atemverschieblicher Tumore unter Atemstillstand in Allgemeinanästhesie wurden auf diversen internationalen Kongressen vorgestellt. Medizinstudium an der Universität Regensburg und der TU München 1989 - 1992 Chirurgischer Assistenzarztzeit in den Bereichen Allgemein- und Unfallchirurgie, Plastische Chirurgie mit Schwerverbrannten-Intensivmedizin. Weiterbildung zum Facharzt für Anästhesiologie im Verbund der Städtischen Krankenhäuser in München 2007 - 2008 Funktionsoberarzt am Deutschen Krebsforschungszentrum Heidelberg seit 08/1998 Facharzt Anästhesie seit 07/2008 Facharzt für Radiologie 2008 - 2009 Oberarzt am Deutschen Krebsfor- 1999 - 2009 Oberarzt an der CHIRURGISCHEN KLINIK DR. RINECKER schungszentrum Heidelberg 2009 - 2012 Nuklearmedizin an der Universitäts- seit 2009 Leitung Anästhesie am RPTC klinik Heidelberg seit 01/2013 Leitung Diagnostik am RPTC 28 29 LEITUNGSTEAM LEITUNGSTEAM Markus Wilms Leitung klinische Qualitätssicherung Christian Skalsky Leitung Medizinphysik Markus Wilms ist seit 2009 Fachoberarzt im Rinecker Proton Therapy Center in München. Nach dem Studium der Humanmedizin an der LudwigMaximilians-Universität in München war Herr Wilms Assistenzarzt in der Radiologischen Gemeinschaftspraxis Ingolstadt tätig. 2004 wurde Herr Wilms Facharzt für Strahlentherapie, seit 2009 hat er ebenso die Fachkunde für Protonentherapie. Dipl.-Phys. Christian Skalsky ist seit Dezember 2008 als Medizinphysiker am RPTC tätig, seit März 2010 leitet er die Abteilung für Medizinphysik am RPTC. Nach dem Physikstudium an der Universität Regensburg und dem Abschluss der Diplomarbeit über Protonentherapie an der Klinik und Poliklinik für Strahlentherapie und Radioonkologie am Universitäts-Klinikum Regensburg war Herr Skalsky dort als Physiker an der Klinik und Poliklinik für Strahlentherapie und Radioonkologie tätig bevor er 1996 als Medizinphysiker an das Institut für Strahlentherapie und Nuklearmedizin am Klinikum Rosenheim wechselte. Dort war Herr Skalsky von 2000 - 2005 unter anderem auch als Dozent im Fach Physik an der Berufsfachschule für Krankenpflege/-hilfe und von 2004 – 2006 als verantwortlicher Physiker für die technische Umstrukturierung des Instituts für Strahlentherapie und Nuklearmedizin in das Medizinische Versorgungszentrum am Klinikum Rosenheim GmbH für Strahlentherapie und Nuklearmedizin tätig. Nach der Umstrukturierung arbeitete er bis zum Wechsel an das RPTC dort als verantwortlicher Medizinphysiker. Von 2004 bis 2008 war Herr Skalsky zudem betreuender Medizinphysik-Experte der Nuklearmedizin an der Klinik Bad Trissl und am Inn-Salzach-Klinikum. Studium an der LMU München 1998 - 2005 Assistenzarzt in Radiologischer Gemeinschaftspraxis Ingolstadt seit 06/2004 Facharzt für Strahlentherapie 2005 - 2009 Facharzt am RPTC seit 06/2006 Beauftragter für Qualitätsmanage- ment am RPTC seit 05/2009 Protonenfachkunde seit 2009 Fachoberarzt am RPTC seit 10/2011 Leitung klinische Qualitätssicherung Studium an der Universität Regensburg 1996 Medizinphysiker an der Klinik und Poliklinik für Strahlentherapie und Radioonkologie der Universität Regensburg 1996 - 2006 Medizinphysiker im Institut für Nuklearmedizin und Strahlentherapie am Klinikum Rosenheim 2004 - 2008 Betreuender Medizinphysik-Experte der Nuklearmedizin an der Klinik Bad Trissl und am Inn-Salzach-Klinikum 2006 - 2010 Medizinphysiker im Medizinischen Versorgungszentrum am Klinikum Rosenheim für Strahlentherapie und Nuklearmedizin seit 03/2009Protonenfachkunde seit 2010 30 Leitender Medizinphysiker am RPTC 31 WISSENSCHAFTLICHER BEIRAT WISSENSCHAFTLICHER BEIRAT UNSER WISSENSCHAFTLICHER BEIRAT Ein weiteres Unternehmens-Highlight des vergangenen Jahres war die Einrichtung des Wissenschaftlichen Beirats. Es ist dem RPTC gelungen, einen Kreis hervorragender Berater zusammenzurufen. Aufgabe dieses Beirats ist es, die klinischen Tätigkeiten des RPTC wissenschaftlich zu begleiten. Hauptziele sind dabei eine beständige Verfahrensoptimierung, und die Definition des RPTC als Leistungserbringer innerhalb der Radioonkologie in Deutschland und Europa. Es gilt, die Leistungsfähigkeit der Protonentherapie im Kontext der verschiedenen heute zur Verfügung stehenden Behandlungsmöglichkeiten zu definieren. 32 Das RPTC hat mit über 1.500 behandelten Patienten in vier Jahren nunmehr nicht nur eine hohe Zahl an Patienten bestrahlt, weltweit die meisten mit vollelektronischem Protonen-Scanning, sondern verfügt auch über aussagekräftige Daten aus der Nachbeobachtung. Daher wurde jetzt der wissenschaftliche Beirat zur Bewertung unserer Erfahrungen eingerichtet. Die Teilnehmer sind hervorragende Persönlichkeiten aus den Bereichen der Medizin und des Gesundheitswesens im Allgemeinen. Die Gruppe der Ärzte und Medizinphysiker wird durch ärztliche Vertreter der gesetzlichen Krankenkassen ergänzt, um das Protonen-Scanning auch aus der Sicht der Kostenträger einzuwerten. Ao. Univ.-Prof. Dr. Barbara Bachtiary Medizinischer Vorstand ProHealth AG Beruflicher Werdegang: • Seit 07/2012 Ärztlicher Vorstand der ProHealth AG • Seit 04/2012 Protonenfachkunde • Seit 06/2011 Tätigkeit als Fachärztin für Radioonkologie am RPTC • 2005 - 2011 Oberärztin für Radioonkologie an der Abteilung für Strahlentherapie der Medizinischen Universität Wien; seit 2008: Leitung der Ambulanz für HNO-Tumore • 2006 Habilitation: Lehrbefugnis für Strahlentherapie und Radioonkologie • 2003 - 2005 Clinical Research Fellow, Department of Radiation Oncology, Princess Margaret Hospital, Ontario Cancer Institute, Toronto, Canada • 01/2003 Anerkennung zur Fachärztin für Strahlentherapie-Radioonkologie • 1997 - 2003 Assistenzärztin in Ausbildung zur Fachärztin für Strahlentherapie-Radioonkologie an der Universitätsklinik für Strahlentherapie der medizinischen Universität Wien • 1997 Anerkennung zur Ärztin für Allgemeinmedizin (jus practicandi) Frau Prof. Dr. Barbara Bachtiary vertritt die ProHealth AG und damit das RPTC im Wissenschaftlichen Beirat. 33 WISSENSCHAFTLICHER BEIRAT WISSENSCHAFTLICHER BEIRAT Prof. Dr. med. Christian G. Chaussy Facharzt für Urologie Jürgen Malzahn Leiter der Abteilung „Stationäre Versorgung, Rehabilitation“ im AOK-Bundesverband, Berlin Beruflicher Werdegang: Beruflicher Werdegang: • S tudium an der Ludwig-Maximilians-Universität München, 1972 Promotion, danach am Institut für Chirurgische Forschung. • 1975 Entwicklung der Extrakorporalen Stoßwellenlithotripsie, Februar 1980 Behandlung des ersten Patienten • 1981 Professor für Urologie in München, 1984 Professor für Urologie an der University of California Los Angeles, 1986 – 2010 Leiter der Urologie am Klinikum Harlaching in München • Beratende Professur Universität Regensburg, Professur an der Keck School of Medicine California • Ab 1996 in Harlaching Behandlung von Prostatakrebs durch Ultraschall (High Frequency Focused Ultrasound, HIFU). • Weitere Auszeichnungen: Maximilian Nitze Preis der Deutschen Gesellschaft für Urologie, von dort auch Ritter von Frisch Preis. Lifetime Achievement Award der Endourological Society und Präsident seit 2012 dort, Ehrenmitglied des Royal College of Surgeons Edinburgh, Ehrenprofessur an der Medizinischen Hochschule Peking, Ehrenmitglied der chinesischen urologischen Gesellschaft. 34 Die Behandlung des Prostatakarzinoms ist zurzeit hoch kompetitiv: Ersatz der operativen Prostatektomie durch Röntgenbestrahlung. Versuch extreme Hypofraktionierung mit Photonen - wie mit Protonen. Wir freuen uns, mit Herrn Professor Chaussy einen weltweit geachteten Urologen gefunden zu haben, der uns bei der Dosiswahl für die Prostatabestrahlung beraten kann. • S eit 2007 Abteilungsleiter Stationäre Versorgung/ Rehabilitation im AOK Bundesverband, Berlin • 2000 – 2007 Wechsel ins Referat Krankenhäuser des AOK-Bundesverbandes und Mitarbeit beim DRG System • 1997 – 2000 Tätigkeit im Referat KrankenhausFallmanagement des AOK-Bundesverbandes • Studium der Humanmedizin in Berlin und Frankfurt am Main Herr Malzahn ist Vertreter der AOK, dem größten bundesweit agierenden Einzelanbieter gesetzlicher Krankenversicherungen. Die AOK ist ein entscheidender Partner des RPTC bei der Zurverfügungstellung der Protonenbestrahlung für gesetzlich Versicherte. 35 WISSENSCHAFTLICHER BEIRAT WISSENSCHAFTLICHER BEIRAT Prof. Dr. med. Oliver Micke Chefarzt der Klinik für Strahlentherapie und Radioonkologie am Franziskus Hospital, Bielefeld Dr. med. Klaus-Peter Thiele Stellvertretender Leiter des Kompetenz-Zentrums Onkologie der MDK Gemeinschaft, Medizinischer Dienst der Krankenkassen (MDK), Nordrhein Beruflicher Werdegang: Beruflicher Werdegang: • S eit 2006 Chefarzt der Klinik für Strahlentherapie und Radioonkologie am Franziskus Hospital, Bielefeld • Oberarzt an der Klinik und Poliklinik für Strahlentherapie – Radioonkologie, Universtitätsklinikum Münster • Wissenschaftliche und klinische Ausbildung am Universitätsklinikum Münster, Memorial SloanKettering Cancer Center in New York und Karolinska Cancer Center in Stockholm 36 Prof. Micke ist eine Kapazität auf dem Gebiet der Strahlentherapie des Pancreaskarzinoms sowie in der Neuroonkologie. Gerade die Protonentherapie im Scanningverfahren hat am RPTC zu neuen, erfolgreichen Therapiekonzepten für das Pancreaskarzinom geführt. Auch die Bestrahlung von Tumorerkrankungen im Schädel- wie im Wirbelsäulenbereich gilt international als klassische Domäne der Protonentherapie. • S eit 2000 Stellvertretender Leiter KompetenzZentrum Onkologie. MDK Nordrhein • Assistenzarzt Uniklinik Düsseldorf, Abt. Hämatologie, Onkologie und Klinische Immunologie Dr. Thiele ist als stellvertretender Leiter des Kompetenz-Centrums Onkologie der MDK-Gemeinschaft, MDK Nordrhein auch Mitglied im gemeinsamen Bundesausschuss der Ärzte und Krankenkassen (GBA). In den wissenschaftlichen Beirat beauftragt von der AOK Bayern. Dr. Thiele ist damit von großer Bedeutung für eine Eingliederung der Protonentherapie in das deutsche öffentliche Gesundheitssystem. 37 WISSENSCHAFTLICHER BEIRAT WISSENSCHAFTLICHER BEIRAT Prof. Dr. rer. nat. Jan J. Wilkens Leiter Medizinphysik der Klinik für Strahlentherapie und Radiologische Onkologie, Technische Universität München Prof. Dr. med. Normann Willich Geschäftsführer der Deutschen Gesellschaft für Radioonkologie (DEGRO) Leiter Register zur Erfassung radiogener Spätfolgen bei Kindern und Jugendlichen (RISK) Beruflicher Werdegang: Beruflicher Werdegang: • S eit 2009 Associate Editor – „European Journal of Medical Physics“ • Seit 2008 W2-Professor für das Fachgebiet “Advanced Technologies in Radiation Therapy” Technische Universität München • 2004-2008 Wissenschaftlicher Mitarbeiter am Deutschen Krebsforschungszentrum • 2006 Post Doctoral Research Associate an der Washington University in St. Louis • 2005 Fachanerkennung für Medizinische Physik” der Deutschen Gesellschaft für Medizinische Physik e.V. (DGMP) • 2003 Research Fellow am Massachusetts General Hospital, North-East Proton Therapy Center (NPTC), Boston (USA) • 2001-2004 Promotion in Physik an der Universität Heidelberg (summa cum laude) • 2000-2002 Studium “Medizinische Physik und Technik”, Universität Kaiserslautern • 1995-2001 Studium der Physik, Universität München und University of Nottingham; Diplom 38 Prof. Dr. Wilkens hat sich ausgezeichnet durch eine langjährige Erfahrung im Bereich der Partikeltherapie mit verschiedenen Ionenarten, sowie einem Forschungsschwerpunkt in der technischen Weiterentwicklung von Protonenbeschleunigung. Auf Grund der aufwändigen und komplexen Technologie des Protonenscanningverfahrens am RPTC nimmt die Medizinphysik hier eine besondere Stellung ein. • S eit 2011 Geschäftsführer der DEGRO (Deutsche Gesellschaft für Radioonkologie) • 1991 – 2011 Direktor der Poliklinik für Strahlentherapie und Radiologie der Universität Münster • 1989 Habilitation in München • 1981 – 1989 Training Radiation Oncology Medical School, University of Munich • 1981 Promotion in Augsburg • 1976 – 1981 Weiterbildung in Chirurgie und Radiologie in Augsburg • 1974 – 1975 Medical residency in Pediatrics, Neurology/Psychiatry • Anaesthesiology, Internal Medicine, Surgery in Berlin, Oberhausen, Kiel, Augsburg, Germany • 1967 – 1974 Medizinstudium an der Universität Kiel Prof. Willich ist ein ausgewiesener Experte für Radioonkologie bei Kindern und Leiter des Registers zur Erfassung radiogener Spätfolgen bei Kindern und Jugendlichen (RISK). Protonentherapie gilt heute als der Goldstandard bei der Behandlung von Kindern. 39 RINECKER PROTON THERAPY CENTER DIE Technik 42 Die Welt des Protonen-Scannings - 2013 52 Wie oft muss der Patient bestrahlt werden? 56 Problem: Krebs als Folge einer Strahlentherapie 41 PROTONEN-SCANNING PROTONEN-SCANNING DIE WELT DES PROTONEN-SCANNINGS – 2013 Zusammenfassung für Patienten Im Gegensatz zu Röntgen erlaubt das Protonen-Scanning ein Zielen der Strahlung in allen drei Dimensionen. Dies bedeutet eine Vermeidung von Bestrahlungsschäden in der Umgebung und erlaubt eine höhere Tumordosis. Der physikalische Vorteil von Protonenbestrahlungen kann nur mit dem technischen Scanning-Verfahren voll ausgeschöpft werden, wie in der derzeit weltweit leistungsfähigsten Anlage am Münchner RPTC verwirklicht. Die Vorteile für den Patienten sind der Entfall der Neutronenbelastung über den Gesamtkörper und keinerlei Überstände der Tumordosis in das Gesunde. Derzeit wird die Hälfte aller Krebserkrankungen bestrahlt, entweder alleine oder in Kombination mit den beiden anderen Säulen der Krebsbehandlung, der Operation und der Chemotherapie. Bei einer über das Leben summierten Krebserkrankungswahrscheinlichkeit von 38% bei Frauen bzw. 45% bei Männern wird in entwickelten Ländern mindestens jeder Fünfte bestrahlt. Die Bestrahlung wird heute fast ausschließlich mit Röntgen vorgenommen, was nur in etwa der Hälfte der Krebspatienten zum lebenserhaltenden Erfolg führt. Der entscheidende Schritt: Von Röntgen zu Protonen Falls die Tumore früh genug in ihrem Krankheitsverlauf erkannt und behandelt werden, das heißt, solange nicht bereits eine ausgedehnte Metastasierung vorliegt, sind diese Probleme in aller Regel auf eine naturgesetzliche Eigenschaft der Röntgenstrahlen zurückzuführen, die auch die modernsten Verfahrensarten wie die Intensity Modulated Radiotherapie (IMRT) oder die häufig unter Produktnamen laufenden Methoden (Cyberknife, Rapid Arc) nicht vollständig überwinden können. Röntgenstrahlen sind elektromagnetische Wellen, wie das Licht, nur kurzwelliger, energiereicher und viel durchdringender. Ihre Wirkung besteht darin, im Körpergewebe das elektrische Gleichgewicht der molekularen Bestandteile zu zerstören (Ionisation) und damit die Bildung „radikaler“ Molekülbruchstü- 42 cke auszulösen, die das genetische Material der Zelle beschädigen und diese zum Absterben bringen. Bei diesem physikalischen Vorgang werden die Röntgenstrahlen absorbiert, gleichsam aufgesaugt und genau das führt dazu, dass ihre örtliche Stärke, die Ortsdosis, im Körper schnell abnimmt. Damit ist die Dosis immer unter der Haut am höchsten, im tiefer sitzenden Tumor hat sie schon abgenommen, hinter dem Tumor wird immer noch gesundes Gewebe bestrahlt. Mit anderen Worten: Röntgenstrahlen sind zweidimensional, nach oben wie unten, nach links und rechts zielbar, nicht aber in Strahlrichtung, nicht in der dritten Dimension. Diese Situation ist äußerst unbefriedigend: Jede Röntgenbestrahlung legt eine Zerstörungsspur durch den Körper, eine Konzentration innerhalb des vom gesunden Gewebe umgebenen Tumors ist unmöglich. Dabei gilt es zu bedenken, dass sämtliche Strahlungseffekte, im Gegensatz zum Beispiel zu Chemotherapeutika, nicht tumorspezifisch sind. Sie wirken auf das gesunde Gewebe genauso stark! Das hat zwar den Vorteil, dass jeder Tumor, wenn man denn weiß, wo er sitzt, wirksam bestrahlt werden könnte. Während alle Zellen Reparaturmechanismen für Strahlenschäden besitzen, die unterschiedlich wirksam sind, könnten diese doch durch technisch einfach zu bewerkstelligende Dosiserhöhungen überspielt werden. Das heißt einerseits, dass Resistenzentwicklungen – die die Chemotherapie so belasten – nicht auftreten können. Das heißt andererseits aber, dass in der klinischen Praxis die auf den Tumor mit Röntgen anwendbare Dosis regelhaft durch die Nebenwirkungen, durch die Schäden im Gesunden begrenzt wird. Wie kann mit Röntgen der Tumor dann überhaupt aus seiner Umgebung sozusagen herausgelöst werden? Einfach dadurch, dass man aus verschiedenen Richtungen konzentrisch auf ihn einstrahlt. Dies ist durch die genannten neueren Methoden optimiert worden. In allen Fällen aber bedeutet die mit Röntgen durch die Nutzung vieler Strahlrichtungen erzielbare Konzentration im Tumor nur einen Austausch der Dosishöhe im Gesunden gegen die Menge des bestrahlten gesunden Gewebes. Das heißt einfach, die gesunden Zellen der Umgebung bekommen dann zwar eine niedrigere Dosis, dafür werden mehr gesunde Zellen erfasst. Diese unvermeidbare Erhöhung des bestrahlten Volumens sollte nicht leicht genommen werden: Jede für eine Zelle nicht tödliche Bestrahlung belegt diese auch mit dem Risiko einer späteren Tumorauslösung eben durch die Bestrahlung. Siehe unten: „Problem: Krebs als Folge einer Strahlentherapie“. Ein „Röntgen-Strahlenbad“ bedeutet zudem im Individualfall zahllose Nebenwirkungen. Beispielsweise, bei der Bestrahlung von Tumoren im Halsbereich die Erfassung mehr oder minder aller Speicheldrüsen, eine extrem belastende Behandlungsfolge, oder die Erfassung hoher Volumina gesunder Hirnanteile, was wiederum gerade bei Kindern zu späteren Intelligenzdefekten führt und vieles mehr. Der Atomphysiker Robert Wilson schlug 1946 vor, durch die Nutzung eines ziemlich exotisch erschei- 43 PROTONEN-SCANNING PROTONEN-SCANNING nenden physikalischen Effektes, diese Unzulänglichkeiten der Röntgentherapie zu umgehen. 1905 hatte der englische Physiker William Henry Bragg folgenden Effekt bei Protonen entdeckt: Protonen, das sind die an sich harmlosen Atomkerne des Wasserstoffs, des häufigsten Elementes im Kosmos und in uns (nicht zu verwechseln sind sie mit den sogenannten Photonen, den von Einstein so benannten Energiepaketen der elektromagnetischen Strahlung, damit des Lichts und von Röntgen). Werden Protonen in komplizierten Strahlungsquellen, den mit elektromagnetischer Energie arbeitenden Zyklotronen oder Synchrotronen auf sehr hohe Geschwindigkeiten beschleunigt (bis 180.000 km/Sek. im RPTC), dringen sie bis zu 38 cm in den menschlichen Körper ein. Auch sie ionisieren – sie wirken in den Zellen grundsätzlich gleich wie Röntgen. Durch ihre bei der hohen Geschwindigkeit zunächst recht niedrige Ionisierung werden sie aber nicht absorbiert, sondern einfach verlangsamt, und je langsamer sie werden, umso mehr stören sie die Elektronenhüllen der Atome, und umso mehr werden sie gebremst. Diese Bremsung eskaliert zu einem scharfen Gipfel der örtlichen Ionisation. schwindigkeit der Protonen in der Tiefe zu justieren (Abbildung 1). Endlich eine Bestrahlung, die nicht nur zwei, sondern dreidimensional gezielt und damit im Tumor konzentriert werden kann! Für den Patienten bedeutet das, ihn vom Durchschlageffekt der Röntgenstrahlung zu befreien; hinter dem Tumor (in Strahlrichtung gesehen) erfährt der Patient keinerlei Strahlungsbelastung mehr und vor dem Tumor ist die Strahlendosis im Gegensatz zu Röntgen nicht höher, sondern niedriger (Abbildung 2). rilisieren, oder anders gesagt, wie das Dosisverhältnis Zielgebiet zu gesunder Umgebung ist. Diese Werte hängen natürlich von der gegebenen Anatomie ab; von dem Verhältnis Tumorvolumen zu Körperumfang im Bestrahlungsgebiet. In der Praxis wird bei allen Röntgenmethoden etwa das Drei - bis Fünffache der Tumordosis in die gesunde Umgebung gestrahlt. Mit Protonen wird, abhängig von der angewandten Methode, siehe unten, ein Verhältnis eins zu eins oder besser erreicht. Die Lage dieses Bragg-Peaks, dieses Ionisationsgipfels nun ist einfach durch Einstellung der Ge- Wir erkennen, dass die Effizienz einer Bestrahlungsmethode einfach davon abhängig ist, wie viel gesunde Zellen geschädigt werden, um eine Tumorzelle zu ste- Noch ist das „gelobte Land“ der Strahlentherapeuten nicht erreicht, aber der größte Teil des Weges schon zurückgelegt. Gemessene Bragg-Peaks am RPTC Dosisverteilung im Verlauf Röntgen / Protonen 90 MeV 95 MeV Tumor 100 MeV 105 MeV Röntgen 110 MeV 115 MeV 120 MeV 80 125 MeV 130 MeV Dosis (%) 135 MeV 140 MeV 60 145 MeV 150 MeV 160 MeV 40 170 MeV 180 MeV 190 MeV 200 MeV 20 210 MeV 220 MeV 230 MeV 250 MeV 0 0 50 100 150 200 250 Tiefe in Wasser (mm) 44 300 350 400 450 Abbildung 1: Am RPTC vermessene Dosisverteilungen. Man erkennt den typischen Verlauf; bei Einstrahlung von links ergibt sich im Einlaufbereich zunächst eine niedrige Dosis-Deposition. Am Ende der Laufbahn zeigt sich die typische Dosis-Eskalation: der Bragg-Peak. Gezeigt sind die Bragg-Peaks für eine Auswahl von am RPTC einstellbaren Protonengeschwindigkeiten (kinetische Energien in MeV). Die Eindringtiefe kann damit beliebig variiert werden. Abbildung 2: Gezeigt ist ein Vergleich von Röntgenstrahlung und Protonenstrahlen hinsichtlich der Dosisverteilung im Verlauf der Eindringtiefe in den Körper bei Einstrahlung von links. Zu erkennen ist der typische Bragg-Peak bei einer gewählten Eindringtiefe von 25 cm, der die Dosis hauptsächlich im Tumor deponiert sowie der typische, physikalisch bedingte, exponentielle Abfall der Dosis bei Röntgenstrahlung. Damit ergibt sich dort eine höhere Dosisbelastung vor dem Tumor sowie eine immer noch erhebliche Dosisbelastung hinter dem Tumor. Linearbeschleuniger 15 MV Bragg-Peak 1 Protonen 190 MeV kinetische Energie = 25cm Eindringtiefe Energiedosis 100 Strahlrichtung 0 0 10 20 30 40 Eindringtiefe (cm) 45 PROTONEN-SCANNING PROTONEN-SCANNING Die Optimierung: Vom ProtonenScattering zum Protonen-Scanning ten Plastikteil, das die (in Strahlrichtung gesehene) Tumorhinterwand widerspiegelt (Abbildung 3). Die Anwendung von Protonen zur Krebsbestrahlung geschah zunächst mit einer Zielmethodik, die heute als Scattering-System bezeichnet wird. Mit dem Scattering-System ist bis heute der Großteil der 95.000 mit Protonen weltweit therapierten Krebsfälle behandelt worden; diese Anlagen sind in Betrieb und wurden bis in jüngster Zeit noch in Betrieb genommen. Kein Hersteller bietet sie für die Zukunft an. Historisch ist es schwer, nachzuvollziehen, warum zunächst diese Methode gewählt wurde. Die Alternative, das erst in jüngster Zeit zum Einsatz gekommene Protonen-Scanning beruht schließlich auch auf einer altehrwürdigen Technik: dem Lenkverfahren für die Elektronenstrahlen in den alten Röhrenfernsehern. Mit diesen komplexen Gerätschaften handelt man sich eine ganze Reihe von Nachteilen und Problemen ein: Die Strahlenquellen (Zyklotrone oder Synchrotrone) liefern die Protonen als bleistiftdünnen Strahl, der so auch in Vakuumröhren, die von Magneten umgeben sind, zum Patienten geleitet wird. Beim Scattering wird dieser Strahl zunächst durch speichenradartig geformte rotierende Filter geschickt, die durch unterschiedliche Verlangsamung der Protonen den Bragg-Peak nacheinander in die verschiedenen Tiefenschichten des Tumors justieren. Anschließend werden ein oder zwei weitere speziell geformte Filter passiert, um den Strahl gleichmäßig über mehr oder minder große Bestrahlungsfelder zu verbreiten. Dann wird ein dritter Filter durchquert, der aus einer randbegrenzenden Schablone besteht und einem gefräs- 46 • Die Begrenzerschablonen und der die tumorkonformale Anpassung bewirkende Filter muss für jede Strahlrichtung bei jedem Patienten, das heißt auch mehrfach für einen Fall, individuell gefräst werden. Dies führt zu Verzögerungen zwischen der Gewinnung der Fertigungsdaten bei der Therapieplanung und dem Bestrahlungsbeginn und erhöht das Risiko von Positionsveränderungen im Tumor (Wachstum) bzw. in der Umgebung (Gewichts- und Volumenverluste). • Die gesamte Maschinerie muss für jeden Patienten und für jeden Feldwechsel ausgetauscht werden, wozu die um den Patienten zirkulierenden schweren Strahlführungsapparaturen (die sogenannten Gantries) meist in eine Nullstellung gedreht werden müssen. Dies verzögert den Behandlungsablauf und strahlenbelastet das Personal, da die Schablonen bei häufigerem Gebrauch kurzzeitig radioaktiv werden. gering, aber: (im Folgenden werden Dosen in Gray angegeben, dies sind absorbierte Dosen. Bei Protonen, die den Körper nicht mehr verlassen, entsprechen diese per Definition in etwa den Sievert Dosen, die die Einstrahldosis angeben und üblicherweise zur Quantifizierung der Strahlengefährdung verwendet werden). Bei einer therapeutischen lokalen Dosis von bis zu 80 Gray bedeutet die Neutronendosis „nur“ 0,3%, immerhin ca. 240 auf den Körper Scattering- und Scanning-Technik im Vergleich Dosis-“Überstände“ Scattering-Technik mit festem Kollimator Harvard, Loma Linda Scanning-Technik Und für den Patienten: • Wann immer beschleunigte Protonen auf Materie treffen, das heißt auf die Filter, kollidieren sie mit Atomkernen, wodurch Neutronenstrahlung entsteht. Diese ist teilweise in Richtung Patient konzentriert. Zwar ist der Anteil dieser Strahlenverluste des Patienten wirkende Millisievert-Neutronendosis. Bereits ab 5000 Millisievert (ausgedehnte Körper-Teilbestrahlung) treten erhebliche körperliche Schäden mit Todesfolge auf 1. Siehe unten Beitrag: „Problem: Krebs als Folge der Strahlentherapie“. • Der entscheidende Nachteil des Scattering-Systems ist, dass mit dem gefrästen Bolus der Dosisstopp sehr genau „konform“ der Tumorhinterwand, dies in Strahlrichtung gesehen, angepasst werden kann. Bei Abbildung 3: Veranschaulichung der beiden Protonentherapietechniken: Scattering und Scanning. RPTC München Scanningmagnete 47 PROTONEN-SCANNING PROTONEN-SCANNING einem nicht überall tiefengleichen, das heißt etwa würfelförmigen, Tumor treten jedoch bei diesem Verfahren unweigerlich vordere Überstände in Höhe der Tumordosis auf (Abbildung 4). • Dies ist immer noch besser als bei Röntgen, wo die vordere Dosis naturgemäß höher ist als die Tumordosis, aber massiv nachteilig im Vergleich zum Scanning-Verfahren. Die unbestritten technisch und strahlenbiologisch beste Applikationsform für Protonen ist das Scanning-Verfahren (Synonyme Pencil-Beam-scanning, Raster-Scanning und andere). Dies funktioniert mit sozusagen null mechanischem Aufwand, dafür aber mit einer komplexen elektronischen Steuerung, die auf schwere Magnete (am RPTC 0,8 to) wirkt. Der bleistiftdünne Strahl wird mit zunächst hoher, dann mit immer niedrigerer Eintrittsgeschwindigkeit durch rein magnetische Ablenkung mäanderförmig über den Tumor geführt, wobei ein X- und ein Y-Achsen- magnet genutzt werden. Dieser Vorgang wird Tiefenschicht für Schicht wiederholt; die Schichteinstellung erfolgt durch patientenferne Regulation der Protonengeschwindigkeit. Das Ergebnis sind einzelne überlappende Spots, deren Abstand der Strahlfleckgröße exakt angepasst wird. Bei einem sehr großen Tumor (5,5 l am RPTC) werden somit in einer Bestrahlungssitzung 25.000 Spots abgetastet. Die Elektronik steuert und archiviert die Dosis jeden einzelnen Spots. Die Dosisverteilung ist dementsprechend Spot für Spot Protonen-Scanning Protonen Scattering Bolus Dosisüberstände bei Scattering Scanning Kugelförmiger Tumor Protonen Scattering Bolus Scanning Dreieckförmiger Tumor x-Richtung (mm) 48 • Es gibt keine signifikante Neutronenbelastung über den Gesamtkörper. • Es gibt keinerlei vordere Überstände der Tumordosis. KEINE Dosisüberstände bei Scanning Abbildung 4: Veranschaulichung der Dosisüberstände beim Scattering-Verfahren. Dargestellt sind Therapieplanvergleiche gerechnet auf einen homogenen Patientenkörper mit zum Einen einem kugelförmigen Tumor und zum Anderen einem dreieckförmigen Tumor. Abbildung 5: Der Protonenstrahl wird beim Scanning mäanderförmig zu den im Therapieplan berechneten Positionen bewegt – gescannt. Dies erfolgt für jede Tiefenschicht, wodurch der Tumor dreidimensional abgetastet wird. In der Abbildung entsprechen die blauen Punkte den Spot-Mittelpunkten, die Verbindungslinien den Bewegungen. y (Schritte) y-Richtung (mm) Dosisüberstände bei Scattering völlig beliebig. An jeder Stelle des Tumors kann die Dosis in weiten Bereichen frei gewählt werden, jedes Dosisbild ist gestaltbar (es könnte sogar der Ortsdosisverlauf von Röntgen simuliert werden) (Abbildung 5 und Abbildung 6 auf Seite 50). Der entscheidende Vorteil ist für den Patienten: x (Schritte) 49 PROTONEN-SCANNING PROTONEN-SCANNING Dies ist das heute einzige Verfahren, das durch Beschränkung der Therapiedosis allein auf das gewünschte Zielvolumen die optimale Patientenschonung gewährleistet und gleichzeitig die optimale Dosis im Tumor. Am RPTC liegt durch die eingesetzte elektronische Steuerung und Überwachung die Präzision der Tiefenschichten, in der Z-Achse, bei 0,5 Millimeter. Alle auch kleinen Toleranzen in der Strahlzulieferung werden durch Nachsteuerung der Scanning-Magnete auf 1,0 Millimeter in den X- und Y-Achsen begrenzt. Die Abweichungen der Dosis Spot to Spot liegen unter 5%. Die Homogenität der Dosisverteilung durch die Spots ist besser als 2% der Dosis. y (cm) Scanning-Muster x (cm) 50 Abbildung 6: Scanning-Muster eines tatsächlichen klinischen Falles. Dargestellt sind die Mäander des Protonenstrahls für einige beispielhafte Tiefenschichten. Wird aufgrund des Bestrahlungsplanes und einer bereits stattgefundenen Bestrahlung von tiefer gelegenen Schichten an bestimmten Spot-Positionen keine Dosis benötigt, so werden diese Spots bei ausgeschaltetem Strahl übersprungen (zu erkennen an den roten Punkten). Die Protonenbestrahlung hat mit dem vollelektronischen Scanning-System ihre Reife erreicht. Welche Systeme existieren weltweit zurzeit? • Das RPTC in München ist als Beispiel genannt. • Die Anlage des Scripps University in San Diego, Kalifornien wird 2013 mit Präzisionswerten in der gleichen Größenordnung in Betrieb gehen. • MD Anderson in Houston, USA, die weltweite Nr. 1 im Krebstherapien Ranking, betreibt ebenfalls eine moderne Scanning-Anlage, die technisch bedingt noch einen etwas breiteren Strahl aufweist. • In der Forschungsanlage des Paul Scherrer Instituts in Villingen, Schweiz - die Scanning-Pioniere - wird ein partielles Scanning-System angewandt, das elektronisch die X- und Z-Achsen steuert, für die Y-Achse wird noch ein mechanischer Vorschub des Gesamtpatienten eingesetzt. • Im Deutschen Krebszentrum Heidelberg wird ein vollelektronisches Scanning-System genutzt. Da die Anlage jedoch technisch primär auf Heavy Ions ausgelegt ist, nicht auf Protonen, werden oben genannte Präzisionswerte nicht erreicht. • Anlagen mit dem sogenannten „Uniform Scanning“ sind im Prinzip keine Scanning Anlagen, lediglich die Filter zur Strahlspreizung werden durch ein festeingestelltes elektronisches Strahl „Wobbling“ ersetzt. Literaturverzeichnis: 1) UNSCEAR: Genetic and Somatic Effects of Ionizing Radiation. United Nations Scientific Committee on the Effects of Atomic Radiation (1986) UNSCEAR: Sources, Effects and Risks of Ionizing Radiation. United Nations Scientific Committee on the Effects of Atomic Radiation (1988) ICRP Publication 60: 1990 Recommendations of the International Commission on Radiological Protection. Annals of the ICRP 21 (1991) 51 GEHEIMNIS DER HYPOFRAKTIONIERUNG GEHEIMNIS DER HYPOFRAKTIONIERUNG WIE OFT MUSS DER PATIENT BESTRAHLT WERDEN? DAS GEHEIMNIS DER HYPOFRAKTIONIERUNG Zusammenfassung für Patienten Neuere Analyseverfahren für die Notwendigkeit von Bestrahlungswiederholungen - heute bis zu 41 Mal - zeigen gleiche Erfolge bei wesentlich verringerten Zahlen der täglichen Bestrahlungssitzungen und damit eine wesentlich verringerte Behandlungsdauer. Dies gilt sowohl für die Röntgen- wie für die Protonenbestrahlung. Die für Protonen-Scanning typische Strahlkonzentration im Tumor erleichtert die Verkürzung der Behandlungsdauer: erfolgt die Schonung des Gesunden bei Protonen doch bereits durch die räumliche Konzentration der Strahlungswirkung. Das RPTC hat z.B. bei Prostatakarzinomen die übliche Behandlungszahl von 41 Sitzungen bereits auf 21 reduziert. Wir arbeiten dran, uns vorsichtig noch kürzeren Behandlungsdauern zu nähern - wegen der höheren Sterilisationseffektivität der Behandlungsverkürzung im Tumor erlaubt es dies auch, mit kleineren Gesamtdosen auszukommen. 52 Naturgemäß ist es für jeden Patienten wichtig, wie oft er bestrahlt werden muss; das heißt, wie lang seine Krebsbehandlung dauert. In der Regel werden die Bestrahlungen einmal täglich vorgenommen. Verfahren mit Bestrahlungswiederholungen am Tage wurden versucht, konnten sich aber nicht durchsetzen. Während theoretisch eine pausenfreie Bestrahlungsfolge sinnvoll erscheint, sind in der Praxis Gruppierungen der Sitzungen üblich: Fünf Wochentage, dann zwei freie Tage am Wochenende. Das RPTC strebt langfristig eine sechs plus eins Lösung an – Überlegungen, die auch von betrieblichen Gegebenheiten wie Zeitbedarf für Wartungsarbeiten usw. abhängen. Wie viele Einzelbestrahlungen hat der Patient nun zu erwarten? Er kann mit drei bis zu einundvierzig Bestrahlungswiederholungen konfrontiert werden. Um diese überraschende Vielfalt zu erklären, konzentrieren wir uns auf die ausschließlich strahlenbiologischen Gesichtspunkte. Leider gibt es auch andere: Während in Deutschland bei gesetzlich versicherten Patienten die Vergütung für Protonenbestrahlungen mittels Pauschalbeträgen pro Fall durchgesetzt worden ist – dies gilt noch nicht für alle Privatpatienten – werden in den USA die Bestrahlungssitzungen einzeln vergütet. Als nahezu einzige Abweichung von der hierzulande üblichen pauschalen Vergütungsnorm werden auch in Deutschland Röntgenbestrahlungssitzungen in Gruppen, das heißt, von der Zahl abhängig bezahlt. Es ist damit für den Behandelnden vorteilhaft, möglichst viele Einzelbestrahlungen an einem und demselben Patienten vorzunehmen. Aber lassen wir dies beiseite. Bei der Bestrahlung von Gehirntumoren gibt es Sonderaspekte, die für eine Vielzahl von Einzelbestrahlungen sprechen: Es kann nach der Bestrahlung zu einer wenn auch geringfügigen Schwellung im Bestrahlungsbereich kommen, die sich in dem knochenbegrenzten Raum des Hirnschädels negativ auswirken kann. Für andere Tumore im Körper gilt dies nicht. Scanning wie im RPTC, tritt zudem die Tumordosis nirgendwo außerhalb des gewollten Zielgebiets auf (im Gegensatz zur älteren Scattering-Methode bei Protonen). Damit stellt sich die Frage neu, wann eine Aufteilung der Strahlendosis, und warum sie noch sinnvoll ist und in welchem Maße: dreimal oder gar einundvierzig Sitzungen? Am RPTC wurden bisher schon Tumore bis 5,5 l Volumen bestrahlt, eine Ausnahme allerdings. Eine so große Zellmenge einer praktisch einzeitigen Sterilisation auszusetzen, würde wahrscheinlich die vorhandenen biologischen Abbausysteme des Körpers überlasten. Die entscheidende Frage ist immer, welches Gewebe, gesund oder tumorös, sich wie schnell erholt. Die Erholungsmechanismen sind bekannt. Eine wenig diskutierte Rolle spielt die Gefäßversorgung der Tumore. Nahezu alle Körperzellen, so auch die der Tumore, sind auf die Versorgung mit unmittelbar angrenzenden kleinsten Blutgefäßen, den Kapillaren angewiesen. Der Abstand Zelle zum nächsten Gefäß beträgt in der Regel nur 200 Mikrometer. Ein Tumor kann sich daher nur dann über mikroskopische Größenordnungen hinaus ausbreiten, wenn es ihm gelingt, durch entsprechende Botensubstanzen das Blutgefäßsystem zur Bildung von Neugefäßen anzuregen. Blutgefäße, möglicherweise besonders solche nachträglich gewachsene, sind strahlenempfindlich. Beispielsweise können Blutschwämme durch Strahlung zur Thrombosierung, zum Verschluss gebracht werden. Dieser wenig untersuchte Mechanismus würde an sich für die Anwendung der Bestrahlung in möglichst wenigen, aber möglichst hohen Einzeldosen sprechen. Von diesem Mechanismus abgesehen hat jede Zelle ein extrem erfolgreiches Reparaturverfahren, das den von der Strahlung entscheidend getroffenen Zellbestandteil, das Genmaterial, wie- Die meisten Tumore allerdings, in der Regel wesentlich kleiner, könnten in einer Sitzung abgetötet werden. Von Sonderfällen abgesehen, rechtfertigt sich die Aufteilung der Bestrahlungseinwirkung auf verschiedene Sitzungen an mehreren Tagen nur durch den Versuch, miterfasstem gesundem Gewebe zwischen den einzelnen Bestrahlungssitzungen eine Erholungschance zu geben. Dies kann Gewebe im Zielgebiet, das sich räumlich vom Tumor nicht abdifferenzieren lässt, oder Gewebe im Zugangsweg für die Strahlung, bzw., bei Röntgen auch im Strahlenaustrittsbereich betreffen. Da bei Protonen, wie bereits vielfach erörtert, die Strahlendosis im Zuflussbereich niedriger ist als bei Röntgen, und hinter dem Tumor keine Strahlung mehr auftritt, muss die Notwendigkeit dieser Vielfachbestrahlung neu diskutiert werden. Bei der moderneren Methode der Protonenbestrahlung, dem Protonen- 53 GEHEIMNIS DER HYPOFRAKTIONIERUNG GEHEIMNIS DER HYPOFRAKTIONIERUNG der in Ordnung bringt. Das genetische Material, die DNA liegt während ihrer überwiegenden Ruhezeit in sogenannten Doppelsträngen vor, die sich spiralig umeinander winden. Die genetische Information ist doppelt, nämlich in beiden der eng aneinanderliegenden Stränge gespeichert: Die den Code bildenden Moleküle der Sprossen dieser gewundenen Leitern ergänzen sich gegenseitig. Nun gibt es Enzyme, die bei einer strahlenbedingten Zerstörung eines dieser Stränge mit einer Sicherheit von 1:20.000 nach der Information des zweiten Stranges den betroffenen wieder reparieren. Hätten wir diesen Mechanismus nicht, könnten wir niemals ein Sonnenbad nehmen. Die DNA der Hautzellen würde zu sehr geschädigt. Selbst Doppelstrangbrüche werden enzymatisch nach den Informationen des zweiten Gens mit einer allerdings niedrigeren Sicherheit von 1:20 repariert. der Zellen beispielsweise einer Zellkultur, aber auch des menschlichen Gewebes, bei einer bestimmten Dosis absterben. Wie bei vielen Wirkungsbeziehungen ergibt dies eine s-förmige Kurve: Bei zunehmender Strahlungsintensität passiert zunächst wenig, die wenigen Schäden werden zuverlässig repariert, dann kommt es zu einem dosisabhängigen, sogenannten linearen Anstieg der Wirkung, die letzten Prozent oder Promille der Zellen zu sterilisieren, benötigt man dann deutlich mehr Dosis (quadratischer Anstieg). Ohne damit eine Kausalbeziehung direkt mathematisch erklären zu wollen, lässt sich der obere, therapeutisch interessante Teil der Kurve durch einen mathematischen Wert abbilden, der (für Formelliebhaber) wie folgt aussieht: Die je nach Zelltyp unterschiedlich präzise funktionierenden Reparaturmechanismen entscheiden, wie strahlenempfindlich oder strahlenresistent (kann bei Tumoren durch eine höhere Strahlendosis ohne weiteres ausgeglichen werden) die verschiedenen gesunden oder tumorösen Gewebe sind. Die Strahlenbiologen haben alles daran gesetzt, diese Reparaturkapazität sprich Strahlungsempfindlichkeit Gewebe für Gewebe zu testen. Formel 1: Wahrscheinlichkeit P für einen klinischen Effekt (z.B. Tumorkontrolle) bei einer Tagesdosis von D, n Fraktionen, einer Tumorzellmenge von N0 sowie den Gewebeparametern α und β. Hierzu muss man tief in ein kompliziertes Gebiet der Strahlenbiologie eintauchen. Die Beziehung zwischen physikalischer Strahlendosis und biologischem Effekt kann damit ausgedrückt werden, wie viele Prozent 54 Die Erholungsfähigkeit von Gewebe lässt sich mit diesem Alpha/Betaverhältnis nun quantifizieren. Sie ist höchst unterschiedlich, hier einige Beispiele: • gesundes Gewebe 6-10 Gray • Mehrzahl der Karzinome 10 Gray • Prostatakarzinome 1,5 Gray Je höher der Wert, desto sinnvoller wäre es, die nötige Bestrahlungsdosis auf viele Einzelsitzungen aufzutei- len, das heißt, zu hyperfraktionieren. Bei niedrigen Werten aber mit möglichst wenig Sitzungen, aber höheren Dosen zu arbeiten: Hypofraktionierung. Der aufgeführte Wert gerade beim Prostatatumor spricht für eine Hypofraktionierung! Die vorsichtige Aufteilung der Bestrahlung in verschiedene Sitzungen aber kommt nach diesen mathematischen Betrachtungen auch mit – biologischen – Kosten (noch einmal eine Formel): Formel 2: Die biologisch äquivalente Dosis zu einer Einzeldosis von 2 Gray EQD2 ist abhängig sowohl von der Fraktionszahl n, der geänderten Tagesdosis D, als auch vom gewebeabhängigen Wert α und β. Die Formel sagt einfach, dass abhängig von diesem gewebetypischen Alpha/Betaverhältnis bei Aufteilung einer Bestrahlung in mehreren Sitzungen immer eine höhere addierte Gesamtdosis notwendig ist und zwar, wiederum von diesem Wert abhängig, unter Umständen erheblich mehr. Um das auszudrücken, führte man den Begriff der Effektivdosis ein. Am Beispiel der Prostatakarzinome bedeutet dies: • Bei einundvierzig Bestrahlungen benötigt man eine physikalische Gesamtdosis von 82 Gray (als Vergleichsstandard), um eine adäquate Therapiesicherheit zu erreichen. • Bei einundzwanzig Fraktionen, wie bisher am RPTC durchgeführt, wird für die gleiche Therapiesicherheit, für die gleiche Effektivdosis von wiederum 82 Gray nur mehr eine physikalische Dosis von 63 Gray benötigt. • Bei einer extremen Hypofraktionierung von nur fünf Sitzungen würde für diese gleiche Effektivdosis von wiederum 82 Gray nur mehr eine physikalische Dosis von 35 Gray notwendig. Die vorhandene Literatur zur Hypofraktionierung hat tatsächlich in jüngster Zeit an 1.100 amerikanischen Patienten1 bewiesen, dass die Rückführung von einundvierzig Bestrahlungstagen auf nur fünf zumindest gleich gute Ergebnisse zeigt. Dies bei Röntgen. Die Zukunft der Protonen geht – vorsichtig – ebenfalls in die Richtung dieser Hypofraktionierung. Da die physikalische Dosis, die bei Protonentherapie ins Gesunde streut sowieso anatomieabhängig nur ca. 1/3 – 1/5 der bei Röntgen unvermeidbaren Schadensdosis beträgt, sollte diese Hypofraktionierung mit Protonen auch mit höchster Patientensicherheit und schonend durchgeführt werden können. Literaturverzeichnis: 1) Katz A, et al.: Five-year Biochemical Control Rates for Stereotactic Body Radiotherapy for Organ Confirmed Prostate Cancer: A Multi-institutional Pooled Analysis ASTRO (2012) 55 KREBS ALS FOLGE EINER STRAHLENTHERAPIE KREBS ALS FOLGE EINER STRAHLENTHERAPIE PROBLEM: KREBS ALS FOLGE EINER STRAHLENTHERAPIE Zusammenfassung für Patienten Das Problem der Auslösung von Krebs in bisher gesundem Gewebe durch die therapeutisch gemeinte - und erfolgreiche - Strahlentherapie selbst ist seit langem bekannt. Es wird heute durch sorgfältige, mathematische Analysen genauer quantifizierbar. Auch wenn sich diese Analysen auf nicht absolut sichere Dosis / Wirkungsbeziehungen im Nieder-Dosisbereich beziehen, eines ist gewiss: Röntgenverfahren setzen natürlich insbesondere Kinder und Jugendliche mit längerer Lebenserwartung dem bis zu 12-fachen Risiko einer Krebsauslösung aus, im Vergleich zu Protonen-Scanning. 56 Alle Formen der äußeren Strahlentherapie nutzen als therapeutisches Wirkmittel ionisierende Strahlung. Diese löst gleichermaßen in allen lebenden Zellen die Bildung sogenannter chemischer Radikale aus, die die Zelle schädigen oder sterilisieren. Dabei differenziert die Strahlungswirkung nicht zwischen tumorösen und gesunden Zellen, was einerseits die Resistenzbildung von Krebszellen gegen die Therapie ausschließt, andererseits durch die Nebenwirkungen der Strahlung in der Regel die auf den Krebs selbst applizierbare Dosis begrenzt. Dies, da keine der verwendeten Therapiemethoden eine Konzentration der Strahlung ausschließlich in den Tumor ermöglicht. Um die Einsatzbreite und Effektivität der Strahlentherapie zu verbessern, wurden gerade in jüngerer Zeit zahlreiche methodische Fortschritte in die Therapie eingeführt. Bei der Röntgentherapie mit elektromagnetischer Strahlung konnte durch exakte Anformung des Strahlquerschnittes (Multileaf-Verfahren) die Anpassung des Zielgebietes auf die Tumorform optimiert werden. Da der naturgesetzliche exponentielle Dosisabfall in der dritten Dimension, in Strahlrichtung selbst, bei der elektromagnetischen Strahlung nicht verändert werden kann, wird versucht, durch Bündelung aus mehr und mehr Strahlrichtungen (z.B. Cyberknife) und sorgfältiger Einzeldosierung dieser verschiedenen Strahlrichtungen (Intensity-Modulated Radiation Therapy, IMRT) eine klinisch vorteilhafte Strahlkonzentration im Tumor- und Zielgebiet zu erreichen. Allerdings, dabei wird nur der Umfang des bestrahlten Volumens von gesundem Umgebungsgewebe ausgetauscht gegen Dosishöhe ebendort: Das Verhältnis Nutzstrahlung im Tumor und gesamte Schadensstrahlung in der gesunden Umgebung hängt nur von der Körpergeometrie ab und lässt sich mit Röntgenmethoden nicht verbessern. Mit Protonen wird die Zielbarkeit zusätzlich in Strahlrichtung, in der dritten Dimension durch das Phänomen des Bragg-Peaks ausgeschöpft. Hinter dem Tumor wird kein Gewebe mehr bestrahlt, vor dem Tumor ist die Strahlungsdosis niedriger, nicht höher als im Tumor wie bei Röntgen. Allerdings geschah dies bei den frühen Protonen-Techniken (Scattering oder sogenannte Uniform-Scanning-Verfahren) durch Kontrolle des Partikelstrahls mithilfe zahlreicher mechanischer Schablonen. Dieses Verfahren ermöglichte eine deutliche Wirkungskonzentration im Tumor, konnte jedoch eine Formanpassung des Zielgebietes nur an die strahlenquellenferne Hinterwand des Tumors erzielen, vorne wurde die hohe Tumordosis immer noch ins gesunde Gewebe verteilt. Das schablonengestützte Formen des Protonenstrahls zudem generierte eine Neutronenstrahlung, die sich weit über das Zielgebiet hinaus in den Körper des Patienten verteilte. Siehe oben „Die Welt des Protonen-Scanning - 2013“. Die bei den verschiedenen Methoden im Gesunden auftretende Schadenstrahlung darf nicht vernachlässigt werden. Bei den Röntgenverfahren insbesondere und bei kleinen Bezirken vor dem Tumor beim Protonen-Scattering, erstreckt sich die volle Tumordosis ins gesunde Gewebe. Bei der üblichen Zweifelder (Strahlrichtungen) -Bestrahlung des Prostatakarzinoms z.B. von beiden Seiten des Körpers erhält bei Röntgen der gesamte Körperabschnitt Hüftgelenk / Prostata / gegenseitiges Hüftgelenk die gleiche Dosis wie der Tumor selbst. Vergleiche Dosisbilder Röntgen / Protonen unter „Fallbeispiele“. Mit naturgemäß großen Schwankungsbreiten treten somit bei routinemäßigen Bestrahlungen mit Röntgen im gesunden Gewebe unerwünschte Dosisbereiche von bis über vielleicht 40 Gray auf. Diese Dosen sind nur deshalb nicht tödlich (siehe Tabelle 1), weil die Bestrahlungsbereiche nur Klinische Frühsymptome von Strahlenwirkungen Dosis Gy Latenzzeit Charakteristische Wirkungen Hauptsymptom <1 > 5 Std. geringe Änderung des Blutbildes 1-2 > 3 Std. deutliche Abnahme der Zahl der Leukozyten und Thrombozyten 2-10 0,5-2 Std. schwere Schäden im Blutbild, Kopfschmerzen, Schwäche, Fieber, Infektionen, Müdigkeit, innere Blutungen, Haarausfall, Durchfall, Erbrechen 10-15 0,5 Std. Durchfall, Fieber, Elektrolytstörungen > 50 Minuten Krämpfe, Zittern, Bewegungsstörung, Schlafbedürfnis, Koma Tabelle 1: Klinische Frühsymptome von Strahlenwirkungen bei Gesamtkörperbestrahlung 1, 2 57 KREBS ALS FOLGE EINER STRAHLENTHERAPIE KREBS ALS FOLGE EINER STRAHLENTHERAPIE Teile des Gesamtkörpers erfassen. Immerhin sind die Nebenwirkungen so gravierend, dass sie bei Auswahl der Therapieentscheidungen berücksichtigt werden müssen und der Patient entsprechend aufgeklärt werden muss (Abbildung 1). Eine weitere Nebenwirkung ist aus der klinischen Praxis bekannt, wenn auch bisher quantitativ nicht vollumfänglich erfasst: Die im gesunden Gewebe bei der Strahlentherapie durch die nicht sterilisierende, aber zellschädigende Mitbestrahlung ausgelösten Sekundärkarzinome. Unter diesem Begriff werden auch in den Bindegeweben strahleninduzierte Tumore verstanden, die histologisch als Sarkome bezeichnet werden müssten. Die klinische Beobachtung solcher Spätkarzinome, die nach Jahren auftreten können, hat schon 1999 zu der Forderung geführt, Kinder und Jugendliche nicht mehr mit Röntgen, sondern mit Protonenmethoden zu therapieren3. Organbezogene Strahlenschäden Demenz Hörverlust Kiefergelenkarthrose Strahlenpneumonitis Leberschädigung Störung der Darmbewegung (Obstipation, Durchfall), Verwachsungsbauch Potenzstörung, Unfruchtbarkeit, Miktionsbeschwerden, Mastdarmstörungen Haarausfall Erblindung, gestörte Tränen-Sekretion Schluckbeschwerden, trockener Mund Perikarditis Querschnittslähmung Funktionsverlust der Niere Sensibilitätsstörung Allgemein: Hautverfärbung, schwer heilende Wunden, lokale Infekte 58 Abbildung 1: Organbezogene Strahlenschäden: Kurzzeit- und Langzeitschäden sind hier zusammengefasst, ihre Ausprägung ist immer von der Dosishöhe im Gesunden abhängig. Hinzu kommt das generalisierte Risiko der Bildung von Sekundärkarzinomen über einen längeren Zeitraum, siehe rechts. Es war jedoch schwierig, das wirkliche Risiko der Sekundärkarzinome zu quantifizieren. Dies schon deshalb, weil in der Nähe des Ursprungtumors später auftretende Karzinome als Tumorrezidive eingestuft werden, ohne sie durch histologische Gewebeproben exakt zu klassifizieren. In neuerer Zeit wurde die Quantifizierung des Sekundärtumorrisikos durch exakte Analyse der Dosiswerte im gesunden Gewebe unternommen4. Dabei wurde die Dosisberechnungsmethode des sogenannten Monte-Carlo-Verfahrens eingesetzt. Hierbei wird mit sehr großem Rechenaufwand das Verhalten einzelner Photonen bei Röntgen beziehungsweise von Protonen verfolgt, wodurch ein sehr exaktes statistisches Bild der Dosisverteilung entsteht. Dabei wurden sowohl die Ortsdosisverteilungen bei Röntgen, wie bei Protonen auch die oben erwähnte Neutronen- Freisetzung berücksichtigt. Die Wahrscheinlichkeit der Tumorentstehung wurde für die einzelnen betroffenen Organe berechnet. Als typisches Beispiel wurde die Bestrahlung eines Kindes mit einem ausgedehnten (Feldgröße 502 cm2) Feld entlang dem Rückenmark genutzt. Eine Lebenserwartung von 73 Jahren wurde zugrunde gelegt. Der Fall stellt damit die Obergrenze des zu erwartenden Tumorrisikos dar. Die prozentualen Risiken pro Lebensjahr zeigt Tabelle 2. Die kumulativen Risiken bei einer Lebenserwartung von 73 Jahren sind in Tabelle 3 aufgeführt. Die Unterschiede zwischen den verschiedenen älteren und moderneren (IMRT) Röntgenverfahren Risiko von Sekundärkarzinomen Strahlentherapieverfahren Jährliches Risiko (% pro Jahr) konventionelle Strahlentherapie (CRT) 0,75 Intensitäts-modulierte Strahlentherapie (IMRT) 0,43 Protonen-Scattering (PSPT) 0,07 Protonen-Scanning (IMPT) 0,06 Tabelle 2: Risiko für die Entwicklung eines Sekundärkarzinoms bei verschiedenen Strahlentherapiearten. Aufgeführt sind die prozentualen Risiken pro Lebensjahr 4. Kumulative Risiken von Sekundärkarzinomen Strahlentherapieverfahren Kumuliertes Risiko (%) konventionelle Strahlentherapie (CRT) 54,8 Intensitäts-modulierte Strahlentherapie (IMRT) 31,4 Protonen-Scattering (PSPT) 5,1 Protonen-Scanning (IMPT) 4,4 Tabelle 3: Risiko für die Entwicklung eines Sekundärkarzinoms bei verschiedenen Strahlentherapiearten. Gezeigt sind die kumulativen Risiken bei einer Lebenserwartung von 73 Jahren 4. 59 KREBS ALS FOLGE EINER STRAHLENTHERAPIE KREBS ALS FOLGE EINER STRAHLENTHERAPIE im Tumorrisiko werden hierbei deutlich, ebenso wie die wesentlich niedrigeren Risiken der Protonenverfahren. Die Verbesserung des Protonenscannings gegenüber der Scattering-Methode ist auf den etwa 90-prozentigen Entfall der beim Scattering generierten Neutroneneinstrahlung in der Größenordnung von 250 Millisievert zurückzuführen sowie auf den Entfall der Tumor-frontalen Hochdosisüberstände beim Scattering. Bei diesen Auswertungen handelt es sich, wie dargestellt, um rein mathematische Verfahren, die die tatsächliche Ortsdosisverteilung exakt wiedergeben. Wesentlich unsicherer ist die zugrunde gelegte Beziehung zwischen der erhaltenen Dosis – im Nieder- dosisbereich – und dem Spätkarzinomrisiko selbst. Diese Daten beruhen auf der Auswertung zahlreicher Strahlenschäden, die allerdings meist unter Kriegsbedingungen (Hiroshima, Nagasaki) oder in Unfallsituationen (einschließlich Tschernobyl und jüngst Fukushima) gewonnen worden sind. Das Problem hierbei war in der Regel die exakte Rekonstruktion der tatsächlich erhaltenen Dosis. Zu pessimistische, oder zu optimistische, Annahmen hierbei hätten sich allerdings gleichlaufend auf die Kalkulation der Sekundärkarzinom-Risiken bei den verschiedenen Verfahren, auch Röntgen versus Protonen, ausgewirkt. Für die klinische Entscheidungsfindung für oder gegen die genutzte Methodik macht es deshalb Sinn, die Sekundärkarzinom-Risikoüberhöhung gegenüber dem risikoärmsten Verfahren, dem Protonen-Scanning, zu normieren und letzteres Verfahren als „eins“ zu setzen. Ergebnis siehe Tabelle 4. Literaturverzeichnis: 1) UNSCEAR: Genetic and Somatic Effects of Ionizing Radiation. United Nations Scientific Committee on the Effects of Atomic Radiation (1986) UNSCEAR: Sources, Effects and Risks of Ionizing Radiation. United Nations Scientific Committee on the Effects of Atomic Radiation (1988) ICRP Publication 60: 1990 Recommendations of the International Commission on Radiological Protection. Annals of the ICRP 21 (1991) 2) Vogt/Schultz: Grundzüge des praktischen Strahlenschutzes 3)Hug E. B., Slater J. D.: Proton radiation therapy for pediatric malignancies: status report. Strahlenther Onkol. 175 (1999) 4)Newhauser W. D., et al.: The risk of developing a second cancer after receiving craniospinal proton irradiation. Phys. Med. Biol. 54 (2009) 2277 Relative Risiken von Sekundärkarzinomen Strahlentherapieverfahren Verhältnis der Risiken konventionelle Strahlentherapie (CRT) 12,4 Intensitäts-modulierte Strahlentherapie (IMRT) 7,1 Protonen-Scattering (PSPT) 1,2 Protonen-Scanning (IMPT) 1,0 Nach heutigem Stand der Wissenschaft sind diese Zahlen die besten Daten, die dem Kliniker zur Entscheidung zwischen den Verfahren der Strahlentherapie dienen können. Tabelle 4: Vergleich der relativen Risiken für die Entwicklung eines Sekundärkarzinoms bei verschiedenen Strahlentherapiearten. Bis über 12-fache Erhöhung des Risikos für die Entwicklung eines Sekundärkarzinoms im Vergleich zum Protonen-Scanning 4. 60 61 RINECKER PROTON THERAPY CENTER Die Therapie 64 Übersicht Behandlungen am RPTC 70 Bestrahlung von Kindern am RPTC 76 Ergebnisse aus 500 bestrahlten Prostatakarzinomen 86 Ergebnisse der neuartigen Protonenbestrahlung des Pancreas 92 Fallbeispiele aus dem RTPC 63 ÜBERSICHT BEHANDLUNGEN ÜBERSICHT BEHANDLUNGEN ÜBERSICHT BEHANDLUNGEN AM RPTC Auch nach dem vierten Betriebsjahr gehören die Prostatakarzinome mit 500 Fällen, entsprechend 33% der behandelten Tumore, zu den häufigsten Indikationen am RPTC. Dies ist nicht zuletzt der hohen Schonung des Gesunden, die mit Protonen möglich ist, und den dadurch verringerten Nebenwirkungen bei gleicher oder verbesserter Effektivität, geschuldet. Weiter bilden die Tumore des Zentralen Nervensystems (ZNS) mit 210 Fällen, gleich einem Anteil von 14%, die zweithäufigste Gruppe. Auch bei Tumoren des ZNS bringen die Präzision, die mit Protonen erreicht werden kann und die geringere Strahlenbelastung im gesunden Gewebe erhebliche Vorteile, da sich wichtige Nervenstrukturen besser schonen lassen und so Nebenwirkungen reduziert werden können. Die Zahl der Tumore im Thoraxbereich – überwiegend der Lungen – erhöhte sich konstant, so dass diese Indikation mit 185 auch nach dem vierten Betriebsjahr 13% der Gesamtfälle bildet. Einen starken Anstieg konnten wir bei Pancreaskarzinomen und extracranialen Chordomen und Chondrosarkomen verzeichnen. Nach 32 Pancreasfällen Ende des dritten Betriebsjahres wur- den alleine im vierten Betriebsjahr 52 Fälle behandelt. Dieser Anstieg um mehr als 100% spiegelt die Möglichkeiten, die sich durch die Protonentherapie im Scanning Verfahren bei der Behandlung von Pancreaskarzinomen ergeben, wieder. Mehr dazu oben bei „Ergebnisse der neuartigen Protonenbestrahlung des Pancreas“. Bei den extracranialen Chordomen und Chondrosarkomen hat sich die Zahl der behandelten Fälle von 29 auf 59 ebenfalls mehr als verdoppelt. Bei diesen seit 2009 am RPTC behandelten Patienten konnte eine lokale Kontrollrate von 100% erreicht werden. Die Behandlung wurde von allen Patienten ausgezeichnet toleriert; es traten keine signifikanten Nebenwirkungen auf. Dies stimmt mit den Erfahrungen aus Studien überein. 2009 publizierte Ares und Kollegen (Paul Scherrer Institut) die Ergebnisse von 64 Patienten welche mit spot-scanning Protonentherapie behandelt wurden1. Nach einem medianem follow-up von 38 Monaten zeigte sich eine lokale 5-Jahres-Kontrollrate von 81% für Chordome und 95% für Chondrosarkome bei minimaler Toxizität. Ein Report von Kindern und Jugendlichen, die mit dersel- Behandelte Patienten Leistungsparameter 14 Patienten gesamt: 1500 1% 49 3% 217 15% ZNS-Tumore 124 8% Kopf-Hals-Tumor Tumore im Thoraxbereich / Lungen Pankreas-Tumore 500 187 33% 13% sonstige gastrointestinale Tumore Extracraniale Sarkome/Chondrosarkome sonstige Tumore im Skelett/Weichteilsystem 84 6% 142 9% 121 63 Prostata-Tumore sonstige urogenitale Tumore Lymphatisches System 1500 Gesamtbestrahlungszeit für Patientenbehandlungen 1685 h 12 min Gesamtanzahl von Fraktionen 26.620 Gesamtanzahl von Einstrahlrichtungen (Felder) 57.233 Gesamtanzahl von applizierten Tiefenschichten 1.882.202 Gesamtanzahl von einzeldosiskontrollierten Scanning-Spots 141.423.398 Kleinstes behandeltes Zielgebiet 1 ml Maximales behandeltes Tumorvolumen 5.654 ml 8% 4% Abbildung 1: Gesamtstatistik der am RPTC bis April 2013 behandelten Indikationsgruppen. 64 Gesamtzahl abgeschlossene Patientenbehandlungen Tabelle 1: Übersicht relevanter Leistungsparameter als Statistik über die Gesamtbetriebszeit des RPTC. 65 ÜBERSICHT BEHANDLUNGEN ÜBERSICHT BEHANDLUNGEN ben Technik therapiert wurden, zeigte eine lokale Kontrollrate von 100% bei ebenfalls minimaler Toxizität2 (Rutz et al, 2008). Im Vergleich zur Protonentherapie sind die Ergebnisse der Röntgentherapie deutlich schlechter: Zorlu et al (2000) berichtete über 5-Jahres Progressionsfreies Überleben von nur 23%3. Auch die Ergebnisse der Behandlung von Chordomen mittels stereotaktischer Radiochirurgie sind enttäuschend: 30-50% lokale 5-Jahres Kontrollrate4, 5. Eine Ausnahme sind nur die Ergebnisse der fraktionierten stereotaktischen Radiochirurgie mit Photonen in der Behandlung von kleinen Chondrosarkomen, mit der ebenfalls eine lokale Kontrollrate von 100% erreicht werden kann. Nachdem im ersten Betriebsjahr mit nur einer der vier Gantries und 298 Patienten begonnen wurde, wurden mittlerweile bereits über 1.500 Patienten aus 44 Nationen behandelt. Die Patienten profitieren dabei von der modernsten derzeit verfügbaren Protonentherapie, dem Protonen-Scanning. Dabei fungiert der punktförmige Protonenstrahl wie ein Pinsel der das Tumorareal - ähnliche wie bei der „Punktmalerei“ mit Farbe – Punkt für Punkt mit der optimalen Dosis ausfüllt. Durch diese hochpräzise Platzierung der Dosis im Tumor wird die Streuung minimiert. So wird das Tumorwachstum gestoppt und umliegendes gesun- des Gewebe bestmöglich geschont. Mit über 1.500 behandelten Patienten und 141.423.398 einzeldosiskontrollierten Scanning-Spots hat das RPTC weltweit mehr Erfahrung mit dieser Methode als irgendein anderes Protonentherapiezentrum (Tabelle 1 auf Seite 65 und Abbildung 2). Diese Präzision ermöglicht es auch, kleinste ebenso wie sehr große Tumore ideal zu bestrahlen (Abbildung 3). w Scanning-Spots pro Feld Tumorvolumina Anzahl Spots Abbildung 2: Häufigkeitsverteilung der Anzahl der Spots, in die die am RPTC behandelten Tumore unterteilt wurden. (Statistik über Gesamtbetriebszeit bis April 2013). 66 Mittelwert 279 ml Minimum 1 ml Maximum 5654 ml Anteil Anteil Mittelwert2471 Minimum32 Maximum24861 Tumorvolumen in ml Abbildung 3: Häufigkeitsverteilung der Tumorvolumina von am RPTC behandelten Patienten (Statistik über Gesamtbetriebszeit bis April 2013). 67 ÜBERSICHT BEHANDLUNGEN ÜBERSICHT BEHANDLUNGEN Anlagenverfügbarkeit 2012 Geplante Behandlungstage (inkl. Totalausfalltage) 275 Summe Totalausfalltage 3 Summe Teilausfalltage anteilig* 2,13 *Definition Teilausfalltag: Zwei oder mehrere Patienten konnten an diesem Tag nicht behandelt werden. Verfügbarkeit 98,1 % Tabelle 2: Für das Kalenderjahr 2012 ergaben sich nur wenige Ausfalltage. Insgesamt wurde so eine Verfügbarkeit von 98,1 % erreicht. Die Zahl der einzelnen Bestrahlungen ist abhängig von der Indikation und bestimmt sich aus der Therapiedosis, der Dosistoleranz des Umgebungsgewebes und der Schnelligkeit, mit der sich die Zellen jeweils (Tumor- und gesunde Zellen) regenerieren. Die am RPTC angewendete Fraktionszahl stützt sich auf etablierte Therapieprotokolle aus der Protonen- und Photonenwelt, bei letzteren wird lediglich die Dosis mit dem für Protonen üblichen Faktor 1,1 umgerechnet (Abbildung 4). Um Risikoorgane noch besser zu schonen, wird, falls erforderlich, aus mehreren Richtungen (Feldern) bestrahlt (Abbildung 5).w Fraktionen Literaturverzeichnis: 1)Ares et al.: Effectiveness and safety of spot scanning proton radiation therapy for chordomas and chondrosarcomas of the skull base: first long-term report. Int J Radiat Oncol Biol Phys. 75 (2009) 1111-1118 4)Debus et al.: Stereotactic fractionated radiotherapy for chordomas and chondrosarcomas of the skull base. Int J Radiat Oncol Biol Phys. 47 (2000) 591-596 5)Krishnan et al.: Radiosurgery for cranial base chordomas and chondrosarcomas. Neurosurgery 56 (2005) 777-784 2)Rutz et al.: Postoperative spot-scanning proton radiation therapy for chordoma and chondrosarcoma in children and adolescents: initial experience at paul scherrer institute. Int J Radiat Oncol Biol Phys. 71 (2008) 220-225 3)Zorlu et al.: Conventional external radiotherapy in the management of clivus chordomas with overt residual disease. Neurol Sci. 4 (2000) 203-7 Felder Anzahl Fraktionen Abbildung 4: Häufigkeitsverteilung der am RPTC zur Anwendung kommenden Fraktionszahlen (Statistik über Gesamtbetriebszeit bis April 2013). 68 Mittelwert2,15 Minimum1 Maximum6 Anteil Anteil Mittelwert17,7 Minimum1 Maximum46 Anzahl Felder Abbildung 5: Häufigkeitsverteilung der am RPTC verwendeten Anzahl von Einstrahlrichtungen (Felder) (Statistik über Gesamtbetriebszeit bis April 2013). 69 BESTRAHLUNG VON KINDERN BESTRAHLUNG VON KINDERN BESTRAHLUNG VON KINDERN AM RPTC Zusammenfassung für Patienten Die Bestrahlung von Kindern und Jugendlichen mit Protonen statt - allen verschiedenen Röntgenverfahren ist internationaler Standard. Gründe sind geringere Wachstumsschäden, bei Bestrahlungen am Kopf die Vermeidung von strahlenbedingten Intelligenzdefekten und die massive Reduktion der bei den Kindern besonders zu befürchtenden, von der Therapiestrahlung selbst ausgelösten Bildung von Zweitkarzinomen. Dank der hohen Strahlpräzision und der Möglichkeit, die Dosis besser in den Tumor zu konzentrieren als dies auch mit der modernsten Form der Photonenbestrahlung möglich ist, ist die Protonentherapie ideal für Fälle, in denen die Dosisbelastung außerhalb des Tumors unbedingt minimiert werden und gesundes Gewebe maximal geschont werden muss. Dies ist insbesondere bei Tumoren, die von strahlenempfindlichem Gewebe umgeben sind sowie bei Kindern und Jugendlichen der Fall. Denn neben den akuten strahlungsbedingten Nebenwirkungen spielen auch Spätnebenwirkungen eine erhebliche Rolle. Denn Kinder und Jugendliche sind aufgrund ihres Wachstums und ihrer hohen Lebenserwartung besonders anfällig für Strahlenschäden und Folgetumore. Je mehr Zeit vergeht, desto höher ist das Risiko, dass sogenannte Sekundärtumore als Folge der bei der Behandlung außerhalb des Tumors auftretenden Strahlung entstehen. Siehe oben: „Problem: Krebs als Folge einer Strahlentherapie“. Bei einer Protonentherapie wird dieses Risiko gegenüber einer Photonenbestrahlung minimiert. So hat eine Planvergleichsstudie1 bei einem 43 Monate alten Jungen gezeigt, dass die Dosisbelastung mit Protonen im Innenohr von 100% auf 2,4%, der Hirnanhangsdrüse von 62% auf 0,1% und die Herzbelastung von 18% auf 0,1% gesenkt werden konnte. Auch die in Loma Linda durchgeführten Untersuchungen zur Verträglichkeit einer Protonenbestrahlung bei intrakraniellen Tumoren im Kindesalter zeigten hervorragende Ergebnisse2 . 70 Da die Bestrahlungen von Kindern, außer bei Chordomen und niedriggradigen Chondro-sarkomen der Schädelbasis, am RPTC und weltweit, im Hinblick auf die Tumordosis nach Standards der Photonenbestrahlung erfolgt, ist die Tumordosis die gleiche wie bei einer Photonenbestrahlung was zu vergleichbaren Kontrollraten führt. Dies allerdings bei einer nachweislich signifikant besseren Schonung des gesunden Gewebes und kritischer Strukturen wie Gehirn - und Intelligenz - , Rückenmark, Leber, Niere, Lunge, etc.. Die Ergebnisse aus einer Studie zu Chordomen und niedriggradigen Chondrosarkomen der Schädelbasis haben bereits gezeigt, dass durch eine mit Protonen mögliche Anhebung der Dosis im Tumor eine signifikante Verbesserung der Heilungsrate erreicht werden kann3, 4, 5, was darauf hoffen lässt, dass die Protonentherapie in Zukunft auch bei weiteren pädiatrischen Tumoren nicht nur zu einer Minimierung der Akut- und Spätnebenwirkungen führt, sondern auch zu verbesserten Heilungsraten. Die nachweisliche Minimierung der Nebenwirkungen und Spätfolgen durch eine Protonentherapie bei Kindern hat die Deutsche Gesellschaft für Radioonkologie (DEGRO) dazu schon 2008 veranlasst, bei der Strahlenbehandlung von pädiatrischen Tumoren grundsätzlich Protonen gegenüber Photonen zu empfehlen. Am RPTC werden Kinder mit Krebserkrankungen gemäß internationaler Protokolle mit dem schonen- 71 BESTRAHLUNG VON KINDERN BESTRAHLUNG VON KINDERN den Protonen-Scanning-Verfahren bestrahlt. Zudem arbeitet das RPTC bei der Erstellung des Therapiekonzeptes, welches neben der Bestrahlung oft auch weitere Aspekte umfasst, und während der Behandlung eng mit dem renommierten Kinderkrankenhaus Schwabing, der größten pädiatrischen Klinik Münchens zusammen. Bei Kleinkindern wird die Protonentherapie in Narkose durchgeführt, um zu verhindern, dass sich der Tumor durch Bewegung verschiebt. Dafür steht dem RPTC ein eigenes, erfahrenes Anästhesieteam zur Verfügung. Bildgebung vor der Protonentherapie Fallbeispiel: Rhabdomyosarkom Februar und März 2011 eine Protonentherapie. Das Kind hatte die Behandlung sehr gut toleriert. Der 5 Jahre alte Patient war an einer seltenen Krebserkrankung der linken Wange erkrankt (gering differenziertes embryonales Rhabdomyosarkom). Der Tumor hatte das linke Kiefergelenk infiltriert, den Knochen der Schädelbasis durchbrochen und reichte bis an die harte Hirnhaut (Abbildung 1). Nach der Tumorbiopsie und Diagnosestellung im Juni 2010 erhielt der Patient zwischen Oktober 2010 und April 2011 eine Chemotherapie gemäß der CWSGuidance. Parallel dazu erhielt der Patient zwischen Tumorregion Die Nachsorgeuntersuchung im Dezember 2011 in der Kinderonkologie Schwabing zeigte, dass sich der Tumor komplett zurückgebildet hatte und somit eine Vollremission erreicht wurde. Als einzige Nachwirkung der Protonentherapie ist ein chronischer Paukenerguss, also eine Ansammlung von Flüssigkeit im Mittelohr, dokumentiert. Folgen dieser Nebenwirkung können eine Hörminderung, ein Druckgefühl im Ohr sowie Schmerzen oder Schwindel sein. Im Vergleich mit einer herkömmlichen Strahlentherapie hatte der Patient durch die besonderen physikalischen Eigenschaften der Protonentherapie eine deutlich geringere Dosis am Rückenmark erhalten. Die Mundhöhle konnte besser geschont werden und die gegenüberliegende Gesichtshälfte konnte komplett aus dem Bestrahlungsfeld gehalten werden. Insgesamt war die applizierte Gesamtdosis am gesunden Gewebe deutlich geringer als bei der konventionellen Strahlentherapie wodurch auch das Risiko der Entstehung von Zweittumoren nach der Behandlung reduziert wurde. Siehe hierzu Planvergleich der durchgeführten Protonenbestrahlung am RPTC (Abbildung 2 auf Seite 74) mit einer theoretischen Berechnung für Röntgen (Abbildung 3 auf Seite 75). Literaturverzeichnis: 1) St Clair WH, Adams JA, Bues M, Fullerton BC, La Shell S, Kooy HM, Loeffler JS, Tarbell NJ: Advantage of protons compared to conventional X-ray or IMRT in the treatment of a pediatric patient with medulloblastoma. Int J Radiat Oncol Biol Phys. 58 (2004) 727 2) McAllister B, Archambeau JO, Nguyen MC, et al.: Proton therapy for pediatric cranial tumors: preliminary report on treatment and disease-related morbidities. Int J Radiat Oncol Biol Phys. 39 (1997) 455 3) Noel G, Feuvret L, Calugaru V, Dhermain F, Mammar H, Haie-Meder C, Ponvert D, Hasboun D, Ferrand R, Nauraye C, Boisserie G, Beaudre A, Gaboriaud G, Mazal A, Habrand JL, Mazeron JJ.: Chordomas of the base of the skull and upper cervical spine. One hundred patients irradiated by a 3D conformal technique combining photon and proton beams. Acta Oncol. 44 (2005) 700 4) Hug EB, Muenter MW, Archambeau JO, DeVries A, Liwnicz B, Loredo LN, Grove RI, Slater JD.: Conformal proton radiation therapy for pediatric low-grade astrocytoma. Strahlenherapie und Onkologie 178 (2002) 10 5) Hug EB, Sweeney RA, Nurre PM, Holloway KC, Slater JD, Munzenrider JE: Proton radiotherapy in management of pediatric base of skull tumors. Int J Radiat Oncol Biol Phys. 52 (2002) 1017 Abbildung 1: Die Kernspintomografie-Aufnahmen in axialer, koronarer und sagitaler Darstellung zeigen die Ausdehnung des Rhabdomyosarkoms der linken Wange vor der Bestrahlung mit Protonen. 72 73 BESTRAHLUNG VON KINDERN BESTRAHLUNG VON KINDERN Abbildung 2: Dargestellt sind die Querschnitte der Dosisverteilung der am RPTC erzeugten Bestrahlungsplanung für die Protonenbehandlung. So wurde der Kinderpatient mit Protonen bestrahlt. Gewebeanteile 100 % GTV1 95-100 % PTV1 90-95 % PTV2 80-90 % Hirnstamm 60-80 % Auge links 40-60 % 20-40 % 10-20 % Wie im RPTC bestrahlt Gewebeanteile 95-100 % PTV1 90-95 % PTV2 80-90 % Hirnstamm 60-80 % Auge links Myelon 40-60 % Myelon Linse links 20-40 % Linse links Chiasma 10-20 % Chiasma Kiefergelenk Röntgen Sehnerv links Theoretisch berechneter Vergleichsplan Kiefergelenk 100.00 80.00 80.00 Volumen (%) 100.00 60.00 40.00 0.00 0.00 Dosisbereiche GTV1 20.00 60.00 40.00 20.00 20.00 40.00 Dosis (Gy(RBE)) 74 Abbildung 3: Dosisverteilung einer theoretisch berechneten Vergleichsplanung mit Röntgenstrahlung. So hätte eine Dosisverteilung bei einer Röntgenbestrahlung aus fünf Einstrahlrichtungen ausgesehen. Man erkennt deutlich die höhere Dosisbelastung von gesundem Gewebe, insbesondere dem Hirnstamm. 100 % Sehnerv links Volumen (%) Protonen Dosisbereiche 60.00 80.00 0.00 0.00 20.00 40.00 60.00 80.00 Dosis (Gy) 75 PROSTATAKARZINOME PROSTATAKARZINOME ERGEBNISSE AUS 500 BESTRAHLTEN PROSTATAKARZINOMEN Zusammenfassung für Patienten Die 500 ersten Patienten mit ProtonenScanning am RPTC bei der Behandlung von Prostatakrebs haben bewiesen: • bessere Verträglichkeit • weniger Nebenwirkungen • Therapiesicherheit wie hoch dosierte Röntgentherapie • halbierte Behandlungsdauer • gut verträgliche Erweiterung des Bestrahlungsfeldes in den Lymphknotenbereich bei Risikofällen. 76 Wir haben im Jahresbericht 3 versucht (Seite 67 ff.) einen Überblick über die Vielfalt der angebotenen Therapieformen beim Prostatakarzinom zu geben: konservativ abwartend, Hormon- und/oder Chemotherapie, Operation, Bestrahlung mittels eingebrachten Isotopen und letztlich die Bestrahlung von außen mit Röntgen oder Protonen. Alle diese Therapieformen können, beziehungsweise müssen bei fortgeschrittenen Fällen zwei- oder sogar dreifach kombiniert werden. Wie seinerzeit erwähnt, zeigte eine gesundheitssoziologische Studie in den USA bestürzende regionale Unterschiede, von Bundesland zu Bundesland, in der Verteilung der angebotenen Therapien. Von daher ist es offensichtlich für den Patienten unerlässlich, sich selbst in die Abwägung der Therapieeffektivität, der Risiken und der Nebenwirkungen der verschiedenen Behandlungsformen einzubringen. Die am RPTC geübte mit dem Scanning-Verfahren technisch optimierte Protonentherapie hat das Potenzial, sich als die Überlegene der möglichen Strahlentherapien zu etablieren. Wir berichten deshalb jährlich von den Ergebnissen unserer ansteigenden Patientenzahlen und länger werdenden Verlaufsbeobachtungen. Die Frage ist, welche Fortschritte diese Protonentherapie innerhalb der Gesamtheit der äußeren Strahlentherapien erzielt. Letztere hat sich bereits als in der onkologischen Effektivität der operativen Behandlung gleichwertig erwiesen1. Die Strahlentherapie ist zudem generell frei von Letalrisiken und im Vergleich (wiederum mit der Prostataektomie) in Bezug auf Inkontinenz und Verlust der Sexualfunktion nebenwirkungsärmer2. Als optimierte Bestrahlungsform sollte daher das Protonen-Scanning das Potenzial haben, effektive Tumorheilung mit Risiko- und Nebenwirkungsarmut zu vereinen. Diese Risiko- und Nebenwirkungsarmut ist zudem ein Vorteil gegenüber der ebenfalls im vorlaufenden Jahresbericht beschriebenen sogenannten „active surveillance“, die viele Patienten zwar auch von eingreifenden Behandlungen freihält, andererseits aber mit einer auch subjektiv empfundenen anhaltenden Morbidität und wiederholten Vielfachpunktionen belastet. Wohin entwickelt sich das Protonen-Scanning? Patientencharakteristika Am RPTC wurden ab dem klinischen Betriebsbeginn am 16.03.2009 bis 02.04.2013 die ersten 500 Patienten mit Prostatakarzinom bestrahlt. Die folgende Auswertung umfasste 500 Patienten: Das internationale Klientel des RPTC aus bisher 44 Nationen erschwert in charakteristischer Weise eine vollständige posttherapeutische Nachbeobachtung: Einige Patienten übergaben nicht alle angeforderten Daten. Für ausführliche Patienten- und Tumorcharakteristika siehe Tabelle 1. Patienten- und Tumorcharakteristika Gesamte Patientenzahl (03/09 bis 04/13) Anteil % [von 500] Alter 66 Jahre (44-86) Stadium T1 192 38,4 T2 und pT2 183 36,6 T3 und pT3 103 20,6 T4 und pT4 14 2,8 Lymphknotenmetastasen negativ 431 86,2 positiv 62 12,4 Fernmetastasen negativ 450 90,0 positiv 51 8,4 ≤ 10 ng/ml 289 57,8 11-20 ng/ml 106 21,2 > 20 ng/ml 83 16,6 2-6 185 37,0 7 188 37,4 8-10 112 22,4 niedrig 115 23,0 mittel 175 35,0 hoch 201 40,2 ja 178 35,6 nein 294 58,6 ja 70 14,0 nein 430 86,0 ja 16 3,2 nein 484 96,8 Initialer PSA Gleason Score Risikogruppe Hormontherapie Prostatektomie Tabelle 1: Patienten- und Tumorcharakteristika von 500 Patienten, welche im Zeitraum 03/09 bis 04/13 aufgrund eines Prostatakarzinoms am RPTC mit Protonentherapie behandelt wurden (auswertbare Parameter). n = 500 Frühere Bestrahlung 77 PROSTATAKARZINOME PROSTATAKARZINOME Angewandtes hypofraktioniertes Therapieverfahren fünfmal wöchentlich. Die Tagesdosen betrugen standardmäßig 3,0 Gray (RBE) (relative biological effectiveness, berücksichtigt das biologische Wirkungsverhältnis von Protonen im Vergleich zu Röntgen). Regelhaft wurden die Patienten der Protonen-Scanning-Therapie am RPTC mit zwei opponierenden Feldern von links und rechts unterzogen (Abbildung 1). Bei Rezidiven und Sonderfällen (z.B. Hüftprothesen) wurden abweichende Feldgeometrien genutzt. Die Therapie erfolgte regelhaft in jeweils 21 Sitzungen Protonen Der Grund dafür, dass wir uns für die höhere Einzeldosis von 3 Gray (RBE) entschieden haben, liegt darin, dass das Prostatakarzinom auf eine Hypofraktionierung positiv reagiert. Dies drückt sich im sogenann- Wie im RPTC bestrahlt ten alpha/beta Wert aus welcher für das Prostatakarzinom bei α/β = 1,5 Gray, für Spätkomplikationen am Enddarm aber α/β = 3 Gray beträgt. Aufgrund dieser Unterschiede in der Fraktionierungsempfindlichkeit können durch die Hypofraktionierung die Nebenwirkungen reduziert und/oder die Tumorkontrolle erhöht werden, siehe auch oben „Wie oft muss der Patient bestrahlt werden?“. Die am RPTC durchgeführte Hypofraktionierung mit 21 Fraktionen ist eine deutProtonen liche Verbesserung gegenüber den in der gängigen Röntgentherapie vorgenommenen 41 Fraktionen. Die biologische Effektivdosis entspricht dabei einer Dosis von 82 Gray bei konventioneller Fraktionierung. Die verwendeten Feldgrößen richteten sich nach dem Risiko einer Beteiligung der Lymphabflusswege (Abbildung 2). Dieses wird auf der Basis der PSA Werte, der Gleason-Scores und des Tumorstadiums Wie im RPTC bestrahlt Dosisbereiche 100.00 100 % 100.00 100 % 80.00 95-100 % 80.00 95-100 % 60.00 90-95 % 80-90 % 40.00 60-80 % 20.00 40-60 % 0.00 0.00 20.00 40.00 60.00 Dosis (Gy(RBE)) 80.00 20-40 % 10-20 % Gewebeanteile Volumen (%) Volumen (%) Dosisbereiche 90-95 % 60.00 80-90 % 40.00 60-80 % 20.00 40-60 % 0.00 0.00 20.00 40.00 Dosis (Gy(RBE)) 60.00 80.00 20-40 % 10-20 % Gewebeanteile CTV1 GTV1 PTV1 PTV1 Rektum CTV1 Blase CTV2 Rektum Abbildung 1: Dargestellt ist die Dosisverteilung eines Bestrahlungsplans mit Protonen für ein Prostatakarzinom eines am RPTC behandelten Patienten. Deutlich sind zu erkennen die 2 opponierenden, lateralen Einstrahlrichtungen (Felder) von links und von rechts. 78 Abbildung 2: Dargestellt ist die Dosisverteilung eines Bestrahlungsplans mit Protonen für ein Prostatakarzinom mit potentieller Lymphknotenbeteiligung eines am RPTC so behandelten Patienten. Deutlich sind zu erkennen die 2 opponierenden, lateralen Einstrahlrichtungen (Felder) von links und von rechts. Das Protonen-Scanning-Verfahren erlaubt simultan den Bereich der Lymphknoten in den beiden gewählten Einstrahlrichtungen mit einer gewollt niedrigeren Dosis (gelber Bereich) gezielt mitzubestrahlen. 79 PROSTATAKARZINOME PROSTATAKARZINOME kalkuliert. Wenn das Risiko einer mikroskopischen Tumorausdehnung in den Beckenlymphknoten größer als 15% liegt, wird am RPTC eine Bestrahlung der pelvinen Lymphabflusswege empfohlen. Insgesamt wurden bei 250 Patienten (53%) die Lymphabflusswege mitbestrahlt. Hierbei betrug die applizierte Standarddosis 52,5 Gray (RBE), welche mit einer Fraktionierung von 21 x 2,5 Gray (RBE) verabreicht wurde. Verträglichkeit: Akute und chronische Nebenwirkungen ren Nebenwirkungen mit vorübergehendem akuten Harnverhalten oder sehr starkem Harndrang kam es bei fünf Patienten. Bei einem Patienten musste die Therapie aufgrund einer stärkeren Blutung aus dem Enddarm abgebrochen werden, dieser Patient litt an einer vorbestehenden Colitis-Ulcerosa. Die akuten Nebenwirkungen dauerten in der Regel nicht länger als 3-4 Wochen und bildeten sich nach Ende der Protonentherapie wieder komplett zurück, siehe Tabelle 2. Spätnebenwirkungen Akute Nebenwirkungen Nebenwirkungen während der Strahlentherapie betreffen vor allem die Harnwege. Nur bei wenigen Patienten traten während der Therapie leichte Nebenwirkungen an der Harnröhre auf, wie vermehrter Harndrang und Brennen beim Urinieren. Bezüglich der Darmfunktion wurden gelegentlich weicher Stuhl oder Reizungen am Enddarm berichtet. Zu stärke- Spätnebenwirkungen der Strahlentherapie treten Monate oder Jahre auch nach der Protonentherapie auf und betreffen vorwiegend den Enddarm oder die Harnwege. Sie werden nach den Kriterien der Radiation Therapy Oncology Group (RTOG) klassifiziert und in leichte (Grad 1), moderate (Grad 2), schwere (Grad 3) und sehr schwere (Grad 4) eingeteilt7: Leichte Nebenwirkungen (Grad 1) sind im Bereich der Harnwege leicht erhöhter Harndrang, im Bereich des Enddarms leichter Durchfall (maximal 5x/Tag) und gelegentlich Blutbeimengungen. Moderate Nebenwirkungen (Grad 2) sind im Bereich der Harnwege häufiger Harndrang und gelegentlich Blut im Urin, im Bereich des Enddarms mäßiger Durchfall (mehr als 5x/Tag) viel rektaler Schleim oder häufig Blutbeimengungen. Schwere Nebenwirkungen (Grad 3) sind im Bereich der Harnwege sehr häufiger Harndrang oder häufig Blut im Urin und im Bereich des Enddarms starke Blutungen, welche eine chirurgische Intervention notwendig machen oder eine narbige Verengung des Darms. Sehr schwere Nebenwirkungen (Grad 4) wären im Bereich der Harnwege und des Darms Gewebeuntergang (Nekrose) oder Fistelbildungen. In der Literatur wird die Häufigkeit von moderaten Spätnebenwirkungen (Grad 2) bei Röntgenbestrahlung im Bereich der Harnwege und des Enddarms von 7-19% beschrieben. Schwere Spätnebenwirkungen (Grad 3) nach konventioneller Röntgentherapie betragen 5-15% 3, 4, 5, 6. Am RPTC konnten wir während der medianen Nachbeobachtungszeit von 9 Monaten nur bei 16 (3,4%) Patienten moderate Spätnebenwirkungen (entsprechend RTOG Klassifikation Grad 2) nach Protonentherapie beobachten7: 7 Patienten hatten stark gehäuften Harndrang und benötigten medikamentöse Therapie. 3 Patienten entwickelten ein akutes Harnverhalten und benötigten für eine kurze Zeit eine Harnableitung bzw. einen Harnröhreneingriff. Sechs Patienten hatten eine stärkere Enddarmentzündung mit zeitweisen Blutungen, welche sich nach Gabe von lokalen entzündungshemmenden Zäpfchen wieder besserte. Lediglich 3 Patienten (0,6%) hatten eine schwere Spätnebenwirkung, die sich als starke Enddarmblutung manifestierte und die Gabe von Blutkonserven notwendig machte (siehe Tabelle 3). Im Bereich der Harnwege wurden keine schweren Spätnebenwirkungen entsprechend der RTOG Klassifikation beobachtet. Bezüglich der Sexualfunktionen berichteten nur wenige Patienten über eine Abnahme der Erektionsfähigkeit, wobei viele dieser Patienten eine antihormo- Späte Nebenwirkungen Akute Nebenwirkungen 80 Akut Lokalisation während bis 3 Monate nach Ende der Protonentherapie Harnableitende Wege Enddarm Spät Art der Nebenwirkung n Anteil % Grad 2 Stark gehäufter Harndrang Harnverhalt 6 1,2% Grad 3 Starke Blutung und Therapieabbruch bei Colitis ulcerosa 1 0,2% Tabelle 2: Art und Häufigkeit der schweren akuten Nebenwirkungen (≥Grad 2, EORTC/RTOG) nach Protonentherapie (n=500). >3 Monate nach Ende der Protonentherapie Lokalisation Art der Nebenwirkung n Anteil % Stark gehäufter Harndrang 7 1,4% Harnverhalt 4 0,8% Harnableitende Wege Grad 2 Enddarm Grad 2 Entzündung des Enddarms 6 1,2% Grad 3 Transfusionspflichtige Blutung aus dem Enddarm 3 0,6% Tabelle 3: Art und Häufigkeit der schweren späten Nebenwirkungen (≥Grad 2, EORTC/RTOG) nach Protonentherapie (n=500). 81 PROSTATAKARZINOME PROSTATAKARZINOME nelle Therapie erhielten, sodass eine kausale Abgrenzung zur Protonentherapie schwierig ist. Insgesamt waren die aufgetretenen Nebenwirkungen der Protonenbestrahlung deutlich geringer als jene der konventionellen Röntgentherapie. Natürlich sind diese Ergebnisse aufgrund der noch relativ kurzen Nachbeobachtungszeit mit Vorbehalt zu betrachten, bestätigen aber unsere Erwartungen: Das Protonen-Scanning am RPTC sichert die Freiheit von jeder Operationsletalität, es verringert die Gefahr einer Harnkontinenz wie auch Impotenz und hat geringere allgemeine Beschwerden im Vergleich zur konventionellen Röntgenbehandlung zur Folge, siehe Tabelle 3 auf Seite 81. Patientenzahl (03/09 bis 03/11) Anteil % 66,5 (44-85) Stadium T1 74 37,7 T2 und pT2 72 36,7 T3 und pT3 41 20,9 T4 und pT4 3 1,5 Lymphknotenmetastasen negativ 172 87,8 positiv 20 10,2 Fernmetastasen negativ 179 91,3 positiv 16 8,2 ≤ 10 ng/ml 115 58,7 11-20 ng/ml 36 18,4 > 20 ng/ml 29 14,8 2-6 73 37,2 7 81 41,3 8-10 35 17,9 niedrig 46 23,5 mittel 78 39,8 hoch 64 32,7 ja 66 33,7 nein 125 63,8 ja 25 12,8 nein 171 87,2 ja 2 1,0 nein 194 99,0 Gleason Score Risikogruppe Hormontherapie 82 n=196 Alter Initialer PSA Tabelle 4: Patienten- und Tumorcharakteristika von 196 Patienten welche im Zeitraum 03/09 bis 03/11 aufgrund eines Prostatakarzinoms am RPTC mit Protonentherapie behandelt wurden (=Patientenkollektiv mit medianer Nachbeobachtungszeit von 21 Monaten, auswertbare Parameter). Erste Ergebnisse Patienten- und Tumorcharakteristika Prostatektomie Frühere Bestrahlung Der PSA Wert ist ein wichtiger Parameter bei der Behandlung des Prostatakarzinoms, da durch ihn der Erfolg der Therapie beobachtet werden kann. Ein PSA Rezidiv liegt definitionsgemäß dann vor, wenn der PSA Nadir (der Mindestwert) um mindestens 2 ng/ml ansteigt (RTOG-ASTRO-Konsensus). Um bereits heute Aussagen über einen längeren Nachbeobachtungszeitraum treffen zu können, wurde eine Untergruppe von 196 Patienten ausgewertet, die vom Betriebsbeginn am 16.03.2009 bis zum 30.03.2011 am RPTC behandelt worden war. Diese Gruppe wurde im Median über 21 Monate nachbeobachtet. 66 dieser Patienten erhielten eine begleitende Hormontherapie, bei 25 handelte es sich um Nachbestrahlungen nach Prostatektomie. 16 wiesen bereits Fernmetastasen auf. Das Verhalten des Prostataspezifischen Antigens (PSA) nach Protonentherapie zeigte sich bei dieser Untergruppe durch einen Abfall im Median von 7,9 ng/ml auf 0,5 ng/ml nach definitiver (alleiniger) Protonentherapie; bei Patienten mit vorlaufender Prostatektomie war ein Abfall von 8,3 ng/ml auf 0,1 ng/ml zu beobachten, palliative Fälle sind hierin eingeschlossen. Während der medianen Nachbeobachtungszeit von 21 Monaten (95% Konfidenzintervall 18-23) traten in der gesamten Gruppe (inklusive Nach- und Rezidivbestrahlungen) bei 13 der insgesamt 196 Patienten (6,8%) ein PSA Rezidiv, siehe Tabelle 5. Für detaillierte Patienten- und Tumorcharakteristika siehe Tabelle 4 links. PSA Rezidive nach Protonentherapie Niedriges Risiko n=46 Mittleres Risiko n=78 Hohes Risiko n=64 PSA Rezidiv 2 4,3% 2 2,6% 9 14,1% Kein PSA Rezidiv 44 95,7% 76 97,4% 55 85,9% Tabelle 5: PSA Rezidive nach Protonentherapie in Abhängigkeit von der Risikogruppe (n=196, mediane Nachbeobachtung 21 Monate, auswertbar 188). 83 PROSTATAKARZINOME PROSTATAKARZINOME Wie erwartet, waren die meisten Rezidive in der Hoch-Risiko Gruppe zu finden (n=9). In der NiedrigRisikogruppe wurde bei 2 Patienten und in der Mittleren Risikogruppe ebenfalls bei 2 Patienten ein PSA Rezidiv beobachtet. 95,7% der Patienten der NiedrigRisikogruppe, 97,4% der Patienten der MittlerenRisikogruppe und 85,9% der Patienten der HochRisikogruppe waren nach 21 Monaten PSA-rezidiv-frei. Studien mit 1.557 eingeschlossenen Patienten bei einer Nachbeobachtungszeit von 15 Jahren eine 5-Jahresüberlebensrate von 94-96% in der NiedrigRisikogruppe, von 94% in der Mittleren-Risikogruppe und von 64-83% in der Hoch-Risikogruppe8. Entwicklungsrichtungen des ProtonenScannings beim Prostata-Karzinom tonenbestrahlung können diese aber reduziert werden, sodass die Bestrahlung der Lymphabflusswege einen weiteren Vorteil für unsere Patienten bringen kann. Wir empfehlen deshalb bereits heute die routinemäßige Bestrahlung der Lymphabflusswege in der hohen-und mittleren Risikosituation. Für die Zukunft werden wir eine standardisierte Erweiterung des Bestrahlungsfeldes entlang der Lymphknotenstationen auch für unsere Niedrig-Risiko Patienten diskutieren. Zur Definition der Risikogruppen siehe Tabelle 6. Vergleich mit der Literatur: Ein Vergleich unserer vorläufigen ersten Ergebnisse mit Publikationen nach Ergebnissen bei Röntgenbestrahlungen ist derzeit naturgemäß dadurch erschwert, dass diese Studien weitaus längere Nachbeobachtungszeiten aufweisen. Trotzdem entsprechen unsere Resultate den internationalen Ergebnissen. So ergab eine Metaanalyse aus 5 randomisierten Die zunehmende Etablierung unseres Verfahrens erlaubt es, die Nachbeobachtungsausfälle bei ausländischen Patienten – mit bereits jetzt beobachtbarer Verbesserungstendenz – zu reduzieren. Die Mitbestrahlung von Lymphabflusswegen auch bei den niederen Risikogruppen wird nach den geltenden Standards der konventionellen Strahlentherapie nicht geübt, da die Nebenwirkungen am Darm dort den positiven Effekt übersteigen. Durch die gezielte Pro- Prognosefaktoren des Prostatakarzinoms 84 Niedriges Risiko Mittleres Risiko Mittleres Risiko PSA Wert ≤10 ng/ml 11-20 ng/ml >20 ng/ml Gleason Score Max. 6 7 >8 Tumorstadium cT1c oder cT2a cT2b >cT2c Tabelle 6: Prognosefaktoren des Prostatakarzinoms. Seit einigen Jahren wird für externe Bestrahlung des Prostatakarzinoms mit Röntgen eine Änderung der Fraktionierung diskutiert. Mittlerweile liegen die Ergebnisse aus mehreren Phase II Studien vor, in denen Patienten mit nur 5 Fraktionen und Gesamtdosen von 35 bis 37 Gray bestrahlt wurden.9 Da die Zielpräzision des Protonen-Scannings zu einer um einen nur beschränkt anatomieabhängigen Faktor von ca. 3-5 niedrigeren Strahlendosis im gesunden Umgebungsgewebe führt, streben wir an, die derzeit bei konventionellen Prostatabestrahlungen international untersuchten Hypofraktionierungsregimes mit nur fünf Bestrahlungen ebenfalls zu nutzen. Aufgrund des günstigen Alpha/Beta-Verhältnisses bei Prostatakarzinomen von nur 1,5 Gray scheint diese Hypofraktionierung in einer hohen Effektivdosis am Tumor zu resultieren, die eine Reduktion der physikalischen Dosis auf nur 35 Gray ermöglicht. Literaturverzeichnis: 1.) D eutsche Gesellschaft für Urologie (DGU): S3-Leitlinie Prostatakarzinom, Version 2.0 (2011) 2.) Klein EA, Kupellian PA.: Localized prostate cancer: radiation or surgery? Urol Clin North Am; 30(2) (2003) 315 3.) D earnaley DP, Sydes MR, Graham JD et al.: Escalateddose versus standard- dose conformal radiotherapy in prostate cancer: first results from the MRC RT01 randomised controlled trial. Lancet Oncol 8 (2007) 475 4.) Elliott SP, Malaeb BS: Long-term urinary adverse effects of pelvic radiotherapy. World J Urol 291 (2011) 35 5.) G uckenberger M, Flentje M.: Intensity-modulated radiotherapy (IMRT) of localized prostate cancer: a review and future perspectives. Strahlenther Onkol 183 (2007) 57 6.) G uckenberger M, Ok S, Polat B et al.: Toxicity after intensity-modulated, in- age-guided radiotherapy for prostate cancer. Strahlenther Onkol 186 (2010) 535 7.) www.rtog.org/ResearchAssociates/AdverseEventReporting/RTOGEORTCLate RadiationMorbidityScoring Schema.aspx 8.) Roach M, Lu J, Pilepich MV, Asbell SO et al.: Four prognostic groups predict longterm survival from prostate cancer following radiotherapy alone on Radiation Therapy Oncology Group clinical trials. Int J Radiat Oncol Biol Phys 47 (2000), 609 9) Katz A, et al.: Five-year Biochemical Control Rates for Stereotactic Body Radiotherapy for Organ Confirmed Prostate Cancer: A Multi-institutional Pooled Analysis ASTRO (2012) 85 PROTONENBESTRAHLUNG DES PANCREAS PROTONENBESTRAHLUNG DES PANCREAS ERGEBNISSE DER NEUARTIGEN PROTONENBESTRAHLUNG DES PANCREAS Zusammenfassung für Patienten Die Röntgenbestrahlung von Karzinomen der Bauchspeicheldrüse ist unbefriedigend – es war nicht möglich, eine wirklich sterilisierende Dosis in den Tumorbereich zu strahlen – das Risiko für die nahen und empfindlichen Umgebungsorgane war zu groß. Unsere ersten 84 Fälle, Bestrahlung vor oder nach operativen Verfahren zeigen jedoch eine sehr gute Verträglichkeit der im Tumor konzentrierten Protonenbestrahlung. Wir hoffen, für die Zukunft zu Lösungen zu kommen, die die Protonenbestrahlung alleine, mit Chemotherapie kombiniert, als Behandlungsmethode bei nicht nur absoluten, sondern auch relativen Gegenanzeigen für operative Eingriffe entwickeln. Die mittlere Überlebenszeit von unbehandelten Patienten mit Pancreaskarzinomen liegt bei 3 Monaten, während die Überlebensraten nach radikaler Operation zwischen 10 und 20 Monaten betragen. Insgesamt ist von einer 5-Jahres-Überlebensrate von zirka 3–4% auszugehen. Patienten mit Tumoren, die auf das Pancreas beschränkt sind und einen Durchmesser von weniger als 3 cm haben, haben eine bessere Prognose als solche Patienten mit größeren Tumoren oder Infiltration des Retroperitoneums. Am günstigsten ist die Prognose für Patienten mit R0-Resektion. Das Ziel einer präoperativen/neoadjuvanten Strahlentherapie bei Pancreaskarzinomen, die als prinzipiell resektabel eingestuft werden, ist die Verbesserung der Resektabilität durch eine Verkleinerung des Tumors, die potenzielle Vermeidung intraoperativer Tumorzellverschleppung, eine frühere Therapie der Systemerkrankung und eine möglicherweise höhere Operabilitätsrate als bei der postoperativen/adjuvanten Therapie. Einhergehend mit diesen potenziellen Vorteilen ist die damit mögliche positive Beeinflussung des rezidivfreien Überlebens und des Gesamtüberlebens. Prinzipiell kann davon ausgegangen werden, dass bei einer präoperativen Radiotherapie günstigere biologische Verhältnisse (unveränderte Vaskularisation, Sauerstoffsättigung) im Tumor bestehen, die zu einem besseren Ansprechen, besonders auf die Strahlen-, aber auch auf die Chemotherapie, führen. 86 Beim frühen operablen Pancreaskarzinom ist die Datenlage klar vorliegend, Therapie der Wahl ist bisher die Operation. Beim lokal fortgeschrittenen inoperablen Pancreaskarzinom ist die Datenlage hingegen sehr different und frustran. Es gibt in der Literatur keinen eindeutigen Standard bezüglich eines therapeutischen Vorgehens. Bekannt ist aber, dass eine Kombination aus Strahlentherapie und Chemotherapie besser ist als eine Monotherapie. Eine Kombination führt aber im Verlauf auch zu größeren Toxizitäten. Somit ist die Radiotherapie mit ihren mittlerweile modernen Techniken stark gefordert. Sicherheitssäume sind enger zu halten, Gesamtdosen müssen gesteigert werden, das gesunde Gewebe wie Myelon, Nieren, Leber, Dünndarm und Magen müssen optimal geschützt werden. Offen ist noch die Frage des richtigen Zeitpunktes der Radiotherapie (konkomitant versus sequentiell), welche Chemotherapie und in welcher Dosierung, Gesamtdosis der Radiotherapie, die Definition des Bestrahlungsfeldes sowie der Stellenwert der Protonentherapie. wenig Energie abgeben, die meiste Energie im Ziel deponieren (Bragg-Peak) und hinter dem Ziel am Ende ihrer Flugbahn keine Ionisation auftritt. Mittlerweile wurden Tausende von Patienten mit verschiedenartigen Krebserkrankungen effektiv und sicher mit Protonen behandelt. Die Liste der Indikationen nimmt stetig zu und damit auch entsprechende gesicherte Literatur. Eine entsprechende Indikation beim Pancreaskarzinom gilt in folgenden Situationen: 1. d efinitive Protonentherapie beim lokal fortgeschrittenem inoperablem Karzinom 2. Protonentherapie im neoadjuvantem Setting 3. Protonentherapie adjuvant in der R1 Situation 4. Protonentherapie beim Lokalrezidiv nach Operation Die Strahlentherapie sollte mit einer systemischen Therapie in Form von Chemotherapie oder Targeted Therapy kombiniert werden, wenn die entsprechenden Voraussetzungen vom Patienten erfüllt werden. Indikation Protonentherapie: In Studien zu klären sind folgende Indikationsstellungen: Die Rationale für die klinische Applikation von Protonen im Behandlungsregime lieferte bereits Dr. Robert Wilson 1946. Wilson beschrieb, dass Protonen auf ihrer Flugbahn in Richtung vordefiniertes Ziel nur sehr 1. Protonentherapie bei R0 Resektion aber Sicherheitssaum < 1mm 2.Protonentherapie beim Lokalrezidiv nach voraus- gegangener Bestrahlung 87 PROTONENBESTRAHLUNG DES PANCREAS PROTONENBESTRAHLUNG DES PANCREAS Grundlage für Behandlungskonzepte mit Protonen: Wilkowski1 et al. demonstrierten bereits 2005 in einer Metaanalyse, dass eine Dosiserhöhung in der Strahlentherapie bzw. in der Chemotherapie oder in beiden, zu einem deutlich besserem Ansprechen der Therapie führt. Bis zu 1/3 der als inoperabel eingestuften Patienten konnten nach Therapie erfolgreich einer Operation zugeführt werden. Dieser Erfolg wurde aber mit einer deutlichen Zunahme von inakzeptablen Toxizitäten erkauft. Ben-Josef2 et al. zeigten mit ihrer Arbeit im Jahre 2008, dass eine Intensivierung der Therapie eine bessere lokale Kontrolle, ein besseres progressionsfreies Überleben als auch ein besserer overall survival erreicht hat. Aber auch hier wurde der Erfolg aufgrund inakzeptabler Nebenwirkungen geschmälert. Kozak3 et al. haben im Jahre 2007 beeindruckend gezeigt, dass durch den Einsatz von Protonen im Behandlungskonzept beim Pancreaskarzinom eine Dosiserhöhung und Hypofraktionierung sicher und effektiv eingesetzt werden kann, ohne die Toxizität zu erhöhen. In dieser dosimetrischen Studie wurde demonstriert, dass die Belastung der Risikoorgane signifikant geringer ist im Vergleich zu der herkömmlichen Strahlentherapie mittels Photonen. Aufgrund der physikalischen Eigenschaften der Protonen erreicht man somit die gewünschte höhere Dosis 88 im Tumor mit homogener Dosisauslastung bei gleichzeitiger optimaler Schonung des gesunden Gewebes. Bei lediglich 1 Patienten (2%) musste die Dosis im Primärtumor auf 15 x 3 Gray (RBE) reduziert werden aufgrund der Chemotherapienebenwirkungen. Behandlung am Rinecker Proton Therapy Center: 26 (53%) Patienten erhielten konkomitant Gemzar 300 mg/m2/wöchentlich. Vom Sommer 2009 bis Januar 2013 wurden 84 Patienten mit histologisch gesicherten inoperablen Pancreaskarzinomen bestrahlt. 49 Patienten, die entsprechende Einschlusskriterien erfüllten, wurden in ein internes Protokoll eingeschlossen und entsprechend ausgewertet, die restlichen 35 Patienten wurden nach individuellen Behandlungsprotokollen behandelt, oder stehen noch vor der ersten Nachkontrolle. Bei Patienten mit 10 Fraktionen im Primärtumorherd und konkomitanter Bestrahlung der Lebermetastasen wurde die Therapie in Narkose (Apnoezustand) 36 Patienten (73%) erhielten 18 x 3 Gray (RBE) in die Primärtumorregion, 6 Patienten (12%) wurden mit 10 x 4 Gray (RBE) im Primärtumor und mit 3 x 14 Gray (RBE) an den Lebermetastasen bestrahlt, weitere 2 Patienten (4%) erhielten zu den 10 x 4 Gray (RBE) im Primärtumor 3 x 12,5 Gray (RBE) im Bereich der Lebermetastasen. 1 weiterer Patient (2%) wurde mit 10 x 4 Gray (RBE) am Primärtumor und mit 10 x 3,5 Gray (RBE) im Bereich der lokoregionalen Lymphabflusswege bestrahlt. Jeweils 1 Patient (somit 4%) wurde mit 18 x 3 Gray (RBE) am Primärtumor und mit 1 x 22 Gray (RBE) bzw. 5 x 8 Gray (RBE) im Bereich der Lebermetastasen bestrahlt, 1 Patient (2%) erhielt 10 x 4 Gray (RBE) im Primärtumor, 10 x 3,5 Gray (RBE) im Bereich der lokoregionären Lymphabflusswege und 4 x 10 Gray (RBE) im Bereich der Lebermetastasen. durchgeführt, um etwaige Atmungsverschieblichkeiten auszuschließen. Initial wurden alle Patienten mittels MRT Abdomen und PET/CT einem Staging unterzogen, vor Therapie wurden die Leberfunktionsparameter abgenommen, die Therapie selbst wurde unter Bildkontrolle und Hochpräzisionslagerung durchgeführt. Übersicht Patientenkollektiv siehe Tabelle 1. Ergebnisse: Übersicht Patientenkollektiv Alter n = 49 Mittelwert 58,5 Jahre Bereich 40-82 Jahre Geschlecht weiblich 33 (67%) männlich 16 (33%) Bestrahlte Zielregion Tumor alleine 28 (57%) Tumor und Lymphabflusswege 9 (18%) Tumor und Metastasen 12 (25%) Protonen-Dosis im Zielgebiet 18 x 3 Gy (RBE) 36 (73%) 15 x 3 Gy (RBE) 1 (2%) 10 x 3 Gy (RBE) + 12 (25%) + Stereotaktische Protonentherapie für Metastasen und simultan hypofraktionierte Protonentherapie der regionalen Lymphabflusswege Tabelle 1: Ausgewertetes Patientenkollektiv Toxizität Akute Nebenwirkungen und Nebenwirkungen im follow-up sind nach RTOG/EORTC Kriterien klassifiziert und in Tabelle 2 auf Seite 90 zusammengefasst. Das mediane follow-up liegt bei 7,5 Monaten. Eine hypofraktionierte Protonentherapie mit dem Scanning Verfahren und Applikation einer effektiven Tumordosis ist sicher und tolerabel durchzuführen. Bei den bisher behandelten Patienten ist es zu keiner therapiebedingten Unterbrechung der Behandlung aufgrund unerwünschter Ereignisse gekommen. Während der Therapie und bis zu 28 Monate später wurden keine Grad 3 oder Grad 4 Nebenwirkungen beobachtet. Bei 1 Patienten (2%) ist eine Radiodermatitis Grad 1 aufgetreten, 14 Patienten (29%) klagten über Übelkeit und Appetitlosigkeit Grad 1, 5 Patienten Grad 2 (10%), welche eher der Chemotherapie zu- 89 PROTONENBESTRAHLUNG DES PANCREAS PROTONENBESTRAHLUNG DES PANCREAS zurechnen sind. 30 Patienten (61%) beendeten die Bestrahlung in gutem Allgemeinzustand ohne therapierelevante Nebenwirkungen. 3 Monate nach Therapie bis aktuell ist nur mehr eine Grad 2 Nebenwirkung (2%) dokumentiert. Keine Spätkomplikationen im Bereich der Risikoorgane wie Rückenmark, Nieren, Leber, Duodenum und Magen sind dokumentiert, mittels Blutbildkontrollen konnten schwere Komplikationen durch Kompression des Gallengangs ausgeschlossen werden. Nebenwirkungen siehe Tabelle 2. Lokalkontrolle Bei den 45 schon nachkontrollierten Patienten wurde in allen Fällen eine Reduktion der Tumorgröße erzielt; diese Ergebnisse wurden 3 Monate nach Ende der Therapie mittels MRT und PET/CT bildgebend evaluiert. 6 Monate nach Therapie zeigte sich bei den dann bereits erfassten 22 Patienten wiederum eine vollständige lokale Kontrolle, 18 Patienten (45%) waren noch nicht in der 6 Monatskontrolle. Lokale Kontrolle siehe Tabelle 3. Gesamtüberleben Eine Nachkontrolle nach 1 Jahr konnte bereits bei 9 Patienten durchgeführt werden. Die lokale Kontrolle war wiederum bei allen bildgebend kontrollierten Patienten gegeben. In diesem Zeitraum sind aber 14 Patienten verstorben, davon 1 Patient an einer MRSAInfektion während der adjuvanten Chemotherapie. Weitere 12 Patienten verstarben an zum Zeitpunkt der Therapie bekannten oder noch nicht aufgetretenen Metastasen. 1 Patient verstarb an einem DarmIleus ohne erkennbaren Bezug zur Strahlentherapie. Zu 2 Patienten wurde der Kontakt verloren. Zusammenfassung: Eine hypofraktionierte Protonentherapie mit erhöhten Gesamtdosen ist eine sichere und effektive Therapie, die in Kombination mit einer Chemotherapie Patienten mit lokal fortgeschrittenem Pancreaskarzinom angeboten werden sollte. Eine Therapie mit Protonen erreicht eine homogene Dosisauslastung im Tumor, erreicht hohe Gesamtdosen im Tumor bei deutlich weniger Belastung der entsprechenden Risikostrukturen. Diese Risikostrukturen sind bei der Protonentherapie signifikant weniger dosislimitierend im Vergleich zur Röntgenbestrahlung. Die Überlegenheit der Protonentherapie ist an der hohen Sicherheit der lokalen Tumorkontrolle belegbar. Entsprechende Studien zur Optimierung der Gesamtdosis sowie Einzeldosis in der Protonentherapie, Art und Dosierung der Chemotherapie nach erfolgreicher Durchführung des Pilotprojektes bezüglich der Toxizität, werden derzeit bei uns vorbereitet. Literaturverzeichnis: 1.) Wilkowski R., Thoma M., Weingandt H., Dühmke E., Heinemann V., et al.: Chemoradiation for Ductal Pancreatic Carcinoma: Principles of Combining Chemotherapy with Radiation, Definition of Target Volume and Radiation Dose. JOP. J Pancreas (Online) 6 (2005) 216-230 2.) Ben-Josef E., Griffith K., Francis I. R., et al.: Phase I radiation dose-escalation trial of intensity-modulated radiotherapy (IMRT) with concurrent fixed dose-rate gemcitabine (FDR-G) for unresectable pancreatic cancer. ASCO Meeting Abstracts 27 (2009) 4602 3.) Kozak K. R., Kachnic L. A., Adams J., et al.: Dosimetric Feasibility of Hypofractionated Proton Radiotherapy for Neoadjuvant Pancreatic Cancer Treatment. Int J Radiat Oncol Biol Phys. 68 (2007) 1557-1566 Lokale Kontrolle Nebenwirkungen Toxizität (RTOG#) unter Therapie bis Ende Protonentherapie 3 Monate nach Ende Protonentherapie 6 Monate nach Ende Protonentherapie Anzahl Patienten 49 46** 40*** Grad 0 30 (61%) 41 (89%) 39 (98%) Grad 1 14 (29%) 4 (9%) 1 (2%) Grad 2 5* (10%) 1 (2%) 0 Grad 3 0 0 0 Grad 4 0 0 0 Tabelle 2: Ausgewertetes Patientenkollektiv - Ergebnisse Nebenwirkung, Festgestellte Nebenwirkungen während und nach bis 6 Monate nach der Therapie 90 #Klassifikation nach Radiation Therapy Oncology Group * Patienten mit gleichzeitiger systemischer Therapie ** 1 Patient verstorben aufgrund fulminanter Lebermetastasierung, 2 Patienten aus follow up verloren *** 6 Patienten verstorben (1x nicht Strahlentherapie-bedingter Ileus, 1x MRSA-Infekt während bei nachfolgender Chemotherapie, 4x Lebermetastasierung) Lokale Tumorkontrolle 3 Monate post Protonentherapie (n=46) Prozentsatz 45 Patienten (98%) 100% 1 Patient (2%) Noch nicht in der 3 Monatskontrolle Lokale Tumorkontrolle 6 Monate post Protonentherapie (n=40) 22 Patienten (55%) 100% 18 Patienten (45%) Noch nicht in der 6 Monatskontrolle Lokale Tumorkontrolle 12 Monate post Protonentherapie (n=35) 9 Patienten (26%) 100% 26 Patienten (74%) Noch nicht in der 12 Monatskontrolle Tabelle 3: Ausgewertetes Patientenkollektiv - Ergebnisse lokale Kontrolle 91 Fallbeispiele Fallbeispiele Patient Diagnose Therapieverlauf Fallbeispiel: Atypisches Meningeom Clivus Progress mit klinischer Symptomatik nach initialer Radiotherapie. Eine Operation war aufgrund der Lokalisation nicht möglich. Eine neuerliche Bestrahlung mittels Röntgen wäre aufgrund der Hirnstammbelastung nicht mehr durchführbar gewesen. Dosisbereiche Gewebeanteile 100 % GTV1 95-100 % PTV1 Mit Protonen konnte nochmals eine tumoreffektive Dosis appliziert werden, bei maximaler Schonung des Hirnstammes. 100 % GTV1 95-100 % PTV1 Hirnstamm 90-95 % Hirnstamm Chiasma 80-90 % Chiasma 60-80 % Sehnerv links 60-80 % Sehnerv links 40-60 % Sehnerv rechts 40-60 % Sehnerv rechts Protonen 20-40 % Wie im RPTC bestrahlt 10-20 % 100.00 80.00 80.00 Volumen (%) 100.00 60.00 40.00 20.00 60.00 40.00 20.00 0.00 0.00 0.00 20.00 40.00 60.00 0.00 Dosis (Gy) 92 Gewebeanteile 90-95 % 10-20 % 15 Felder IMRT Dosisbereiche 80-90 % 20-40 % Theoretisch berechneter Vergleichsplan Volumen (%) Röntgen Protonenschema Nebenwirkung Aktuell 68 Jahre, männlich Atypisches Meningeom Clivus links Erstdiagnose 2006 03/06 Teilresektion 04/06 Radiotherapie mit Röntgen 27 x 2 Gy bis 54 Gy 07/10 Progress bildgebend; Kopfschmerz, Schwindel, Gangunsicherheiten Bis zu diesem Zeitpunkt engmaschige Kontrolle & enger Kontakt zur heimatnahen Neurochirurgie, da Verschlechterung der Symptomatik (v.a. Kopfschmerzen & Schwindel), neuerliche Radiatio indiziert; 04/12 Beginn einer Reradiatio mit Protonentherapie 21 x 2,5 Gy (RBE) bis 52,5 Gy (RBE) Keine therapieassoziierten Nebenwirkungen aufgetreten 05/12 Ende der Protonentherapie; Kopfschmerzen und Schwindel vollständig verschwunden; Sehfähigkeit status idem; 01/13 bildgebend und klinisch stabile Situation 20.00 40.00 60.00 Dosis (Gy(RBE)) 2 Feld Protonen-Scanning 93 Fallbeispiele Fallbeispiele Patient Diagnose Therapieverlauf Protonenschema Nebenwirkung Aktuell Fallbeispiel: Kind: Embryonales Rhabdomyosarkom Mit Röntgen hätte auch die kontralaterale Seite Dosis erhalten. Bildgebung vor Protonentherapie Röntgen 5 Jahre, männlich Embryonales Rhabdomyosarkom (< 5 cm) der linken Wange mit epiduralem Kontakt zur Schädelbasis und Infiltration des linken Kiefergelenkes 06/10 Tumorbiopsie und Diagnosestellung 10/10-04/11 Chemotherapie gemäß CWS – guidance 02/11-03/11 Protonentherapie gemäß Protokoll 05/11-10/11 Erhaltungschemotherapie gemäß CWS – guidance 28 x 1,8 Gy (RBE) bis 50,4 Gy (RBE) Chronischer Paukenerguss, mittlerweile konsolidiert 12/12 Kinderonkologie Schwabing: - kein Anhalt für Resttumor oder lokales Rezidiv - es ist von einer Vollremission auszugehen Sowohl das Innenohr als auch das Myelon (Rückenmark) konnten mit Protonen besser geschont werden. Zusätzlich wurden Knochen und kontralaterales gesundes Gewebe entlastet. Um das Zweittumorrisiko so gering wie möglich zu halten, sollten Kinder gemäß Leitlinien der Deutschen Gesellschaft für Radio-Onkologie (DEGRO) mit Protonen bestrahlt werden. Bildgebung nach Protonentherapie: Remission Tumorregion Theoretisch berechneter Vergleichsplan Protonen Wie im RPTC bestrahlt Dosisbereiche 100 % 100.00 80-90 % 60.00 60-80 % 40.00 40-60 % 20.00 20-40 % 10-20 % 20.00 40.00 60.00 80.00 60-80 % 40.00 40-60 % 20.00 0.00 0.00 20-40 % 10-20 % 20.00 40.00 60.00 80.00 Dosis (Gy(RBE)) Gewebeanteile Gewebeanteile GTV1 GTV1 PTV1 PTV1 PTV2 PTV2 Hirnstamm Hirnstamm Auge links Auge links Myelon Myelon Linse links Linse links Chiasma Chiasma Sehnerv links Sehnerv links Kiefergelenk 94 90-95 % 80-90 % 60.00 Dosis (Gy) 5 Felder (Stehfeldplan) 95-100 % 80.00 Volumen (%) Volumen (%) 90-95 % 100 % 100.00 95-100 % 80.00 0.00 0.00 Dosisbereiche Kiefergelenk 2 Feld Protonen-Scanning 95 Fallbeispiele Fallbeispiele Patient Diagnose Therapieverlauf Protonenschema Fallbeispiel: Bronchialkarzinom Nebenwirkung Aktuell Das Lokalrezidiv war mit 66 Gy durch Röntgenstrahlung vorbelastet, eine neuerliche Bestrahlung mittels Röntgen wäre aufgrund der Belastung des umgebenden gesunden Lungengewebes sowie der Nähe zum Myelon (Rückenmark) nicht mehr möglich gewesen. Dosisbereiche Gewebeanteile 100 % GTV1 95-100 % PTV1 58 Jahre, männlich Bronchialkarzinom (NSCLC) links zentral Erstdiagnose 02/2010 cT3 cN2 M0 R0 03/10 Start Chemotherpaie mit Cisplatin/Navelbine 06/10 kombinierte Radiochemotherapie mit Röntgen bis 66 Gy 01/11 Start Chemotherapie Taxotere bei Tumorprogress 06/11 Protonentherapie bei Progress unter Chemotherapie PTV: 2 x 5 Gy (RBE) bis 10 Gy (RBE) + 4 x 8 Gy (RBE) bis 32 Gy(RBE) durchgeführt in Apnoe keine therapieassoziierten Nebenwirkungen Restaging 08/11: - gute partielle Remission - keine therapieassoziierten Nebenwirkungen dokumentiert - guter Allgemeinzustand und Ernährungszustand Mit Protonen war eine neuerliche Bestrahlung mit hoher Dosis möglich. Myelon (Rückenmark) und Lunge werden maximal geschont, die gegenüberliegende Lunge bleibt strahlungsfrei. Dosisbereiche 100 % GTV1 95-100 % PTV1 90-95 % Myelon 90-95 % Myelon 80-90 % Lunge links 80-90 % Lunge links 60-80 % Lunge rechts 60-80 % Lunge rechts 40-60 % 40-60 % 20-40 % Theoretisch berechneter Vergleichsplan Protonen 10-20 % 20-40 % Wie im RPTC bestrahlt 10-20 % 100.00 100.00 80.00 80.00 Volumen (%) Volumen (%) Röntgen 60.00 40.00 20.00 60.00 40.00 20.00 0.00 0.00 0.00 9.00 18.00 27.00 36.00 45.00 0.00 Dosis (Gy) 5 Felder (Stehfeldplan) 96 Gewebeanteile 9.00 18.00 27.00 36.00 45.00 Dosis (Gy(RBE)) 2 Feld Protonen-Scanning 97 Fallbeispiele Fallbeispiele Patient Diagnose Therapieverlauf Protonenschema Fallbeispiel: Lungenmetastase Nebenwirkung Aktuell Dosisbereiche Gewebeanteile 100 % GTV1 95-100 % CTV1 90-95 % PTV1 80-90 % Lunge links 60-80 % Lunge rechts 67 Jahre, männlich Nierenzellkarzinom Erstdiagnose 10/2007 10/07 Tumornephrektomie 06/08 Start Chemotherpaie (Sutent) bei mediastinalen Lymphknoten-Metastasen 08/10 Bestrahlung mit Röntgen der mediastinalen Lymphknoten bei Progress 10/12 Protonentherapie einer progredienten Lungenmetastase 3 x 14 Gy (RBE) bis 42 Gy (RBE) durchgeführt in Apnoe keine Nebenwirkungen dokumentiert Kontrolle Ende März 2013 vorgesehen Bestrahlung einer singulären Lungenmetastase. Aufgrund der speziellen Applikationstechnik mit Apnoe und Protonen, ist es möglich den Sicherheitssaum möglichst klein zu halten und gesundes Lungengewebe zu schonen. Deutlich weniger Dosis im gesunden Gewebe im Vergleich zu Photonen. Dosisbereiche 100 % GTV1 95-100 % CTV1 40-60 % Protonen 10-20 % PTV1 Lunge links 60-80 % Lunge rechts 20-40 % Wie im RPTC bestrahlt 10-20 % 100.00 80.00 80.00 Volumen (%) 100.00 60.00 40.00 20.00 60.00 40.00 20.00 0.00 0.00 0.00 9.00 18.00 27.00 36.00 45.00 0.00 Dosis (Gy) 5 Felder (Stehfeldplan) 98 90-95 % 80-90 % 40-60 % 20-40 % Theoretisch berechneter Vergleichsplan Volumen (%) Röntgen Gewebeanteile 9.00 18.00 27.00 36.00 45.00 Dosis (Gy(RBE)) 3 Feld Protonen-Scanning 99 Fallbeispiele Fallbeispiele Patient Diagnose Therapieverlauf Protonenschema Fallbeispiel: Pancreaskopfkarzinom Nebenwirkung Aktuell Aufgrund der Risikoorgane, die das Pancreas und somit das Pancreaskarzinom umgeben (Darm, Niere, Rückenmark), wäre eine Bestrahlung mit Röntgen mit einer hohen Dosis nicht möglich gewesen. Dosisbereiche 53 Jahre, weiblich Pankreaskopfkarzinom ED 10/2011 pT3 N1 M0 R0 10/2011 Duodenopancreatektomie mit adjuvanter Gemzar Therapie 11/2012 Lokalrezidiv Pankreascorpus, inoperabel eingestuft 12/2012 Protonentherapie PTV: 10 x 4 Gy (RBE) bis 40 Gy (RBE) durchgeführt in Apnoe GTV: 10 x 4,4 Gy (RBE) bis 44 Gy (RBE) integrierter Boost Keine therapieassoziierten Nebenwirkungen dokumentiert Nachkontrolle derzeit Gewebeanteile Dosisbereiche > 105 % GTV1 > 105 % GTV1 100-105 % PTV1 100-105 % PTV1 95-100 % Niere links 95-100 % 90-95 % Myelon 90-95 % Myelon Darm 80-90 % Darm 70-80 % Darm 1 70-80 % Darm 1 50-70 % 30-50 % Theoretisch berechneter Vergleichsplan Protonen 30-50 % Wie im RPTC bestrahlt 10-30 % 100.00 100.00 80.00 80.00 Volumen (%) Volumen (%) 10-30 % 60.00 40.00 20.00 60.00 40.00 20.00 0.00 0.00 0.00 10.00 20.00 30.00 40.00 50.00 0.00 Dosis (Gy) 9 Felder IMRT 100 Niere links 80-90 % 50-70 % Röntgen Gewebeanteile 10.00 20.00 30.00 40.00 50.00 Dosis (Gy(RBE)) 1 Feld Protonen-Scanning 101 Fallbeispiele Fallbeispiele Patient Diagnose Therapieverlauf Protonentherapie Protonenschema Besonderheit Nebenwirkung Aktuell Fallbeispiel: Kind: Synovialsarkom Bei einer Bestrahlung mit Röntgen hätte das linke Ovar chirurgisch verlegt werden müssen, um eine Funktionserhaltung zu ermöglichen. Dosisbereiche Gewebeanteile 100 % PTV 95-100 % Mit Hilfe der Protonen kann das linke Ovar geschont werden. Der operative Eingriff konnte vermieden werden. 100 % PTV 95-100 % Ovar links 90-95 % Adnexen links 90-95 % Adnexen links Adnexen rechts 80-90 % Adnexen rechts 60-80 % Uterus 60-80 % Uterus 40-60 % Blase 40-60 % Blase Protonen 20-40 % Wie im RPTC bestrahlt 10-20 % 100.00 80.00 80.00 Volumen (%) 100.00 60.00 40.00 20.00 60.00 40.00 20.00 0.00 0.00 0.00 20.00 40.00 60.00 0.00 Dosis (Gy) 102 Gewebeanteile 80-90 % 10-20 % 9 Felder IMRT Dosisbereiche Ovar links 20-40 % Theoretisch berechneter Vergleichsplan Volumen (%) Röntgen 15 Jahre, weiblich Synovialsarkom linke Leiste 08/11 Tumorresektion, R1 Resektion 09/11Nachresektion 11/11-04/12 Chemotherapie nach dem CWS-Protokoll 04/12 Tumorboardbeschluss zur Protonentherapie 05/12-06/12 Protonentherapie Tumorbett linke Leiste 28 x 1,8 Gy (RBE) bis 50,4 Gy (RBE) Schonung des linken Ovars, keine chirurgische Verlegung Radiodermatitis Grad I Komplette Remission, Nachsorge Kinderonkologie Schwabing 20.00 40.00 60.00 Dosis (Gy(RBE)) 1 Feld Protonen-Scanning 103 Fallbeispiele Fallbeispiele Patient Diagnose Therapieverlauf Protonenschema Nebenwirkung Aktuell Fallbeispiel: Prostatakarzinom Dosisbereiche Gewebeanteile 100 % CTV1 95-100 % PTV1 90-95 % Rektum 80-90 % Blase 60-80 % 59 Jahre, männlich Prostatakarzinom ED 08/2011 pT1c cN0 cM0 Gleason Score 3 + 3 = 6 iPSA 11 ng/ml 08/2011 bioptische Sicherung 11/2011 Protonentherapie Prostata und Samenblasenbasen Pollakisurie Grad 1 21 x 3,0 Gy (RBE) bis 63,0 Gy (RBE) Keine therapieassoziierten Nebenwirkungen aufgetreten 02/2012PSA 3,36 ng/ml 08/2012PSA 0,88 ng/ml Bei der isolierten Bestrahlung der Prostata konnte die Belastung der Risikoorgane Rektum und Harnblase durch eine Bestrahlung mit Protonen gegenüber einer IMRT Röntgenbestrahlung deutlich reduziert werden. Somit ist eine deutliche Verringerung der akuten Toxizität sowie der Spättoxizität zu erwarten. Dosisbereiche Protonen 90-95 % Rektum 80-90 % Blase 10-20 % 100.00 100.00 80.00 80.00 60.00 40.00 20.00 60.00 40.00 20.00 0.00 0.00 0.00 20.00 40.00 60.00 80.00 0.00 Dosis (Gy) 104 PTV1 20-40 % Wie im RPTC bestrahlt Volumen (%) Volumen (%) 10-20 % 5 Felder IMRT CTV1 40-60 % 20-40 % Theoretisch berechneter Vergleichsplan 100 % 95-100 % 60-80 % 40-60 % Röntgen Gewebeanteile 20.00 40.00 60.00 80.00 Dosis (Gy(RBE)) 2 Feld Protonen-Scanning 105 Fallbeispiele Fallbeispiele Patient Diagnose Therapieverlauf Fallbeispiel: Prostatakarzinom mit Erfassung der Lymphabflusswege Protonenschema Nebenwirkung Aktuell Dosisbereiche Gewebeanteile 100 % GTV1 95-100 % PTV1 90-95 % CTV1 80-90 % CTV2 60-80 % Rektum 73 Jahre, männlich Prostatakarzinom ED 02/2012 pT1c cN0 cM0 Gleason Score 3+4 = 7a iPSA 19,01 ng/ml 02/12 bioptische Sicherung 07/12 Protonentherapie Prostata und Samenblasenbasen sowie der regionalen Lymphabflusswege Pollakisurie Grad 1, Dysurie Grad 1 Prostata 21 x 3,0 Gy (RBE) bis 63,0 Gy (RBE) Lymphabflusswege: 21 x 2,5 Gy (RBE) bis 52,5 Gy (RBE) Unter Therapie keine therapieassoziierten Nebenwirkungen aufgetreten 10/12 PSA 0,44 ng/ml 01/13 PSA 0,14 ng/ml Bei der Bestrahlung der Prostata und der Lymphabflusswege mit Protonen konnte eine bessere Schonung von Rektum und Harnblase erzielt werden. Zudem konnte der Darm bei der Bestrahlung der Lymphabflusswege ausgespart werden, trotz eines großen Zielvolumens kam es zu keiner zusätzlichen Toxizität. Dosisbereiche 40-60 % Protonen 10-20 % PTV1 90-95 % CTV1 80-90 % CTV2 60-80 % Rektum 10-20 % 80.00 80.00 Volumen (%) 100.00 60.00 40.00 20.00 60.00 40.00 20.00 0.00 0.00 0.00 20.00 40.00 60.00 80.00 0.00 Dosis (Gy) 106 GTV1 20-40 % Wie im RPTC bestrahlt 100.00 9 Felder IMRT 100 % 95-100 % 40-60 % 20-40 % Theoretisch berechneter Vergleichsplan Volumen (%) Röntgen Gewebeanteile 20.00 40.00 60.00 80.00 Dosis (Gy(RBE)) 2 Feld Protonen-Scanning 107 Fallbeispiele Fallbeispiele Patient Diagnose Therapieverlauf Protonenschema Nebenwirkung Aktuell Fallbeispiel: Prostatakarzinom - Metastasen Protonenschema Dosisbereiche Theoretisch berechneter Vergleichsplan > 115 % PTV1 100-115 % PTV4 95-100 % PTV5 Aufgrund der hohen Präzision und des steilen Dosisgradienten der Protonentherapie konnten die paraaortalen Lymphknotenmetastasen trotz einer Vorbelastung durch Röntgen im Bereich der Prostata sowie der Lymphknoten im Beckenbereich hochdosiert bestrahlt werden. Gewebeanteile > 115 % PTV1 100-115 % PTV4 95-100 % PTV5 90-95 % PTV6 90-95 % PTV6 PTV7 80-90 % PTV7 60-80 % Niere links 60-80 % Niere links 40-60 % Niere rechts 40-60 % Niere rechts 20-40 % Myelon 20-40 % Myelon Protonen Wie im RPTC bestrahlt 10-20 % 100.00 80.00 80.00 Volumen (%) 100.00 60.00 40.00 20.00 60.00 40.00 20.00 0.00 0.00 0.00 20.00 40.00 60.00 80.00 0.00 Dosis (Gy) 8 Felder (Stehfeldplan) 108 Dosisbereiche 80-90 % 10-20 % Volumen (%) Röntgen Gewebeanteile 64 Jahre, männlich Prostatakarzinom ED 08/2011 pT3b pN1 cM0 Gleason Score 5 + 4 = 9 iPSA 4,9 ng/ml 08/11 radikale Prostatektomie und Lymphadenektomie 11/11 konsolidierende Radiotherapie (Röntgen) 33 x 2 Gy bis 66 Gy inkl. iliakaler Lymphabflusswege 08/12 paraaortales Lymphknotenrezidiv, PSA 2,15 ng/ml 09/12 Protonentherapie paraaortale Lymphabflusswege mit integriertem Boost auf PET-positive Lymphknoten Lymphabflusswege: 21 x 2,5 Gy (RBE) bis 52,5 Gy (RBE) Boost: 21 x 3,0 Gy (RBE) bis 63,0 Gy (RBE) Keine therapieassoziierten Nebenwirkungen aufgetreten 12/12 PSA 0,4 ng/ml 01/13 PSA 0,5 ng/ml (unter Antihormontherapie) Bildgebend Metastase rechte Hüfte & 2 Rippenmetastasen, entsprechende Schmerzsymptomatik 03/13 Protonentherapie der ossären Metastasen Metastasen Rippen (Wirbelsäulen-nah): 10 x 4,0 Gy (RBE) bis 40,0 Gy (RBE) Metastase Hüfte rechts: 10 x 3,0 Gy (RBE) bis 30,0 Gy (RBE) 20.00 40.00 60.00 80.00 Dosis (Gy(RBE)) 1 Feld Protonen-Scanning 109 Kontakt / Impressum Kontakt Impressum Für Patienten: +49 (0) 89 660 680 Für Ärzte: +49 (0) 89 452 286 2268 Email: [email protected] Internet: www.rptc.de Adresse: Schäftlarnstrasse 133 D - 81371 München Herausgeber ProHealth AG Hans-Pinsel-Strasse 10 85540 Haar/München Tel.: +49 (0) 89-456 96 99-0 Fax: +49 (0) 89-456 96 99-20 Internet: www.prohealth.de Vertreten durch Dr. rer. nat. Jörg Hauffe Sitz: München, Registergericht: München, HRB 126719 Vorsitzender des Aufsichtsrates: PD Dr. med. Dr. habil. Hans Rinecker München, Mai 2013 Autoren Prof. Dr. med. Barbara Bachtiary Dr. med. Alfred Haidenberger Dr. rer. nat. Jörg Hauffe PD Dr. med. Dr. habil. Hans Rinecker Dr. med. Marc Walser Copyright Die Rechte an Texten, Bildern und Grafiken liegen bei der ProHealth AG. Nachdruckgenehmigungen für Texte und Grafiken Nachdruck, auch auszugsweise, nur mit Genehmigung durch die Pro Health AG. [email protected] Weitere Bildrechte Shutterstock (Seite 19) 110 RINECKER PROTON THERAPY CENTER Rinecker Proton Therapy Center (RPTC) Telefon: Email: Internet: Adresse: +49 (0) 89 660 680 [email protected] www.rptc.de Schäftlarnstrasse 133, D - 81371 München