Paraneoplastische endokrine Syndrome
Werbung

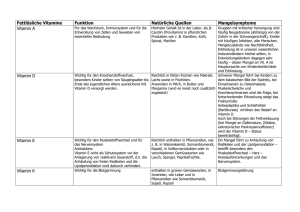
PARANEOPLASTISCHE ENDOKRINE SYNDROME HYPO- UND HYPERVITAMINOSEN SPEICHERERKRANKUNGEN Dr. med. Peter Igaz PhD DSc Klinik II. der Inneren Medizin Medizinische Fakultät Semmelweis Universität • • • • Hauptcharakteristika von paraneoplastischen endokrinen Syndromen Hormonsekretion ist selten zu hemmen. Meistens bei fortgeschrittenen Tumorkrankheiten zu finden. Hormone sind nicht effektiv als Tumormarker. Im Hintergrund von paraneoplastischen endokrinen Syndromen ist oft nicht das charakterischtises Hormon zu finden, sondern andere ähnlich wirkende Mediatoren. Die wichtigsten Hormone in paraneoplastischen Syndromen • Mediatoren verursachend Hyperkalzämie – Parathormon like peptide (PTHrP) – Vitamin D – PTH • ADH • ACTH • IGF-II • Andere GHRH, Kalcitonin, hCG, GH, CRH, Eritropoetin, ANP, Endothelin, Renin, GI Hormone (GIP, Somatostatin, PP, VIP stb.) Kriterien der Feststellung der Diagnose • Klinische Kriterien – 1. Hormonsekretion ist im Zusammenhang von Tumoren zu bringen – 2. ungewöhnlich hohe Hormonkonzentrationen im Blut oder Urine – 3. Hormonproduktion ist nicht zu hemmen – 4. anderen Ursachen ausgeschlossen – 5. Krankheit ist durch die Entfernung der Tumor zu • Forschungskriterien – 1. Hormon oder mRNA ist im Tumor zu finden. – 2. Hormon ist sezerniert von Zellenkultur isoliert von Tumor. – 3. Konzentrationsgradient zwischen arteriellen und venösen Seite des Tumors. Die wichtigsten paraneoplastischen endokrinen Syndrome • 1. Tumorassoziierte Hyperkalzämie • 2. SIADH: syndrome of inappropriate secretion of antidiuretic hormone • 3. ectopisches ACTH Syndrom • 4. Tumorassozieirte Hypoglykämie Tumorassoziierte Hyperkalzämie • Häufigstes paraneoplastische endokrine Syndrom. • In 5 % von allen Tumoren zu finden. • Mit schnellen Beginn, führt zu schwierigen Hyperkalzämie: Konfusion, Stupor, Koma, Erbrechen, Dehydration. • Sehr schlechte Prognose: allgemeines Überleben nach Entstehen: 4-8 Wochen • Ursachen: – PTHrP – Vitamin-D – Direkte osteolytische Effekte der Tumoren Häufigste Tumorarten assoziiert mit Hyperkalzämie • • • • • • • Lungen (meistens Kleinzellen) cc. Brustcc. 60 % aller Myeloma multiplex Fällen Kopf-Hals cc. Harnwegtumoren Speiseröhrencc. Lymphoma – Vitamin-D Diagnose von Tumorassoziierten Hyperkalzämie • Serum Kalzium hoch, Phosphat niedrig. • In schwierigen Fällen se Ca > 3.5 mmol/l • Wichtig!!!: Se gesamt Ca Konzentration hängt von Serum Albumin und TotalProtein. Korrektion!!! • Wenn Serum TP ist mit 1 g/dl niedriger, man muss zu den gemessenen Se Ca 0.2 zugeben!!! • Serum PTH niedrig <20 pg/ml (<2 pmol/l) Therapie • Rehydration, Flüssigkeitszufuhr • Furosemid • Vermeiden von Tiazid Diuretika und Litium • Bisphosphonate (z.B. Pamidronat 60-90 mg, Zoledronat 4-8 mg i.v.) • Kalcitonin – schnelle Verminderung von Hyperkalzämie • Gallium nitrát • Mithramycin SIADH • Wahrscheinlich das zweithäufigste endokrine paraneoplastische Syndrom. • Überproduktion von ADH (Vasopressin) • Folgen: – Schwierige Hyponaträmie (Se Na oft <120 mmol/l). – Hypoosmolalität des Serums (<275 mOsm/kg), Urine zu konzentriert (>100 mOsm/kg) und NaKonzentration auch erhöht. – Somnolenz, Coma, Konvulsionen. Neoplastische Ursachen von SIADH • Kleinzelliges Lungencc. – in 5-15 % von allen Patienten mit dieser Tumorart zu finden. • Andere Lungentumoren. • Karcinoide, prostatacc., cervixcc. Diagnose von SIADH • Hipoosmoläles Serum, konzentrierte Urine. • Hyponaträmie im Serum, hohe urinale Natrium Konz.. • Ödémák hiánya. • Mangel von Ödemen: Hypothyreose, Addison-Krankheit, Hypophyseninsuffienz, Medikamente (psychiatrische Medikamente, Diuretika), ZNS Krankheiten. Therapie von SIADH • Schwieriger Fall (se Na < 120 mmol/l) – Hypertonische Salzinfusion – Mit oder ohne Furosemid – Ziel: 125 mmol/l – Die Gewschwindigkeit der Erhöhung soll nicht über 0.5 mmol/l/h gehen, sonst Gefahr von Zentralen Pontin Myelinolyse. • Milder Fall (se Na > 120 mmol/l) – Beschränkte Flüssigkeitszufuhr (< 800-1000 ml/Tag) - Urea – In chronischen Fällen: Demeclocyclin – hemmt die renale Effekte von ADH. – Tolvaptan – ADH V2 R Antagonist Ektopisches ACTH-Syndrom • 10-20 % von allen Cushing Fällen. • Häufiger in Männer. • Im Gegensatz zu klassischen CushingSyndrom: Verlauf ist schnell, proximale Myopathie häufig, Ödemen, Hypokalämie, IGT, Diabetes mellitus. • Klassische phenotypische Zeichen von Cushing sind oft nicht zu sehen. • Hyperpigmentation durch die hohen serum ACTH Konzentrationen. Die häufigste Tumorarten im Hintergrund von ektopischen ACTH-Syndrom • 45-50 % kleinzelliges Lungencc. • • • • • • 15 % Thymus Karcinoid 10 % Bronchus Karcinoid 10 % GEP Tumoren 5 % andere Karcinoid Tumorarten 2 % Phäochromocytoma 1 % Ovarium Adenocc. Diagnose von ektopischen ACTHSyndrom • Hormonale Diagnose – Hohe Kortisolwerte (mangelhafte Tagesrhythmus) – Nicht hemmbar durch Dexamethason – Nicht durch CRH zu stimulieren – hohes ACTH – In dubiösen Fällen Kathetherisation von Sinus petrosus inferior • Andere Peptide auch möglich zu finden. • Hypokalämia, Alkalose häufig HSD11B2 Bildgebende Verfahren • 1. Rutinuntersuchungen: Thorax Rtg., Bauch US. • 2. Thorax CT. • 3. Bauch CT. • 4. Somatostatin Rezeptor Scintigraphia. Behandlung von ektopischen ACTHSyndrom • 1. Entfernung oder Behandlung der Tumor (Kemo-, Radiotherapie). • 2. Somatostatin Analoge • 3. Hemmer der Glukokortikoiden Biosynthese – Ketokonazol, Mitotan, Aminogluthetimid • 4. Bilaterale Adrenalektomie Tumorassoziierte Hypoglykämie • Die Hypoglykämie ist nicht durch Insulinom oder gesteigerten Glukosenverbrauch von verbreiteten Metastasen oder grossen primären Tumoren verursacht. • Meistens verbunden mit Produktion von Insulin like Growth Factor 2 (IGF-2). • Ursachen: mesenchymale Tumoren – 50% (Fibrosarkom, Rhabdomyosarkom, Leiomyosarkom, Mesotheliom), Hepatozelluläre Tumoren – 25% • 1/3 retroperitoneal, 1/3-a intraabdominal, andere intrathoracal. Diagnose und Behandlung • Diagnose – Hypoglykämie (glu<2.2 mmol/l) mit niedrigen Insulin und C-Peptid Werten. – IGF-2 kann erhöht sein, nur selten gemessen • Behandlung – Tumorentfernung – Experimentelle Behandlungen: GH, Glukagon, Glukokortikoid, Somatostatin Analoge. Die wichtigsten Vitamine • Wasserlösliche Vitamine – B-Vitamine (B1 (Thiamin), B2 (Riboflavin), Nikotinsäure, B6 (Pyridoxin), Folsäure, B12 (Cyanocobalamin) – Vitamin C (Ascorbinsäure) – Biotin • Fettlösliche Vitamine – Vitamin A – Vitamin D – Vitamin E – Vitamin K Die wichtigsten Vitaminmangelkrankheiten Beri-Beri (Mangel an Vitamin B1) Müdigkeit, Neurasthenie, Hypotonie, Muskelschwäche, Polyneuropathie, Beinödeme, Herzinsuffizienz, Krampfanfälle, Enzephalitis-syndrome (Wernicke-Enzephalopathie) Alkoholiker Reis Mangel an Vitamin B2 • Ursachen: gestörte Resorption, Alkoholismus, Schilddrüsenunterfunktion • Symptome: tiefrote, glatte, glänzende Lippen, Cheilosis, Stomatitis, Dermatitis, Glossodynie, seborrhoische Hautveränderungen, Photophobie, abnehmende Sehschärfe, verlangsamtes Wachstum, hypochrome mikrozytäre Anämie. Mangel an Nikotinsäure • Pellagra • 4D Syndrom: Dermatitis, Diarrhö, Demenz, Death (Tod). • Ursachen: Eiweißmangel, Leberzirrhose, Alkoholismus, gestörte Resorption, INH, Karzinoid • Symptome: schmetterlingsförmige Dermatitis im Gesicht, Glossitis, Stomatitis, Ösophagitis, Magen- und Duodenalulzera, Konjunktivitiden, Urethritiden, Polyneuropathie, Organpsychosen, Depressionen, Hyperkeratosen Mangel an Vitamin B6 • Ursachen: INH, Östrogene, Progesteron, Penicillamin, Hydralazin, verminderte Resorption • Symptome: Appetitlosigkeit, Übelkeit, Brechreiz, Cheilosis, Glossitis, Konjunktivitis, seborrhoische Dermatitis, Polyneuropathie, Krämpfe, Hyperästhesie, bei Kindern und Heranwachsenden epileptische Anfälle Mangel an B12: perniziöse Anämie (atrophische Gastritis, Ikterus, Anorexie), funikulare Myelose Mangel an Folsäure: makrozytäre Anämie, Glossitis, aphtöse Stomatitis Mangel an Vitamin C, Skorbut • Ursachen: verminderte Zufuhr, herabgesetzte Resorption • Symptome: Gewichtsabnahme, Schwellung des Gaumens, ödematöses Zahnfleisch mit Blutungen, Hyperkeratosen, Pili recurvati, schlechte Wundheilung, Petechien, Knochenschmerzen (Osteoporose, Periostalablösung), selten Parenchymoder Hirnblutungen, Epiphysenvergrößerungen, Herzrhytmusstörungen, Hypotonie. Mangel an Vitamin A • Ursachen: verminderte Zufuhr, verringerte Fettresorption, Mangel an Retinolbindendem Protein. • Symptome: Nachtblindheit, gestörtes Dämmerungsehen, Trockenheit von Konjunktiven und Hornhaut (Xerophtalmia), Hornhauterosionen mit Sekundärinfektionen, Perforation (Verlust des Auges), Follikuläre Hyperkeratose, Tracheitis, Bronchitis, Einschränkung des Riechvermögens, Amenorrhö, Nierensteine, Pyelonephritiden. Mangel an Vitamin D Rachitis und Osteomalazie 1. • Rachitis: bei Kinder, Osteomalazie: bei Erwachsenen. • Ursachen: mangelhafte Versorgung mit Vitamin D, Mangel an Licht, Stoffwechselkrankheiten, Selten: Mangel an 1α-Hydroxylase, Vitamin-D-Rezeptor Mutationen Mangel an Vitamin D Rachitis und Osteomalazie 2. • Symptome – Bei Kinder: Knochendeformitäten und Minderwuchs, bei Erwachsenen: Knochendeformitäten (Kyphose, Skoliose) + Knochenschmerzen, Muskelerschöpfung – Labordiagnostik: alkalische Phosphatase hoch, Se Ca niedrig, P hoch, 25-OHD3 niedrig – Rtg.-Aufnahmen: Rosenkranz (Schwellung im Bereich der Knorpel-Knochen-Grenze der Rippen), Knochenverbiegungen, Knochendeformitäten. Therapie von Rachitis/Osteomalazie • Vitamin D 10.000-50.000 E/Tag, • Dann 1000 E/Tag für längere Periode • Ca-Zufuhr • Weitere Formen von Vitamin D – Aktivierte Formen • 1α-Cholecalciferol, alfacalcidiol (Alpha-D3) • 1α, 25-Cholecalciferol, Rocaltrol Mangel an Vitamin E und Vitamin K • Vitamin E – Hyperkeratosen, retrolentale Fibroplasie, Sehstörungen, Ataxie • Vitamin K – Blutungsneigung Hypervitaminose A • Ursachen: iatrogen (sehr selten: nach Verzehr von arktischer Tiere (Eisbär) • Symptome: Kopfschmerzen, Müdigkeit, Anorexie, Brechreiz, Lethargie, Koma, erhöhter Hirndruck mit Stauungspapille, Doppelbilder, trockene, spröde Haut mit wachsgelber Tingierung, Haarausfall, Schleimhautblutungen, Amenhorrhö, Ulcus cruris, externe und interne Exostosen am Schädel, Hyperurikämie, Thrombosenegung, Hyperkalzämie Hypervitaminose D • Hyperkalzämie • Neuronale, ZNS, muskuläre, gastrointestinale, renale Symptome. • Manchmal lebensgefährlich. SPEICHERERKRANKUNGEN Allgemeine Merkmale • Geerbte Krankheiten. • Akkumulation von den Substanzen kann zytotoxisch sein. • Veschiedene Schwierigkeit: – Milde Phenotype z.B. Hämochromatose – Oft ZNS Manifestationen zu sehen z.B. Wilson-Krankheit, Mukopolysacharidosen. Primäre Hämochromatose • angeborene Eisenstoffwechselkrankheit • Eisenablagerungen in Leber, Pankreas (BronzeDiabetes), Herz, Gonaden, Hypophyse, Gelenken und andere Organe. • Meistens autosomal rezessiv. • Niedrige Penetranz • Häufigste Mutation des HFE Gens (MHC-I Klasse) C282Y, aber andere Gene können auch mutiert sein z.B. Ferroportin, Hepcidin, Hemojuvelin. Genetisch heterogene Krankheit. • Sehr häufig: Prävalenz von Homozygoten 1:300-1:400, Heterozygoten: 1:10-1:20. Sehr verschiedene Penetranz. Sekundäre Hämochromatose • Anämie durch uneffektive Erythropoese – Thalassaemia major – Sideroblastische Anämie • Chronische Lebererkrankungen – alkoholische Leberzirrhose – porto-cavaler Shung • erhöhte orale Eisenaufnahme – medizinische Überdosierung • andere erbliche oder kongenitale Störungen – Porphyria cutanea tarda – kongenitale Atransferrinämie • Parenterale Eisenüberladung – bluttransfusionsbedingte Eisenüberladung – erhöhte parenterale Eisenzufuhr – Hämodialyse Symptome von primären Hämochromatose • Beschwerden: unspezifische Oberbauchschmerzen, Müdigkeit, verminderte Leistungsfähigkeit, Gelenkbeschwerden. • Spätstadium: klassische Trias (Leberzirrhose, Diabetes mellitus, Hyperpigmentierung /Bronzdiabetes/), Verminderung von Libido und Potenz • Lebererkarnkung – langsam: Siderose, Fibrose, Zirrhose • verstörte Glukosestoffwechsel • Hauptpigmentierung • Gelenkveränderungen • Kardiomyopathie – Eisenablagerung im Herzmuskel • Endokrine Veränderungen: Störung der hypothalamisch-hypophysären Achse, der Nebennieren, Schilddrüse, Nebenschilddrüse Pathogenese der Leberkrankheit bei primären Hämochromatose erhöhte Eisenresorption in Proximalen Dünndarm Eisenübeladung der Hepatozyten Lipidperoxidation Membranschädigung Zelltod HCC Stimulation der Kollagenbiosynthese Fibrose Zirrhose Laboratoriumsdiagnose von Hämochromatose • Serumeisen – erhöht • Transferrinsättigung >60% (norm. 25-50) • Serumferritin > 300 μg/l (norm. 25-250) Therapie von Hämochromatose • Ziel: Entspeicherung der Eisendepots des Körpers • Aderlässe von 500 ml Blut entziehen 250 mg Eisen. 1-2 wöchentliche Aderlässe in 16-24 Monaten – Reduktion de Serumferritinspiegels unter 50 μg/l, Normalisierung der Transferrinsättigung, Abfall des Hämoglobins auf 12 g/dl. • Chelatbildner Desferoxamin 25-50 mg/kg im Fall von Anämie M. Wilson • Erbliche Krankheit des Kupferstoffwechsels. • Kupferspeicherung in Leber, ZNS, andre organe. • Chronische Hepatitis, Zirrhose mit neurologischen und psychiatrischen Symptomen. • Freies Kupfer: Hämolyse, fulminante Hepatitis • Diagnose: erniedrigte Serumkupferspiegel, erniedrigte Coeruloplasmin, erhöhte Kupferausscheidung durch den Urin • Therapie: Kupferchelatbildner: D-Penicillamin M. Wilson Genetik und Pathophysiologie • Selten, autosomal rezessiv vererbt. • Prävalenz: 1:30.000 (Heterozygoten: 1:200 – 1:300) • Mutationen des ATP7B Gens. • Kupferüberladung: hepatobiliäre Sekretion des Kupfers gestört ist. • Erniedrigte Coeruloplasminspiegel, Erhöhung an Albumin gebundenen Kupfers. • Kupferüberladung der Organe Befunde bei M. Wilson 1. • Leberschädigung: chronisch-aktive Hepatitis, Leberzirrhose, fulminante Hepatitis • Hämolytische Anämie: bei 15% erstes Zeichen • Neurologische Erkrankung: muskuläre Hypertonie, Rigidität, Dysarthrie, Dysphagie, Hypersalivation, Spastik, Beugekontrakturen, Verlust der Analsphinkterfunktion • Psychiatrische Manifestation: Agressivität, Psychoneurosen, manisch-depressive oder schizophrene Osychose, organische Demenz. Befunde bei M. Wilson 2. • Augenbeteiligung: Kayser-FleischerKornealring, gold brauner Ring am Rand der Kornea, Kupferablagerung in der DescemetMembran • Nierenbeteiligung: Kupferablagerung in den proximalen Tubuli – Aminoazidurie, Glukosurie, Urikosurie, Hyperphosphaturie, Hyperkalzurie, Nierensteinbildung, Spätmanifestation. • Skelettmanifestationen: Demineralisation des Knochens, Osteomalazie, Spontanfrakturen, subartikuläre Zysten, Osteochondritis dissecans, Chondromalazia • Herzbeteiligung: Kardiomyopathie, Rhythmusstörungen. Laboratoriumsbefunde bei m. Wilson • Serumkupferspiegel < 12.6 μmol/l (norm. 12.6-18.9 μmol/l) • Serumcoeruloplasminkonzentration <1.25 μmol/l (norm. 1.25-2.5 μmol/l) • Kupferausscheidung im 24-Sunden-Urin > 100 μg • Kupfergehalt der Leber > 250 μg/g Therapie von m. Wilson • D-Penicillamin: 1.5 g/Tag, später 1 g/Tag (neurologische, psychiatrische Symptomatik und Leberschädigung bilden sih zurück, Leberzirrhose nicht mehr), mit Vitamin B6 • Zinkazetat – verhindert intestinale Kupferresorption • Kupferarme Diät • Lebertransplantation Lysosomale Specichelerkrankungen • Mucopolysaccharidosen z.B. Hurler Krankheit • Gangliosidose z.B. Tay-Sachs Krankheit • Neutrale Sphingolipidosen z.B. Fabry Krankheit, Gaucher Krankheit, NiemannPick • Glykoproteinosen z.B. Fucosidose, Mannosidose • Mucolipidosen • Leukocystrophien Tay-Sachs Krankheit • Hexosamanidase A Defizienz • Häufig in Ashkenazi Juden • Neurodegenerative Krankheit, Makrokephalie, motorische Dysfunktionen, Dementia. Infantilform fatal. • Cherry Red Spot. Gaucher-Krankheit • Autosomal rezessiv Krankheit. • β-Glukosidase Defizienz. • Typ 1. – keine neurologische Manifestationen, Hepatosplenomegalie, Gaucher-Zellen, Knochenmarkinfiltration • Typ 2. und Typ 3. sehr selten, ZNS Manifestationen.