Pflichtfragen Chemie I
Werbung

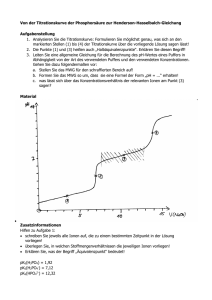
Chemie Pflichtfragen Pflichtfragen Chemie I 1. Definieren Sie die Begriffe chemische und physikalische Eigenschaften! Chemische Eigenschaften Eine chemische Eigenschaft einer Substanz in ein Merkmal, das wir nur beobachten oder messen können, wenn die Substanz verändert (umgewandelt) wird. Physikalische Eigenschaften Eine physikalische Eigenschaft einer Substanz ist ein Merkmal, das an dieser Substanz beobachten oder messen könne OHNE die Substanz zu verändern. 2. Definieren Sie die Begriffe Substanz, Element, Mischung und Verbindung! Substanz Eine Substanz ist eine einheitliche Art von Materie. Element Ein Element ist ein Reinstoff, der mit chemischen Methoden nicht in einfachere Komponenten zerlegt werden kann. Mischung Eine Mischung besteht aus mehr als einer Substanz; diese Komponente können unter Ausnützung ihrer verschiedenen physikalischen Eigenschaften getrennt werden. Verbindung Eine Verbindung ist eine ganz spezifische Kombination von Elementen, die mit chemischen Mitteln zerlegt werden kann, aber nicht mit physikalischen. 3. Definieren Sie die Begriffe Intensiv und Extensive Größen! Größen, die von der Qualität der Stoffportion abhängen und zu ihr proportional sind, bezeichnet man als extensive Größen. Im Gegensatz dazu sind intensive Größen von der Quantität der Stoffportion unabhängig und nur abhängig von der Art des Stoffes. 4. Definieren Sie die Begriffe Atom und Element! Atom Ein Atom ist das kleinste Teilchen, das die chemischen Eigenschaften dieses Element hat. Element Ein Element ist eine Substanz, die aus Atomen aufgebaut ist, die alle dieselben chemischen Eigenschaften haben. 5. Definieren Sie die Begriffe Metalle und Nichtmetalle! Metalle Ein Metall ist eine Substanz, die den Strom Leitet, einen metallischen Glanz hat und duktil ist. Nichtmetalle Ein Nichtmetall leitet den Strom nicht und ist weder hämmerbar noch duktil. Seite 1 von 13 Chemie Pflichtfragen 6. Definieren Sie die Begriffe Nukleonen und Isotope! Nukleonen Atomkerne bestehen aus zwei Teilchensorten, die Nukleonen genannt werden. Ein Nukleon ist das Proton, das andere das Neutron. Isotope Isotope sind Atome mit derselben Ordnungszahl, aber einer unterschiedlichen Atommasse. 7. Definieren Sie die Begriffe Atomare Masseneinheit, Mol und molare Masse! Atomare Masseneinheit Eine atomare Masseneinheit (u) ist 1/ 12 der Masse eines Kohlenstoff‐12 Atoms. Die Masse eines 12C‐Atoms ist genau 12 u. Mol Das Mol ist die Einheit für die Substanzmenge. Ein Mol Teilchen enthält die gleiche Zahl von Teilchen, wie Kohlenstoffatome in genau 12 g des Kohlenstoff C‐12 Isotops enthalten ist. 1 mol =6,022 . 1023 Teilchen n.M=m [mol].[g/mol] = [g] Molare Masse Die molare Masse ist die Masse pro Mol von Atomen eines Elementes. 8. Definieren Sie die Begriffe chemische Verbindung und Bindung! Eine chemische Verbindung ist eine Substanz, die aus zwei oder mehr Atomen besteht, die in einem Fixen Verhältnis zueinander stehen. Als chemische Bindungen sind die metallischen Bindung, die Ionenbindung, die polare Atombindung und die Atombindung möglich. Die Grenzen zwischen diesen drei Bindungsarten sind schwer zu ziehen. Als Hilfe für die Zuordnung bedient man sich der Elektronegativität (ein Maß für die Anziehung gemeinsamer bindender Elektronen). Je größer die Differenz der Elektronegativität zweier Elemente ist, desto polarer* ist die Bindung. (* polar: die Ladungen sind ungleich verteilt) Unpolar ist die reine Atombindung (zwischen zwei Atomen mit gleicher EN), extrem polar ist die Ionenbindung. 9. Benennen Sie drei Ionen (aus Tabelle Skriptum WS 2008/09, Seite 31, es werden 3 Ionenformeln angegeben)! Positive Ionen (Kationen) Ammonium (NH+ 4 ) Kalium (K+) Kupfer(I) (Cu+) Natrium (Na+) Silber (Ag+) Wasserstoff (H+) Barium (Ba2+) Blei(II) (Pb2+) Calcium (Ca2+) Chrom(II) (Cr2+) Cobalt(II) (Co2+) Eisen(II) (Fe2+) Kupfer(II) (Cu2+) Magnesium(II) (Mg2+) Mangan(II) (Mg2+) Quecksilber(II) (Hg2+) Negative Ionen (Anionen) Acetat (C 2 H 3 O 2 ‐) Bromid (Br‐) Chlorid (Cl‐) Chlorat (ClO 3 ‐) Cyanid (CN‐) Fluorid (F‐) Hydrid (H‐) Hydrogencarbonat (HCO 3 ‐) oder Bicarbonat Hydrogensulfat (HSO 4 ‐) Hydroxid (OH‐) Iodid (I‐) Nitrat (NO 3 ‐) Perchlorat (CLO 4 ‐) Permanganat (MnO 4 ‐) Carbonat (CO 3 2‐) Chromat (CrO 4 2‐) Seite 2 von 13 Chemie Pflichtfragen Zink (Zn2+) Oxid (O2‐) 2+ Zinn(II) (Sn ) Peroxid (O 2 2‐) Sulfat (SO 4 2‐) Aluminium (Al3+) Sulfid (S2‐) 3+ Eisen(III) (Fe ) Sulfit (SO 3 2‐) 3 Chrom(III) (Cr ) Phosphat (PO 4 3‐) 10. Benennung von drei Arten chemischer Reaktionen (aus Tabelle Skriptum WS 2008/09, Seite 35, es werden 3 Arten mit je einem Beispiel zu benennen sein)! Klassifikation chemischer Reaktionen Typ der Reaktion Besondere Merkmale Klassifikationsschema I: basiert auf der Zusammensetzung der Ausgangssubstanzen und Produkte Synthese Bildung einer Verbindung aus einfacheren Ausgangsmaterialien: 2 H 2 + O 2 2 H 2 O Zersetzung Bildung einfacher Substanzen aus einem Ausgangsmaterial: CaCO 3 CaO + CO 2 Doppelter Austausch Der Austausch der Partner: (Metathese) 2NaCl (aq) + Pb(NO 3 ) 2 (aq) 2 NaNO 3 (aq) + PbCl 2 (s) Verbrennung Reaktion mit Sauerstoff unter Bildung von Co 2 , H 2 O, N 2 und Oxiden anderer Elemente, die zugeben sind: CH 4 (g) + 2 O 2 (g) 2 H 2 O (g) + CO 2 (g) Korrosion Reaktion eines Metalls mit Sauerstoff unter Bildung des Metalloxides: 4 Fe (s) + 3 O 2 (g) 2 Fe 2 O 3 (s) Klassifikationsschema II: basiert auf der treibenden Kraft der Reaktion Gasbildung Bildung eines Gases: CaCO 3 (s) + 2 HCl (aq) CaCl 2 (aq) + H 2 O (l) + CO 2 (g) Treibende Kraft: Freisetzung eines Gases Fällung Bildung eines Niederschlages, wenn zwei Lösungen gemischt werden: 3 CaCl 2 (aq) + 2 Na 3 PO 4 (aq) Ca 3 (PO 4 ) 2 (s) + 6 NaCl (aq) Treibende Kraft: Bildung eines unlöslichen Niederschlages Neutralisation Reaktion zwischen einer Säure und Base HCl (aq) + NaOH (aq) NaCl (aq) + H 2 O (l) Treibende Kraft: Bildung des Lösungsmittels (Wasser) Redox Übertragung von Elektronen von einer Spezies auf eine andere: 2 Mg (s) + O 2 (g) 2 MgO (s) Treibende Kraft: Übertragung der Elektronen führt zu größerer Stabilität 11. Beschreiben Sie die drei gängigen Säure Base Theorien! Arrhenius Arrhenius Säuren und Basen werden an ihrer Fähigkeit erkannt, die Färbung gewisser Farbstoffe zu verändern. Säure Abgabe von H+ ‐ Ionen in wässriger Lösung. Base Bildung von OH‐ ‐ Ionen in wässriger Lösung. Brönsted Säure = Protonendonator Base = Protonenakzeptator Seite 3 von 13 Chemie Pflichtfragen Nach Lewis 12. 13. 14. 15. 16. 17. Säure = e‐ Paarakzeptator Base = e‐ Paardonator Definieren Sie die Begriffe starke – schwache Säuren! Starke Säure Eine starke Säure ist eine Säure, die bei normalen Konzentrationen in wässriger Lösung vollständig ionisiert. Schwache Säure Eine schwache Säure ist bei normaler Konzentration in wässriger Lösung nur partiell ionisiert. Definieren Sie die Begriffe Oxidation und Reduktion! Oxidation Oxidation ist die Abgabe von Elektronen. Reduktion Reduktion ist die Aufnahme von Elektronen. Zählen Sie die Regeln für die Zuordnung von Oxidationszahlen auf! • Die Summe der Oxidationszahlen aller Atome in einer Verbindung entspricht seiner Nettoladung; • Atome in elementarer Form haben die Oxidationszahl 0; • Elemente der Gruppe I haben die Oxidationszahl +1; Elemente der Gruppe II haben die Oxidationszahl +2; Elemente der Gruppe III (außer Bor) haben +3 für M3+ oder +1 für M1+; Elemente der Gruppe IV (außer C, Si) haben +4 für M4+ oder +2 für M2+; • Für Wasserstoff in nichtmetallischen Verbindungen +1 Für Wasserstoff in metallischen Verbindungen ‐1 • Fluor hat in alle Verbindungen ‐1; • Für Sauerstoff (außer in Fluorverbindungen) ‐2; in Peroxiden (O 2 2‐) ‐1; in Superoxiden (O 2 ‐) ‐1/2; in Ozoniden (O 3 ‐) ‐1/3. Definieren Sie den Begriff stöchiometrische Beziehung anhand eines Beispiels! Unter Stöchiometrischer Beziehung versteht man das Molverhältnis der einzelnen Elemente in einer Verbindung. 4H (g) + O 2 (g) 2H 2 O (g) Definieren Sie den Begriff limitierendes Reagenz! Eine limitierendes Reagenz ist ein Reaktand, der die theoretische Ausbeute eines Reaktionsproduktes bestimmt. Definieren Sie den Begriff molare Konzentration! Die molare Konzentration stellt die Verbindung zwischen dem Volumen und der in diesem Volumen vorhandenen Stoffmenge her: Die molare Konzentration eines gelösten Stoffes in Seite 4 von 13 18. 19. 20. 21. 22. Chemie Pflichtfragen einer Lösung ist die Stoffmenge pro Liter Lösung. Diese wird auch als Molarität bezeichnet. Die Einheit der molaren Konzentration ist Mol pro Liter (mol/l). Definieren Sie den Begriff Titration! Die analytische Bestimmung der Zusammensetzung durch Messung des Volumens einer Lösung, das benötigt wird, um mit einem vorgegebenen Volumen einer anderen Lösung zu reagieren, nennt an Titration. Definieren Sie den Begriff Ideale Gase (Erklärung der Formel inkl. Einheiten)! Ideale Gase sind hypothetische Gase deren Druck, Volumen und Temperatur vollständig durch die ideale Gasgleichung beschrieben werden können. p.V = n.R.T [n]…Stoffmenge in Mol [R]…Gaskonstante (J.mol‐1K‐1) [p]…Druck in Pascal [V]…Volumen in Liter [T]…Temperatur in Kelvin p.V = n.R.T kommt von V ~ 1/p (n, T = konstant) V ~ T (n, p = konstant) V ~ n (p, T = konstant) Kombination der drei Beziehungen: V ~ (n.T)/p mit R als Proportionalitätskonstante: V = R(n.T)/p p.V = n.R.T Definieren Sie die Begriffe Energie, Wärme, Enthalpie, endothermer‐exothermer Prozess! Energie Die Energie eines Systems ist ein Maß für die Fähigkeit dieses Systems, Arbeit zu leisten oder Wärme zu produzieren. Enthalpie Die Änderung der Enthalpie eines Systems ist gleich der freigesetzten oder aufgenommenen Wärmemenge bei konstantem Druck. Endothermer Prozess Ein endothermer Prozess ist eine Änderung, bei der ΔH positiv ist. Exothermer Prozess Ein exothermer Prozess ist eine Änderung, bei der ΔH negativ ist. Definieren Sie die Begriffe Standardreaktionsenthalpie – Standardbildungsenthalpie! Standardreaktionsenthalpie Eine Standardreaktionsenthalpie ist die Reaktionsenthalpie bei der Umsetzung der Reaktanden in ihrem Standardzustand in Produkte in deren Standardzustand. Standardbildungsenthalpie Die Standardbildungsenthalpie einer Verbindung ist die Standardreaktionsenthalpie pro Mol der Verbindung für die Synthese aus den Elementen in ihrer stabilsten Form bei 1 bar und der angegebenen Temperatur. Beschreiben Sie den Begriff Wellenfunktion eines Elektrons anhand der Geometrie der Orbitale (Beschreibung)! Die Wellenfunktion ist der mathematische Ausdruck, der angibt, wo sich die Elektronen befinden. Die Wahrscheinlichkeit ein Elektron an einer bestimmten Stelle zu finden ist Seite 5 von 13 Chemie Pflichtfragen proportional dem Quadrat der Wellenfunktion Ψ an dieser Stelle. Eine bestimmte Wellenfunktion gibt eine bestimmte Geometrie an. Die Wellenfunktion eines Elektrons in einem Atom wird Atomorbital genannt. s‐Orbitale: sharp l = 0 radialsymmetrisch p‐Orbitale: principal l = 1 hantelförmig in den drei Raumachsen d‐Orbitale: diffuse l = 2 gekreuzte Doppelhanteln f‐Orbitale: fundamental l = 3 rosettenförmig 23. Definieren Sie den Begriff Quantenzahl und beschreiben Sie das Aufbauprinzip von Vielelektronenatomen! Eine Quantenzahl ist eine Zahl, die den Zustand eines Elektrons beschreibt und den Wert einer Eigenschaft festgelegt. Laut Schrödinger gibt es drei verschiedene Quantenzahlen: Hauptquantenzahl n Gibt die Energie eines Elektrons im Atom an ( wie das Bohr’sche Atommodel). Diese Zahl kann 1, 2, … bis unendlich annehmen. Nebenquantenzahl l Teilt die Orbitale einer bestimmten Schale in verschiedene Sets auf, welche als Unterschale genannt werden. Alle Orbitale einer bestimmten Schale, die denselben Wert haben, gehören zur gleichen Unterschale. Für eine Schale mit der Hauptquantenzahl n kann die Nebenquantenzahl die Werte 0, 1, 2, … bis n‐1 annehmen, so dass n Werte auftreten. Magnetische Quantenzahl m l Bezeichnet man die individuellen Orbitale in einer Unterschale. Eine Unterschale mit der Nebenquantenzahl l besteht aus 2.l + 1 einzelnen Orbitalen, jedes Orbital entspricht einem der zugelassenen Werte von m l und zwar l, l‐1, l‐2, … bis –l. Spin‐magnetische Quantenzahl m s Wurde nicht von Schrödinger vorhergesagt. Ein Elektron kann sich in zwei Richtungen drehen (Spin), im Uhrzeigersinn und gegen dem Uhrzeigersinn. Pauli Verbot: maximal zwei Elektronen können jedes einzelne Orbital besetzen. Wenn zwei Elektronen ein Orbital besetzen, dann muss sich deren Spin unterscheiden. Ein Vielelektronenatom ist ein Atom das aus mehr als einem Elektron besteht. Ein Atom eines Elementes der Ordnungszahl Z hat Z Elektronen. 24. Definieren Sie die Begriffe: Atomradius, Ionenradius, Ionisierungsenergie, Elektronenaffinität, Elektronennegativität und beschreiben Sie die Periodizität der physikalischen Eigenschaften! Atomradius Da die Elektronenwolke der Atome und Ionen keinen klaren Abgrenzungen ermöglichen, müssen wir definieren, was wir unter diesen Radien verstehen. Der Atomradius eines Elementes ist die halbe Distanz zwischen den Mittelpunkten benachbarter Atome. Wenn das Element ein Metall ist, dann ist die entsprechende Distanz jene zwischen den Kernen von benachbarten Atomen in der festen Probe. Seite 6 von 13 Chemie Pflichtfragen Der Atomradius nimmt im Periodensystem von links nach rechts ab und von oben nach unten zu. Ionenradius Der Ionenradius eines Elementes ist der Beitrag zur Distanz zwischen benachbarten Ionen in einer festen ionischen Verbindung. Die Distanz zwischen den Kernen eines Kations und seines benachbarten Anions ist die Summe zweier Ionenradien. Der Ionenradius nimmt im Periodensystem von links nach rechts ab und von oben nach unten zu. Ionisierungsenergie Die Ionisationsenergie eines Elementes ist die minimale Energie, die nötig ist, um ein Elektron vom Grundzustand eines gasförmigen Atoms zu entfernen. Die Ionisationsenergie variiert periodisch mit der Ordnungszahl und nimmt von links nach rechts in einer Periode ab zu und nimmt bei Beginn der nächsten Perioden wieder ab. Elektronenaffinität Die Elektronenaffinität ist die freigesetzte Energie, wenn ein Elektron an ein Atom oder Ion eines Elementes in der Gasphase addiert wird. Die Elektronenaffinität nimmt in Richtung oben rechts zu ( F ist am meisten exotherm). Elektronennegativität Die Elektronegativität χ eines Elementes ist ein Maß für die Fähigkeit eines Atoms in einer Verbindung Elektronen an zu ziehen. Umso höher die Elektronegativität umso stärker ist die Tendenz Elektronen anzuziehen. Die Elektronegativität ist im Periodensystem oben rechts am größten und unten links am niedrigsten. 25. Welche Trends in den chemischen Eigenschaften sind in den s‐, p‐ und d‐ Blöcke zu beobachten? s‐Block Wenn ein Element zum s‐Block gehört, hat es eine niedrige Ionisationsenergie und daher können seine Valenzelektronen leicht abgegeben werden. Das Element wird wahrscheinlich E+ und E2+ bilden. Reaktive Metalle, besitzen alle erwartenden Eigenschaften von Metallen. Die Ionisationsenergien dieses Blockes sind am unteren Ende am niedrigsten, da diese Elementen dort am leichtesten ihre Valenzelektronen abgeben. Alle Metalle der Gruppe I und Gruppe II (außer Beryllium) reduzieren Wasser zu Wasserstoff. Diese Elemente des S‐ Blockes kommen in der Natur nicht frei vor, ebenso haben alle Metalle einen silbergrauen Glanz. Alle s‐Blockelemente haben basische Oxide, die mit Wasser unter Bildung von Hydroxiden reagieren. p‐Block Einige Elemente auf der linken Seite des p‐Blockes haben so wenig Ionisationsenergie, dass sie noch einige metallische Eigenschaften des s‐Blockes. Die Metalle des p‐Blockes sind weniger reaktiver und die Ionisationsenergie ist höher als der s‐Blockmetalle. Leiten Strom nur schlecht (schlechter als S‐Block und d‐Block). Auf der rechten Seite ist eine hohe Elektronegativität und Elektroaffinität, daher streben diese Elemente die Edelgaskonfiguration an. Elemente im rechten oberen Teil des Blocks sind Nichtmetalle und kommen häufig in ionogene Verbindungen als Anionen vor. d‐Block Alle d‐Block Elemente sind Metalle. Elemente die auf der linken Seite dieses Blockes bei Scandium liegen, haben niedrigere Ionisationsenergien und sind daher ähnlich reaktiv wie die Seite 7 von 13 Chemie Pflichtfragen s‐Block Metalle. Die rechte Seite ist dem p‐Block ähnlich hohe Ionisationsenergie und niedrig reaktiv. Die d‐Block Metalle sind die Übergansmetalle von s‐Block zu p‐Block. Bilden mehrere Kationen aus, mit unterschiedlichen Oxidationszahlen. 26. Definieren Sie die Begriffe ionische Bindung und Gitterenthalpie! Ionische Bindung Eine ionische Bindung ist eine Anziehung zwischen der entgegengesetzten Ladung der Kationen und Anionen. Gitterenthalpie Die Energie, die freigesetzt wird, wenn ein Festkörper sich aus einem Ionengas bildet, ist der negative Betrag der Gitterenthalpie. 27. Definieren Sie die Begriffe kovalente Bindungen und Oktettregel! Kovalente Bindung Eine kovalente Bindung besteht aus einem Elektronenpaar, das zwischen zwei Atomen geteilt wird. Oktettregel So weit es geht, versuchen die Atome ihr Oktett zu vervollständigen, indem sie Elektronenpaare miteinander teilen. 28. Definieren Sie den Begriff Radikal! Ein Radikal ist ein Atom, Molekül oder Ion mit wenigstens einem ungepaarten Elektron. 29. Welche Faktoren beeinflussen die Geometrie von Molekülen (Aufzählung)! • Anordnung der Atome • Die Bindungswinkeln • Lage und Anzahl der bindenden e‐ ‐ Paare • Bildungslänge und Art der Bindung (z.B.: Doppelbindung) • Art der Atome • Anzahl der Bindungen und Bindungspartner 30. Definieren Sie die Begriffe Polarisierung, Dipole, Dipolmoment, polare und unpolare Moleküle! Ein elektrischer Dipol ist eine positive Ladung neben einer gleich großen aber entgegengesetzten negativen Ladung. Die Größe eines Dipols wird als elektrisches Dipolmoment in der Einheit Debye (D) angegeben. Da Debye ist so definiert, dass eine einfache negative Ladung (ein Elektron) mit genau 100pm von einer einzelnen positiven Ladung (einem Proton) zu einem Dipolmoment von 4,80 D führt. Ein polares Molekül ist ein Molekül mit einem elektrischen Dipolmoment von ungleich Null. Umgekehrt hat ein unpolares Molekül ein elektrisches Dipolmoment von Null. Seite 8 von 13 Chemie Pflichtfragen 31. Beschreiben Sie σ‐ und π‐ Bindungen! Eine σ‐ Bindung besteht aus zwei Elektronen in einem Orbital und hat eine Zylindersymmetrie um die Verbindungsachse der beiden Kerne. Eine π‐Bindung besteht aus zwei Elektronen, die ein Orbital so besetzen, dass es zwei Lappen ausbildet, je einen auf den beiden Seiten der Verbindungsachse der beiden Kerne. 32. Beschreiben Sie alle Arten von Wechselwirkungen zwischen Ionen und Molekülen! Ion‐Ion Die Ion‐Ion Wechselwirkung führt zu einer hohen Gitterenthalpie, sowie hoher Schmelz‐ und Siedepunkten. Die gilt besonders, wenn die Feststoffe aus kleinen hochgeladenen Ionen bestehen da elektrostatische Kräfte solcher Ionen stärker aneinander binden. Ion‐Dipol Die Ion‐Dipol Wechselwirkung ist die Anziehung zwischen einem Kation und der partiell negativen Ladung eines polaren Moleküls oder zwischen einem Anion und der partiell positiven Ladung. Die Ion‐Dipol Wechselwirkung nimmt mit zunehmenden Abstand stärker ab, als eine Ion‐Ion Wechselwirkung. Die Ion‐Dipol Wechselwirkung ist für die Hydratation von Kationen in der Lösung sehr wichtig, weil die partiell negative Ladung am O‐Atom des H 2 O von der positiven Ladung des Kations angezogen wird. Dipol‐Dipol Eine Dipol‐Dipol Wechselwirkung ist die Anziehung zwischen den elektrischen Dipolen polarer Moleküle. Sind schwächer als die Ion‐Ion Wechselwirkung. London Kräfte Die Londonkräfte bewirken eine Anziehung zwischen den Teilchen, auch wenn dieser unpolar sind, wie etwa Atome oder unpolare Moleküle. Sie werden hervorgerufen durch die Veränderung der Elektronenverteilung in der Spezies selbst. Durch kontinuierliche bewegende Elektronen können spontane Dipole entstehen. Die Stärke der Londonkräfte nimmt zunehmend der größer von den Molekülen zu. Wasserstoffbrückenbindung N, O, F; die Verbindung bildet ein gemeinsames H Atom. 33. Definieren Sie den Begriff Wasserstoffbrückenbindung! Eine Wasserstoffbrückenbindung ist eine Bindung, die durch ein Wasserstoffatom zwischen zwei stark elektronegativen Atomen bewirkt wird. Ist für die Festigkeit von Holz verantwortlich. 34. Definieren Sie den Begriff dynamisches Gleichgewicht! Das dynamische Gleichgewicht ist ein Zustand, bei dem ein Prozess in die eine Richtung und der gegenläufige Prozess simultan mit gleichen Geschwindigkeiten ablaufen. AgCl Ag+ + Cl‐ 35. Definieren Sie den Begriff Dampfdruck einer Flüssigkeit! Der Dampfdruck einer Flüssigkeit (oder eines Feststoffes) ist jener Druck, der von seinem Dampf ausgeübt wird, wenn sich Dampf und Flüssigkeit (oder Feststoff) im dynamischen Gleichgewicht befinden. In Flüssigkeiten haben einzelne Teilchen unterschiedliche Energien. Gelangt ein energiereiches Teilchen an die Oberfläche einer Flüssigkeit, kann es in die Gasphase Seite 9 von 13 Chemie Pflichtfragen übergehen. Dies geschieht umso häufiger, je höher die Temperatur und damit die durchschnittliche Energie der Teilchen ist. Im Gleichgewichtszustand ergibt sich aus den so gebildeten gasförmigen Teilchen ein ganz bestimmter Partialdruck im Gasraum über der Flüssigkeit, dieser entspricht dem Dampfdruck der Flüssigkeit. 36. Zählen Sie alle Klassen von Feststoffen auf! nach Eigenschaften: • Metalle • Ionische Feststoffe • Vernetzte Feststoffe • Molekulare Feststoffe nach Aufbau: • amorphe Feststoffe • kristalline Feststoffe 37. Definieren Sie den Begriff Legierung! Eine Legierung ist eine homogene Mischung von zwei oder mehr Metallen. Ihre Strukturen sind komplizierter als jene der reinen Metalle, weil verschiedene Metallatome unterschiedliche Radien haben. Einige Legierungen sind fester als ihre Reinmetalle aus denen sie bestehen. 38. Beschreiben Sie den Begriff metallische Leitfähigkeit! Elektronische Leitfähigkeit in Metallen kann durch die Molekülorbitale erklärt werden, die sich auf den gesamten Festkörper erstrecken. Überlappen zwei Atomorbitale bilden sich dabei zwei Molekülorbitale (n Atomorbitale = n Molekülorbitale). Seite 10 von 13 Chemie Pflichtfragen 39. Definieren Sie den Begriff Löslichkeit und geben Sie die Definition von Henrys Gesetz und Raoults Gesetz an! Löslichkeit Löslichkeit einer Substanz entspricht ihrer Konzentration in der gesättigten Lösung. Sie ist abhängig vom Lösungsmittel, der Temperatur und ‐ bei Gasen‐ vom Druck. Henry‘sches Gesetz Die Löslichkeit eines Gases in einer Flüssigkeit ist proportional dem Partialdruck über der Flüssigkeit. Raoults Gesetz Der Dampfdruck einer idealen Lösung ist die Summe der einzelnen Partialdrücke der Komponenten. P ges = P A + P B P a = X A .P A * und P b = P B .X B * 40. Definieren Sie die Begriffe Reaktionsgeschwindigkeit – Aktivierungsenergie – Katalysator! Reaktionsgeschwindigkeit Änderung der Konzentration einer Lösung einer Substanz durch die Zeit, die für die Konzentrationsänderung benötigt wird. Die Geschwindigkeit einer Reaktion wird durch die Geschwindigkeit des langsamsten Reaktionsschrittes festgelegt. Aktivierungsenergie Aktivierungsenergie ist die minimale Energie, die für die Reaktion nötig ist. Sie resultiert aus der Kollisionstheorie: Zusammenstoß ist nur dann erfolgreich, wenn die Atome mit einer bestimmten Energie und in einem bestimmten Winkel aufeinander treffen diese kritische Energie wird auch Aktivierungsenergie genannt. Katalysator Ein Katalysator ist eine Substanz, die die Reaktionsgeschwindigkeit erhöht, ohne selbst bei der Reaktion verbraucht zu werden. 41. Definieren Sie die Begriffe Gleichgewichtskonstante – Massenwirkungsgesetz! Gleichgewichtskonstante Die Gleichgewichtskonstante K C hat einen speziellen Wert für eine gegebene Reaktion bei bestimmter Temperatur. K C bleibt auch bei unterschiedlichen Mischungen konstant, die Konzentration ändert sich natürlich. K C ist die molare Konzentration der Reaktanden und Produkte einer Reaktionsmischung. Massenwirkungsgesetz Für ein Gleichgewicht der Form, aA + bB = cC + dD wird der Reaktionsquotient ܳ ൌ ሾ ܥሿ ሾܦሿௗ ሾܣሿ ሾܤሿ aus den molaren Konzentrationen der Reaktanden und Produkte im Gleichgewicht ermittelt, und er entspricht einer Konstanten K c , die einen speziellen Wert für eine gegebene Reaktion bei bestimmter Temperatur hat. Seite 11 von 13 Chemie Pflichtfragen 42. Welche Größen beeinflussen die Zusammensetzung eines chemischen Gleichgewichts? • Druck • Temperatur • Konzentration 43. Definieren Sie die Begriffe konjugierte Säuren – Basen Paare und nennen Sie zwei typische Beispiele! Jede Brönsted Base hat eine konjugierte Säure und jede Brönsted Säure hat eine konjugierte Base. (Konjugierte Base einer Brönsted Säure ist jene Base, die sich bildet, wenn die Säure ein Proton abgegeben hat. Die konjugierte Säure einer Base ist jene Säure, die sich bildet, wenn die Base ein Proton aufgenommen hat). Die Säure und ihre konjugierte Base werden konjugierte Säure‐Basen Paar. • H 2 SO 2 HSO 4 ‐ • HCl Cl‐ • H 3 PO 4 H 2 PO 4 ‐ 44. Definieren Sie die Begriffe Ionisationskonstanten und Säure‐ bzw. Basenstärke! Ionisationskonstante Können gemessen oder berechnet werden. • Ionisationskonstante der Säuren K s Je stärker die Säure, umso höher K s bzw. umso kleiner pK s , desto größer ist K s pK s = ‐log K s • Ionisationskonstante der Basen K B Ebenfalls pK B = ‐ logK B Je größer K B umso kleiner ist pK B starke Base 45. Beschreiben Sie den Begriff Eigenionisation von Wasser! Nach Brönsted kann Wasser H+ aufnehmen oder abgeben, daher kann das Wasser als Säure oder Base reagieren. H 2 O kann auch ohne vorhandene Säure oder base ionisieren. Bei der Abgabe von einem H+ (Proton) an ein zweites H 2 O Molekül ionisiert die Substanz selbst und wird als Eigenionisation genannt. 46. Beschreiben Sie den Begriff chemischer Puffer und beschreiben Sie dessen Wirkung! Eine Pufferlösung (Puffer) wirkt der Änderung des pH‐Wertes entgegen, weil er sowohl eine Säure zur Bildung von OH‐ Ionen als auch eine Base zur Bildung von H+ Ionen enthält. Sie besteht aus einem schwachen konjugierten Säure‐Base‐Paar und werden oft durch Mischungen einer schwachen Säure oder Base mit einem Salz der entsprechenden Säure oder Base hergestellt. Seite 12 von 13 Chemie Pflichtfragen 47. Beschreiben Sie den Begriff Löslichkeitsprodukt und geben Sie Größen an, die das Gleichgewicht beeinflussen können! Löslichkeitsprodukt K L Das heterogene Gleichgewicht zwischen der gesättigten Lösung eines Salzes und seinem festen Bodenkörper wird durch das Lösungsprodukt beschrieben. K L = [A].[.B] Das dynamische Gleichgewicht ist dadurch gekennzeichnet, dass im Zeitmittel ebenso vielen Ionen in Lösung gehen wie an der Kristalloberfläche auskristallisiert. Die Konzentration der gesättigten Lösung bleibt also konstant. Das Löslichkeitsprodukt ist wie alle Gleichgewichtskonstanten temperaturabhängig. Ist das Produkt der Konzentrationen in der Lösung geringer als das Löslichkeitsprodukt, so liegt keine gesättigte Lösung vor. Ist die Lösung übersättig, so ist das Produkt thermodynamisch instabil und nur zeitlich begrenzt haltbar. Seite 13 von 13