Handout.Ligation von Amiden
Werbung
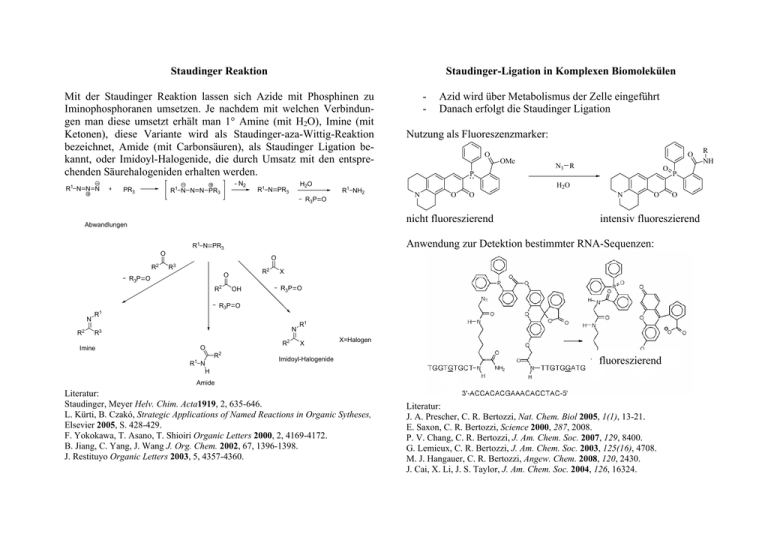
Staudinger Reaktion Staudinger-Ligation in Komplexen Biomolekülen Mit der Staudinger Reaktion lassen sich Azide mit Phosphinen zu Iminophosphoranen umsetzen. Je nachdem mit welchen Verbindungen man diese umsetzt erhält man 1° Amine (mit H2O), Imine (mit Ketonen), diese Variante wird als Staudinger-aza-Wittig-Reaktion bezeichnet, Amide (mit Carbonsäuren), als Staudinger Ligation bekannt, oder Imidoyl-Halogenide, die durch Umsatz mit den entsprechenden Säurehalogeniden erhalten werden. 1 R N N N - N2 R1 N N N PR3 PR3 H2O 1 R N PR3 R1 NH2 R3P O - Azid wird über Metabolismus der Zelle eingeführt Danach erfolgt die Staudinger Ligation Nutzung als Fluoreszenzmarker: O N3 R O N O O N O 2 R O R3P O R2 OH X R3P O R3P O N R2 R1 N R3 Imine R2 O R2 R1 N H R1 X X=Halogen Imidoyl-Halogenide fluoreszierend Amide Literatur: Staudinger, Meyer Helv. Chim. Acta1919, 2, 635-646. L. Kürti, B. Czakó, Strategic Applications of Named Reactions in Organic Sytheses, Elsevier 2005, S. 428-429. F. Yokokawa, T. Asano, T. Shioiri Organic Letters 2000, 2, 4169-4172. B. Jiang, C. Yang, J. Wang J. Org. Chem. 2002, 67, 1396-1398. J. Restituyo Organic Letters 2003, 5, 4357-4360. O intensiv fluoreszierend O R3 P H2O Anwendung zur Detektion bestimmter RNA-Sequenzen: R1 N PR3 O R2 O P nicht fluoreszierend Abwandlungen OMe Literatur: J. A. Prescher, C. R. Bertozzi, Nat. Chem. Biol 2005, 1(1), 13-21. E. Saxon, C. R. Bertozzi, Science 2000, 287, 2008. P. V. Chang, C. R. Bertozzi, J. Am. Chem. Soc. 2007, 129, 8400. G. Lemieux, C. R. Bertozzi, J. Am. Chem. Soc. 2003, 125(16), 4708. M. J. Hangauer, C. R. Bertozzi, Angew. Chem. 2008, 120, 2430. J. Cai, X. Li, J. S. Taylor, J. Am. Chem. Soc. 2004, 126, 16324. R NH Eine ungewöhnliche Amidierung Herkömmliche Herstellung von Amiden: Staudinger-Ligation; über Aktivierung der Carbonsäure mit Kupplungsreagenzien (DCC, EDC…); über Säurechloride (SchottenBaumann); mit aromatischen Carbonsäuren (Schmidt-Reaktion); mit Aminen und Carbonsäuren, die einen Schmelzpunkt im Bereich von 160 - 180°C haben Vorteile der neuen Amidierungsmethode: • Einfache und direkte Amidierung • Äquimolare Mengen an Säure und Amin • Raumtemperatur • Keine Nebenprodukte • Abtrennung des Wassers durch Molsieb • Leichte Aufarbeitung (Filtration und Säure-Base-Extraktion) • Wiedergewinnung des Katalysators Da die Darstellung sekundärer Amide unter den gegeben Transamidierungsbedingungen nicht erfolgreich war, entwickelten Bell et al.[1] eine alternative Strategie. Durch Verwendung katalytischer Mengen eines organischen Imids und einer Brønsted-Base gelang ihnen die Metathese sekundärer Amide. O 1 R H2O OH HO O ArB(OH)2 Katalysator O R1 H O O B Katalytische Transamidierung Reaktionen, bei denen kovalente Bindungen gebrochen und unter kontrollierten Gleichgewichtsbedingungen neu geknüpft werden können, bezeichnet man als dynamisch kovalente Chemie (DCC). DCC war bis dato nur für Ester, Thioester, Imine und Disulfide bekannt. Durch Entwicklung neuer Katalysatoren konnte nun auch DCC mit Molekülen, die ein Carbonsäureamid enthalten, durchgeführt werden. Hoerter et al.[2] entwickelten einen Katalysator (Al2(NMe2)6), der die katalytische Transamidierung von tertiären Amiden mit primären Aminen ermöglichte. O oder Ar R1 O O B 1 R B OH HO B OH Br O O N O Ar R1 R1 NHR2 H2NR2 R. M. Al-Zoubi, O. Marion, D. G. Hall, Angew. Chem. 2008, 120, 2918 – 2921. B. S. Jursic, Z. Zdravkovksi, Synth. Commun. 1993, 23, 2761 – 2770. C. A. G. N. Montalbetti, V. Falque, Tetrahedron 2005, 61, 10827 – 10852. L. Kürti, B. Czakó, Strategic applications of named reactions in organic synthesis, Elsevier, 2005, S. 396 – 399. N H O O R R2 + O O I R4 R3 N H basischer Kat. R4 + R1 N H R2 R3 N H Der gleichgewichtsgesteuerte Austausch zwischen einer Reihe von Amidpaaren konnte hierfür für Substrate mit N-Alkyl- und N-Arylsubstituenten erfolgreich durchgeführt werden. [1] C. M. Bell et al., Angew. Chem. 2007, 119, 775. [2] J. M. Hoerter et al., J. Am. Chem. Soc. 2008, 130, 647.











