Teil_12_Carbonsäuren
Werbung

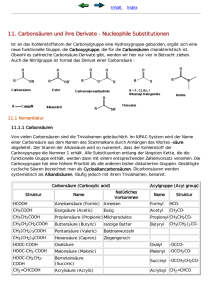
Carbonsäuren und Ihre Derivate BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_1 Nomenklatur (II) • IUPAC – System: Name des Stammalkans + Endung „-säure“ (gilt auch für Alkene und Alkine) • Cycloaliphatische Säuren → Cycloalkan + Endung „Carbonsäure“ • Benzoide Arencarbonsäuren → Benzoesäuren • Dicarbonsäuren → Alkandicarbonsäuren (Trivialnamen) • Carboxy-Gruppe hat die höchste Priorität bei der Benennung BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_2 Nomenklatur (I) Struktur IUPAC Name Trivialname natürl. Vorkommen HCOOH Methansäure Ameisensäure Ameisen CH3COOH Ethansäure Essigsäure Essig CH3CH2COOH Propansäure Propionsäure Milchprodukte CH3(CH2)2COOH Butansäure Buttersäure Butter CH3(CH2)3COOH Pentansäure Valeriansäure Baldrianwurzel CH3(CH2)4COOH Hexansäure Capronsäure Ziegengeruch BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_3 Struktur und physikalische Eigenschaften • Carboxy-Gruppe ist planar (sp2) und polar • Verkürzte CO-Einfachbindung (vgl. Ether: ca. 143 pm) • Ausbildung von Wasserstoffbrückenbindungen zu polaren Molekülen wie Wasser, Alkoholen oder Aminen • Carbonsäuren dimerisieren leicht ⇒ hohe Schmelz- und Siedepunkte • Siedepunkte: Ethanol (78 °C), Essigsäure (118 °C, aber bei 16,7 °C fest) • Intensiver Geruch der kurzkettigen Säuren, höhere Säuren geruchsneutral BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_4 Struktur und physikalische Eigenschaften Carbonsäuren reagieren im wässrigen Medium sauer! BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_5 Struktur und physikalische Eigenschaften Elektronenziehende Substituenten (-I Effekt) erhöhen die Acidität der Carbonsäure à Proton spaltet sich leichter ab! Je größer der Abstand zwischen Substituent und Carboxylgruppe, desto geringer der Effekt. BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_6 Acidität von Carbonsäuren • Carbonsäuren sind relativ schwache Säuren • Carbonsäuren sind stärker sauer als Alkohole • Carboxylat-Anion ist mesomeriestabilisiert Carboxylate – die Salze der Carbonsäuren • IUPAC: Name des Kations + Stammalkan + Endung „-oat“ • Trivialnamen: Natriumethanoat = Natriumacetat • Viele Carboxylate sind gut wasserlöslich (z.B. Na- & K-Salze) • Wässrige Lösungen der Carboxylate reagieren schwach basisch BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_7 Basizität von Carbonsäuren • Protonierung am Carbonyl-Sauerstoff ist möglich, aber erschwert, d.h. die Elektronendichte ist gering • Protonierungsschritt ist wichtig für viele Reaktionen der Carbonsäuren und der Derivate BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_8 Salzbildung Carbonsäuren reagieren mit Base zu Wasser + Salz! Zugabe einer stärkeren Säure setzt die Carbonsäure wieder frei. Die stärkere Säure verdrängt die schwächere aus dem Salz. BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_9 Herstellung von Carbonsäuren • Hydrolyse von Carbonsäurederivaten (z.B. Ester, Amide, Nitrile ...) • Oxidation von Alkoholen / Aldehyden • Oxidative Spaltung von Alkenen • Reaktion metallorganischer Verbindungen • ... • Spezielle Reaktionen BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_10 Hydrolyse von Carbonsäurederivaten BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_11 Oxidation von Alkoholen (I) Oxidation: Erhöhung der Oxidationszahl des C-Atoms prim. Alkohol: Aldehyd: OZ = –1 OZ = +1 Carbonsäure: OZ = +3 Oxidationsmittel: CrO3, KMnO4, konz. HNO3 Beispiel: BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_12 Derivate der Carbonsäuren Carbonsäurehalogenide Carbonsäureanhydride Carbonsäureester Carbonitrile Carbonsäureamide BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_13 Reaktionen der Carbonsäuren & ihrer Derivate • Carboxyl-Gruppe zeigt ähnliches Reaktionsverhalten wie die Carbonyl-Gruppe • Substitution erfolgt nach Additions-Eliminierungs-Mechanismus (AEM) • AEM wichtigste Weg zur Herstellung von Carbonsäurederivaten • Säurekatalysiert: Protonierung des Carbonyl-Sauerstoffs → Aktivierung der Carbonyl-Gruppe für nukleophilen Angriff, Erzeugung einer besseren Abgangsgruppe • Basenkatalysiert: Erhöhung der Nukleophil-Konzentration • Carbonsäuren: Deprotonierung durch das Nukleophil als Konkurrenzreaktion BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_14 Relative Reaktivität der Carbonsäurederivate: Carbonylaktivität BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_15 Carbonsäurederivate – Reaktionen I Nucleophiler Angriff: ROCl > Anhydrid > Thioester > Ester > Säureamid Säurekatalyse: Protonierung des Carbonyl-Sauerstoffs à erhöhte Angreifbarkeit des C-Atoms à Tetraedrisches Zwischenprodukt… BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_16 Carbonsäurederivate – Reaktionen II Enolatbildung: Kann durch starke Basen entfernt werden BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_17 Reaktionen von Carbonsäurehalogeniden (I) ... mit O- und N-Nukleophilen • Heftige Reaktion mit Wasser (pH neutral) zu Carbonsäuren • Meist in Gegenwart einer Base (z.B. Pyridin, Alkalihydroxid) • Neutralisation des gebildeten HX • Reaktion mit NH3, prim. und sek. Aminen zu Amiden • tert. Amine reagieren zu Alkanoylammoniumsalzen (keine Amidbildung!) • Heftige Reaktion mit Carbonsäuren zu Carbonsäureanhydriden BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_18 Herstellung von Carbonsäureestern: Veresterung von Carbonsäuren (I) Reaktion kann durch Säure katalysiert werden: z.B.: HCl, H2SO4, p-Toluolsulfonsäure BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_19 Carbonsäureester als Duft- und Aromastoffe Buttersäure: ranziger Geruch Fruchtester Capronsäure: Ziegengeruch Carbonsäureester Geruch / Aroma Essigsäurepentylester Birne Essigsäureisobutylester Banane Propionsäure(n-butyl)ester Fruchtig („Gletscheis-Bonbons“) Buttersäuremethylester Apfel , Ananas Buttersäureethylester Ananas Buttersäurepropylester Erdbeere Buttersäure(n-pentyl)ester Apfel, Aprikose Buttersäureisopentylester Birne Buttersäurebenyzlester Erdbeere Isovaleriansäureeethylester Orange 3-Hydroxy-capronsäureethylester Orange Capronsäureethylester Ananas BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_20 Aminocarbonsäuren Klassifizierung Carbaminsäure: • Strukturell die einfachste aller Aminosäuren • Monoamid der Kohlensäure • Instabil: NH3 & CO2 β-Aminosäuren: • Generell ohne große Bedeutung γ-Aminosäuren: • Promintester Vertreter: GABA 4-Aminobuttersäure: Inhibitorischer Neurotransmitter BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_21 Synthese von Carbonsäureamiden (I) • Aminolyse von Carbonsäuren (Ammonolyse bei Ammonaik) • Amine reagieren als Base und als Nucleophil • Amid-Bildung ist reversible: Umkehrung mit heißer basischer/saurer wässriger Lösung BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_22 Synthese von Carbonsäureamiden (II) • Aminolyse/Ammonolyse von Carbonsäurederivaten • Carbonsäurehalogenide und -anhydride reagieren mit NH3 oder prim./sek. Aminen zu Amiden • Reaktion nach Additions-Eliminierungs-Mechanismus • Abgangsgruppe: Halogenid oder Carboxylat • Amine sind nukleophiler als Alkohole: Ester können in Amide umgewandelt werden • Reaktion verläuft unter milden Bedingungen, kein Katalysator erforderlich • Umamidierung: Amid-Bindung ist sehr stabil, Reaktion mit einem Amin erfolgt erst bei relativ hoher Temperatur (> 150 °C) BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_23 Peptidbindung • Peptidbindung: Amidbindung zwischen zwei Aminosäuren • Amid-Bildung in der Natur durch Ribosomen katalysiert: • Reaktion ist endergonisch • Aktivierung erforderlich • Planare Struktur der Peptidbindung: Diederwinkel von 180 °C • Substituenten immer trans-ständig zueinander (bei nativen Substraten) • Oligopeptide: 2–10 Aminosäuren, Polypeptide: 10–100 AS, Makropeptide: > 100 AS BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_24 α-Aminosäuren Bausteine des Lebens → Peptide und Proteine BB 1.1, BBGW 2.4, BE 1.3, BGEO 4.3.6 SS 2016_25