MRCP-rundum: IPMN u.a. (muzinöse) zystische Pankreasläsionen
Werbung

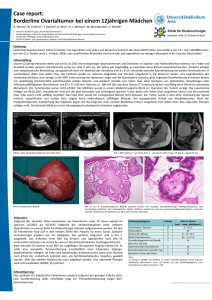
MRCP-rundum: IPMN u.a. (muzinöse) zystische Pankreasläsionen Kittner T, Klinik für Radiologie Krankenhaus Dresden-Friedrichstadt Städtisches Klinikum Akademisches Lehrkrankenhaus der TU Dresden Anforderungen an die radiologische Diagnostik Detektion (nur 5% aller Pankreas-Tu) Artdiagnose, Dignität Resektabilität T und NM anatomische Varianten (A.hep. dex. in 25% aus AMS) Methoden Sonographie (Endosonografie incl. Biopsie) Computertomographie MR-Tomographie incl. MRCP und MRA -Verfügbarkeit Angiographie (DSA) ERCP FDG PET PET CT PET-MRT MultiSlice-ComputerTomografie 64-Zeilen MSCT Detektorbreite 40 mm Mehrzeilen-Spiral-CT Isotrope Bildgebung 0.3 Alt 0.3 0.3 Neu MR-“one-stop-shopping“ MR-Schnittbilddarstellung in Atemanhaltetechnik i.v.- Kontrastmittel dynamische Untersuchung (arteriell, portal-venös, Equilibrium) mit Gd-DTPA MR-Cholangio Pankreatikografie MR-Angiografie MR-”one-stop-shopping” SD=2-4 mm Stroszczynski C, Grützmann R, Kittner T: CT and MR imaging of pancreatic cancer. Recent Results Cancer Res 2008; 177: 5-14 Häufigste zystische Veränderungen des Pankreas Neoplastisch Intraduktale papillär muzinöse Neoplasie (IPMN) Seröse zystische Neoplasie (seröses Zystadenom) Muzinöse zystische Neoplasie (muzinöses Zystadenom/ Zystadenokarzinom) Solide pseudopapilläre Neoplasie Zystische endokrine Tumoren Azinuszellkarzinom Zystisches Lymphangiom -16% -10% Pseudozysten Postentzündlich Posttraumatisch -22% Retentionszysten Chronische Pankreatitis Pankreaskarzinom Kongenital Zystische Fibrose Polyzystische Erkrankung einfache Zyste Parasiten Echinokokkus - 6% -24% - 7% Klöppel G, Kosmahl M (2001) Cystic lesions and neoplasms of the pancreas. Pancreatology 1: 648-655 Brambs HJ, Juchems M: Zystische Tumoren des Pankreas. Radiologe 2008 (48): 740-751 Intraduktale Papilläre Muzinöse Neoplasie Seitenast IPMN Hauptgang Typ 28 % Seitenast Typ 46 % Gemischter Typ 26 % segmental oder diffus eher Proc. uncinatus, junge Pat., eher benigne 136 operierte Fälle(1) 1 Sohn TA, Yeo CJ, Cameron JL et al. (2004) Intraductal papillary mucinous neoplasms of the pancreas: an updates experience. Ann Surg 239-788-799 Intraduktale Papilläre Muzinöse Neoplasie CT MRT Beweis Kommunikation mit Gangsystem essentiell Dünnschicht-CT mit MPR bis 80% Nachweis MRT mit MRCP bis 87% Nachweis Seitenast IPMN 1 Sahani DV, Kadavigere R, Blake M et al. (2006) Intraductal papillary mucinous neoplasms of the pancreas: multi-detector row CT with 2D curved reformations- correlation with MRCP. Radiology 238: 560-569 Seitenast IPMN ? Intraduktale Papilläre Muzinöse Neoplasie Seitenast-IPMN –borderline Klinik und Labor Pankreatitis Oberbauchschmerzen Intraduktale Papilläre Muzinöse Neoplasie IPMN Hauptgangtyp Irregularität Septen Verdickungen Solide Anteile Kann chron. Pankreatitis (auch klinisch) bei Gangverlegung )ähneln polypöse duktale Veränderungen mit KM-Enhancement (1) 1 Fukukura N, Fujiyoshi F, Sasaki M et al. (2000) Intraductal papillary mucinous tumors of the pancreas. Comparison of helical CT an MR imaging. Acta Radiol 44: 464-471 Schnellschnitt IPMN Referenz-Histo: Duktales-Adeno-Ca T3 N1 Intraduktale Papilläre Muzinöse Neoplasie Gutartig 2,6 cm Durchmesser Borderline Maligne Tumoren Carcinoma in situ 27% (4,7 cm Durchmesser, Hauptgang weiter als benigne, Gallengang dilatiert) Invasives Karzinom 40% (muzinös, duktal) werden solider Klöppel G (1998) Clinicopathologic view of intraductal papillary-mucinous tumor of the pancreas. Hepatogastroenterology 45: 1981-1985 Bildmorphologische Kriterien einer malignen Entartung einer IPMN Brambs HJ, Juchems M: Zystische Tumoren des Pankreas. Radiologe 2008 (48): 740-751 Muzinöse zystische Neoplasien Tumoren ohne Verbindung mit dem Gangsystem, die schleimbildendes Epithel und häufig ein ovarienartiges Stroma aufweisen (1) fast ausschließlich weibliche Patienten (M:F=1:9) (2) meist solitär dickwandige bzw. gekammerte Zysten meist größer und Druckschmerzen, nur 25% symptomlos Tumorgröße > 6 cm und Knotennachweis korreliert mit Entartungsrisiko (3) (17,5% Ca, 10,5% borderline, 70% Adenom. Crippa S et al., Ann Surg, 2008) 95% in Korpus und Schwanz Hämorrhagie stark hinweisend auf MZN Ddx monozystische Tumore vs. Pseudozysten schwer (4) 1 Zamboni G, Scarpa A, Bogina G et al. (1999 ) Mucinous cystic tumors of the pancreas: clinicopathological features, prognosis, and relationship to other mucinous cystic tumors. Am J Surg Pathol 23: 410-422 2 Klöppel G, Kosmahl M (2001) Cystic lesions and neoplasms of the pancreas. Pancreatology 1: 648-655 3 Thompson LD, Becker RC, Przygodzky et al. (1999) Mucinous cystic neoplasms (mucinous cystadenocarcinoma of low-grade malignant potential )of the pancreas: a clinicopathological study of 130 casesAm J Surg Pathol 23: 1-16 4 Brambs HJ, Juchems M: Zystische Tumoren des Pankreas. Radiologe 2008 (48): 740-751 Muzinöse zystische Neoplasie MZ Adenom IPMN:MZN=7:1 Suzuki Y, Atomi y, Sugiyama M et al. (2004) Cystic neoplasms of the pancreas: a japanese multiinstitutional study of intraductal papillary mucinous tumors and mucinous cystic tumors. Pancreas28: 241-246 Zyste Dysontogenetische Zyste Seröse Zystische Neoplasie Häufigster Subtyp mikrozystisch Choledochus unauffällig Makro- (Oligo) zystische SZN Ddx MZN, Pseudozysten, Seitenast IPMN (eher kolbenartig1 ) 1 Kim SY, Lee JM, Kim SH et al. (2006 ) Macrocystic neoplasms of the pancreas: CT differentiation of serous oligocystic adenoma from mucinous cystadenoma and intraductal papillary mucinous tumor. AJR 187: 1192-1198 Solide pseudopapilläre Neoplasie CT MRT 24 % Brambs HJ, Juchems M: Zystische Tumoren des Pankreas. Radiologe 2008 (48): 740-751 Klöppel G, Kosmahl M (2001) Cystic lesions and neoplasms of the pancreas. Pancreatology 1: 648-655 Pankreas-Pseudozyste Anamnese !!! Chron. Pankreatitis- hämodyn. wirksame, rezidivierende Blutungen Amplatzer Vascular Plug Bergert H, Dobrowolski F, Caffier S, Bloomenthal A, Hinterseher I, Saeger HD:Prevalence and treatment of bleeding complications in chronic pancreatitis. Langenbecks Arch Surg. 2004 Nov;389(6):504-10. Epub 2004 Jun 2. Pankreas-Pseudozysten Zufallsbefund und symptomatischer zystischer Pankreastumor-Maligne vs. benigne Gutartig 40% Potentiell maligne 29% Maligne Tumoren 31 % (1) Malignitätsverdächtig: (1) CEA, CA 19-9 Zyste > 3cm solide Tumoranteile periphere Verkalkungen erweiterter Pankreashauptgang 176 Patienten 1Goh BK, Tan YM, Thong CH et al. (2008) How useful are clinical, biochemical, and cross-sectional imaging features in predicting potentially malignant or malignant cystic lesions of the pancreas ? Results from a single intstitution experience with 220 surgical treated cases. J Am Coll Surg 206: 17-27 zufällig entdeckte kleine Zysten meist beim älteren Patienten entsprechen in 50 % nicht Pseudozysten sondern> 50% malignen oder prämalignen Neoplasien (2); hiervon 36% IPMN (3) < 2 cm selten maligne, Verlaufskontrolle mgl. 2Fernandez del-Castillo C, Targarono J, Thayer SP et al. (2003) Incidental pancreatic cysts: clinicopathologic characteristics and comparison with symptomatik patients. Arch Surg 138: 427-434 3Goh BK, Tan YM, Yap WM et al. (2006) Pancreatic serous oligocystic adenomas: clinicopathologic features and comparison with serous microcystic adenomas and mucineous cystic neoplasms. World J Surg 30: 1553-1559 S3-Leitlinie „Exokrines Pankreaskarzinom“ 2007 Ergebnis einer evidenzbasierten Konsensukonferenz (13.-14.10.2006) Bildgebende Verfahren zur Primär-Diagnostik „Zur Klärung eines Tumorverdachts sind unterschiedliche Verfahren geeignet, wie Sonografie, Endosonografie, Multidetektor-CT, MRT mit MRCP oder ERCP“. Empfehlungsgrad B, Evidenzstärke 2, Konsens Empfehlung „Diagnostische Verfahren der ersten Wahl zur Detektion des Pankreaskarzinoms sind die Oberbauchsonografie, die Endosonografie, die Multidetektor-CT-Untersuchung sowie die MRT in Kombination mit der MRCP.“ Empfehlungsgrad: B, Evidenzstärke 3, Konsens Adler G, Seufferlein T, Bischoff SC et al. S3-Leitlinie „Exokrines Pankreaskarzinom“ Z Gastroenterol 2007; 45: 487-523 S3-Leitlinie „Exokrines Pankreaskarzinom“ 2007 Ergebnis einer evidenzbasierten Konsensukonferenz (13.-14.10.2006) Zystische Prozesse „Zur Differenzialdiagnostik zystischer Prozesse werden prinzipiell Oberbauchsonografie, die Multidetektor-CTUntersuchung die MRT mit MRCP sowie die Endosonografie und die ERCP angewandt“. Empfehlungsgrad D, Evidenzstärke 3, Konsens Anmerkungen „Keine der aufgeführten Methoden erlaubt eine eindeutige Diagnose. Allenfalls in Kombination mit den u.g. Verfahren (endosonografische Punktion mit CEA und CA 19-9 Bestimmung) lässt sich in Verbindung mit der jeweiligen klinischen Konstellation eine belastbare Aussage machen.“ Adler G, Seufferlein T, Bischoff SC et al. S3-Leitlinie „Exokrines Pankreaskarzinom“ Z Gastroenterol 2007; 45: 487-523 Zusammenfassung Morphologische Klassifikation der zystischen Pankreas-Tumoren nach Sahani et al., 2005 1. Unilokuläre Zysten -keine Septen oder soliden Anteile—Pseudozysten bei bek. Pankreatitis !!!!! Anamnese !!!!! -selten bei monozyst. serösen Adenomen, IPMN, zyst. Lymphangiomen 2. Mikrozystische Läsionen -Seröse Zystische Neoplasie 3. Makrozystische Läsionen -meist Muzinöse Zystische Neoplasie -selten oligozystische seröse Zystadenome 4. Zysten mit soliden Komponenten -zwingend malignitätssuspekt -MZN, IPMN, zystisch degenerierte andere Tu/ Metastasen Sahani DV, Kadavigere R, Sokar A et al. (2005) Cystic pancreatic lesions: a simple imaging-based classification system for guiding management. RadioGraphics 25: 1471-1484 Zusammenfassung Alter, Geschlecht und Lage Kosmahl M, Pauser U, Peters K et al. (2004) Cystic neoplasms of the pancreas and tumor-like-lesions with cystic features: a review of 418 cases and a classification proposal. Virchows Arch 445: 169-178 Zusammenfassung Zufallsbefund und symptomatischer zystischer Pankreastumor-Maligne vs. benigne Morphologische Kriterien für maligne: (86 Patienten mit zufällig zystischen Tu < 3 cm): Septierungen Intrazystische, solide Vegetationen Unilokulär und klein selten maligne (PPV 97%) Sahani DV, Saokar A, Hahn PF (2006) Pancreatic cysts 3 cm or smaller: how agressive should treatment be ? Radiology 238: 912-919 Rückblick Teslascan (Mn-DPDP) i.v. 2x Gad-DTPA (hepatozellular –spezifisch) Teslascan Kittner T, Förster A, Abolmaali N, Hietschold V Comparison of the efficacy of MR Imaging enhanced with mangofodipir infusion (Mn-DPDP) to unenhanced MRI imaging and spiral CT in diagnosing focal pancreatic lesions. Radiology 213 (1999) 466 Ausblick Tumor-Biologie Rezeptoren/ Gen-Expression Molekulare Bildgebung „ The features MRT/ MR-Spektroskopie Vaskularisation/ Perfusion Mehrzeilen-Spiral-CT are Angiografie Morphologie becoming clearer“ Metabolismus PET/ PET-CT/PET-MRT Ultraschall Röntgen Anatomie Klöppel G, Kosmahl M (2001) Cystic lesions and neoplasms of the pancreas. Pancreatology 1: 648-655 Panta rhei- alles fließt „Alles fließt und nichts bleibt; es gibt nur ein ewiges Werden und Wandeln“ Platon (nach Heraklits Lehre)