Die ATP-Synthase weiter gedreht
Werbung

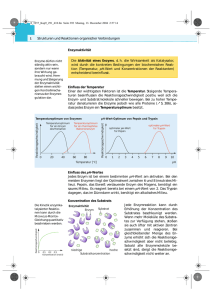
10 Jahre BIOspektrum 66 Die ATP-Synthase weiter gedreht Wolfgang Junge Hartmu t Michel Biophysik, Universität Osnabrück Achim Krö ger Lothar Jae nicke Die ATP-Synthase erzeugt ATP, den zentralen Treibstoff der Zelle, auf Kosten elektrochemischer Energie. Das Enzym ist aus zwei rotierenden Schrittmotoren aufgebaut, deren einer, als Motor, den anderen, als Generator, antreibt. Ihr Zusammenwirken hält weit gehenden künstlich eingeführten Modifikationen der Struktur stand. Die seit Mitte der neunziger Jahre in Umrissen vermutete Grobmotorik des Enzyms ist heute bewiesen. Wichtige Konstruktionsmerkmale werden jetzt erkennbar, so sichert die elastische Übertragung des Drehmoments die Robustheit der Funktion und einen hohen kinetischen Wirkungsgrad unter Last. Christiane Gatz terhelt Volkmar Braun Wolfgang Junge Abb. 1: Schematische Darstellungen und Animationen der ATP Synthase. (A) Schnitt durch den Kopfteil, F1, nach der zuerst publizierten, asymmetrisch mit Nukleotiden belegten Struktur[3], dazu als Animation eine Energie-minimierte Interpolation von Cherepanov (www.biologie.uniosnabrueck.de/biophysik/Junge/pictures/F1.avi). (B) Schematische Darstellung des Ionentranslokators, FO, und eine Animation dazu (www.biologie.uni-osnabrueck.de/biophysik/ Junge/pictures/FO.avi). Der H+-Leitwert von FO, etwa 10 fS, ist mit diesem Modell verträglich[60]. (C) Eine von Olaf Fritsche im Institut des Autors 1996 produzierte Animation des gesamten Enzyms, welche, vom Institut für Wissenschaftlichen Film, Göttingen, grafisch verfeinert in dessen CD „Die Zelle I“ aufgenommen, über die Website des Autors weite Verbreitung fand (www.biologie.uni-osnabrueck.de/biophysik/ Junge/pictures/FOF1.MOV). Die ATP-Synthase (FOF1-ATPase) er- zeugt eine chemische Differenz des ATP/ADP-Systems auf Kosten einer elektrochemischen Energiedifferenz des Protons[1]. Dies gehört, seit Ende der siebziger Jahre unangefochten, zum biochemischen Grundwissen. Der Mechanismus der Kopplung von Ionentransport und ATP-Synthese blieb jedoch zunächst verborgen. Arbeiten von Paul Boyer[2] hatten einen alternierenden oder rotierenden Reaktionsablauf der ATP-Hydrolyse an den zwei oder drei Reaktionsorten des F1-Teils wahrscheinlich gemacht. Die Rotation wurde erst durch die Kristallstruktur von John Walker plausibel[3]. Der dreizählige, durch unterschiedliche NukleotidBelegung asymmetrisierte F1-Teil des Enzyms ließ vermuten, dass die an den drei Wirkorten nacheinander ablaufende ATPHydrolyse die zentrale Welle im Kreise herum treibt[3]. Günter Schäfer hat dies im ersten Heft des BIOspektrums dargestellt[4]. Abbildung 1A zeigt die in einer Lagerschale umlaufende zentrale Welle, welche von einem hin- und herschwingenden Hebel angetrieben wird, der an der Nukleotid-Bindetasche ansetzt. Wenig später wurde die Rotation der zentralen Welle (der Untereinheit γ) im Hexagon der Untereinheiten (αβ)3 von F1 in unterschiedlicher Weise nachgewiesen[5–7]. Für Biochemiker überzeugend war der mikrovideografische Ansatz der Gruppen von Masasuke Yoshida und Kazuhiko Kino- Dieter Oes sita mit rotierenden, an der zentralen Welle des auf einer Unterlage immobilisierten F1Teils befestigten Aktin-Filamenten (s. Abb. 3A). Vermutlich war auch der Ionentransportierende Teil des Enzyms, FO, ein Rotationsmotor. Das vom Autor 1993 vorgeschlagene Konzept für dessen Funktionsweise, gestützt auf Brownsche Relativ-Rotation von Untereinheiten und elektrostatische Einschränkungen, wurde 1997 im BIOspektrum dargestellt[8] (s. auch[9–10] und Abb. 1B). In groben Umrissen fand das Konzept zweier rotierender Motoren/Generatoren (Abb. 1C) nach der Verleihung des Nobel-Preises an Paul Boyer und John Walker im Jahre 1997 Eingang in die Lehrbücher der Biochemie. Erweiterte Strukturmodelle: Gegründet auf Röntgen-Kristallstrukturanalyse für den F1Teil[11–14] sowie für F1 mit einem Teil von FO[15], auf Röntgen- und NMR-Analyse für einzelne Untereinheiten in Lösung[16–20], auf AFM für den Ring der c-Untereinheiten im FO-Teil[21, 22], auf EM[23] und auf geeignete chemische Quer-Vernetzungen[24–29] stellt sich das Enzym heute wie in Abbildung 2A dar. Der F1-Teil wurde mit unterschiedlichen Nukleotiden und Inhibitoren in einem Fall bis auf 0,2 nm aufgelöst[30]. Auffällig ist ein Arginin als festes, zugleich auf das γ-Phosphat des ATP hin „verschwenkbares“ und dieses stabilisierende Gegenkation. Die Kooperativität der drei Reaktionsorte und der Einfluss mechanischer Veränderungen großer Reichweite auf die Prozessierung der Nukleotide ist bisher nicht vollständig erschlossen worden (zur Übersicht[31]). Für den FO-Teil wurde durch AFM eine Ringstruktur der in mehreren Kopien vorhandenen Untereinheit c bewiesen (Abb. 1B). Die Anzahl von Kopien der Untereinheit c im Ring variiert zwischen 14 (in Chloroplasten[22]) über 11 (in einem Natrium-translozierenden Bakterium[32]) bis 10 (in Hefe[15] und E. coli[33]). Die beiden Motor/Generatoren arbeiten daher (i) mit unBIOspektrum · 1/05 · 11. Jahrgang 10 Jahre BIOspektrum 67 Abb. 2: Aktuelles Strukturmodell der ATP Synthase. (A) Strukturmodell von FOF1 (Zitate im Text). Roter Pfeil: künstlich eingeführter Helix-Längenunterschied entsprechend 11+14=25 Aminosäuren[48, 49]. Roter Kreis: Ort des einfusionierten Cytochrom b[50]. (B) Schnitt durch den F1-Teil. Rot markiert die ohne Funktionsverlust zu deletierenden Aminosäuren[51]. Konstruktionsprinzipien des Doppelmotors, fein abgestimmt oder robust? funktionsfähige Hybride aufgebaut aus Untereinheiten des Enzyms aus Spinatchloroplasten, Synechocystis, E. coli und P. modestum (Zitate in[46]) sind Beispiele dafür. Der Ionentranlokator, FO, kann auch mit Na+ arbeiten[47]. Die in Abbildung 2A grün dargestellte Verbindung des FO-Teils mit dem F1Teil durch zwei parallel geführte Untereinheiten b ließ sich ohne Funktionsverlust (i) durch künstlich eingeführte Cysteine verbrücken, (ii) um je 14 Aminosäuren verlängern[48] oder (iii) um 11 Aminosäuren verkürzen[49]. An der durch einen roten Kreis markierten Stelle konnte ein kleines Protein, Cytochrom b, einfusioniert werden, ebenfalls ohne Blockade[50]. Die zentrale Welle wurde an ihrem α-helikalen (C-terminalen) Ende um 12 Aminosäuren verkürzt (in Abb. 2B rot dargestellt). ATP-Hydrolyse drehte jedoch auch nach Verlust dieses „Lagerzapfens“ Aktin-Filamente (s. Abb. 3A) gegen den Widerstand des viskosen Mediums[51]. Der C-Terminus der Welle wurde, wiederum ohne totalen Aktivitätsverlust, mit der Lagerschale kovalent verbrückt[46, 52, 53]. MDSimulationen legten nahe, dass das Enzym auf Grund seines hohen Drehmoments in der Lage sein könnte, die Wasserstoffbrücken in der α-Helix der Welle aufzubrechen, um so von der künstlich blockierten Welle/Lager-Konstruktion (Abb. 2B) auszuweichen auf ein Drehzapfengelenk, realisiert durch die Einfachbindungen am Cα-Atom einiger Aminosäuren[52]. Die- Bei einem Molekül mit derart komplexer Funktion vermutet man bei oberflächlicher Betrachtung eine sehr feine Abstimmung der Elementarakte in den beiden miteinander gekoppelten Motoren, dem Ionentranslokator FO und dem Syntheseapparat F1. Es gibt jedoch eine Fülle von Hinweisen auf eine eher robuste Konstruktionsweise, die Variabilität der Symmetrien (3:10, :11, :14) und Abb. 3: Bestimmung der Winkelabhängigkeit des in F1 erzeugten Drehmoments nach Übertragung auf den Ring von FO mit angeheftetem Aktin-Filament. (A) Schema des Messprinzips[56]. (B) Berechnete Abhängigkeit der Rate als Funktion der elastischen Torsionssteife der zentralen Welle[57, 58]. Die elastische Drehmomentübertragung ermöglicht einen hohen kinetischen Wirkungsgrad. angepasster Symmetrie, (ii) mit verschiedener Übersetzung in unterschiedlichen Organismen und (iii) mit nicht-ganzzahliger Stoichiometrie. Für Chloroplasten wurde strukturell ein H+/ATP-Verhältnis von 14:3 = 4,67 erwartet. Funktionell wurde jedoch eine H+/ATP-Stoichiometrie von 4 bestimmt[34–36], ein bisher nicht aufgeklärter Widerspruch. Höhere Auflösung der Rotationsbewegung Erste Hinweise für einen in drei Schritten erfolgenden Rotationsfortschritt im F1-Teil ergaben sich bereits aus spektroskopischen Untersuchung am Ensemble und an Einzelmolekülen[37–42]. Durch DunkelfeldMikroskopie mit nano-Gold-Partikel wurde die Schrittweite, 120°, direkt dargestellt[43]. Bei ATP-Limitierung wurden vier Phasen unterscheidbar: das Warten auf ATP-Bindung, eine Drehung um 80°, die Spaltung des gebundenen ATP in < 1ms und eine Drehung um 40°[44]. Dass eine schrittweise Drehung in umgekehrter Richtung, angetrieben durch protonen- bzw. natriummotorische Kraft, für ATP-Synthese sorgt, wurde spektroskopisch an Proteoliposomen nachgewiesen[40–42]) und, spektakulär, auch an von außen durch ein rotierendes Magnetfeld angetriebenen, immobilisierten Enzymen[45]. BIOspektrum · 1/05 · 11. Jahrgang se offenbar mögliche nanotechnische Lösung scheint im Normalzustand des Enzyms jedoch nicht genutzt zu werden[6, 37, 53]. Welche konstruktiven Tricks lassen dieses komplex aufgebaute Enzym derart robust mit strukturellen Veränderungen fertig werden? Elastische Kraftübertragung, Drehmoment und Wirkungsgrade: Es wurde darüber spekuliert, dass das robuste Zusammenspiel der beiden Schrittmotoren durch ein ausgleichendes Strukturelement, eine elastische Kraftübertragung, vermittelt wird[54, 55]. Die Winkelabhängigkeit des Drehmoments sollte die vermutete Elastizität widerspiegeln. Zum Nachweis der inneren Elastizität haben Siegfried Engelbrecht, Karin Gumbiowski und Oliver Pänke ein Aktin-Filament mono-spezifisch am Ring der c-Untereinheiten des am F1-Teils immobilisierten Enzyms angeheftet[56]. Die durch die ATP-Hydrolyse im F1Teil des Enzyms angetriebene Drehung gegen den viskosen Widerstand deformierte das Filament. Dessen visko-elastische Biegung erlaubte die Berechnung der Winkelabhängigkeit des am c-Ring angreifenden Drehmoments[46, 57, 58]. Es schwankte mit geringer Amplitude (Periode 120°) um einen Mittelwert von ca. 56 pNnm. In Anbetracht der Schrittmotor-Eigenschaft des Antriebs (Aktivierungsenergie >40 kJ/mol) bedeutete die geringe Schwankungsbreite die Glättung der Kraftschläge durch innere Elasti- 10 Jahre BIOspektrum 68 zität des Enzyms. Eine statistisch-mechanische Beschreibung dieses nanoskopischen Schrittmotors mit den Methoden der statistischen Mechanik führte Cherepanov zu dem Schluss, dass eine hohe Rate nur bei elastisch weicher Kopplung zwischen dem mit ausgeprägten Kraftschlägen arbeitenden Antrieb und der entfernten großen Last möglich ist[46, 57, 58] (s. Abb. 3B). Die elastische Kopplung erklärt zugleich die Robustheit der Funktion gegenüber Struktur-Modifikationen und die Fähigkeit, mit unterschiedlichen und nicht-ganzzahligen Übersetzungen zu arbeiten. Innere Elastizität ist ein einfaches Konstruktionsprinzip, um einen großen kinetischen Wirkungsgrad zu erzielen, einfacher zu realisieren und robuster als die Glättung der Kraftschläge durch sorgfältige Abstimmung (etwa durch einen „hydrogen bonded zipper“) der Elementarvorgänge in den beiden Motoren, wie von Georg Oster vorgeschlagen[59]. Unter der Last eines typisch 3 µm langen Aktin-Filaments arbeitet die F1-ATPase um Größenordnungen langsamer als das freie Enzym. Wenn es gar an einem Hindernis an der Oberfläche anstößt, bleibt es ganz stehen. Im ersten Fall befindet sich das Enzym nahe am, im zweiten im thermodynamischen Gleichgewicht, in beiden Fällen wird es elastisch deformiert. Das aus der elastischen Deformation von Aktin-Filamenten bestimmte mittlere Drehmoment von 56 pNnm, multipliziert mit dem Winkel pro ATP, 2π/3, deckte sich mit der molaren Freien Energie der ATP-Hydrolyse in den Experimenten, 70 kJ/mol[58]. Das bedeutet einen thermodynamischen Wirkungsgrad von Eins, nicht überraschend für ein gleichsam ruhendes Enzym. Wichtiger sind folgende Aussagen: (i) Das Enzym besitzt wegen elastischer Kraftübertragung einen hohen kinetischen Wirkungsgrad und (ii) es gibt trotz des hohen Drehmoments keinen Schlupf zwischen den beiden Motoren (dieser tritt erst auf, wenn der Eingriff des Hebels in die umlaufende Welle bei Abwesenheit von Nukleotiden gelockert ist). Zusammengefasst: Die ATP Synthase ist ein robustes und effizientes Enzym, welches chemische mit Ionentransport-Reaktionen mechanisch durch eine ausgeprägte Grobmotorik verbindet. Seine Funktionsweise wird im Prinzip verstanden, die Details der elektrischen, chemischen und mechanischen Vorgänge sind dagegen erst im Ansatz erkennbar. [3] Abrahams, J.P., Leslie, A.G.W., Lutter, R., and Walker, J.E. (1994): Nature 370, 621–628. [35] Turina, P., Samoray, D., and Graber, P. (2003): EMBO J. 22, 418–426. [4] Schäfer, G. (1995): BIOspektrum 1, 17–21. [36] Berry, S., and Rumberg, B. (1999): Biochim.Biophys.Acta 1410, 248–261. [5] Duncan, T.M., Bulygin, V.V., Zhou, Y., Hutcheon, M.L., and Cross, R.L. (1995): Proc.Natl.Acad.Sci.USA 92, 10964–10968. [6] Sabbert, D., Engelbrecht, S., and Junge, W. (1996): Nature 381, 623–625. [38] Sabbert, D., and Junge, W. (1997): Proc.Natl.Acad.Sci.USA 94, 2312–2317. [7] Noji, H., Yasuda, R., Yoshida, M., and Kinosita, K. (1997): Nature 386, 299–302. [39] Häsler, K., Engelbrecht, S., and Junge, W. (1998): FEBS Lett. 426, 301–304. [8] Junge, W. (1997): BIOspektrum 5.97, 24–30. [40] Kaim, G., Prummer, M., Sick, B., Zumofen, G., Renn, A., Wild, U.P., and Dimroth, P. (2002): FEBS Lett. [9] Junge, W., Lill, H., and Engelbrecht, S. (1997): Trends Biochem.Sci. 22, 420–423. 525, 156–163. [10] Junge, W. (2004): Photosynth.Res. 80, 197–221. [41] Borsch, M., Diez, M., Zimmermann, B., Reuter, R., and Graber, P. (2002): FEBS Lett. 527, 147–152. [11] Braig, K., Menz, R.I., Montgomery, M.G., Leslie, A.G., and Walker, J.E. (2000): Structure.Fold.Des 8, 567–573. [12] Gibbons, C., Montgomery, M.G., Leslie, A.G., and Walker, J.E. (2000): Nat.Struct.Biol. 7, 1055–1061. [13] Shirakihara, Y., Leslie, A.G.W., Abrahams, J.P., Walker, J.E., Ueda, T., Sekimoto, Y., Kambara, M., Saika, K., Kagawa, Y., and Yoshida, M. (1997): Struc- ture 5, 825–836. [14] Abrahams, J.P., Buchanan, S.K., van Raaij, M.J., Fearnley, I.M., Leslie, A.G.W., and Walker, J.E. (1996): Proc.Natl.Acad.Sci.USA 93, 9420–9424. [15] Stock, D., Leslie, A.G., and Walker, J.E. (1999): Science 286, 1700–1705. [16] Del Rizzo, P.A., Bi, Y., Dunn, S.D., and Shilton, B.H. (2002): Biochemistry 41, 6875–6884. [17] Hausrath, A.C., Grüber, G., Matthews, B.W., and Capaldi, R.A. (1999): Proc.Natl.Acad.Sci.USA 96, 13697–13702. [18] Wilkens, S., Dunn, S.D., Chandler, J., Dahlquist, F.W., and Capaldi, R.A. (1997): Nature Structural Biology 4, 198–201. [19] Girvin, M.E., Rastogi, V.K., Abildgaard, F., Markley, J.L., and Fillingame, R.H. (1998): Biochemistry 37, 8817–8824. [20] Rastogi, V.K., and Girvin, M.E. (1999): Nature 402, 263–268. [21] Muller, D.J., Dencher, N.A., Meier, T., Dimroth, P., Suda, K., Stahlberg, H., Engel, A., Seelert, H., and Matthey, U. (2001): FEBS Lett. 504, 219–222. [22] Seelert, H., Poetsch, A., Dencher, N.A., Engel, A., Stahlberg, H., and Mueller, D.J. (2000): Nature 405, 418–419. [23] Rubinstein, J., and Walker, J. (2002): J.Mol.Biol 321, 613–619. [24] Watts, S.D., Zhang, Y., Fillingame, R.H., and Capaldi, R.A. (1995): FEBS Lett. 368, 235–238. [25] Altendorf, K., Stalz, W., Greie, J., and DeckersHebestreit, G. (2000): J.Exp.Biol. 203 Pt 1, 19–28. [26] Stalz, W.D., Greie, J.C., Deckers-Hebestreit, G., and Altendorf, K. (2003): J.Biol.Chem. 278, 27068–27071. [27] Dunn, S.D., Kellner, E., and Lill, H. (2001): Biochemistry 40, 187–192. [28] Dunn, S.D., McLachlin, D.T., and Revington, M. (2000): Biochim.Biophys.Acta 1458, 356–363. [29] Dunn, S.D., Revington, M., Cipriano, D.J., and Shilton, B.H. (2000): J.Bioenerg.Biomembr. 32, 347–355. [42] Diez, M., Zimmermann, B., Borsch, M., Konig, M., Schweinberger, E., Steigmiller, S., Reuter, R., Felekyan, S., Kudryavtsev, V., Seidel, C.A., and Graber, P. (2004): Nat.Struct.Mol.Biol 11, 135–141. [43] Yasuda, R., Noji, H., Kinosita, K., and Yoshida, M. (1998): Cell 93, 1117–1124. [44] Shimabukuro, K., Yasuda, R., Muneyuki, E., Hara, K.Y., Kinosita, K., Jr., and Yoshida, M. (2003): Proc.Natl.Acad.Sci.U.S.A 100, 14731–14736. [45] Itoh, H., Takahashi, A., Adachi, K., Noji, H., Yasuda, R., Yoshida, M., and Kinosita, K. (2004): Nature 427, 465–468. [46] Junge, W., Pänke, O., Cherepanov, D., Gumbiowski, K., Müller, M., and Engelbrecht, S. (2001): FEBS Lett. 504, 152–160. [47] Dimroth, P., Wang, H., Grabe, M., and Oster, G. (1999): Proc.Natl.Acad.Sci.USA 96, 4924–4928. [48] Sorgen, P.L., Bubb, M.R., and Cain, B.D. (1999): J.Biol.Chem. 274, 36261–36266. [49] Sorgen, P.L., Caviston, T.L., Perry, R.C., and Cain, B.D. (1998): J.Biol.Chem. 273, 27873–27878. [50] Cipriano, D.J., Bi, Y., and Dunn, S.D. (2002): J.Biol.Chem. 277, 16782–16790. [51] Müller, M., Pänke, O., Junge, W., and Engelbrecht, S. (2002): J.Biol.Chem. 277, 23308–23313. [52] Gumbiowski, K., Cherepanov, D., Müller, M., Pänke, O., Promto, P., Winkler, S., Junge,W. and Engelbrecht,S. (2001): J.Biol.Chem. 276, 42287–42292. [53] Müller, M., Gumbiowski, K., Cherepanov, D.A., Winkler, S., Junge, W., Engelbrecht, S., and Pänke, O. (2004): Eur.J.Biochem. 271,3914–3922 [54] Pänke, O., and Rumberg, B. (1999): Biochim.Biophys.Acta 1412, 118–128. [55] Cherepanov, D.A., Mulkidjanian, A., and Junge, W. (1999): FEBS Lett. 449, 1–6. [56] Pänke, O., Gumbiowski, K., Junge, W., and Engelbrecht, S. (2000): FEBS Lett. 472, 34–38. [57] Cherepanov, D.A., and Junge, W. (2001): Biophys.J. 81, 1234–1244. [58] Pänke, O., Cherepanov, D.A., Gumbiowski, K., Engelbrecht, S., and Junge, W. (2001): Biophys.J. 81, 1220–1233. [59] Elston, T., Wang, H., and Oster, G. (1998): Nature 391, 510–514. [60] Feniouk, B.A., Kozlova, M.A., Knorre, D.A., Cherepanov, D., Mulkidjanian, A., and Junge, W. (2004): Biophys.J. 86, 4094–4109. [30] Menz, R.I., Walker, J.E., and Leslie, A.G. (2001): Cell 106, 331–341. [31] Senior, A.E., Nadanaciva, S., and Weber, J. (2002): Biochim.Biophys.Acta 1553, 188–211. Korrespondenzadresse: [32] Stahlberg, H., Muller, D.J., Suda, K., Fotiadis, D., Prof. Dr. Wolfgang Junge Universität Osnabrück D-49069 Osnabrück Tel.: 0541-969-2872 Fax: 0541-969-2262 [email protected] www.biologie.uni-osnabrueck.de/biophysik/junge Engel, A., Meier, T., Matthey, U., and Dimroth, P. Literatur [37] Sabbert, D., Engelbrecht, S., and Junge, W. (1997): Proc.Natl.Acad.Sci.USA 94, 4401–4405. (2001): EMBO Rep. 2, 229–233. [1] Mitchell, P. (1961): Nature 191, 144–148. [33] Jiang, W., Hermolin, J., and Fillingame, R.H. (2001): Proc.Natl.Acad.Sci.USA 98, 4966–4971. [2] Boyer, P.D. (1993): Biochim.Biophys.Acta 1140, 215–250. [34] van Walraven, H.S., Strotmann, H., Schwarz, O., and Rumberg, B. (1996): FEBS Lett. 379, 309–313. BIOspektrum · 1/05 · 11. Jahrgang