LIPIDE - Tired Joe
Werbung

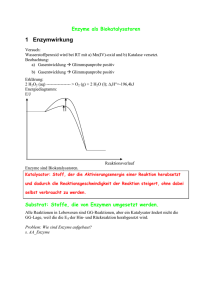
LIPIDE =Fette und fettähnliche Substanzen Erdnussöl Sonnenblumenöl Schweinefett Kokosöl Palmöl Baumwollsaatöl Flachs- (Lein) -öl Talgbutter Knochenfett Tran Seite 118 © Florian Zeller 07/08 Fette - hydrophob, lipophil wegen dieser Eigenschaften nicht frei im Cytoplasma Öltropfen Membran - Reservestoffe (Depotfett) Baustoffe (Membran) Wärmeisolatoren (Unterhautfettgewebe der Säugetiere z.B. Wale/Robben) Schutz bestimmter Organe vor Stoß (Niere, Gelenke, Auge) Chemischer Bau der Neutralfette (Glyceride) Fette sind Ester aus dem dreiwertigen Alkohol Glycerin (C3-Körper) und höheren Fettsäuren (langkettige Carbonsäuren). Funktionelle Gruppen, die für die Bindungsbildung wichtig sind: Hydroxylgruppe Carboxylgruppe Esterbindung Glycerin Fettsäuren CnH2n+1COOH Fettsäuren: z.B. z.B. Triglycerid = Fett (Fettsäureglycerinester) Diese Formel gilt für die gesättigten FS! Palmitinsäure Stearinsäure C15H31COOH C17H35COOH gesättigte Fettsäuren Ölsäure Linolsäure C17H33COOH C17H31COOH ungesättigte Fettsäuren Fette bestehen meist aus Fettsäuregemischen !! Struktur eines Fettmoleküls: Wegen räumlicher Behinderung „schwenkt“ der mittlere Fettsäurerest auf die andere Seite. Stimmgabel Seite 119 © Florian Zeller 07/08 Lipoide (=fettähnliche Substanzen) z.B. Lecithin, ein Phospholipid: - Baustoff von Biomembranen (z.B. im Gehirn) MODELL EINER ELEMENTARMEMBRAN Funktion von Membranen - - Zellkompartimentierung (= gegeneinander abgetrennte Reaktionsräume in einer Zelle) Regelung des passiven und aktiven Stofftransports zwischen den einzelnen Zellorganellen einer Zelle sowie zwischen den Zellen und dem Außenmedium Zytoplasmamembran (begrenzt Zelle nach außen hin) enthält ferner z.B. Rezeptormoleküle für Mormone oder Transmitterstoffe Antigene Enzymproteine Membranen sind semipermeabel !! Lecithin - Molekül lipophiler hydrophiler Teil der Phosphorsäureester hydrophyler Teil Seite 120 © Florian Zeller 07/08 Kohlenhydrate Glucose, Stärke, Glycogen, Cellulose Monosaccharid = Einfachzucker Polysaccharide = Vielfachzucker Funktion: - Betriebsstoffe: Glucose als Energiequelle - Reservestoffe: Störke bei Pflanzen Energievorrat, Glycogen bei Tieren aber verminderte osmotische Wirksamkeit - Bau- oder Gerüststoffe:Cellulose der pflanzlichen Zellwand! (nicht Membran!) Funktionelle Gruppen: Eine funktionelle Gruppe gibt einem Molekül seine ganz charakteristischen Eigenschaften, die vor allem das (bio-)chemische Reaktionsverhalten beeinflussen! 1. Glucose = Traubenzucker (Monosaccharid) Summenformel: C6H12O6 Strukturformel: Kettenform: Meistens aber schließt sich die Glucose zu einem Ring zusammen. Ringform: ∝-D-Glc 𝜷-D-Glc Man kann die Ringform bisweilen vereinfachen: Trotz der Vereinfachung wird - ∝- und 𝜷 - Stellungausgedrückt Am C-Atom Nr. 4 die Stellung der Hydroxylguppe berücksichtigt. Dies ist nämlich wichtig für die Reaktion der Glucose zu Polysacchariden! zeichnen können! Seite 121 © Florian Zeller 07/08 2. Stärke, Glycogen, Cellulose (Polysaccharide) - Diese Polysaccharide sind aus lauter Glucosemolekülen zusammengesetzt. Die Glucosemoleküle verbinden sich durch Wasserabspaltung zwischen zwei Hydroxylgruppen: schematisch: … … = Verbindungsstück Stärke (= pflanzliches Reservekohlenhydrat) - AMYLOSE Tritt in der Natur in 2 Modifikationen auf: AMYLOPEKTIN Bau von Amylose a) ∝-D-1,4-glycosidisch verknüfte Glc-Moleküle (250 – 500) b) Es bilden sich unverzweigte, schraubenartige Ketten Bau von Amylopektin a) ∝-D-1,4 und ∝-D-1,6 glycosidisch verknüpfte Glc-Moleküle( > 2.000) ∝-1,6-glc-Bindung ∝-1,4-glc-Bindung b) Es bilden sich verzweigte, schraubenartige Ketten Verzweigungen mit ∝-1,6-glycosidische Bindungen unverzweigte Kette, lauter ∝-1,4-glycosidische Bindungen Seite 122 © Florian Zeller 07/08 Clycogen (= tierisches Reservekohlenhydrat) Bindungstypen (a), Raumstruktur und Verzweigungen (b) wie bei Amylopektin; Unterschied: viel mehr Glc-Moleküle (bis zu 100.000) und viel mehr Verzweigungen !! Cellulose (=pflanzliches Gerüstpolysaccharid) Baumaterial pflanzlicher Zellwände Wegen fädigem Bau verspinnbar z.B. Baumwolle, Flachs a) 𝛽-D-1,4-glycosidisch verknüpfte Glc-Moleküle ( > 10.000) Jedes zweite Molekül muss um 180° gedreht werden. b) Es bilden sich unverzweigte, fädige Ketten Anmerkung: Zum zeichnen reichen drei Moleküle aus!!! Stärkenachweis: Mit Jod-Kaliumiodidlösung I2,KI: (Reagenz im Reagenzglas Jod) Die Jodmoleküle lagern sich in die Stärkespiralen ein eine Einlagerungsverbindung (= Tunnelverbindung) entsteht. Tief blaue Färbung! Seite 123 © Florian Zeller 07/08 Pentosen D-Ribose ALDOSE 2-D-Desoxyribose ALDOSE D-Ribulose KETOSE Seite 124 © Florian Zeller 07/08 Triosen Glycerinaldehyd ALDOSE Dihydroxyaceton KETOSE Wichtige Zwischenprodukte des Zellstoffwechsels !!! Grundlagen des biologischen Energieumsatzes 1. Hauptsätze der Thermodynamik 1. Energieerhaltungssatz - Energie kann weder verlorengehen, noch aus dem Nichts entstehen - Energie und Arbeit sind einander gleichwertig (Energie ist die Fähigkeit, Arbeit zu leisten) - Verschiedene Energieformen können ineinander umgewandelt werden, z.B. ihre Energie kann in Notenpunkte umgewandelt werden, jahh, das geht!!! z.B. Wärmeenergie kann in mechanische oder Lichtenergie umgewandelt werden (Dampfmaschine, Kerzenflamme) Bei einer chemischen Reaktion kann nur die Energie abgegeben werden, die aus dem System der Reaktionspartner stammt, z.B. bei Explosionen wie Mehlstaubexplosion (V) oder Knallgasreaktion Knallgasreaktion: 2H2 + O2 2H2O ∆H < 0 hoher niedriger Energiegehalt Enthalpieänderung: ∆H < 0 = exotherme Reaktion ∆H > 0 = endotherme Reaktion Wie bei der Knallgasreaktion, so stellt bei vielen chemischen Reaktionen Wärme die einzig freiwerdende Energieform dar. Es liegt eine Änderung des Wärmeinhalts vor, eine sogenannte Enthalpieänderung ∆H. Das Streben nach minimalem Wärmeinhalt ist Eine Triebkraft chemischer Reaktionen! PRINZIP DES Eine weitere Triebkraft chemischer Reaktionen ist Das Streben nach maximaler Unordnung! PRINZIP DES ENTHALPIEMINIMUMS ENTHALPIEMAXIMUMS Entropie S = Maß für die unordnung Seite 125 © Florian Zeller 07/08 2. Entropiesatz Alle Prozesse laufen so ab, dass die Energie konstant bleibt oder zunimmt; die Gesamtentropie des Universums strebt auf ein Maximum zu! Festfrierversuch: Ba(OH)2 (f) + 2 NH4SCN (f) 2 NH3 (g) + 2 H2O (fl) + Ba(SCN)2 (gelöst) Sorten der Edukte: Anzahl der Moleküle: Aggregatzustände: 2 3 fest starre geometrische Form 3 5 gasförmig, flüssig, gelöst recht unordentlich Entropie nimmt zu !! (= streben nach Chaos) Deswegen läuft diese Reaktion freiwillig ab, obwohl der Wärmeinhalt des Systems, d.h. die Enthalpie zunimmt, wie wir es von einer Endothermen Reaktion kennen. Gibbs und Helmholtz fassten die Größen Enthalpie und Entropie zusammen: ∆G = Änderung der freien Enthalpie ∆H − Enthalpie T × ∆S Tem- Entropie peratur G = freie Enthalpie = Gipsche Energie G = Änderung der freien Enthalpie = Arbeitsfähigkeit einer chemischen Reaktion (G‘ unter physiologischen Standardbedingungen wie pH = 7,25°C, 1 molare Lösung…) ∆G < 0 exergonische Reaktion ∆G > 0 endergonische Reaktion Graphische Darstellung der Energieverhältnisse EA EA exergonisch endergonisch Seite 126 © Florian Zeller 07/08 Die Zelle ist ein offenes System Ständige Stoffaufnahme und Stoffausscheidung hält Zelle im Fließgleichgewicht. Beim Stoffabbau entstehen kleinere Moleküle, diese sind Bausteine für den Aufbau körpereigener Stoffe. Zur Bildung dieser Stoffe wird beim Stoffabbau freigesetzte Energie verbraucht. Chlorophyll haltige Zellen können als Energiequelle unmittelbar Lichtenergie benutzen und damit ___ aufbauen. Alle anderen Zellen bedürfen als Energiequellen der Zufuhr energiereicher organischer Stoffe. Seite 127 © Florian Zeller 07/08 2. Energiespeicherung und Energieübertragung in Organismen Chemisch gespeicherte Energie = bestehender Aufbau der Stoffe aus Atomen/Molekülen, bestehende Atombindungen Besonders wichtige energiereiche Verbindungen sind bestehende organische Phosphorsäureester: ATP, ADP PEP Adenosintriphosphat, Adenosindiphosphat GTP,GDP Guanosintriphosphat, Guanosindiphosphat Phosphoenolpyruvat (~ brenztraubensäure) Die hydrolytische Abspaltung einer Phosphatgruppe an bestehenden P-O-Bindungen führt zur Bereitstellung freier Enthalpie! Energiereiche Bindungen: Symbol ~ ; also z.B. P~O; Moleküle wird an dieser Stelle Unter Energiefreisetzung zerlegt. Beispiel: ATP: universeller biologischer Energiespeicher und –überträger, 1929 erstmals aus Muskelextrakt isoliert. Zusammensetzung von Adenosintriphosphat Adenin Ribose Adenosin – triphosphat (ATP) Adenosin – Energetische Koppelung endergonischer und exergonischer Reaktionen in Lebewesen Beispiel: Glycolyse Ausgerechnet der 1. Schritt der Glycolyse, die Umwandlung von Glucose in Glucose-6-phosphat, mag von selber nicht so recht, das Ankoppeln von Phosphat an die Glucose ist endergonisch: Glucose + ATP Glucose-6- P + H2O + ADP ∆G’ = +13 kJ/mol endergon Seite 128 © Florian Zeller 07/08 Dieser Schritt kann also nur gekoppelt mit einem energieliefernden, einem exergonischen Schritt ablaufen. Also wird er an die Hydrolyse von PEP gekoppelt, und diese ist exergonisch: PEP + H2O + ADP Gesamtbilanz: Brenztraubensre Glc + PEP Glc-6- P + ∆G‘ = -55 kJ/mol exergon ATP ∆G‘ = -43 kJ/mol exergon + BTS Wie man an den Teilschritten sehen kann, erfolgt die Koppelung der endergonischen mit der exergonischen Reaktion nicht direkt, sondern über das ATP-ADP-System! Bei der Spaltung eines ATP Moleküls (ATP ADP + P ) werden 30 kJ/mol freigesetzt!! Schematische Darstellung: Koppelung von Stoffwechselreaktion durch P-Gruppenübertragung durch das ATP/ADP – System: exergonisch ∆ G‘= -55 kJ/mol endergonisch exergonisch endergonsich ∆G‘ = +13 kJ/mol Gesamtbilanz solcher gekoppelter Reaktionen muss (schwach) exergonsich bleiben!!! Weiter Funktonen des ATP-ADP-Systems: ATP-Spaltung ohne P-Übertragung, dann wird ∆G’direkt in andere Energieformen umgewandelt, z.B. im Muskel in Bewegungsenergie. Universeller Energiespeicher der Lebewesen Universeller Überträger für freie Energie G, also Reaktionskoppelung (Phosphatgruppenübertragung), z.B. bei Glycolyse Energiespender und Umwandlung in andere Energieformen z.B. bei Muskelkontraktion Seite 129 © Florian Zeller 07/08 ENZYME Enzyme und Aktivierungsenergie (Versuch) Hydrolyse von Harnstoff e + H2O Urease Harnstoff 2 NH3 + CO2 Ammoniak Die Urease fungiert als Biokatalysator: Das sind Katalysatoren, die in Organismen gebildet werden und für die meisten Stoffwechselreaktionen in Lebewesen unentbehrlich sind. Man nennt sie ENZYME. Rolle des Katalysators: Erhöht die Reaktionsgeschwindigkeit einer chemischen Reaktion. Er ermöglicht einen günstigen Reaktionsweg mit herabgesetzter Aktivierungsenergie. Er geht selbst unverbraucht aus der Reaktion hervor. Energiediagramm ∆G [kJ/mol] EA ohne Enzym EA mit Enzym ∆G < 0 Bau der Enzyme reine Proteinenzyme (= Proteoenzyme) z.B. Urease ENZYME Proteidenzyme, bestehen aus Proteinanteil = Apoenzym Holoenzy + Nichtproteinanteil = prosthetische Gruppe Fest, nicht abtrennbar = Coenzym (Bsp. Katalase) leicht lösbar = Cosubstrat (Bsp. NAD, ATP) Seite 130 © Florian Zeller 07/08 Proteoenzym Proteidenzym mit prosthetischer Gruppe; nicht ablösbar = Coenzym Proteidenzym mit prosthetischer Gruppe; ablösbar = Cosubstrat Seite 131 © Florian Zeller 07/08 Modellvorstellung zur Enzymwirkung Enzym und Substrat passen zusammen wie Schlüssel und Schloss. Das Substrat passt also exakt ins aktive Zentrum bzw. in die Substratbindungsstelle des Enzyms. Bildung eines Enzym-Substrat-Komplexes nach dem Schlüssel-Schloss-Prinzip, EA wird herabgesetzt. Spezifität der Enzyme Substratspezifität: Ein Enzym setzt nur ein bestimmtes Substrat um, chemisch ähnliche Substanzen werden zwar gebunden ABER nicht umgesetzt! Beispiel Urease: Harnstoff Thioharnstoff Guanidin chemisch ähnliche Substanzen werden nicht umgesetzt Wirkungsspezifität: Ein Substratmolekül kann auf verschiedene Weise chemisch umgesetzt werden. Ein bestimmtes Enzym katalysiert aber jeweils nur eine der möglichen Reaktionen. Beispiel: Enzyme bei Gärungen: Seite 132 © Florian Zeller 07/08 Der Geschwindigkeitsbestimmende Schritt ist die Bildung von E 1S1 = Enzym-Substrat-Komplex. Absolute Spezifität = Substrat- und Wirkungsspezifität gekoppelt, d.h. es sind Enzyme die nur ein ganz bestimmtes Substrat in nur einer einzigen Reaktion umsetzten! Gruppenspezifität Diese Enzyme setzen Verbindungen mit gleichen funktionellen Gruppen um, z.B. Hydroxylgruppen R – OH oder Peptidbindungen oder Glycosiedische Bindungen. Benennung und Einteilung der Enzyme Enzymname mit absoluter Spezifität: - Name des Substrats: - Wirkung (Reaktionstyp): - Endsilbe: Enzymname Enzyme mit Gruppenspezifität: z.B. Clucose oxidieren -ase Glucoseoxidase anstelle des Substratnamens steht der Gruppenname oder der Name des Bindungstyps, + Endung -ase z.B. PEPTIDASE Enzyme, die ihr Substrat hydrolytisch spalten, erhalten den abgekürzten Substratnamen + Endung -ase Einteilung nach REAKTIONSTYP, den sie KATALYSIEREN: 1. Oxidoreduktasen: Enzyme der biologischen Oxidation und Reduktion 2. Transferasen: gruppenübertragende Enzyme 3. Hydrolasen: katalysieren hydrolytische Spaltungen 4. Isomerasen: katalysieren Isomerisierungen (= Umlagerungen innerhalb eines Moleküls) 5. Ligasen: knüpft unter Spaltung von ATP Bindungen 6. Decarboxylasen: spalten aus – COOH Kohlendioxid CO2 ab 7. Kinasen: übertragen P Seite 133 © Florian Zeller 07/08 Abhängigkeit der Enzymwirkung von Außen Von bestimmten Reaktionsbedingungen (Enzymaktivität = RG = Stoffumsatz/Zeit) a) Von der Temperatur Enzymatisch gesteuerte Reaktionen zeigen eine typische Temperaturabhängigkeit Unterer Temperaturbereich: RGT-Regel gültig: mit steigender Temperatur erhöht sich die RG (= Reaktionsgeschwindigkeit) der katalytischen Reaktion um das 2 – 3 fache pro 10° (nach van´t Hoff) Biologisches Optimum Höchste Enzymaktivität Höherer Temperaturbereich Hitzedenaturierung des Enzyms. Die katalytische Wirkung des Enzyms geht zunehmend verloren, da zunehmende Denaturierung des Proteinanteils (Quartär-, Tertiär- und sogar Sekundärstruktur verändert, wirkungslos) R6 sinkt. b) Vom pH-Wert Enzyme sind globuläre Proteine (kugelförmig), ihr räumlicher Bau (v.a. Tertiärstruktur) hängt z.B. von den ionischen Gruppen der am Aufbau beteiligten Aminosäuren Anzahl und Art der ionischen Ladungen hängen vom pH-Wert (H3O+, OH-) ab. Die einen liegen es alkalisch, die anderen werden erst im Sauren lustig. Wird der pH-Wert verändert, so wird dadurch das Verhältnis der H3O+-Ionen zu den OH--Ionen verändert, damit können Ionenbindungen, die die Tertiärstruktur stabilisieren, entladen werden und aufbrechen Funktionsverlust RG sinkt !! Seite 134 © Florian Zeller 07/08 c) Vom Ionenmilieu und anderen Stoffen Enzymvergiftung durch Schwermetallionen (z.B. Blei Pb2+, Kupfer Cu2+, Quecksilber Hg2+) Umweltgifte !! dauerhafte Änderung des räumlichen Baus der Enzyme, da die Eiweißmoleküle um die Schermetallionen Molekülaggregate bilden (reversibel nur bei geringer Konzentration) = Nicht kompetitive Hemmung Enzymwirkung kann durch sog. Aktivatoren heraufgesetzt werden, da diese den räumlichen Bau des Enzyms stabilisieren!! Bsp.: Ca2+-Ionen fördern Enzym zur Blutgerinnung. Enzymwirkung kann durch sog. Inhibitoren herabgesetzt werden, (Ionen oder andere Stoffe), hier unterscheiden wir zwei Fälle: Fall 1: kompetitive Hemmung = Verdrängungshemmung - Substrat und Hemmstoff konkurrieren um das aktive Zentrum, der Hemmstoff besitzt nämlich räumliche Ähnlichkeiten mit dem Substrat, kann sich also an das aktive Zentrum lagern, wird aber NICHT umgesetzt (Konkurrenz) !! - Reversibel durch Erhöhung der Substratkonzentration! - Sonderform der kompetitiven Hemmung: Substrathemmung: Ein zu großer Substratüberschuss kann hemmend wirken. Offensichtlich „rangeln“ dann mehrere Substratmoleküle ums aktive Zentrum, was die Umsetzung blockiert. Produkthemmung: Oft wirken Produkte enzymatisch gesteuerter Reaktionen ebenfalls als kompetitive Hemmstoffe auf das Enzym. Fall 2: allosterische Hemmung - Der Hemmstoff wird nicht am aktiven Zentrum, sondern an einer anderen Stelle des Enzyms = allosterisches Zentrum gebunden dadurch Veränderung des räumlichen Baus des Enzyms Substrat passt nicht mehr (so gut) in das aktive Zentrum und somit wird die Enzymwirkung herabgesetzt oder aufgehoben. - Reversibel, wenn der Hemmstoff aus dem Stoffgemisch entfernt werden kann. - Dieser Hemmmechanismus eignet sich gut zur Kontrolle von längeren Stoffwechselketten durch „Rückkoppelung“: (siehe auch Abb. 29.2.) Kontrolle längerer Stoffwechselketten durch Rückkoppelung Anmerkung: Durch die vielen zwischen A und H liegenden Reaktionsschritte ist das Produkt H so sehr verändert Worden, dass keine sog. einfache Produkthemmung mehr stattfinden kann. Seite 135 © Florian Zeller 07/08 Das Endprodukt H des letzten Reaktionsschrittes wirkt hier als allosterischer Hemmstoff auf das Enzym, welches den 1. Schritt der Stoffwechselkette katalysiert. Je mehr Endprodukt, desto geringer die Enzymaktivität von E 1. Es kommt zur Unterbrechung des Nachschubs. Wird aber das Endprodukt H durch Ausscheidung oder Abbau entfernt, so fällt seine Hemmwirkung auf das Ausgangsenzym E1 weg, die Reaktionen der Kette und die Herstellung des Endproduktes kommen wieder in Gang! Seite 136 © Florian Zeller 07/08 Hemmstoffe Kompetitive Hemmung. Mit der Aufklärung von immer mehr enzymatischen Reaktionen ergab sich, dass viele Enzyme mehrere, strukturell ähnliche Substrate umsetzen. Man spricht daher bei vielen Enzymen nicht mehr von Substratspezifität, sondern nur noch von Gruppenspezifität. Es kann auch der Fall eintreten, dass ein dem Substratmolekül chemisch ähnliches Molekül vom Enzymmolekül gebunden, jedoch nicht umgesetzt wird. Wie mit dem eigentlichen Substratmolekül bildet das Enzymmolekül ein Komplex: E + I ⇌ [ EI ] (I: Inhibitor) Dadurch wird das aktive Zentrum blockiert und die Enzymwirkung reversibel gehemmt. Man spricht hierbei von der Bildung eines Enzym-Inhibitorkomplexes (EI) und von einer kompetitiven Hemmung. Substrat- und Hemmstoffmoleküle konkurrieren um das aktive Zentrum, wobei das Ausmaß der Hemmung mit der Konzentration des Inhibitors steigt. In der Medizin werden solche Hemmstoffe eingesetzt, um bestimmte Reaktionen zurückzudrängen. So wird bei manchen Menschen zu viel Harnsäure gebildet, die sich in knorpeligen Geweben, z.B. der Gelenke ablagern kann, was zur Gicht führt. Harnsäure entsteht beim Abbau stickstoffhaltiger Verbindungen über das Zwischenprodukt Hypoxanthin unter dem Einfluss des Enzyms Xanthinoxidase. Mit dem Stoff Allopurinol wurde eine Verbindung gefunden, die dem Hypoxanthin sehr ähnlich ist und das Enzym Xanthinoxidase kompetitiv hemmt. Durch dosierte Zugabe kann somit die Bildung von Harnsäure vermindert werden. Gicht Nichtkompetitive (allosterische) Hemmung Bestimmte Enzyme werden von Verbindungen gehemmt, deren Moleküle keine Ähnlichkeit mit dem Substratmolekülen aufweisen. Es findet somit auch keine Konkurrenz um die Substratbindungsstellen, also das aktive Zentrum, statt. Vielmehr müssen solche Enzyme eine weitere Bindungsstelle besitzen, an der sich die Hemmstoffmoleküle anlagern können. Man bezeichnet diese Art der Hemmung als nichtkompetitive bzw. allosterische Hemmung. Durch die Anlagerung des Hemmstoffes wird die Struktur des Enzyms so verändert, dass keine Substratmoleküle mehr gebunden werden können. Diese Art der Hemmung spielt eine wichtige Rolle bei der Regulation des Stoffwechselgeschehens. In einer Reaktionskette kann ein Endprodukt das wirksame Enzym eines der ersten Schritte nichtkompetitiv hemmen. Häuft sich dieses Endprodukt zu stark an, so kommt es durch die Hemmung zu einer Drosselung des Nachschubs und erst beim Absinken der Konzentration löst sich das Endprodukt von der allosterischen Bindungsstelle und die Reaktion beginnt von neuem. Die Abhängigkeit der Enzymaktivität von der Substratkonzentration Die Geschwindigkeit v einer enzymkatalysierten Reaktion in Abhängigkeit von der Substratkonzentration = c (Substrat) kann in folgender Weise dargestellt werden: Seite 137 © Florian Zeller 07/08 Beachte: Enzymkonzentration ist konstant ! Reaktionsv geschwindigkeit = ∆𝐶 (𝐾𝑜𝑛𝑧𝑒𝑛𝑡𝑟𝑎𝑡𝑖𝑜𝑛 𝑑𝑒𝑠 𝑆𝑢𝑏𝑠𝑡𝑟𝑎𝑡𝑠 ) ∆𝑡 (𝑍𝑒𝑖𝑡 ) v vmax 1 2 vmax KM 1. 2. 3. 4. c (Substrat) [mol/l] Mit steigender c(Substrat) steigt auch die Zahl der umgesetzten Substratmoleküle Pro Zeiteinheit, also v. Bei weiterer steigender c(Substrat) nähert sich v asymptotisch an den Sättigungswert vmax an, bei dem alle Enzymmoleküle bereits besetzt sind. Eine weitere Steigerung von v ist durch eine Erhöhung der c(Substrat) nicht mehr zu erreichen!!! Im Gegenteil: Bei einer weiteren starken Erhöhung von c(Substrat) beginnen sich die Substratmoleküle an der Substratbindungsstelle gegenseitig zu behindern!!! v nimmt ab!!! SUBSTRATHEMMUNG Um die Aktivität eines Enzyms quantitativ zu erfassen, wäre es günstig, den Zahlenwert der c(Substrat) anzugeben, bei dem vmax erreicht wird. Dieser ist aber experimentell nur sehr ungenau zu ermitteln. (Siehe Kurve, gestrichelter Bereich auf der x-Achse) Genau zu ermitteln ist dagegen nur vmax. Um einen genaueren Zahlenwert für die Aktivität eines Enzyms angeben zu können, verwendet man die genau ermittel𝑣 bare c(Substrat) bei 𝑚𝑎𝑥 . 2 Michaelis-Konstante: c(Substrat bei 𝒗𝒎𝒂𝒙 Einheit: mol/l 𝟐 Die Michaelis Konstante KM ist ein Maß für die Substrataffinität eines Enzyms. Ein hoher Zahlenwert bedeutet eine geringere Affinität (flacher Kurvenlauf!) bzw. umgekehrt. Die Wechselzahl ist eine weitere Möglichkeit, die Aktivität eines Enzyms zu charakterisieren: Wechselzahl = Zahl der Substratmoleküle, die von einem Enzymmolekül pro Minute umgesetzt werden. (Normale Wechselzahlen liegen zwischen 1.000 und 10.000, die Katalase hat 5 x 106 !) Abhängigkeit der Enzymaktivität von der Substratkonzentration (für eine konstante Enzymmenge) RG RG vmax vmax 1 2 vmax 1 2 KM Substratkonzentration vmax KM Substratkonzentration Seite 138 © Florian Zeller 07/08