C 11 EuG Inhalt Komplexverbindungen Grundlagenkonzepte
Werbung

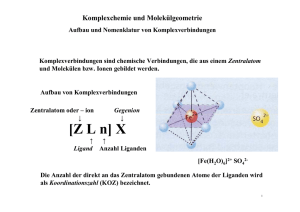
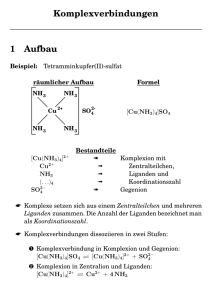
Komplexverbindungen C 11 EuG Inhalt Komplexverbindungen Grundlagenkonzepte Nebengrupenelemente 1 Atombau 1.1 Schalenmodell (Bohrsches Atommodell) 1.2 Orbitalmodell (Quantenmechanisches Atommodell) a) Orbitale b) Kästchenschema und Regeln zur Elektronenbesetzung c) Oxidationszahlen von Nebengruppenelementen (= Nebengruppenmetallen) 2 Metallbindung 2.1 Elektronengasmodell 3 Atombindung 4 Komplexbindung 4.1 Erweiterung der bisherigen Modellvorstellung zu Salzlösungen 4.2 Räumlicher Bau 4.3 Benennung a) Molekülkation oder neutrales Molekül b) Molekülanion 4.4 Bindungsverhältnisse 4.5 Bedeutung a) Medizin b) Nachweisreaktionen c) Biologie d) Technik: Auflösen schwerlöslicher Verbindungen 1 Komplexverbindungen Grundlagenkonzepte Bsp. 1: Unterscheidung von Stoffebene und Teilchenebene: Stoffebene: Ein farbloses Gas reagiert mit einem silbrigen Feststoff. Teilchenebene: Ein zweiatomiges Sauerstoffmolekül reagiert mit zwei Atomen Magnesium aus einem Metallgitter Bsp. 2: Unterscheidung von Beobachtung (B) und Folgerung (F): B: Stoffänderung mit Farb- und Zustandsänderung und Energieänderung auf Stoffebene F: Erklärung durch Änderung der chemischen Bindung und evtl. der zwischenmolekularen Kräfte auf Teilchenebene Bsp. 3: Unterscheidung zwischen qualitativen ("Wie?") und quantitativen ("Wieviel?") Fragestellungen: B (qualitativ): Farbänderung von Orange nach Grün => Mit den Sinnen wahrnehmbar! B (quantitativ): Die Masse eines Endstoffs beträgt 5 g => Mit Messgeräten messbar! Bsp. 4: Unterscheidung Säure-Base-Reaktionen und Redox-Reaktionen: Beide: Donator-Akzeptor-Reaktionen (korrespondierende Paare) S/B-Reakt: Protonenübertragung Redox-Reakt: Elektronenübertragung Bsp. 5: Unterscheidung zwischenmolekulare Kräfte und chemische Bindungen: Zwimol. Kr.: Van-der-Waals-Kräfte, Dipol-Dipol-Wechselwirkungen, Wasserstoffbrückenbindungen Grenzfälle: Ion-Dipol-Wechselwirkung (Hydrathülle!) 2 Komplexverbindungen Chem. Bdg.: Bsp. 6: Ion-Ion-Wechselwirkung in Salzschmelzen Ionenbindung (Ion-Ion-Wechselwirkung im Gitter), Atombindung (= Elektronenpaarbindung = Kovalente Bindung), je nach ∆EN unpolar oder polar neu: Komplexbindung (= koordinative Bindung = dative Bindung) neu: Metallbindung Lehrplanaufbau: Spiralcurriculum 9. Jgst.: Atombau (Hauptgruppen, Schalenmodell) - Ionenbindung - Redox Säure-Base 10. Jgst.: Atombau (Hauptgruppen, Schalenmodell) - Atombindung Zwischenmolekulare Kräfte - Säure-Base - Redox 11. Jgst.: Atombau (Nebengruppen, Orbitalmodell) - Metallbindung Atombindung (Orbitalmodell) - Komplexbindung - Säure-Base (quantitativ) - Redox (quantitativ) - Elektrochemie Vorteil: Ständige Wiederholung Nachteil: Langeweile, Gefahr von Lücken durch Abschaltens! Vorgehensweise: In jedem Kapitel erst schnelle Wiederholung, dann ausführlich Neues Erstes Halbjahr: Schwerpunkt Nebengruppenelemente Zweites Halbjahr: Schwerpunkt zusätzliche quantitative Aspekte: Chemische Gleichgewichte und Eletrochemie Empfehlung: Selbständige Wiederholung der Arbeitshefte unter: http://www.virtuelle-schule.net/net2/bcnt/ Atommodelle und Periodensystem, Ionenbindung in Salzen, Elektronenpaarbindung in molekularen Stoffen, Quantitative Aspekte, Protonenbergänge, Elektronenübergänge 3 Komplexverbindungen Nebengruppenelemente 1 Atombau 1.1 Schalenmodell (Bohrsches Atommodell) z. B. Elektronenkonfiguration (= Elektronenbesetzung) von 8O K-Schale: 2eL-Schale (Valenzschale): 6e- (Vgl. Hauptgruppennummer VI) z. B. Atomradienvergleich von F und Cl (zwei beliebige Elemente der gleichen Hauptgruppe) Cl > F Der Atomradius nimmt in einer Hauptgruppe von oben nach unten zu, da neue Schalen besetzt werden. z. B. Atomradienvergleich von 3Li und 4Be (zwei beliebige Elemente der gleichen Periode) Li > Be Der Atomradius nimmt in einer Periode von links nach rechts ab, da die Protonenzahl zunimmt und somit die Anziehung der Elektronen stärker wird. (Der gegenläufige Effekt der gegenseitigen Abstoßung der Elektronen einer Schale ist schwächer) Probleme: - Feinaufspaltung von Linienspektren nicht erklärbar - Unregelmäßigkeiten im Verlauf z. B. der Ionisierungsenergien nicht erklärbar - Elektronenkonfiguration von Elementen mit einer Protonenzahl > 20 nicht erklärbar (z. B. 35Br) - Einschränkung der Gültigkeit der Oktettregel nur für die Elemente der 2. Periode nicht erklärbar 4 Komplexverbindungen 1.2 Orbitalmodell (Quantenmechanisches Atommodell) a) Orbitale Die Schalen (= Hauptenergieniveaus) werden in Unterschalen (= Orbitale) unterteilt. Diese Unterteilung ergibt sich aufgrund von Symmetrieeigenschaften aus den möglichen Kombinationen von vier Quantenzahlen. Hauptquantenzahl n - bestimmt die Größe des Orbitals -n=1 => K-Schale n=2 => L-Schale - Werte: n = 1, 2, 3, ... Nebenquantenzahl l - bestimmt die Form des Orbitals -l=0 => s-Orbital (kugelförmig) l=1 => p-Orbital (hantelförmig) l=2 => d-Orbital (doppelt hantelförmig) l=3 => f-Orbital (vierfach hantelförmig) - Werte: l = 0, 1, 2, ... (n-1) Magnetische Quantenzahl m - bestimmt die Orientierung im Raum und die Anzahl - m = 0 => nur ein s-Orbital m = -1, 0, +1 => drei p-Orbitale m = -2, -1, 0, +1, +2 => fünf d-Orbitale m = -3, -2, -1, 0, +1, +2, +3 => sieben f-Orbitale 5 Komplexverbindungen - Werte: m = -l, (-l+1), ... , 0 , ... (+l-1),+l Spinquantenzahl ml - bestimmt die Ausrichtung des Elektrons - Werte: ml = +1/2, -1/2 b) Kästchenschema und Regeln zur Elektronenbesetzung z. B. AO(N) E ↑ ↑ ↑ 2px 2py 2pz Valenzelektronen ↑↓ 2s ↑↓ 1s oder in Kurzschreibweise: 1s2 [2s2 2p3] 6 Komplexverbindungen Hundsche Regel: Energiegleiche Orbitale werden zunächst einfach besetzt. (Ursache: Spinpaarungsenergie) falsch: ↑↓ ↑ Pauli-Verbot: Ein Elektron darf nicht in allen vier Quantenzahlen mit einem anderen übereinstimmen. (Folge: müssen zumindest entgegengesetzten Spin haben) falsch: ↑↑ Aufbauschema (nur für Atome, nicht unbedingt für Ionen!): Nach den 3p Orbitalen wird zunächst das 4s Orbital besetzt und erst dann die 3d Orbitale. Orbitaltyp s n p d f 1 1s 2 2s 2p 3 3s 3p 3d 4 4s 4p 4d 4f 5 5s 5p 5d 5f 6 6s 6p 6d 7 7s 7p 7 Komplexverbindungen z. B. Elektronenkonfiguration (alle!) von 22Ti als Kästchenschema: E ↑ ↑ 3d Valenzelektronen ↑↓ 4s ↑↓ ↑↓ ↑↓ 3p ↑↓ 3s ↑↓ ↑↓ ↑↓ 2p ↑↓ 2s ↑↓ 1s oder in Kurzschreibweise: 1s2 2s2 2p6 3s2 3p6 [4s2 3d2] 8 Komplexverbindungen 9 Ausnahmen: z. B. Cu (Kupfer) [3d10 4s1] z. B. Cr (Chrom) [3d5 4s1] => Leere, halb- oder vollbesetzte d Orbitale sind energetisch abgesenkt c) Oxidationszahlen von Nebengruppenelementen (= Nebengruppenmetallen) V Oxidationszahlen von Manganverbindungen D/B: Na2S2O 3-Lsg. (Natriumthiosulfat) verd. Salzsäure KMnO4-Lsg. (Kaliumpermanganat) NaOH-Lsg. Mn2+ (farblos) MnO2 (braun) MnO4- (violett) MnO43- (blau) MnO42- (grün) Gl: Red.: MnO4- + 5e- + 8H3O+ Red.: MnO4- + 3e- + 2H2O Red.: MnO4- + 2eRed.: MnO4- + e- F: - Bei Nebengruppen sind Abstände von +I möglich (Hauptgruppen meist +II) → → → → Mn2+ + 12H2O MnO2 + 4OHMnO43MnO42- Komplexverbindungen 10 Beispiele: Pb2+/Pb4+, S2-/S, SO2/SO3 vgl. mit Fe2+/Fe3+, Cu1+/Cu2+ - d-Elektronen werden leicht abgegeben => alle Nebengruppenelemente sind Nebengruppenmetalle Frage: Warum sind bei Mn die Oxidationsstufen +II und +VII besonders leicht zu erreichen? - Valenzelektronenkonfiguration im Grundzustand: [4s2 3d5] - in der Oxidationsstufe +II: [3d5 4s0] => Halb besetzte d-Orbitale sind energetisch günstig - in der Oxidationsstufe +VII: 3s2 3p6 [4s0 3d0] => Alle Valenzelektronen formal abgegeben, die ehemalige Valenzschale ist leer, die darunter liegende vollbesetzt. 2 Metallbindung 2.1 Elektronengasmodell Stoffebene Teilchenebene Elektronengasmodell A Feststoff B silbriger Glanz C gute elektrische Leitfähigkeit D Verformbarkeit Teilcheneigenschaften der einzelnen Metall-Atome - die Metallkationen(rümpfe)2 1 großer Atomradius A bilden ein regelmäßiges Gitter 2 niedrige Ionisierungsenergie und sind leicht verschiebbarD - die Valenzelektronen sind gleichmäßig dazwischen verteilt (delokalisiert) und leicht verschiebbarB, C Probleme: Halbleiter nicht erklärbar, dafür Bändermodell notwendig Komplexverbindungen 11 3 Atombindung (Ausblick für die 12. Jgst.) bisher: Schalenmodell neu: Orbitalmodell - die Valenzschalen überlappen - Atom-Orbitale (AO) überlappen, so dass Molekül-Orbitale (MO) entstehen - bindende Elektronenpaare in bindenden MolekülOrbitalen werden von beiden Kernen angezogen - je nach überlapendem Orbitaltyp und Orbitalrichtung wird zwischen σ und π-Bindung unterschieden. Aus diesen setzen sich dann die Doppel- und Dreifachbindungen zusammen. - der räumliche Bau richtet sich nach der Elektronenpaarabstoßung (EPA-Modell) - damit die Orbitale dazu passen, wird ab dreiatomigen Molekülen vorher ein mathematischer Trick angewandt, die sogenannte Hybridisierung - bindende Elektronenpaare werden von beiden Kernen angezogen - es entstehen Einfach-, Doppel- oder Dreifachbindungen - der räumliche Bau richtet sich nach der Elektronenpaarabstoßung (EPA-Modell) E Wasserstoff-Molekül (H2) K-Schale AO(H) MO(H2) AO(H) K-Schale ↑ ↑ 1s ↑↓ σ 1s eine (s-s)σ(H-H)-Bdg. Komplexverbindungen 12 z. B. Valenzelektronenkonfiguration von C als Kästchenschema: E AO(C) (Grundzustand) ↑ AO(C) (angeregter Zustand) ↑ ↑ ↑ ↑↓ 2s 2s AO(C) hybridisiert... ...für vier σ-Bdg.: ↑ 2sp3 ↑ 2p 2p E ↑ ↑ ↑ ↑ ...für drei σ- und eine π-Bdg.: ...für zwei σ- und zwei π-Bdg.: ↑ ↑ 2p 2p ↑ ↑ ↑ 2sp2 ...für Doppelbindung (grau) räumlicher Bau der Hybrid-Atom-Orbitale: tetraedrisch 109° trigonal planar 120° ↑ ↑ ↑ 2sp ...für Dreifachbindung (grau) linear 180° Komplexverbindungen 13 4 Komplexbindung 4.1 Erweiterung der bisherigen Modellvorstellung zu Salzlösungen V Maskierung von Eisen(III)-ionen durch Komplexbildung mit Fluorid-Ionen D/B: (2) KSCN-Lsg. KSCN-Lsg. (1) NaF-Lsg. FeCl3-Lsg. FeCl3-Lsg. I - Farbänderung von Gelb nach Rot F: I II II - (1) Entfärbung - (2) keine Rotfärbung Es findet eine Reaktion statt zwischen den hydratisierten Eisen(III)-ionen und den Thiocyanat-Ionen (1) Es findet eine Reaktion statt zwischen den hydratisierten Eisen(III)-ionen und den Fluorid-Ionen (2) Es findet keine Reaktion mehr statt zwischen den Eisen(III)-ionen und den Thiocyanat-Ionen Komplexverbindungen Gl: I + II - alte Vorstellung (einfache Hydratisierung): FeCl3 → Fe3+ + 3Cl- neue Vorstellung (Bildung eines Aquakomplexes): FeCl3 + 6H2O → [Fe(H2O)6]3+ + 3ClI - Ligandenaustauschreaktion: [Fe(H2O)6]3+ + 3SCN- → [Fe(H2O)3(SCN)3] + 3H2O II (1) Ligandenaustauschreaktion: [Fe(H2O)6]3+ + 6F→ [FeF6]3- + 6H2O (2) Maskierung: [FeF6]3- + 3SCN→ keine Reaktion, der Nachweis für Fe3+-Ionen ist negativ Komplexe sind Moleküle oder Molekülionen, die aus einem Zentralteilchen (Zentralatom oder Zentralion) und mehreren Liganden bestehen. Zwischen den Liganden und dem Zentralteilchen besteht eine Komplexbindung. Die Koordinationszahl gibt die Zahl der gebundenen Liganden an. 14 Komplexverbindungen 15 Schema I: K K+ N S- C + S- K+ K+ C N K K+ ClCl- + Cl- N S- C S 3+ C N ClFe3+ ClCl- SC S- Fe3+ S - C N Komplexverbindungen Schema II: 16 (1) (2) N S- C K+ N S- C K+ K+ N S- C K+ K+ K+ Na+ Na + F- Na+ F- Na+ Na+ Na+ Cl- Cl- Cl- Na N S- C Na+ Cl- + Cl- F- FF- Na+ Na+ Cl- Na+ N S- C FNa+ N S- C 3- 3+ 3- FCl- Na+ FNa+ Cl- Fe3+ Cl- Na + F Fe3+ F- F- Na+ FF - F Fe - F- 3+ Na+ - Na + F- FF- Komplexverbindungen 4.2 Räumlicher Bau Koordinationszahl Räumlicher Bau (Bindungswinkel) 2 linear (180°) 4 tetraedrisch (109°) quadratisch planar (90°) => selten 6 oktaedrisch (90°) 17 Beispiel [Ag(NH3)2]+ [CoCl4]2[Ni(CN)4]2[Fe(CN)6]4- 4.3 Benennung (Nomenklatur) a) Molekülkation oder neutrales Molekül: <Anzahl der Liganden><Art der Liganden><Zentralteilchen(de)><Oxidationszahl des Zentralteilchens> z. B. [Co(NH3)6]3+ Hexa-ammin-cobalt(III)-Ion z. B. [CoCl3(NH3)3] Tri-chloro-tri-ammin-cobalt(III) b) Molekülanion: <Anzahl der Liganden><Art der Liganden><Zentralteilchen(lat.)-at><Oxidationszahl des Zentralteilchens> z. B. [Fe(CN)6]4Hexa-cyano-ferrat(II)-Ion Komplexverbindungen 18 4.4 Bindungsverhältnisse V Lösen von Kupfer(II)-ionen durch Komplexbildung mit Ammin-Liganden D/B: NH3-Lsg. NaOH-Lsg. CuSO4-Lsg. Cu(OH)2-Niederschlag I F: Gl: - Entfärbung von hellblau nach farblos - weißer Niederschlag - Es entsteht schwerlösliches Kuper(II)-hydroxid II - Tiefblaufärbung - Niederschlag löst sich auf - Es entstehen lösliche Tetra-ammin-di-aqua-kupfer(II)-ionen I [Cu(H2O)6]2+ + 2OH- → Cu(OH)2↓ + 6H2O II Cu(OH)2 + 4NH3 + 2H2O → [Cu(NH3)4 (H2O)2]2+ + 2OH- Komplexverbindungen Schema: 19 I II N N N N H Na + Na+ H Na + O- O- H O2+ Na+ H OCu2+ Na+ 2- O 2+ 2- O- Na+ S O O- Cu2+ O- 2- O O S O O O- - H O- Cu2+ O- H S O O- Komplexverbindungen 20 Die freien Elektronenpaare der Liganden greifen an je einem unbesetzten Orbital des Zentralteilchens an und bilden eine Komplexbindung aus. Da hier beide Elektronen des bindenden Elektronenpaars von einem einem der Bindungspartner stammen (dem Ligand), nennt man diese besondere Form der Elektronenpaarbindung auch "Dative Bindung". Da die Liganden eindeutig einem Zentralteilchen zugeordnet werden können, bezeichnet man diese Bindung auch als "Koordinative Bindung". Die formale Ladung eines Atoms in einem Molekül oder einem Molekülion ergibt sich aus der Differenz der Hauptgruppennummer und der Summe der Valenzelektronenzahl nach einer formal homolytischen Bindungsspaltung. Die formale Ladung wird direkt am Atom in einem Kreis dargestellt. Die Summe der formalen Ladungen ergibt die Gesamtladung. Die Strukturformel wird in eckige Klammern geschrieben. Die echte Ladung (= Gesamtladung) wird außen an die eckige Klammer geschrieben. Nebengruppenelemente verhalten sich also einerseits wie Metalle, bilden andererseits aber auch wie Nichtmetalle Atombindungen aus und bilden Moleküle und Molekülionen. Auch Moleküle und Molekülionen aus mehreren Nichtmetallen sind eigentlich Komplexe: z. B. CO32Carbonation 2[CO3] Tri-oxo-carbonat(IV)-Ion 2SO4 Sulfation 2[SO4] Tetra-oxo-sulfat(VI)-Ion H2CO3 Kohlensäure [CO(OH)2] Di-hydroxo-(mono)-oxo-Kohlenstoff(IV) H2SO4 Schwefelsäure [SO2(OH)2] Di-hydroxo-di-oxo-Schwefel(VI) jedoch wird hier meist zur Vereinfachung die kürzere Schreibweise gewählt. Komplexverbindungen 21 4.5 Bedeutung a) Medizin - Schwermetallionen bilden mit Proteinen (z. B. Enzymen) Komplexe => hochgiftig! Therapie: Gabe von besonders starken, mehrbindigen (Chelat*-)Liganden *chelos(grch.)=Schere => lösliche Schwermetallkomplexe werden ausgeschieden - Cyanidionen bilden mit Enzymen welche an der Atmung beteiligt sind Komplexe=> hochgiftig! - Kohlenstoffmonoxid bildet mit Hämoglobin einen Komplex => Sauerstofftransport gestört b) Nachweisreaktionen - qualitativer Nachweis durch Farbänderung (z. B. [Fe(H2O)3(SCN)3] tiefrot) - quantitativer Nachweis durch Farbintensität (Absorption proportional zur Konzentration) oder durch Wiegen eines schwerlöslichen Feststoffs c) Biologie - Wasserenthärter in Waschmitteln binden als mehrzähnige Liganden Ca2+-Ionen => früher Eutrophierung durch (Poly)phosphate - Aktive Zentren von Enzymen enthalten häufig einen Komplex d) Technik: Auflösen schwerlöslicher Verbindungen - Goldgewinnung (Cyanidlaugerei) 1. Schritt (Redox, sehr schlecht): 4Au + O2 + 2H2O → 4Au+ + 4OH2. Schritt (Komplexbildung, sehr gut): Au + 2CN→ [Au(CN)2]- Fixieren (Auswaschen von überflüssigem AgBr nach der Belichtung) AgBr + 2S2O32→ [Ag(S2O3)2]3- + Br- Aluminium-Rohstoffgewinnung Al(OH)3 + OH→ [Al(OH)4]-








![ÜBERGANGSMETALLKOMPLEXE Na2[Fe(CN)5NO] ⋅ 2H2O](http://s1.studylibde.com/store/data/002682926_1-4994fab9e6ff9a7ce3deb92323ee5953-300x300.png)
