Boceprevir (Victrelis ) und Telaprevir (Incivo ) Die 2004 publizierte
Werbung
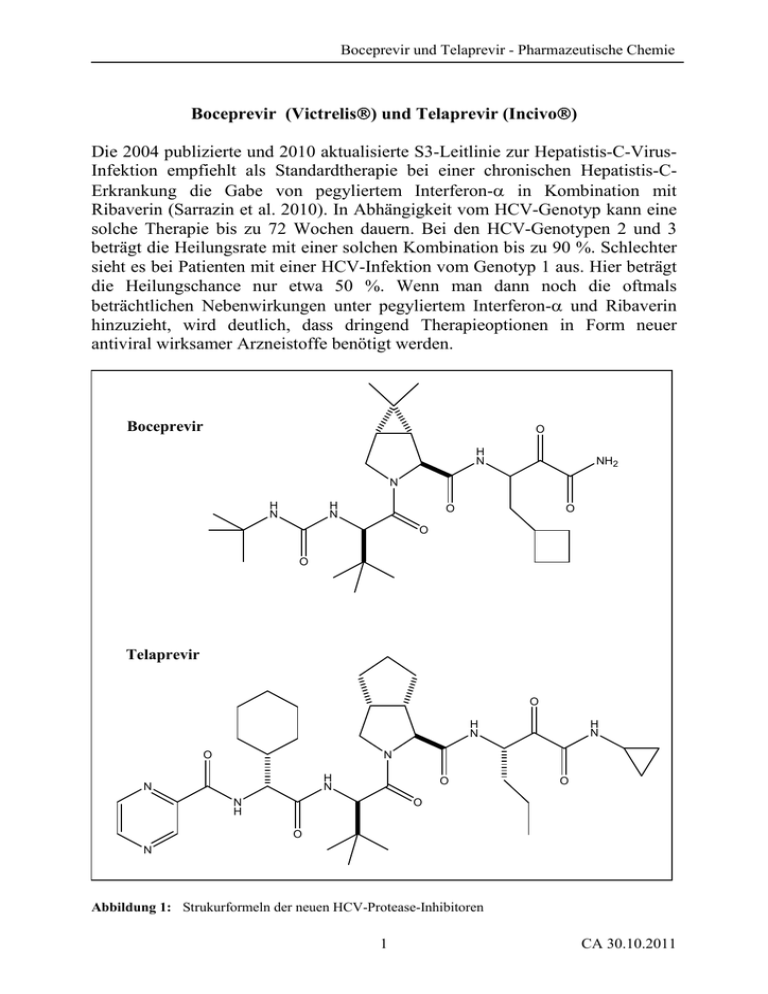
Boceprevir und Telaprevir - Pharmazeutische Chemie Boceprevir (Victrelis ) und Telaprevir (Incivo ) Die 2004 publizierte und 2010 aktualisierte S3-Leitlinie zur Hepatistis-C-VirusInfektion empfiehlt als Standardtherapie bei einer chronischen Hepatistis-CErkrankung die Gabe von pegyliertem Interferon-α in Kombination mit Ribaverin (Sarrazin et al. 2010). In Abhängigkeit vom HCV-Genotyp kann eine solche Therapie bis zu 72 Wochen dauern. Bei den HCV-Genotypen 2 und 3 beträgt die Heilungsrate mit einer solchen Kombination bis zu 90 %. Schlechter sieht es bei Patienten mit einer HCV-Infektion vom Genotyp 1 aus. Hier beträgt die Heilungschance nur etwa 50 %. Wenn man dann noch die oftmals beträchtlichen Nebenwirkungen unter pegyliertem Interferon-α und Ribaverin hinzuzieht, wird deutlich, dass dringend Therapieoptionen in Form neuer antiviral wirksamer Arzneistoffe benötigt werden. Boceprevir O H N NH2 N H N H N O O O O Telaprevir O H N O H N N H N N O N H O O O N Abbildung 1: Strukurformeln der neuen HCV-Protease-Inhibitoren 1 CA 30.10.2011 Boceprevir und Telaprevir - Pharmazeutische Chemie Mit Boceprevir (Victrelis) und Telaprevir (Incivo) (Strukturformeln s. Abbildung 1) stehen nun zwei neue direkt antiviral wirksame und peroral bioverfügbare Arzneistoffe in Kombination mit pegyliertem Interferon-α und Ribaverin zur Behandlung der chronischen HCV-Infektion vom Genotyp 1 zur Verfügung. Beide Arzneistoffe gehören zu den Protease-Inhibitoren, eine Arzneistoffklasse, die bislang lediglich bei der Therapie der HIV-Infektion bekannt war. Etablierte HIV-Protease-Hemmer sind beispielsweise Saquinavir, Indinavir und Ritonavir. Boceprevir und Telaprevir hemmen spezifisch die NS3/4A-Protease des HCV. Die NS3/4A-Protease spaltet das virale Vorläuferprotein in verschiedene strukturelle und nichtstrukturelle Proteine und ist somit essentiell für die Replikation des Virus (Pizzi et al. 1994). Zudem kann sie Substanzen innerhalb der Interferon-Signalkaskade spalten und ist in der Lage, die Aktivierung von Interferonen und Zytokinen und damit die körpereigene Immunantwort auf das HCV zu unterdrücken. (Lahm et al. 2002, Raney et al. 2010, Lange et al. 2011). Eine Hemmung dieser HCV-Protease verhindert somit sowohl die Replikation des Virus als auch die körpereigene Immunantwort und scheint demzufolge eine erfolgversprechende Therapieoption zu sein. Die Kristallstruktur des NS3-Proteins ist bekannt (u.a. Yao et al. 1999). Das NS3-Protein und das NS4A-Protein des HCV bilden einen nichtkovalenten Komplex, wobei das NS4A-Protein als Kofaktor fungiert. NS3 ist ein bifunktionelles Enzym. Das N-terminale Ende bildet eine Serinprotease und das C-terminale Ende eine RNS-abhängige NTPase/Helikase (Lahm et al. 2002). Das aktive Zentrum der NS3-Serinprotease wird entsprechend zu den humanen Serinproteasen (z.B. Chymotrypsin, Trypsin, Thrombin) durch eine katalytische Triade bestehend aus den Aminosäuren Serin, Histidin und Asparaginsäure gebildet (bei HCV: Ser-139, His-57, Asp-181) (Abbildung 2). Die Hydrolyse des viralen Vorläuferproteins wird durch einen nukleophilen Angriff der Hydroxylgruppe des Serins am Carbonyl-Kohlenstoff der zu spaltenden Peptidbindung eingeleitet. Das tetraedrische Intermediat ist negativ geladen und wird durch Wechselwirkungen in der Oxyanionentasche des Enzyms stabilisiert. Nach der Abspaltung des ersten Hydrolyseproduktes, des primären Amins, wird das acylierte Enzym mit Hilfe eines Wassermoleküls über ein weiteres anionisches Intermediat und unter Abspaltung des zweiten Hydrolyseproduktes, der Carbonsäure, regeneriert (Schirmeister und Welker 2009, Raney et al. 2010). Da der Hydrolysemechanismus der NS3-Serinprotease über kovalente Intermediate verläuft, entwickelte man auch kovalente Inhibitoren für dieses Enzym. Üblicherweise wird dabei die zu spaltende Amidbindung durch eine elektrophile Einheit ersetzt, die ein kovalentes Addukt mit dem Serinrest bildet. Substanzen, die diesen Bauplan aufweisen, werden als „transition-state analogues“ bzw. als „serine-trap inhibitors“ bezeichnet. Eine Vielzahl 2 CA 30.10.2011 Boceprevir und Telaprevir - Pharmazeutische Chemie elektrophiler Gruppen ist bislang zur Synthese von Inhibitoren dieser Serinprotease getestet worden, u.a. Aldehyde, Lactame, α-Ketosäuren und αKetoamide (Steinkühler et al. 2001, De Francesco et al. 2003). O R1 R2 N H O Peptidbindung Substrat O H N N H O Asp81 Ser139 2. Hydrolyseprodukt Carbonsäure OH R1 O His57 (1) R1 2. tetrahedrisches Intermediat H O O O H N H N O Ser139 O R1 N H O H R2 Asp81 1. tetrahedrisches Intermediat O His57 (4) N N H O Ser139 Asp81 O His57 (2) H2N R2 O H2O R1 1. Hydrolyseprodukt Amin H H O O N N H O Ser139 Asp81 O His57 (3) Abbildung 2: Hydrolysemechanismus der NS3-Serinprotease nach Raney et al. 2010 sowie Schirmeister und Welker 2009 3 CA 30.10.2011 Boceprevir und Telaprevir - Pharmazeutische Chemie Boceprevir und Telaprevir gehören zu den α-Ketoamiden (Abbildung 3). Beide Wirkstoffe sind kovalent-reversible Inhibitoren der NS3-Serinprotease. O H N Boceprevir NH 2 alpha-Ketoamid N H N H N O O O O Angriff der Hydroxylgruppe des Serin 139 an das C-Atom der alpha-Ketogruppe des Boceprevir O NH 2 alpha-Ketoamid O O H N H N O Asp 81 Ser139 O katalytische Triade der NS3-Serinprotease His 57 Zerfall des kovalenten Enzym-Inhibitor-Konjugates Bildung des kovalenten Enzym-Inhibitor-Konjugates O NH 2 O Ser139 O H N N H O Asp 81 O His57 kovalentes Enzym-Inhibitor-Konjugat Abbildung 3: Wirkungsmechanismus der kovalent-reversiblen NS3-Serinprotease-Hemmer mit α-Ketoamid-Partialstruktur 4 CA 30.10.2011 Boceprevir und Telaprevir - Pharmazeutische Chemie Durch einen nukleophilen Angriff der Hydroxylgruppe des Serin 139 innerhalb der katalytischen Triade von NS3 am Kohlenstoff der α-Ketogruppe von Boceprevir bzw. Telaprevir bildet sich ein kovalentes Enzym-InhibitorKonjugat, das ein tetraedrisches Kohlenstoffatom an der Verknüpfungsstelle besitzt. Dieses Konjugat entspricht quasi dem ersten tetraedrischen Intermediat, wenn das eigentliche Substrat hydrolisiert wird. Die Bildung des EnzymInhibitor-Konjugates ist reversibel, jedoch ist dieser Komplex ausreichend stabil, um das aktive Zentrum von NS3 effektiv zu blockieren. Für Telaprevir beträgt die Halbwertszeit des Enzym-Inhibitor-Komplexes ungefähr eine Stunde (Perni et al. 2006, Neyts 2006), für Boceprevir sogar 10 bis 20 Stunden (Malcolm et al. 2006). Obwohl es sich bei der NS3/4A-Protease um eine Serinprotease handelt, unterscheidet sich das aktive Zentrum doch deutlich von dem anderer Serinproteasen. Die NS3-Substratbindungstasche ist sehr flach, die eigentlich typischen Bindungstaschen fehlen, weshalb für die Bindung zahlreiche Wechselwirkungen benötigt werden (De Francesco und Migliaccio 2005). Die Spezifität für die passgenaue Bindung im aktiven Zentrum ergibt sich bei den beiden neuen Proteasehemmern durch ihren peptidomimetischen Molekülanteil. Die Bindungsstelle für Substrate in Proteasen liegt in einer Spalte. Nach Berger und Schechter ergibt sich für die einzelnen Aminosäuren sowie deren Bindungsstellen in der Spalte eine einheitliche Nomenklatur. Ausgehend von der zu spaltenden Peptidbindung werden die Aminosäurereste des Substrates zum N-terminalen Ende hin als P1, P2, P3, usw., die zum C-terminalen Ende hin als P1’, P2’, P3’, usw. bezeichnet. Die entsprechenden Bindungstaschen in der Spalte werden dementsprechend als S1, S2, S3, usw. zum N-terminalen Ende hin und als S1’, S2’, S3’, usw. zum C-terminalen Ende hin gekennzeichnet (Schechter und Berger 1967). Beide neuen Inhibitoren ähneln sich in ihrer Struktur und in der Ausfüllung der hydrophoben S1- bis S3-Taschen. Boceprevir ist ein P1- bis P3-peptidomimetischer Inhibitor. Telaprevir ist länger und füllt zusätzliche Taschen aus. Insbesondere der S1-Tasche wurde bei der Entwicklung von Boceprevir bzw. Telaprevir Aufmerksamkeit gewidmet. Das zu spaltende virale Vorläuferprotein, also das natürliche NS3-Substrat, enthält an dieser Position vorwiegend einen Cysteinrest, seltener einen Threoninrest (Pizzi et al. 1994, Steinkühler et al. 2001). An P1-Position der neuen Inhibitoren sitzen sich ähnelnde Aminosäuren mit lipohilen Resten: Boceprevir enthält dort eine Aminosäure mit einem Cyclobutylmethylrest („Cyclobutylalanin“), Telaprevir eine mit einem n-Propylrest („Ethylalanin“) (s. Abbildungen 4 und 5). Beide Inhibitoren besitzen an P1 ein chirales C-Atom. Das jeweilige (S)Diastereomer besitzt wesentlich höhere Aktivität als das entsprechende (R)Diastereomer (Venkatraman et al. 2010). Interessanterweise stellt Boceprevir hinsichtlich des chiralen C-Atoms dieser P1-Aminosäure ein Diastereomerengemisch dar, während Telaprevir kein Gemisch der zwei 5 CA 30.10.2011 Boceprevir und Telaprevir - Pharmazeutische Chemie möglichen Diastereomeren ist, sondern diastereomerenrein in Form des (S)Diastereomers verwendet wird. Unter physiologischen Bedingungen findet allerdings eine schnelle Epimerisierung statt, so dass die Verwendung des (S)Diastereomers wie beim Telaprevir keinen Vorteil gegenüber der Verwendung des Gemisches wie beim Boceprevir haben sollte. Telaprevir: N chirales C-Atom: Boceprevir: (R)- und (S)-Diastereomer Telaprevir: nur (S)-Diastereomer bizyklisches Prolin bei Boceprevir und Telaprevir bei Telaprevir längere Kette, mehr Taschen werden ausgefüllt: Boceprevir O N N O N H H N O (R,S) NH2 N H N H N O H O O Telaprevir: O H N Boceprevir: (R,S)-Cyclobutylalanin Telaprevir: (S)-Ethylalanin bei Boceprevir und Telaprevir identisch: tert.-Butylglycin (S) H Abbildung 4: Strukturvergleich Boceprevir und Telaprevir Die P2-Position nimmt in beiden Inhibitoren ein ähnlich substituiertes, sehr rigides, bizyklisches Prolin ein, die P3-Position ist wiederum in beiden Inhibitoren identisch besetzt mit einer Aminosäure, die einen tert.-Butylrest („tert.-Butylglycin“) trägt. 6 CA 30.10.2011 Boceprevir und Telaprevir - Pharmazeutische Chemie Boceprevir ist ein primäres, Telaprevir dagegen ein cyclopropyl-substituiertes sekundäres α-Ketoamid. Ein tertiäres α-Ketoamid dagegen ist nahezu unwirksam (Madison et al. 2008). zu spaltende Peptidbindung O virales Polypeptid N H S2 O Boceprevir H N NH2 N H N H N O O O O S1 S3 S2 Telaprevir O H N O H N N H N N O N H O O O N S1 S3 Abbildung 5: Bindung von Boceprevir und Telaprevir in den Taschen S1 bis S3 7 CA 30.10.2011 Boceprevir und Telaprevir - Pharmazeutische Chemie Zahlreiche weitere NS3/4A-Protease-Inhibitoren befinden sich derzeit in der Entwicklung. Da sich mit Boceprevir und Telaprevir die Struktur der αKetoamide als „serine-trap inhibitors“ etabliert hat, besitzen folglich auch die Nachfolgesubstanzen der zweiten Generation diese Partialstruktur. Ein vielversprechender Kandidat ist Narlaprevir (SCH 900518) (Tong et al. 2010). Auch diese Verbindung bildet über Serin 139 eine kovalente Bindung zur Serinprotease aus. Die Halbwertszeit dieses Komplexes beträgt ein bis zwei Stunden und liegt damit im Bereich von Telaprevir (Strukturformel s. Abbildung 6). wie bei Boceprevir wie bei Telaprevir O Narlaprevir H N H N N H N H N S O O O O O O neu wie bei Boceprevir/ Telaprevir, allerdings unterschiedliche Konfiguration am chiralen C-Atom Abbildung 6 1 C-Atom mehr als bei Telaprevir Kovalent-reversibler HCV-NS3-Inhibitor in der klinischen Entwicklung Sowohl die hohe Replikationsrate des Hepatitis-C-Virus als auch die Ungenauigkeit der HCV-Polymerase können zu Mutationen an verschiedenen Stellen der HCV-NS3-Protease und damit zu Resistenzen gegen die neu entwickelten NS3-Inhibitoren führen. Bei Boceprevir und Telaprevir wurden an verschiedenen Positionen Resistenzmutationen identifiziert, die natürlich während einer Therapie zu viralen Durchbrüchen führen können. Die Wahrscheinlichkeit des Auftretens solcher Mutationen mit entsprechenden viralen Durchbrüchen ist für eine Monotherapie größer als für eine Kombinationstherapie mit pegyliertem Interferon-α und Ribaverin (u.a. Welsch 8 CA 30.10.2011 Boceprevir und Telaprevir - Pharmazeutische Chemie et al. 2008, Sarrazin und Zeuzem 2010, Lange et al. 2011). Auch die sich derzeit in der klinischen Prüfung befindlichen Inhibitoren der zweiten Generation zeigen solche Resistenzen. O N N O NH Ciluprevir S O N H N O OH O O NH O O N N O TMC-435 S H N N O Abbildung 7: O O O S N H O Strukturformeln zweier nichtkovalenter NS3-Inhibitoren („product-based inhibitors“) 9 CA 30.10.2011 Boceprevir und Telaprevir - Pharmazeutische Chemie Parallel zur Entwicklung kovalent-reversibler Inhibitoren mit α-KetoamidPartialstruktur wird ein weiterer Weg verfolgt. Ausgehend von der Beobachtung, dass die N-terminalen Hydrolyseprodukte insbesondere durch die freie Carbonsäuregruppe des P1-Cysteins über Wechselwirkungen mit dem aktiven Zentrum eine sogenannte Produkt-Hemmung der NS3-Protease bewirken, sind in den letzten Jahren zahlreiche nichtkovalente Inhibitoren („product-based inhibitors“) mit P1-Carboxylgruppe synthetisiert worden. Der erste NS3-Inhibitor dieser Art, der in die klinische Prüfung gelangte, war Ciluprevir, dessen weitere Entwicklung aufgrund seiner Kardiotoxizität aber eingestellt wurde (Neyts 2006, Liu-Young und Kozal 2008). Mittlerweile befinden sich zahlreiche Nachfolgesubstanzen in der klinischen Prüfung wie zum Beispiel TMC-435 (Lenz et al. 2010) (Strukturformeln s. Abbildung 7). Strukturell weist die Klasse der reveriblen nichtkovalenten Inhibitoren keinerlei Gemeinsamkeiten mit den α-Ketoamiden auf. Es handelt sich wie im Fall von Ciluprevir entweder um peptidomimetische, makrozyklische Carbonsäuren oder aber wie bei TMC-435 um die entsprechenden bioisosteren Sulfonamide. Literatur: De Francesco, R. et al. Antiviral Res 2003, 58, 1 De Francesco, R. und Migliaccio, G. Nature 2005, 436, 953 Lahm, A. et al. Curr Drug Targets 2002, 3, 281 Lange, C.M. et al. Pharm Unserer Zeit 2011, 1, 60 Lenz, O. et al. Antimicrob Agents Chemother 2010, 54, 1878 Liu-Young, G. und Kozal, M.J. AIDS Patient Care STDS 2008. 22, 449 Madison, V. et al. J Synchotron Radiat 2008, 15, 204 Malcolm, B.A. et al. Antimicrob Agents Chemother 2006, 50, 1013 Neyts, J. Antiviral Res 2006, 71, 363 Perni, R.B. et al. Antimicrob Agents Chemother 2006, 50, 899 Pizzi, E. et al. Proc Natl Acad Sci 1994, 91, 888 Raney, K.D. et al. J Biol Chem 2010, 285, 22725 Sarrazin, C. et al. Z Gastroenterol 2010, 48, 289 Sarrazin, C. und Zeuzem, S. Gastroenterology 2010, 138, 447 Schechter, I. und Berger, A. Biochem Biophys Res Commun 1967, 27, 157 Schirmeister, T. und Welker, A. Pharm Unserer Zeit 2009, 6, 564 Steinkühler, C. et al. Curr Med Chem 2001, 8, 919 Tong, X. et al. Antimicrob Agents Chemother 2010, 54, 2365 Venkatraman, S. et al. Bioorg Med Chem Lett 2010, 20, 2151 Welsch et al. Genome Biol 2008, 23, 9 Yao, N. et al. Structure Fold Des 1999, 7, 1353 10 CA 30.10.2011