Die chemische Bindung - Fachrichtung Chemie TU Dresden
Werbung

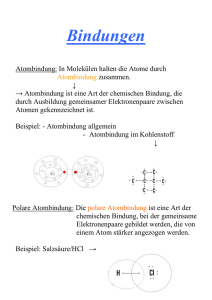
Fakultät Mathemathik/Naturwissenschaftensname, Professur für Anorganische Chemie I Brückenkurse Chemie Wintersemester 2015/2016 chemische Bindung, chemische Reaktionen, Reaktionsgleichungen und stöchiometrisches Rechnen Dr. rer. nat. Lars Borchardt Literaturempfehlungen Die chemische Bindung Die chemische Bindung Die chemische Bindung Atome Chemische Bindung Atombindung Moleküle Ionenbindung Metallbindung Zwischenmolekulare Kräfte van der WaalsBindung Makromoleküle Wasserstoffbrückenbindung intramolekular flüchtige Stoffe makromolekulare Stoffe Molekülgitter diamantartige Stoffe salzartige Stoffe Atomgitter Ionengitter intermolekular metallische Stoffe Metallgitter Molekülgitter Die chemische Bindung Atome Chemische Bindung Atombindung Moleküle Ionenbindung Metallbindung Zwischenmolekulare Kräfte van der WaalsBindung Makromoleküle Wasserstoffbrückenbindung intramolekular flüchtige Stoffe makromolekulare Stoffe Molekülgitter diamantartige Stoffe Atomgitter salzartige Stoffe Ionengitter intermolekular metallische Stoffe Metallgitter Molekülgitter Ionenbindung Ionenbindungen sind heteropolare Verknüpfungen von Elementen mit ausgeprägt metallischen und ausgeprägt nichtmetallischen Eigenschaften. z. B. NaCl: Na• + Cl → Na+ + Cl ‾ elektrostatische Anziehungskräfte zwischen positiv geladenen Kationen und negativ geladenen Anionen ungerichtete Kräfte, d.h. sie wirken in alle Raumrichtungen Ionengitter mit starken Bindungskräften Kristallgitter des NaCl ClNa+ Ionenbindung Ionenbildung am Beispiel Natriumfluorid Element Kernladungszahl Masse Radius (nm) Elektronenkonfiguration Gesamtladung Atom Na 11 23 0,186 1s22s22p63s1 0 Kation Na+ 11 23 0,095 1s22s22p6 +1 Atom F 9 19 0,064 1s22s22p5 0 9 19 0,136 1s22s22p6 -1 -e - +e Anion F - Ionenbindung Eigenschaften von Verbindungen mit Ionenbindung salzartiger Charakter relativ hohe Schmelz- und Siedetemperaturen: FP = 800 °C K P = 1440 °C leiten in wässriger Lösung und in der Schmelze den elektrischen Strom infolge Dissoziation in Ionen spröde Ionenbindung Spalten von NaCl-Kristallen Die chemische Bindung Atome Chemische Bindung Atombindung Moleküle Ionenbindung Metallbindung Zwischenmolekulare Kräfte van der WaalsBindung Makromoleküle Wasserstoffbrückenbindung intramolekular flüchtige Stoffe makromolekulare Stoffe Molekülgitter diamantartige Stoffe Atomgitter salzartige Stoffe Ionengitter intermolekular metallische Stoffe Metallgitter Molekülgitter Atombindung Atombindungen, auch als kovalente Bindungen bezeichnet, sind homöopolare Verknüpfungen von Atomen mit nichtmetallischen Eigenschaften. z.B. H2 Cl2 H∙ + ∙ H → H∙ ∙ H Cl ∙ + ∙ Cl → Cl ∙ ∙ Cl oder Cl bindendes Elektronenpaar Cl bindendes Elektronenpaar, das beiden Atomen gemeinsam gehört gerichtete starke Kräfte Atom- (starke) bzw. Molekülgitter (schwache Bindungskräfte) Atombindung Atombindungen, auch als kovalente Bindungen bezeichnet, sind homöopolare Verknüpfungen von Atomen mit nichtmetallischen Eigenschaften. → stabile Edelgaskonfiguration durch das bindende e- -Paar z.B. H2 N2 H 2O H H N N H O H 1s2 ≙ Heliumkonfiguration 2s2p6 ≙ Neonkonfiguration H: 1s2-Konfiguration O: 2s2p6-Konfiguration Atombindung z. B. E Kohlenstoff im Grundzustand, C zweibindig dieser Zustand ist instabil 1s2 E 2s2 2p2 Anregung (Promotion) Kohlenstoff im angeregten Zustand, C* vierbindig 1s2 2s1 2p3 Atombindung Atombindung Beispiel: Nitrat-Ion Polare Atombindung Atombindung und Ionenbindung sind ideale Grenzfälle; die realen Bindungsverhältnisse liegen oft dazwischen. z. B.HF δ+ H δ F δ+ δ- Übergänge zwischen den Bindungsarten + Ionenbindung + verzerrte Ionen polarisierte Atombindung Atombindung Atombindung VALENZBINDUNGSTHEORIE VB-Theorie MOLEKÜLORBITALTHEORIE MO-Theorie = Überlappung der Orbitale = einheitliches Elektronensystem => Elektronendichte zwischen den Kernen => Kombination von AO zu Molekülorbitalen Die chemische Bindung Atome Chemische Bindung Atombindung Moleküle Ionenbindung Metallbindung Wasserstoffbrückenbindung Makromoleküle intermolekular flüchtige Stoffe makromolekulare Stoffe Molekülgitter diamantartige Stoffe Atomgitter salzartige Stoffe Ionengitter metallische Stoffe Metallgitter Die metallische Bindung Die metallische Bindung K LM K L M Na + Na K LM Mg + Mg zwei Theorien: K L → Na2 ??? → Mg2 ??? M 1. Elektronengas - Modell 2. Energie- Bänder- Modell Die metallische Bindung Elektronengas - Modell Auf Metallgitterplätzen befinden sich positive Metallionenrümpfe, zwischen denen sich die Elektronen als freibewegliches Elektronengas befinden. Der Zusammenhalt erfolgt durch ungerichtete elektrostatische Anziehungskräfte. + + + + + + Elektron Ionenrumpf + + + Die metallische Bindung Energiebänder-Modell Metalldampf Metallkristall dichte Folge gleicher Energie-zustände Atomorbital Energieband der Atomorbitale im Metallkristall Die metallische Bindung Eigenschaften von Metallen gerichtete Bewegung des Elektronengases gute elektrische und thermische Leitfähigkeit Absorption und Reflexion von Licht aller Wellenlängen metallischer Glanz Undurchsichtigkeit kaum Strahlungsdurchlässigkeit Verschiebbarkeit der Gleitebenen gute mechanische Verformbarkeit (Duktilität) hohe Dichte Die metallische Bindung Plastische Verformbarkeit: Vergleich Metall - Ionenkristall Metalle Ionenkristalle Bindungskräfte bleiben erhalten gute mechanische Verformbarkeit es wirken Abstoßungskräfte Sprödigkeit Die chemische Bindung Atome Chemische Bindung Atombindung Moleküle Ionenbindung Zwischenmolekulare Kräfte van der WaalsBindung Makromoleküle Wasserstoffbrückenbindung intramolekular flüchtige Stoffe makromolekulare Stoffe Molekülgitter diamantartige Stoffe salzartige Stoffe Atomgitter Ionengitter intermolekular Molekülgitter Die zwischenmolekularen WW Van der Waals-Kräfte sind schwache, ungerichtete Anziehungskräfte zwischen Dipolen kommen zwischen allen Atomen, Ionen und Molekülen vor beeinflussen Gitterenergien und Bindungsenergien z. B. CO2 innerhalb des CO2-Moleküls: Atombindung zwischen den CO2Molekülen: van der Waals-Kräfte Molekülgitter Die zwischenmolekularen WW Wasserstoffbrückenbindungen - entstehen durch stark positiv polarisierte H- Atome, die an elektronegative Atome gebunden sind und mit anderen elektronegativen Partnern in Wechselwirkung treten - es entstehen dreidimensionale Netzwerke, die für den Molekülzusammenhalt verantwortlich sind - bewirken Abweichungen in charakteristischen Stoffeigenschaften Die zwischenmolekularen WW Die chemische Bindung Atome Chemische Bindung Atombindung Moleküle Ionenbindung salzartige Stoffe Metallbindung Zwischenmolekulare Kräfte van der WaalsBindung Wasserstoffbrückenbindung intramolekular intermolekular metallische Stoffe Koordinative Bindung Metallgitter Molekülgitter Koordinationsverbindungen bestehen aus einem Koordinationszentrum und einer Ligandenhülle zeigen spezifische Eigenschaften und Reaktionen Anzahl der Liganden (koordinierende Atome) = Koordinationszahl Koordinationszentrum (Zentralatom/-ion) Ligandenhülle Koordinationszahl (Koordinationspolyeder) Koordinationsverbindungen Koordinationsverbindungen Eigenschaften von Komplexverbindungen Farbe CuSO4 (hellblau) FeSO4 (hellgrün) → [Cu(NH3)4]2+ (tiefblau) → [Fe(CN)6]4- (gelb) Leitfähigkeit keine Dissoziation in Einzelionen; deshalb geringere Leitfähigkeit als der Summe der Einzelionen entspricht. Charakteristische Einzelreaktionen bleiben aus + Cl→ AgCl↓ Ag+ → keine Fällung [Ag(NH3)2]+ + ClMagnetisches Verhalten diamagnetisch (vorhandene d-Elektronen gepaart) paramagnetisch (ungepaarte d-Elektronen vorhanden) Koordinationsverbindungen Formeln, Oxidationszahlen und Mesomerie Formeln Oxidationszahlen ... gibt die elektrischen Ladungen an, die die Atome in Elementen oder Verbindungen besitzen würden, wenn man sich diese aus Ionen aufgebaut denkt. Beispiele Kohlenstoff (C) Verbindung CO2, CO, HCOOH C CH3OH CH4 Stickstoff (N) Oxidationszahl +4 +2 ±0 -2 -4 Verbindung HNO3 NO2 HNO2 NO N2O N2 NH2OH N2H4 NH3 Oxidationszahl +5 +4 +3 +2 +1 ±0 -1 -2 -3 eine positive Oxidationszahl kann nicht größer als die Gruppennummer sein die maximale negative Oxidationszahl ist gleich der Gruppennummer minus 8 Oxidationszahlen ±0 1. OZ eines Elementes ist immer Null ±0 ±0 H2 Cl2 Al 2. Fluor hat immer die OZ –1 3. in Ionenverbindungen entspricht OZ der Ionenladung; treten gebrochene Zahlen auf, liegen verschiedene OZ vor (Fe3O4: 2x +3, 1x +2 → +8) +1 -1 NaCl +1 -1 Li H +2 -2 Ca O +2/+3 -2 Fe3 O4 4. in kovalenten Verbindungen wird die Verbindung (gedanklich) in Ionen aufgeteilt, wobei die Bindungselektronen dem elektronegativeren Partner zugeteilt werden. Bei gleichen Bindungspartnern erhalten beide die Hälfte der Bindungselektronen. Mesomerie Mesomerie Isomerie …zwei oder mehreren chemischen Verbindungen mit gleicher Summenformel, die sich jedoch in der Verknüpfung oder der räumlichen Anordnung der Atome unterscheiden. unterscheiden sich in der Reihenfolge der Atome und Bindungen gleiche Konstitution, unterscheiden sich durch die räumliche Anordnung der Atome Chemische Reaktionen in der anorganischen Chemie Allgemeine Gesetzmäßigkeiten (Wiederholung) Chemische Grundgesetze Gesetz von der Erhaltung der Masse ∗ 1785 von LAVOSIER beschrieben Bei allen chemischen Vorgängen bleibt die Gesamtmasse der beteiligten Stoffe konstant oder m Ausgangsstoffe = m Endstoffe Chemische Grundgesetze 1 mol H2 1 mol H2 1 mol O2 + 4,04 Gramm 1 mol H2O 1 mol H2O = 32,0 Gramm mAusgangsstoffe = m Endstoffe 36,04 Gramm Chemische Grundgesetze Gesetz der konstanten Proportionen Proust 1799 Eine chemische Verbindung bildet sich immer aus konstanten Masseverhältnissen der Elemente z.B.: CO mC 12,011g 1g = = mO 15,999g 1,333g Chemische Grundgesetze Gesetz der multiplen Proportionen Dalton 1803 Bilden zwei Elemente mehrere Verbindungen miteinander, dann stehen die Massen desselben Elementes zueinander im Verhältnis kleiner ganzer Zahlen mO[ CO ] z.B.: CO/CO2 mO[ CO2 ] 15,999g 1 = = 2 ∙ 15,999g 2 Chemische Reaktionen Elementare Reaktionsmechanismen Dissoziation Lösung der alten Bindungen ohne Bildung einer neuen Bindung Assoziation Bildung neuer Bindungen ohne alte Bindungen zu lösen Anorganische Chemie Löslichkeit und Fällung Säure/Base-Reaktionen Reduktion, Oxidation, Redoxprozesse Komplexbildungsreaktionen Chemische Reaktionen Redoxreaktionen Fe-Blech und CuSO4-Kristall (H2O) Reiben Cu-Abscheidung Gesamtreaktion: Fe + Cu2+ → Cu + Fe2+ Chemische Reaktionen Redoxreaktionen Zn-Blech und CuSO4-Lösung Cu-Abscheidung Gesamtreaktion: Zn + Cu2+ Cu + Zn2+ Chemische Reaktionen Redoxreaktionen Galvanische Halbzellen Redoxreaktion zwischen Zn-Stab und CuSO4-Lösung ohne räumliche Trennung → Cu-Abscheidung auf Zn Teilreaktionen: Oxidation: Reduktion: Zn-Stab Zn Cu2+ + 2e- Gesamtreaktion: Cu2+ + Zn → Cu + Zn2+ → Zn2+ + 2e→ Cu Cu Cu2+ CuSO4-Lösung Zn2+ Chemische Reaktionen Die elektrochemische Spannungsreihe ... ist eine Ordnung der Redoxsysteme nach der Größe ihrer Standardpotentiale. reduzierte Form Redoxsystem → oxidierte Form +e- Mn2+ + 12H2O Au 6H2O 6H2O Ag Fe2+ 4OHCu H2 + 2H2O Pb Sn H2(g)+ 2OHFe Cr Zn H2(g)+ 2OHMn → MnO4-+ 8H3O+ → Au3+ → O2(g)+ 4H3O+ → O2(g)+ 4H3O+ → Ag+ → Fe3+ → O2(g)+ 2H2O → Cu2+ → 2H3O+ → Pb2+ → Sn2+ → 2H2O(l) + 2e→ Fe2+ → Cr3+ → Zn2+ → 2H2O(l) + 2e→ Mn2+ + 5e+ 3e+ 4e+ 4e+ e+ e+ 4e+ 2e+ 2e+ 2e+ 2e2e- + + 3e+ 2e+ 2e- E° in V +1,51 +1,50 +1,23 +0,81 +0,80 +0,77 +0,40 +0,34 0 -0,13 -0,14 -0,42 -0,44 -0,74 -0,76 -0,83 -1,19 pH-Wert 0 7 14 0 7 14 Chemische Reaktionen Das Redoxsystem mit dem negativeren Standardpotential ist immer der elektronenliefernde Vorgang. Beispiele: E°Cu > E°Zn → Reaktion läuft nicht ab Fe + Cu2+ → Fe2+ + Cu ° EFe < E°Cu → Reaktion läuft ab Pb + Fe2+ → Pb2+ + Fe ° ° EPb > EFe → Reaktion läuft nicht ab ° EI° < ECl → Reaktion läuft ab Cu + Zn2+ → Cu2+ + Zn 2I- + Cl2 → I2 + 2Cl- Chemische Reaktionen Säure-Base-Reaktionen Theorien Definition nach ARRHENIUS (1883) Säuren: Wasserstoffverbindungen, die bei Dissoziation H+-Ionen bilden Basen: Hydroxide, die bei Dissoziation OH--Ionen bilden Beispiele: HCl H2SO4 NaOH ⇌ H+ + Cl⇌ 2H+ + SO42⇌ Na+ + OH- Säuren reagieren mit Basen zu Salzen und Wasser (Neutralisation): H+ + Cl- + Na+ + OH- ⇌ Na+ + Cl- + H2O Chemische Reaktionen Säure-Base-Reaktionen Theorien Definition nach BRØNSTEDT und LOWRY (1923) Säuren: Stoffe, die H+- Ionen (Protonen) abgeben → Protonendonatoren Basen: Stoffe, die H+- Ionen aufnehmen → Protonenakzeptoren Beispiele: HCl Säure ⇌ H+ Proton NH3 + H+ ⇌ Base Proton + Clkonjugierte Base NH4+ konjugierte Säure Chemische Reaktionen Der pH-Wert Der pH-Wert ist der negative dekadische Logarithmus des Zahlenwertes der H3O+-Ionenkonzentration. pH = - lg c(H3O+) pH = 7 = 10-7 mol/l neutral pH < 7 > 10-7 mol/l sauer pH > 7 < 10-7 mol/l basisch destilliertes Wasser Leitungswasser (Dresden) Blut Magensaft Cola Milch pH = 7,0 pH = 6,5 pH = 7,4 pH = 0,9 - 1,6 pH = 2,0 - 3,0 pH = 6,5 Søren Sørensen Chemische Reaktionen pH-Skala und Indikatoren Neutralpunkt saurer Bereich 1 2 3 4 5 Methylorange 6 7 Lackmus 8 basischer Bereich 9 10 Thymolphthalein Phenolphthalein Bromkresolgrün Methylrot Tashiro 11 12 Chemische Reaktionen Umschlagfarben verschiedener Indikatoren H+ OH - Methylrot H+ OH - Tashiro H+ OH - Methylorange H+ OH - Universalindikator H+ OH - Phenolphthalein H+ OH - Bromkresolgrün Chemische Reaktionen Natürliche Indikatoren Beispiel: Cyanidin aus Rotkohl Farbänderung durch R. Boyle, 1660 1627-1691 stufenweise Deprotonierung R = Zuckerreste sauer basisch Chemische Reaktionen Vergleich zwischen S-B- und Redoxreaktionen S-B-Reaktionen Redoxreaktionen übertragene Teilchen H3O+-Ionen Elektronen Donator Säure Reduktionsmittel Akzeptor Base Oxidationsmittel Donatorstärke pH, pKS/B E, E° pH = pKS + lg c A cHA E = E° + 0,059 c Ox lg z cRe d Chemische Reaktionen Komplexbildungsreaktionen Koordinationsverbindungen bestehen aus einem Koordinationszentrum und einer Ligandenhülle zeigen spezifische Eigenschaften und Reaktionen Anzahl der Liganden (koordinierende Atome) = Koordinationszahl Koordinationszentrum (Zentralatom/-ion) Ligandenhülle Koordinationszahl (Koordinationspolyeder) Chemische Reaktionen Komplexbildungsreaktionen Bildung einer Komplexverbindung [Cu(H2O)6]2+ + 4 NH3 → [Cu(NH3)4]2+ + 6 H2O hellblau dunkelblau Chemische Reaktionen Komplexbildungsreaktionen Cyanidlaugerei: 4 Au + 8 KCN + O2 + H2O → 4 K[Au(CN)2] + 4 KOH 2 K[Au(CN)2] + Zn → K2[Zn(CN)4] + 2 Au Macraes Gold Mine Berliner Blau (Pariser Blau, Französischblau, Turnbulls Blau, Preußisch Blau, Chinesischblau, Tintenblau, … ) 4 Fe3+ + 3 K4[Fe(CN)6] → Fe4[Fe(CN)6]3 x H2O + 12 K+ Chemische Reaktionen Komplexbildungsreaktionen Bedeutung von Komplexen 1. Katalytische Prozesse REPPE-Synthese Anlagerung von R-OH, H2O und CO an Ethin mit Ni(CO)4 als Katalysator FISCHER-TROPSCH-Synthese Umsetzung von CO + H2 zu KW mit Fe bzw. Co als Katalysator 2. Biochemie Hämoglobin enthält Fe als Sauerstoffüberträger Vitamin B12 (Co-Komplex) 3. Analytik Komplexometrische Titration Gravimetrie 4. Metallherstellung Cyanidlaugerei Extraktion, Ionenaustausch Chemische Reaktionen Komplexbildungsreaktionen Anwendung: Komplexometrische Titration In der Praxis am häufigsten eingesetzt: Dinatriumsalz der Ethylendiamintetraessigsäure Kurzbezeichnung „Dinatrium-EDTA" (Na2[H2Y] oder [H2Y]2-) Handelsnamen: Komplexon III, Chelaplex III bzw. Titriplex III Reaktionsgleichungen Reaktionsgleichungen Beispiel: Stellen Sie die Reaktionsgleichung für die Neutralisationsreaktion von Aluminiumhydroxid mit Schwefelsäure auf, wobei Aluminiumsulfat und Wasser entstehen. Reaktionsgleichungen Beispiel: Stellen Sie die Reaktionsgleichung für die Neutralisationsreaktion von Aluminiumhydroxid mit Schwefelsäure auf, wobei Aluminiumsulfat und Wasser entstehen. Al(OH)3 + H2SO4 Al2(SO4)3 + H2O Reaktionsgleichungen Beispiel: Stellen Sie die Reaktionsgleichung für die Neutralisationsreaktion von Aluminiumhydroxid mit Schwefelsäure auf, wobei Aluminiumsulfat und Wasser entstehen. Al(OH)3 + H2SO4 Al2(SO4)3 + H2O 2 Al(OH)3 + 3 H2SO4 Al2(SO4)3 + 6 H2O Reaktionsgleichungen Reaktionsgleichungen 1. Ausgangs- und Endstoffe müssen bekannt sein z. B.: Bei der Auflösung von Kupfer in Salpetersäure entstehen Cu2+Ionen und Stickstoffmonoxid Cu + H3O+ + NO3- → Cu2+ + NO 2. Bestimmung der Oxidationszahlen aller beteiligten Elemente, Änderungen feststellen ±0 +1 -2 +5 -2 +2 +2 -2 Cu + H3O+ + NO3- → Cu2+ + NO Änderung: Cu: ±0 → +2, N: +5 → +2 3. Aufstellen von Teilgleichungen für Oxidation und Reduktion Oxidation: Elektronenabgabe, Anstieg der OZ Cu → Cu2+ + 2eReduktion: Elektronenzunahme, Reduzierung der OZ NO3- + 3e- → NO Reaktionsgleichungen 4. Ladungsausgleich herstellen (bei Reaktionen im sauren Medium durch H3O+Ionen, im basischen durch OH--Ionen) NO3- + 4 H3O+ + 3 e- → NO 5. Stoffbilanz aufstellen (auf beiden Seiten der Gleichung müssen die gleiche Anzahl Atome vorhanden sein; Ausgleich durch H2O) NO3- + 4 H3O+ + 3 e- → NO + 6 H2O 6. Ausgleich der ausgetauschten Elektronen Ox.: Cu → Cu2+ Red.: NO3- + 4 H3O+ + 3 e→ NO Ox.: 3Cu → 3 Cu2+ Red.: 2 NO3- + 8 H3O+ + 6 e→ 2 NO + 2 e+ 6 H2O + 6 e+ 12 H2O 7. Kombination der Teilgleichungen beider Redoxpaare 3 Cu + 2 NO3- + 8 H3O+ → 3 Cu2+ + 2 NO + 12 H2O | ·3 | ·2 Reaktionsgleichungen 1) Bestimmen Sie die Koeffizienten in folgenden Bruttoreaktionsgleichungen: KMnO4 + HCl KCl + MnCl2 + Cl2 + H2O Na3SbS4 + HCl Sb2S5 + H2S + NaCl NaOH + PCl5 NaCl + Na4P2O7 + H2O C6H6 + O2 CO2 + H2O Reaktionsgleichungen 2) Phosphor wird durch erhitzen von Tricalciumphosphat (Apatit) mit Siliciumdioxid (Quarzsand) und Kohlenstoff hergestellt. Stellen Sie die Reaktionsgleichung auf, wenn Calciumsilikat und Kohlenstoffmonoxid als Nebenprodukte erhalten werden! 3) Stellen Sie die Reaktionsgleichung für den explosionsartigen Zerfall von Glycerintrinitrat C3H5(NO3)3 auf, wenn sich dabei Kohlenstoffdioxid, Wasser, Stickstoff und Sauerstoff bilden! Der Molbegriff 1.) Stoffmenge Mol … Stoffmenge eines Systems, das aus ebenso vielen Einzelteilchen besteht, wie Atome in 12g des Kohlenstoffnuklides 12C enthalten sind. 1 Mol enthält NA (NA = Avogadro-Konstante = 6,022∙1023 ) Teilchen. n(X)/mol = m(X)/g M(X)/g· mol-1 Masse des Stoffes X molare Masse des Stoffes X 2.) Molare Masse M(X) Beispiel: H2O 2 · relative Atommasse von H 1 · relative Atommasse von O =2· =1· 1,008 15,999 relative Molekülmasse von H2O molare Masse M(H2O) = = 18,015 18,015 g/mol ____________________________________________________________________________________________________________________________ Mengen- und Gehaltsangaben 3.) Anteile Massenanteil ωi = mi (•100%) Σmi Volumenanteil φi = Vi (•100%) ΣVi Stoffmengenanteil χi = ni (•100%) Σni Äquivalent: Bruchteil 1/z* eines Teilchens X Äquivalentstoffmenge n( 1 X) = z * n(X) z* 4.) typische Angaben für Spurenbestandteile ppm (parts per million) ppb (parts per billion) ppt (parts per trillion) 1 : 106 1 : 109 1 : 1012 [μg/g, mg/kg] [ng/g, μg/kg] [pg/g, ng/kg] Mengen- und Konzentrationsangaben 5.) Konzentration Massenkonzentration Masse des Stoffes X/g Gesamtvolumen/l ß(X)/g/l = m(X)/g V/l Stoffmengenkonzentration Stoffmenge des Stoffes X/mol Gesamtvolumen/l c(X)/mol/l = n(X)/mol V/l Volumenkonzentration Volumen des Stoffes X/ml Gesamtvolumen/l σ(X)/ml/l = V(X)/ml V/l Stöchiometrisches Rechnen 1) Die Analyse von Kaliumpermanganat KMnO4 ergibt einen Massenanteil von ω(K) = 24,74 % Kalium und ω(Mn) = 34,76 % Mangan, der Rest ist Sauerstoff. Berechnen Sie die relative Atommasse von Mangan! 2) Das Element Chlor mit der mittleren relativen Atommasse AR = 35,453 besteht in der Natur aus einem Gemisch der Isotope mit den relativen Atommassen AR(35Cl) = 34,97 und AR(36Cl) = 36,97. Berechnen Sie die prozentualen Massenanteile dieser beiden Isotope im Isotopengemisch! 3) Die Formel des Kaliumsulfates ist K2SO4. Berechnen Sie a) wie viel g der drei Elemente in 1 g Kaliumsulfat enthalten sind; b) die Massenanteile der in Kaliumsulfat enthaltenen Elemente in %; c) wie viel g Kalium in 20 g einer Lösung von Kaliumsulfat mit 10 % Massenanteil enthalten sind; d) Die Masse des Sauerstoffs in 1 t technischem Kaliumsulfat, das einen Massenanteil von 98 % reinen Kaliumsulfats hat. Stöchiometrisches Rechnen 4) 1,63 g Chromoxid ergeben bei der Analyse 1,12 g Chrom. Berechnen Sie die Formel des Chromoxids! 5) Die Formel von Magnesiumdiphosphat lautet Mg2P2O7. Berechnen Sie die Massenanteile in % für a) die in dieser Verbindung enthaltenen Elemente b) die in dieser Verbindung enthaltenen Elementoxide MgO und P2O5. 6) Wie viel g festes Eisen(III)-chlorid lassen sich aus 75 g Eisen(III)-oxid durch chemische Umsetzung mit Salzsäure herstellen? 7) Wie viel g metallisches Antimon könne im günstigsten Fall aus 1 kg Sb2O3 mit einem Massenanteil von 90 % gewonnen werden? 8) Aus 100 kg Kochsalz erhält man bei der Umsetzung nach dem Sodaverfahren von LeBlanc 72 kg wasserfreie Soda. Berechnen Sie die Produktausbeute in %! Stöchiometrisches Rechnen 9) Wie viel ml Ammoniaklösung mit 25 % Massenanteil und einer Dichte von 0,907 g/ml sind zur Präparation folgender Lösungen notwendig: a) 2 l Lösung der Konzentration 0,1 mol/l b) 250 g Lösung mit 5 % Massenanteil. 10) 10 g kristallwasserhaltiges Kupfersulfat CuSO4 * 5 H2O werden in 100 g Wasser gelöst. Berechnen Sie den Massenanteil des kristallwasserfreien Salzes in der Lösung in % und die Molalität der Lösung!