redox-reaktionen
Werbung

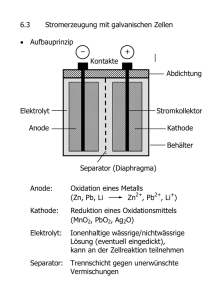
3.5 3.5.1 REDOX-REAKTIONEN --------------------------------------------------------------------------------------------------------- 138 Definitionen Aufstellung von Reaktionsgleichungen für Redoxreaktionen 139 3.5.2 3.5.2.1 3.5.2.2 3.5.2.3 Oxidationszahl Regeln für die Erstellung von Oxidationszahlen Die Chemie des Swimmingpools Drill&Practice: Oxidationszahlen 141 142 143 3.5.3 3.5.3.1 3.5.3.2 RedoxRedox-Gleichgewichte Redoxreihe Drill&Practice: Redox-Gleichgewichtslagen 143 145 3.5.4 3.5.4.1 3.5.4.2 Korrosion von Metallen Säurekorrosion Sauerstoffkorrosion Rosten von Eisen: Sauerstoffkorrosion Drill&Practice: Korrosionen 146 147 148 149 Chem. zu elektr. Energie: Galvanische Elemente Galvanische Elemente Daniell-Element Standardwasserstoffhalbzelle Lokalelemente Lochfrasskorrosion Korrosionsschutz Opferanode Drill&Practice: Galvanische Elemente und Lokalelemente Batterien Toxikologie von Quecksilber, Cadmium und Blei Typen galvanischer Zellen Leclanché-Element Alkaline Batterie Zink-Luft-Batterie Lithium-Batterie Silberoxid-Knopfzelle 150 150 151 152 153 153 153 155 156 156 157 158 158 159 159 159 3.5.6 3.5.6.1 3.5.6.2 3.5.6.3 3.5.6.4 Akkumulatoren Blei-Akkumulator Nickel-Cadmium-Akkumulator Nickel-Metallhydrid-Akkumulator Lithium-Ionen-Akkumulator 160 162 162 163 3.5.7 3.5.7.1 Brennstoffzellen Drill&Practice: Batterien 165 3.5.8 3.5.8.1 Elektrische zu chemische Energie: Elektrolyse Elektrolyse einer Na2SO4-Lösung 167 3.5.8.2 Aluminium und Alu-Recycling Aluminium und Getränkedosen 168 169 3.5.4.3 3.5.5 3.5.5.1 3.5.5.2 3.5.5.3 3.5.5.4 138 141 143 146 150 160 164 166 KME 138 Definitionen 3.5 3.5.1 Redox-Reaktionen Definitionen Redoxreaktionen sind Elektronenübertragungsreaktionen. Säure-Base-Reaktionen sind Protonenübertragungsreaktionen. Es handelt sich hier also um eine ganz neue Reaktionsklasse mit eigenen Gesetzmässigkeiten aber auch vielen Parallelen zu Säure-Base-Reaktionen. Typische Redox-Reaktionen Die Fotosynthese, also die Reaktion von Kohlenstoffdioxid und Wasser zu Glucose und Sauerstoff nach 6 CO2(g) + 6 H2O(l) C6H12O6(s) + 6 O2(g) lässt sich bekanntlich in Primärvorgänge (Umwandlung von Lichtenergie in chemische Energie) und Sekundärvorgänge (Synthese von Glucose aus CO2 und H2O) unterteilen. Die Umwandlung von Lichtenergie in chemische Energie (ATP) in der Membran der Chloroplasten beginnt mit der Reaktion von Wasser zu Sauerstoff und 4 Protonen. Die freiwerdenden Elektronen werden von der einen Seite der Membran zur anderen über eine recht komplizierte Kette von Proteinen weitergereicht. Es handelt sich dabei also um eine Elektronenübertragungsreaktion. Zur Klärung von Gesetzmässigkeiten bei Elektronenübertragungsreaktionen ist dieses System viel zu komplex. Ausserdem lassen sich nur schlecht Experimente gestalten. Daher ist es sinnvoll einen Schritt zurückzugehen und 2 Reaktionen mit Magnesiummetall zu besprechen. e- e- Definitionen KME 139 Redoxreaktionen sind Elektronenübertragungsreaktionen. Elektronenabgabe Prozess Oxidation Gibt ein Teilchen Elektronen ab, spricht man davon, dass es Oxidation werden oxidiert wird. Elektronen obdachlos. Bei der Elektronenaufnahme Reduktion werden Nimmt ein Teilchen Elektronen auf, so wird es reduziert. Elektronen rangeholt. Bei der Oxidationsmittel Elektronenakzeptoren Stoffe, die andere Stoffe oxidieren, bezeichnet man als Oxidationsmittel. Da sie von den anderen Stoffen zwangsläufig Elektronen aufnehmen, werden sie selbst reduziert. Reduktionsmittel Elektronendonatoren Stoffe, die andere Stoffe reduzieren, bezeichnet man als Reduktionsmittel. Da sie zwangsläufig an die anderen Stoffe Elektronen abgeben, werden sie selbst oxidiert. Stoff Reduktion Aufstellung von Reaktionsgleichungen für Redoxreaktionen Reaktion: Salzsäurelösung (HCl-Gas in H2O) mit Magnesium(-metall) Beobachtung: 1. Was sind die Ausgangsstoffe? Welche Teilchen befinden sich in der Lösung? Welche sind für die Reaktion relevant und welche sind nur Zuschauer? 2. Aufstellen der 1. Teilreaktion (Oxidation) mit Hilfe der Redoxtabelle. Ohne Redoxtabelle geht gar nichts. Die Redoxtabelle von links nach rechts gelesen entspricht einer Oxidation. 3. Berechnung der Anzahl der abgegebenen Elektronen. Die Summe der Gesamtladung aller Teilchen auf der linken Seite der Reaktionsgleichung ist gleich der Summe der Gesamtladung der Teilchen auf der rechten Seite. Bei der Oxidation schreibt man damit zwangsläufig „+ e-„ auf der rechten Seite der Reaktionsgleichung. 4. Aufstellen der 2. Teilreaktion (Reduktion) mit Hilfe der Redoxtabelle. Wird die Redoxtabelle von rechts nach links gelesen, entspricht das einer Reduktion. Da die Edukte in einer Reaktionsgleichung immer auf der linken Seite stehen, wird der Ausdruck aus der Redoxtabelle für die Reaktionsgleichung gewendet. KME 140 Definitionen 5. Berechnung der Anzahl der aufgenommenen Elektronen. Die Summe der Gesamtladung aller Teilchen auf der linken Seite der Reaktionsgleichung ist gleich der Summe der Gesamtladung der Teilchen auf der rechten Seite. Bei der Reduktion schreibt man damit zwangsläufig + e- auf der linken Seite der Reaktionsgleichung. 6. Aufstellen der Gesamtreaktion. Da es immer jemanden braucht, der etwas gibt und jemanden der etwas nimmt muss bei Elektronenübertagungsreaktionen die Anzahl der abgegebenen und aufgenommenen Elektronen gleich sein. Sollte dies nicht der Fall sein, wird das KGV (kleinste gemeinsame Vielfache) gesucht. Dies ist dann die Anzahl der gesamthaftig übertragenen Elektronen. Für die Gesamtreaktion werden die Teilgleichungen mathematisch addiert. Die Elektronen müssen sich herauskürzen. 7. Eine Redoxgleichung hat mindestens 2 Oxidationsmittel (Elektronenakzeptoren) und 2 Reduktionsmittel (Elektronendonatoren). Dies lässt sich in der Gesamtgleichung notieren. Ausserdem gibt es mindestens 2 Redoxpaare, ähnlich den korrespondierenden Säure-Base-Paaren. Zusätzlich lässt sich auf beiden Seiten der Gleichung die Elektronenübertragung einzeichnen. Aufstellung von Reaktionsgleichungen für Redoxreaktionen Aluminium + Brom gibt Aluminiumbromid Magnesium + Sauerstoff gibt Magnesiumoxid Beobachtung: Beobachtung: Reaktionsgleichung: Wer ist das OM, wer das RM. Wie viele e- werden übertragen? Reaktionsgleichung: Wer ist das OM, wer das RM. Wie viele e- werden übertragen? KME 141 Oxidationszahl 3.5.2 Oxidationszahl Die Oxidationszahlen geben Auskunft darüber, ob es sich bei einer x-beliebigen Reaktion um eine Redox-Reaktion handelt oder nicht. 3.5.2.1 Regeln für die Erstellung von Oxidationszahlen Die Oxidationszahl ist eine Art imaginäre Ladung eines Atoms. Sie dient zur Elektronen-Buchführung. Ändert sich die Oxidationszahl im Laufe der Reaktion, so handelt es sich um eine Redoxreaktion. Erhöht sich bei einer Reaktion die Oxidationszahl eines Teilchens, so handelt es sich um eine Oxidation, wird sie erniedrigt, handelt es sich um eine Reduktion. 1. Die Oxidationszahlen werden für jedes Atom aufgrund der Elektronegativität (EN) kalkuliert. 2. Oxidationszahlen werden mit römischen Ziffern bezeichnet. Die Vorgehensweise wird am Beispiel Alkohol Aldehyd Carbonsäure erläutert: a. Grundlage ist die Strukturzeichnung. b. Die Elektronen werden aufgrund der EN dem jeweils elektronegativerem Atom vollständig zugeordnet. Bei gleichen Atomen wird die Bindung in der Mitte geteilt. c. Die Anzahl der so zugeordneten e- wird pro Atom addiert und mit der Anzahl der Valenzelektronen des Atoms verglichen. Ist die errechnete Anzahl der e- grösser als die Valenzelektronenanzahl, so hat die Oxidationszahl ein negatives Vorzeichen, ist sie kleiner ein positives. d. Der Vergleich der Oxidationszahlen der Edukte und Produkte zeigt, welches Atom überhaupt oxidiert oder reduziert wird. Alkohol Propanol CH3-CH2-CH2 -OH Aldehyd Propanal CH3-CH2-CHO Carbonsäure Propansäure CH3-CH2-COOH H H C H H C H H O C H H H H O C C C H H H H H H H H O C C C H Das C1 ändert bei diesem Vorgang die Oxidationzahl von ____über ____ auf _____ = Aus dieser Vorgehensweise ergeben sich zwangsläufig folgende Regeln 1. Elemente erhalten die Oxidationszahl Null (EN der Atome ist identisch): Beispiel O2 2. Wasserstoff in Verbindungen hat die Oxidationszahl +I: Beispiel H2O 3. Sauerstoff in Verbindungen hat die Oxidationszahl –II: Beispiel H2O 4. Fluor in Verbindungen hat die Oxidationszahl –I (EN am höchsten): Beispiel HF 5. Ausnahmen: Metallhydride z.B. CaH2 (H = -I) und Wasserstoffperoxid H2O2 (O = -I) 6. Bei Salzen ist die Oxidationszahl gleich der Ladungszahl der Ionen: Beipiel CuCl2 7. Die Summe der Oxidationszahlen bei Verbindungen ist Null: Beispiel H2O oder CuCl2 8. Die Summe der Oxidationszahlen bei Komplexionen ist gleich der Ladung: Beispiel NO3- O H Oxidationszahl Bestimmung der Oxidationszahlen Mit Hilfe der Regeln lassen sich alle Oxidationszahlen bestimmen oder kalkulieren. Fe3+ CO2 HNO2 NH3 H3O+ O H H C H C O H Mit Hilfe der Oxidationszahlen lässt sich leicht beurteilen, welches Teilchen an einer Redoxreaktion teilnimmt und ob es oxidiert wird oder reduziert. Erhöht sich bei einer Reaktion die Oxidationszahl eines Teilchens, so handelt es sich um eine Oxidation, wird sie erniedrigt, handelt es sich um eine Reduktion. Beispiel: Auf S. 140 bearbeitete Verbrennung von Mg mit Sauerstoff Welches Teilchen wird oxidiert? Welches wird reduziert? Wie viele Elektronen werden übertragen? 3.5.2.2 Die Chemie des Swimmingpools Aus hygienischen Gründen brauchen Swimmingpools und öffentliche Bäder einen gewissen Aufwand an Pflege. Als Desinfektionsmittel gegen Algen und Bakterien wird in öffenlichen Schwimmbädern Chlorgas eingesetzt, das folgendes Gleichgewicht eingeht. Oxidationszahlen? OM? RM? Elektronenzahl? Oxidation? Reduktion? Cl2(g) + 2 H2O(l) HClO (aq) + H3O+ (aq) + Cl- (aq) Hypochlorige Säure (HClO) wirkt als starkes Oxidationsmittel und tötet somit Algen und Bakterien. HClO ist auch bekannt als Eau de Javelle oder Javelle Wasser. Cl2 als toxisches, korrosives Gas ersetzt man im privaten Bereich durch festes, in Tablettenform erhältliches Calciumhypochlorit Ca(ClO)2. Oxidationszahlen? OM? RM? Elektronenzahl? Oxidation? Reduktion? Ca(ClO)2 (s) + 2 H2O (l) 2 HClO (aq) + Ca(OH)2 (aq) Zu welchem Stoff reagiert HClO wenn es als Oxidationsmittel eingesetzt wird? KME 142 Redox-Gleichgewichte 3.5.2.3 Drill&Practice: Oxidationszahlen 1. Bestimmen Sie die Oxidationszahlen NO NO-3 Mn(OH)2 KMnO4 Fe2O3 Fe3O4 () H2O2 O2 NaH CH3CH2OH (Trinkalkohol, Strukturzeichnung notwendig!) 2. Entscheiden Sie, ob es sich bei den folgenden Reaktionen um Protolysen oder Redox-RK handelt. 3. a) CaCO3(s) + 2 HCl(aq) Ca2+(aq) + 2 Cl-(aq) + CO2(g) + H2O(l) b) 2 H2SO4(l) + 2 NaBr(s) Na2SO4(s) + SO2(g) + 2 H2O(l) + Br2(l) c) PBr3(l) + 3 H2O(l) H3PO3(l) + 3 HBr d) SiO2(s) + 6 HF(aq) H2SiF6(l) + 2 H2O(l) Bevor Kohlenhydrate und Fette im ZitronensäurecyClus zu CO2 und H2O vollständig abgebaut werden (humaner Stoffwechsel), wird ein Zwischenprodukt, das Pyruvat, oxidativ decarboxyliert (CO2Abspaltung). Weisen Sie den Oxidationsprozess durch Notierung der Oxidationszahlen nach. (Freie Elektronen- paare nicht eingezeichnet.) O OH C C C O H3C O H + O C O H3C Lösungen unter www.dinternet.ch.vu weiter zu Drill&Practice. 3.5.3 Redox-Gleichgewichte 3.5.3.1 Redoxreihe Reaktion von Kupfer mit Ag+-Ionen Beobachtung Reaktion Reaktion von Silber mit Cu2+-Ionen Beobachtung Reaktion KME 143 KME 144 Redox-Gleichgewichte Auch Redox-Reaktionen sind Gleichgewichtsreaktionen. Das Kupfer gibt offensichtlich leichter die Elektronen an Silberionen ab als Silber an Kupferionen. Diese Beobachtung ist in der Tabelle der Standard-Elektrodenpotentiale oder auch Redoxreihe genannt, systematisiert. Die Einordnung eines Stoffes in die Tabelle gibt die Tendenz an, mit der Elektronen abgegeben oder aufgenommen werden. Die Systematik und der Umgang mit den Standard-Elektrodenpotentialen ist dem der Säure-Base-Tabelle sehr ähnlich, nur dass es sich hier um Elektronenübertragungen handelt und dass sich ein paar Vokabeln ändern. Säure-Base-Tabelle Redox-Reaktionen Säure-Base-Reaktionen Starke Reduktionsmittel stehen oben links, starke Oxi- Starke Säuren stehen oben links, starke Basen unten dationsmittel unten rechts. rechts. Starke Reduktionsmittel haben eine grosse Tendenz Starke Säuren haben eine grosse Tendenz Protonen Elektronen abzugeben. Starke Oxidationsmittel haben abzugeben. Starke Basen haben eine grosse Tendenz eine grosse Tendenz Elektronen aufzunehmen. Protonen aufzunehmen. Es reagiert immer das stärkere Reduktionsmittel mit dem stärkeren Oxidationsmittel. Die Bergabreaktion ist dann möglichst steil. Das Gleichgewicht liegt bei Redox-Reaktionen immer auf der Seite der schwächeren Reduktionsmittel bzw. Oxidationsmittel. Es reagiert immer die stärkere Säure mit der stärkeren Base. Die Bergabreaktion ist dann möglichst steil. Das Gleichgewicht liegt bei Säure-Base-Reaktionen immer auf der Seite der schwächeren Säure bzw. Base. Bei Bergaufreaktionen liegt das GG links, bei Bergab- Bei Bergaufreaktionen liegt das GG links, bei Bergabreaktionen rechts. reaktionen rechts. Redox-Gleichgewichte Klären Sie mit Hilfe der Bergauf-und Bergabreaktionstechnik die Befunde des Eingangsexperiments der Reaktion von Silber mit Kupfer(II)ionen und von Kupfer mit Silberionen. Benutzen Sie die Redoxtabelle. Beurteilen Sie ob sich ein Eisenschlüssel in einer Kupfer(II)salzlösung mit metallischem Kupfer überzieht. Die einzelnen Komponenten der eingangs erwähnten Fotosynthesemaschinerie liessen sich auf analoge Weise in die Redoxtabelle integrieren. Dies würde zeigen, von welchem Protein zu welchem Protein die Elektronen freiwillig fliessen, und wo man die Reaktion erzwingen müsste. Die erzwungene Reaktion ist ja bei der Fotosynthese der übliche Fall, da Lichtenergie eine Grundvoraussetzung für die Primärreaktion ist. 3.5.3.2 Drill&Practice: Redox-Gleichgewichtslagen 1. a) b) c) Stellen Sie mit Hilfe der Redoxtabelle die Reaktionsgleichungen auf: 1. Teilgleichung 2. Teilgleichung Elektronen ausgleichen Gesamtgleichung Gleichgewichtslage. Reaktion von Aluminium mit Fluorgas. Reaktion einer wässrigen Eisen(III)-chloridlösung mit Wasserstoffgas (pH=7) Reaktion von Eisen(II)-Ionen in saurer Dichromat-Lösung (Cr2O27 ) 2. Welche Oxidationsmittel können Iodid oxidieren, nicht aber Bromid? 3. Cr3+ soll mit einem geeigneten Reduktionsmittel zu Chrom umgesetzt werden. Suchen Sie einen passenden Partner aus und notieren Sie die Reaktionsgleichung. Lösungen unter www.dinternet.ch.vu weiter zu Drill&Practice. KME 145 Korrosion von Metallen 3.5.4 Korrosion von Metallen Nach Angaben der Eidgenössischen Materialforschungs- und Prüfungsanstalt (EMPA) gehen der Schweiz pro Jahr etwa 10 - 15 Mia. Franken durch Korrosion (corrodere (lat.) = zernagen) verloren. Zürich z.B. kostet der Unterhalt seines ca. 1000 km langen Wasserrohrnetzes (Eisen) etwa 25 Mio. Franken pro Jahr. Korrosion ist: "Die Reaktion eines metallischen Werkstoffes mit seiner Umgebung, die eine messbare Veränderung des Werkstoffes bewirkt und zu einer Beeinträchtigung der Funktion eines metallischen Bauteils oder eines ganzen Systems führen kann. (EMPA)". Es gibt 2 Arten von Korrosion Angriff von Metallen durch Säuren Säurekorrosion Angriff von Metallen durch Sauerstoff Sauerstoffkorrosion 3.5.4.1 Säurekorrosion Reaktion von Magnesium mit verdünnter Salzsäure (siehe Kapitelanfang) Beobachtung Reaktion Verallgemeinerung Bestätigung der Verallgemeinerung Reaktion von Kupfer mit verdünnter Salzsäure Beobachtung Klären Sie die Reaktion von Kupfer mit Salpetersäure (65%ig) HNO3 ist ein starkes Oxidationsmittel. NO2(g) ist braun. Arbeiten Sie erst theoretisch, indem Sie die Teilreaktionen der Oxidation und der Reduktion aufschreiben, um dann zur Gesamtgleichung zu kommen. Beurteilen Sie auf welcher Seite das GG liegt. Führen Sie das Experiment in der Kapelle durch. KME 146 Korrosion von Metallen 3.5.4.2 Sauerstoffkorrosion Reinigung von Silber Silber bildet an der Luft mit der Zeit eine schwarze Schicht aus Silbersulfid (Ag2S). Dieses "Anlaufen" wird durch den in der Luft vorhandenen Schwefelwasserstoff (H2S) hervorgerufen. Auch in Proteinen finden sich in Form der Aminosäure Cystein (R-SH) Schwefelverbindungen. Daher ist es wenig ratsam, gekochte Eier mit Silberlöffeln zu essen, da das entstehende Silbersulfid etwas faulig schmeckt. Silberschmuck wird durch die Proteine der Haut (hier wichtig: Keratin) angegriffen, besonders beim Baden im Meer. Warum? Reaktion KME 147 Korrosion von Metallen KME 148 Rosten von Eisen: Sauerstoffkorrosion Autos rosten. Da besteht kein Zweifel. Besonders der Auspuff ist gefährdet. Sehr ärgerlich wenn einem in Italien bei 35 °C auf der Autobahn Milano-Bologna der Pott über die Strasse scheppert. 3 Voraussetzungen müssen gegeben sein, damit man von "Rosten" sprechen kann: Zusammensetzung von Rost Zusammensetzung von Rost Rost ist eine Mischung aus verschiedenen Eisenverbindungen, er ist relativ porös und wenig dicht und erlaubt das Eindringen von Wasser und Luft in tiefere Schichten. Luftfeuchtigkeit Salze Rost bildet sich, wenn die relative Luftfeuchtigkeit mehr als 70% beträgt. Salze (z.B. Streusalze im Winter) wirken als Katalysatoren und beschleunigen die Reaktion. Alkalische Stoffe wie Zement und Beton schützen weitgehend vor der Zersetzung, daher lassen sich rostige Eisengitter beim Bau von Häusern verwenden. Das Bahnhofsgebäude Zürich-Altstetten musste 1997 renoviert werden, da rostende Armierungseisen den Beton abgesprengt hatten. Rostumwandlerlösung besteht hauptsächlich aus Phosphorsäure und wandelt den Rost in eine harte, unlösliche Schicht von Eisenphosphaten (z.B. FePO4) um, die mit der Metalloberfläche Armierungseisen Rostumwandler Eisensäule in Delhi fest "verwächst". Dadurch lässt sich weiteres Rosten verzögern. In der Praxis wirkt Rostumwandler nur bedingt, da die verwendete Säuremenge auf die Dicke der Rostschicht abgestimmt sein muss, damit nicht das darunter liegende Metall angegriffen wird (Säurekorrosion). Zu wenig Rostumwandler lässt unter den Eisenphosphaten eine Schicht Rost zurück. Die genaue Beschreibung der chemischen Vorgänge beim Rosten sind schwierig zu durchschauen. Je nach Feuchtigkeit und Luftverschmutzung laufen die chemischen Prozesse unterschiedlich schnell ab. Die 7 m hohe und 7 Tonnen schwere Eisensäule von Delhi aus dem 4. Jahrhundert zeigt nur sehr wenige Roststellen. In der sehr trockenen, sehr reinen Luft rostet Eisen fast nicht. Die Säule soll geheime Wünsche in Erfüllung gehen lassen, wenn man sie mit den Armen umfassen kann. Durch Zugabe von mindestens 12.5% Chrom zu Eisen tritt eine starke Verminderung des Rostens auf. Wahrscheinlich liegt das an einem Überzug der Oberfläche mit Cr2O3, das die Passivierung darunter liegenden Schichten vor Korrosion schützt. Ein ähnlicher Vorgang des Metallschutzes durch Metalloxide gibt es für die relativ unedlen Metalle Aluminium und Magnesium, die im Flugzeug- und Autobau Verwendung finden. Anwendungsaufgabe Formulieren Sie für das Rosten des Eisens die Reaktionsgleichungen in stark alkalischen Lösungen (pH = 14) und in stark sauren Lösungen (pH = 0). Es ist sinnvoll zuerst die Teilreaktionen der Oxidation und der Reduktion zu formulieren. pH = 14 pH = 0 Korrosion von Metallen 3.5.4.3 Drill&Practice: Korrosionen 1. „Säuren greifen üblicherweise Metalle an“. Diesen Satz hört man relativ oft, er ist aber sehr pauschal und stimmt eigentlich nicht. Kommentieren Sie den Satz und geben Sie eine exakte chemische Erläuterung. Formulieren Sie den Satz so um, dass er hieb- und stichfest wird. 2. Ein in der Wüste abgestelltes Auto rostet nur sehr langsam. Warum? Geben Sie Reaktionsgleichungen an. (Diesen Umstand macht man sich bei Flugzeugen zu Nutze. Sie werden in Wüstenregionen „parkiert“.) 3. Ein kleines Gedicht (nach Chemkon 4/2003 S. 216) Notieren Sie rechts neben den Strophen die Chemie. Der Dinter wählte mit Bedacht `ne Stunde in der G-5-8. Salzsäure soll’t das Thema sein: „Wie wirkt sie auf Metalle ein?“ Das Kupfer, ja das glänzend` Dingk versetzte man mit Säure flink. Im Schrank liess man den Becher steh`n, um in 4 Tagen nachzuseh`n. Wo das Metall geblieben war, das Resultat schien Dinter klar. So holte er voller Behagen, was angesetzt man vor vier Tagen. Doch wie erschrak der Dinter da, als er das Glas mit Kupfer sah. Im Raum sah’s jeder ganz genau: Die Lösung war ganz tief-grün blau. Das war nun wirklich nicht zum Lachen. Was sollte nun der Dinter machen? Sollt` er von Sabotage sprechen oder verschämt das Glas zerbrechen? Das Kupfer, Eisen und das Zink versetzt man neu mit Säure flink. Brav fanden seine Schüler gar, wo Wasserstoff entstanden war. Der Dinter liess zusammenfassen: „Welch` Schlüsse sich wohl ziehen lassen?“ Da sagte einer der sonst Leisen: „Die Säure oxidiert das Eisen.“ Durch Dinters Denken fuhr ein Blitz, es riss ihn förmlich aus dem Sitz. Der Sauerstoff, der musst` es sein, der kriegte auch das Kupfer klein. Froh nutzte Dinter die Aussage, am Ende stellte sich die Fragen: „Kann es dem Sauerstoff gelingen in Säure Kupfer zu bezwingen?“ Somit ist allen sonnenklar, was jetzt zu tun, das liegt doch nah. Die Stifte raus und nach Belieben, die Gleichung jetzt mal aufgeschrieben. Lösungen unter www.dinternet.ch.vu weiter zu Drill&Practice. KME 149 Chem. zu elektr. Energie: Galvanische Elemente 3.5.5 Chem. zu elektr. Energie: Galvanische Elemente Die Geschichte der Elektrochemie, also der Umwandlung von chemischer in elektrische Energie beginnt mit dem in Bologna beheimateten Anatom Luigi Galvani. 1786 machte er eine erstaunliche Entdeckung. Frisch präparierte Froschschenkel zuckten zusammen, wenn er den Messinghaken, an dem der Froschschenkel befestigt war, an ein Eisendrahtgitter hing. Die experimentelle Verfolgung dieses Phänomens zeigte, dass das Zucken nur bei der Kombination von verschiedenen Metallen einsetzte. Galvani postulierte eine neue Form von Elektrizität "tierische Elektrizität", ohne zu wissen, dass er eigentlich die erste Batterie entdeckt hatte. Erst der Physiker Alessando Volta konnte zeigen, dass die Elektrizität nicht vom Froschschenkel, sondern vom Metall ausging. Volta war nun in der Lage den Chemikern ein ganz neues Produkt in die Hand zu geben, eine Batterie, die kontinuierlich hohe Ströme abgeben konnte. Er entwickelte dazu die nach ihm benannte Volta'sche Säule, einen Stapel von Kupfer- und Zinkplatten, die durch in Schwefelsäure getränkte Filzplatten getrennt wurden. Mit Hilfe der Säule wurden 1807 von Humphry Davy in England die Elemente Kalium und Natrium entdeckt. Nachvollzug der Volta'schen Säule 3.5.5.1 Galvanische Elemente Daniell-Element Vorversuch: Zinkblech in einer CuSO4-Lösung Beobachtung Reaktion Die Reaktion läuft offensichtlich freiwillig ab. Die Energie dieser Reaktion geht als Wärme verloren. Das Ziel des Daniell-Elements ist es, diese Enthalpie als elektrische Energie nutzbar zu machen. Dies wird durch eine Trennung der Oxidationsvorgänge und Reduktionsvorgänge erreicht. Dabei werden die Elektronen gezwungen den Weg über einen metallischen Draht zu nehmen, was landläufig als "Strom" bezeichnet wird. KME 150 KME 151 Chem. zu elektr. Energie: Galvanische Elemente Die Membran verhindert eine Durchmischung der beiden Elektrolyte und damit auch einen direkten Kontakt zwischen Cu2+-Ionen und der Zn-Elektrode. Andererseits ermöglicht sie den Ionenaustausch, ohne den der Stromfluss aufgrund des Aufbaus eines elektrochemischen Potentials innerhalb kürzester Zeit zum Erliegen käme. Die Begriffe Anode und Kathode sind mit den Begriffen Oxidation und Reduktion Anodische Oxidation Elektrolyse + - gekoppelt. Das A und O ist die Anodische Oxidation! Anode Kathode Anode (Oxidation) Kathode (Reduktion) Gesamtreaktion - + Anode Kathode galvanisches Element Das Daniell-Element ist ein Beispiel für ein galvanisches Element. Galvanische Elemente sind Anordnungen, welche durch geeignete exotherme Redoxreaktionen direkt elektrische Energie freisetzen. In einem solchen Element sind die beiden Redoxpartner räumlich voneinander getrennt und die Elektronenübertragung erfolgt durch einen Draht. Standardwasserstoffhalbzelle Die Standardwasserstoffhalbzelle stellt die Basis der Redoxreihe dar. Der H2Halbzelle wurde per Definition das Potential (Spannung) "Null" zugeordnet. Die Standardbedingungen sind in der Grafik aufgeführt. Zur Wasserstoffhalbzelle wurde eine Zn-Halbzelle (Zn-Metall eintauchend in Zn2+-Lösung der Konzentration 1 mol·L-1 bei 25 °C) kombiniert. Die Messung des Potentials ergibt -0.76 Volt. Anode Kathode Gesamtreaktion Die Spannung eines galvanischen Elements errechnet sich unter Standardbedingungen aus der Differenz der Redoxpotentiale der beteiligten Halbzellen (Redoxtabelle). Für das Daniell-Element gilt: Chem. zu elektr. Energie: Galvanische Elemente 3.5.5.2 Lokalelemente Schon Volta hatte es erkannt. Berührt man mit der Zunge gleichzeitig ein Stück Blei und ein Stück Silber, die miteinander in Kontakt stehen, bemerkt man einen unangenehmen, scharfen Geschmack. Trennt man die Metalle, so bleibt der Geschmack aus. Volta hatte ein Lokalelement hergestellt. Definition eines Lokalelements und Beispiele Anode Kathode Gesamtreaktion Was ist das Besondere? Aus der Redoxtabelle geht hervor: Reaktion von Zn mit H3O+ ist eine Bergabreaktion, die von Pt mit H3O+ ist eine Bergaufreaktion. Zink wird durch Säure oxidiert, würde also auch ohne Lokalelement zerfallen. Es tritt jetzt ein beschleunigter Zerfall auf, da die freigesetzten Elektronen zum Platin herüberfliessen und auch dort die H3O+-Ionen reduzieren. So wird beim Lokalelement der Ort der Zn2+Ionen Produktion und der Ort der Reduktion der H3O+-Ionen getrennt. Zieht man die beiden Prozesse auseinander, tritt diese Abstossungsreaktion eben nicht auf. Dies ist vorteilhaft, da beide Ionen positiv geladen sind und sich abstossen. Es ist wie im Kino: Einlass und Ausgang durch die gleiche Tür führt zu katastrophalen Zuständen (die Personen würden sich behindern, wie die gleichgeladenen Ionen), während getrennte Einlässe und Ausgänge überhaupt kein Problem darstellen. KME 152 Chem. zu elektr. Energie: Galvanische Elemente Lochfrasskorrosion Anode Kathode Gesamtreaktion Solche Lokalelemente sind äusserst unerwünscht, da die Korrosion an ganz bestimmten Stellen sehr schnell abläuft, man spricht auch von Lochfrasskorrosion. Korrosionsschutz Aufgabe Fertigen Sie eine Zeichnung von einem Werkstück an, das eine beschädigten ZnÜberzug hat. (Orientieren Sie sich an obiger Zeichnung.) Anode Kathode Gesamtreaktion Opferanode Unterirdisch verlegte Pipelines aus Eisen oder Stahl schützt man vor Korrosion in dem man sie leitend mit einem unedleren Metall (hier Magnesium) verbindet. Der Boden selbst stellt den Elektrolyten dar. Das unedlere Metall wird zuerst oxidiert, es dient als Opferanode. Das Anodenmaterial muss von Zeit zu Zeit ausgetauscht werden. Das Feuerverzinken in der Automobilindustrie (450 °C) dient dem gleichen Zweck. Zum einen dient das Zink als Opferanode, zum anderen bildet Zink eine relativ undurchlässige Oxidschicht, ähnlich wie Chromoxid beim Stahl oder Aluminiumoxid. KME 153 Chem. zu elektr. Energie: Galvanische Elemente Anwendungsaufgabe Korrosion von Eisennägeln Im Experiment sehen Sie 3 Eisennägel. Die Nägel überziehen sich leicht mit einer Oxidschicht. Daher wurden die Köpfe und die Spitzen kurz vor dem Experiment angefeilt. Nur hier lässt sich chemisch von „Eisen“ sprechen. Die Nägel sind in eine gel-artige, wässrige Agarschicht eingelegt. Die Agarschicht enthält gelöstes NaCl. Es wurden 2 Indikatoren zugegeben: eine Rotfärbung deutet auf die Produktion von H2 hin eine Blaufärbung zeigt die Produktion von Fe2+-Ionen an Der mittlere Eisennagel ist mit einer Kupferwendel umwickelt und der rechte Eisennagel wurde bis zur Hälfte mit Zink überzogen. Beobachten Sie das Experiment. Zeichnen Sie die Effekte (überdeutlich) ein. Diskutieren Sie mit ihrer NachbarIn, was das Ganze mit Korrosion und Lokalelementen zu tun und formulieren Sie die Reaktionen mit Hilfe der Redoxtabelle. Fe Fe Fe/Zn Cu KME 154 Chem. zu elektr. Energie: Galvanische Elemente 3.5.5.3 Drill&Practice: Galvanische Elemente und Lokalelemente 1. Wird ein Kupferblech in eine Silbernitratlösung getaucht, so überzieht es sich mit einer schwarzen Schicht von fein verteiltem Silber. a) Konstruieren Sie ein galvanisches Element, das nach dieser Reaktion arbeitet. Alles genau beschriften. b) Geben Sie die Reaktionen in den beiden Halbzellen an und formulieren Sie die Gesamtreaktion. c) Warum muss auch hier, wie bei allen galvanischen Elementen, für einen Ladungsaustausch gesorgt werden? 2. Man sollte sehr vorsichtig sein, wenn man mit Zahnfüllungen aus Amalgam [Legierung aus a) Um was für einen Typus von „Element“ handelt es sich hier? b) Geben Sie den Grund für den Schmerz an. c) Geben Sie Reaktionsgleichungen an. d) Fertigen Sie eine Zeichnung an, aus der die Redoxvorgänge gut zu erkennen sind. Lösungen unter www.dinternet.ch.vu weiter zu Drill&Practice. KME 155 Chem. zu elektr. Energie: Galvanische Elemente KME 156 3.5.5.4 Batterien Mobile Technik ist nicht möglich ohne mobile Stromversorgung. An der Batterie hängt das halbe Leben. Rund 20 Rappen bezahlt man in der Schweiz für den Verbrauch einer Kilowattstunde elektrischer Energie aus der Steckdose. Wer diesen Strombedarf mit den billigsten Einwegbatterien deckt, gibt dafür mindestens 300 Franken aus. So schlecht wie der ökonomische Vergleich fällt auch die ökologische Bilanz der mobilen Stromspender aus: Rohstoffgewinnung, Herstellung, Transport und Entsorgung benötigen ein Vielfaches der Energiemenge, die eine Batterie je abgeben kann. In eine Batterie werden 50x so viel Energie hineingesteckt, wie sie abgeben kann. Daten für die Schweiz Verkauf 100 Mio Stück pro Jahr an Einmalbatterien und Akkumulatoren magere 65% (Für Glas und Alu ca. 90%) Rücklaufquote 35% = 35 Mio landen im Kehricht. Das verstösst gegen das Umweltschutzgesetz und ist kriminell. Der Schadstoffgehalt der am häufigsten verkauften Alkali-Mangan-Batterie hat markant Schadstoffgehalt abgenommen (z.B. 0% Hg). Im Gemisch mit anderen Typen z.B. Nickel-Cadmium-Akkumulatoren wieder brisant. Moderne Kehrichtverbrennungsanlagen mit Rauchgasreinigungsanlagen halten giftige SchwerKehrichtverbrennung metalle weitgehend zurück. Das Problem verlagert sich aber auf die Filterasche. Das Deponieren von 1 Tonne Batterien kostet keine 100 SFR, das Recycling etwa 5000 SFR. Kosten Die Batteriesammlung kostet eine Gemeinde 800 SFR/Tonne. Seit 1992 gibt es pro Batterie eine vorgezogene Entsorgungsgebühr (VEG) von 5-10 Rappen VEG pro Batterie. Einzige Firma in der Schweiz: Batrec Industrie AG in Wimmis, Bern. Kapazitätsauslastung Recycling lediglich 44%. Alle Metalle können recycliert werden. Das Buwal droht seit langem mit einem Batteriepfand, wenn nicht bald eine Rücklaufquote von Buwal 80% erreicht ist, besonders im Hinblick auf die problematischen Nickel-CadmiumAkkumulatoren. Toxikologie von Quecksilber, Cadmium und Blei Quecksilber Verwendung Amalgame, Edelmetallgewinnung, Neonröhren, Katalysatoren, galvanische Elemente Toxikologie Hg metallisch ist wenig toxisch (Abführmittel im alten Rom) Hg Dämpfe rel. toxisch wie Hg(I)- und Hg(II)-Verbindungen Schädigung des Nervensystems (Zittern der Hände, Lähmungen, Gedächtnisverlust) Dimethylquecksilber spielte 1953-1960 eine grosse Rolle: eine Fabrik hatte Abwässer in die Minamatabucht geleitet. Lipidlösliche Hg-verbindungen reicherten sich in Tunfischen an und gelangten zum Menschen: Minamata-Krankheit. Ende 1995 werden die Opfer offiziell entschädigt, Ende 1997 wird die Minamata-Bay wieder dem Fischen freigegeben. Cadmium Verwendung Farben (Cadmiumsulfid), Akkumulatoren, Korrosionsschutz Toxikologie Verdauungs- und Atemstörungen Osteoporose bzw. Osteomalazia (Knochenentdichtung/Knochenerweichung) Cadmium aus Abraumhalden von Zinkhütten am Jinzu-River in Japan wurde ab 1912 ins Wasser eingeleitet und führte zur Itai-Itai-Krankheit (jap. für "Aua-aua"), Blei Verwendung Autobatterie, Strahlenschutz, Legierungen, Pigmente (Mennige, Pb3O4) Toxikologie Pb metallisch wie auch Verbindungen sind giftig Hautresorption (aber rel. gering) Pb2+ ersetzt Ca2+ in Knochen und Zähnen Anämie, Muskelschwäche Bleitetraethyl im Benzin ist verboten KME 157 Chem. zu elektr. Energie: Galvanische Elemente Typen galvanischer Zellen Brennstoffzellen Sekundärelemente Primärelemente Leclanché Element Zn Becher Alkaline Zn Pulver KOH Zink-Luft Zn Pulver KOH NH4Cl MnO2 Spannung (V) Oxidationsmittel Name Elektrolyt Reduktionsmittel Primärelemente liefern nur so lange elektrischen Strom bis das Oxidations- oder Reduktionsmittel aufgebraucht ist. Dafür sind nur möglichst billige Komponenten geeignet. Sekundärelemente oder Akkumulatoren können nach Entladung durch einen Elektrolyseprozess wieder aufgeladen werden. Brennstoffzellen (Brennstoffelemente) enthalten das Oxidationsmittel und Reduktionsmittel nicht von vorn herein. Die Stoffe werden den getrennten Räumen in situ zugeführt. Obwohl alle Batterien unterschiedlich aussehen, arbeiten sie alle nach dem gleichen Prinzip. Immer ist es eine Redox-Reaktion in getrennten Räumen, bei der das Fliessen der Elektronen über einen Umweg ausgenutzt wird. Vorteil 1.2 - 1.5 billig MnO2 1.5 billig, auslaufsicher, hohe Stromentnahme pro Zeiteinheit, allgemeintauglich O2 1.2 - 1.5 billig Lithium Li LiCLO4 MnO2 ca. 3.5 Silberoxid Knopfzellen Zn Pulver KOH Ag2O 1.5 Bleiakku Pb H2SO4 PbO2 ca. 2 V Ni-Cd Cd KOH NiOOH 1.3 Ni-MH M-H2 KOH NiOOH 1.2 Lithium-Ionen Li+/C org. LöCobaltsungsm oxide ittel Knallgaszelle H2 KOH O2 1.23 Methanol CH3OH -- O2 1.23 Hydrazin N2H4 O2 1.23 3/3.6 leicht, lagerfähig, eignet sich für Impulsleistung (Blitzgeräte) konstante Spannung über lange Zeit robust, gutmütig, zuverlässig schnell ladbar, robust, hohe Stromentnahme pro Zeiteinheit umweltverträglich, hohe Kapazität, kein Memory-Effekt leicht, sehr hohe Energiedichte, umweltverträglich, kein MemoryEffekt hoher Wirkungsgrad, umweltfreundlich Nachteil Spannung sinkt nach 10 min auf 1 V, nicht auslaufsicher, Hg haltig problematische Handhabung durch offene Bauweise teuer, eignet sich nicht für dauernd hohe Stromentnahme (Videoleuchten) teuer schlechte Ausbeute für das hohe Gewicht, umweltbedenklich giftiges Cadmium, MemoryEffekt hitzeempfindlich beim Schnellladen, Lazy Battery Effekt nicht geeignet für hohe Ströme (Videoleuchten), teuer, korrodiert mit der Zeit technische Schwierigkeiten, (Korrosion, Wasserstoffbetankung, Aktivierungsenergie) Die ideale Batterie, gut für alles und erst noch billig, gibt es nicht! Chem. zu elektr. Energie: Galvanische Elemente KME 158 Leclanché-Element Das Leclanché Element wurde erstmalig 1867 auf der Weltausstellung in Paris vorgestellt und galt als technische Sensation. Es besteht aus einem Zinkbecher als Anode und einem Braunstein (MnO2) /Graphit-Gemisch als Kathode. Der Kohlestift (Graphit) wird als Elektrode genutzt. Als Reduktionsmittel dient der Zinkbecher selbst, als Oxidationsmittel Braunstein. Als Elektrolyt dient mit Stärke eingedickte, saure Ammoniumchloridlösung, die mit dem Braunstein vermengt ist. Durch die Kombination von Säure und einem unedlen Metall entsteht H2, dessen Bildung man durch die Zugabe von Hg inhibieren konnte. (Als Budget Batterie bei Migros.) Aufgabe Welchen Nachteil sehen Sie beim Leclanché Element? Leclanché Element Alkaline Batterie Alkaline ist quasi Standard. Mit diesem Typ wurden Batterien umweltfreundlicher, da man auf Hg, Cd oder Pb verzichten konnte. Gegenüber dem Leclanché Element hat sie eine bedeutende Leistungssteigerung erfahren. Bei der Alkaline wird eine Paste aus Zinkpulver eingesetzt, was die Oberfläche gegenüber dem Zinkbecher des Leclanché Elements deutlich erhöht. Als Oxidationsmittel wird wieder ein Braunstein (MnO2) /Graphit-Gemisch verwendet. Elektrolyt ist KOH, vermischt mit dem Reduktions- und Oxidationsmittel. Durch die Verwendung von KOH anstatt Säure (daher der Ausdruck Alkaline für alkalisch), wird die Wasserstoffbildung (s.o.) vermieden. Durch einen Stahlmantel wird diese Batterie auslaufsicher verschlossen. Die Spannung beträgt 1.5 V. Anode Kathode Gesamt Das Wiederaufladen ist bedingt möglich. (in begrenztem Umfang in den speziell gebauten Rechargable Alkaline Manganese Cells, RAM). Chem. zu elektr. Energie: Galvanische Elemente Beispiele für Primärelemente Zink-Luft-Batterie Nur eine geringe Abwandlung in der Chemie ist bei der Zink-Luft-Batterie gegenüber der Alkaline zu erkennen. Als Oxidationsmittel wird Sauerstoff der Luft anstatt Braunstein verwendet. Elektrolyt ist KOH. Die Batterie ist an sich billig und umweltfreundlich, wird aber wegen ihrer offenen Bauweise und damit verbundenen problematischen Handhabung nur als Grossbatterie für Langzeitanwendungen (Baustellenbeleuchtungen, Weidezäune eingesetzt). Ausserdem wird sie bei Höhrgeräten eingesetzt (wahrscheinlich in kleinerer Bauweise). Die Spannung liegt zwischen 1.2 und 1.5 V. Anode Kathode Zn → Zn2+ + 2 eO2 + 2 H2O + 4 e- → 4 OH- Gesamt Lithium-Batterie Durch seine Stellung in der Redox-Reihe ist Lithium sehr gut als Reduktionsmittel geeignet. Da es heftig mit Wasser reagiert, darf der Elektrolyt kein Wasser enthalten. Daher nutzt man organische Lösungsmittel (Propylencarbonat oder Dimethoxyethan). Als Oxidationsmittel kommt wieder MnO2 zum Einsatz, als Elektrolyt kann Lithiumperchlorat (LiClO4) genutzt werden. Die Spannung beträgt ca. 3.5 V. Lithiumbatterien werden in absehbarer Zeit wohl die Standardbatterien werden. Anode Kathode Li → Li+ + eLi+ + e- + MnO2 → LiMnO2 Gesamt Lithium-Ionen werden an der Kathode in das MnO2-Gitter eingelagert. Lithiumbatterien sind durch ihre sehr geringe Selbstentladung äusserst langlebig, wegen der geringen Dichte des Lithiums sehr leicht und können bei nur geringer Stromentnahme etwa 10 Jahre verwendet werden (Herzschrittmacher). Silberoxid-Knopfzelle Die gebräuchlichste Armbanduhrenbatterie ist die Silberoxid-Knopfzelle. Der Hauptvorteil liegt in ihrer konstanten Spannung von 1.5 V über ihre ganze Lebenszeit hinweg. Als Reduktionsmittel wird wieder Zinkpulver verwendet, als Oxidationsmittel Silberoxid (Ag2O). Elektrolyt ist KOH. Anode Kathode Gesamt Zn → Zn2+ + 2 eAg2O + 2 e- + H2O → 2 Ag + 2 OH- KME 159 Akkumulatoren 3.5.6 Akkumulatoren 3.5.6.1 Blei-Akkumulator Der Bleiakkumulator hat enorme wirtschaftliche Bedeutung als AutoStartbatterie. Mit ihm lässt sich elektrische Energie in Form von chemischer Energie speichern. Die chemischen Reaktionen sind reversibel (umkehrbar). In der Schweiz fahren zur Zeit (2004) 4.9 Mio. Einheiten, alle mit einer Starterbatterie. Was für Teilchen liegen in einer wässrigen H2SO4-Lösung vor? In welchen relativen Mengen sind sie vorhanden? Entladevorgang Formulieren Sie mit Hilfe der Redoxtabelle die Teilreaktionen an der Anode (Oxidation) und an der Kathode. Suchen Sie dazu die Ihnen passend erscheinenden Reaktionen aus der Tabelle heraus. Formulieren Sie dann die Gesamtreaktion. Anode Kathode KME 160 Akkumulatoren Gesamtreaktion der Entladung und Ladung Stoffliche Unterschiede zwischen geladenem und entladenem Bleiakkumulator Die chemischen Vorgänge beim Entladen im Überblick Die Elektroden bestehen zur Begünstigung der Reaktion aus Blei- bzw. Bleidioxidschwamm mit grosser Oberfläche. Das gebildete Blei(II)sulfat ist schwerlöslich und setzt sich im Laufe der Entladung auf den Elektroden ab. Das Blei(II)sulfat ist für eine spätere Rückreaktion (Laden) wieder verfügbar. Die Reaktionsgleichung zeigt, dass die Konzentration der Säure (H3O+) während des Entladens abnimmt. Man kann deshalb den Ladezustand der Batterie durch aräometrische Dichtemessung kontrollieren. Ist ein Bleiakkumulator vollständig aufgeladen, so bildet sich Knallgas, da Wasser elektrolysiert wird. Der Akku beginnt zu gasen. (Sehr unerwünscht.) Informationen zum Verhalten eines Bleiakkumulators KME 161 Akkumulatoren KME 162 3.5.6.2 Nickel-Cadmium-Akkumulator Der Ni-Cd-Akku war lange Zeit die einzige Alternative zum Bleiakku, wurde und wird aber mehr im portablen Bereich eingesetzt. Seine Speicherkapazität ist bezogen auf sein Gewicht nicht gerade überwältigend. Die Anode besteht (in geladenem Zustand) aus Cadmium-Schwamm, die Kathode aus Nickel(III)oxidhydroxid (NiOOH). Als Elektrolyt dient KOH-Lösung. Der Akku liefert eine Spannung von 1.3 V. Da eine Batterie etwa 20% Cd enthält, darf sie nicht in den Abfall gelangen. Aufgabe Notieren Sie die Gesamtreaktion und notieren Sie die Lade- und Entladerichtung. Anode Cd(s) + 2 OH-(aq) → Cd(OH)2(s) + 2 e- Kathode 2 NiOOH(s) + 2 H2O(l) + 2 e- → 2 Ni(OH)2(s) + 2 OH-(aq) Gesamtreaktion Der Memory-Effekt ist ein Phänomen, das einen Ni-Cd-Akku bei falscher Handhabung schnell ausser Gefecht setzen kann. Wenn ein Ni-Cd-Akku mit niedrigen Strömen dauergeladen oder vor der vollständigen Entleerung (< 0.8 V = Geräteabschaltspannung) aufgeladen wird, d.h. wenn nur Teilladungen durchgeführt werden, entstehen an der Anode immer grössere Cd(OH)2-Kristalle. Durch mehrmalige Wiederholung wird der Vorgang verstärkt. Dadurch verringert sich die verfügbare Energie immer mehr, indem der Akku nur noch wenige Minuten die nötige Spannung liefert. Ni-Cd-Akkus können durch ein spezielles Refreshing Gerät wieder reaktiviert werden. (Bester NiCd Akku (CHIP 10/2002) Sanyo N-3US.) 3.5.6.3 Nickel-Metallhydrid-Akkumulator Bei den neuen Nickel-Metallhydrid-Akkumulatoren ist anstatt eines MemoryEffects ein Lazy Battery Effect zu erwarten, der dem Memory Effect zwar ähnelt aber wesentlich weniger gravierend ist. Die Ni-MH Akkus haben die Ni-CdAkkus bereits verdrängt. Sie sind umweltverträglicher und haben ein wesentlich besseres Leistungsgewicht; alle modernen Natels waren bis anhin mit ihnen ausgerüstet. Sie werden zur Zeit durch Li-Ion-Akkus verdrängt. Ihre Lebensdauer beträgt 500-1000 Lade-Entladecyclen. Der Hauptunterschied zum Ni-Cd-Akku liegt in der Wahl der Anode. Anstatt Cd wird eine spezielle Metalllegierung aus Lanthan, Neodym, Nickel, Cobalt und Silicium (abgekürzt als "M") verwendet. Die Legierung kann reversibel, elementaren Wasserstoff (H2) als Metallhydrid (M+I-H-I) speichern. Das Reduktionsmittel ist also Wasserstoff (H2). Als Oxidationsmittel wird wieder Nickel(III)oxidhydroxid (NiOOH) verwendet und als Elektrolyt KOH. Die Spannung beträgt 1.2 V. Bester NiMH-Akku (CHIP 10/2002) Panasonic Rechargeable 2000 Aufgabe Notieren Sie die Gesamtreaktion und notieren Sie die Lade- und Entladerichtung. Anode Metall-H2(s) + 2 OH-(aq) → Metall + 2 H2O(l) + 2 e- Kathode 2 NiOOH(s) + 2 H2O(l) + 2 e- → 2 Ni(OH)2(s) + 2 OH-(aq) Gesamtreaktion Metall-H2 NiOOH Akkumulatoren KME 163 3.5.6.4 Lithium-Ionen-Akkumulator Er scheint der Akku der Zukunft zu sein, leicht, hohe Energiedichte. Der Vorteil gegenüber dem Ni-MH Akkumulator liegt im Gewicht: er ist bei vergleichbarer Leistung um 50% leichter. Er hat keinen Memory oder Lazy Battery Effekt, dafür korrodiert aber das Lithium auch ohne Nutzung des Akkus, so dass er nach 2 Jahren unbrauchbar ist. Cobalt-Oxid Graphit Li+ e- Li+ eLi+ Li+ e- Li+ e- e- Das Bild enthält einen Fehler. Welchen? Die Anode besteht aus Graphit, der im geladenen Zustand aufgrund seines delokalisierten Elektronensystems gut Elektronen speichern kann. Für 1 Elektron wird als Gegenion 1 Li+-Ion eingelagert, man schreibt LiC. Beim Entladevorgang wird das im Graphit gebundene Elektron abgegeben (siehe Graphik). Die Cobaltionen im Cobalt-Oxid (LiCoO2 • CoO2) werden zu Co+III reduziert. Die an der Anode frei gewordenen Li+-Ionen wandern vom Graphit durch die Membran zum reduzierten Cobalt-Oxid, wo sie sich auch wieder als Li+-Ionen einlagern. Es entsteht LiCoO2. Die Li+-Ionen "swingen" praktisch zwischen den Elektroden hin und her. Deshalb wird die Li-Ionen-Batterie auch oft als Swing-Batterie bezeichnet. Der hohe Preis ist bedingt durch das relativ teure LiCoO2 • CoO2, daher wird mit Hochdruck an Mangan-Oxid Materialien gearbeitet. Aufgabe Übertragen Sie die Informationen im Text mit Hilfe der Graphik in Reaktionsgleichungen. Anode Kathode Gesamtreaktion Sinnvoller Umgang mit Akkus • • • • NiCd vermeiden, wenn man sie aber hat, dann pflegen, d.h. tief entladen und dann erst wieder laden aber nicht ständig laden. Akkus nutzen für Geräte mit hohem Stromverbrauch, die oft genutzt werden. Akkus lohnen sich nicht z.B. für Digitalwecker (lange Zeit geringe Ströme), da relativ hohe Selbstentladung In Ni-MH oder Lithium-Ionen Akkus investieren KME 164 Brennstoffzellen 3.5.7 Brennstoffzellen Heute wird in grossem Umfang elektrische Energie aus der Verbrennung fossiler Brennstoffe erzeugt. Der Wirkungsgrad beträgt etwa 30%, d.h. 30% der maximal zu erwartenden Energie wird in elektrische Energie umgewandelt. Die elektrische Energie wird wiederum eingesetzt für das Laden von Akkumulatoren, auch mit einem gewissen geringen Wirkungsgrad. Brennstoffzellen arbeiten bei einem Wirkungsgrad von 7085%, d.h. die direkte Umsetzung von chemischer Energie in elektrische Energie ist sehr effizient. Bei der sog. Knallgaszelle werden Wasserstoff und Sauerstoff in getrennten Räumen an Katalysatoren umgesetzt. Als Elektrolyt dient KOH. Die Spannung beträgt 1.23 V. Anode Kathode Gesamtreaktion Die Entwicklung der Brennstoffelemente ist allerdings trotz des starken Interesses an diesen Arbeiten noch immer nicht zu technischer Verwendbarkeit gediehen. Die Schwierigkeiten bei der elektrochemischen Oxidation von C, CO, CH4 (Methan), CH3OH (Methanol) oder ähnlich leicht verfügbaren Brennstoffen (also nicht H2) liegen in den hohen erforderlichen Aktivierungsenergien begründet. Arbeitet man deshalb bei hohen Temperaturen, so treten erhebliche Korrosionsprobleme durch die notwendigen Salzschmelzen auf (wasserfreier Elektrolyt). Bei Daimler-Crysler läuft eine A-Klasse die mit Methanol angetrieben wird: Necar5 (New Electric Car). Methanol kann in grossen Quantitäten aus Biomasse hergestellt werden. Entweder ein Reformer an Bord erhitzt das flüssige Methanol und versetzt es mit Wasser, wobei Wasserstoff nach CH3OH + H2O 3 H2 + CO2 entsteht, oder man setzt eine Direkt-Methanol-Brennstoffzelle ein. Das Prinzip ist das gleiche. Anode und Kathode bestehen aus porösen Graphitplatten. Dazwischen befindet sich eine Polymerfolie, die nur Protonen leiten kann, Elektronen werden nicht transportiert (kennt man aus der Biochemie, dort nennt man Moleküle mit solchen Eigenschaften "Protonophore"). Auf der Polymerfolie befindet sich eine dünne Katalysatorschicht, die den Wasserstoff in Protonen und Elektronen trennt. Die Elektronen nehmen den Weg über den Draht, erreichen den Sauerstoff und reagieren mit ihm zu O2-. Zwei durch die Folie tretende Protonen reagieren mit dem O2- zu H2O. Daimler-Crysler versprach den Start der Serienproduktion für 2005. Aber nix is. Wahrscheinlicher ist die Einführung von Wasserstoff-Verbrennungsmotoren. BMW plant bis 2007 einen BMW der 7er Reihe auf den Markt zu bringen. Auch läuft bei Daimler-Crysler ein Wasserstofffahrzeug F600 Hygenius mit Brennstoffzelltechnik. Eine Serienreife wird nicht vor 2020 erwartet. Brennstoffzellen auf Basis von Hydrazin (N2H4(l)) sind bereits entwickelt worden. Da sich nach N2H4(l) + O2(g) → N2(g) + 2 H2O nur Stickstoff und Wasser bilden, ist diese Art des Antriebs sehr umweltfreundlich, ist aber wegen des hohen Preises (150 mal teurer als Benzin) bisher nur in der Raumfahrt eingesetzt worden. e CH3OH e - - O H+ 2 CO HO 2 2 Anode Kathode N N N N * protonenleitende Polymerm em bran n * Brennstoffzellen 3.5.7.1 Drill&Practice: Batterien 1. Ein bischen Japanisch sollte jeder lernen. Was bedeutet „Itai-Itai“ und was hat das mit Akkumulatoren zu tun? 2. Es gibt eine Vielzahl verschiedener Batterietypen (Nicht nur Bauart, sondern auch chemische Typen). Nennen Sie ein paar Gründe, indem Sie die chemische Verschiedenartigkeit der Batterien kurz miteinander vergleichen. 3. Das Lithium in Li-Batterien darf nicht mit Wasser in Berührung kommen, da es mit diesem sofort reagiert. Formulieren Sie die entsprechende Reaktionsgleichung (Tabelle der Redoxpotentiale zu Hilfe nehmen). Bestimmen Sie die Oxidationszahlen und stellen Sie fest, wer oxidiert bzw. reduziert wird und wieviele Elektronen jeweils übertragen werden. 4. Fassen Sie die Vor- und Nachteile von Blei-, Ni/Cd- und Ni/Metallhydrid-Akkumulatoren anhand der Angabe in der Tabelle im Skript zusammen. 5. Warum eignet sich prinzipiell der Bleiakku so gut für den Einsatz in Motorfahrzeugen? Nutzen Sie für Ihre Antwort die Gesamtreaktion des Bleiakkus. Lösungen unter www.dinternet.ch.vu weiter zu Drill&Practice. KME 165 Elektrische zu chemische Energie: Elektrolyse 3.5.8 Elektrische zu chemische Energie: Elektrolyse Die Brennstoffzelle wandelt chemische Energie aus H2 und O2 in elektrische Energie um. Der umgekehrte Vorgang, die Erzeugung von H2 und O2 aus Wasser wird bekanntlich Elektrolyse genannt. Elektrolysen sind uns bereits mehrfach begegnet u.a. bei der elektrischen Leitfähigkeit von Salzlösungen. Die Elektrolyse ist eine wichtige Technik zur Produktion von Stoffen wie Chlor (Cl2) und metallischem Natrium (Na) aus der NaClSchmelzelektrolyse, Aluminium aus der Schmelzflusselektrolyse, Wasserstoff (H2) und Sauerstoff (O2) aus der Wasserelektrolyse (Labormassstab) oder Edelmetalle wie Gold aus den entsprechenden Salzlösungen. Durch die Elektrolyse kann eine nicht von selbst ablaufende Redoxreaktion erzwungen werden, es läuft also unter Energieaufwand eine Bergaufreaktion ab, ganz so wie bei der Fotosynthese. Ein wichtiger Punkt ist, dass sich die elektrische Energie in Form von chemischer Energie wiederfindet. Bei der Wasserelektrolyse wird H2O in die "energiereicheren" Stoffe H2 und O2 überführt, die dann in einer Knallgas-Brennstoffzelle wieder elektrische Energie liefern können. Elektrische Energie lässt sich in Form von chemischer Energie speichern. Elektrischer Strom lässt sich in Form von H2 „zwischenspeichern“. H2 + O 2 energiereich Brennstoffzelle Elektrolyse H2O energiearm Aufgabe Zeichnen Sie ein Energiediagramm, aus der der obere Kreislauf hervorgeht. Für eine Elektrolyse sind 2 Elektroden und ein Elektrolyt notwendig, der frei bewegliche Ladungsträger enthält z.B. Salzlösung oder Salzschmelze. Der Elektrolyt kann durch das Anlegen von Gleichstrom stofflich verändert werden. KME 166 Elektrische zu chemische Energie: Elektrolyse 3.5.8.1 Elektrolyse einer Na2SO4-Lösung Beobachtung (Gas?, pH?) Pluspol orange-rot: H3O+-Ionen, blau: OH--Ionen Minuspol Aufgabe Zeichnen Sie die Beobachtungen in die Graphik ein. Formulieren Sie mit Hilfe der Beobachtungen und mit Hilfe der Redoxtabelle die Reaktionsgleichungen. 2Extra-Info: 2 SO24 → S2O8 + 2 e bei +2.01 Volt. + - Teilchen die sich im Elektrolyt befinden? Oxidationsüberlegungen: Was könnte alles passieren? Was ist wahrscheinlich? Reduktionsüberlegungen: Was könnte alles passieren? Was ist wahrscheinlich? Oxidation (Anode) Reduktion (Kathode) Gesamtreaktion FAZIT für Elektrolysen: Wer reagiert mit wem? KME 167 Elektrische zu chemische Energie: Elektrolyse 3.5.8.2 Aluminium und Alu-Recycling Aluminium: Verwendung und Herstellung Anode Kathode KME 168 Elektrische zu chemische Energie: Elektrolyse KME 169 Aluminium und Getränkedosen • Verbrauch von Aludosen pro Jahr weltweit 150 Milliarden Europa 29 Milliarden Schweiz 120 Millionen Gewicht einer 3.3 dl Aludose Energieverbrauch pro Tonne Alu Stromverbrauch einer 4-köpfigen Familie Vorteile von Alu-Getränkedosen Transport von Getränken in Aludosen Recyclingquote Schweiz Anteil von rezykliertem Material in einer Getränkedose Dosensammlung • Verbrauch von Aludosen pro Kopf pro Jahr USA 380 Stück Europa 75 Stück Schweiz 17 Stück 13.8 g (ca. 1700 Tonnen Alu für 120 Mio Dosen) 12500 kWh 66% der Energie werden in der Schweiz aus Wasserkraft gewonnen 3500 kWh pro Jahr Mit der Energie zur Gewinnung der 1700 Tonnen für die schweizerischen Aludosen könnten ca. 6000 4-köpfige Familien ein Jahr mit Strom versorgt werden. leicht, verformbar aber formbeständig, gute Temperaturleitfähigkeit, dunkel, korrosionsbeständig, chemisch weitgehend neutral, recylingfähig 1 m3 Transportvolumen enthalten 755 Getränkeflaschen oder 1936 3.3 dl Dosen Ein 32 t LKW transportiert 29000 L in Aludosen. Für die gleiche Menge in Flaschen bräuchte man zwei LKW. 91% oder 1400 Tonnen leere Dosen 60% Jede Aludose enthält einen Aufschlag von 5 Rappen. Die Sammlungen werden mit 1.30 SFR/kg Dosen vergütet. (IGORA) Recyclingprozedur Abtrennen des Lacks und der org. Reste durch Abschwelen Einschmelzen zu neuen Dosen und anderen Aluprodukten (Zwischen Primäraluminium und Sekundäraluminium besteht kein Qualtiätsunterschied.) Energieverbrauch beim Recycling 5% der Primärenergie WWF-Oekobilanz Verpackungen 9/95 „Die Aludose ist das beste Einweggebinde 3.3 dl für kohlensäurehaltige Getränke.“ Aludose 30 UBP (Umweltbelastungspunkte) PET-Flasche 41 UBP Glas-Flasche 46 UBP Wie bei allen statistischen Aussagen gilt: Genau hinsehen und genau erkennen, über was gesprochen wird. Nach wie vor gilt: Vermeidung von Einwegverpackungen ist immer die bessere und ökologischere Alternative.