TC3 - Bioprozesstechnik Vorlesung Enzyme - Mai 2010
Werbung

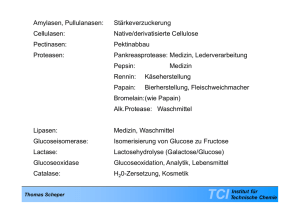
Amylasen, Pullulanasen: Stärkeverzuckerung Cellulasen: Native/derivatisierte Cellulose Pectinasen: Pektinabbau Proteasen: Pankreasprotease: p Medizin,, Lederverarbeitung g Pepsin: Medizin Rennin: Käseherstellung Papain: Bierherstellung, Fleischweichmacher Bromelain:(wie Papain) Alk.Protease: Waschmittel Lipasen: Medizin Waschmittel Medizin, Glucoseisomerase: Isomerisierung von Glucose zu Fructose Lactase: Lactosehydrolyse (Galactose/Glucose) Glucoseoxidase Glucoseoxidation, Analytik, Lebensmittel Catalase: H202-Zersetzung, Kosmetik Thomas Scheper TCI Institut für Technische Chemie 35% Waschmittel 12% 10% 7% 7% 5% 5% 10% Mehl- und Backwaren Käseherstellung Früchteverwertung und Weinherstellung Brauerei Stärkeabbau Glucose-Isomerisierung Abbildung : 9% Sonstige: Diagnostika Chemie Papier und Textil Silage und Tierfutter Lederherstellung g Industrielle Anwendungsfelder von Enzymen verändert nach Taschenatlas der Biotechnologie und Gentechnik, Wiley VCH 2002 Thomas Scheper TCI Institut für Technische Chemie Thomas Scheper TCI Institut für Technische Chemie Industrielle Enzyme bakteriellen Ursprungs: 60% proteolytische Enzyme Enzyme, 20% Carbohydrasen tierischen Ursprungs: Rennin (Käseherstellung) Pankreas-Proteasen/Lipasen pflanzlichen Ursprungs: Thomas Scheper Papain TCI Institut für Technische Chemie Enzyme als Biokatalysatoren: Vorteile 1 Effiziente Katalysatoren: beschleunigen um den Faktor ~ 108 – 1010 (1017 bekannt), Konzentration ~ 10-3 – 10-4 % (chem. Katalysator 0.1 – 1%) Umweltfreundlich: abbaubar Milde Reaktionsbedingungen: pH 5 5-8, 8 20 20-40 40 °C C, minimiert Nebenreaktionen Kompatibel mit anderen Enzymen: Ähnliche Reaktionsbedingungen – Multienzymreaktionen Gleichgewicht verlagern Nicht gebunden an natürliche Rolle: Hohe Substrattoleranz Wasser - Organische Lösungsmittel Breites Spektrum an Reaktionen: katalysieren verschiedenste Reaktionen (Nomenklatur) kein Einfluß auf thermodynamisches Gleichgewicht Hin- und Rückreaktion werden katalysiert Thomas Scheper S TCI P Q Institut für Technische Chemie Selektivität: Chemoselektivität: greift nur eine funktionelle Gruppe an, Esterhydrolyse / Acetalspaltung / …. Regioselektivität und Diastereoselektivität: erkennen gleiche funktionelle Gruppen an verschiedenen Stellen im Molekül, setzt nur eine um Enantioselektivität: aus L-Aminosäuren – chirale Katalysatoren, prochirale Verbindungen werden zu optisch aktiven Produkten umgesetzt, oder die Enantiomeren einer racemischen Mischung reagieren unterschiedlich schnell (kinetische Racematspaltung); bereits 1898 von Emil Fischer erkannt O R O R1 H+ H 2O O + R1-OH R OH OH OH H O HO HO OH OR1 + H2O O HO HO R OH + R1-OH OH R O-Methyltransferase OH OH Thomas Scheper S-Adenosylmethionin OCH3 OH TCI Institut für Technische Chemie Enzyme als Biokatalysatoren: Nachteile Enzyme werden in der Natur nur in einer Enantiomerenform gebildet: nur L-Aminosäuren, kein Spiegelbild (komplett neues Enzym nötig, um z.B. bei enantioselektiver Reaktion das entgegengesetzte Enantiomer zu synthetisieren) Variationen der Reaktionsbedingungen limitiert: erhöhte Temp., extreme pH, hohe Salzkonz. denaturieren Enzyme Höchste Aktivität in Wasser: viele organ. Moleküle schlecht wasserlöslich, enzymatische Aktivität in organ. Lösungsmittel stark erniedrigt Enzyme benötigen ihre natürlichen Cofaktoren bzw. Cosubstrate: NAD(P)H, ATP, SAM, UDP-Glucose, instabil, teuer, in stöchiometrischen Mengen, können nicht durch künstliche Cofaktoren ersetzt werden,, ökonomisches Recycling noch nicht möglich (Ausnahme: NADH Rec. mit Formiatdehydrogenase) Enzyme zeigen Inhibierungsphänomene: S b t t oder Substratd Produktinhibierung, P d kti hibi Substratkonzentration S b t tk t ti niedrig i di h halten, lt Produkt P d kt kontinuierlich entfernen (schwierig) Enzyme y lösen Allergien g aus: mit gleicher Vorsicht wie Chemikalien behandeln Thomas Scheper TCI Institut für Technische Chemie Subtilisin: unspezifisch Trypsin: Spaltung auf Carboxylseite von Cystein oder Arginin Thrombin: Spaltung zwischen Arginin und Glycin Coenzyme Thomas Scheper ATP Phosphat NAD(P)H FADH2 Hydrid Coenzym A Acetylreste Biotin Carboxylrest S-Adenosylmethionin Methylgruppe TCI Institut für Technische Chemie Thomas Scheper TCI Institut für Technische Chemie The following numbering scheme was developed by the Enzyme Commission (E.C.) Enzyme number: E.C. X. X. X. X number of main division/class further identification number, e.g. for actual substrate type of reaction (often donor group) type of reaction (often acceptor group) Main division/classes 1. Oxidoreductases 2. Transferases 3. Hydrolases 4. Lyases 5. Isomerases 6 6. Li Ligases Thomas Scheper TCI Institut für Technische Chemie Mechanismus der Serin Protease “Katalytische Triade” His 57 Asp 102 CH2 O H2 C C O H N1 Ser 195 3 CH2 N: H O nucleophiler Angriff R’ R N C O H I ) Mi I.) Michaelis-Komplex h li K l Thomas Scheper PolypeptidSubstrat TCI Institut für Technische Chemie His 57 Asp 102 CH2 O H2 C C O H Ser 195 N N+ CH2 H O R’ R N C H O- tetraedrisches Zwischenprodukt II.) Tetraedrisches Zwischenprodukt Thomas Scheper TCI Institut für Technische Chemie His 57 Asp 102 CH2 O H2C C O H Ser 195 N CH2 N H O R’ R Acyl-Enzym A lE Zwischenprodukt N C O H R’NH2 H2O His 57 Asp 102 C O Ser 195 CH2 O H2C H N CH2 N O H III.) Hydrolyse des Acyl-EnzymZwischenproduktes Thomas Scheper R O H C O TCI Institut für Technische Chemie His 57 Asp 102 C O Ser S 195 CH2 O H2 C H N CH2 N+ O H R O C H His 57 Asp 102 CH2 O H2 C C O H Ser 195 N CH2 N H O + R O IV ) Decacylierung IV.) D li Thomas Scheper O- H C O TCI Institut für Technische Chemie Leonar Michaelis 1875-1949 Thomas Scheper Maud Menten 1879-1960 TCI Institut für Technische Chemie v vmax 1 vmax 2 KM Thomas Scheper [S] TCI Institut für Technische Chemie 1 v 1 vmax - 1 KM Thomas Scheper 1 [S] TCI Institut für Technische Chemie allosterische ll t i h Eff Effekte: kt Änderung Ä d der d R Raumstruktur t kt akt. Zentrum allosterischer Hemmer allosterischer Aktivator keine Hemmung keiner Aktivierung nix Thomas Scheper schlapp rasch TCI Institut für Technische Chemie v ohne Hemmung vmax 1 v max 2 Diffusionshemmung [S] Thomas Scheper TCI Institut für Technische Chemie 1 v 1 vmax 1 KM Thomas Scheper Diffusionshemmung ohne Hemmung g 1 [S] TCI Institut für Technische Chemie pH-Gradient pH Gradient Substrat Produkt Enzym y Thomas Scheper TCI Institut für Technische Chemie C H 2 C OOH H N O S N O C H3 C H3 G A id P -G-Amidase Pen H2 O C OOH Phenylessigsäure Penicillin G C H3 C H3 S H2 N + N O C OOH 6 Amino 6penicillansäure (6-APA ) Reaktionsschema für die enzymatische Spaltung von Penicillin G zur 6-APS-Produktion Thomas Scheper TCI Institut für Technische Chemie Festbett mit Penicillin-G-Amidase pH 9 7 5 3 Ort Aktivität der "Hydrolyse" 7 Thomas Scheper pH TCI Institut für Technische Chemie pH-Messung und nd Kontrolle Lauge Träger mit immobilisierter P i illi G A id Penicillin-G-Amidase Thomas Scheper TCI Institut für Technische Chemie Enzym H 2 O + (D, L)-R C OOH L-Ami no sä ur e + D-Aminoa cy l -AS + C H3 C OOH NHC OR' Aminoacyl-Aminosäure ((racemisch)) Thomas Scheper TCI Institut für Technische Chemie D,L-Ester D,L Ester v1 v2 v3 L-Aminosäure L Aminosäure + D D-Ester Ester LA i ä L-Aminosäure + D-Aminosäure DA i ä L-Aminosäure + D-Aminosäure v1 = enantioselektive i l k i enzymatische i h Hydrolyse H d l v2 = nicht-enantioselektive enzymatische Hydrolyse v3 = nicht-enzymatische y Hydrolyse y y Thomas Scheper TCI Institut für Technische Chemie D,L-Acetylaminosäure Aminoacylase l Festbett D,L-Acetylamino-säure i ä Tank K i t lli ti Kristallisation Reracemisieren der D-Acetylaminosäure Seperator erwärmen kristalline L-Aminosäure Thomas Scheper TCI Institut für Technische Chemie Edukte Ultrafiltrationsmembran Reaktionsraum mit Enzymen Fritte Produkte Abbildung x.11 Prinzip des Festmembranreaktors Edukt Edukt Ultrafiltrationsmembran Produkt Produkt Prozeßführung und -regelung Thomas Scheper TCI Institut für Technische Chemie N-Acetylierung von D,L-Methionin Zugabe von N-AcetylD,L-Methionin Kristallisation Acylase Enzymmembranreaktor Verdampfer p Racemisierung von N-AcetylD,(L)-Methionin Mutterlauge g Separation Trocknung Feinreinigung L-Methionin Thomas Scheper TCI Institut für Technische Chemie O NH4 OH + NH2 Enzym 1 R COOH R NAD + NADH CO 2 + H 2 O C OOH + 2 H2 O HCOOH Enzym 2 Enzym 1 z.B. Leucindehydrogenase (LeuDH) Enzym 2 z.B. Formiatdehydrogenase (FDH) Thomas Scheper TCI Institut für Technische Chemie NH2 + H2 O + CO2 COOH O COOH E1 HCOOH Thomas Scheper E2 Ultrafiltrationsmembran Ausschlußgrenze 5000 Dalton PEG 20 000 NADH TCI Institut für Technische Chemie Enzymatisches Verfahren Chemisches Verfahren H2N NH COOH O S N O CH3 O Herstellung von 7-Aminocephalosporinsäure COOH O Cephalosporin C D-Aminosäureoxidase Lösemittel CHCl 22 (CH3 )3 SiHN (CH3 )3SiO2C O NH3 HO 22 (CH)SiCl 33 S NH O O2 ZN-CPC C C N O O CH3 NH COOH O O S N CO2Si(CH3 )3 O O COOH CH3 O a -Keto-adipinyl-7-ACS mehrfach silyliertes Molekül HO 22 T<0°C PCl5 CO2 (CH3 )3SiH (CH3 )3SiO2C N Cl O O S N O CO2 Si(CH3 )3 OH H3 S NH O O N COOH O Imidchlorid CH3 O O Glutaryl-7-ACS HOOC-(CH)-COOH 23 Hydrolyse T<0°C Glutarylamidase H2 N O S N H3 O COOH O 7-Aminocephalosporansäure Thomas Scheper TCI Institut für Technische Chemie Vergleich der Kosten der Ausgangsmaterialen 88 Prrocess Chemical process 100 Enzymatic process Glutaryl amidase from natural source 24 Enzymatic process Glutaryl amidase from E. Coli 0 20 40 60 80 100 Raw material costs [%] Thomas Scheper TCI Institut für Technische Chemie Herstellung der Glutarylamidase 100 % culture lt broth b th 2,3 % 100 % raw material 3.9 % enzyme cost 100 % 15,3 % 0 10 20 30 40 50 60 70 80 90 100 [%] natural source Thomas Scheper TCI rec. E. Coli Institut für Technische Chemie Vergleich der Verfahren waste per t 7-ACA 7 ACA Zinc waste to be as ZnNH4PO4 incinerated waste water emission chemical process 1.8 t 31 t 0.1 t COD 7.5 kg enzymatic process 0.0 t 1t 1.7 t COD 1 kg Thomas Scheper TCI Institut für Technische Chemie Abfallmengen 1 t 7-ACA Chemischer Prozeß 31 t Thomas Scheper Enzymatischer Prozeß 0,3 t TCI Institut für Technische Chemie