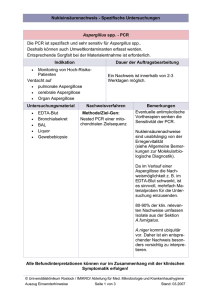
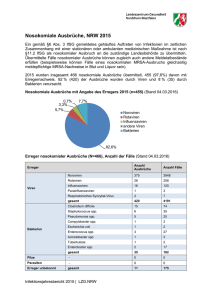
Ätiologisch bedeutende Mikroorganismen bei bakteriellen Infektionen
Werbung

Leistungskatalog Institut für Hygiene und Mikrobiologie der Julius-Maximilians-Universität zu Würzburg Stand Dezember 2009 Seite 1 von 281 Öffnungszeiten – Ansprechpartner – Rufbereitschaft Dienstzeiten: Montag - Freitag Annahmeschluss Samstag Annahmeschluss Sonntag Annahmeschluss 8.00 - 17.00 Uhr 16.30 Uhr 8.00 - 12.00 Uhr 11.30 Uhr 8.00 - 12.00 Uhr 11.30 Uhr Rufbereitschaftsdienst: Montag - Freitag: 17.00 - 8.00 Uhr Samstag und Sonntag 12.00 - 8.00 Uhr Diensthandy: Bei eiligen Untersuchungen können die Materialien auch außerhalb der regulären Dienstzeiten verarbeitet werden. In diesen Fällen ist der Dienstarzt über die Telefonzentrale 201-13 oder über Dienst-Handy 0172 - 6633567 erreichbar. Seite 2 von 281 Wichtige Adressen, Telefonanschlüsse und Funkruf __________________________________________________________________________ Telefon Funk __________________________________________________________________________ Institut für Hygiene und Mikrobiologie Institutsvorstand Prof. Dr. M. Frosch Sekretariat 46 161 Stellvertreter Prof. Dr. U. Vogel 46 802 3556 Nationales Referenzzentrum für Meningokokken Prof. Dr. U. Vogel 46 802 3556 46 941 3154 Medizinische Mikrobiologie Prof. Dr. Dr. Abele-Horn Infektiologie Prof. Dr. Dr. B. Sinha 46949 Prof. Dr. Dr. Abele-Horn 46 941 3154 46 802 3556 Frau Heinrich 57 141 3361 Frau Junger 57 142 2274 Herr Kröckel 57 143 2283 Herr Kühnlein 57 144 2263 Krankenhaushygiene Prof. Dr. U. Vogel Hygienefachkräfte Diagnostik Befundabfrage 46 712 Pforte 46 918 Varialabor 46 939 Blutkultur-, Liquorlabor 46 933 TB-Labor 46 919 Pilzlabor 46 910 Stuhl-/Parasitologielabor 46 940 Serologisches Labor 46 938 DNA-Labor 46 912 __________________________________________________________________________ Seite 3 von 281 Inhaltsverzeichnis BAKTERIOLOGIE ................................................................................................................. 8 I Allgemeine Angaben zur Gewinnung und zum Transport mikrobiologischer Untersuchungsmaterialien ..................................................................................................... 8 1. Gewinnung und Versand mikrobiologischer Untersuchungsmaterialien ...................... 8 1.1 Angaben auf dem Anforderungsschein ................................................................ 9 1.2 Gewinnung von Untersuchungsmaterialien .........................................................10 1.3 Transportgefäße und Transportmedien...............................................................11 1.4 Transport und Lagerung von Untersuchungsmaterialien .....................................18 II Diagnostik von Infektionskrankheiten ............................................................................23 Sepsis / Endokarditis / Kardiovaskuläre Infektionen ..........................................................23 1 Sepsis ........................................................................................................................23 2 Endokarditis ...............................................................................................................25 3 Perikarditis .................................................................................................................26 4 Schrittmacherinfektionen ...........................................................................................27 5 Katheter-assoziierte Infektionen.................................................................................28 6 Infektionen mit ungewöhnlichen Erregern ..................................................................30 Neurologische Infektionen und Infektionen des ZNS .........................................................35 1 Meningitis, Enzephalitis, Empyem .............................................................................35 2 Hirnabszess ...............................................................................................................36 Infektionen der oberen Atemwege ....................................................................................43 Infektionen der Mundhöhle................................................................................................43 1 Parodontitis................................................................................................................43 2 Sialadenitis ................................................................................................................44 3 Stomatitis, Periodontitis .............................................................................................44 Infektionen der Nase und der Nasennebenhöhlen ............................................................45 1 Rhinitis .......................................................................................................................45 2 Sinusitis .....................................................................................................................46 Infektionen des Oropharynx ..............................................................................................46 1 Epiglottitis ..................................................................................................................46 2 Laryngitis ...................................................................................................................47 3 Tonsillitis, Pharyngitis ................................................................................................48 4 Peritonsillarabszess ...................................................................................................49 Infektionen der Ohren .......................................................................................................52 1 Otitis externa .............................................................................................................52 2 Otitis media................................................................................................................53 Infektionen der tiefen Atemwege .......................................................................................55 1 Pneumonie, Bronchitis ...............................................................................................55 2 Lungenabszess..........................................................................................................57 3 Cystische Fibrose ......................................................................................................58 4 Infektionen mit seltenen Erregern ..............................................................................59 Infektionen am Auge .........................................................................................................63 1 Konjunktivitis, Blepharitis, Dakryoadenitis, Dakryozystitis, Infektionen der Orbita ......63 2 Keratitis .....................................................................................................................64 3 Kontaktlinsen-Keratitis ...............................................................................................64 4 Endophthalmitis .........................................................................................................65 Infektionen der Haut und der Weichgewebe, postoperative Wundinfektionen, Abszesse innerer Organe..................................................................................................................70 Knochen und Gelenke ......................................................................................................79 1 Septische Arthritis ......................................................................................................79 2 Infektreaktive Arthritis ................................................................................................80 3 Osteomyelitis .............................................................................................................80 Infektionen der Harnwege .................................................................................................84 Seite 4 von 281 1 Zystitis, Pyelonephritis ...............................................................................................84 Urogenitale Infektionen .....................................................................................................90 1 Urethritis ....................................................................................................................90 2 Prostatitis ...................................................................................................................91 3 Epididymitis ...............................................................................................................93 4 Zervizitis ....................................................................................................................94 5 Endometritis und Salpingitis .......................................................................................95 6 Bartholinitis ................................................................................................................95 7 Bakterielle Vaginose (BV) ..........................................................................................95 8 Infektionen durch Intrauterinpessare (IUP, Spirale) ....................................................97 Infektionen des Gastrointestinaltraktes ...........................................................................102 7 Ergänzende Untersuchungen bei Infektionen des Magen-Darm-Traktes: ................103 Infektionen durch Parasiten ............................................................................................107 III Diagnostik bei Infektionen mit seltenen Erregern .........................................................112 Acanthamoeba................................................................................................................114 Actinomyces spp.............................................................................................................115 Amöben (Entamoeba histolytica) ....................................................................................116 Anaerobier ......................................................................................................................117 Aspergillus spp. ..............................................................................................................119 Außereuropäische Pilze (Dimorphe Pilze) .......................................................................120 Bacillus anthracis (Anthrax) ............................................................................................121 Bartonella spp. ................................................................................................................122 Bordetella pertussis – B. parapertussis - Keuchhusten ...................................................123 Borrelia burgdorferi - Borreliose ......................................................................................124 Brucella spp. ...................................................................................................................126 Candida spp. ..................................................................................................................127 Capnocytophaga canimorsus..........................................................................................129 Chlamydophila pneumoniae............................................................................................130 Chlamydophila psittaci ....................................................................................................131 Chlamydia trachomatis ...................................................................................................132 Clostridium spp. ..............................................................................................................134 Corynebacterium diphtheriae - Diphtherie .......................................................................136 Coxiella burnetii ..............................................................................................................138 Cryptococcus neoformans ..............................................................................................139 Cryptosporidium spp. ......................................................................................................140 Dermatophyten ...............................................................................................................141 Echinococcus multilocularis ............................................................................................142 Echinococcus granulosus ...............................................................................................142 Erysipelothrix - Erysipeloid (Schweinerotlauf) .................................................................143 Francisella tularensis - Tularämie ...................................................................................143 Giardia duodenalis - Giardiasis .......................................................................................145 Erreger der HACEK-Gruppe ...........................................................................................146 Legionella spp. - Legionellose .........................................................................................147 Leishmanien - Leishmaniose ..........................................................................................149 Leptospira spp. - Leptospirose ........................................................................................150 Listeria spp. - Listeriose ..................................................................................................151 MRSA – Methicillin-resistenter Staphylococcus aureus...................................................152 Mycoplasma hominis ......................................................................................................153 Mycoplasma pneumoniae ...............................................................................................154 Mykobakterien - Mycobacterium tuberculosis - Komplex.................................................155 Nicht-tuberkulöse Mykobakterien (NTM) .........................................................................157 Neisseria gonorrhoeae - Gonorrhoe................................................................................159 Nocardia spp. - Nokardiose.............................................................................................160 Pneumocystis jirovecii.....................................................................................................161 Staphylococcus spp. .......................................................................................................162 MRSA .............................................................................................................................164 Streptococcus spp. .........................................................................................................165 Seite 5 von 281 Ureaplasma urealyticum .................................................................................................166 Vibrio cholerae - Cholera ...............................................................................................168 Yersinia spp. ...................................................................................................................169 IV Untersuchungsmaterialien .......................................................................................170 Abstriche.........................................................................................................................170 Materialien aus den Atemwegen .....................................................................................176 Biopsien ..........................................................................................................................180 Blut /Stammzellen ...........................................................................................................180 Fremdkörper ...................................................................................................................183 Haut und Nägel ...............................................................................................................185 Punktate .........................................................................................................................187 Knochenmark .................................................................................................................189 Sekrete ...........................................................................................................................191 Gastrointestinaltrakt ........................................................................................................196 Harnwege .......................................................................................................................197 Serologie ............................................................................................................................201 I. Bakteriologie ...................................................................................................................201 Bartonella henselae ........................................................................................................201 Borrelia burgdorferi .........................................................................................................201 Brucella abortus ..............................................................................................................202 Campylobacter jejuni ......................................................................................................203 Chlamydia trachomatis ...................................................................................................203 Chlamydophila pneumoniae............................................................................................204 Coxiella burnetii ..............................................................................................................204 Diphtherie-Antitoxin (Impfstatus) .....................................................................................205 Escherichia coli O157 (EHEC) ........................................................................................206 Francisella tularensis ......................................................................................................206 Helicobacter pylori ..........................................................................................................207 Legionella pneumophila ..................................................................................................207 Leptospira species ..........................................................................................................208 Mycoplasma pneumoniae ...............................................................................................208 Neisseria gonorrhoeae....................................................................................................209 Rickettsia sp. ..................................................................................................................209 Salmonella spp ...............................................................................................................210 Streptococcus pyogenes.................................................................................................210 Tetanus-Antitoxin (Impfstatus) ........................................................................................211 Treponema pallidum .......................................................................................................212 Yersinia enterocolitica/Y. pseudotuberculosis .................................................................213 II. Mykologie ....................................................................................................................214 Aspergillus fumigatus ......................................................................................................214 Seltene Aspergillus-Spezies ...........................................................................................214 Außereuropäische Systemmykosen durch Coccidioides immitis oder Histoplasma capsulatum .....................................................................................................................215 Candida albicans ............................................................................................................215 Cryptococcus neoformans, C. gattii ................................................................................216 Exogen Allergische Alveolitis ..........................................................................................216 III. Parasitologie ............................................................................................................217 Echinococcus spp. ..........................................................................................................217 Entamoeba histolytica .....................................................................................................217 Leishmania spp...............................................................................................................218 Schistosoma spp. ...........................................................................................................218 Taenia solium .................................................................................................................219 Toxocara canis ...............................................................................................................219 Toxoplasma gondii ..........................................................................................................220 Trichinella spiralis ...........................................................................................................221 Mycobacterium tuberculosis............................................................................................221 Hygiene ..............................................................................................................................222 Seite 6 von 281 Hinweise für den Einsender ............................................................................................223 Molekularbiologie ...............................................................................................................247 I. Präanalytik ......................................................................................................................247 II. Laufzeiten bei molekularbiologischen Untersuchungen ..................................................248 III. Angaben zu einzelnen Untersuchungen ........................................................................250 Aspergillus spp. ..............................................................................................................250 Borrelia burgdorferi .........................................................................................................251 Chlamydophila pneumoniae............................................................................................252 Chlamydia trachomatis ...................................................................................................253 Enterohämorrhagischer Escherichia coli (EHEC) ............................................................254 Enteropathogener E. coli (EPEC)...................................................................................255 Enterotoxischer E. coli (ETEC) ......................................................................................256 Enteroinvasiver E. coli (EIEC) und Shigellen .................................................................257 Enteroaggregativer E. coli (EAEC) .................................................................................258 Eubakterien ....................................................................................................................259 Legionella sp. .................................................................................................................260 Mycobacterium tuberculosis............................................................................................261 Mycoplasma pneumoniae (ZNS-Infektion) ......................................................................262 Mycoplasma pneumoniae (Pneumonie) ..........................................................................263 Pneumocystis jirovecii (P. carinii f. sp. hominis) ..............................................................264 Toxoplasma gondii ..........................................................................................................265 Tropheryma whipplei.......................................................................................................266 IV. Molekularbiologische Methoden zur Speziesdiagnostik, Feintypisierung und Resistenztestung ................................................................................................................267 Mycobacterium sp. 16s ...................................................................................................267 Mycobacterium sp. - ITS .................................................................................................268 Mycobacterium tuberculosis - Komplex ...........................................................................269 Mycobacterium bovis ......................................................................................................270 Eubakteriendifferenzierung durch 16S rRNA-Sequenzierung..........................................271 Methicillin-resistenter Staphylococcus aureus (MRSA): mecA-Gen ................................272 spa-Typisierung von Methicillin-resistenten Staphylococcus aureus Stämmen (MRSA) ..273 Vancomycin Resistenzgene für Enterokokken ................................................................274 Molekularer Direkt-Nachweis von MRSA (IDI MRSA, Becton Dickinson) ........................275 Typisierung von VRE mittels multilocus variable number of tandem repeat analysis (MLVA) .......................................................................................................................................276 NRZM (www.meningococcus.de) ....................................................................................277 I. Meningokokken-Nachweis und Typisierung .................................................................277 II. Meningokokken-Serologie...........................................................................................278 III. Weitere Tätigkeiten im Sinne des Aufgabenkatalogs des RKI ....................................278 IV. Literatur .....................................................................................................................279 KLHI (www.haemophilus-online.de) ................................................................................280 I. Haemophilus influenzae-Nachweis und Typisierung ....................................................280 II. Weitere Tätigkeiten im Sinne des Aufgabenkatalogs des RKI .....................................280 III. Literatur .....................................................................................................................281 Seite 7 von 281 BAKTERIOLOGIE I Allgemeine Angaben zur Gewinnung und zum Transport mikrobiologischer Untersuchungsmaterialien Die Diagnose bakterieller Infektionen zählt zu den wichtigsten Aufgaben des medizinischmikrobiologischen Labors. Die Häufigkeit, die Zahl der in Frage kommenden Erreger und die diagnostischen Möglichkeiten haben in großem Maß zugenommen. Der vorliegende Leistungskatalog gibt in dem speziellen Teil einen Überblick über die Erregergruppen, die bei bakteriologisch verursachten Krankheitsbildern eine Bedeutung haben können. Im Hinblick auf einen gezielten Resourceneinsatz wird zwischen häufig vorkommenden und seltenen Infektionserregern unterschieden. Im Rahmen einer Stufendiagnostik sollten zuerst die häufigen Erreger untersucht und dann, bei negativem Untersuchungsergebnis, an die seltenen Erreger gedacht werden. Für Mikroorganismen, die im Institut für Hygiene und Mikrobiologie nachgewiesen werden, sind die labordiagnostischen Verfahren mit Angaben der Untersuchungsmethoden angegeben. Für Erreger, deren Untersuchungen nicht angeboten werden, die aber differentialdiagnostisch von Bedeutung sind, wird auf das Labor, in dem entsprechende Untersuchungen durchgeführt werden, verwiesen. 1. Gewinnung und Versand mikrobiologischer Untersuchungsmaterialien Die richtige Gewinnung adäquaten Untersuchungsmaterials und der sachgemäße Transport zum Labor sind die Voraussetzung für ein valides Ergebnis. Dafür müssen folgende Bedingungen erfüllt sein: - ausreichende Angaben auf der Untersuchungsanforderung (Anforderungsschein) - optimale Entnahme des Untersuchungsmaterials - adäquate Transportbedingungen - die Informationsübermittlung wesentlicher Patientendaten Seite 8 von 281 1.1 Angaben auf dem Anforderungsschein Bitte senden Sie pro Untersuchungsmaterial einen Anforderungsschein ein! Exakte Angaben auf dem Anforderungsschein erleichtern durch Einengen der Fragestellung die Befundbeurteilung. In einigen Fällen ergibt sich aus ihnen erst die entsprechend anzuwendende Verarbeitungstechnik (z. B. bei Brucellose, Legionellose). Wichtige Angaben auf dem Anforderungsschein einer bakteriologischen Probe ______________________________________________________________________ Allgemeine Daten - Name, Vorname, Geburtsdatum und Adresse des Patienten - Station und Telefonnummer des Einsenders - Telefonnummer über die eilige Befunde übermittelt werden sollen - Unterschrift des einsendenden Arztes Persönliche bzw. wesentliche Daten des Patienten - Klinische Angaben - Anamnestische Hinweise, z. B. Reiseanamnese - Diagnose oder Verdachtsdiagnose (für spezielle Fragestellungen) - Immunstatus des Patienten, z. B. Neutropenie - Vorbehandlung und aktuelle antibiotische Therapie - Erst- oder Wiederholungsuntersuchung (ggf. Datum und Ergebnis der Erstuntersuchung) - Vorbefunde Untersuchungsmaterial - Infektlokalisation - Art und Herkunft des Untersuchungsmaterials (z. B. intraoperativ entnommener Abstrich von der Gallenblase, bei Blutkulturen auch Angabe des Entnahmeorts (z. B. Vene, ZVK, Port) - Entnahmedatum, bei Blutkulturen auch Uhrzeit der Entnahme Untersuchungsanforderung - Gewünschte Untersuchung, ggf. Stufendiagnostik ______________________________________________________________________ Seite 9 von 281 1.2 Gewinnung von Untersuchungsmaterialien Mangelnde Qualität des Untersuchungsmaterials führt zu einer Einschränkung der Befundqualität; unzureichende bakteriologische Befunde führen eventuell zu falschen therapeutischen und gelegentlich zu forensischen Konsequenzen. Allgemeine Grundsätze zu Entnahme und Transport von Untersuchungsmaterialien __________________________________________________________________________ - Klärung, welches Untersuchungsmaterial für die Diagnose der vorliegenden Erkrankung geeignet ist, z. B. Blutkulturen bei Sepsis. - Entnahme des Probenmaterials ohne Kontamination mit Keimen der Standortflora und Keimen aus der Umwelt, da die Anwesenheit von Standortflora zu Interpretationsschwierigkeiten bei der Befundung führen kann. - Entnahme des Probenmaterials ohne Kontakt des Untersuchungsmaterials mit Antiseptika und Desinfizientien, um eine Schädigung der Keime zu vermeiden - Entnahmezeitpunkt vor Beginn der antimikrobiellen Therapie, um falsch negative Befunde zu verhindern; eine lebensrettende Therapie hat allerdings Vorrang und sollte nicht verhindert werden! - Einsendung geeigneter Untersuchungsmengen zur Durchführung aller gewünschten Anforderungen, z. B. reicht 1 ml Liquor zur Untersuchung von Pilzen, Mykobakterien und pathogenen Keimen nicht aus. - Auswahl geeigneter Transportgefäße, z. B. keine Abstrichröhrchen für flüssige Untersuchungsmaterialien. - Auswahl geeigneter Transportmedien, um das Austrocknen anspruchsvoll wachsender Keime oder das Absterben anaerober Keime zu verhindern. - Korrekte Beschriftung der Untersuchungsgefäße - Korrekter Umgang mit infektiösen Materialien: Alle Materialien sind grundsätzlich als infektiös zu betrachten; sie müssen in sterile, dicht verschließbare und auslaufsichere Gefäße gegeben werden; der Verdacht auf Erreger mit einem hohem Infektionspotential (Brucellen, außereuropäische Pilze) muss wegen der Gefahr der Laborinfektion dem Labor mitgeteilt werden (Personenschutz beachten! DIN 55515). - Für den Postversand müssen bezüglich der Verpackung die Richtlinien beachtet werden. Seite 10 von 281 1.3 Transportgefäße und Transportmedien Blutkulturflasche, aerob Blutkulturflasche, anaerob Verwendung: Verwendung: zur direkten Beimpfung von aeroben Blutkulturen zur direkten Beimpfung von anaeroben Blutkulturen BacT/ALERT FA Aerob bioMérieux Deutschland GmbH Art.-Nr. 259791 Bezug über Klinikapotheke möglich BacT/ALERT FN Anaerob bioMérieux Deutschland GmbH Art.-Nr. 259793 Bezug über Klinikapotheke möglich Seite 11 von 281 Blutkulturflasche Kinder Verwendung: zur direkten Beimpfung von Blutkulturen von Kindern BacT/ALERT PF Pediatric bioMérieux Deutschland GmbH Art.-Nr. 259794 Bezug über Klinikapotheke möglich Seite 12 von 281 Brain-Heart-Infusion-Medium Brain-Heart-Infusion-Medium in in Kunststoffröhrchen mit Universal-Probenröhrchen mit schwarzer Kappe weißem Schraubdeckel, frei stehend Verwendung: zum Transport von Augenabstrichen Verwendung: zum Transport von ZVK-Spitzen von Neu- und Frühgeborenen Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201-46918 Nährbodenküche Tel.: 201 46707 Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201-46918 Nährbodenküche Tel.: 201 46707 Schraubbecher mit Herzklappenmedium Probenröhrchen mit Thioglykolatbouillon Verwendung: zum Transport von intraoperativ entnommenen Herzklappen Verwendung: zum Transport von intraoperativ entnommenen Untersuchungsmaterialien der Orthopädischen Klinik Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201-46918 Nährbodenküche Tel.: 201-46707 Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201-46918 Nährbodenküche Tel.: 201-46707 Seite 13 von 281 Uricult (Urin-Eintauch-Nährmedium) Universal-Probenröhrchen, konisch mit rotem Schraubverschluss (Serumröhrchen) Verwendung: zur direkten Beimpfung und Bebrütung von Urin Verwendung: zur Untersuchung von Urinproben Bezug über Apotheke Roche Diagnostics GmbH Art.-Nr. 1284894 Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201-46918 Universal- Abstrichtupfer mit Transportmedium (blaue Kappe) Universal-Abstrichtupfer mit Transportmedium (orange Kappe) Verwendung: Abstriche für bakteriologische und mykologische Untersuchungen mit Transportmedium für Aerobier, Anaerobier und anspruchsvoll wachsende Bakterien Verwendung: besonders dünner Tupfer für die Entnahme von Untersuchungsmaterialien mit Transportmedium für Aerobier, Anaerobier und anspruchsvoll wachsende Bakterien, zur PCR von C. trachomatis Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201-46918 Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201-46918 Seite 14 von 281 GO-Slide Objektträger zum Nachweis von Chlamydien Verwendung: kultureller Nachweis von Neisseria gonorrhoeae Verwendung: zum Nachweis von C. trachomatis (Immunfluoreszenz) Bezug über: Becton Dickinson GmbH Art.-Nr. 273257 Weithalsgefäße mit Spezialmedium zum Nachweis von Cholera Spezialmedium zum Nachweis von Leptospiren Verwendung: Alkalisches Peptonwasser zum Transport von Stuhlproben bei Verdacht auf Cholera Verwendung: zum Nachweis von Leptospiren aus Urin, Blut und Liquor Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 Nährbodenküche Tel.: 201 46707 Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 Seite 15 von 281 Spezialmedium zum Nachweis von Urogenitalen Mykoplasmen Universal-Probenröhrchen mit Schraubdeckel (blaue Kappe) Verwendung: 10B-Medium zum kulturellen Nachweis von urogenitalen Mykoplasmen (Ureaplasma urealyticum, Mycoplasma hominis) Verwendung: Untersuchung von flüssigen Materialien, Punktaten, Biopsien (mit NaCl), BAL, Bronchialsekret Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201-46918 Bezug über: Zentrallager des Uniklinikums (Petrinistraße) Tel. 201 55587; SAP-Nr. 10104808 Universal-Probenröhrchen mit weißem Schraubdeckel, frei stehend (SputumRöhrchen) Stuhlröhrchen mit Löffel Verwendung: zum Nachweis von Bakterien aus Sekreten des Respirationstraktes Verwendung: Untersuchung von Stuhlproben Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201-46918 Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201-46918 Seite 16 von 281 Magensaftröhrchen Verwendung: zur Untersuchung von Magensaft auf Mycobacterium tuberculosis enthält 2 ml 70%iges Tri-Natriumphosphat zur Pufferung Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201-46918 Seite 17 von 281 1.4 Transport und Lagerung von Untersuchungsmaterialien Zur Vermeidung von Qualitätseinbußen (quantitative Bewertung, Absterben sensibler Erreger) wird die Verarbeitung des Materials innerhalb weniger Stunden nach der Entnahme (optimal bis zu 2 Stunden) dringend empfohlen. Bei einem längeren Transport sollten geeignete Transportmittel verwendet werden. Die Anlage der Materialien sollte bis spätestens 24 Stunden nach der Abnahme angestrebt werden; innerhalb dieses Zeitraumes können die meisten Materialien bei Raumtemperatur gelagert werden. Anspruchsvoll wachsende Mikroorganismen wie Shigellen, Gonokokken oder Meningokokken und Anaerobier sind besonders anfällig gegen Umwelteinflüsse und sterben nach der Entnahme der Untersuchungsmaterialien sehr schnell ab. Um dies zu verhindern, müssen die Proben bei längerem Transport entweder sofort ins Labor gebracht werden, oder aber in einem geeigneten Transportmedium gelagert und transportiert werden. Die Lagerung bei Kühlschranktemperatur ist nur dann zu empfehlen, wenn zwischen Materialentnahme und Transport mehr als 12 Stunden liegen sowie bei Außentemperaturen von mehr als 20°C. Bei der Lagerung im Kühlschrank besteht die Gefahr, dass empfindliche Erreger (Anaerobier, Pneumokokken, Haemophilus usw.) absterben oder so geschädigt werden, dass die kulturelle Anzucht nur schwer oder nicht mehr möglich ist. Dies trifft zu für Wunden, Abszesse, Infektionen aus dem Respirationstrakt. Zum Nachweis der hier aufgeführten anspruchsvoll wachsenden Mikroorganismen müssen mit Ausnahme der Anaerobier zusätzlich zu den Routine-Untersuchungsmaterialien gesonderte Proben abgenommen und in den aufgeführten speziellen Transportmedien verschickt werden. Seite 18 von 281 Versand und Lagerungsbedingungen für bakteriologische Untersuchungsproben __________________________________________________________________________________ Material Transportmedium Methode Transport Lagerung __________________________________________________________________________________ Blut Blutkulturen direkte Beimpfung Kultur ≤ 2 h, RT ≤ 24 h, RT (25°C) Knochenmark nativ Kultur ≤ 1 h, RT nicht möglich in Blutkulturen Kultur ≤2 h, RT ≤ 24 h, RT Erwachsene in sterilem Gefäß Kultur ≤ 2 h, RT ≤ 24 h 4°C Frühgeborene Brain-Heart-Infusion-Bouillon Kultur ≤ 2 h, RT ≤ 24 h, 37°C Katheterspitzen: -------------------------------------------------------------------------------------------------------------------------------------------------------------------------Infektionen des Herzens nativ Kultur, PCR ≤ 2 h, RT nicht möglich in Blutkulturen Kultur ≤ 2 h, RT ≤ 24 h, RT Schrittmachersonden nativ Kultur ≤ 2 h, RT ≤ 24 h, RT Herzklappen in BHI-Bouillon Kultur, PCR ≤ 2 h, RT ≤ 24 h, RT Perikardpunktat -------------------------------------------------------------------------------------------------------------------------------------------------------------------------ZNS-Infektionen Liquor - Bakterien nativ Kultur ≤ 2 h, RT nicht möglich in Blutkulturen Kultur ≤ 2 h, RT ≤ 24 h, RT (25°C) Liquor - Bakterien nativ PCR ≤ 2 h, RT ≤ 24 h, 4°C Liquor - Tbc nativ Kultur ≤ 2 h, RT ≤ 24 h, 4°C nativ PCR ≤ 2 h, RT ≤ 24 h, 4°C Liquor - Viren (Virologie) nativ PCR ≤ 2 h, RT ≤ 24 h, 4° Abszessmaterial nativ Kultur ≤ 2 h, RT nicht möglich Hirnbiopsie in Blutkulturen Kultur ≤ 2 h, RT ≤ 24 h, RT nativ Kultur ≤ 2 h, RT nicht möglich -------------------------------------------------------------------------------------------------------------------------------------------------------------------------Oberer Respirationstrakt1 Mundhöhle, Sekret nativ Kultur ≤ 2 h, RT ≤ 24 h, 4°C Mundhöhle, Abstrich anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Mundabstrich aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Mundhöhle, Abszesse nativ Kultur ≤ 2 h, RT nicht möglich Aspirate Nebenhöhlen anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT nativ Kultur ≤ 2 h, RT nicht möglich anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Material Nasopharynx aerobes TM Kultur, PCR ≤ 2 h, RT ≤ 24 h, RT Nasenabstrich aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Rachenabstrich aerobes TM Kultur (Mikroskopie) ≤ 2 h, RT ≤ 24 h, RT -------------------------------------------------------------------------------------------------------------------------------------------------------------------------Ohren Innenohrabstriche aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Punktate nativ Kultur ≤ 2 h, RT nicht möglich in Blutkulturen Kultur ≤ 2 h, RT ≤ 24 h, RT _____________________________________________________________________________________________________ __________________________________________________________________________________ Seite 19 von 281 Material Transportmedium Methode Transport Lagerung __________________________________________________________________________________ Ohren Abstriche Otitis externa aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, 4°C Spülflüssigkeit nativ Kultur ≤ 2 h, RT ≤ 24 h, 4°C -------------------------------------------------------------------------------------------------------------------------------------------------------------------------Unterer Respirationstrakt1 Sputum auf Bakterien nativ Kultur (PCR) ≤ 2 h, RT ≤ 24 h, 4°C Sputum auf Mykobakterien nativ Kultur, PCR ≤ 2 h, RT ≤ 24 h, 4°C Magensaft auf Tbc in Natriumphosphat Kultur, PCR ≤ 2 h, RT ≤ 24 h, 4°C Sputum auf Pilze nativ Kultur (AG, PCR) ≤ 2 h, RT ≤ 24 h, 4°C Bronchialsekret nativ Kultur, PCR ≤ 2 h, RT ≤ 24 h, 4°C Trachealsekret, BAL nativ Kultur, PCR ≤ 2 h, RT ≤ 24 h, 4°C ≤ 2 h, RT ≤ 24 h, 4°C Rachenspülwasser nativ Kultur, PCR Aspirate Trachea anaerobes TM Kultur, PCR nativ Kultur, PCR ≤ 2 h, RT nicht möglich anaerobes TM Kultur, PCR ≤ 2 h, RT ≤ 24 h, 4°C ≤ 2 h, RT ≤ 24 h, 4°C Pleurapunktat Abszessmaterial nativ Kultur, PCR ≤ 2 h, RT nicht möglich anaerobes TM Kultur ≤ 2h, RT ≤ 24 h, RT -------------------------------------------------------------------------------------------------------------------------------------------------------------------------Augen Bindehautabstriche aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Augenkammerwasser sofortiger Transport Kultur ≤ 2 h, RT nicht möglich in Blutkulturen Kultur ≤ 2 h, RT ≤ 24 h, RT Hornhautgeschabsel sofortiger Transport Kultur, Mikroskopie ≤ 2 h, RT nicht möglich Kontaktlinsen nativ Kultur ≤ 2 h, RT ≤ 24 h, 4°C -------------------------------------------------------------------------------------------------------------------------------------------------------------------------Haut, Weichgewebe Abstriche aerobes, anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Sekrete, Eiter, Punktat nativ Kultur, PCR ≤ 2 h, RT nicht möglich in Blutkulturen, aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT nativ Kultur ≤ 2 h, RT nicht möglich in Blutkulturen Kultur ≤ 2 h, RT ≤ 24 h, RT nativ Kultur ≤ 2 h, RT nicht möglich in Blutkulturen, TM Kultur ≤ 2 h, RT ≤ 24 h, RT Ulcus anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Biopsien nativ Kultur, PCR ≤ 2 h, RT nicht möglich Hautabstriche nativ Kultur ≤ 2 h, RT ≤ 24 h, RT Nägel, Haare nativ Kultur ≤ 2 h, RT ≤ 24 h, RT Bisswunden - Abstriche aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Verbrennungswunden aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, 4°C Abszessmaterial Fisteln Mykosen Wunden __________________________________________________________________________________________ Seite 20 von 281 __________________________________________________________________________________ Material Transportmedium Methode Transport Lagerung __________________________________________________________________________________ Intraoperatives Material Intraoperative Materialien Galle, Abszessmaterial nativ Kultur, PCR ≤ 2 h, RT nicht möglich anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT nativ Kultur ≤ 2 h, RT nicht möglich anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT -------------------------------------------------------------------------------------------------------------------------------------------------------------------------Knochen, Gelenke Synovialflüssigkeit2 2 Punktate nativ Kultur, PCR ≤ 2 h, RT nicht möglich in Blutkulturen Kultur ≤ 2 h, RT ≤ 24 h, RT nativ Kultur, PCR ≤ 2 h, RT nicht möglich anaerobes TM, in Blutkultur Kultur ≤ 2 h, RT ≤ 24 h, RT Biopsate nativ Kultur, PCR ≤ 2 h, RT nicht möglich Biopsate v. Verbrennungen nativ Kultur ≤ 2 h, RT ≤ 24 h, 4°C Gewebe nativ Kultur, PCR ≤ 2 h, RT nicht möglich -------------------------------------------------------------------------------------------------------------------------------------------------------------------------Urogenitaltrakt Urin nativ Kultur ≤ 2 h, RT ≤ 24 h, 4°C Uricult Eintauchkultur Kultur ≤ 2 h, RT ≤ 24 h, 37°C Dialysat nativ Kultur ≤ 2 h, RT nicht möglich in BK-Flaschen Kultur ≤ 2 h, RT ≤ 24 h, 37°C Material aus Genitaltrakt: aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Vaginalabstrich aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Zervixabstrich anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Urethralabstrich nativ Kultur, PCR ≤ 2 h, RT ≤ 24 h, 4°C aerobes TM Kultur, PCR ≤ 2 h, RT ≤ 24 h, RT Prostatasekret nativ Kultur ≤ 2 h, RT nicht möglich aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Ejakulat nativ Kultur ≤ 2 h, RT nicht möglich intraoperatives Material nativ Kultur ≤ 2 h, RT nicht möglich anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Abszesse nativ Kultur ≤ 2 h, RT nicht möglich in Blutkulturen Kultur ≤ 2 h, RT ≤ 24 h, RT -------------------------------------------------------------------------------------------------------------------------------------------------------------------------Gastrointestinaltrakt Stuhl zum Nachweis von: Campylobacter nativ Kultur ≤ 4 h, RT nicht möglich Shigellen nativ Kultur ≤ 2 h, RT nicht möglich in TM Kultur ≤ 2 h, RT ≤ 24 h, RT nativ Kultur nicht möglich nicht möglich Cholera in Peptonwasser Kultur ≤ 2 h, RT nicht möglich darmpathogene Bakterien nativ Kultur ≤ 2 h, RT ≤ 24 h, 4°C Clostridium difficile nativ Kultur ≤ 2 h, RT nicht möglich nativ Toxinnachweis ≤ 2 h, RT ≤ 24 h, 4°C ____________________________________________________________________________________________________ Seite 21 von 281 ____________________________________________________________________________ Untersuchungsmaterial UntersuchungsTransportmedium Transport Lagerung methode __________________________________________________________________________________ Rektumabstrich aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Helicobacter/Stuhl nativ Kultur ≤ 4 h, RT nicht möglich Helicobacter/Biospie nativ Kultur ≤ 1 h, RT nicht möglich Spezial-TM Kultur ≤ 1 h, RT ≤ 4 h, 4°C -------------------------------------------------------------------------------------------------------------------------------------------------------------------------- BAL = broncho-alveoläre Lavage, D = direkte Beimpfung, RT = Raumtemperatur, TM = Transportmedium; 1 bei längerem Transport (≥ 12 h oder über Nacht) sollte die Lagerung bei 4°C erfolgen, um ein Überwuchern der ätiologisch bedeutsamen Flora durch Keime der Normalflora zu verhindern. Allerdings besteht dadurch die Gefahr, dass empfindliche Keime absterben. 2 bei längerem Transport empfiehlt sich das Einimpfen in Blutkulturflaschen. __________________________________________________________________________________ Seite 22 von 281 II Diagnostik von Infektionskrankheiten Sepsis / Endokarditis / Kardiovaskuläre Infektionen --------------------------------------------------------------------------------------------------------------------------- 1 Sepsis --------------------------------------------------------------------------------------------------------------------------1.1 Erregerspektrum: Die häufigsten Sepsiserreger sind je nach der Infektionsquelle (Pneumonie, Urosepsis usw.) Enterobacteriaceae (z.B. E. coli, Klebsiellen), Staphylokokken, Streptokokken und Pneumokokken. Bei Infektionen des Gastrointestinaltraktes oder chirurgischen Eingriffen am Abdomen können auch anaerobe Bakterien eine Rolle spielen. Infektionen durch Pilze gewinnen eine zunehmende Bedeutung. Das Erregerspektrum der häufigsten Sepsiserreger ist in Tabelle1 aufgelistet. 1.2 Indikation für die mikrobiologische Untersuchung: - V. a. Sepsis, septischer Schock, V. a. Bakteriämie, Fungämie, bei Fieber unklarer Genese (FUO; fever of unknown origin). - bei Meningitis, Pneumonie, Pyelonephritis, Osteomyelitis, eitriger Arthritis, Epiglottitis, Omphalitis bei Neugeborenen, Infektionen der Weichgewebe wie Abszesse und Phlegmone oder Infektionen des Gastrointestinaltraktes, da diese Infektionen häufige Infektionsquellen für die Sepsis darstellen. Daher sollten bei diesen Erkrankungen neben den Kulturen von Liquor, Sputum, Urin, Wundabstrichen und Punktaten auch Blutkulturen entnommen werden. Bei Erregerwechsel oder Fungämie ist auch eine unter antibiotischer Therapie entnommene Blutkultur sinnvoll. 1.3 Untersuchungsmethode: - Erregernachweis aus Blut, Resistenzbestimmung der isolierten Erreger - in Einzelfällen DNA-Nachweis mittels PCR (universelle PCR, wenn möglich gezielte PCR z.B. bei V. a. Meningokokken (siehe Tabelle 1) 1.4 Untersuchungsmaterial: Blutkulturen, selten Nativblut oder Knochenmark 1.4.1 Blutkulturen: Siehe Kapitel IV: Untersuchungsmaterialien – Blut. Lagerung und Transport: ≤ 2 h bei RT, falls das nicht möglich ist, Lagerung bis zu 24 h bei RT. Interpretation: Nicht alle positiven Blutkulturen sind klinisch relevant; in etwa 2 - 3% der Fälle liegt eine abnahmebedingte Kontamination durch Hautflora vor. Hinweis für die klinische Relevanz des Seite 23 von 281 nachgewiesenen Erregers in der Blutkultur gibt der Erregernachweis in mehreren Blutkulturflaschen oder der Nachweis desselben Erregers aus anderen Untersuchungsmaterialien, z. B. Urin. Zu den häufigen Kontaminanten von Blutkulturen zählen: - koagulasenegative Staphylokokken (meist Staphylococcus epidermidis) - Korynebakterien (Achtung: Corynebacterium jeikeium bei Patienten mit Malignomen!) - aerobe apathogene Sporenbildner - Propionibakterien (anaerobe Hautflora) - α- oder nicht-hämolysierende Streptokokken (Achtung: können Erreger einer subakuten Endokarditis oder Sepsis bei Neutropenie sein!). Wenn diese Erreger nur in einer Blutkulturflasche nachgewiesen werden, ist die Bedeutung des Befundes fraglich. Allerdings können sie bei immunsupprimierten Patienten eine Rolle spielen. 1.4.2 Nativblut: Indikation für die mikrobiologische Untersuchung: Malaria, Infektion durch Mykobakterien, Trypanosomiasis, Filariose, Leptospirose Probengefäße: Citrat-/Heparin- oder EDTA-Monovette (siehe unten) Abnahme und Blutvolumen: Entnahme von Blut mit steriler Kanüle aus Vene oder aus einem liegenden venösen Katheter - Malaria: 5 ml EDTA-Blut - Tuberkulose: 10 ml Citrat-Blut - Trypanosomen: 5 ml EDTA-Blut - Filariose: 5 ml EDTA-Blut, ggf. nächtliche Blutentnahme, um die Periodizität der Erreger zu berücksichtigen (Rücksprache mit dem Labor) Lagerung und Transport: bei Raumtemperatur bis zu 24 h 1.4.3 Knochenmark: Indikation: Infektion durch Mykobakterien oder intrazelluläre Erreger, in der Hämatologie bei V. a. Kontamination. Probengefäße: Sterile Spritze mit Schraubdeckel oder Blutkulturflaschen. Abnahme: Siehe Kapitel IV: Untersuchungsmethoden - Knochenmark. Seite 24 von 281 Lagerung und Transport: ≤ 2 h bei RT, bei längerer Lagerung Verimpfung in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT. ---------------------------------------------------------------------------------------------------------------------------------------- 2 Endokarditis ---------------------------------------------------------------------------------------------------------------------------------------2.1 Erregerspektrum: Die häufigsten Erreger der akuten Endokarditis sind S. aureus und seltener Enterobacteriaceae; die subakute Endokarditis wird in erster Linie durch Streptokokken und Enterokokken verursacht. Das Erregerspektrum der häufigsten Endokarditiserreger ist in Tabelle1 aufgelistet. 2.2 Indikation für die mikrobiologische Untersuchung: - V. a. Endokarditis - Bei Endokarditis unklarer Ätiologie sollte jede intraoperative entnommene Herzklappe mikrobiologisch untersucht werden! 2.3 Untersuchungsmethode - Erregernachweis aus Blut, Resistenzbestimmung der isolierten Erreger, - DNA-Nachweis mittels universeller PCR (aus Herzklappen, Blut, Op-Material), insbesondere bei negativen Blutkulturen und ätiologisch unklarem Erreger. - Sufendiagnostik: zunächst Kultur, dann PCR bei negativem Ergebnis. 2.4 Untersuchungsmaterial: Blutkulturen, Herzklappengewebe, intraoperativ gewonnenes Material nach Klappenersatz 2.4.1 Blutkulturen: Siehe Kapitel IV: Untersuchungsmaterial - Blut Lagerung und Transport: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei RT. Interpretation: Nicht alle positiven Blutkulturen sind klinisch relevant; in etwa 2 - 3% der Fälle liegt eine abnahmebedingte Kontamination durch Hautflora vor. Hinweis für die klinische Relevanz des nachgewiesenen Erregers in der Blutkultur gibt der Erregernachweis in mehreren Blutkulturflaschen. 2.4.2 Herzklappen und Herzklappengewebe: Probengefäße: Weithalsgefäß mit Brain-Heart-Infusion-Bouillon (anzufordern unter Tel.: 201- 46918). Materialentnahme: Herzklappen intraoperativ steril entnehmen und in das Gefäß überführen. Seite 25 von 281 Lagerung und Transport: ≤ 2 h bei RT, eine längere Lagerung ist bei 37°C (bis zu 24 h) möglich. Dauer der Untersuchung: Ein negativer Befund wird nach 3 - 4 Wochen erstellt. Interpretation: Bei Nachweis pathogener Erreger ist die Ätiologie der Infektion gesichert. Bei Nachweis von koagulasenegativen Staphylokokken, die sowohl als Besiedler der Hautflora als auch als Endokarditiserreger nach Herzklappenersatz vorkommen, ist die Relevanz der Isolate zu prüfen. ---------------------------------------------------------------------------------------------------------------------------------------- 3 Perikarditis ---------------------------------------------------------------------------------------------------------------------------------------3.1 Erregerspektrum: Die häufigsten Erreger der Perikarditis sind Staphylokokken, Streptokokken und seltener Enterobacteriaceae; das Erregerspektrum ist in Tabelle1 aufgelistet. 3.2 Indikation für die mikrobiologische Untersuchung: - V. a. Perikarditis - Bei Perikarditis unklarer Ätiologie sollte jedes entnommene Punktat mikrobiologisch untersucht werden! 3.3 Untersuchungsmethode: - Erregernachweis aus Punktaten, Resistenzbestimmung der isolierten Erreger - DNA-Nachweis mittels universeller PCR bei negativen Blutkulturen und ätiologisch unklarem Erreger. - Sufendiagnostik: zunächst Kultur, dann PCR bei negativem Ergebnis. 3.4 Untersuchungsmaterial: Blutkulturen, Punktate 3.4.1 Blutkulturen: siehe Kapitel IV: Untersuchungsmaterial - Blut Lagerung und Transport: ≤ 24 h bei RT, ist das nicht möglich Lagerung bis zu 24 h bei RT. 3.4.2 Perikardpunktat: Probengefäße: Universal-Probenröhrchen mit blauem Schraubverschluss. Materialentnahme, Lagerung und Transport: Siehe Kapitel IV: Untersuchungsmaterial – Punktate Seite 26 von 281 Lagerung und Transport: ≤ 24 h bei RT, bei längerer Lagerung Verimpfung in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT. Dauer der Untersuchung: Ein negativer Befund wird nach 21 Tagen erstellt. ---------------------------------------------------------------------------------------------------------------------------------------- 4 Schrittmacherinfektionen ---------------------------------------------------------------------------------------------------------------------------------------4.1 Erregerspektrum: Schrittmacherinfektionen werden hauptsächlich durch Staphylokokken (S. aureus und koagulasenegative Staphylokokken) verursacht; das Erregerspektrum ist in Tabelle 1 aufgelistet. 4.2 Indikation für die mikrobiologische Untersuchung: Bakterielle Infektion von Schrittmachern. 4.3 Untersuchungsmethoden: - Kulturelle Anzucht der Erreger und Resistenzbestimmung - bei negativem Ergebnis universelle PCR, Identifizierung der Erreger mittels 16S rRNASequenzanalyse. 4.4 Untersuchungsmaterial: Blut (Blutkulturen), Schrittmachersonden, Op-Material. 4.5 Probengefäße: Weithalsgefäß mit Brain-Heart-Infusion-Bouillon (Anforderung unter 201-46918). 4.6 Materialentnahme: Schrittmacher unter sterilen Bedingungen entnehmen und in Weithalsgefäß überführen. 4.7 Lagerung und Transport: Bei Raumtemperatur innerhalb von 24 h. 4.8 Dauer der Untersuchung: Kultur: Nachweis der Erreger: 2 Tage, Resistenzbestimmung: 3 Tage; PCR: 3 Tage. 4.9 Interpretation: Bei Nachweis pathogener Erreger wie S. aureus ist die Ätiologie der Infektion gesichert. Bei Nachweis von koagulasenegativen Staphylokokken, die auch als Besiedler der Haut vorkommen, ist die Relevanz der Isolate zu prüfen. Seite 27 von 281 ---------------------------------------------------------------------------------------------------------------------------------------- 5 Katheter-assoziierte Infektionen ---------------------------------------------------------------------------------------------------------------------------------------Intravaskuläre Katheter werden in 2 Kategorien unterteilt: solche für kurzzeitigen (ein- oder mehrlumige Silikon- oder Polyurethankatheter) und solche für längerfristigen Einsatz (Port, HickmanKatheter); letztere müssen in der Regel chirurgisch implantiert werden. Zu den Langzeitkathetern gehören Hickman-Katheter, Broviac-Katheter, Port-Systeme. Da die Katheter schwer ersetzbar sind, sollten zunächst alle diagnostischen Möglichkeiten am noch liegenden Katheter ausgeschöpft werden Malassezia furfur kann bei Neu- und Frühgeborenen, die eine lipidreiche parenterale Ernährung erhalten, Katheter-assoziierte Infektionen verursachen. Da diese Keime eine Subkultivierung auf Spezialnährmedien erfordern, muss ein klinischer Verdacht dem Labor mitgeteilt werden. 5.1 Erregerspektrum: Katheter-assoziierte Infektionen werden hauptsächlich durch Haut- und Umgebungskeime verursacht. Bei Langzeitkathetern können auch schnell wachsende Mykobakterien, Pilze und Anaerobier eine Rolle spielen. Das Erregerspektrum ist in Tabelle 1 aufgelistet. 5.2 Indikation zur mikrobiologischen Untersuchung: V. a. Katheterinfektion 5.3 Untersuchungsmethode: Kultur und Resistenzbestimmung der Isolate. Die heute übliche mikrobiologische Methode zur Untersuchung von Venenkathetern ist die Agar-RollTechnik nach Maki. Sie erlaubt eine semiquantitative Bestimmung der Bakterien. 5.4 Untersuchungsmaterial: Bei Verdacht auf Katheter-assoziierte Infektionen muss der Katheter gezogen und zur Untersuchung in die Mikrobiologie gesandt werden. Ist dies nicht möglich, sollte die DTTP (detection time till positivity) bestimmt werden. Zur Bestimmung der DTTP werden Blutkulturen zeitgleich aus dem Katheter und aus einer Vene entnommen. Patienten mit einer katheterbedingten Infektion zeigen in der Katheterkultur schneller ein positives Ergebnis als in der peripher abgenommen Blutkulturen. Die Differenz muss > 2 h sein. 5.5 Probengefäße: - Erwachsene: steriles Transportgefäß ohne Transportmedium - Frühgeborene: Brain-Heart-Infusion-Medium 5.6 Materialentnahme: Siehe Kapitel IV: Untersuchungsmaterial - Fremdkörper. Seite 28 von 281 5.7 Lagerung und Transport: ≤ 2 h bei RT, bei längerem Transport Lagerung bis zu 24 h bei 4°C. 5.8 Dauer der Untersuchung: Kultur: 1 - 2 Tage, Erstellung des Antibiogramms: 1 Tag; vorläufig negative Befunde werden nach 2 Tagen, Endbefunde nach 5 Tagen erstellt. 5.9 Interpretation: Der Nachweis von Mikroorganismen in einer Keimzahl von ≥ 15 Kolonien/Katheterspitze gilt als klinisch relevante Besiedlung und ist bei vorliegender klinischer Symptomatik oder lokalen Infektionszeichen wahrscheinlich mit einer Katheterinfektion assoziiert. Weniger als 15 Kolonien/Katheterspitze sprechen für eine Kontamination. Beim Nachweis von Korynebakterien, Propionibakterien, Bacillus spp. und von koagulasenegativen Staphylokokken ist die klinische Bedeutung des Befundes fraglich, insbesondere dann, wenn die Erreger nur aus einer Blutkulturflasche isoliert wurden. 5.10 CAP-Dialysate: Bei CAP-Dialysaten handelt es sich um hypertone Lösungen. Um ein Absterben oder eine Schädigung der Mikroorganismen zu verhindern, sollten die CAP-Dialysate sofort nach der Abnahme in das Labor gebracht werden oder aber schon auf der Station in Blutkulturflaschen geimpft werden (5 – 10 ml, Verdünnungseffekt der hypertonen Lösung und optimales Wachstumsmedium für Mikroorganismen). Seite 29 von 281 ---------------------------------------------------------------------------------------------------------------------------------------- 6 Infektionen mit ungewöhnlichen Erregern ---------------------------------------------------------------------------------------------------------------------------------------Die folgenden Erreger verursachen in seltenen Fällen eine Bakteriämie, Sepsis oder kardiovaskuläre Infektionen. Für ihren Nachweis ist eine weiterführende Diagnostik notwendig. Aspergillus spp. Leptospira spp. Bartonella spp. Mycoplasma hominis Brucella spp. Mycobacterium spp. Legionella spp. Ureaplasma urealyticum Seite 30 von 281 Tabelle 1: Erregerspektrum bei Bakteriämie und Sepsis (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Angewandte Nachweisverfahren ---------------------------------------------Material TM Mikr Kultur PCR AK __________________________________________________________________________ Bakteriämie und Sepsis häufige Erreger: E. coli Blutkultur + + 0 0 S. aureus Blutkultur + + 0 0 S. pneumoniae Blutkultur + + 0 0 Enterococcus spp. Blutkultur + + 0 0 koagulasenegative Staphylokokken Blutkultur + + 0 0 Klebsiella spp. Blutkultur + + 0 0 Candida spp. Blutkultur ++ + 0 + Enterobacter spp. Blutkultur + + 0 0 Haemophilus influenzae Blutkultur + + 0 0 Salmonella spp. Blutkultur + + 0 + Pseudomonas aeruginosa Blutkultur + + 0 0 Neisseria meningitidis Blutkultur ++ + + 0 Malassezia furfur Blutkultur + + 0 0 Anaerobier Blutkultur + + 0 0 Blutkultur + + 0 0 Nutritionally variant streptococci (NVS) Blutkultur + + 0 0 Enterococcus faecalis Blutkultur + + 0 0 Enterococcus spp. Blutkultur + + 0 0 Staphylococcus aureus Blutkultur + + 0 0 Enterobacteriaceae Blutkultur + + 0 0 seltene Erreger: (Bacteroides, Fusobakterien, Prevotella) Endokarditis Subakute Endokarditis/häufige Erreger Streptokokken der Viridansgruppe (u. a. S. sanguinis, S. salivarius, S. mutans) Akute Endokarditis/häufige Erreger __________________________________________________________________________ Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, AK = Antikörpernachweis, Kultur: nach Anzüchtung Identifizierung und Erstellung eines Antibiogramms. Seite 31 von 281 __________________________________________________________________________ Angewandte Nachweisverfahren ---------------------------------------------Material TM Mikr Kultur PCR AK __________________________________________________________________________ Akute Endokarditis/seltene Erreger Neisseria spp. Blutkultur ++ + 0 0 Coxiella burnetii Blutkultur 0 0 0 + *Brucella spp. (!) Blutkultur + + 0 + + 0 0 Candida spp. Blutkultur ++ *Bartonella spp. (externe Untersuchung) Blutkultur + Haemophilus influenzae Blutkultur + + 0 0 Haemophilus spp. Blutkultur + + 0 0 Actinobacillus spp. Blutkultur + + 0 0 Eikenella corrodens Blutkultur + + 0 0 Cardiobacterium hominis Blutkultur + + 0 0 Kingella spp. Blutkultur + + 0 0 Pseudomonas aeruginosa Blutkultur + + 0 0 Staphylococcus aureus Blutkultur + + 0 0 Candida spp. Blutkultur ++ + 0 0 Enterococcus faecalis Blutkultur + + 0 0 Streptokokken der Viridansgruppe Blutkultur + + 0 0 koagulasenegative Staphylokokken Blutkultur + + 0 0 *Bakterien der HACEK-Gruppe: Endokarditis bei Drogenabhängigen __________________________________________________________________________ Angewandte Nachweisverfahren ---------------------------------------------Material TM Mikr Kultur PCR AK __________________________________________________________________________________________ Endokarditis nach Klappenersatz Early onset Staphylococcus epidermidis Blutkultur + + 0 0 Staphylococcus aureus Blutkultur + + 0 0 Enterobacteriaceae Blutkultur + + 0 0 Candida spp. Blutkultur ++ + 0 0 Streptokokken der Viridansgruppe Blutkultur + + 0 0 Enterococcus faecalis Blutkultur + + 0 0 Corynebacterium spp. Blutkultur + + 0 0 _________________________________________________________________________ Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, AK = Antikörpernachweis, (!) = Keime der Risikogruppe 3, * = langsames Wachstum Seite 32 von 281 _________________________________________________________________________ Angewandte Nachweisverfahren ---------------------------------------------Material TM Mikr Kultur PCR AK __________________________________________________________________________ Late onset Staphylococcus epidermidis Blutkultur + + 0 0 Staphylococcus aureus Blutkultur + + 0 0 Enterobacteriaceae Blutkultur + + 0 0 Candida spp. Blutkultur ++ + 0 0 Legionella spp. Blutkultur 0 + 0 + Urin 0 Antigennachweis Perikarditis häufige Erreger Staphylococcus aureus Blutkultur, Punktat + + + 0 0 Streptococcus pneumoniae Blutkultur, Punktat + + + 0 0 Streptokokken der Gruppe A Blutkultur, Punktat + + + 0 0 Escherichia coli Blutkultur, Punktat + + + 0 0 Pseudomonas aeruginosa Blutkultur, Punktat + + + 0 0 Salmonella spp. Blutkultur, Punktat + + + 0 + Shigella spp. Blutkultur, Punktat + + + 0 0 Neisseria meningitidis Blutkultur, Punktat D ++ + + 0 *Histoplasma capsulatum (!) Blutkultur, Punktat N + + 0 + Mycoplasma pneumoniae Blutkultur, Punktat N 0 0 + + Chlamydophila pneumoniae Blutkultur, Punktat N 0 0 + + seltene Erreger __________________________________________________________________________ Angewandte Nachweisverfahren ---------------------------------------------Material TM Mikr Kultur PCR AK __________________________________________________________________________________________ Candida spp. Blutkultur, Punktat N ++ + + 0 *Mycobacterium tuberculosis (!) Blutkultur, Punktat N ++ + + 0 Echinococcus granulosus Blutkultur, Punktat N 0 0 0 + Entamoeba histolytica Blutkultur, Punktat N 0 0 0 + Toxoplasma gondii Blutkultur, Punktat N 0 0 + + Trichinella spiralis Blutkultur, Punktat N 0 0 0 + ---------------------------------------------------------------------------------------------------------------------------------------------------- Bei der Untersuchung von Punktaten sollte bei negativem Kulturergebnis die universelle PCR durchgeführt werden! _____________________________________________________________________________________________________ Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, AK = Antikörpernachweis, (!) =Keime der Risikogruppe 3, * = langsames Wachstum; N = Nativmaterial (Transport ≤ 2 h), D = Direktbeimpfung des Mediums. Seite 33 von 281 _________________________________________________________________________ Angewandte Nachweisverfahren ---------------------------------------------Material TM Mikr Kultur PCR AK __________________________________________________________________________ Katheter-assoziierte Infektionen Kurzzeitkatheter häufige Erreger: koagulaseneg. Staphylokokken ZVK-Spitze 0 --- + 0 0 Staphylococcus aureus ZVK-Spitze 0 --- + 0 0 Enterococcus spp. ZVK-Spitze 0 --- + 0 0 Candida spp. ZVK-Spitze 0 --- + 0 0 Enterobacteriaceae ZVK-Spitze 0 --- + 0 0 Malassezia furfur ZVK-Spitze 0 --- + 0 0 koagulaseneg. Staphylokokken Blutkultur (ZVK, peripher) 0 --- + 0 0 Staphylococcus aureus Blutkultur (ZVK, peripher) 0 --- + 0 0 Enterococcus spp. Blutkultur (ZVK, peripher) 0 --- + 0 0 Candida spp. Blutkultur (ZVK, peripher) 0 --- + 0 0 Enterobacteriaceae Blutkultur (ZVK, peripher) 0 --- + 0 0 atypische Mykobakterien Blutkultur(ZVK, peripher) 0 --- + 0 0 Anaerobier Blutkultur (ZVK, peripher) 0 --- + 0 0 Acinetobacter spp. Blutkultur (ZVK, peripher) 0 --- + 0 0 Alcaligenes spp. Blutkultur (ZVK, peripher) 0 --- + 0 0 seltene Erreger: Langzeitkatheter häufige Erreger: seltene Erreger: _________________________________________________________________________ TM = Transportmedium, Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = Mikroskopie nicht durchgeführt), AK = Antikörpernachweis, (!) = Keime der Risikogruppe 3 _________________________________________________________________________ Seite 34 von 281 Neurologische Infektionen und Infektionen des ZNS --------------------------------------------------------------------------------------------------------------------------- 1 Meningitis, Enzephalitis, Empyem --------------------------------------------------------------------------------------------------------------------------1.1 Erregerspektrum: Das Erregerspektrum der bakteriellen Meningitis, Enzephalitis und des Empyems ist in Tabelle 2 aufgelistet. 1.2 Indikation für die mikrobiologische Untersuchung: - Meningitis - akut und chronisch entzündliche Erkrankungen des ZNS: u. a. bei Meningitis, Meningoenzephalitis, Enzephalitis, Ventrikulitis, Hirnabszessen, Hirnnervenlähmungen, Myelitis transversa, bei unklarem Fieber und bei unklaren Krämpfen. - Kontraindikationen: erhöhter intrakranieller Druck (Stauungspapille) und Gerinnungsstörungen. Eine relative Kontraindikation ist ein kontaminiertes bzw. infiziertes Punktionsgebiet. 1.3 Untersuchungsmethode: - Mikroskopie (Gramfärbung) 3 3 4 5 Sensitivität: < 10 KBE/ml (25%), 10 -10 KBE/ml (60%), > 10 KBE/ml (97%) - Kultur und Resistenzbestimmung der isolierten Erreger - universelle PCR nach Vorbehandlung mit Antibiotika - gezielte PCR (Meningokokken, Mykobakterien, Toxoplasmose) 1.4 Untersuchungsmaterial: Liquor, Hirnbiopsie, intraoperative Materialien 1.4.1 Liquor Mindestvolumen: - Bakterien ≥ 1 ml - Pilze ≥ 2 ml - Parasiten ≥ 5 ml - Mykobakterien ≥ 5 ml, besser 10-15 ml (je 5 ml für Mikroskopie, Kultur und PCR); bei negativer Mikroskopie und Verdacht auf tuberkulöse Meningitis, erneute Liquorgewinnung und Einsatz von mindestens 15 ml für die Kultur. Ist nur wenig Liquor vorhanden, so ist der Kultur der Vorrang zu geben (Goldstandard mit größter Sensitivität). Lagerung und Transport: ≤ 2 h bei Raumtemperatur, vor Licht geschützt; ist das nicht möglich, Verimpfung eines Aliquots in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT. Seite 35 von 281 Unter diesen Umständen sind folgende Untersuchungen nicht möglich: mikroskopisches Präparat, Antigennachweis, quantitative Bestimmung der Erreger, Nachweis von Viren, Nachweis von Parasiten; daher außerdem Einsendung von nativem Liquor. Zum Nachweis von Viren, Mykobakterien, Parasiten, Pilzen und Nukleinsäuren: bei ≤ 4°C (maximal 24 h). Bei V. a. Parasiten und Pilze Liquor nicht tieffrieren. 1.4.2 Hirnbiopsie, intraoperative Materialien: Probengefäße: Universal-Probenröhrchen mit blauem Verschluss. Lagerung und Transport: ≤ 2 h bei RT, eine längere Lagerung ist nicht möglich. 1.5 Dauer der Untersuchung: Die folgenden Zeitabstände gelten für schnell wachsende Bakterien, bei Nachweis langsam wachsender Bakterien wie Mykobakterien dauert die Untersuchung länger. - Mikroskopie: ≤ 1 h nach Eingang des Materials - Kultur: 1-2 Tage Anzucht, 1 weiterer Tag zur Resistenzbestimmung - PCR: 1 Tag Ein vorläufig negativer Befund wird nach 2 Tagen, ein Endbefund nach 5 Tagen erstellt. 1.6 Interpretation Bei Nachweis pathogener Erreger ist die Ätiologie der Infektion gesichert. Bei Nachweis von koagulasenegativen Staphylokokken, die sowohl als Besiedler der Haut als auch als Meningitiserreger bei Shuntinfektionen vorkommen, ist die Relevanz der Isolate zu prüfen. Meldepflicht: Meningokokkenmeningitis (Erkrankung und Tod) Meldepflicht durch das Labor: H. influenzae, Listerien, N. meningitidis, Brucella spp. --------------------------------------------------------------------------------------------------------------------------- 2 Hirnabszess --------------------------------------------------------------------------------------------------------------------------2.1 Erregerspektrum: Hirnabszesse werden in erster Linie von Anaerobiern verursacht (vgl. Tabelle 1). Es handelt sich meist um Mischinfektionen selten um Monoinfektionen mit 1 Keim. 2.2 Indikation für die mikrobiologische Untersuchung: - Hirnabszess - Intraoperativ gewonnene Materialien vom ZNS Seite 36 von 281 2.3 Untersuchungsmethode: - Kultur und Resistenzbestimmung der isolierten Erreger - die universelle PCR ist bei Mischinfektionen nicht indiziert 2.4 Untersuchungsmaterial: Liquor, intraoperative Materialien, Abszessmaterial 2.4.1 Liquor: Siehe Kapitel IV: Untersuchungsmaterial – Liquor Lagerung und Transport: ≤ 2 h bei RT, bei längerer Lagerung Verimpfung eines Aliquots in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT. 2.4.2 Abszessmaterialien: Siehe Kapitel IV: Untersuchungsmaterial - Punktate Lagerung und Transport: ≤ 2 h bei RT, eine längere Lagerung ist nicht möglich; bei längerem Transport Verimpfung in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT. 2.5 Dauer der Untersuchung: Ein negativer Befund wird nach 14 Tagen erstellt. 2.6 - Interpretation: Hirnabszesse sind in der Regel Mischinfektionen, deren Infektionsquelle häufig der Oropharynx ist, d.h. bei Nachweis von Keimen aus dem Oropharynx wie z. B. Streptokokken der Viridansgruppe können diese sowohl eine Kontamination als auch Abszesserreger sein. Derartige Befunde sollten mit dem Institut für Mikrobiologie diskutiert werden. Dagegen sind pathogene Keime klinisch relevant. - Bei Nachweis von mehreren Keimen handelt es sich nicht unbedingt um eine Kontamination (Mischinfektion!). - Der nachgewiesene Erreger ist häufig ein Leitkeim der Infektion. Die Antibiotikatherapie sollte daher kalkuliert unter Berücksichtigung des nachgewiesenen Keimes erfolgen. Seite 37 von 281 Tabelle 2: Erregerspektrum bei Infektionen des ZNS (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Akute bakterielle Meningitis häufige Erreger Neisseria meningitidis Liquor, Blutkultur + ++ + 0 + 0 Streptococcus pneumoniae Liquor, Blutkultur + ++ + 0 0 0 Haemophilus influenzae Liquor, Blutkultur + + + 0 0 0 Peptostreptococcus spp. Liquor, Blutkultur + + + 0 0 0 Fusobacterium spp. Liquor, Blutkultur + ++ + 0 0 0 Clostridium perfringens Liquor, Blutkultur + ++ + 0 0 0 *Brucella spp. (!) Liquor, Blutkultur + + + 0 0 0 Treponema pallidum Liquor, Serum N 0 0 0 0 + Borrelia burgdorferi Liquor, Serum N 0 0 0 + + Mycoplasma pneumoniae Liquor, Serum N 0 0 0 + + Streptokokken der Gruppe B Liquor, Blutkultur + + + 0 0 0 Escherichia coli Liquor, Blutkultur + + + 0 0 0 Listeria monocytogenes Liquor, Blutkultur + + + 0 + 0 Streptokokken der Gruppe A Liquor, Blutkultur + + + 0 0 0 Klebsiella pneumoniae Liquor, Blutkultur + + + 0 0 0 Streptococcus pneumoniae Liquor, Blutkultur + + + 0 0 0 Neisseria meningitidis Liquor, Blutkultur + ++ + 0 + 0 Listeria monocytogenes Liquor, Blutkultur + + + 0 + 0 Enterobacteriaceae Liquor, Blutkultur + + + 0 0 0 Pseudomonas aeruginosa Liquor, Blutkultur + + + 0 0 0 Streptococcus pneumoniae Liquor + + + 0 0 0 Haemophilus influenzae Liquor + + + 0 0 0 Streptokokken der Gruppe A Liquor + + + 0 0 0 seltene Erreger bei Früh- und Neugeborenen bei Immunsupprimierten bei Schädelbasisfrakturen ------------------------------------------------------------------------------------------------------------------------------------------------------Bei negativem Kulturergebnis sollte die universelle PCR von einem Aliquot des Liquors durchgeführt werden! __________________________________________________________________________________________ TM = Transportmedium, Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Seite 38 von 281 Diagnose erlauben, AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum, N = Nativmaterial (Transport ≤ 2 h). __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ nach Schädeltrauma Staphylococcus aureus Liquor + + + 0 0 0 Staphylococcus epidermidis-Gr. Liquor + + + 0 0 0 Enterobacteriaceae Liquor + + + 0 0 0 Staphylococcus epidermidis-Gr. Liquor + + + 0 0 0 Staphylococcus aureus Liquor + + + 0 0 0 Enterobacteriaceae Liquor + + + 0 0 0 Propionibacterium acnes Liquor + + + 0 0 0 bei Shuntpatienten Chronische Meningitis Acanthamoeba Liquor N +++ 0 0 0 0 *Brucella spp. (!) Liquor, Serum + + + 0 0 + Candida spp. Liquor, Serum N ++ + + + 0 *Coccidioides immitis (!) Liquor, Serum N + + 0 0 + Cryptococcus neoformans Liquor, Serum N + + + 0 + *Histoplasma capsulatum (!) Liquor, Serum N + + 0 0 + Borrelia burgdorferi Liquor, Serum N 0 0 0 + + Treponema pallidum Liquor, Serum N 0 0 0 0 + N ++ + 0 + *Mycobacterium tuberculosis (!) Liquor Leptospira spp. Liquor, Serum + Spezialmedium 0 + Externe Untersuchung! Fokale ZNS-Läsionen *Actinomyces spp. Liquor, Punktat N + + 0 0 0 *Blastomyces spp. (!) Liquor, Punktat N + + 0 0 0 Cysticercus spp. Liquor, Punktat N +++ 0 0 0 Aspergillus spp. Liquor, Punktat N ++ + + + + *Nocardia spp. Liquor, Punktat N ++ + 0 0 0 Schistosoma mansoni Liquor, Punktat N +++ 0 0 0 + Toxoplasma gondii Liquor, Punktat N 0 0 0 + + ------------------------------------------------------------------------------------------------------------------------------------------------------Bei negativem Kulturergebnis sollte die universelle PCR von einem Aliquot des Liquors durchgeführt werden! __________________________________________________________________________________________ TM = Transportmedium, Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikro- organismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier, (!) = Keim der Risikogruppe 3, * = langsames Wachstum, N = Nativmaterial (Transport ≤ 2 h). Seite 39 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren -----------------------------------------------------TM Mikro Kultur AG PCR AK __________________________________________________________________________ Meningitis durch Protozoen Naegleria fowleri Liquor N +++ (+) 0 0 0 Acanthamoeba Liquor N +++ (+) 0 0 0 Salmonella typhi Liquor, Serum + + + 0 0 + Ehrlichia canis Liquor N + + Coxiella burnetii Liquor, Serum + 0 0 0 0 + Mycoplasma pneumoniae Liquor, Serum N 0 0 0 0 + *Brucella spp. (!) Liquor, Serum + 0 0 0 + Listeria monocytogenes Liquor + + 0 + 0 Treponema pallidum Liquor, Serum N 0 0 0 + Borrelia burgdorferi Liquor, Serum N 0 0 + + Leptospira spp. Liquor, Serum Encephalitis Externe Untersuchung Encephalitis + Spezialmedium + Externe Untersuchung Nocardia spp. Liquor N + + 0 0 0 *Actinomyces spp. Liquor N ++ + 0 0 0 *Mycobacterium tuberculosis (!) Liquor N ++ + 0 + 0 *Histoplasma capsulatum (!) Liquor, Serum N +++ 0 + 0 0 Acanthamoeba Liquor N +++ + 0 0 0 Toxoplasma gondii Liquor, Serum N 0 0 0 + + Plasmodium falciparum Liquor N +++ 0 0 0 0 Tropheryma whipplei Liquor N 0 0 0 + 0 Bartonella spp. Liquor N + + Encephalitis Externe Untersuchung ------------------------------------------------------------------------------------------------------------------------------------------------------Bei negativem Kulturergebnis sollte die universelle PCR von einem Aliquot des Liquors durchgeführt werden! ________________________________________________________________________________________ TM = Transportmedium, Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum, N = Nativmaterial (Transport ≤ h). Seite 40 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------------------TM Mikro Kultur AG PCR AK __________________________________________________________________________ Subdurales Empyem Streptococcus spp. Punktat nativ/anaerobes TM 0 0 0 0 (S. milleri, S. anginosus) Staphylococcus aureus Punktat „ + 0 0 0 Streptococcus pneumoniae Punktat „ + 0 0 0 Haemophilus influenzae Punktat „ + 0 0 0 Enterobacteriaceae Punktat „ + 0 0 0 Bacteroides spp. Punktat „ + 0 0 0 Punktat nativ/anaerobes TM + 0 0 0 Peptostreptococcus spp. Punktat „ + 0 0 0 Bacteroides spp. Punktat „ + 0 0 0 Prevotella spp. Punktat „ + 0 0 0 Porphyromonas spp. Punktat „ + 0 0 0 Enterobacteriaceae Punktat „ + 0 0 0 Staphylococcus aureus Punktat „ + 0 0 0 Candida spp. Punktat „ ++ + 0 + 0 Actinomyces spp. Punktat „ ++ + 0 0 0 Nocardia spp. Punktat „ ++ + 0 0 0 Fusobacterium spp. Punktat „ ++ + 0 0 0 Streptococcus pneumoniae Punktat „ + 0 0 0 Haemophilus influenzae Punktat „ + 0 0 0 Listeria monocytogenes Punktat „ + 0 + 0 Staphylococcus aureus Punktat nativ/anaerobes TM + 0 0 0 Escherichia coli Punktat „ + 0 0 0 Pseudomonas aeruginosa Punktat „ + 0 0 0 Streptococcus spp. Punktat „ + 0 0 0 Peptostreptococcus spp. Punktat „ + 0 0 0 Salmonella spp. Punktat, Serum „ + 0 0 + Staphylococcus epidermidis Punktat „ + 0 0 0 *Nocardia spp. Punktat „ + 0 0 0 Hirnabszess Streptococcus spp. (S. intermedius, S. anginosus) Epiduraler Abszess ++ _______________________________________________________________________________________ TM = Transportmedium, Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikro- organismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier Seite 41 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren -----------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Epiduraler Abszess *Actinomyces spp. Punktat Fusobacterium spp. Punktat *Mycobacterium spp. (!) Punktat Aspergillus spp. Punktat *Brucella spp. (!) Punktat, Serum Treponema pallidum Punktat, Serum N anaerobes TM N N anaerobes TM ++ + 0 0 0 ++ + 0 0 0 ++ + 0 + + 0 ++ + + + + 0 0 + 0 0 0 + + 0 0 0 N Cranialer epiduraler Abszess Peptostreptococcus spp. Punktat nativ/anaer. TM Streptokokken der Viridansgruppe Punktat „ + 0 0 0 Streptococcus milleri Gruppe Punktat „ + 0 0 0 Bacteroides spp. Punktat „ + 0 0 0 Staphylococcus aureus Punktat „ + 0 0 0 Enterobacteriaceae Punktat „ + 0 0 0 Pseudomonas aeruginosa Punktat „ + 0 0 0 + 0 0 0 Dentogener Abszess Streptococcus pneumoniae Aspirat Haemophilus influenzae Aspirat „ + 0 0 0 Staphylococcus aureus Aspirat „ + 0 0 0 Peptostreptococcus spp. Aspirat „ + 0 0 0 Fusobacterium spp. Aspirat „ + 0 0 0 Prevotella spp. Aspirat „ + 0 0 0 Porphyromonas spp. Aspirat „ + 0 0 0 nativ/anaer. TM ++ ________________________________________________________________________________________ TM = Transportmedium, Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum, N = Nativmaterial (Transport ≤ 2 h). Seite 42 von 281 Infektionen der oberen Atemwege Die Indikation zur mikrobiologischen Diagnostik ergibt sich bei Versagen einer kalkulierten Therapie, bei Infektionen von Früh- und Neugeborenen und bei immunsupprimierten Patienten. Wegen der Empfindlichkeit der Erreger gegen Umwelteinflüsse sollten die Untersuchungsmaterialien möglichst schnell (innerhalb von 2 h bei Raumtemperatur) und wegen der Gefahr der Austrocknung in einem Transportmedium versandt werden. Da empfindliche Bakterien bei Temperaturen um 4°C absterben, sollte eine Lagerung im Kühlschrank unterbleiben. Ist eine Verarbeitung innerhalb von 2 h nach der Abnahme nicht möglich, muss die Lagerung bei Raumtemperatur erfolgen. Dabei besteht die Gefahr, dass die Krankheitserreger von Keimen der Normalflora überwuchert werden. Die Diagnostik ist dadurch erschwert, dass der obere Respirationstrakt von einer Vielzahl von Mikroorganismen, einschließlich pathogener Keime, besiedelt ist. Beim Nachweis pathogener Keime wie ß-hämolysierenden Streptokokken ist daher die Relevanz der Isolate zu prüfen. Eine Infektion liegt nur vor, wenn klinische Symptome vorhanden sind. Infektionen der Mundhöhle --------------------------------------------------------------------------------------------------------------------------- 1 Parodontitis --------------------------------------------------------------------------------------------------------------------------1.1 Erregerspektrum: Fakultativ oder obligat anaerobe Bakterien wie Porphyromonas gingivalis, Treponema denticola, Tannerella forsythensis, Aggregatibacter (früher Actinobacillus) actinomycetemcomitans. 1.1.2 Indikation für die mikrobiologische Untersuchung: Juvenile oder schwere generalisierte Parodontitis. 1.3 Untersuchungsmethode: Kulturelle Anzüchtung und Resistenzbestimmung der Isolate. 1.4 Untersuchungsmaterialien: Zahntaschenexprimat, Sulcusflüssigkeit 1.5 Probengefäße: Universal-Probenröhrchen mit blauem Verschluss. Seite 43 von 281 1.6 Lagerung und Transport - Flüssigkeiten: ≤ 2 h bei RT, ist das nicht möglich, Verimpfung in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT - Abstrichtupfer: bis zu 24 h bei Raumtemperatur. --------------------------------------------------------------------------------------------------------------------------- 2 Sialadenitis --------------------------------------------------------------------------------------------------------------------------2.1 Erregerspektrum: Bacteroides und gramnegative Anaerobier, Streptokokken, Peptostreptokokken, S. aureus. 2.2 Indikation für die mikrobiologische Untersuchung: Eitrige Entzündungen 2.3 Untersuchungsmethode: Kulturelle Anzüchtung und Resistenzbestimmung der Isolate. 2.4 Untersuchungsmaterialien: Absaugflüssigkeit, Punktate, Blutkulturen. 2.5 Probengefäße: Universal-Probengefäß mit blauem Verschluss, Blutkulturflaschen für Punktate. 2.6 Lagerung und Transport: Flüssigkeiten: ≤ 2 h bei RT, ist das nicht möglich, Verimpfung in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- 3 Stomatitis, Periodontitis --------------------------------------------------------------------------------------------------------------------------3.1 Erregerspektrum: Streptokokken, fakultativ oder obligat anaerobe fakultativ anaerobe Bakterien wie Porphyromonas gingivalis, Prevotella intermedia, Fusobakterien. 3.2 Indikationen für die mikrobiologische Untersuchung Persistierende, eitrige oder nekrotisierende Stomatitis. 3.3 Untersuchungsmethode: Kulturelle Anzüchtung und Resistenzbestimmung der Isolate, Identifizierung der Erreger mittels 16S rRNA-Sequenzanalyse. PCR Seite 44 von 281 3.4 Untersuchungsmaterialien: Tupferabstrich, Spülflüssigkeit. 3.5 Probengefäße: Universal-Abstrichtupfer mit blauer Kappe, Universal-Probengefäß mit blauem Verschluss. 3.6 Lagerung und Transport: - Spülflüssigkeit: ≤ 2 h bei RT, ist das nicht möglich, Verimpfen in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT. - Abstrichtupfer bis zu 24 h bei RT. Infektionen der Nase und der Nasennebenhöhlen --------------------------------------------------------------------------------------------------------------------------- 1 Rhinitis --------------------------------------------------------------------------------------------------------------------------1.1 Erregerspektrum: Pneumokokken, A-Streptokokken, Haemophilus influenzae, S. aureus. 1.2 Indikation für die mikrobiologische Untersuchung: Eitrige Rhinitis, bei einer Dauer von über 2 Wochen, Sekundärinfektion nach einer Infektion mit Viren. 1.3 Untersuchungsmethode: Kulturelle Anzüchtung und Resistenzbestimmung der Isolate 1.4 Untersuchungsmaterialien: Nasenabstrich, Spülflüssigkeit, Absaugflüssigkeit, Nasopharyngealsekret. 1.5 Probengefäße: Universal-Abstrichtupfer mit blauer Kappe, Universal-Probengefäß mit blauem Verschluss. 1.6 Probenentnahme: - Tupfer aus der Sterilverpackung entnehmen - mit dem Watteteil des Tupfers die Nasenhöhle des Patienten abstreichen - Tupfer in das Transportmedium stecken und fest verschließen - Nasopharyngealabstrich: Tupfer vorsichtig entlang der Nasenscheidewand und des Nasenbodens in den Nasopharynx vorschieben, dann rotierend abstreichen. Seite 45 von 281 1.7 Lagerung und Transport: - Flüssige Materialien: ≤ 2 h bei RT, ist das nicht möglich, Verimpfen in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT - Abstrichtupfer bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- 2 Sinusitis --------------------------------------------------------------------------------------------------------------------------2.1 Erregerspektrum: Pneumokokken, A-Streptokokken, Haemophilus influenzae, S. aureus, anaerobe Bakterien. 1.2 Indikation für die mikrobiologische Untersuchung: Bei chronischem Verlauf (> 8 Wochen) oder bei Komplikationen unter Beteiligung der Orbita oder der Schädelgrube. 2.3 Untersuchungsmethode: Kulturelle Anzüchtung und Resistenzbestimmung der Isolate. 2.4 Untersuchungsmaterialien: Punktate, endoskopisch gewonnenes Material. 2.5 Probengefäße: Universal-Probengefäß mit blauem Verschluss, Transportmedium für Anaerobier. 2.6 Lagerung und Transport: - Flüssige Untersuchungsmaterialien ≤ 2 h bei RT, ist das nicht möglich, Verimpfung in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT - Abstrichtupfer bis zu 24 h bei RT. Infektionen des Oropharynx --------------------------------------------------------------------------------------------------------------------------- 1 Epiglottitis --------------------------------------------------------------------------------------------------------------------------1.1 Erregerspektrum: Haemophilus influenzae, Pneumokokken, S. aureus. 1.2 Indikation für die mikrobiologische Untersuchung: Schwere Infektion Seite 46 von 281 1.3 Untersuchungsmethode: Kulturelle Anzüchtung und Resistenzbestimmung der Isolate. 1.4 Untersuchungsmaterialien: Tupferabstriche 1.5 Probengefäße: Universal-Abstrichtupfer mit blauer Kappe. 1.6 und Materialentnahme: Siehe Kapitel IV, Untersuchungsmaterialien - Abstriche 1.7 Lagerung und Transport: Abstrichtupfer: bis 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- 2 Laryngitis --------------------------------------------------------------------------------------------------------------------------2.1 Erregerspektrum: Bordetella pertussis, B. parapertussis, Haemophilus influenzae, Moraxella. 2.2 Indikation für die mikrobiologische Untersuchung: Krankheitsdauer von über 2 Wochen sowie bei Komplikationen wie Epiglottitis, Laryngotracheitis. 2.3 Untersuchungsmethode: - Kulturelle Anzüchtung und Resistenzbestimmung der Isolate - DNA-Nachweis mittels PCR bei Bordetellen. 2.4 Untersuchungsmaterialien: Tupferabstriche, Spülflüssigkeit (Bronchoskop) 2.5 Probengefäße: Universal-Abstrichtupfer mit blauer Kappe, Dacrontupfer mit Transportmedium für anspruchsvoll wachsende Keime, Universal-Probenröhrchen mit blauem Verschluss. 2.6 Lagerung und Transport: - Spülflüssigkeiten: ≤ 2 h bei RT, ist das nicht möglich, Verimpfung in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT - Abstrichtupfer: bis zu 24 h bei RT. Seite 47 von 281 --------------------------------------------------------------------------------------------------------------------------- 3 Tonsillitis, Pharyngitis --------------------------------------------------------------------------------------------------------------------------3.1 Erregerspektrum: A-Streptokokken, Anaerobier bei Angina Plaut-Vincenti, Corynebacterium diphtheriae. 3.2 Indikation für die mikrobiologische Untersuchung: Bei Fieber, bei eitriger Pharyngitis. 3.3 Untersuchungsmethode: Kulturelle Anzüchtung und Resistenzbestimmung der Isolate. 3.4 Untersuchungsmaterialien: Tupferabstriche. 3.5 Probengefäße: Universal-Abstrichtupfer mit blauer Kappe. 3.6 Probenentnahme: Rachenabstrich bei Tonsillitis: Siehe Kapitel IV: Untersuchungsmaterial - Abstriche (Rachenabstrich). Pharynxabstrich bei Pharyngitis: Siehe Kapitel IV: Untersuchungsmaterial - Abstriche. Nasopharyngealabstrich bei Pharyngitis: Siehe Kapitel IV: Untersuchungsmaterial - Abstriche. Diese Abstriche dürfen nur ausgeführt werden, wenn die Epiglottis nicht entzündet ist! Angina Plaut-Vincenti: Der Abstrichtupfer sollte in ein Transportmedium für Anaerobier gegeben werden. Außerdem sollte zur Sicherung der Diagnose ein Grampräparat angefordert werden und die Verdachtsdiagnose auf dem Antragsformular vermerkt werden. Rachenspülwasser: Siehe Kapitel IV: Untersuchungsmaterial - Material aus den Atemwegen. 3.7 Lagerung und Transport: - Rachenspülwasser: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C - Abstrichtupfer bis zu 24 h bei RT. -------------------------------------------------------------------------------------------------------------------------- Seite 48 von 281 4 Peritonsillarabszess --------------------------------------------------------------------------------------------------------------------------4.1 Erregerspektrum: A-Streptokokken, Fusobakterien, oropharyngeale Flora. 4.2 Untersuchungsmethode: Kulturelle Anzüchtung und Resistenzbestimmung der Isolate. 4.3 Untersuchungsmaterialien: Tupferabstriche, Op-Material. 4.4. Probengefäße: Universal-Abstrichtupfer mit blauer Kappe, Universal-Probengefäß mit blauer Verschlussklappe, Transportmedium für Anaerobier 4.5 Lagerung und Transport: - Op-Material: ≤ 2 h bei RT, eine längere Lagerung ist nicht möglich. - Abstrichtupfer bis zu 24 h bei RT. Seite 49 von 281 Tabelle 3: Erregerspektrum bei Infektionen der oberen Atemwege (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren -----------------------------------TM Mikr Kultur PCR __________________________________________________________________________ Infektionen der Mundhöhle Parodontitis Fakultativ anaerobe Bakterien Obligat anaerobe Bakterien Zahntaschenexprimat, Sulcusfl. „ anaer. TM „ --- + 0 --- + 0 --- + 0 (P. gingivalis, P. intermedia) Sialadenitis Gramnegative Anaerobier Absaugflüssigkeit, Punktat anaer. TM (P. gingivalis, P. intermedia) Peptostreptokokken „ „ --- + 0 Streptokokken „ „ --- + 0 S. aureus „ „ --- + 0 --- + 0 Stomatitis, Periodontitis Streptokokken Gramnegative Anaerobier Tupferabstrich, Spülflüssigk. anaer. TM „ „ --- + 0 „ „ --- + 0 --- + 0 --- + 0 (P. gingivalis, P. intermedia, Fusobakterien) Infektionen der Nase und Nebenhöhlen Sinusitis Streptococcus pneumoniae Nasenabstrich Haemophilus influenzae Nasenabstrich anaerobes TM „ Streptokokken der Gruppe A Nasenabstrich „ --- + 0 Prevotella spp. Nasenabstrich, Aspirat “ --- + 0 Fusobacterium spp. Nasenabstrich, Aspirat “ --- + 0 Peptostreptococcus spp. Nasenabstrich, Aspirat “ --- + 0 Staphylococcus aureus Nasenabstrich “ --- + 0 Moraxella catarrhalis Nasenabstrich “ --- + 0 _______________________________________________________________________ TM = Transportmedium, Mikr = Mikroskopie (+ = Keimwachstum, unspezifisch; ++ = Keimwachstum, spezifisch, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben , ---- = Mikroskopie nicht durchgeführt, AG = Antigennachweis, TS = Trachealsekret, BAL = bronchoalveoläre Lavage, Anaerobier. Seite 50 von 281 ________________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikr Kultur PCR AK __________________________________________________________________________ Infektionen des Oropharynx Epiglottitis Haemophilus influenzae b / non b Rachenabstrich aerobes TM --- + 0 0 Haemophilus parainfluenzae Rachenabstrich aerobes TM --- + 0 0 Streptococcus pneumoniae Rachenabstrich aerobes TM --- + 0 0 Staphylococcus aureus Rachenabstrich aerobes TM --- + 0 0 Pasteurella multocida Rachenabstrich aerobes TM --- + 0 0 Moraxella catarrhalis Rachenabstrich aerobes TM --- + 0 0 Bordetella pertussis Rachenhinterwandabstr. D --- + + + Bordetella parapertussis Rachenhinterwandabstr. D --- + + + Haemophilus influenzae Rachenabstrich aerobes TM --- + 0 0 Rachenabstrich aerobes TM --- + 0 0 Mycoplasma pneumoniae Rachenabstrich aerobes TM --- 0 + + Corynebacterium diphtheriae Rachenabstrich aerobes TM --- + Corynebacterium ulcerans Rachenabstrich aerobes TM --- + 0 0 Arcanobacterium haemolyticum Rachenabstrich aerobes TM --- + 0 0 Angina Plaut-Vincenti (Anaerobier) Rachenabstrich aerobes TM +++ 0 0 0 Laryngitis Pharyngitis, Tonsillitis Hämolysierende Streptokokken der Gruppen A, C und G Toxinnachweis Viren (Adenoviren, EBV u. a.) Peritonsillarabszess Streptokokken der Gr. A Punktat N, BK --- + 0 0 oropharyngeale Flora Punktat N, BK --- + 0 0 Tracheitis Staphylococcus aureus Rachenabstrich aerobes TM --- + 0 0 Streptokokken der Gruppe A Rachenabstrich aerobes TM --- + 0 0 Haemophilus influenzae b Rachenabstrich aerobes TM --- + 0 0 __________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, Mikr = Mikroskopie (+ = Keimwachstum, unspezifisch; ++ = Keimwachstum , spezifisch, --- = nicht durchgeführt), AK = Antikörpernachweis, TS = Trachealsekret, BAL = bronchoalveoläre Lavage, Anaerobier, N = Nativmaterial (Transport ≤ 2 h), BK = Blutkultuflaschen. Seite 51 von 281 Infektionen der Ohren --------------------------------------------------------------------------------------------------------------------------- 1 Otitis externa --------------------------------------------------------------------------------------------------------------------------Die Otitis externa ist eine Entzündung des äußeren Ohres und des Gehörgangs. Man unterscheidet vier Kategorien mit unterschiedlichem Erregerspektrum (siehe Tabelle 4). - Akute lokalisierte Otitis externa Pustel; Furunkel, Erysipel - Akute diffuse Otitis externa (swimmer’s ear) Diffuse Entzündung, bes. in feuchtem, warmem Klima - Chronische Otitis externa meist durch Drainage von Sekret aus dem Mittelohr bei beschädigtem Trommelfell - Maligne (invasive) Otitis externa Nekrotisierende Infektion des Gehörgangs, bes. bei Diabetes 1.1 Erregerspektrum: siehe Tabelle 4 1.2 Indikation für die mikrobiologische Untersuchung: Bei Therapieversagen. 1.3 Untersuchungsmethode: Kulturelle Anzüchtung und Resistenzbestimmung der Isolate. 1.4 Untersuchungsmaterialien: Tupferabstriche, Spülflüssigkeit. 1.5 Probengefäße: Universal-Abstrichtupfer mit blauer Kappe, Universal-Probengefäß mit blauem Verschluss. 1.6 Materialentnahme: Ohrmuschel vorher desinfizieren. Mit einem Abstrichtupfer wird dann der Gehörgang rotierend abgestrichen. Bei einem tiefen Gehörgangabstrich sollte ein Ohrtrichter verwendet werden, um eine Kontamination mit Keimen des Außenohres zu vermeiden. 1.7 Lagerung und Transport: - Spülflüssigkeit: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. - Abstrichtupfer bis zu 24 h bei RT. Seite 52 von 281 --------------------------------------------------------------------------------------------------------------------------- 2 Otitis media --------------------------------------------------------------------------------------------------------------------------Man unterscheidet die akute und die chronische Erkrankung. 2.1 Erregerspektrum: siehe Tabelle 4. 2.2 Indikation für die mikrobiologische Untersuchung: Bei Neugeborenen, bei Immunsuppression, bei Mastoiditis, bei Beteiligung der Hirnnerven oder Schädelknochen. 2.3 Untersuchungsmethode: Kulturelle Anzüchtung und Resistenzbestimmung der Isolate. 2.4 Untersuchungsmaterialien: Tupferabstriche, Punktate 2.5 Probengefäße: Universal-Abstrichtupfer mit blauer Kappe, Universal-Probengefäß mit blauem Verschluss. 2.6 Materialentnahme: Siehe Kapitel IV: Untersuchungsmaterial - Abstriche 2.7 Lagerung und Transport: - Punktate: ≤ 2 h bei RT, ist das nicht möglich, Verimpfung in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT. - Abstrichtupfer bis zu 24 h bei RT. Seite 53 von 281 Tabelle 4: Erregerspektrum bei Infektionen Ohren _________________________________________________________________________________ Material Angewandte Nachweisverfahren -----------------------------------TM Mikr Kultur AG PCR __________________________________________________________________________ Otitis media Akute Form Streptococcus pneumoniae Ohrabstrich aerobes TM --- + 0 0 Haemophilus influenzae Ohrabstrich aerobes TM --- + 0 0 Moraxella catarrhalis Ohrabstrich aerobes TM --- + 0 0 Streptokokken der Gruppe A Ohrabstrich aerobes TM --- + 0 0 Staphylococcus aureus Ohrabstrich aerobes TM --- + 0 0 Pseudomonas aeruginosa Ohrabstrich aerobes TM --- + 0 0 Enterobacteriaceae Ohrabstrich aerobes TM --- + 0 0 Staphylococcus aureus Ohrabstrich aerobes TM --- + 0 0 Anaerobier Ohrabstrich aerobes TM --- + 0 0 Staphylococcus aureus Ohrabstrich aerobes TM --- + 0 0 Streptokokken der Gruppe A Ohrabstrich aerobes TM --- + 0 0 Chronische Form Otitis externa Akute Otitis externa Akute diffuse Otitis externa (Swimmer’s ear) Pseudomonas aeruginosa Ohrabstrich aerobes TM --- + 0 0 Enterobacteriaceae Ohrabstrich aerobes TM l --- + 0 0 Streptococcus pneumoniae Ohrabstrich aerobes TM --- + 0 0 Haemophilus influenzae Ohrabstrich aerobes TM --- + 0 0 Ohrabstrich Nativmaterial --- + 0 0 Chronische Otitis externa Maligne, invasive Form Aspergillus spp. __________________________________________________________________________ TM = Transportmedium, Mikr = Mikroskopie (+ = Keimwachstum, unspezifisch; ++ = Keimwachstum , spezifisch, --- = nicht durchgeführt), AG = Antigennachweis, TS = Trachealsekret, BAL = bronchoalveoläre Lavage, Anaerobier Seite 54 von 281 Infektionen der tiefen Atemwege --------------------------------------------------------------------------------------------------------------------------- 1 Pneumonie, Bronchitis --------------------------------------------------------------------------------------------------------------------------1.1 Erregerspektrum: siehe Tabelle 5 1.2 Indikation für die mikrobiologische Untersuchung: Ambulant erworbene Pneumonien, bes. mit schwerem Verlauf, bei Pneumonien von Patienten mit Risikofaktoren wie Alter > 65 Jahre, Diabetes mellitus oder anderen schweren Grunderkrankungen sowie bei Immunsuppression, bei nosokomialen Pneumonien, bei Pneumonien mit persistierenden Infiltraten oder bei Therapieversagen, bei Patienten mit rezidivierenden Bronchitiden oder Atemwegsinfektionen sowie zur Erfassung resistenter Erreger. 1.3 Untersuchungsmethode: - Kulturelle Anzucht und Resistenzbestimmung der Isolate („typische Pneumonieerreger“) - DNA-Nachweis mittels PCR („atypische Pneumonieerreger“). 1.4 Probengefäße: Sputumröhrchen 1.5 Untersuchungsmaterialien: 1.5.1 Sputum: Siehe Kapitel IV: Untersuchungsmaterial - Material aus den Atemwegen Lagerung und Transport: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. 1.5.2 Induziertes Sputum: Siehe Kapitel IV: Untersuchungsmaterial - Material aus den Atemwegen Lagerung und Transport: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. 1.5.3 Trachealsekret/ Bronchialsekret: Tracheal- und Bronchialsekret ist ein wertvolleres Material als Sputum und sollte immer dann gewonnen werden, wenn die Gewinnung einer BAL nicht möglich ist. Die Materialien sind geeignet zum Nachweis von: - schnell wachsenden Bakterien - Sprosspilzen, Schimmelpilzen - Mycobacterium spp. (suboptimal, BAL besser) - Legionella spp. (suboptimal) - Mycoplasma pneumoniae (suboptimal), Chlamydophila pneumoniae, Chlamydia trachomatis bei Säuglingen (suboptimal) - Nocardia spp., Aktinomyzeten Seite 55 von 281 - Anaerobiern bei Aspirationspneumonie (suboptimal). Materialentnahme: Siehe Kapitel IV: Untersuchungsmaterial - Material aus den Atemwegen. Lagerung und Transport: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. 1.5.4 Broncho-alveoläre Lavage (BAL) Die BAL ist das geeignetste Material für die Pneumonie-Diagnostik und gilt als beste Methode zum Nachweis alveolärer oder in den terminalen Bronchioli ablaufenden Infektionen. Es werden alle ätiologisch bedeutsamen Keime quantitativ erfasst; das Risiko einer Kontamination mit Keimen der Normalflora ist mit dieser Methode am geringsten; weiterhin kann die Kontaminationsrate durch Verwerfen der ersten Sekretportion gesenkt werden. Materialentnahme: Siehe Kapitel IV: Untersuchungsmaterial - Material aus den Atemwegen. Lagerung und Transport: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. Interpretation: Bei der mikroskopischen Untersuchung der BAL-Flüssigkeit spricht ein Anteil an Plattenepithelzellen von mehr als 1% an der Gesamtheit der nachweisbaren Zellen für eine 4 erhebliche Kontamination der Probe! Keimzahlen ≥ 10 KBE/ml sprechen für eine Pneumonie. Die pathogenen Keime sollten in höheren Konzentrationen vorliegen als die Kontaminationskeime der Normalflora. 1.5.5 Nasopharyngeale Absaugung: Siehe Kapitel IV: Untersuchungsmaterial - Material aus den Atemwegen. Lagerung und Transport: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. 1.5.6 Pleurapunktat: Siehe Kapitel IV: Untersuchungsmaterial - Punktate Lagerung und Transport: ≤ 2 h bei RT, ist das nicht möglich, Verimpfung in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT.. 1.5.7 Magensaft: Siehe Kapitel IV: Untersuchungsmaterial - Material aus den Atemwegen Lagerung und Transport: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. 1.5.8 Blutkulturen: Da Pneumonien häufig Bakteriämien verursachen, sollten stets Blutkulturen abgenommen werden (siehe Kapitel IV: Untersuchungsmaterial - Blutkulturen). 1.6 Transport und Lagerung (allgemeine Aspekte): Sekrete aus dem Oropharynx können bis auf wenige Ausnahmen (Mykoplasmen, Chlamydien) nicht durch Transportsysteme geschützt werden. Seite 56 von 281 Die empfohlenen Transportzeiten und Lagerungsbedingungen müssen strikt eingehalten werden, da nur dann ein Absterben empfindlicher Mikroorganismen sowie die Überwucherung oder Hemmung ätiologisch wichtiger Erreger durch Keime der Normalflora weitgehend verhindert werden kann. 1.7 Dauer der Untersuchung: Ein negativer Befund wird nach 3 Tagen erstellt. 1.8 Interpretation: Die Untersuchung von Tracheal- und Bronchialsekret hat eine hohe Sensitivität, aber eine geringe Spezifität für bakterielle Pneumonieerreger. Mikroorganismen der Normalflora, zu denen in geringen Keimzahlen auch die pathogenen Pneumonieerreger wie Pneumokokken gehören, besiedeln unter Beatmungsbedingungen auch den oberen und unteren Respirationstrakt und sind schwer von den ätiologisch bedeutsamen Pneumonieerregern zu unterscheiden. Die nachgewiesenen pathogenen Keime verursachen nicht in jedem Fall eine Pneumonie. Eine antibiotische Therapie sollte deshalb nur bei vorliegenden klinischen oder radiologischen Zeichen durchgeführt werden. Weiterhin dürfen potentielle andere Infektionsloci nicht vernachlässigt werden. Da die Kontaminationsgefahr mit Keimen der Normalflora bei der BAL geringer ist, weist die 4 Untersuchung eine hohe Spezifität auf: 10 Keime/ml sprechen bei entsprechender klinischer Symptomatik für den ätiologisch bedeutsamen Pneumonieerreger. --------------------------------------------------------------------------------------------------------------------------- 2 Lungenabszess --------------------------------------------------------------------------------------------------------------------------2.1 Erregerspektrum: Pneumokokken, S. aureus, Klebsiellen, Anaerobier (Tabelle 5). 2.2 Indikation zur mikrobiologischen Diagnostik: V. a. Lungenabszess 2.3 Untersuchungsmethode: Kulturelle Anzüchtung und Resistenzbestimmung der Erreger, DNA-Nachweis mittels PCR. 2.4 Probengefäße: Universal-Probenröhrchen mit blauem Schraubdeckelverschluss 2.5 Materialentnahmenahme: - Abszessmaterial sollte punktiert oder aspiriert werden, Abstriche sind ungeeignet. - Um ein Austrocknen zu verhindern, sollte vor allem Biopsiematerial in wenig Ringerlösung (ca. 1 ml) überführt werden. Seite 57 von 281 2.6 Transport: ≤ 2 h bei RT, bei längerem Transport Verimpfung in Blutkulturflaschen, dann bis zu 24 bei RT; Biopsate können nicht gelagert werden, sondern müssen sofort transportiert werden. 2.7 Dauer der Untersuchung: Ein negativer Befund wird nach 3 Tagen erstellt. 2.8 Interpretation: Der Nachgewiesenen Erreger entspricht in der Regel dem Infektionserreger. --------------------------------------------------------------------------------------------------------------------------- 3 Cystische Fibrose --------------------------------------------------------------------------------------------------------------------------Die Mukoviszidose ist eine autosomal rezessiv vererbte Erkrankung (Mutation im Cystic-FibrosisTransmembrane-Conductance-Regulator-Gen), die zu einer generalisierten Störung des sekretorischen Epithels aller exokrinen Drüsen führt. Im Respirationstrakt wird ein sehr zäher Schleim produziert, der die Selbstreinigungsfunktion der Alveolen beeinträchtigt. Es siedeln sich Bakterien an, die zu chronischen Entzündungen und zu einem Umbau des Lungengewebes führen. 3.1 Erregerspektrum: S. aureus, H. influenzae, P. aeruginosa, Burkholderia-Komplex, Nonfermenter. 3.2 Untersuchungsmethode: Kulturelle Anzüchtung mit Resistenzbestimmung der Isolate (Agardiffusionstest, MHK-Bestimmung), Sequenzierung bei unklaren Ergebnissen. 3.3 Probengefäße: Sputumröhrchen 3.4 Untersuchungsmaterialien: Sputum, Bronchialsekret, BAL (mindestens 1 ml), Rachenabstrich bei Kleinkindern. 3.5 Lagerung und Transport: Wegen der quantitativen Auswertung der Untersuchungsmaterialien ist ein sofortiger Transport bei Raumtemperatur notwendig. Seite 58 von 281 3.6 Dauer der Untersuchung: Die Untersuchung ist langwierig und kann bis zu 1 Woche dauern. Das besondere Erregerspektrum, das durch seltene und langsam wachsende und schwer differenzierbare Erreger gekennzeichnet ist, verlangt spezielle Anlage- und Differenzierungsmethoden sowie persönliche Erfahrung. Von allen relevanten Keimen wird die minimale Hemmkonzentration (MHK) bestimmt. --------------------------------------------------------------------------------------------------------------------------- 4 Infektionen mit seltenen Erregern --------------------------------------------------------------------------------------------------------------------------- Actinomyces spp. - Aspergillus spp. - Bacillus anthracis - Bordetella spp. - Candida spp. - Chlamydophila pneumoniae - Chlamydophila psittaci - Chlamydia trachomatis - Coxiella burnetii - Legionella spp. - Mycoplasma pneumoniae - Mycobacterium tuberculosis und MOTT - Nocardia spp. - Pneumocystis jirovecii --------------------------------------------------------------------------------------------------------------------------- Seite 59 von 281 Tabelle 5: Erregerspektrum bei Infektionen der tiefen Atemwege (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren --------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Pneumonie Ambulant erworbene Pneumonie häufige Erreger: Streptococcus pneumoniae Sputum, TS, BAL, BK N Haemophilus influenzae Sputum, TS, BAL , BK Moraxella catarrhalis + + 0 0 0 N + 0 0 0 Sputum, TS, BAL , BK N + 0 0 0 Klebsiella pneumoniae Sputum, TS, BAL , BK N + 0 0 0 Legionella pneumophila Sputum, BAL, TS N + 0 + 0 Urin N Mycoplasma pneumoniae BAL, TS, Rachenabstrich N 0 0 + + Chlamydia pneumoniae BAL, TS N 0 0 + + Bordetella pertussis Nasopharyngealsekret D + 0 + + Coxiella burnetii Serum N 0 0 0 + Nocardia asteroides Sputum, TS, BAL N + + 0 0 0 Actinomyces spp. Sputum, TS, BAL N ++ + 0 0 0 Chlamydia trachomatis TS, Rachenabstr. N 0 0 0 + + Sputum, BK N + + 0 0 0 Pseudomonas aeruginosa BAL, TS, Sputum, BK N + 0 0 0 Staphylococcus aureus BAL, TS, Sputum, BK N + 0 0 0 Klebsiella pneumoniae BAL, TS, Sputum, BK N + 0 0 0 Candida albicans BAL, TS, Sputum, BK N ++ 0 0 + 0 Aspergillus spp. BAL, TS, Sputum N ++ 0 0 + + Legionella spp. BAL, TS, Sputum N (+) + 0 0 Urin N + seltene Erreger: (bei Neu- und Frühgeborenen) Bacillus anthracis (Anthrax) Objektträger (bei Kontakt mit Weidetieren) Nosokomiale Pneumonie + __________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial (Transport < 2 h), Mikr = Mikroskopie (+ = Keimwachstum, unspezifisch; ++ = Keimwachstum , spezifisch), AG = Antigennachweis, AK = Antikörpernachweis, TS = Trachealsekret, BAL = bronchoalveoläre Lavage, BK = Blutkultur, Anaerobier Seite 60 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ nach Auslandsaufenthalt Francisella tularensis (!) Sputum, BK Speziallabor für Keime der Risikogruppe 3 Sputum Speziallabor für Keime der Risikogruppe 3 BAL, TS, Biopsat N + + 0 0 + BAL, TS, Biopsat N + + 0 0 + BAL, TS, Biopsat N + + 0 0 + BAL, TS, Biopsat N + + 0 0 + Pseudomonas aeruginosa BAL, TS, Sputum, BK N + 0 0 0 Klebsiella pneumoniae BAL, TS, Sputum, BK N + 0 0 0 Enterobacter spp. BAL, TS, Sputum, BK N + 0 0 0 Proteus spp. BAL, TS, Sputum, BK N + 0 0 0 Morganella morganii BAL, TS, Sputum, BK N + 0 0 0 Staphylococcus aureus BAL, TS, Sputum, BK N + 0 0 0 Streptococcus pneumoniae Sputum, TS, BAL, BK N + 0 0 0 Nocardia asteroides Sputum, TS, BAL N + 0 0 0 Legionella spp. BAL, TS, BAL, Serum N + 0 + + (USA, [Missouri, Arkansas, Oklahoma], Asien) Pseudomonas pseudomallei (!) (Südostasien, Nordaustralien) Histoplasma capsulatum (!) (USA [Ohio, Mississippi, Missouri], Afrika, Mittel- und Südamerika) Blastomyces dermatitidis (!) (USA [Ohio, Mississippi]), Indien, Zentral- und Südamerika, Mittelasien Coccidioides immitis (!) (USA [Südwest], Mexiko) Paracoccidioides brasiliensis (!) (Südamerika, bes. Brasilien) bei Immunsuppression ++ Urin N Mycobacterium tuberculosis (!) Sputum, TS, BAL N ++ + + 0 + 0 M. avium intracellulare Sputum, TS, BAL N ++ + 0 0 0 Candida spp. TS, BAL , BK N ++ + 0 + + Aspergillus fumigatus BAL, TS, Sputum N ++ + + + + Pneumocystis carinii BAL N +++ 0 0 + 0 __________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial (Transport < 2 h), Mikr = Mikroskopie (+ = Keimwachstum, unspezifisch; ++ = Keimwachstum , spezifisch, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben), AG = Antigennachweis, AK = Antikörpernachweis, TS = Trachealsekret, BAL = bronchoalveoläre Lavage, BK = Blutkultur, Anaerobier, (!) = Keime der Risikogruppe 3 Seite 61 von 281 ________________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Aspirationspneumonie Aerobier (wie amb. Pneumonie) BAL, Biopsie N + 0 0 0 Peptostreptococcus spp. BAL, Biopsie N + 0 0 0 Fusobacterium spp. BAL, Biopsie N + 0 0 0 Prevotella melaninogenica BAL, Biopsie N + 0 0 0 Porphyromonas spp. BAL, Biopsie N + 0 0 0 Streptococcus pneumoniae Punktat, Biopsie N + 0 0 0 Haemophilus influenzae Sputum, TS, BAL N + 0 0 0 Streptococcus pneumoniae Sputum, TS, BAL N + 0 0 0 Moraxella catarrhalis Sputum, TS, BAL N + 0 0 0 Klebsiella spp. Sputum, TS, BAL N + 0 0 0 Staphylococcus aureus Sputum, TS, BAL N + 0 0 0 Haemophilus influenzae Sputum, TS, BAL N + 0 0 0 Pseudomonas aeruginosa Sputum, TS, BAL N + 0 0 0 Burkholderia cepacia-Komplex Sputum, TS, BAL N + 0 0 0 Stenotrophomonas maltophilia Sputum, TS, BAL N + 0 0 0 Candida spp. Sputum, TS, BAL N + 0 0 0 Aspergillus fumigatus Sputum, TS, BAL N + + 0 0 + 0 0 0 Bronchitis CF Kinder Jugendliche + Lungenabszess Peptostreptococcus spp. Punktat, Biopsie Fusobacterium nucleatum Punktat, Biopsie “ + 0 0 0 Prevotella melaninogenica Punktat, Biopsie “ + 0 0 0 Bacteroides fragilis Gruppe Punktat, Biopsie “ + 0 0 0 Staphylococcus aureus Punktat, Biopsie “ + 0 0 0 Klebsiella pneumoniae Punktat, Biopsie “ + 0 0 0 Pseudomonas aeruginosa Punktat, Biopsie “ + 0 0 0 anaerobes TM _______________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial (Transport < 2 h), Mikr = Mikroskopie (+ = Keimwachstum, unspezifisch; ++ = Keimwachstum , spezifisch, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben), AG = Antigennachweis, AK = Antikörpernachweis, TS = Trachealsekret, BAL = bronchoalveoläre Lavage, BK = Blutkultur, Anaerobier, (!) = Keime der Risikogruppe 3 Seite 62 von 281 Infektionen am Auge --------------------------------------------------------------------------------------------------------------------------- 1 Konjunktivitis, Blepharitis, Dakryoadenitis, Dakryozystitis, Infektionen der Orbita --------------------------------------------------------------------------------------------------------------------------1.1 Erregerspektrum: Siehe Tabelle 6. 1.2 Indikation für die mikrobiologische Untersuchung: Eine kulturelle und zytologische Untersuchung ergibt sich bei jeder Entzündung am Auge. 1.3 Untersuchungsmethode: Kultur und Resistenzbestimmung der Isolate 1.4 Untersuchungsmaterialien: Augenabstrich, Bindehautabstrich. 1.5 Probengefäße: Universal-Abstrichtupfer mit oranger Kappe. 1.6 Materialentnahme: Die Probenentnahme sollte nach Möglichkeit unter sterilen Kautelen vor Anwendung von Lokalanästhetika und insbesondere von Lokalantibiotika sowie beim Nachweis von Chlamydien vor Fluoreszein-Applikation erfolgen. Die Abstriche werden durch Auswischen des unteren Konjunktivalsacks mit sterilen Dacrontupfern, die vorher mit einem flüssigen Transportmedium befeuchtet worden sind, gewonnen. Auch wenn nur ein Auge entzündet ist, sollten stets beide Augen abgestrichen werden (ein Abstrich dient zur Kontrolle). 1.7 Lagerung und Transport: bis zu 24 h bei RT. 1.8 - Infektionen mit seltenen Erregern: Viren: Adenoviren bei Keratokonjunktivitis epidemica, HSV bei Herpes-simplex-Keratitis, VZV bei Zoster ophthalmicus, CMV; die Diagnostik wird im Institut für Virologie durchgeführt. Toxocara canis oder Toxocara cati sowie Toxoplasma gondii: Antikörpernachweis Neisseria gonorrhoeae: Bindehautabstrich auf einem Nährmediumträger (Go-Slide) Chlamydia trachomatis: Bindehautabstrich (Probenröhrchen mit oranger Kappe für den DNANachweis). Seite 63 von 281 --------------------------------------------------------------------------------------------------------------------------- 2 Keratitis --------------------------------------------------------------------------------------------------------------------------Die Keratitis ist eine meist durch lokale Verletzung ausgelöste Entzündung der Hornhaut. 2.1 Erregerspektrum: Siehe Tabelle 6. 2.2 Indikation für die mikrobiologische Untersuchung: Eine kulturelle und zytologische Untersuchung ergibt sich bei jeder Entzündung am Auge. 2.3 Untersuchungsmethode: Kultur und Resistenzbestimmung der Isolate. 2.4 Untersuchungsmaterialien: Hornhautabstrich, Hornhautgeschabsel. 2.5 Probengefäße: Universal-Probenröhrchen mit blauem Verschluss. 2.6 Materialentnahme: Bei Entzündungen der Hornhaut wird Hornhautgeschabsel mit speziellen Schabern gewonnen und mit wenig physiologischer Kochsalzlösung versetzt. 2.7 Lagerung und Transport: ≤ 1 h bei RT, eine längere Lagerung ist nicht möglich. --------------------------------------------------------------------------------------------------------------------------- 3 Kontaktlinsen-Keratitis --------------------------------------------------------------------------------------------------------------------------3.1 Erregerspektrum: Siehe Tabelle 6. 3.2 Untersuchungsmethode: Kultur und Resistenzbestimmung der Isolate. 3.3 Untersuchungsmaterial: Kontaktlinsenaufbewahrungsflüssigkeit, Kontaktlinse. B. V. a. Acanthamöben-Keratitis entsprechende Diagnostik anfordern! Seite 64 von 281 3.4 Probengefäße: Universal-Probenröhrchen mit blauem Verschluss oder Kontaktlinsenbehälter 3.5 Materialentnahme: - Hände sorgfältig desinfizieren - Transportgefäß vorbereiten und mit wenig steriler Kochsalzlösung füllen - Kontaktlinse aus dem Auge entfernen und vorsichtig in das Transportgefäß fallen lassen. 3.6 Lagerung und Transport: ≤ 2 bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. --------------------------------------------------------------------------------------------------------------------------- 4 Endophthalmitis --------------------------------------------------------------------------------------------------------------------------Eine Endophthalmitis ist eine schwere Infektion der Augenkammer und der intraokularen Gewebe (Uvea, Retina). Die Symptome treten bei bakterieller Ursache meist innerhalb von 72h nach iatrogener oder traumatischer Verletzung des Auges auf. Man unterscheidet die post-chirurgische, die posttraumatische und die endogene (hämatogene) Entzündung. 4.1 Erregerspektrum: Siehe Tabelle 6. 4.2 Untersuchungsmethode: Kultur und Resistenzbestimmung der Isolate. 4.3 Probengefäße: Redonflaschen aus dem OP, sterile Spritzen. 4.4 Materialentnahme: Die Materialentnahme erfolgt intraoperativ (siehe Kapitel IV: Untersuchungsmaterial- Punktate). 4.5 Lagerung und Transport: ≤ 1 h bei RT; eine Zwischenlagerung ist nicht möglich! Die Materialien dürfen nicht eingefroren werden und nur kurzzeitig bei 4°C aufbewahrt werden. Bei Endophthalmitis sollte außerhalb der Dienstzeiten der zuständige Mikrobiologe verständigt werden (Tel. Dienst-Handy 0172 – 6633567). 4.6 Interpretation: Die Konjunktiven sind häufig mit Keimen der physiologischen Hautflora und bei Kindern mit der Flora des Oropharynx besiedelt. Die Wertung eines nachgewiesenen Erregers als kausalen Keim für die Infektion ist daher schwierig. Dagegen kann bei Endophthalmitis jedem nachgewiesenen Erreger eine ätiologische Bedeutung zukommen. Seite 65 von 281 Tabelle 6: Erregerspektrum bei Infektionen am Auge (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Infektionen der Konjunktiva Eitrige Konjunktivitis bei Neugeborenen Neisseria gonorrhoeae Abstrich D --- + 0 0 0 Chlamydia trachomatis Abstrich N --- 0 0 + + Objektträger Immunfluoreszenz Akute Konjunktivitis Staphylococcus aureus Abstrich aerobes TM --- + 0 0 0 Streptokokken der Gruppe A Abstrich „ --- + 0 0 0 Streptococcus pneumoniae Abstrich „ --- + 0 0 0 Haemophilus influenzae Abstrich „ --- + 0 0 0 Pseudomonas aeruginosa Abstrich „ --- + 0 0 0 Bartonella henselae (externe Untersuchung) Abstrich „ --- 0 0 + 0 Chlamydia trachomatis Abstrich „ --- 0 0 + 0 Objektträger Immunfluoreszenz Chronische Konjunktivitis Moraxella lacunata Abstrich aerobes TM --- + 0 0 0 Staphylococcus spp. Abstrich „ --- + 0 0 0 C. trachomatis Abstrich „ --- 0 0 + 0 0 + 0 Objektträger Immunfluoreszenz Infektionen der Retina Toxoplasma gondii Abstrich N 0 0 Serum + Candida spp. Abstrich N ++ + 0 0 0 Borrelia burgdorferi Abstrich N --- 0 0 + 0 Toxocara canis Abstrich N +++ 0 0 0 0 Orbitainfektion/Orbitalphlegmone Staphylococcus aureus Abstrich aerobes TM --- + 0 0 0 Peptostreptococcus spp. Abstrich „ --- + 0 0 0 Pseudomonas aeruginosa Abstrich „ --- + 0 0 0 ________________________________________________________________________________________ TM = Transportmedium, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = techniken, die eine mikrobiologische Diagnose erlauben, --- = Spezialfärbungen, - nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier Seite 66 von 281 _________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Orbitalphlegmone Haemophilus influenzae Abstrich „ --- + 0 0 0 Mycobacterium spp. Abstrich N ++ + 0 0 0 Zygomycetes Abstrich N ++ + 0 0 0 Aspergillus spp. Abstrich N ++ + 0 0 0 Echinococcus spp. Abstrich N 0 0 0 0 + Infektionen des Tränenkanals Dakryoadenitis (Tränendrüse) Staphylococcus aureus Abstrich aerobes TM --- + 0 0 0 Streptococcus pneumoniae Abstrich aerobes TM --- + 0 0 0 aerobes TM Haemophilus influenzae Abstrich --- + 0 0 0 Neisseria gonorrhoeae Abstrich D ++ + 0 0 0 *Mycobacterium tuberculosis (!) Abstrich N ++ + 0 + 0 Canaliculitis (Tränenkanal) *Actinomyces israelii Abstrich aerobes TM ++ + 0 0 0 Streptococcus spp. Abstrich aerobes TM --- + 0 0 0 Candida spp. Abstrich N ++ + 0 0 0 Aspergillus spp. Abstrich N ++ + 0 0 0 Dakryozystitis (Tränensack) Streptococcus pneumoniae Abstrich aerobes TM --- + 0 0 0 Streptococcus pyogenes Abstrich “ --- + 0 0 0 Staphylococcus aureus Abstrich “ --- + 0 0 0 Haemophilus influenzae Abstrich “ --- + 0 0 0 Pseudomonas aeruginosa Abstrich “ --- + 0 0 0 Candida albicans Abstrich N ++ + 0 0 0 Aspergillus spp. Abstrich N ++ + 0 0 0 Infektionen des Augenlides Blepharitis Staphylococcus aureus Abstrich aerobes TM --- + 0 0 0 Streptococcus spp. Abstrich “ --- + 0 0 0 Moraxella catarrhalis Abstrich “ --- + 0 0 0 _______________________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum Seite 67 von 281 _________________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikro Kultur AG PCR AK __________________________________________________________________________ Hordeolum Staphylococcus aureus Abstrich --- + 0 0 0 anaerobes TM --- aerobes TM Lidabszess/Phlegmone Streptococcus spp. Abstrich + 0 0 0 Haemophilus influenzae Abstrich „ --- + 0 0 0 Anaerobier Abstrich „ --- + 0 0 0 Staphylococcus spp. Abstrich aerobes TM --- + 0 0 0 Streptococcus pneumoniae Abstrich „ --- + 0 0 0 Pseudomonas aeruginosa Abstrich “ --- + 0 0 0 Bacillus cereus Abstrich “ --- + 0 0 0 Enterobacteriaceae Abstrich “ --- + 0 0 0 Moraxella lacunata Abstrich “ --- + 0 0 0 Mycobacterium fortuitum Abstrich N ++ + 0 0 0 Mycobacterium chelonei Abstrich N ++ + 0 0 0 Anaerobier Abstrich --- + 0 0 0 Fusarium solani Abstrich N + + 0 0 0 Candida albicans Abstrich N ++ + 0 0 0 Aspergillus fumigatus Abstrich N ++ + 0 0 0 Alternaria spp. Abstrich N + + 0 0 0 Acremonium spp. Abstrich N + + 0 0 0 Acanthamoeba spp. Abstrich N +++ 0 0 0 0 Staphylococcus epidermidis-Gruppe Aspirat N + + 0 0 0 Staphylococcus aureus Aspirat N + + 0 0 0 Streptococcus spp. Aspirat N + + 0 0 0 Infektionen der Cornea Keratitis anaerobes TM Viren (Adenoviren, HSV, VZV, CMV) Endophthalmitis Exogen/nach Katarakt-OP ________________________________________________________________________________________ TM = Transportmedium, AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier, Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), N = Nativ (Transport <2 h) Seite 68 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikro Kultur AG PCR AK __________________________________________________________________________ Endophthalmitis Exogen/linsenloses Auge Propionibacterium spp. Aspirat N + + 0 0 0 Haemophilus influenzae Aspirat N + + 0 0 0 Streptococcus pneumoniae Aspirat N + + 0 0 0 Streptokokken der Viridansgruppe Aspirat N + + 0 0 0 Bacillus cereus, Bacillus spp. Aspirat N + + 0 0 0 Koagulasenegative Staphylokokken Aspirat N + + 0 0 0 Candida spp. Aspirat N ++ + 0 + 0 Aspergillus fumigatus Aspirat N ++ + 0 + 0 Aspergillus flavus Aspirat N ++ + 0 0 0 Acremonium spp. Aspirat N + + 0 0 0 Penicillium spp. Aspirat N + + 0 0 0 Mucor Aspirat N ++ + 0 0 0 Staphylococcus aureus Aspirat N + + 0 0 0 Neisseria meningitidis Aspirat N ++ + 0 0 0 Streptococcus spp. Aspirat N + + 0 0 0 Haemophilus influenzae Aspirat N + + 0 0 0 Enterobacteriaceae Aspirat N + + 0 0 0 Pseudomonas aeruginosa Aspirat N + + 0 0 0 Nocardia asteroides Aspirat N + + 0 0 0 Candida albicans Aspirat N ++ + 0 + 0 Exogen/Bläschen Exogen/posttraumatisch Endogen ________________________________________________________________________________________ TM = Transportmedium, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier Seite 69 von 281 Infektionen der Haut und der Weichgewebe, postoperative Wundinfektionen, Abszesse innerer Organe 1 Erregerspektrum: siehe Tabelle 7. 2 Indikation für die mikrobiologische Untersuchung: Die Indikation zur mikrobiologischen Untersuchung ergibt sich bei primären Haut-, Weichgewebe-, Knochen- oder Gelenkinfektionen, bei Abszessen, bei infizierten traumatischen Wunden, Bissverletzungen und Zysten sowie bei operativ eröffneten Körperhöhlen. 3 Untersuchungsmethode: Kulturelle Anzucht und Resistenzbestimmung der Isolate. 4 Untersuchungsmaterial: 4.1 Eiter, Sekrete, Abszesse, Empyem, Gangrän, Pusteln, Bläschen, Punktate Probengefäße: Universal-Probenröhrchen mit blauem Schraubverschluss. Materialentnahme und Transport: - perkutane Punktion und Sekretaspiration mit einer Spritze unter aseptischen - Bedingungen (ein Tupferabstrich besitzt wenig Wert) Transportmodus 1 oder 2, bei längerem Transport erfolgt Transportmodus 3 - bei Abszessspaltung Entnahme von Abszessinhalt mit chirurgischem Löffel Transportmodus 1 - bei exsudatarmen Prozessen Aspiration vom Grund der Läsion mit Tuberkulinspritze nach Entfernen der Kanüle und Verschließen der Spritze, Transportmodus 1, 2, ggf. 3 - bei intraoperativer Entnahme sollte zusätzlich eine Probe von Granulationsgewebe eingesandt werden, Transportmodus 1. 4.2 Fisteln Probengefäße: Universal-Probenröhrchen mit blauem Schraubverschluss. Materialentnahme und Transport: Öffnung desinfizieren, Katheter zur Aspiration oder Gewebekürettage im Fistelgang einführen und Untersuchungsmaterial entnehmen, Transportmodus 1. 4.3 Ulzerationen, Wunden, Bisswunden Die Materialentnahme bei Bisswunden sollte nicht unmittelbar nach dem Biss erfolgen, sondern erst dann, wenn die ersten Entzündungsreaktionen auftreten, i. d. Regel nach 12 h. Probengefäße: Universal-Probengefäß mit blauem Schraubverschluss, Universal-Abstrichtupfer mit blauem Verschluss. Seite 70 von 281 Materialentnahme und Transport: Wundränder desinfizieren, oberflächlich Schorf abheben, ggf. Wundgrund kürettieren, evtl. vorhandenes Exsudat mit steriler Spritze aspirieren oder mit sterilem Abstrichtupfer entnehmen, Transportmodus 2 oder 3. 4.4 Phlegmonöse Prozesse Probengefäße: Universal-Probengefäß mit blauem Schraubverschluss. Materialentnahme und Transport: Desinfektion Hautoberfläche, Probeexzision aus Rand der Entzündung, Transportmodus 1. 4.5 Chronisch granulomatöse Prozesse, Aktinomykose, Myzetome, Osteomyelitis Probengefäße: Universal-Probengefäß mit blauem Schraubverschluss, Universal-Abstrichtupfer mit blauem Verschluss. Materialentnahme und Transport: Gewebe, Punktat oder Biopsat ggf. in physiologischer Kochsalzlösung aufnehmen, bei Verdacht auf Aktinomykose keine Kochsalzlösung, sondern Ringerlösung verwenden, Transportmodus 1. 5 Probengefäße: Universal-Probenröhrchen mit blauem Verschluss. 6 Lagerung und Transport : Die Untersuchungsproben müssen innerhalb von 2 h ins Labor gebracht werden, da jede Art der Lagerung die Ausbeute verringert. Falls dies nicht möglich ist, können die Proben bei 4°C gelagert werden. Dabei muss man sich aber im Klaren sein, dass empfindliche Keime bei einer Lagerung bei 4°C absterben. Daher sollten flüssige Untersuchungsmaterialien bei längerem Transport in Blutkulturflaschen verimpft werden. Transportmodus 1: Der Transport erfolgt in sterilen leeren Gefäßen (Universal-Röhrchen mit blauem Schraubverschluss), ggf. mit Zusatz von wenig physiologischer Kochsalzlösung, um ein Austrocknen der Proben zu vermeiden. Diese Aufbewahrungsart erfordert einen sofortigen Transport, eine Lagerung ist nicht erlaubt! Transportmodus 2: Diese Aufbewahrungsart erfordert sofortigen Transport, eine Lagerung ist nicht erlaubt! Falls dies nicht möglich ist, müssen flüssige Untersuchungsmaterialien in Blutkulturflaschen verimpft werden. Transportmodus 3: Der Transport erfolgt in Medien für anspruchsvoll wachsende Keime oder für Anaerobier (Thioglykolatlösung) oder in Abstrichtupfern mit Transportmedium (Abstrichtupfer mit blauer Kappe). Diese Aufbewahrungsart erlaubt eine Transportzeit von mehr als 2 h, maximal 24 h bei 4°C; Anaerobier müssen bei Zimmertemperatur aufbewahrt werden. Seite 71 von 281 7 Fehler bei der Materialgewinnung und dem Materialtransport: - Kontamination mit Begleitkeimen aus der Umgebung der Wunde - Gewinnung von zu wenig Material - Absterben empfindlicher Keime am trockenen Tupfer - Entnahme unter antibiotischer Therapie - zu lange Lagerungs- oder Transportzeiten - bei zu kühler Lagerung: Absterben sensibler Keime - bei Lagerung in der Wärme: Überwucherung durch schnellwachsende Mikroorganismen. 8 Dauer der Untersuchung: Bei der Untersuchung auf aerobe Bakterien wird ein negativer Befund nach 3 Tagen, bei der Untersuchung auf anaerobe Bakterien und Pilze nach 7 Tagen erstellt. 9 Interpretation: Bei exakter Abnahme der Untersuchungsmaterialien ist das Risiko der Kontamination durch die Normalflora der Haut bzw. der Schleimhäute gering, so dass die isolierten Erreger als relevant zu betrachten sind. 10 Infektionen mit seltenen Erregern: Aeromonas hydrophila (nach Kontakt mit Brackwasser) Bacillus anthracis (Anthrax) Bartonella spp. (Kratzwunden durch Katzen) Capnocytophaga canimorsus (bei Hundebissen) Corynebacterium diphtheriae (Hautdiphtherie) Erysipelothrix rhusiopathiae (Schweinerotlauf) Francisella tularensis (Tularämie) Mycobacterium marinum ( v. a. in Aquarien) Mycobacterium tuberculosis und MOTT Sporothrix schenckii (Hautwunden bei Gärtnern, Landwirten, Baumschulen, v. a. in den Tropen und Subtropen, selten in Mittelmeerländern) Vibrio vulnificus (nach Kontakt mit Salzwasser) Seite 72 von 281 Tabelle 7: Erregerspektrum bei Infektionen der Haut und der Weichgewebe (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Infektionen der Haut und Weichgewebe Erysipel Streptokokken der Gruppen A-G Abstrich Staphylococcus aureus Abstrich Biopsie --- + 0 0 0 „ --- + 0 0 0 N --- 0 0 + 0 aerobes TM Erythema migrans/chronicum Borrelia burgdorferi, B. garinii, B. afzelii Serum + Folliculitis Staphylococcus aureus Abstrich aerobes TM --- + 0 0 0 Abstrich aerobes TM --- + 0 0 0 Staphylococcus aureus Abstrich aerobes TM --- + 0 0 0 Streptokokken der Gruppe A Abstrich aerobes TM --- + 0 0 0 + 0 0 0 + 0 0 0 + 0 0 0 0 0 0 Furunkel/Karbunkel Staphylococcus aureus Impetigo und Ecthyma Myositis Staphylococcus aureus Punktat, Biopsie N Streptococcus spp. Punktat, Biopsie N Clostridium perfringens Punktat, Biopsie N ++ Nekrotisierende Fasciitis Streptokokken der Gruppe A Abstrich aerobes TM + Panaritium Streptococcus pyogenes Sekret, Abstrich aerob. TM + 0 0 0 Staphylococcus aureus Sekret, Abstrich aerob. TM + 0 0 0 ________________________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Zuordnung möglich, +++ = Nachweis von Mikroorganismen, gattungsspezifische Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, * = langsames Wachstum, Anaerobier Seite 73 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Zellulitis/Phlegmone häufige Erreger: Streptokokken der Gruppe A Biopsie N + + 0 0 0 Staphylococcus aureus Biopsie N + + 0 0 0 Haemophilus influenzae Biopsie N + 0 0 0 Enterobacteriaceae Biopsie N + 0 0 0 Clostridium spp. Biopsie N ++ + 0 0 0 Bacillus anthracis Biopsie N ++ + 0 0 0 Pasteurella multocida Biopsie N + 0 0 0 Erysipelothrix spp. Biopsie N + 0 0 0 Aeromonas hydrophila Biopsie N + 0 0 0 Vibrio vulnificus Biopsie N + 0 0 0 *Mycobacterium spp. Biopsie N + 0 + 0 Staphylococcus aureus Abstrich aerobes TM + 0 0 0 Enterobacteriaceae Abstrich „ + 0 0 0 Clostridium spp. Abstrich „ + 0 0 0 + 0 0 0 seltene Erreger: ++ Wundinfektionen nach Trauma + Chronisch, ulzerierend bei Diabetes, AVK S. aureus Abstrich Clostridium spp. Abstrich „ + 0 0 0 Enterobacteriaceae Abstrich „ + 0 0 0 Pseudomonas aeruginosa Abstrich „ + 0 0 0 Aeromonas hydrophila (Brackwasser) Abstrich N + 0 0 0 Mycobacterium marinum (Aquarium) Biopsie N + 0 0 0 Vibrio vulnificus (Salzwasser) Abstrich N + 0 0 0 aerobes TM + nach Kontakt mit Wasser + _________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, * = langsames Wachstum, Anaerobier Seite 74 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren ---------------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Postoperative Wundinfektionen Staphylococcus aureus Abstrich Streptococcus pyogenes Abstrich Enterococcus spp. + 0 0 0 „ + 0 0 0 Abstrich „ + 0 0 0 Enterobacteriaceae Abstrich „ + 0 0 0 Anaerobier Abstrich „ + 0 0 0 Staphylococcus aureus Abstrich aerobes TM + 0 0 0 Pseudomonas aeruginosa Abstrich “ + 0 0 0 Enterobacteriaceae, bes. Proteus Abstrich “ + 0 0 0 Candida albicans Abstrich “ + 0 0 0 + 0 0 0 aerobes TM Verbrennungswunden ++ Bisswunden Menschenbisse Staphylococcus aureus Abstrich, Sekret Streptococcus pyogenes Abstrich, Sekret „ + 0 0 0 Eikenella corrodens Abstrich, Sekret „ + 0 0 0 Haemophilus influenzae Abstrich, Sekret „ + 0 0 0 Anaerobier Abstrich, Sekret „ + 0 0 0 aerobes TM Prevotella, Porphyromonas, Fusobacterium, Peptostreptokokken Tierbisse Pasteurella multocida Abstrich, Sekret aerobes TM + 0 0 0 Pasteurella spp. Abstrich, Sekret „ + 0 0 0 Staphylococcus intermedius Abstrich, Sekret „ + 0 0 0 Staphylococcus aureus Abstrich, Sekret „ + 0 0 0 Hämolysierende Streptokokken Abstrich, Sekret „ + 0 0 0 Eikenella corrodens Abstrich, Sekret „ + 0 0 0 Capnocytophaga spp. Abstrich, Sekret „ + 0 0 0 Anaerobier Abstrich, Sekret „ + 0 0 0 __________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, K = Antikörpernachweis, * = langsames Wachstum, Anaerobier Seite 75 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren ---------------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Mykosen Tinea Trichophyton rubrum Hautgeschabsel 0 + + 0 0 0 infizierte Haare 0 + + 0 0 0 Trichophyton rubrum Nagelspäne 0 + + 0 0 0 Trichophyton mentagrophytes Nagelspäne 0 + + 0 0 0 Candida albicans Nagelspäne 0 + + 0 0 0 Geotrichum candidum Nagelspäne 0 + + 0 0 0 Acremonium spp. Nagelspäne 0 + + 0 0 0 Scopulariopsis brevicaulis Nagelspäne 0 + + 0 0 0 Escherichia coli Punktat N + 0 0 0 Bacteroides spp. Punktat N + 0 0 0 Enterococcus spp. Punktat N + 0 0 0 Favus Trichophyton schoenleinii (Afrika, Mittelmeerraum) Nagelmykosen Abszesse Abdomen, Divertikulitis Peptostreptococcus spp. Punktat N Clostridium spp. Punktat N Proteus spp. Punktat N Fusobacterium spp. Punktat N Klebsiella spp. Punktat Pseudomonas spp. + 0 0 0 + 0 0 0 + 0 0 0 + 0 0 0 N + 0 0 0 Punktat N + 0 0 0 Staphylococcus spp. Punktat N + 0 0 0 Eubacterium spp. Punktat N + 0 0 0 Streptococcus spp. Punktat N + 0 0 0 Streptokokken der Gruppe A Punktat N + 0 0 0 Erysipelothrix rhusiopathiae Biopsie, Blut N + 0 0 0 ++ ++ (berufliche Exposition, z. B. Metzger) __________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, K = Antikörpernachweis, * = langsames Wachstum, Anaerobier Seite 76 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren ---------------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Haut Staphylococcus aureus Punktat N + 0 0 0 Propionibacterium spp. Punktat N + 0 0 0 Peptostreptococcus spp. Punktat N + 0 0 0 0 +++ 0 0 0 + 0 +++ 0 0 0 + Leishmania tropica-Komplex Punktat, Biopsie (Indien, Afghanistan, Türkei) (am Wundrand) Leishmania brasiliensis-Komplex Punktat, Biopsie (Zentralamerika, Südamerika) (am Wundrand) Leber Escherichia coli Punktat N + 0 0 0 Streptococcus spp. Punktat N + 0 0 0 Peptostreptococcus spp. Punktat N + 0 0 0 Fusobacterium spp. Punktat N + 0 0 0 Bacteroides spp. Punktat N + 0 0 0 Entamoeba histolytica Punktat N 0 0 0 0 ++ +++ Serum Leishmania donovani Punktat + N +++ 0 0 0 Serum 0 0 Mikrosporidien Punktat N +++ 0 0 0 0 Actinomyces spp. Punktat N ++ + 0 0 0 Staphylococcus aureus Punktat N + 0 0 0 Salmonella spp. Punktat N + 0 0 + Escherichia coli Punktat N + 0 0 0 Enterococcus Punktat N + 0 0 0 Streptococcus spp. Punktat N + 0 0 0 Klebsiella spp. Punktat N + 0 0 0 Proteus spp. Punktat N + 0 0 0 Pseudomonas spp. Punktat N + 0 0 0 Milz Shigella spp. Punktat N + 0 0 0 Bacteroides spp. Punktat N + 0 0 0 ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium, P = Port-A-Cul-Medium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum Seite 77 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren ---------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Milz Propionibacterium spp. Punktat N Clostridium spp. Punktat N Fusobacterium spp. Punktat Candida spp. + 0 0 0 + + 0 0 0 N ++ + 0 0 0 Punktat N ++ + 0 + 0 Aspergillus spp. Punktat N ++ + 0 + 0 Leishmanien Punktat N +++ 0 0 0 0 Serum *Blastomyces dermatitidis (!) Punktat, Biopsie + N +++ + 0 0 Serum Mikrosporidien 0 + Punktat, Biopsie N Staphylococcus aureus Punktat Propionibacterium spp. Punktat Peptostreptococcus spp. +++ 0 0 0 0 N + 0 0 0 N + 0 0 0 Punktat N + 0 0 0 Streptococcus spp. Punktat N + 0 0 0 Bacteroides spp. Punktat N + 0 0 0 *Mycobacterium tuberculosis (!) Punktat N + 0 + 0 *Brucella spp. (!) Punktat N + 0 0 + Francisella tularensis (!) Punktat Speziallabor Treponema pallidum Punktat N 0 0 0 0 + Echinococcus spp. Punktat N + 0 0 0 0 Perianal, vulvovaginal, Scrotum Granulome/Lebergranulome + Serum Schistosoma spp. Punktat + N + 0 0 0 Serum *Histoplasma capsulatum (!) Punktat + N + + 0 0 Serum *Coccidioides immitis (!) Punktat Punktat 0 + N + + 0 0 Serum Coxiella burnetii 0 0 + N Serum 0 0 0 + 0 + ________________________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Zuordnung möglich, +++ = Nachweis von Mikroorganismen, gattungsspezifische Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum Seite 78 von 281 Knochen und Gelenke --------------------------------------------------------------------------------------------------------------------------- 1 Septische Arthritis --------------------------------------------------------------------------------------------------------------------------Die septische Arthritis ist ein eine akute, bakterielle Infektion der Gelenke. Die Erreger gelangen hämatogen oder von außen in die Gelenke. 1.1 Erregerspektrum: siehe Tabelle 8. 1.2 Indikation für die mikrobiologische Untersuchung: Alle Infektionen der Knochen und Gelenke müssen durch eine mikrobiologische Untersuchung abgeklärt werden. 1.3 Untersuchungsmethode: Kulturelle Anzucht und Resistenzbestimmung der Isolate, universelle PCR. 1.4 Untersuchungsmaterial: Intraoperative Untersuchungsmaterialien, Sekrete, Punktate, (Abstriche sind weniger geeignet), Blutkulturen bei Fieber. 1.5 Probengefäße: Universalröhrchen mit blauem Verschluss, Weithalsgefäß mit Thioglykolatbouillon für intraoperativ gewonnene Materialien der Orthopädie, ggf. Blutkulturflaschen. 1.6 - Materialentnahme: Desinfektion der Einstichstelle mit 70%-igem Alkohol (Einwirkzeit 3 min, allenfalls orientierend bis zum Trocknen des Alkohols) - streng aseptisches Vorgehen wie bei der Blutkulturentnahme (Händedesinfektion des Arztes, Einmalhandschuhe, Mundschutz). 1.7 Untersuchungsvolumen: Da in den meisten Fällen nicht mit einer hohen Keimzahl im Gelenkpunktaten etc. zu rechnen ist, sollten möglichst große Mengen an Untersuchungsmaterial entnommen und eingesandt werden. 1.8 Lagerung und Transport: ≤ 2 h nach Abnahme bei RT, ist dies nicht möglich, Verimpfen in Transportmedium für anspruchsvoll wachsende Mikroorganismen (Thioglykolatbouillon) oder in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT. Seite 79 von 281 1.9 Dauer der Untersuchung: Ein negativer Befund wird für aerobe Bakterien nach 3 Tagen erstellt. Bei der Untersuchung auf anaerobe Bakterien wird ein negativer Befund nach 10 - 14 Tagen erstellt. 1.10 Interpretation: Bei exakter Abnahme der Untersuchungsmaterialien ist das Risiko der Kontamination durch die Normalflora der Haut bzw. der Schleimhäute gering, so dass die isolierten Erreger als relevant zu betrachten sind. --------------------------------------------------------------------------------------------------------------------------- 2 Infektreaktive Arthritis --------------------------------------------------------------------------------------------------------------------------Sie ist eine entzündliche Gelenkerkrankung, die als Komplikation nach einer bakteriellen Infektion auftreten kann. Die häufigsten Infektionen treten nach einer Darminfektion (postenteritische Arthritis) oder nach einer Infektion des Urogenitaltraktes (posturethritische Arthritis) auf. In der Regel sind die großen Gelenke betroffen, insbesondere das Kniegelenk. Im Gelenk lassen sich keine Erreger (Erregerspektrum siehe Tabelle 7) anzüchten. Die Diagnose erfolgt serologisch. --------------------------------------------------------------------------------------------------------------------------- 3 Osteomyelitis --------------------------------------------------------------------------------------------------------------------------3.1 Erregerspektrum: Siehe Tabelle 8. 3.2 Untersuchungsmethode: - Kulturelle Anzucht und Resistenzbestimmung der Isolate - universelle PCR bei Proben aus sterilen Kompartimenten. 3.3 Untersuchungsmaterial: Intraoperative Gewebeproben, Sekrete, Punktate, (Abstriche sind weniger geeignet), Blutkulturen bei Osteomyelitis oder Diszitis. 3.4 Probengefäße: Universalröhrchen mit blauem Verschluss, Weithalsgefäß mit Thioglykolatbouillon für intraoperativ gewonnene Materialien der Orthopädie, ggf. Blutkulturflaschen 3.5 - Materialentnahme: Desinfektion der Einstichstelle mit 70%-igem Alkohol (Einwirkzeit 3 min, allenfalls orientierend bis zum Trocknen des Alkohols) Seite 80 von 281 - streng aseptisches Vorgehen wie bei der Blutkulturentnahme (Händedesinfektion des Arztes, Einmalhandschuhe, Mundschutz). 3.6 Untersuchungsvolumen: Da in den meisten Fällen nicht mit einer hohen Keimzahl im Gelenkpunktaten etc. zu rechnen ist, sollten möglichst große Mengen an Untersuchungsmaterial entnommen und eingesandt werden. 3.7 Lagerung und Transport: Der Transport sollte so schnell wie möglich, am besten ≤ 2 h nach Abnahme erfolgen. Ist dies nicht möglich, sollte entweder ein Transportmedium für anspruchsvoll wachsende Mikroorganismen verwendet werden (Thioglykolatbouillon) oder eine Verimpfung der Materialien in Blutkulturflaschen erfolgen. Dennoch sollte die Transportdauer 24 h nicht überschreiten. Die Proben müssen bei Raumtemperatur gelagert werden. 3.8 Dauer der Untersuchung: Bei der Untersuchung auf aerobe Bakterien wird ein negativer Befund nach 3 Tagen erstellt. Bei der Untersuchung auf anaerobe Bakterien wird ein negativer Befund nach 10 – 14 Tagen erstellt. 3.9 Interpretation: Bei exakter Abnahme der Untersuchungsmaterialien ist das Risiko der Kontamination durch die Normalflora der Haut bzw. der Schleimhäute gering, so dass die isolierten Erreger als relevant zu betrachten sind. Seite 81 von 281 Tabelle 8: Erregerspektrum bei Infektionen der Knochen und Gelenke (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Septische Arthritis Häufige Erreger Staphylococcus aureus Punktat N + + 0 0 0 Streptokokken der Gruppe A Punktat N + + 0 0 + Streptococcus pneumoniae Punktat N + + 0 0 0 Enterococcus spp. Punktat N + + 0 0 0 Enterobacteriaceae Punktat N + + 0 0 0 Pseudomonas aeruginosa Punktat N + + 0 0 0 Neisseria gonorrhoeae Punktat D/N ++ + 0 0 0 *Brucella spp. (!) Punktat N + + 0 0 + Salmonella spp. Punktat N + + + 0 + *Mycobacterium spp. (!) Punktat N ++ + 0 + 0 Y. enterocolitica Serum/Stuhl --- 0 + 0 0 + Salmonella spp. Serum/Stuhl --- 0 + 0 0 + Shigella spp. Serum/Stuhl --- 0 + 0 0 + Campylobacter spp. Serum/Stuhl --- 0 + 0 0 + Chlamydia trachomatis Serum --- 0 0 0 (+) + Mycoplasma pneumoniae Serum --- 0 0 0 (+) + Ureaplasma urealyticum Serum --- 0 0 0 (+) + bei Immunsuppression Seltene Erreger Infektreaktive Arthritis Postenteritisch Posturethritisch ________________________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum Seite 82 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Osteomyelitis bei Erwachsenen Staphylococcus aureus Punktat N + + 0 0 0 Streptokokken der Gruppe A Punktat N + + 0 0 + Salmonella spp. Punktat N + + 0 0 0 Candida spp. Punktat N ++ + + 0 0 Pseudomonas aeruginosa/spp. Punktat N + + 0 0 0 Punktat N + + 0 0 0 Streptococcus spp. Punktat N + + 0 0 0 Propionibacterium spp. Punktat N + + 0 0 0 Enterobacteriaceae Punktat N + + 0 0 0 Pseudomonas spp. Punktat N + + 0 0 0 Staphylococcus spp. Punktat N + + 0 0 0 Anaerobier Punktat N + + 0 0 0 Mycobacterium tuberculosis Punktat N + + 0 + 0 Nicht tuberkulöse Mykobakterien Punktat N + + 0 + 0 0 + + Punktat/Blut N + + 0 + 0 S. epidermidis-Gruppe Punktat, Gewebe N + + 0 0 0 S. aureus Punktat, Gewebe N + + 0 0 0 B-Streptokokken Punktat, Gewebe N + + 0 0 0 Enterobacteriaceae Punktat, Gewebe N + + 0 0 0 Anaerobier Punktat, Gewebe N + + 0 0 0 Punktat, Gewebe N + + 0 0 0 bei Kindern Haemophilus influenzae nach Trauma Seltene Erreger Brucella spp. Punktat/Blut N Actinomyces spp. + + Protheseninfektionen (Propionibacterium, Peptostreptokokken) Enterokokken ________________________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum Seite 83 von 281 Infektionen der Harnwege --------------------------------------------------------------------------------------------------------------------------- 1 Zystitis, Pyelonephritis --------------------------------------------------------------------------------------------------------------------------1.1 Erregerspektrum: siehe Tabelle 9. 1.2 Indikation für die mikrobiologische Untersuchung (Urinuntersuchung): Immunsuppression, vor und nach Intervention an den Harnwegen, in der Schwangerschaft, bei Diabetikern, bei neurogenen Harnblasenentleerungsstörungen, bei Fieber, Durchfall, Erbrechen oder unklarer Gedeihstörung beim Säugling, bei unklaren abdominellen Schmerzen oder Flankenschmerzen. Bei asymptomatischen Patienten nach vorausgegangener Bakteriurie, während der Schwangerschaft, bei laborchemischem Verdacht auf eine Harnwegsinfektion (z. B. Hämaturie oder positiver Nitrit-Test) sowie nach Beendigung der antibiotischen Therapie eines komplizierten Harnwegsinfektes. Bei symptomatischen Patienten bei Anzeichen einer Harnwegsinfektion bei stationärem Aufenthalt, bei Fortbestehen der Symptome unter antibiotischer Therapie, bei Fieber oder Sepsis unklarer Genese und bei prädisponierenden Faktoren. 1.3 Untersuchungsmethode: Kulturelle Anzucht und Resistenzbestimmung der Isolate. 1.4 Probengefäße: Universal-Probenröhrchen, konisch mit rotem Verschluss, Urin-Eintauch-Nährmedium (Uricult). 1.5 Untersuchungsmaterial: Am besten geeignet zur Untersuchung ist der Morgenurin. Im Idealfall sollte zwischen der Gewinnung der Urinprobe und der letzten Miktion mindestens 3 h liegen. Bei einer vorliegenden Pollakisurie ist dies allerdings nicht möglich. Die Urinentnahme sollte vor Beginn einer antibiotischen Therapie erfolgen. Bei positivem Hemmstofftest (Nachweis von antibiotischer Aktivität im Urin) muss die Urinuntersuchung nach Absetzen der Antibiotika wiederholt werden. Bei der Therapie mit Chinolonen oder Aminoglykosiden ist ein therapiefreies Intervall von 5 Tagen, bei den übrigen Antibiotika von 3 Tagen einzuhalten. 1.5.1 Mittelstrahlurin (MSU) Mittel der Wahl für die Uringewinnung ist die Gewinnung von Mittelstrahlurin (MSU), da es dabei zu keiner Beeinträchtigung der Patienten kommt. Bei Kindern wird die Gewinnung von MSU etwa ab dem 4. Lebensjahr empfohlen, wenn keine Balanitis oder Vulvitis vorliegt. Bei den Fällen, bei denen keine eindeutigen Befunde mittels MSU-Proben zu gewinnen sind oder die Gewinnung von MSU nicht möglich ist sowie bei Kindern unter 3 Jahren, müssen andere Verfahren angewandt werden (siehe Kapitel IV: Untersuchungsmaterial - Harnwege). Seite 84 von 281 1.5.2 Katheterurin (Einmalkatheter) Eine transurethrale Katheterisierung kann routinemäßig nicht empfohlen werden. Wegen der Gefahr der Keimeinschleppung sollte sie bei Männern oder Jungen zur diagnostischen Uringewinnung gar nicht und bei Frauen oder Mädchen nur in Ausnahmefällen durchgeführt werden, z. B. wenn eine MSU-Gewinnung oder eine Blasenpunktion nicht möglich sind (siehe Kapitel IV: Untersuchungsmaterial - Harnwege). 1.5.3 Dauerkatheterurin Um eine Einschleppung von Mikroorganismen in das System zu vermeiden, erfordert die Probenentnahme eine exakte Entnahmetechnik (siehe Kapitel IV: Untersuchungsmaterial Harnwege). 1.5.4 Blasenpunktionsurin Durch suprapubische Aspiration von Blasenurin ist eine Kontamination der Probe nahezu ausgeschlossen. Voraussetzung ist eine gut gefüllte Harnblase (ggf. sonographische Kontrolle) (siehe Kapitel IV: Untersuchungsmaterial - Harnwege). 1.5.5 Beutelurin bei Säuglingen Bei Säuglingen und Kleinkindern erfolgt die Gewinnung des Spontanurins mit Hilfe eines Beutels (Beutelurin). In diesem Fall werden die Genitalien wie oben beschrieben gereinigt; danach wird ein selbstklebender Urinbeutel befestigt. Idealerweise sollte dann bei reichlicher Flüssigkeitszufuhr die Miktion abgewartet und danach der Beutel entfernt werden. Diese Methode gilt allerdings nur als orientierende Untersuchung. Jeder positive Befund muss z. B. durch eine Blasenpunktion überprüft werden. 1.5.6 Erststrahlurin Gewinnung des Urins am Morgen vor dem Wasserlassen. Bei V. a. eine Tuberkulose ist Erststrahlurin dem Mittelstrahlurin vorzuziehen (mindestens 30 ml), da sich die Erreger über Nacht im Urin sammeln. Bei einer Leukozyturie ohne signifikante Bakteriurie ist an eine Tuberkulose zu denken (siehe Kapitel IV: Untersuchungsmaterial - Harnwege). 1.6 Urinmenge. V. a. Zystitis 5 ml Tuberkulose 30 – 50 ml Schistosoma haematobium ca. 400 ml früher Nachmittagsurin (Zeitpunkt höchster Eiausscheidung) 1.7 Lagerung und Transport: Nativurin ≤ 2 h nach Abnahme; ist dies nicht möglich, Lagerung bis zu 24 h bei 4°C. Vorteile von Nativurin Seite 85 von 281 - Möglichkeit der makroskopischen und mikroskopischen Beurteilung - Möglichkeit der Untersuchung auf antimikrobielle Substanzen (Hemmstofftest) Nachteile von Nativurin Bei längeren Transportwegen bzw. längerer Aufbewahrung der Proben in ungekühltem Zustand ist die Keimzahl nicht mehr exakt. Urineintauchkulturen Bei der Abnahme ist darauf zu achten, dass das Röhrchen gleichmäßig benetzt ist und keine Restflüssigkeit enthält, da diese durch wiederholte Benetzung der Kulturoberfläche während des Transports fälschlicherweise zu erhöhten Keimzahlen führen kann. Die Proben können bei 37°C im Brutschrank bebrütet werden. Bei Keimwachstum Transport ins Labor, die Transportdauer von 24 h sollte aber nicht überschritten werden. Vorteile der Urineintauchkultur - Exakte Keimzahlbestimmung zum Zeitpunkt der Urinabnahme - Alternative bei Verzögerung von Transport und Bearbeitung Nachteile der Urineintauchkultur - makroskopische und mikroskopische Beurteilung ist nicht möglich - Untersuchung auf antimikrobielle Substanzen ist nicht möglich → falsch negative Befunde 1.8 - Keimzahlbestimmung bei konfluierenden Kolonien ist nicht zulässig - Mischkulturen können nur schwer erkannt werden - anspruchsvoll wachsende Keime werden nicht von allen Nährmedien erfasst. Dauer der Untersuchung: Ein negativer Befund wird nach 24 - 48 h erstellt. 1.9 Interpretation: Urin ist eine sterile Flüssigkeit. Da die vordere Harnröhre physiologisch mit Bakterien besiedelt ist, kann dies bei der Gewinnung des Urins zu einer klinisch unbedeutenden Kontamination führen. Zu den häufigsten Kontaminanten gehören: koagulasenegative Staphylokokken, Streptokokken der Viridans-Gruppe, Enterokokken, Korynebakterien, Propionibakterien. Diagnostisch bedeutend ist daher die Abgrenzung einer Kontamination von pathogenen Infektionserregern. Zeichen einer Kontamination sind niedrige Keimzahlen, Mischkulturen, unterschiedliche Keime in seriellen Proben oder Keime, die gewöhnlich nicht mit einer Infektion der Harnwege assoziiert sind. Bei komplizierten Harnwegsinfektionen ist die Anzüchtung mehrerer Erreger aber nicht ungewöhnlich. Da Patienten mit einem Harnwegsinfekt deutlich höhere Keimzahlen im Urin aufweisen, muss das Ausmaß der Bakteriurie ermittelt werden, d. h. die Urinuntersuchung muss quantitativ erfolgen. In Abhängigkeit von der Uringewinnung sind unterschiedliche Keimzahlen beweisend für eine Infektion der Harnwege: Seite 86 von 281 Interpretation der Urinkulturen ________________________________________________________________________________ Uringewinnung Kontamination Verdacht auf Harnwegsinfekt Harnwegsinfekt ________________________________________________________________________________ MSU < 10 000 KBE/ml 10 000 – 100 000 KBE/ml > 100 000 KBE/ml Katheterurin < 1 000 KBE/ML 1 000 – 10 000 KBE/ml > 10 000 KBE/ml Blasenpunktat jeder Keimnachweis ________________________________________________________________________________ Unter antibiotischer Therapie und bei erhöhter Diurese sind die Keimzahlen niedrig, auch wenn eine Infektion vorliegt. Bei einer Leukozyturie ohne Bakteriurie ist an eine Urethritis oder eine Infektion durch einen seltenen Erreger zu denken. Diagnostisches Vorgehen bei V. a. eine Infektion der Harnwege _________________________________________________________________________________ Klinischer Verdacht auf Harnwegsinfektion ↓ Abnahme von Mittelstrahlurin ↓ Beginn einer kalkulierten Antibiotikatherapie ---------------------------------------------------------------------------------------------------------------------------------------Positiver Erregernachweis Negativer Erregernachweis Gezielte Therapie nach Befundmitteilung weiterhin kalkulierte Therapie ↓ Gutes Ansprechen auf die Therapie ↓ Keine Kontrolluntersuchung ↓ Keine Besserung ↓ Wiederholung der Untersuchung ↓ Untersuchung auf „atypische“ Erreger ↓ ggf. Urethritis-Diagnostik Rezidiv nach initial gutem Ansprechen ↓ Erneute Urinuntersuchung __________________________________________________________________________ Seite 87 von 281 Tabelle 9: Keimspektrum bei Infektionen der Harnwege (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) Infektionen der Harnwege __________________________________________________________________________ Material Angewandte Nachweisverfahren -----------------------------------TM Kultur AG PCR AK __________________________________________________________________________ Zystitis akut, unkompliziert Escherichia coli Urin 0 + 0 0 0 Enterococcus faecalis Urin 0 + 0 0 0 Staphylococcus saprophyticus Urin 0 + 0 0 0 Proteus mirabilis Urin 0 + 0 0 0 Klebsiella spp. Urin 0 + 0 0 0 Escherichia coli Urin 0 + 0 0 0 Proteus mirabilis Urin 0 + 0 0 0 Proteus vulgaris Urin 0 + 0 0 0 Morganella morganii Urin 0 + 0 0 0 Providencia spp. Urin 0 + 0 0 0 Klebsiella spp. Urin 0 + 0 0 0 Pseudomonas aeruginosa Urin 0 + 0 0 0 Enterococcus faecalis Urin 0 + 0 0 0 Corynebacterium urealyticum Urin 0 + 0 0 0 Candida spp. Urin 0 + 0 0 0 Staphylococcus aureus Urin 0 + 0 0 0 Escherichia coli Urin 0 + 0 0 0 Enterobacteriaceae Urin 0 + 0 0 0 Mycoplasma hominis Urin 0 + 0 0 0 Punktat N + 0 0 0 nosokomial oder kompliziert Pyelonephritis Nierenabszesse Kortikal Staphylococcus aureus + __________________________________________________________________________ TM = Transportmedium, Nativmaterial (Transport < 2 h), Mikr = Mikroskopie Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier Seite 88 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren --------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Kortikomedullär Escherichia coli Punktat N + + 0 0 0 Klebsiella spp. Punktat N + + 0 0 0 Proteus spp. Punktat N + + 0 0 0 Staphylococcus aureus Punktat N + + 0 0 0 Escherichia coli Punktat N + + 0 0 0 Proteus spp. Punktat N + + 0 0 0 Klebsiella spp. Punktat N + + 0 0 0 Pseudomonas aeruginosa Punktat N + + 0 0 0 Streptococcus spp. Punktat N + + 0 0 0 Enterococcus faecalis Punktat N + + 0 0 0 *Mycobacterium spp. (!) Punktat N ++ + 0 + 0 Bacteroides spp. Punktat N + + 0 0 0 Candida spp. Punktat N ++ + + 0 0 Perinephritisch __________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium, N = Nativmaterial (Transport < 2 h), Mikr = Mikroskopie Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum Seite 89 von 281 Urogenitale Infektionen --------------------------------------------------------------------------------------------------------------------------- 1 Urethritis --------------------------------------------------------------------------------------------------------------------------1.1 Erregerspektrum: Siehe Tabelle 10. 1.2 Indikation für die mikrobiologische Untersuchung: Therapieversagen, Rezidive, Komplikationen. 1.3 Untersuchungsmethode: - Kulturelle Anzucht und Resistenzbestimmung der Isolate - DNA-Nachweis mittels PCR zum Nachweis von Chlamydien. 1.4 Probengefäße Urinröhrchen, Universal-Abstrichröhrchen mit oranger (Chlamydien) oder blauer Kappe, UniversalProbenröhrchen mit blauem Verschluss, sterile Gefäße mit speziellen Transportmedien. 1.5 Untersuchungsmaterial, Lagerung und Transport: 3-Gläser-Probe nach Meares: 1. Erste Urinprobe (Gewinnung siehe Kapitel IV: Untersuchungsmaterial - Harnwege) (5 - 10 ml) 2. Mittelstrahlurin (Gewinnung siehe Kapitel IV: Untersuchungsmaterial - Harnwege (5 - 10 ml) 3. Urethralsekret bzw. Urethralabstrich (siehe Kapitel IV: Untersuchungsmaterial - Abstriche, Sekrete) Lagerung und Transport: Sekret: ≤ 2 h bei RT, ist das nicht möglich bis zu 24 h bei 4°C Abstrich: bis zu 24 h bei RT 1.6 Dauer der Untersuchung: Ein negativer Befund wird nach 3 Tagen erstellt. 1.7 Infektionen mit „atypischen“ Erregern: Zum Nachweis folgender Keime, müssen gesonderte Urethralabstriche abgenommen und in speziellen Transportmedien verschickt werden. Es müssen gesonderte Lagerungszeiten eingehalten werden: - Neisseria gonorrhoeae Ausstreichen auf Thayer-Martin-Agar oder Spezial-Agarplatte unmittelbar nach der Entnahme Transport ohne Transportmedium (TM) nicht möglich, Lagerung in TM bis zu 24 h bei RT - Chlamydia trachomatis (nativer Abstrich für LCX-PCR) Transport ohne TM ≤ 2 h bei RT, in TM Lagerung bis zu 24 h bei 4°C Seite 90 von 281 Mycoplasma hominis und Ureaplasma urealyticum - Transport in Transportmedium (TM) für anspruchsvoll wachsende Keime Transport ohne TM ≤ 2 h bei RT, falls das nicht möglich bis zu 24 h bei 4°C Gardnerella vaginalis und Anaerobier - Transport ohne TM ≤ 2 h bei RT, falls das nicht möglich, Lagerung bis 24 h bei RT Trichomonas vaginalis (Nativurin, erste Urinprobe) - Transport ≤ 2 h bei RT, Lagerung nicht möglich. --------------------------------------------------------------------------------------------------------------------------- 2 Prostatitis --------------------------------------------------------------------------------------------------------------------------2.1 Erregerspektrum: Leitkeim der akuten und chronischen Prostatitis ist Escherichia coli, gefolgt von anderen Enterobacteriaceae. Die Rolle von Chlamydia trachomatis und urogenitalen Mykoplasmen bei der chronisch bakteriellen Prostatitis ist umstritten. 2.2 Indikation für die mikrobiologische Untersuchung: Jede Prostatitis muss ätiologisch abgeklärt werden. 2.2 Untersuchungsmethode: - Kulturelle Anzucht und Resistenzbestimmung der Isolate - DNA-Nachweis mittels PCR für „atypische“ Erreger. 2.3 Probengefäße: Urinröhrchen, Universal-Probenröhrchen mit blauem Verschluss. 2.4 Untersuchungsmaterial: 2.4.1 4-Gläser-Probe nach Meares (klassisch oder vereinfacht) Klassische 4 - Gläser - Probe: 1. Erste Urinprobe (Gewinnung siehe Kapitel IV: Untersuchungsmaterial - Harnwege) (5 - 10 ml) 2. Mittelstrahlurin (Gewinnung siehe Kapitel IV: Untersuchungsmaterial - Harnwege (5 - 10 ml) 3. Urethralsekret bzw. Urethralabstrich (siehe Kapitel IV: Untersuchungsmaterial - Abstriche, Sekrete) Lagerung und Transport. Sekret: ≤ 2 h bei RT, ist das nicht möglich bis zu 24 h bei 4°C Abstrich: bis zu 24 h bei RT 4. Exprimaturin Lagerung und Transport: ≤ 2 h bei RT, dann bis zu 24 h bei 4°C. Seite 91 von 281 Vereinfachte 4 - Gläser – Probe: 1. Prostataexprimat Lagerung und Transport: ≤ 2 h bei RT, dann bis zu 24 h bei 4°C. 2. Exprimaturin Lagerung und Transport: s. o. 3. Ejakulat Lagerung und Transport: ≤ 2 h bei RT, eine längere Lagerung ist nicht möglich. Voraussetzung für die quantitative Untersuchung ist ein steriler Mittelstrahlurin (vorherige Überprüfung notwendig!). 2.4.2 Exprimaturin Materialentnahme: - Hygienische Händedesinfektion und Verwendung von Einmalhandschuhen - nach Reinigung der Harnröhrenmündung wird die Prostata vom Rektum aus massiert - das ausfließende Exprimat in sterilem Gefäß auffangen - den dann gelassenen Urin in einem sterilen Gefäß auffangen 2.4.2 Prostatasekret Materialentnahme: - Hygienische Händedesinfektion und Verwendung von Einmalhandschuhen - nach Reinigung der Harnröhrenmündung wird die Prostata vom Rektum aus massiert - das ausfließende Exprimat in sterilem Gefäß auffangen - bei kleinen Mengen das Sekret mit dem Abstrichtupfer aufnehmen und in Transportmedium einbringen Transport und Lagerung: Sekret: ≤ 2 h bei Raumtemperatur, ist das nicht möglich, bis zu 24 h bei 4°C, Ausnahmen wie bei Urethritis beschrieben. Urin: ≤ 2 h bei Raumtemperatur, ist das nicht möglich, bis zu 24 h bei 4°C. Dauer der Untersuchung: Ein Endbefund wird nach 5 Tagen erstellt. 2.5 Interpretation: Eine um den Faktor von mindestens 10 höhere Keimzahl in der Urinprobe nach der Prostatamassage spricht dafür, dass der Infektionserreger in der Prostata lokalisiert ist. Als einfache Screening-Untersuchung hat sich der Leukozyten-Nachweis mit einem Teststreifen im Urin vor und nach der Prostatamassage bewährt. Bei fehlender Leukozyturie spricht ein positiver Leukozyten-Nachweis im Exprimaturin für eine Prostatitis. Alternativ kann, da Prostataexprimaturin nur in kleinen Mengen zur Verfügung steht, Ejakulat zur Untersuchung eingeschickt werden. Seite 92 von 281 --------------------------------------------------------------------------------------------------------------------------- 3 Epididymitis --------------------------------------------------------------------------------------------------------------------------3.1 Erregerspektrum: siehe Tabelle 10. 3.2 Indikation für die mikrobiologische Untersuchung Jede Epididymitis sollte mikrobiologisch abgeklärt werden. 3.3 Untersuchungsmethoden: - Kulturelle Anzucht und Resistenzbestimmung der Isolate - DNA-Nachweis mittels PCR für den Nachweis „atypischer“ Erreger. 3.4 Probengefäße: Urinröhrchen, Universal-Probenröhrchen mit blauem Verschluss, Universal-Weithalsgefäße. 3.5 Untersuchungsmaterialien: Bei der Epididymitis gelingt der Erregernachweis trotz Einsatzes aller diagnostischen Mittel nur bei zwei Drittel der Patienten. Das diagnostische Vorgehen ergibt sich wie folgt: __________________________________________________________________ Krankheitsbild Untersuchungsmaterial __________________________________________________________________ Epididymitis Ejakulat, Urethralabstrich Epididymitis mit Harnwegsinfektion Mittelstrahlurin, Urethralabstrich Epididymitis mit Begleiturethritis 3-Gläser-Probe Epididymitis mit Begleitprostatitis 4-Gläser-Probe __________________________________________________________________ 3.6 Materialentnahme: Urin, Urethralabstrich, 3- und 4-Gläserprobe wie unter Urethritis beschrieben Ejakulat Materialentnahme: Hygienische Händedesinfektion durchführen und Einmalhandschuhe benutzen nach Reinigung der Genitalien mit Wasser und Seife Probe in einem sterilen Gefäß auffangen 3.7 Lagerung und Transport, ausgenommen Ejakulate Urethralabstriche und -sekrete: ≤ 2 h bei RT, ist das nicht möglich, bis zu 24 h bei 4°C Urin: ≤ 2 h bei Raumtemperatur, dann bis zu 24 h bei 4°C Ejakulat: ≤ 2 h bei RT, eine Lagerung ist nicht möglich. Seite 93 von 281 --------------------------------------------------------------------------------------------------------------------------- 4 Zervizitis --------------------------------------------------------------------------------------------------------------------------4.1 Erregerspektrum Siehe Tabelle 10. 4.2 Indikation für die mikrobiologische Untersuchung: Therapieversagen, rezidive, Komplikationen. 4.3 Untersuchungsmethode: Kulturelle Anzucht und Resistenzbestimmung der Isolate. 4.4 Probengefäße: Universal-Probenröhrchen mit blauem Verschluss, Universal-Abstrichtupfer mit blauer Kappe. 4.5 Materialentnahme des Zervikalabstrichs: Siehe Kapitel IV: Untersuchungsmaterial - Abstriche). Bei Verdacht auf Listeriose sollte das Zervikalsekret am Ende der Menses mit Abstrichtupfern entnommen und, wenn möglich, direkt auf Tryptose- und Blutagar ausgestrichen werden (Agar in der Mikrobiologie anfordern, Tel. 46918). Der Nachweis von Gonokokken und Chlamydien erfolgt wie bei Urethritis beschrieben. Transport und die Lagerung sind unter Urethritis beschrieben 4.6 Lagerung und Transport: ≤ 24 h bei RT; Ausnahmen wie bei Urethritis beschrieben. Seite 94 von 281 --------------------------------------------------------------------------------------------------------------------------- 5 Endometritis und Salpingitis --------------------------------------------------------------------------------------------------------------------------Wegen der Kontaminationsmöglichkeit lassen Zervikalabstriche nur ungenaue Rückschlüsse auf das Keimspektrum einer Endometritis zu. Zur Untersuchung ist am besten ein intraoperativ oder bei einer Abrasio entnommenes Material geeignet. Der Transport und die Lagerungen erfolgen innerhalb von 24 h bei RT. Die postpartale Endometritis ist eine Infektion, die in zwei klinischen Verlaufsformen beobachtet wird, und die fast immer fieberhaft verläuft (>38°C). Die Frühform tritt 48 h nach der Entbindung ein und ist assoziiert mit einer bakteriellen Vaginose, einer Sectio oder einem Amnioninfektionssyndrom. Die Spätform (>48 h) ist die Folge einer aszendierenden Infektion. Erkrankungen sind auch noch 6 Wochen nach der Entbindung möglich. Erregerspektrum siehe Tabelle 10. --------------------------------------------------------------------------------------------------------------------------- 6 Bartholinitis --------------------------------------------------------------------------------------------------------------------------Als Untersuchungsmaterial eignet sich durch den Ausführungsgang entnommenes Exsudat. Bei Abszessen sollten möglichst Punktate vor der Abszessspaltung gewonnen werden. Die Materialien müssen in Transportmedium innerhalb von 24 h bei RT verschickt bzw. gelagert werden. --------------------------------------------------------------------------------------------------------------------------- 7 Bakterielle Vaginose (BV) --------------------------------------------------------------------------------------------------------------------------Bei der BV ist die normale Standortflora der Vagina unterdrückt. Aufgrund der Alkalisierung des pHWertes wird das Wachstum von Gardnerella vaginalis und anaeroben Bakterien gefördert. 7.1 Erregerspektrum: Siehe Tabelle 10. 7.2 Mikrobiologische Diagnostik: Die Diagnose der BV erfolgt in der Praxis anhand der sog. Spiegel-Kriterien, von denen mindestens drei positiv sein müssen: - typischer grau-weißer, homogener Ausfluss - vaginaler pH-Wert > 4,5 - positiver Amintest: Geruchsverstärkung (typischer Fischgeruch) bei Zugabe von 10%iger KOHLösung zum Fluor - mikroskopischer Nachweis von Schlüsselzellen (clue cells, vaginale Epithelzellen mit massenhaft Bakterien besetzt). Seite 95 von 281 7.3 Untersuchungsmethode: Mikroskopie, kulturelle Anzucht und Resistenzbestimmung der Isolate 7.4 Probengefäße: Universal-Abstrichtupfer mit blauer Kappe. 7.5 Untersuchungsmaterial: Vaginalsekret, Vaginalabstriche 7.6 Materialentnahme: Siehe Kapitel IV: Untersuchungsmaterial - Abstriche Objektträgerbeschickung 7.7 - die Probe sofort nach der Entnahme auf einen sterilen Objektträger aufbringen - Präparat lufttrocknen lassen - Versand in einem bruchsicheren Plastikbehälter. Lagerung und Transport: - Vaginalsekret: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C - Abstrichtupfer: bis zu 24 h bei RT. 7.8 Dauer der Untersuchung: Ein negativer Befund wird nach 5 Tagen erstellt. 7.9 Interpretation: Mikrobiologisch wird die Diagnose der BV durch die Bestimmung des BV-Index im Grampräparat gestellt. Dabei wird die durchschnittliche Anzahl von Laktobazillen, Gardnerella vaginalis und Anaerobiern (Bacteroides und Mobiluncus) pro Gesichtsfeld bestimmt. Ein alleiniger Nachweis von G. vaginalis ist nicht beweisend für eine BV. Seite 96 von 281 Beurteilungskriterien für das Grampräparat bei Verdacht auf eine BV bei 1000-facher Vergrößerung. _________________________________________________________________________________ Indexzahl I Laktobazillen Indexzahl II G. vaginalis Indexzahl III gebogene Stäbchen Bacteroides _________________________________________________________________________________ 0 4+ 0 0 0 0 1 3+ 1 1+ 1 1+, 2+ 2 2+ 2 2+ 2 3+, 4+ 3 1+ 3 3+ 4 0 4 4+ Bewertung: Gesamtindexzahl: 4+ = > 30 Morphotypen = Indexzahl I + Indexzahl II + Indexzahl III (Max. 10) 3+ = 6 - 30 Morphotypen 0 - 3 Punkte: kein Hinweis auf BV 2+ = 1 - 5 Morphotypen 4 - 6 Punkte: kein eindeutiger Hinweis auf BV 1+ = < 1 Morphotyp > 7 Punkte: Hinweis auf BV --------------------------------------------------------------------------------------------------------------------------- 8 Infektionen durch Intrauterinpessare (IUP, Spirale) --------------------------------------------------------------------------------------------------------------------------8.1 Erregerspektrum: Siehe Tabelle 10. 8.2 Probengefäße: Steriles Weithalsgefäß. 8.3 Untersuchungsmaterial: Spirale, Intrauterinpessare 8.4 Materialentnahme: - Vorbereitung eines sterilen Weithalsgefäßes - Zugabe von ca. 20 ml Ringerlösung (Kochsalz schädigt Aktinomyzeten!) - Entnahme des IUP unter sterilen Kautelen - Überführen in das Transportgefäß. 8.5 Lagerung und Transport: Möglichst innerhalb von 2 h (maximal bis zu 24 h) bei Raumtemperatur, bei Verdacht auf Aktinomyzeten ist eine Lagerung darüber hinaus nicht möglich. Seite 97 von 281 Tabelle 10: Erregerspektrum bei urogenitalen Infektionen (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren ---------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Urethritis Neisseria gonorrhoeae Urethralabstrich D Chlamydia trachomatis Urethralabstrich Erststrahlurin + 0 0 N 0 0 + 0 0 0 + 0 Objektträger Ureaplasma urealyticum Urethralabstrich ++ 0 Immunfluoreszenz aerobes TM + 0 0 0 Streptokokken der Gruppe B Urethralabstrich aerobes TM + 0 0 0 Enterobacteriaceae Urethralabstrich aerobes TM + 0 0 0 Prostatitis Escherichia coli 4-Gläser Probe N + 0 0 0 Enterobacteriaceae 4-Gläser Probe N + 0 0 0 Pseudomonas aeruginosa 4-Gläser Probe N + 0 0 0 Staphylococcus aureus 4-Gläser Probe N + 0 0 0 Enterococcus faecalis 4-Gläser Probe N + 0 0 0 Trichomonas vaginalis 4-Gläser Probe N 0 0 0 0 Ejakulat, Urethralabstr. N 0 0 + + Urin 0 0 0 + 0 Neisseria gonorrhoeae Ejakulat, Urethralabstr. D ++ + 0 0 0 Enterobacteriaceae Ejakulat, Urethralabstr. N + + 0 0 0 Pseudomonas aeruginosa Ejakulat, Urethralabstr. N + + 0 0 0 Ureaplasma urealyticum Ejakulat, Urethralabstr. N 0 + 0 0 0 Escherichia coli 4-Gläser Probe N + 0 0 0 Pseudomonas aeruginosa 4-Gläser Probe N + 0 0 0 Staphylococcus aureus 4-Gläser Probe N + 0 0 0 Abstrich 0 + 0 0 0 +++ Epididymitis Chlamydia trachomatis Orchitis Balanitis Candida albicans + ________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier, O = Objektträger Seite 98 von 281 Erregerspektrum (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren ---------------------------------------------TM Mikro Kultur AG PCR Sero __________________________________________________________________________ Balanitis Streptokokken der Gruppe B Abstrich 0 + 0 0 0 Staphylococcus aureus Abstrich 0 + 0 0 0 Neisseria gonorrhoeae intraoperativ D + 0 0 0 Chlamydia trachomatis intraoperativ N 0 0 + + Mycoplasma hominis intraoperativ + 0 0 0 Peptostreptococcus spp. intraoperativ “ + 0 0 0 Bacteroides spp. intraoperativ “ + 0 0 0 + 0 0 0 + 0 0 0 Salpingitis ++ anaerobes TM Enterobacteriaceae intraoperativ “ Actinomyces spp. intraoperativ “ + Endometritis Chlamydia trachomatis Zervixabstrich anaerobes TM 0 + + + Escherichia coli Zervixabstrich “ + 0 0 0 Streptokokken der Gruppe A, B Zervixabstrich „ + 0 0 0 Mycoplasma hominis Zervixabstrich „ + 0 0 0 *Mycobacterium tuberculosis (!) Zervixabstrich N ++ + 0 + 0 *Actinomyces spp. Zervixabstrich anaerobes TM ++ + 0 0 0 Bacteroides spp. Zervixabstrich „ + 0 0 0 Streptokokken der Gruppe B Zervixabstrich anaerobes TM + 0 0 0 Escherichia coli Zervixabstrich “ + 0 0 0 postpartal Enterococcus spp. Zervixabstrich “ + 0 0 0 Bacteroides spp. Zervixabstrich “ + 0 0 0 Prevotella spp. Zervixabstrich “ + 0 0 0 Clostridium spp. Zervixabstrich “ + 0 0 0 Mycoplasma hominis Zervixabstrich “ + 0 0 0 __________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Zuordnung möglich, +++ = Nachweis von Mikroorganismen, gattungsspezifische Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, (!) = Keime der Risikogruppe 3, * = nicht langsames Wachstum Seite 99 von 281 _________________________________________________________________________________ Material Angewandte Nachweisverfahren --------------------------------------------TM Mikro Kultur AG PCR Sero __________________________________________________________________________ Zervizitis Chlamydia trachomatis Zervixabstrich N Neisseria gonorrhoeae Zervixabstrich D Listeria monocytogenes Zervixabstrich ++ aerobes TM 0 + + + + 0 0 0 + 0 0 0 Vaginitis Trichomonas vaginalis Vaginalabstrich N +++ 0 0 0 0 Candida spp. Vaginalabstrich 0 ++ + 0 0 0 Bacteroides spp. Vaginalabstrich aerobes TM + 0 0 0 Prevotella spp. Vaginalabstrich “ + 0 0 0 *Actinomyces spp. Vaginalabstrich “ + 0 0 0 Peptostreptococcus spp. Vaginalabstrich “ + 0 0 0 Eubacterium nodatum Vaginalabstrich “ + 0 0 0 Mobiluncus spp. Vaginalabstrich „ ++ + 0 0 0 Vaginalabstrich aerobes TM + + 0 0 0 Mycoplasma hominis Vaginalabstrich „ + 0 0 0 Mobiluncus spp. Vaginalabstrich „ + 0 0 0 Bacteroides spp. Vaginalabstrich „ + 0 0 0 Neisseria gonorrhoeae Exsudat D ++ + 0 0 0 Chlamydia trachomatis Exsudat N 0 0 + + + Staphylococcus aureus Exsudat N + 0 0 0 Anaerobier Exsudat N + 0 0 0 B-Streptokokken Spirale in Ringer-Lösung N --- + 0 0 0 Escherichia coli Spirale in Ringer-Lösung N --- + 0 0 0 Actinomyces spp. Spirale in Ringer-Lösung N --- + 0 0 0 Candida spp. Spirale in Ringer-Lösung N --- + 0 0 0 ++ Bakterielle Vaginose Gardnerella vaginalis (*Nachweis von "clue cells") ++ Bartholinitis Spirale _________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikros = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Zuordnung möglich, +++ = Nachweis von Mikroorganismen, gattungsspezifische Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, * = langsames Wachstum Seite 100 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren --------------------------------------------TM Mikro Kultur AG PCR Sero __________________________________________________________________________ Amnioninfektionssyndrom Ureaplasma urealyticum Amnionfl., Abstr. bei Sectio N + 0 0 0 Mycoplasma hominis Amnionfl., Abstr. bei Sectio N + 0 0 0 Bacteroides spp. Amnionfl., Abstr. bei Sectio N + 0 0 0 Gardnerella vaginalis Amnionfl., Abstr. bei Sectio N + 0 0 0 Streptokokken der Gruppe B Amnionfl., Abstr. bei Sectio N + 0 0 0 Peptostreptococcus spp. Amnionfl., Abstr. bei Sectio N + 0 0 0 Escherichia coli Amnionfl., Abstr. bei Sectio N + 0 0 0 Enterococcus faecalis Amnionfl., Abstr. bei Sectio N + 0 0 0 _________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Zuordnung möglich, +++ = Nachweis von Mikroorganismen, gattungsspezifische Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier Seite 101 von 281 Infektionen des Gastrointestinaltraktes Für die Diagnose der bakteriellen Darminfektionen sind in erster Linie Stuhlproben und Rektalabstriche geeignet. Rektalabstriche sollten wegen der geringeren Ausbeute nur untersucht werden, wenn Stuhl nicht gewonnen werden kann. In speziellen Fällen sind auch extraintestinale Proben wie Blutkulturen, Urin, Lebensmittel oder auch Operationsmaterial von Bedeutung. 1 Erregerspektrum: Siehe Tabelle 11. 2 Indikation zur mikrobiologischen Untersuchung von Stuhl: - Antibiotika-induzierte Diarrhoe (Clostridium difficile) - Darminfektionen, unklare Diarrhoe, Salmonellose u. a. - Verdacht auf Darmtuberkulose. 3 Untersuchungsmethoden: Kulturelle Anzucht und Resistenzbestimmung der Isolate, Mikroskopie, PCR. 4 Probengefäße: Stuhlröhrchen mit Löffel 5 Untersuchungsmaterial: - Darminfektionen Stuhl - V. a. Typhus oder Paratyphus kulturelle Untersuchung von Blut (Blutkulturen), Stuhl - Clostridium difficile-assoziierte Colitis nur flüssiger Stuhl (> 5 ml), bei weniger Untersuchungsmaterial ist eine weitere Untersuchung angezeigt. - V. a. Parasitenbefall: 3 Stuhlproben im Abstand zwischen 1 - 3 Tagen. 5.1 Stuhl Siehe Kapitel IV: Untersuchungsmaterial - Gastrointestinaltrakt. Lagerung und Transport: ≤ 2 h bei RT, bei längerer Lagerung bis zu 24 h bei 4°C (Ausnahmen beachten!) 5.2 Rektalabstriche Siehe Kapitel IV: Untersuchungsmaterial - Gastrointestinaltrakt. Lagerung und Transport: ≤ 2 h bei RT, bei längerer Lagerung bis zu 24 h bei 4!°C. 5.3 Lebensmittelproben - Lebensmittelproben unter Vermeidung von Kontamination entnehmen Seite 102 von 281 - 5.4 Lebensmittel müssen sofort und gekühlt transportiert werden. Duodenalsaft Siehe Kapitel IV: Untersuchungsmaterial - Gastrointestinaltrakt. Lagerung und Transport: Bis zu 24 h bei RT. 6 Dauer der Untersuchung: Ein negativer Befund wird nach 48 h erstellt. 7 Ergänzende Untersuchungen bei Infektionen des Magen-Darm-Traktes: - Magensaft zur Untersuchung auf Tuberkulose - Magenschleimhautbiopsie zur Untersuchung von Helicobacter pylori - Duodenalsaft zur Untersuchung auf Lamblien - Dünndarmbiopsie zur Untersuchung von Mykobakterien - Dickdarmbiopsie zur Untersuchung von Amöben 8 Weiterführende Diagnostik: ---------------------------------------------------------------------------------------------------------------------------------------Blutige Diarrhoe nach Antibiotikatherapie C. difficile Persistierende Enteritis (> 3 Wochen) Amöben, Lamblien, EHEC, Cyclospora V. a. Appendizitis Yersinia enterocolitica Enteritis mit Fieber und blutige Stühle EHEC, Campylobacter, Amöben, Balantidium coli Wässrige Stühle Lamblien, Kryptosporidien, Vibrio, Aeromonas hydrophila, Plesiomonas shigelloides, Blastocystis hominis Diarrhoe unter Immunsuppression Kryptosporidien, Mykobakterien, Isospora, Mikrosporidien (Enterocytozoon bieneusi) Diarrhoe kurz nach einer Mahlzeit Clostridium perfringens, Bacillus cereus, S. aureus, Aeromonas ---------------------------------------------------------------------------------------------------------------------------------------- Seite 103 von 281 Tabelle 11: Erregerspektrum bei Infektionen des Gastrointestinaltraktes (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren --------------------------------------------TM Mikr Kultur AG PCR AK __________________________________________________________________________ Diarrhoe Erwachsene und Kinder Salmonella spp. Stuhl 0 --- + 0 0 0 Shigella spp. Stuhl 0 --- + 0 0 0 Campylobacter spp. Stuhl 0 --- + 0 0 0 Yersinia enterocolitica Stuhl 0 --- + 0 0 + Yersinia pseudotuberculosis Stuhl 0 --- + 0 0 0 Plesiomonas shigelloides Stuhl 0 --- + 0 0 0 Aeromonas hydrophila Stuhl 0 --- + 0 0 0 Vibrio cholerae Stuhl + --- + 0 0 0 Salmonella typhi Stuhl, Blut 0 --- + 0 0 + Salmonella paratyphi Stuhl, Blut 0 --- + 0 0 + (C. jejuni, C. coli, C. lari, C. fetus) Kinder < 2 Jahre Escherichia coli (obligat pathogen) Stuhl 0 --- + 0 + 0 EHEC* Stuhl 0 --- + 0 + + ETEC, EPEC, EIEC Stuhl 0 --- + 0 + + (Toxinnachweis) Antibiotikatherapie/Intensivpflege Clostridium difficile Stuhl 0 --- + + 0 0 Stuhl 0 --- + 0 0 0 Entamoeba histolytica Stuhl 0 +++ 0 0 0 + Giardia lamblia Stuhl 0 +++ 0 0 0 0 Blastocystis hominis Stuhl 0 +++ 0 0 0 0 Clostridium difficile Stuhl 0 --- + + 0 0 Stuhl 0 --- + 0 0 + (Toxinnachweis) Candida spp. Persistierende Enteritis (> 3 Wochen) Appendizitische Symptome Yersinia spp. ________________________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier Seite 104 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------------------TM Mikro Kultur AG PCR AK __________________________________________________________________________ Reiseanamnese Entamoeba histolytica Stuhl 0 +++ 0 0 0 + Isospora belli Stuhl 0 +++ 0 0 0 0 Giardia lamblia Stuhl 0 +++ 0 0 0 0 Cryptosporidium spp. Stuhl 0 +++ 0 0 0 0 Strongyloides stercoralis Stuhl 0 +++ 0 0 0 0 Cyclospora cayetanensis Stuhl 0 +++ 0 0 0 0 Giardia lamblia Stuhl 0 +++ 0 0 0 0 Cryptosporidium spp. Stuhl 0 +++ 0 0 0 0 Vibrio parahaemolyticus Stuhl 0 0 + 0 0 0 Aeromonas hydrophila Stuhl 0 0 + 0 0 0 Plesiomonas shigelloides Stuhl 0 0 + 0 0 0 Entamoeba histolytica Stuhl 0 +++ 0 0 0 + Campylobacter jejuni Stuhl 0 --- + 0 0 0 EHEC Stuhl 0 --- 0 0 + +* wässriger Stuhl Fieber, Blut im Stuhl Immunsuppression/HIV-Infektion Giardia lamblia Stuhl 0 +++ 0 0 0 0 Cryptosporidium spp. Stuhl 0 +++ 0 0 0 0 Entamoeba histolytica Stuhl 0 +++ 0 0 0 + Microsporidium spp. Stuhl 0 +++ 0 0 0 0 Blastocystis hominis Stuhl 0 +++ 0 0 0 0 Strongyloides stercoralis Stuhl 0 +++ 0 0 0 0 Candida spp. Stuhl 0 --- + 0 0 0 atypische Mykobakterien Stuhl 0 +++ + 0 0 0 + 0 + + Ulcuserkrankung Helicobacter pylori Biopsat Spezialmedium ________________________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier Seite 105 von 281 __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------------------TM Mikro Kultur AG PCR AK __________________________________________________________________________ Infektionen nach dem Genuss von Lebensmitteln Salmonella spp. Stuhl, Lebensmittel 0 --- + 0 0 + Staphylococcus aureus Lebensmittel 0 --- + 0 0 0 Bacillus cereus Lebensmittel 0 --- + 0 0 0 Clostridium botulinum Lebensmittel, Blut 0 --- 0 0 0 0 Clostridium perfringens Lebensmittel 0 --- + 0 0 0 Vibrio parahaemolyticus Stuhl, Lebensmittel 0 --- + 0 0 0 Listeria monocytogenes Lebensmittel 0 --- + 0 0 0 Taenia saginata Stuhl 0 +++ 0 0 0 0 Taenia solium Stuhl 0 +++ 0 0 0 0 (auch Toxinnachweis) (Toxinnachweis) ________________________________________________________________________________________ TM = Transportmedium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen, -techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, AK = Antikörpernachweis, Anaerobier Seite 106 von 281 Infektionen durch Parasiten Endoparasiten (Protozoen und Helminthen) können zu unterschiedlichen Zeitpunkten verschiedene Kompartimente des menschlichen Wirtes befallen. Da die Untersuchungsverfahren und die Materialien sehr unterschiedlich sind, ist ein allgemeines Parasiten-Screening nicht möglich. Vielmehr muss vor der Untersuchung eine Eingrenzung aufgrund der (Reise-) Anamnese sowie der organbezogenen Symptomatik vorgenommen werden. Daraufhin erfolgt die Auswahl des einzusendenden Materials. Bei negativem Befund müssen Untersuchungen gegebenenfalls (mehrmals) wiederholt werden, da die Präpatenzzeit (Zeit bis zum Nachweis von Nachkommen des Parasiten bzw. dessen Geschlechtsprodukten) möglicherweise noch nicht abgelaufen ist. 1 Erregerspektrum: Siehe Tabelle 12. 2 Indikationen für die mikrobiologische Untersuchung: - Parasiten-Diagnostik aufgrund der klinischen organbezogenen Symptomatik - Gezielte Diagnostik bei Verdacht auf eine bestimmte Parasitose 3 Untersuchungsmethoden: Mikroskopie im Stuhl oder von Organbiopsien, PCR, Antikörpernachweis, selten kulturelle Anzucht. 4 Untersuchungsmaterialien: Stuhl, Organbiopsien, Blut, Knochenmark, Sekrete, Punktate, Urin. 5 Materialentnahme: 5.1 Blut und Knochenmark 5.1.1 Nativblut Entnahme aus dem Finger, dem Ohrläppchen oder aus der Spritze; Nativblut ist besser geeignet als Blut mit gerinnungshemmenden Zusätzen. 5.1.2 Knochenmark Es lässt sich wegen der schnell einsetzenden Gerinnung ein Heparinzusatz in der Regel nicht vermeiden. Vom aspirierten Mark werden 0,2 – 0,3 ml steril auf 2 Kulturröhrchen verteilt (Gefäße bei Speziallabor anforderbar, Tel. 46912). Bereits auf Objektträgern ausgestrichenes Blut oder Knochenmark können nach Lufttrocknung ebenfalls versendet werden. 5.2 Stuhl Bei Verdacht auf Parasitenbefall des Darmes sollten 3 Stuhlproben untersucht werden, die im Abstand zwischen 1 - 3 Tagen eingesandt werden sollten. Stuhlmenge: ca. 5 g (etwa bohnengroß) Lagerung: ≤ 24 h bei Raumtemperatur, in Ausnahmefällen bei 4°C Seite 107 von 281 5.3 Duodenalsaft Duodenalsaft kann zur Untersuchung auf Trophozoiten von Giardien (rascher Transport erforderlich!) und zum Nachweis von Eiern hepatischer Trematoden eingesendet werden. Material darf nicht gekühlt werden! 5.4 Urin Zum Nachweis von Schistosomen-Eiern wird 24 h-Sammelurin benötigt. Der Versand von größeren Volumina kann vermieden werden, indem ein Sediment des 24 h-Urins vorab hergestellt wird. 5.5 Sputum Zum Nachweis von Helminthen, die als Larve einen pulmonalen Wanderweg durchlaufen (Ascaris, Hakenwürmer, Strongyloides) sowie von Eiern des Lungenegels kann Sputum bei respiratorischen Symptomen in einem Sputumröhrchen eingesendet werden. 5.6 Nadelpunktion, Hautbiopsie, Organbiopsie Durch Nadelpunktion oder Hautbiopsie kann Material aus der Randzone von Hautulzera gewonnen werden. Alle Gewebebiopsien (z.B. Leber, Milz, Lymphknoten, Duodenum, Colon) sollten in wenig NaCl versendet werden, damit sie während des Transportes nicht eintrocknen. 5.7 Tupfpräparate von Organschnitten Diese Materialien können unmittelbar nach dem Eintrocknen auf dem Objektträger versendet werden; eine Fixierung in absolutem Methanol kann auch bereits vor dem Versand erfolgen. Beim Versand sollte daraufhin angegeben werden, ob die Präparate bereits fixiert sind. 6 Lagerung und Transport: Die Proben können mit Ausnahme von Untersuchungen auf Amöben und Giardien bis zu 24 h bei Raumtemperatur gelagert werden. 6.1 Amöben und Lamblien Bei V. a. Giardiasis oder eine invasive Amöbiasis muss frischer Stuhl untersucht werden, d. h. der Stuhl muss innerhalb von 30 Minuten ins Labor gebracht werden (bewegliche Trophozoiten sind etwa eine Stunde lang nachweisbar). Falls trotz wiederholter Stuhluntersuchungen keine Giardien nachweisbar sind, sollte Duodenalsaft untersucht werden. Bei einer asymptomatischen Amöbeninfektion genügt der Nachweis von Amöbenzysten (Dauerformen), d. h. der Stuhl kann bis zu 24 Stunden gelagert werden. Seite 108 von 281 Tabelle 12.1: Parasitendiagnostik aufgrund der klinischen Symptomatik Symptomatik Untersuchung Parasitose Gastrointestinale Symptomatik Mikroskopie v. Stuhl Giardiasis, Amöbiasis, Balantidiose, BlastocystisInfektion, Mikrosporidiose, Kokzidieninfektion, Nematoden-, Zestoden- und Trematoden-Befall Mikr. v. Duodenalsaft Giardiasis, Befall mit hepatischen Trematoden Blutausstrich/Dicker Tr. Malaria Serologie Amöbiasis, Schistosomiasis, TrematodenInfektionen*, Toxocariasis, Trichinellose Duodenalbiopsie** Giardiasis, Mikrosporidiose, Strongyloidiasis Colon-, Rektumbiopsie** enterale Schistosomiasis Fieber Blutausstrich/Dicker Tr. Malaria, Babesiose, afrik. Schlafkrankheit, ChagasErkrankung, Filariasis Serologie Toxoplasmose, Leishmaniasis, Schistosomiasis, Filariasis*, Chagas-Erkrankung*, Trichinellose Hepatische Erkrankung Mikroskopie v. Stuhl Schistosomiasis, Lebertrematoden-Infektionen, Amöbiasis, Mikrosporidien Mikr. v. Duodenalsaft Mikrosporidien, Lebertrematoden-Befall Serologie Amöbiasis, Leishmaniasis, Schistosomiasis, Echinokokkose, Toxocariasis, TrematodenInfektion* Leberbiopsie** Mikrosporidiose, Schistosomiasis, Toxocara-, Trematoden-Infektion Splenomegalie Atemwegserkrankungen Bluttausstrich/Dicker Tr. Malaria, Babesiose Serologie Leishmaniasis Milzbiopsie** Leishmaniasis Mikroskopie v. Sputum Nematoden-Infektionen, Paragonimiasis*, Mikrosporidiose und Kryptosporidiose (immunsupprimierte Patienten) Lymphadenopathie Serologie Echinokokkose, Paragonimiasis* Lymphknotenpunktat** Toxoplasmose, Leishmaniasis, afrik. Schlafkrankheit, Chagas-Erkrankung Serologie Toxoplasmose, Leishmaniasis, Filariasis*, ChagasErkrankung*, afrik. Schlafkrankheit* __________________________________________________________________________ Seite 109 von 281 Symptomatik Untersuchung Parasitose _________________________________________________________________________ Urogenitale Erkrankung Kardiale Erkrankung Mikrosk. v. Vaginalabstrich Trichomoniasis Mikroskopie v. Urin Mikrosporidien, Schistosomiasis Blutausstrich Malaria Blutausstrich Malaria, Chagas-Erkrankung Serologie Toxoplasmose, Trichinellose, Toxocariasis, Chagas-Erkrankung* Hautveränderungen Myokardbiopsie** Chagas-Erkrankung Hautbiopsie**, Punktat Leishmaniasis, Filariasis (Onchozerkose und Mansonellose), Zerkariendermatitis Serologie Leishmaniasis, Schistosomiasis, Onchozerkose*, Trichinellose, Toxocariasis ZNS-Erkrankungen Blutausstrich Malaria, afrik. Schlafkrankheit Liquor Acanthamöben-, Naegleria-Infektionen, afrik. Schlafkrankheit Serologie Toxoplasmose, Toxocariasis, Schistosomiasis, Echinokokkose, Zystizerkose, afrik. Schlafkrankheit* Augen-Erkrankungen Hirnbiopsie** Acanthamöben-, Naegleria-Infektionen Kornealmaterial Acanthamöben-Infektion, Mikrosporidiose Serologie Toxoplasmose, Toxocariasis, Zystizerkose, Echinokokkose, Onchozerkose* Eosinophilie Serologie Toxocariasis, Trichinellose, Schistosomiasis, Filariasis*, Sputum Askariasis, Hakenwurminfektion, Strongyloidiasis Stuhl Askariasis, Hakenwurminfektion, Strongyloidiasis, Schistosomiasis Muskelbiopsie** Trichinellose __________________________________________________________________________ *) Diese Untersuchungen werden auswärtig vom Bernhard-Nocht-Institut durchgeführt (BernhardNocht-Institut für Tropenmedizin, Bernhard-Nocht-Str. 74, 20359 Hamburg). **) Es sollte von diesen Materialien immer parallel eine Probe zur histopathologischen Untersuchung an das Institut für Pathologie geschickt werden (ggf. Spezialfärbungen für Parasiten). Seite 110 von 281 Tabelle 12.2: Vorgehen bei der Untersuchung auf bestimmte Parasiten Parasit Probenmaterial Versand Ascaris lumbricoides Stuhl, (Sputum) Raumtemperatur, ≤ 24 h Balantidium coli (bei Metzgern, Bauern) blutiger Stuhl Raumtemperatur, ≤ 1 h Babesia microti, divergens, canis Kapillarblut, evtl. EDTA-Blut Raumtemperatur, ≤ 1 h Bandwürmer (Taenia, Diphyllobothrium, Hymenolepis) Stuhl Raumtemperatur, ≤ 24 h Blastocystis hominis (fakultativ pathogen) Stuhl Raumtemperatur, ≤ 24 h Cryptosporidium parvum (bes. Immunsupprimierte) Stuhl, Bronchiallavage, (Sputum) Raumtemperatur, ≤ 1 h Echinococcus spp. Serologie Raumtemperatur, ≤ 24 h Ektoparasiten (Flöhe, Läuse, Zecken) Parasit selbst oder Teile dessen 70%-iger Alkohol Endoparasiten (ganze Würmer oder Bestandteile) Parasit selbst oder Teile dessen Kochsalzlösung, ≤ 24 h Entamoeba histolytica Stuhl mit blutigem Schleim Raumtemperatur , ≤ 1 h Serum bei invasiven Formen Raumtemperatur, ≤ 24 h Enterobius vermicularis (Oxyuren) perianales Abklatschpräparat Raumtemperatur, ≤ 24 h (Tesafilm auf Objektträger) Filarien (Haut: Onchocerca u. a.) Skin snips in NaCl, Raumtemperatur , ≤ 1 h (Scapula, Beckenkamm, Wade) Filarien (Blut: Loa, Wuchereria, Brugia u. a.) Serologie* Raumtemperatur, ≤ 24 h EDTA-Blut (12:00 Loa, Raumtemperatur , ≤ 1 h 24:00 Wuchereria/Brugia), Serologie* Raumtemperatur, ≤ 24 h Giardia duodenalis Stuhl, Duodenalsaft Raumtemperatur, ≤ 1 h Hakenwürmer (Ancylostoma, Necator) Stuhl, (Sputum) Raumtemperatur, ≤ 24 h Kokzidien (Isospora, Cyclospora, Sarcocystis) Stuhl Raumtemperatur, ≤ 24 h Lebertrematoden (Fasciola*, Clonorchis u. a.) Stuhl, Serum*, Duodenalsaft Raumtemperatur, ≤ 24 h Leishmania spp. bei kutaner Leishmaniose Punktat, Biopsie Raumtemperatur, ≤ 1 h Leishmania spp. bei viszeraler Form Punktat, Biopsie, Serum Raumtemperatur ,≤ 1 h Leishmania spp. bei mukokutaner Form Punktat, Biopsie, Serum Raumtemperatur ,≤ 1 h Mikrosporidien (Enterocytozoon spp. u. a.) Stuhl, Urin, Duodenalaspirat Raumtemperatur, ≤ 24 h Duodenalbiopsie, Konjunktivalabstrich, Raumtemperatur ,≤ 1 h Korneaspäne Paragonimus spp. (nach Krabbengenuss) Sputum, Serologie* Raumtemperatur, ≤ 24 h Plasmodium spp. (Malaria) Kapillarblut, evtl. EDTA-Blut Raumtemperatur ,≤ 1 h Schistosoma haematobium (Blasenbilharziose) 24 h-Sammelurin, Serologie, Raumtemperatur, ≤ 1 h S. japonicum, S. mansoni u. a. (Darmbilharziose) Stuhl, Serologie, Rektumbiopsie Raumtemperatur, ≤ 1 h Strongyloides stercoralis Stuhl, (Sputum) Raumtemperatur, ≤ 24 h Toxocara canis, cati Serologie Raumtemperatur, ≤ 24 h Toxoplasma gondii Serologie, Lypmhknotenaspirat Raumtemperatur, ≤ 24 h Trichomonas vaginalis Zervix-, Vaginalsekret, Urin Raumtemperatur, ≤ 24 h Blasenbiopsie Trichuris trichiura Stuhl Raumtemperatur, ≤ 24 h Trichinella spiralis Serologie, Muskelbiopsie Raumtemperatur, ≤ 1 h Trypanosoma brucei rh/gamb (afrik. Schlafkrankheit) EDTA-Blut, Liquor, Serologie* Raumtemperatur, ≤ 1 h Trypanosoma cruzi (Chagas-Erkrankung) EDTA-Blut, Organbiopsien, Serologie* Raumtemperatur, ≤ 1 h Seite 111 von 281 III Diagnostik bei Infektionen mit seltenen Erregern Acanthamoeba Actinomyces spp. Amöben (Entamoeba histolytica) Anaerobier Aspergillus spp. Außereuropäische Pilze (Dimorphe Pilze) Bacillus anthracis (Anthrax) Bartonella spp. Bordetella pertussis/ B. parapertussis Borrelia burgdorferi Brucella spp. Candida spp. Capnocytophaga spp. Chlamydophila pneumoniae Chlamydophila psittaci Chlamydia trachomatis Clostridium spp. Corynebacterium diphtheriae Coxiella burnetii Cryptococcus neoformans Cryptosporidium spp. Dermatophyten Echinococcus spp. Erysipelothrix Francisella tularensis Giardia lamblia Erreger der HACEK-Gruppe Legionella spp. Leishmanien Leptospira spp. Listeria spp. MRSA (Methicillin-resistenter Staphylococcus aureus) Mycoplasma hominis Mycoplasma pneumoniae Mycobacterium tuberculosis-Komplex Seite 112 von 281 Nicht-tuberkulöse Mykobakterien (NTM) Neisseria gonorrhoeae Nocardia spp. Pneumocystis jirovecii Staphylococcus spp. Streptococcus spp. Ureaplasma urealyticum Vibrio cholerae Yersinia enterocolitica Seite 113 von 281 Acanthamoeba Klinik: Akanthamöben verursachen im ZNS eine Meningoenzephalitis und am Auge eine Keratitis. Untersuchungsmethode: Der mikrobiologische Nachweis erfolgt mikroskopisch oder kulturell. Untersuchungsmaterial: - Liquor bei Enzephalitis (mindestens 1 ml) - Hornhaut-Abrasio-Material - Hornhautgeschabsel auf Objektträger - Kontaktlinsen oder Kontaktlinsen-Aufbewahrungsmedium Probengefäße: Universalröhrchen mit blauem Schraubverschluss Zur kulturellen Anzüchtung muss ein Transportmedium (Page-Medium) verwendet werden (Anforderung unter Tel. Nr. 46939). Lagerung und Transport: Der Transport muss innerhalb von 2 h bei Raumtemperatur erfolgen. Da Akanthamöben kälteempfindlich sind, sollen die Untersuchungsmaterialien nicht im Kühlschrank aufbewahrt werden. Eine längere Lagerung ist nicht möglich. Dauer der Untersuchung: Die mikroskopische Untersuchung dauert ca. 2 h, die kulturelle Anzüchtung bis zu 7 Tagen. Seite 114 von 281 Actinomyces spp. Klinik: Aktinomyzeten verursachen zervikofaziale, thorakale, abdominale und pelvine Aktinomykosen. Untersuchungsmethode: Kulturelle Anzucht und Resistenzbestimmung der Isolate; Identifizierung durch 16 S rRNASequenzanalyse. Untersuchungsmaterial: Abszesspunktate, intraoperativ Wundabstriche, Fistelsekret, Biopsien, respiratorische Sekrete, gewonnene Materialien, Spiralen. Sehr gut geeignet sind endoskopisch gewonnene Bronchialsekretproben und Abszess- oder Empyemeiter (durch transthorakale Lungenpunktion oder perkutane Nadelbiopsie gewonnen). Probengefäße: Universal-Probenröhrchen mit blauen Schraubverschluss, Universal-Probenröhrchen mit Thioglykolatbouillon, Universal-Abstrichröhrchen mit blauer Kappe. Lagerung und Transport: - ≤ 2 h bei RT, bei längerem Transport bis zu 24 h im Transportmedium bei RT - Aktinomyzeten sind kälteempfindlich und dürfen nur kurz bei 4°C gelagert werden - manche Spezies sind empfindlich gegen NaCl, daher Transport in Ringerlösung Dauer der Untersuchung: Die kulturelle Anzüchtung ist langwierig und kann bis zu 2 Wochen dauern. Ein negativer Befund wird nach 2 Wochen erstellt. Seite 115 von 281 Amöben (Entamoeba histolytica) Klinik: Über 90% der mit Amöben infizierten Personen sind asymptomatische Träger. In unkomplizierten Fällen verursachen Amöben eine akute Rektokolitis, in komplizierten Fällen entsteht eine Dysenterie mit blutig-schleimigen Durchfällen, Koliken und Tenesmen. Ulzerationen führen zu Peritonitis. Abszessbildung in Leber und im ZNS möglich. Untersuchungsmethode: - Stuhl: Mikroskopie - Leberabszesse: radiologischer Nachweis, die Punktion des Abszesses sollte unterbleiben - Antikörpernachweis (mittels Immunfluoreszenz; siehe Leistungskatalog Serologie) Untersuchungsmaterial: Stuhl bei Dysenterie (Nachweis von Trophozoiten, Zysten), bei Trägern (oft Zysten) Trophozoiten bleiben bei RT ca. 1 h vital, d. h. Stuhl muss im Labor warm ankommen. Punktate - Probengefäße: Stuhlröhrchen mit Löffel. Lagerung und Transport: - Dysenterie: Stuhl ≤ 1 h bei RT; ist das nicht möglich, bis zu 24 h im Transportmedium bei RT; der sollte in einem Stuhlröhrchen in einem Becher mit warmem Wasser (37°C) transportiert werden. Eine Untersuchung von Nativmaterial, das länger als 2 h unterwegs ist, macht keinen Sinn! - Asymptomatische Infektion: Stuhl: ≤ 24 h bei RT (Nachweis von Zysten) Serum: ≤ 24 h bei RT. Dauer der Untersuchung: Ein negativer Befund wird nach 24 h erstellt. Seite 116 von 281 Anaerobier Klinik: Abszesse, Pleuraempyem, Aspirationspneumonie, Appendizitis, Peritonitis, infizierte Ulzera. Untersuchungsmethoden: Kulturelle Anzucht mit Resistenzbestimmung der Isolate (MHK-Bestimmung), ggf. Identifizierung durch 16 S rRNA-Sequenzanalyse. Untersuchungsmaterialien: Geeignete Materialien: Abszess- und Biopsiematerial, Fistelsekrete, Eiter aus tiefen Wunden, intraoperative Abstriche (falls die Gewinnung von Aspiraten nicht möglich), Punktate (z. B. Pleurapunktat), Pericardflüssigkeit, Peritonealflüssigkeit, Ascites, Gewebeproben bei Myositis oder Cellulitis, tracheales Aspirat, bronchoalveoläre Lavage (BAL), Blasenpunktionsurin, Nierenbeckenurin, Zervixabstriche, Knochenstücke bei Osteomyelitis, Blutkulturen und Liquores, jedoch nur auf Anforderung und bei V. a. Hirnabszess. Ungeeignete Materialien: Alle Materialien, die mit Normalflora kontaminiert sind, sind zur Untersuchung auf Anaerobier ungeeignet (Sputum, Trachealsekret, Vaginalabstriche): Nasen- oder Rachenabstriche, Abstriche von oberflächlichen Wunden, Sputum, Mittelstrahl- oder Katheterurin und Vaginalabstriche. Probengefäße: - Universal-Abstrichtupfer mit blauer Kappe (mit Transportmedium für Anaerobier) - Universal-Probenröhrchen mit blauem Schraubverschluss (ohne Transportmedium, daher nur für den sofortigen Transport geeignet) - Probenröhrchen oder Weithalsgefäße mit Thioglykolatbouillon (anzufordern unter Tel. 201-46918) - Blutkulturflaschen. Materialentnahme: - Untersuchungsmaterialien rasch und blasenfrei entnehmen Seite 117 von 281 - die Materialien dürfen nicht mit Normalflora kontaminiert werden, daher empfiehlt sich vor der Abnahme eine gründliche Desinfektion der Haut bzw. Schleimhaut und die Aspiration mit einer Kanüle und Spritze - falls möglich, Einsendung von Punktionsmaterial (>1 ml) oder Gewebebiopsien (in wenig Kochsalz, besser in hochwertiger Nährbouillon oder Ringer-Lösung transportieren) - statt Ulzera sind Biopsate oder Aspirate zu bevorzugen; diese möglichst vom Ulkusrand entnehmen, Abstriche sind nur in Ausnahmefällen und mit Transportmedium zu verwenden - Wichtige Materialien wie Hirnabszesse sollten telefonisch im Labor (Tel. 201-46918) angemeldet werden. Lagerung und Transport: - Die Materialien müssen von der Probenentnahme bis zur Verarbeitung im Labor vor Sauerstoffeinfluss geschützt werden! - Transportzeiten daher so kurz wie möglich halten; am besten die Proben sofort nach der Gewinnung ins Labor schicken; ist dies nicht möglich, Transportmedien für Anaerobier verwenden, ersatzweise Transportmedien für anspruchsvoll wachsende Keime oder Blutkulturflaschen (Einimpfen des Materials). Ein trockener Abstrich ist unakzeptabel! - Flüssige Materialien nicht in verschlossenen Spritzen transportieren, den Spritzeninhalt in ein steriles Gefäß überführen. - Liquor sollte sofort nativ und nicht in Nährmedien transportiert werden! - Untersuchungsmaterialien bis zum Transport bei Raumtemperatur lagern! Sie gehören weder in den Kühlschrank noch sollten sie eingefroren werden! - flüssige Materialien (Punktate, Sekrete usw.): ohne Transportmedium: ≤ 2 h bei Raumtemperatur, eine längere Lagerung ist nicht möglich! mit Transportmedium: bis zu 24 h bei Raumtemperatur - Biopsiematerial: ohne Transportmedium: ≤ 2 h bei Raumtemperatur, eine längere Lagerung ist nicht möglich! - Abstriche: ohne Transportmedium: ≤ 2 h bei Raumtemperatur, eine längere Lagerung ist nicht möglich! mit Transportmedium: bis zu 24 h bei Raumtemperatur. Dauer der Untersuchung: Ein negativer Befund wird nach 7 Tagen erstellt. Seite 118 von 281 Aspergillus spp. Klinik: Organ- und Systemmykosen, Otomykosen bei Otitis externa, Mykosen von Verbrennungswunden. Untersuchungsmethoden: - Mikroskopie des Nativmaterials - Kulturelle Anzucht - Resistenzbestimmung (MHK-Bestimmung), nur nach Anforderung (Te.: 201-46918) - DNA-Nachweis mittels PCR (Sensitivität geringer als der AG-Nachweis, Spezifität 100%) - Antigennachweis (Platelia-Test; Sensitivität 60 - 90%, Spezifität > 95%) - Antikörpernachweis Untersuchungsmaterial: - Kultur: Sputum, BAL, Bronchial-, Trachealsekret, Spülflüssigkeit, Liquor, Biopsiematerial - Antigen und PCR: Blut, Liquor und Sekrete aus den Atemwegen Aspergillen sind aus Blut und Liquor nur selten anzüchtbar, ggf. kann ein Anzüchtungsversuch mit Nativblut in einer mykologischen Bouillon versucht werden (Kontaktaufnahme mit dem Pilzlabor Tel. 201-46910). Aufgrund der besseren Sensitivität empfiehlt sich bei V. a. eine Aspergillose ein AntigenNachweis aus Blut, Liquor oder aus Sekreten aus den Atemwegen. Um die Sensitivität der Sputumkultur zu steigern, sollten bei klinischem Verdacht wenigstens 3 aufeinanderfolgende Kulturen untersucht werden. Probengefäße: Universal-Probenröhrchen mit blauer Verschlusskappe. Lagerung und Transport: Bis zu 24 h bei Raumtemperatur (Aspergillen sind empfindlich gegenüber Kälte) Dauer der Untersuchung Mikroskopie: 30 - 60 min, Kultur: 2 - 5 Tage, Resistenzbestimmung: 2 Tage, Antigennachweis: 1 Tag. PCR: 2 Tage. Seite 119 von 281 Außereuropäische Pilze (Dimorphe Pilze) Histoplasma capsulatum, Blastomyces dermatitidis, Coccidioides immitis, Paracoccidioides brasiliensis. Außereuropäische Pilze gehören zu den Mikroorganismen der Risikogruppe 3. Wegen der Gefahr einer Laborinfektion sollte bei V. a. eine außereuropäische Pilzinfektion das Labor vor Einsendung des Materials telefonisch verständigt werden (Tel.: 201-46910). Außerdem muss ein Vermerk auf dem Einsendeschein gemacht werden. Klinik: Pneumonien und Organmykosen insbesondere im ZNS, Verletzungsmykosen. Untersuchungsmethoden: - Kultur, Mikroskopie, ggf. Identifizierung mittels 16 S rRNA-Sequenzanalyse - Antikörpernachweis Untersuchungsmaterial Sputum, BAL, Trachealsekret, Bronchialsekret, Liquor, Abszessmaterial, Punktate, Biopsien. Probengefäße: Universal-Probenröhrchen mit blauem Verschluss, Universal-Abstrichtupfer mit blauer Kappe. Die Gefäße müssen bruchsicher sein! Lagerung und Transport: Bis zu 24 h bei Raumtemperatur. Dauer der Untersuchung: Die kulturelle Anzucht kann bis zu 4 Wochen dauern. Ein negativer Befund wird nach 4 Wochen erstellt. Meldepflicht! Seite 120 von 281 Bacillus anthracis (Anthrax) B. anthracis gehört zu den Mikroorganismen der Risikogruppe 3. Wegen der Gefahr einer Laborinfektion, Verdachtsdiagnose "Anthrax" oder "Milzbrand" auf dem Einsendeschein vermerken! Klinik: Man unterscheidet den Lungen-, Haut- und Darmmilzbrand. Infektionen treten nach Exposition zu Weidetieren (Rinder, Schafe, Ziegen, Pferde, Schweine) auf, ferner bei Kontakt mit Roh-Wolle und Fellen. Betroffen sein können Veterinäre, Scherer, Gerber sowie Beschäftigte in Woll-, Leder- und Pinselfabriken. Bei der Hautinfektion bildet sich an der Inokulationsstelle eine hämorrhagische Pustel mit zentraler Nekrose. Lymphogene Aussaat ist möglich. Untersuchungsmaterial: Sekrete der Atemwege, Wundabstriche, Biopsien. Untersuchungsmethode: - Kultur mit Resistenzbestimmung der Isolate - Identifizierung der Isolate mittels 16 S rRNA-Sequenzanalyse. Probengefäße: Universal-Probenröhrchen mit blauem Verschluss (bruchsicher!), Universal-Abstrichtupfer mit blauer Kappe. Lagerung und Transport: Bis zu 24 h bei Raumtemperatur oder bei 4°C. Dauer der Untersuchung: Die Dauer der Untersuchung beträgt ca. 4 Tage. Ein negativer Befund wird nach 4 Tagen erstellt. Meldepflicht! Seite 121 von 281 Bartonella spp. Klinik: B. henselae ist der häufigste Erreger der Katzenkratzkrankheit. Die Bakterien werden durch Bisse, häufiger durch Kratzverletzungen von Katzen auf den Menschen übertragen. Nach ca. 2 Wochen kommt es zu einer regionalen Lymphadenopathie, Kopfschmerzen, Fieber und Müdigkeit. Schwere Verläufe einer Enzephalitis, chronische Lymphadenopathien, Bakteriämien mit und ohne Endokarditis sind beschrieben. Bei immunsupprimierten Patienten kann sich eine generalisierte Form mit Beteiligung von Leber, Milz und Knochenmark entwickeln. B. henselae ist auch der Erreger der bazillären Angiomatose und der bazillären Peliosis. B. quintana verursacht bei HIV-infizierten und anderen immungeschwächten Patienten Bakteriämien und Lymphadenopathien. Untersuchungsmaterial: Biopsiematerial, Lymphknoten in wenig NaCl, Serum zum Antikörpernachweis. Untersuchungsmethode: - DNA-Nachweis mittels PCR (externe Untersuchung) - Antikörpernachweis (externe Untersuchung) Dis Untersuchungen werden im Institut für Medizinische Mikrobiologie der Universität Tübingen, Elfriede-Aulhorn-Straße 6, 72076 Tübingen (Tel.: 07071-2982349) durchgeführt. Probengefäße: Universal-Probenröhrchen mit blauem Schraubverschluss, Serumröhrchen. Lagerung und Transport: ≤ 2 h bei Raumtemperatur, ist dies nicht möglich bis zu 24 h bei 4°C. Dauer der Untersuchung: ca. 1 Woche, da externe Untersuchungen! Seite 122 von 281 Bordetella pertussis – B. parapertussis - Keuchhusten Klinik: Der typische Verlauf des Keuchhustens wird in 3 Stadien eingeteilt: Beginn mit dem Stadium catarrhale über 1-2 Wochen, Stadium convulsivum über 4-6 Wochen und im Anschluss daran das Stadium decrementi. Untersuchungsmaterial: - transnasale Rachenhinterwandabstriche - Rachenabstriche sind ungeeignet - Serumröhrchen zum Antikörpernachweis Untersuchungsmethoden: - DNA-Nachweis mittels PCR (ist der Kultur überlegen) (externe Untersuchung) - Antikörpernachweis (externe Untersuchung) Die Untersuchungen werden im Institut für Hygiene und Mikrobiologie im Klinikum Krefeld, Lutherplatz 40, 47805 Krefeld (Tel.: 02151-322462) durchgeführt. Probengefäße: Universal-Abstrichtupfer mit blauer Kappe, Calcium-Alginat-Tupfer können auf die PCR inhibitorisch wirken. Lagerung und Transport: ≤ 2 h bei RT, ist das nicht möglich bis zu 24 h bei 4°C. Dauer der Untersuchung: ca. 1 Woche, da externe Untersuchungen! Der Nachweis von IgA- oder IgG-Antikörpern ist für die Akutdiagnostik nicht geeignet. Er ist aber für epidemiologische Fragestellungen von Interesse. Seite 123 von 281 Borrelia burgdorferi - Borreliose Klinik: Borrelien werden durch Zecken übertragen. Während der Blutmahlzeit der Zecken wandern die Borrelien aus deren Darm in die Speicheldrüsen und gelangen von dort in die Haut des Wirtes. Dort erfolgt zunächst eine lokale Ausbreitung der Erreger; später disseminieren die Keime über die Blut- und Lymphwege in verschiedene Organe. Stadium I: An der Einstichstelle bildet sich ein Erythema migrans. Die Hauterscheinung kann über Wochen persistieren (Erythema chronicum migrans). Daneben kann eine Lymphadenitis cutis benigna auftreten. Stadium II: Klinische Manifestation: Haut, Nervensystem (Fazialisparesen, Zeichen der Meningitis), Herz (Rhythmusstörungen) und Bewegungsapparat. Häufig klagen die Patienten über Müdigkeit und ein deutliches Krankheitsgefühl. Fieber und eine generalisierte Lymphadenitis können vorkommen. Die häufigste Manifestation in Europa ist die Neuroborreliose (Meningopolyneuritis Garin-Bujadoux-Bannwarth). Stadium III: Es tritt Monate bis Jahre nach der Infektion auf. Klinisch manifestiert sich die Erkrankung durch die Acrodermatitis chronica atrophicans und durch rheumatische Beschwerden (Gelenkentzündungen mit Ergussbildung). Die chronische Neuroborreliose zeichnet sich durch eine chronische Meningitis oder Enzephalomyelitis mit lymphozytärer Pleozytose im Liquor über mehr als 6 Monate aus. Gelenkentzündungen (Lyme-Arthritis), Myositis, Bursitis ergänzen das rheumatologische Krankheitsbild. Untersuchungsmaterial: Antikörpernachweis: Serum, Liquor PCR: Punktate, Gewebeproben. Probengefäße: Serumröhrchen, Universal-Probengefäß mit blauem Verschluss. Untersuchungsmethoden: - Antikörpernachweis im Rahmen einer Stufendiagnostik: 1. Schritt: Suchtest mittels ELISA 2. Schritt: Bestätigungstest mittels Immunoblot Seite 124 von 281 - DNA-Nachweis mittels PCR Besonderheiten: Bei Neuroborreliose Nachweis von intrathekal gebildeten Antikörpern (Serum-Liquor-Index). Verlaufsuntersuchungen bei grenzwertigem oder negativem Ergebnis der Erstuntersuchung und bestehendem klinischen Verdacht. Lagerung und Transport: ≤ 24 h bei 4°C. Dauer der Untersuchung: PCR: 1 Tag Antikörpernachweis: 2 Tage; die Untersuchungen werden nicht täglich durchgeführt. Seite 125 von 281 Brucella spp. Brucellen gehören zu den Mikroorganismen der Risikogruppe 3. Wegen der Gefahr der Laborinfektion sollten alle Antragsformulare den Vermerk “cave Brucellose“ haben. Für die Untersuchung auf Brucellen muss bei klinischem Verdacht eine gezielte Untersuchungsanforderung erfolgen, da die Nährmedien länger als gewöhnlich bebrütet werden müssen. Klinik: Infektionen mit Brucellen treten nach Exposition zu Rindern (Brucella abortus, Morbus Bang), Schweinen (B. suis), Ziegen (B. melitensis, Maltafieber) oder nach Verzehr von unpasteurisierten Milchprodukten auf. Veterinäre oder Tierpfleger sind häufiger betroffen. Menschen aus Mittelmeerländern (Endemiegebiete) erkranken ebenfalls häufiger an einer Brucellose („importierte Erkrankungen“, Reiseanamnese!). Untersuchungsmethode: - Kultur und Resistenzbestimmung (externe Untersuchung am Robert-Koch-Institut, Berlin) - DNA-Nachweis mittels PCR (externe Untersuchung am Robert-Koch-Institut, Nordufer 20, 13353 Berlin, Tel.: 01888-754-0) - Antikörpernachweis Untersuchungsmaterial: Blutkulturen, Abszessmaterial, Knochenmark, Punktate, Liquor; wenig geeignet ist Urin. Bei Brucelloseverdacht sind zusätzliche serologische Untersuchungen dringend erforderlich. 85% der Brucellosen werden nur serologisch diagnostiziert. Probengefäße: Blutkulturflaschen für flüssige Untersuchungsmaterialien, Biopsate in wenig Kochsalzlösung. Lagerung und Transport: Blutkulturflaschen bis zu 24 h bei RT, Abszessmaterial ≤ 1 h bei RT, dann einfrieren bei minus 70°C oder Verimpfen in Blutkulturflaschen. Dauer der Untersuchung: Ein negativer Befund wird nach 3 Wochen erstellt. Meldepflicht bei Erkrankung und Tod! Seite 126 von 281 Candida spp. Bei der Untersuchung von Pilzen sind klinische Angaben unverzichtbar, denn nur unter Berücksichtigung des Immunstatus des Patienten und der klinischen Symptome kann eine Wertung des Befundes erfolgen. Klinik: Man unterscheidet oberflächliche Candidosen der Haut (Windelsoor, Vaginalsoor), invasive Candidosen der Schleimhäute (Ösophagus), Fungämien sowie Organmykosen mit Organabsiedelungen, z. B. im ZNS, in der Leber usw. bei Immunsuppression. Untersuchungsmethoden: - Mikroskopie - Kultur - Resistenzbestimmung (routinemäßig bei Isolation aus sterilen Kompartimenten, andre Isolate nur nach telefonischer Anforderung (Tel.: 201-46910) - Antigen-Nachweis (Sensitivität ca. 76%, Spezifität ca. 79%) Aufgrund der kurzen Halbwertszeit der Candida-Antigene im Serum sind engmaschige Antigenbestimmungen notwendig. - DNA-Nachweis mittels PCR (Sensitivität ca. 80%, Spezifität ca. 79%) - Antikörpernachweis Probengefäße: Universal-Probenröhrchen mit blauem Schraubverschluss, Sputumröhrchen, UniversalAbstrichröhrchen mit blauer Kappe, Urinröhrchen, Stuhlröhrchen. Untersuchungsmaterial: - bei V. a. Fungämie oder Sepsis: Blutkulturen, Urin - bei Vaginalmykosen: Vaginalabstriche - V. a. Infektionen des Harntraktes: Urin - Gastrointestinale Infektion: intraoperative Abstriche, Drainagen, Redon-Drainagen - V. a. Infektionen der Atemwege: BAL, Bronchialsekret, kein Sputum! - Meningitis: Blutkulturen, Liquor Um bei immunsupprimierten Patienten das Ausmaß einer Candida-Besiedlung für eine Infektion abschätzen zu können, sollten stets Untersuchungen mehrerer Materialien (Blut, Urin) sowie ein Antigen-Test oder ein histologischer Nachweis angestrebt werden. Seite 127 von 281 Lagerung und Transport: ≤ 2 h bei Raumtemperatur, ist das nicht möglich bis zu 24 h bei 4°C. Dauer der Untersuchung: - Kultur: 2 Tage - Resistenzbestimmung: 2 Tage (bei Nachweis in sterilen Kompartimenten erfolgt automatisch eine Resistenzbestimmung, bei Nachweis aus nicht-sterilen Kompartimenten muss die Resistenzbestimmung gesondert angefordert werden). - Antigennachweis: ≤ 4 h. Interpretation: Jeder positive Candida-Nachweis im Blut, Liquor, Blasenpunktionsurin, BAL oder sterilen Kompartimenten muss als pathologisch angesehen werden und bedarf der diagnostischen Abklärung. Negative Kulturbefunde schließen eine Candida-Infektion nicht aus. Der Nachweis von Candida-Antigen im Serum ist als Hinweis auf eine invasive CandidaInfektion zu werten, jedoch nicht als Beweis. Negative Candida-Antigenbefunde schließen eine Mykose nicht aus. Antigenteste eigenen sich zur Therapiekontrolle von Candidosen (Absinken des Antigentiters bei Therapieerfolg). Seite 128 von 281 Capnocytophaga canimorsus Klinik: Der Erreger kann durch Hundebisse übertragen werden und führt vor allem bei immunsupprimierten Patienten, bei Patienten mit Hepatopathien oder bei splenektomierten Patienten zu schweren septischen Verläufen mit Endokarditis, Meningitis mit einer hohen Letalität von 25%. Untersuchungsmaterial: Wundabstriche, Wundsekrete, Blutkulturen. Untersuchungsmethode: Kulturelle Anzucht und Resistenzbestimmung der Isolate; Bestätigung mittels 16 S rRNASequenzanalyse. Probengefäße: Universal-Abstrichröhrchen mit blauer Kappe, Universal-Probenröhrchen mit blauem Verschluss, bei V. a. Bakteriämie Blutkulturflaschen. Lagerung und Transport: ≤ 2 h bei RT, eine längere Lagerung ist nicht möglich; bei längerem Transport Einimpfen des Materials in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT. Dauer der Untersuchung: Die Dauer der Untersuchung beträgt ca. 5 Tage. Ein negativer Befund wird nach 48 h erstellt. Seite 129 von 281 Chlamydophila pneumoniae Klinik: Infektionen der oberen (Sinusitis, Pharyngitis, Otitis media) und unteren Atemwege (Bronchitis, Pneumonie). Untersuchungsmethode: - DNA-Nachweis mittels (Spezifität 100%) - Antikörpernachweis mittels ELISA Der kulturelle Nachweis von C. pneumoniae ist zeitaufwendig und wenig sensitiv und wird im IHM nicht durchgeführt. Untersuchungsmaterial: - Trachealsekret, BAL, bei Kindern in Ausnahmefällen tiefe Rachenabstriche, besser oropharyngeale Absaugungen, Sputum ist weniger gut geeignet. Die Materialien sollten zellreich sein, da Chlamydien nur intrazellulär wachsen. - Serum für den Nachweis von Antikörpern. Probengefäße: Universal-Probenröhrchen mit blauem Schraubverschluss, Universal-Abstrichtupfer mit blauer Kappe. Probenentnahme: siehe Infektionen des Respirationstraktes. Lagerung und Transport: bis 24 h bei 4°C . Dauer der Untersuchung 1 Tag; die Untersuchungen werden aber nicht täglich durchgeführt. Seite 130 von 281 Chlamydophila psittaci Klinik: Infektionen der unteren Atemwege (Pneumonie mit Schüttelfrost, hohem Fieber, Kopf- und Muskelschmerzen und Exanthem). Untersuchungsmethode: - DNA-Nachweis mittels PCR (externe Untersuchung) - Antikörpernachweis (externe Untersuchung) Die PCR und weiterführende Serologie wird im Nationalen Referenzzentrum für Chlamydien, Universität Jena, durchgeführt (Institut für Medizinische Mikrobiologie der Universität Jena, Semmelweißstraße 4, 07740 Jena; Tel.: 03641-933472). Untersuchungsmaterial: - Trachealsekret, BAL, bei Kindern in Ausnahmefällen tiefe Rachenabstriche, besser oropharyngeale Absaugungen, Sputum. Die Materialien sollten zellreich sein, da Chlamydien nur intrazellulär wachsen. - Serum für den Nachweis von Antikörpern. Probengefäße: Universal-Probenröhrchen mit blauem Schraubverschluss, Universal-Abstrichtupfer mit blauer Kappe. Probenentnahme: siehe Infektionen des Respirationstraktes. Lagerung und Transport: ≤ 24 h bei 4°C, bei längerer Lagerung Material einfrieren bei minus 70°C. Dauer der Untersuchung: PCR: 1 Tag; da die Untersuchungen in Jena durchgeführt werden, kann die Diagnostik bis zu 1 Woche dauern. Seite 131 von 281 Chlamydia trachomatis Klinik: C. trachomatis verursacht Infektionen der Konjunktiva, des Urogenitaltraktes (Urethritis, Zervizitis, Salpingitis, Adnexitis, Epididymitis, Prostatitis) und der Atemwege (Pharyngitis, Otitis media, Bronchitis, Pneumonie bei Neu- und Frühgeborenen). In seltenen Fällen kommt es zu Myokarditis, Endokarditis, Peritonitis und Arthritis. Untersuchungsmethode: - Mikroskopischer Nachweis durch Immunfluoreszenz - DNA-Nachweis mittels PCR - Antikörpernachweis (ELISA) Da der kulturelle Erregernachweis aufwendig und wenig sensitiv ist, erfolgt die Diagnostik am IHM mittels Immunfluoreszenz oder mittels der Ligase-Kettenreaktion (LCX). Untersuchungsmaterial: Atemwege: Die Materialien sollten zellreich sein, da Chlamydien nur intrazellulär wachsen. Trachealsekret, BAL, bei Kindern in Ausnahmefällen tiefe Rachenabstriche, besser oropharyngeale Absaugungen, Sputum ist ungeeignet. Urogenitaltrakt: Urethralabstriche, Erststrahlurin für die PCR, Serum zum Antikörpernachweis Konjunktivitis: Konjunktivalabstriche. Probengefäße: Universalabstrichtupfer mit oranger Kappe, Universal-Probenröhrchen mit blauem Verschluss, Objektträger mit markierten Testfeldern für die Immunfluoreszenz (Tel.: 20146918). Materialentnahme: Urethralabstrich: Der Abstrichtupfer wird 2-3 cm tief in die Harnröhre eingeführt. Drehbewegungen bei der Entnahme sollen erreichen, dass möglichst viele mit Chlamydien infizierte Epithelzellen am Tupfer haften. Die Patienten sollten mindestens 1 h vor der Probenentnahme nicht mehr uriniert haben. Seite 132 von 281 Konjunktivalabstrich: Die Abstriche werden durch Auswischen des unteren Konjunktivalsacks mit sterilen Dacrontupfern, die vorher mit einem flüssigen Transportmedium befeuchtet worden sind, gewonnen. Auch wenn nur ein Auge entzündet ist, sollten stets beide Augen abgestrichen werden (ein Abstrich dient zur Kontrolle). Rachenabstrich, Trachealsekret: siehe Infektionen des Respirationstraktes Objektträger für die Immunfluoreszenz: Tupfer kräftig auf dem Testfeld des Objektträgers ausrollen, so dass die Testfläche bedeckt ist, dann Material kurz trocknen lassen, mit Methanol 5 min lang fixieren und lufttrocknen. Lagerung und Transport: - Material für die PCR: ≤ 2 h bei RT oder bis zu 24 h bei 4°C - Objektträger für die Immunfluoreszenz: ≤ 1 h bei RT in bruchsicheren Gefäßen (Transportküvette) oder Lagerung bis zu 24 h bei 4°C. Dauer der Untersuchung: PCR: 1 Tag, Immunfluoreszenz: 4 h. Seite 133 von 281 Clostridium spp. Clostridium botulinum, Clostridium difficile, Clostridium perfringens, Clostridium tetani Klinik: C. botulinum: Botulismus als Lebensmittelintoxikation, Wundbotulismus C. difficile: Antibiotika-assoziierte Diarrhoe, pseudomembranöse Kolitis, wässrige Diarrhoe, toxisches Megacolon, Darmperforation, Sepsis C. perfringens: Gasbrand, Myositis. Untersuchungsmethode: - C. botulinum: Toxinnachweis mittels Tierversuch aus Serum, Lebensmitteln - C. difficile: Nachweis von C. difficile-Toxin A und B mittels ELISA Kultur (größere Sensitivität als der Toxinnachweis) Aufgrund der höheren Sensitivität der Kultur, werden von allen Toxin-negativen Stühlen Kulturen angelegt Resistenzbestimmung nach Rücksprache mit dem Labor (MHK-Bestimmung) - C. perfringens: Mikroskopie: Gramfärbung Kultur mit Resistenzbestimmung (MHK-Bestimmung) - C. tetani: Toxinnachweis mittels Tierversuch aus Serum bzw. aus Wundsekreten. Untersuchungsmaterial: - C. botulinum: Serum, Lebensmittelrückstände, Speisereste, Mageninhalt, Wundsekrete bei Wundbotulismus - C. difficile: Stuhl (nur Einsendung von flüssigem Stuhl ist sinnvoll), Blutkulturen bei V. a. systemische Infektion - C. perfringens: Wundabstriche, Wundsekrete, intraoperative Gewebeproben, Abszessmaterial, Punktate - C. tetani: Serum, Wundsekrete. Seite 134 von 281 Probengefäße: Blutkulturflaschen, Universal-Probenröhrchen mit blauem Verschluss, Universalabstrichtupfer mit blauer Kappe. Lagerung und Transport: - C. botulinum: Serum: ≤1 h bei RT oder bis zu 24 h bei 4°C Wundsekrete: ≤1 h bei RT oder bis zu 24 h bei 4°C - C. difficile: Stuhl: ≤ 2 h bei RT oder bis zu 24 h bei 4°C - C. perfringens: ≤1 h bei RT, ist das nicht möglich, bis zu 24 h im Transportmedium (z. B. Port-A-Cul-Röhrchen) bei RT - C. tetani: Serum: ≤1 h bei RT oder bis zu 24 h bei 4°C Wundsekrete: ≤1 h bei RT oder bis zu 24 h bei 4°C. Dauer der Untersuchung: - C. botulinum: Tierversuch: 1 - 5 Tage. Ein negativer Befund wird nach 5 Tagen erstellt. - C. difficile: Toxinnachweis: 1 Tag, Kultur: 2-3 Tage. Ein negativer Befund wird nach 3 Tagen erstellt. - C. perfringens: Mikroskopie: 2 h, Kultur: 2-5 Tage. Ein negativer Befund wird nach 5 Tagen erstellt. - C. tetani: Tierversuch:1 - 5 Tage. Ein negativer Befund wird nach 5 Tagen erstellt. Erkrankung, Tod und Krankheitsverdacht sind meldepflichtig (Tetanus, Botulismus)! Seite 135 von 281 Corynebacterium diphtheriae - Diphtherie Ein Verdacht auf Diphtherie sollte immer im Labor angemeldet werden, ferner sollte der Dienstarzt verständigt werden, um eine optimale Materialanlage auf neu herzustellenden Nährmedien zu garantieren. Klinik: Diphtherie der Atemwege und in seltenen Fällen Hautdiphtherie durch toxinbildende Stämme. Die Hautmanifestation der Diphtherie kann sich auf 3 verschiedene Arten äußern: - durch Infektion der intakten Haut (aus einer pustulösen Läsion geht ein Ulkus hervor; der Ulkusboden ist mit einer grau-weißen Membran bedeckt) - durch Wundinfektionen, deren Wundfläche mit einer Membran bedeckt ist - durch Superinfektion ekzematöser Haut Endokarditis, Osteomyelitis, septische Arthritis durch nicht-toxigene Stämme. Untersuchungsmethode: - Kultur und Resistenzbestimmung der Isolate - Nachweis des Toxingens mittels PCR aus Kulturen (externe Untersuchung am Konsiliarlabor für Diphtherie; Max von Pettenkofer-Institut, Pettenkoferstraße 9a, 80336 München, Tel.: 089-5160-5200) - Antikörpernachweis (Impfstatus) Untersuchungsmaterial: Zum Nachweis von Corynebacterium diphtheriae sollten immer mehrere Abstriche vor Gabe der Antibiotika oder des Antitoxins aus Rachen, Nase oder Tonsillen sowie von der Haut abgenommen werden. Probengefäße: Universal-Abstrichtupfer mit blauer Kappe, Pseudomembranen mit wenig physiologischer NaCl-Lösung in Universal-Probenröhrchen mit blauem Verschluss. Materialentnahme: Rachen- und Tonsillenabstriche sollten am besten unter den Pseudomembranen entnommen werden (diese mit einer sterilen Pinzette hochhalten). Außerdem sollte ein Stück der Pseudomembran in einem sterilen Gefäß eingesandt werden. Sinnvoll ist die Entnahme von Serum zur Bestimmung des Impfstatus des Patienten. Seite 136 von 281 Lagerung und Transport: umgehend bei Raumtemperatur, ist dies nicht möglich Lagerung bis zu 24 h bei RT. Dauer der Untersuchung: Der Nachweis von Corynebacterium diphtheriae erfolgt kulturell. Nach Isolation der Keime muss der Nachweis des Toxingens mittels PCR am Konsiliarlabor (Max von PettenkoferInstitut in München) erbracht werden. Dadurch verlängert sich die Dauer der Untersuchung auf ca. 5-6 Tage. Seite 137 von 281 Coxiella burnetii Q-Fieber tritt nach Exposition zu symptomlos erkrankten Haustieren (Schafe, Rinder oder Ziegen) auf. Die Erreger werden in großen Mengen mit dem Kot, Urin oder der Milch ausgeschieden und bleiben monatelang infektiös. Die Infektion erfolgt durch Einatmen des erregerhaltigen Staubs. Die Diagnosestellung erfolgt serologisch, nicht bakteriologisch! Klinik: Die Mehrzahl der Erkrankungen verläuft als milde, selbstlimitierende fieberhafte Erkrankung mit Kopfschmerzen. In schweren Fällen treten Pneumonie, Endokarditis, Hepatitis, seltener Myo- oder Perikarditis sowie Meningitis oder Enzephalitis auf. Die chronische Infektion manifestiert sich als Endokarditis oder Osteomyelitis. Untersuchungsmethoden: - Antikörpernachweis - die kulturelle Anzüchtung und PCR erfolgen in Speziallaboratorien Untersuchungsmaterial: Serum Dauer der Untersuchung: 1 Tag. Seite 138 von 281 Cryptococcus neoformans Klinik: Kryptokokkose, opportunistische Infektion bei immunsupprimierten Patienten, Meningoenzephalitis, Meningitis, selten Befall der Gelenke, Knochen, und der Augen (Chorioretinitis), selten Endokarditis, Abszesse. Untersuchungsmethoden: Mikroskopie (Tuschepräparat, Gramfärbung) Kultur Antigennachweis (Sensitivität 90% - 99%). Untersuchungsmaterial: Antigennachweis: Liquor, Serum, BAL Kultur: Liquor ( 3 - 5 ml), Urin, BAL, Abszessmaterial, Exsudate, Blutkulturen. Probengefäße Universal-Probenröhrchen mit blauem Verschluss. Lagerung und Transport ≤ 2 h bei RT, ist das nicht möglich, bis zu 24 h bei 4°C. Dauer der Untersuchung: Antigennachweis: 2 h Kultur: 2 Tage. Ein Endbefund wird nach 8 Tagen erstellt. Seite 139 von 281 Cryptosporidium spp. Kryptosporidien sind wichtige Infektionserreger des Intestinaltraktes bei immunkompetenten und immunsupprimierten Patienten, insbesondere bei AIDS-Patienten. Klinik: Wässrige, mit großen Flüssigkeitsverlusten einhergehende Durchfälle. Untersuchungsmethode: Mikroskopie mittels KINYOUN-Färbung (modifizierte Ziehl-Neelsen-Färbung). Untersuchungsmaterial: Stuhl Da die Ausscheidung der Zysten unregelmäßig erfolgt, sollten mindestens 3 Stuhlproben untersucht werden, bevor eine Kryptosporidiose ausgeschlossen wird. Probengefäße: Stuhlröhrchen Lagerung und Transport: ≤ 1 h bei RT, eine längere Lagerung ist nicht möglich! Dauer der Untersuchung: 2 h. Seite 140 von 281 Dermatophyten Klinik: Mykosen der Kopfhaut, Nagel- und Hautmykosen. Untersuchungsmethoden: Mikroskopie, Kultur. Untersuchungsmaterial: Haare, Nagelspäne, Hornhautgeschabsel, Hautschuppen, Wundabstriche, Sekrete. Probengefäße: - Universal-Probengefäß mit blauem Schraubverschluss. Materialentnahme: - verdächtige Hautstellen mit Alkohol vorsichtig desinfizieren - danach Hornhautgeschabsel, Nagelspäne oder Hautschuppen vom entzündlichen Randwall abkratzen - in ein trockenes Gefäß überführen, ggf. Zusatz von wenig NaCl. Lagerung und Transport: Bis zu 24 h bei Raumtemperatur. Dauer der Untersuchung Kultur: 1 - 3 Wochen. Ein negativer Befund wird nach 4 Wochen erstellt. Seite 141 von 281 Echinococcus multilocularis Echinococcus granulosus Die mikrobiologische Diagnose einer Echinokokkose erfolgt primär serologisch! Klinik: Zytisch-verdrängende Raumforderungen bei zystischer Echinokokkose durch E. granulosus und infiltrativ-destruierende/metastasierende Läsionen bei alveolärer Echinokokkose durch E. multilocularis. Untersuchungsmethode: Mikroskopischer Direktnachweis von Echinokokkenbestandteilen (Protoskolezes, Häkchen, Kalziumkörperchen, parasitäre Vesikelchen/Membranen) sowie Antikörpernachweis Untersuchungsmaterial: Von der Punktion einer Zyste mit dem V. a. eine alveoläre Echinokokkose ist wegen der Gefahr der Metastasierung Abstand zu nehmen! Bei der Punktion einer Zyset mit V.a. zystische Echinokokkose ist die Gefahr einer anaphylaktischen Reaktion zu bedenken! Punktate von Zysten, Sputum bei V.a. Echinococcus granulosus-Infektion; operativ gewonnenes Material/Gewebe/histologische Schnittpräparate beider angegebenen Echinokokkus-Arten Serum zum Nachweis von Antikörpern. Probengefäße: Universal-Probenröhrchen mit blauem Verschluss, histologische Schnitte bzw. Serumröhrchen. Lagerung und Transport: Bis zu 24 h bei RT oder bei 4°C. Dauer der Untersuchung: Mikroskopischer Direktnachweis: 2 h Serologie: 1 Tag. Seite 142 von 281 Erysipelothrix - Erysipeloid (Schweinerotlauf) Erysipelothrix rhusiopathiae kommt bei Schweinen, Geflügel, Salzwasserfischen und Schalentieren vor, die Übertragung erfolgt durch Hautverletzungen. Systemische Infektionen wie Sepsis und Endokarditis sind möglich. Klinik: Nach einer Verletzung mit kontaminiertem Material zeigt sich an der Eintrittspforte zunächst ein schmerzhaftes, hellrotes Infiltrat, das sich langsam ausbreitet. Untersuchungsmethode: Kultur mit Resistenzbestimmung der Isolate. Untersuchungsmaterial: Wundabstriche, Wundsekrete, Blutkulturen bei Sepsis. Untersuchungsgefäße: Universal-Abstrichröhrchen mit blauer Kappe, Blutkulturflaschen. Lagerung und Transport: Wundsekrete: ≤ 2 h bei RT, ist das nicht möglich, bis zu 24 h bei 4°C. Wundabstriche in Transportmedium: ≤ 24 h bei RT Blutkulturen: bis zu 24 h bei RT. Dauer der Untersuchung: Anzüchtung: 2 Tage; Resistenzbestimmung: 2 Tage. Francisella tularensis - Tularämie Der Erreger der Tularämie, Francisella tularensis, ist ein Keim der Risikogruppe 3. Klinik: Francisella wird in seltenen Fällen durch Bisse von Nagetieren auf den Menschen übertragen. An der Bissstelle entwickelt sich eine papulöse Primärläsion, der nach 2 - 4 Tagen eine regionale Lymphknotenschwellung folgt. Im Vordergrund der Erkrankung stehen Seite 143 von 281 hohes Fieber mit Schüttelfrost, Kopf- und Gliederschmerzen. Bei Verdacht auf eine Tularämie ist die serologische Diagnose dringend erforderlich. Wegen der Gefahr einer Laborinfektion bei Verdacht auf Tularämie unbedingt das Labor benachrichtigen (Tel.: 20146918). Untersuchungsmethode: - Kultur und Resistenzbestimmung; Identifizierung mittels 16 S rRNA Sequenzanalyse - Antikörpernachweis (siehe Leistungsverzeichnis Serologie). Untersuchungsmaterial: Eiter, Lymphknotenpunktate, Gewebebiopsien, Sputum, respiratorische Sekrete, Liquor, Blut, Wundabstriche. Untersuchungsgefäße: Universal-Probengefäße mit blauem Verschluss. Lagerung und Transport: Bis zu 24 h bei RT. Dauer der Untersuchung: Kultur mit Identifizierung: ca. 1 Woche. Meldepflicht! Seite 144 von 281 Giardia duodenalis - Giardiasis Klinik: Akute oder chronische Diarrhoe (Lamblienruhr) mit wässrigen, nicht blutenden Durchfällen, z. T. mit Bauchkrämpfen, Erbrechen und nur selten Fieber. Ein symptomloser Trägerstatus mit Ausscheidung von Zysten ist möglich. Untersuchungsmethode: Mikroskopie (Nachweis von Zysten und Trophozoiten). Untersuchungsmaterial: - Stuhl, Duodenalsekret, ggf. Dünndarmbiopsie - Optimum: Stuhlproben an 3 aufeinanderfolgenden Tagen - bei negativem Befund Duodenalaspirat ggf. Biopsie. Probengefäße: Stuhlröhrchen, Universal-Probenröhrchen (Aspirat) mit blauem Verschluss. Lagerung und Transport: ≤ 1 h bei RT, eine längere Lagerung ist nicht möglich. Dauer der Untersuchung: Mikroskopie: 1 - 2 Stunden. Meldepflicht! Seite 145 von 281 Erreger der HACEK-Gruppe Dazu gehören: Haemophilus influenzae, Haemophilus parainfluenzae, Haemophilus aphrophilus, Haemophilus paraaphrophilus, Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae, Kingella denitrificans. Klinik: Endokarditis, Osteomyelitis, Arthritis, Meningitis, Peritonitis, Abszesse, Wundinfektionen. Die Erreger der HACEK-Gruppe gehören zur Normalflora der Mundhöhle und des oberen Respirationstrakts. Sie verursachen opportunistische oder invasive Infektionen, wenn sie durch kleine Wunden im Mundbereich in die Blutbahn eingeschwemmt werden, z. B. Endokarditis. Untersuchungsmethode: - Kultur mit Resistenzbestimmung der Isolate; Identifizierung ggf. mittels 16S rRNA Sequenzanalyse - Universelle PCR aus sterilen Kompartimenten, z. B. Herzklappen. Untersuchungsmaterial: Blutkulturen, Herzklappen, intraoperativ gewonnenes Gewebe, Punktate, Liquor, Wundabstriche, Sekrete, Abszessmaterial, Biopsien. Probengefäße: Universal-Abstrichröhrchen mit blauer Kappe, Universal- Probenröhrchen mit blauem Verschluss, Weithalsgefäße mit BHI-Bouillon (Anforderung unter Tel. : 201-46918) für Herzklappen oder Gewebe. Lagerung und Transport: Flüssige Materialien: ≤2 h bei RT, bei längerer Lagerung Verimpfen in Blutkulturflaschen Abstriche: ≤ 2 h bei RT, ist das nicht möglich, bis zu 24 h in Transportmedium bei RT Herzklappen usw.: ≤ 2 h bei RT, ist das nicht möglich, bis zu 24 h in BHI-Bouillon bei 37°C. Dauer der Untersuchung: Kultur: 2 - 5 Tage, PCR mit Sequenzierung 2 Tage. Seite 146 von 281 Legionella spp. - Legionellose Etwa 90% der Legionellosen werden durch einen der 15 Serotypen von L. pneumophila hervorgerufen, wobei anteilsmäßig die Serotypen 1 (70-80%), 4 und 6 überwiegen. Weitere wichtige humanpathogene Spezies sind: L. micdadei, L. bozmanii, L. dumoffii und L. longbeachae. Klinik: „Atypische“ ambulant erworbene oder nosokomiale Pneumonie (schwerer Verlauf Legionärskrankheit, leichter Verlauf Pontiac Fieber), extrapulmonale Organbeteiligung ist möglich (Sinusitis, Phlegmone, Pankreatitis, Peritonitis, Pyelonephritis, Enzephalitis, Endound Myokarditis). Untersuchungsmethoden: - Kultur (geringe Sensitivität, Spezifität 100%) in Ausnahmefällen nach Rücksprache mit dem Labor! - Direkter mikroskopischer Nachweis mittels Immunfluoreszenz (Sensitivität 35% - 70%, Spezifität 96% - 99%) - DNA-Nachweis mittels PCR (Sensitivität ca. 80%, Spezifität 100%) - Antigennachweis aus Urin, geeignet zu Beginn der Erkrankung (1 - 10 Tage, dann unsicher) in Einzelfällen unter Therapie und noch nach Wochen der Erkrankung positiv, bei der ambulant erworbenen Pneumonie Sensitivität 70%-80 %, Spezifität 99 %, 2malige Wiederholung erhöht die Sensitivität auf 95%; bei der nosokomialen Pneumonie nimmt die Sensitivität in Abhängigkeit von der die Erkrankung verursachenden Serovarianten ab. - Antikörpernachweis für epidemiologische Untersuchungen. Die Serologie ist zur Akutdiagnostik ungeeignet und sollte nur bei epidemiologischen Fragestellungen herangezogen werden. Untersuchungsmaterial: Sputum, Trachealsekret, BAL, Pleurapunktate und Biopsate, Urin für den Antigennachweis. Probengefäße: Sputumröhrchen, Universal-Probenröhrchen mit blauem Verschluss, Urinröhrchen. Seite 147 von 281 Lagerung und Transport: ≤2 h bei RT, ist das nicht möglich, bis zu 24 h bei 4°C. Dauer der Untersuchung: Kultur: 3 - 4 Tage, Immunfluoreszenz: 3 h, PCR: 1 Tag, Antigennachweis: 4 h. Meldepflicht! . Seite 148 von 281 Leishmanien - Leishmaniose Leishmaniosen sind Zoonosen; die Infektion erfolgt über Mücken (Phlebotomen). Die Erkrankung kommt hauptsächlich in tropischen bzw. subtropischen Zonen vor. Fälle aus Mittelmeerländern sind beschrieben. Klinik: - Viszerale Leishmaniose (Kala Azar): Leishmania donovani mit Fieber ohne Periodizität, Hepatosplenomegalie, generalisierter Lymphadenopathie, im späteren Verlauf Hautveränderungen, Anämie. - Kutane Leishmaniose: Leishmania tropica, Leishmania infantum u.a. mit Schwellung, Rötung, Papel und Ulcus der betroffenen Areale. - Mukokutane Leishmaniose: Leishmania brasiliensis u.a. in Südamerika. Untersuchungsmethode: Mikroskopie (Giemsafärbung), Antikörpernachweis (siehe Leistungskatalog Serologie) Untersuchungsmaterial: Knochenmark, Organbiopsate, Punktate, Lymphknotengewebe. Probengefäße: Universal-Probenröhrchen mit blauem Verschluss. Lagerung und Transport: ≤ 2 h bei RT, eine längere Lagerung ist nicht möglich. Dauer der Untersuchung: 1 Tag. Seite 149 von 281 Leptospira spp. - Leptospirose Infektionen mit Leptospiren (L. interrogans) treten nach Hautkontakt mit Wasser auf, das mit dem Urin infizierter Tiere kontaminiert ist. Man findet Leptospirosen z. B. bei Patienten nach Sturz in Tümpel oder Bäche oder nach Auslandsaufenthalten bei Kontakt mit Wasser, z. B. in Sumpfgebieten Asiens oder Südamerikas. Klinik: Leptospiren verursachen 3 Formen der Leptospirose: asymptomatische Infektion, anikterische Leptospirose und ikterische Leptospirose (Morbus Weil). Untersuchungsmethoden: - Kultur (externe Untersuchung) - Antikörpernachweis (positiv ab dem 6. bis 10. Krankheitstag), externe Untersuchung Untersuchungsmaterial: - Blut innerhalb der ersten 10 Tage der Erkrankung - Liquor innerhalb der ersten 10 Tage der Erkrankung - Urin ab der zweiten Krankheitswoche - Serum für die Serologie ab der 2. Krankheitswoche Bei der Entnahme von Urin muss darauf geachtet werden, dass der Urin frisch ist. Probengefäße: Spezialgefäße vom Labor anfordern (Tel.: 201-46918) Da Leptospiren nur in Spezialnährmedien wachsen, muss bei klinischem Verdacht das Labor verständigt und die Untersuchungsmaterialien in die entsprechenden Nährmedien eingeimpft werden (Tel.: 201-46918). Die Beimpfung der Nährmedien erfolgt entsprechend der Vorschriften des Referenzlabors. Alle Untersuchungen zum Nachweis von Leptospiren werden im Bayerischen Landesamt für Gesundheit und Lebensmittelsicherheit, Veterinärstraße 2, 85764 Oberschleißheim, (Tel.: 089-31560-322) durchgeführt. Dauer der Untersuchung: Die Dauer der Untersuchung beträgt ca. 1 Woche. Meldepflicht! Seite 150 von 281 Listeria spp. - Listeriose Listerien kommen in der Umwelt vor und lassen sich im Stuhl von ca. 3 % aller Menschen nachweisen. Klinik: Listerien verursachen in der Schwangerschaft eine Chorioamnionitis. Von dieser ausgehend kann es zu einer Infektion des Fötus kommen mit Abort, Totgeburt oder Infektion des Kindes. Bei Neugeborenen können Listerien Pneumonien und Sepsis (Frühmanifestation) bzw. Meningitis und Enzephalitis (Spätmanifestation) verursachen. Bei immunsupprimierten und alten Patienten können die Erreger zu Sepsis und Meningitis führen. Untersuchungsmethoden: - Kultur mit Resistenzbestimmung der Isolate - DNA-Nachweis mittels PCR (externe Untersuchung am Institut für Medizinische Mikrobiologie der Universität Mannheim, Theodor-Kutzer-Ufer 1-3, 68167 Mannheim, Tel.: 0621-3832224). Die Untersuchung spezifischer Antikörper hat keine Aussagekraft. Sie wird nicht empfohlen und daher am IHM nicht durchgeführt. Untersuchungsmaterial: - Abstriche von Zervix, Plazenta, Vagina und Rektum - Amnionflüssigkeit - Mekonium, Stuhl - Blut und Liquor Probengefäße: Universal-Abstrichtupfer mit blauer Kappe, Blutkulturflaschen, Liquorröhrchen, UniversalProbenröhrchen mit blauem Verschluss. Lagerung und Transport: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. Dauer der Untersuchung: Kultur 2 Tage, Resistenzbestimmung 1 Tag, PCR, da externe Untersuchung bis 1 Woche. Meldepflicht! Seite 151 von 281 MRSA – Methicillin-resistenter Staphylococcus aureus MRSA sind S. aureus-Stämme, die durch Expression des mecA-Gens eine Resistenz gegenüber Methicillin aufweisen. Sie sind resistent gegenüber allen Betalaktamantibiotika. Klinik: Wundinfektionen, eitrige Abszesse, Hautinfektionen, Sepsis, Endokarditis, Osteomyelitis, Arthritis, häufig als Kolonisationskeim auf Haut und Schleimhaut. Untersuchungsmethode: - Mikroskopie (Gramfärbung) - Kultur und Resistenzbestimmung der Isolate - bei unklarem Ergebnis mecA-Gen mittels PCR (Referenzmethode) aus Kulturen - Direkter PCR-Nachweis von MRSA in Nasen- und Wundabstrichen (Screening). Untersuchungsmaterial: - V. a. Infektion: Abstriche aller Art, Sekrete, Blutkulturen, Punktate, Liquor usw. - Screening - Kultur: Nasenabstrich (einen Abstrichtupfer für beide Nasenlöcher verwenden), Rachenabstrich, Leistenabstrich, Axillaabstrich. - Screening - PCR: Nasenabstrich (einen Abstrichtupfer für beide Nasenlöcher verwenden), Wundabstrich. Probengefäße: Universal-Abstrichtupfer mit blauer Kappe Lagerung und Transport: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. Dauer der Untersuchung: Kultur: 2 Tage, Resistenzbestimmung 1 Tag, PCR 3 h. Der direkte PCR-Nachweis auf MRSA wird von Montag bis Freitag täglich im IHM durchgeführt; Annahmeschluss 15.15 h. Ein positives oder negatives Ergebnis wird am Tag des Probeneingangs erstellt. Positive Proben werden kulturell überprüft. Seite 152 von 281 Mycoplasma hominis Klinik: Mycoplasma hominis gilt als seltener Erreger der Pyelonephritis, des postpartalen Fiebers sowie der Sepsis und Meningitis (Hydrocephalus) bei Neu- und Frühgeborenen. Untersuchungsmethoden: - Kultur Die Resistenzbestimmung der angezüchteten Keime erfolgt nur in Ausnahmefällen und nach telefonischer Rücksprache. - DNA-Nachweis mittels PCR (externe Untersuchung am Max von Pettenkofer-Institut, Pettenkoferstraße 9a, 80336 München; Tel.: 089-5160-4200). Untersuchungsmaterial: - Urin zur Diagnose der Pyelonephritis (Nativurin nur bei schnellem Transport) - Blut zur Diagnose des postpartalen Fiebers - Liquor bei Hydrocephalus von Neugeborenen und Frühgeborenen - Wundabstriche oder Wundsekrete. Probengefäße: Urinröhrchen, Universal-Abstrichröhrchen mit blauem Verschluss, Spezialmedium (Mykoplasmen-Medium) zum Nachweis von urogenitalen Mykoplasmen (Anforderung Tel.: 201- 46918). Die normalen Blutkultursysteme sind zur Anzucht von Mykoplasmen nicht geeignet. Für die Untersuchung von Blut müssen 2 ml Heparinblut (1 mg/10 ml) in 9 - 18 ml MykoplasmenBouillon eingesandt werden. Lagerung und Transport: - Nativurin und Abstriche ohne Transportmedium: ≤ 2 h bei RT, eine längere Lagerung ist nicht möglich. - Abstriche in Transportmedium: bis zu 24 h bei 4°C, darüber hinaus bei minus 70°C - Blut in Mykoplasmen-Bouillon: ≤ 2 h bei RT. Dauer der Untersuchung: Kultur: 4 - 7 Tage; PCR 1 Tag. Seite 153 von 281 Mycoplasma pneumoniae Klinik: M. pneumoniae gilt als Erreger von Infektionen der oberen (Pharyngitis, Rhinitis, Otitis media) und unteren Atemwege (Bronchitis, Pneumonie). Darüber hinaus sind extrapulmonale Infektionen möglich: Meningitis, Enzephalitis, Fazialisparesen, transverse Myelitis, Myokarditis, Pankreatitis, Nephritis, Hepatitis. Untersuchungsmethoden: - Kultur nur bei epidemiologischen Fragestellungen - DNA-Nachweis mittels PCR zum Nachweis der Keime aus den Sekreten der Atemwege, nested PCR zum Nachweis der Keime aus Liquor (Sensitivität 70%-95%, Spezifität 100%) - Antikörpernachweis (ELISA, Immunoblot). Untersuchungsmaterialien: - Trachealsekret, BAL, Sputum ist wenig geeignet - in Ausnahmefällen tiefe Rachenabstriche, besser nasopharyngeale Absaugung - Liquor bei extrapulmonalen Infektionen. Probengefäße: Sputumröhrchen für Nativmaterial, Universal-Probengefäß mit blauem Verschluss, UniversalAbstrichröhrchen mit blauer Kappe. Lagerung und Transport: Nativmaterial ohne Transportmedium: ≤ 2 h bei RT, bei längerer Lagerung Einfrieren bei minus 70°C und Versand auf Trockeneis Materialien in Transportmedium: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. Dauer der Untersuchung: PCR: 1 Tag; nested PCR: 2 Tage; Kultur bis zu 21 Tagen, Antikörpernachweis: ELISA 1 Tag, Immunoblot: 2 Tage; die Untersuchungen werden nicht täglich durchgeführt. Seite 154 von 281 Mykobakterien - Mycobacterium tuberculosis - Komplex In Deutschland kommt am häufigsten Mycobacterium tuberculosis, selten M. bovis (Reservoir bei Rindern) vor. In sehr seltenen Fällen Infektionen durch M. microti (Vorkommen bei Nagern). Aufgrund ihrer engen genotypischen und phänotypischen Verwandtschaft werden M. tuberculosis, M. bovis, M. bovis BCG, M. africanum (in Afrika vorkommend) und M. microti zum Mycobacterium tuberculosis-Komplex zusammengefasst. Klinik: Lungentuberkulose, Miliartuberkulose, extrapulmonale Erkrankungen, bei immun- supprimierten Patienten Impf-Tuberkulose durch den Tuberkulose-Impfstamm M. bovis BCG. Untersuchungsmethoden: - Mikroskopie der Nativmaterialien (Ziehl-Neelsen-Färbung) - Kultur mit Resistenzbestimmung der Isolate - DNA-Nachweis mittels PCR; Identifikation auf Speziesebene durch 16S rRNASequenzanalyse. Die Mikroskopie wird anhand des nach Ziehl-Neelsen gefärbten Direktpräparates beurteilt. Die Menge nachgewiesener säurefester Stäbchen (SFS) wird semiquantitativ angegeben: +/-: 1-3 SFS/Präparat +: 4-10 SFS/Präparat ++: 10-100 SFS/Präparat +++: 1-10 SFS/Gesichtsfeld ++++: > 10 SFS/Gesichtsfeld Nachweisgrenze: Mikroskopie: 105 Mykobakterien/ml Sputum bzw. bei 104/ml bei angereicherten Proben PCR: 102-103 Mykobakterien/ml Sputum Kultur: bei 10-100 Mykobakterien/ml Sputum. Die Kultur hat die größte Sensitivität. Bei wenig Untersuchungsmaterial muss der Kultur vor der PCR der Vorzug gegeben werden. Untersuchungsmaterialien: - Sputum oder indiziertes Sputum, BAL, Tracheal- und Bronchialsekret - Magensaft in Natriumphosphatlösung (Tel.: 201-46918) - Urin Seite 155 von 281 - Nativblut (Heparin- oder Citratblut) - Liquor - Biopsate und Wundsekrete (nativ, nicht in Abstrich-Röhrchen!), Punktate. Bei der Lungentuberkulose sollte die Diagnostik aus drei am Morgen gewonnenen Sputumproben erfolgen. Ist dies nicht möglich, so sollte induziertes Sputum gewonnen werden. Weiterhin kommt die dreimalige Untersuchung von Magensaft in Frage. Invasiv gewonnene Materialien haben eine größere Sensitivität, insbesondere die BAL. Zum Nachweis von Mycobacterium tuberculosis aus Blut sind die herkömmlichen Blutkultursysteme nicht geeignet. Es sollten 10 - 12 ml Heparin- oder Citratblut eingesandt werden, die dann im Labor auf Spezialnährmedien verimpft werden. Untersuchungsmengen: - Sputum ≥ 2 ml - Bronchialsekret 5 - 10 ml - Magensaft (immer bei Kindern) 20 - 30 ml - BAL, Pleurapunktat 10 - 30 ml - Urin (am besten konzentrierter Morgenurin) 30 - 50 ml - Liquor ≥ 5 ml - Blut (Heparin- oder Citratblut) 5 - 10 ml - Stuhl etwa 5 g (bohnengroß) - Darmbiopsie bei HIV-Patienten in 1 ml NaCl-Lösung Diese Mengen müssen unbedingt eingehalten werden! Bei Einsendung von kleineren Mengen schließt ein negativer Befund eine Tuberkulose nicht aus! Lagerung und Transport: ≤ 24 h bei 4°C. Interpretation: Ein positives Mikroskopie-Ergebnis oder Wachstum in Flüssigmedien erlaubt noch keine Artdiagnose. Ein negatives PCR-Ergebnis schließt eine Tuberkulose nicht aus! Dauer der Untersuchung: Kultur: je nach der Konzentration der Erreger 2 - 4 Wochen; ein negativer Befund wird nach 10 Wochen erstellt; Resistenzbestimmung: ca. 2 Wochen; PCR mit Sequenz: 4 Tage. Seite 156 von 281 Nicht-tuberkulöse Mykobakterien (NTM) Klinik: - Pulmonale Infektionen: M. avium-intracellulare-Komplex, M. kansasii, M. malmoense, M. chelonae, M. abscessus, M. xenopi - Haut- und Weichteilinfektionen: M. marinum, M. ulcerans, M. fortuitum, M. chelonae, M. abscessus, M. ulcerans, M. haemophilum - Wund- und Fremdkörperinfektionen: M. chelonae, M. abscessus, M. fortuitum - Systemische Infektionen: M. avium, M. kansasii (bei HIV-positiven Patienten), M. abscessus, M. chelonae, M. haemophilum (bei HIV-negativen Patienten) - Lymphadenitis: M. avium, M. scrofulaceum, M. malmoense. Untersuchungsmethoden: - Mikroskopie (Ziehl-Neelsen-Färbung) - Kultur, Identifizierung durch 16S rRNA-Sequenzanalyse - Resistenzbestimmung, ausgenommen schnellwachsende Mykobakterien (externe Untersuchung im Nationalen Referenzzentrum für Mykobakterien, Parkallee 35, 23845 Borstel, Tel.: 045-37188210) - PCR der Nativmaterialien (externe Untersuchung in Borstel). Untersuchungsmaterialien: - Sputum oder indiziertes Sputum, BAL, Tracheal- und Bronchialsekret - Blut (Heparin- oder Citratblut) - Biopsate und Wundsekrete, Punktate - Gewebeproben, insbesondere Lymphknotenextirpate (in 0,5 ml sterilem NaCl aufnehmen) Zum Nachweis von NTM aus Blut sind die herkömmlichen Blutkultursysteme nicht geeignet. Es sollten 10 -12 ml Heparin- oder Citratblut eingesandt werden. Untersuchungsmengen: - Sputum ≥ 2 ml - Bronchialsekret 5 - 10 ml Seite 157 von 281 - BAL, Pleurapunktat 10 - 30 ml - Blut (heparinisiert oder Citratblut) 5 - 10 ml - Biopsiematerial in 1 ml NaCl-Lösung Lagerung und Transport: innerhalb von 24 h bei 4°C. Dauer der Untersuchung: Kultur: je nach Konzentration und Wachstumsgeschwindigkeit 1 Woche bis zu 8 - 12 Wochen; ein negativer Befund wird nach 12 Wochen erstellt. Seite 158 von 281 Neisseria gonorrhoeae - Gonorrhoe Gonokokken sind sehr empfindlich gegenüber Umwelteinflüssen und Kälte. Sie sterben in der Umwelt sehr schnell ab. Daher müssen für den Transport des Untersuchungsmaterials spezielle Transportmedien benutzt werden. Klinik: Gonorrhoe, Urethritis, Vaginitis, Endometritis, Salpingitis, Adnexitis, infektiöse Arthritis, Sepsis, bei Neugeborenen Konjunktivitis . Untersuchungsmethoden: - Mikroskopie (Gramfärbung) - Kultur mit Resistenzbestimmung der Isolate. Untersuchungsmaterialien: Abstriche (Urethra, Konjunktiva, Vagina, Zervix), Ejakulate, Gewebebiopsien, Sekrete, Gelenkpunktate, Augen- und Rachenabstriche. Die Abstriche müssen entweder - sofort auf Selektivmedien (Thayer-Martin-Agar, Anforderung über Tel.: 201-46918) verimpft und sofort ins Labor gebracht werden oder - in einem speziellen Transportmedium (GO-Slide, Auskunft über Tel.: 201-46939) transportiert werden. Probengefäße: - Sterile Universal-Röhrchen mit Transportmedium - Kommerzielle Transportmedien, z. B. GO-Slide Gefäße ohne Transportmedien können nicht verwendet werden!! Lagerung und Transport : ≤ 1 h nach Abimpfen auf die Agarplatte oder bis zu 24 h im Transportmedium. Ein Transport von Materialien ohne Verwendung eines Transportmediums ist nicht möglich! Dauer der Untersuchung: Kultur: 2-5 Tage, Resistenzbestimmung 2 Tage. Ein negativer Befund wird nach 5 Tagen erstellt. Seite 159 von 281 Nocardia spp. - Nokardiose In Deutschland kommen in erster Linie N. asteroides und N. farcinica, seltener N. abscessus, N. paucivorans und N. nova vor. N. brasiliensis führt eher zu superfizialen Nokardiose und kommt in den Tropen vor. Klinik: Nokardien verursachen v. a. bei Immunsupprimierten oder bei Patienten nach einer Organtransplantation Infektionen: pulmonale Nokardiose (Pneumonie), cerebrale Nokardiose (granulomatöse Infektion des ZNS) häufig durch hämatogene Ausbreitung aus der Lunge und disseminierte Nokardiosen (Endokarditis). Nokardiosen der Haut kommen auch bei immunkompetenten Patienten v. a. in den Tropen, in Deutschland sehr selten vor. Untersuchungsmethoden: - Mikroskopie (Gramfärbung, modifizierte Ziehl-Neelsen-Färbung) - Kultur und Resistenzbestimmung der Isolate; Speziesidentifizierung mittels 16S rRNASequenzanalyse. Untersuchungsmaterial: Sputum oder besser bronchoskopisch gewonnenes Material, Liquor, Punktate, Abszessmaterial, Hirnbiopsien, Wundabstriche, Wundsekrete. Untersuchungsgefäße: Universal-Probenröhrchen mit blauem Schraubverschluss, Universal-Abstrichröhrchen mit blauer Kappe. Lagerung und Transport: ≤ 24 h bei RT Da Nokardien sehr empfindlich gegenüber Kälteeinflüssen sind, sollte eine Kühlung des Untersuchungsmaterials unterbleiben. Dauer der Untersuchung: Kultur: 4 - 7 Tage, Sequenzanalyse bis zu 14 Tagen. Ein negativer Befund wird nach 2 Wochen erstellt. Gezielte Untersuchungsanforderung, da die Kulturen länger bebrütet werden müssen! Seite 160 von 281 Pneumocystis jirovecii Klinik: Pneumocystis jirovecii (früher Pneumocystis carinii) verursacht bei immunsupprimierten Patienten eine Pneumonie. Extrapulmonale Manifestationen sind selten. Untersuchungsmethode: - Mikroskopie (Giemsafärbung oder mit fluoreszierenden Antikörpern) - Nested PCR Untersuchungsmaterialien: Das Untersuchungsmaterial muss Material aus den Alveolen enthalten. - BAL, transtracheale Biopsate (Sensitivität 80% - 90%). - induzierte Sputumproben, Bronchial- und Trachealsekreten (Sensitivität 50% - 60%) - nicht geeignet sind Sputum, Rachenabstriche. Transportgefäße: Universal-Probenröhrchen mit blauem Verschluss. Lagerung und Transport: ≤ 24 h bei 4°C. Dauer der Untersuchung: Mikroskopie: 3 h, PCR: 2 Tage. Für die Untersuchung ist eine gezielte Anforderung notwendig, da Spezialfärbungen durchgeführt werden. Seite 161 von 281 Staphylococcus spp. S. aureus, S. epidermidis-Gruppe, S. saprophyticus Koagulasenegative Staphylokokken (KN-Staphylokokken) gehören zur Normalflora der Haut und Schleimhäute und werden daher nicht in jedem Untersuchungsmaterial differenziert und ausgetestet. Klinik : S. aureus : Wundinfektionen, Hautinfektionen, eitrige Sepsis, Abszesse, Endokarditis, Impetigo und Osteomyelitis, andere Arthritis, Staphylococcal Scalded Skin Syndrome, Toxic Shock Syndrome S. epidermidis-Gr. : Endokarditis, Katheter-assoziierte Infektionen, Fremdkörperinfektionen S. saprophyticus: Infektionen der Harnwege. Untersuchungsmethoden: - Mikroskopie (Gramfärbung) - Kultur und Resistenzbestimmung der Isolate (MHK-Bestimmung) Differenzierung und Austestung von S. aureus, S. saprophyticus und klinisch relevanten KN-Staphylokokken - Nachweis von Panton-Valentin-Leukozidin (PVL) bei S. aureus-Stämmen mittels PCR nach Rücksprache mit dem Labor. Untersuchungsmaterial: Abstriche aller Art, Sekrete, Punktate, Biopsien, Blutkulturen, Liquor, Fremdkörper, Herzklappen. Untersuchungsgefäße: Universal-Abstrichtupfer mit blauer Kappe, Universal-Probenröhrchen mit blauem Verschluss. Lagerung und Transport: ≤ 2 h bei RT, ist das nicht möglich Lagerung bis zu 24 h bei 4°C. Dauer der Untersuchung: Kultur mit Resistenzbestimmung 2 - 3 Tage; PVL-PCR: 1 Tag. Seite 162 von 281 SSSS = Staphylococcal Scalded Skin Syndrome Erreger: Staphylococcus aureus mit exfoliativen Toxinen A und B Nachweis: Exfoliativtoxine (Gene ETA oder ETB) mittels PCR im Referenzlabor (RobertKoch-Institut, Burgstraße 37, 38855 Wernigerode; Tel.: 039-43679246). TSS = Toxic Shock Syndrome Erreger: Staphylococcus aureus mit Toxic Shock Syndrome Toxin 1 (TSST-1), z. T. auch mit Enterotoxin A und B Nachweis: Toxinnachweis von TSST-1, Enterotoxin A und B, PCR zum Nachweis der Gene tst, sea und seb, im Referenzlabor (Robert-Koch-Institut, Burgstraße 37, 38855 Wernigerode; Tel. 039-43679246). Seite 163 von 281 MRSA Methicillin-resistenter S. aureus siehe unter M Seite 164 von 281 Streptococcus spp. Klinik: - S. pyogenes (A-Streptokokken): Tonsillitis, Scharlach (A-Streptokokken mit erythrogenem Toxin), Erysipel, Sepsis, Toxic Shock Syndrome, nekrotisierende Fasciitis u. a. - S. agalactiae (B-Streptokokken): Sepsis und Meningitis bei Neugeborenen, Harnwegsinfektionen - C-, F-, G-Streptokokken: Sepsis, Wundinfektionen, Abszesse - S. pneumoniae (Pneumokokken): Pneumonie, Otitis, Meningitis, Sepsis - Streptokokken der Viridansgruppe: Endokarditis. Untersuchungsmethoden: Kultur mit Resistenzbestimmung (A-Streptokokken nur bei Penicillinallergie). Untersuchungsmaterial: Abstriche aller Art, Blutkulturen, Liquores, usw. Untersuchungsgefäße: Universal-Abstrichtupfer mit blauer Kappe, Universal-Untersuchungsröhrchen mit blauem Verschluss. Lagerung und Transport ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. STSS = Streptococcal Toxic Shock Syndrome Erreger: Streptococcus pyogenes (A-Streptokokken), B-Streptokokken und C- Streptokokken mit erythrogenen Toxinen Nachweis: Nachweis der erythrogenen Toxine (SPE, SPA, SPB, SPC) mittels ELISA und PCR zum Nachweis der Gene speA, speB und speC im Referenzzentrum (Institut für Hygiene und Mikrobiologie, Pauwelstraße 30, 52057 Aachen, Tel.: 0241-808-9787). Seite 165 von 281 Ureaplasma urealyticum Klinik: Ureaplasma urealyticum verursacht Infektionen des Urogenitaltraktes (Urethritis) und ist ein seltener Erreger der Sepsis und Pneumonie bei Frühgeborenen. Darüber kann eine urogenitale Besiedlung in der Schwangerschaft zur Frühgeburtlichkeit führen. Untersuchungsmethoden: - Kultur Da auch die Harnröhre von Gesunden mit Ureaplasmen besiedelt sein kann, sollte der Nachweis der Keime zur Diagnose der Urethritis quantitativ geführt werden. Untersuchungsmaterial: - Trachealsekret, Bronchialsekret, Rachenabstriche bei Frühgeborenen - Abstriche aus dem Urogenitaltrakt (Vagina, Urethra), Sperma, Prostatasekret - Liquor bei Hydrocephalus (bei Frühgeborenen) - Blut bei V. a. Sepsis bei Frühgeborenen Die normalen Blutkultursysteme sind zur Anzucht von Mykoplasmen nicht geeignet. Für die Untersuchung von Blut müssen 2 ml Heparinblut (1 mg/10 ml) in 9 - 18 ml 10 BBouillon (Anforderung unter Tel.: 201-46918) eingesandt werden. Bei Urethritis: - erster Morgenurin (Transport ≤ 2 h ) - Urethralsekret (falls möglich eine definierte Millilitermenge) in 2 ml 10 B-Medium (Anforderung unter Tel.: 46939) - Urethralabstrich. Materialentnahme bei Urethritis: - das Untersuchungsmaterial (Urethralsekret bzw. -abstriche ) sollte, falls möglich, mit einer kalibrierten Platin- bzw. Plastiköse entnommen werden und in 2 ml 10 B-Bouillon inokuliert werden - für die Entnahme von Urethralabstrichen sollten Dacrontupfer verwendet werden, da Baumwolltupfer Inhibitoren enthalten können. Probengefäße: Universal-Abstrichröhrchen mit blauer Kappe, Universal-Probenröhrchen mit blauem Verschluss. Seite 166 von 281 Lagerung und Transport: - Abstriche ohne Transportmedium: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24h bei 4°C, bei längerem Transport Lagerung bei minus 70°C. - Blut: in 10B-Bouillon ≤ 2 h bei RT, ist das nicht möglich, bis zu 24 bei 4°C - Urin: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. Dauer der Untersuchung: Kultur: 3 - 5 Tage; ein negativer Befund wird nach 4 Tagen erstellt. Seite 167 von 281 Vibrio cholerae - Cholera Klinik: Cholera Untersuchungsmethode: Mikroskopie Kultur mit Resistenzbestimmung der Isolate. Untersuchungsmaterial: Stuhl Der Erreger ist sehr empfindlich gegenüber Umwelteinflüssen. Der Stuhl muss daher in alkalischem Peptonwasser (Anforderung über Tel.: 201-46918) transportiert werden! Probengefäße: Probengefäß mit alkalischem Peptonwasser. Lagerung und Transport: ≤ 1 h bei RT, eine längere Lagerung ist nicht möglich. Dauer der Untersuchung: 2 Tage Meldepflicht! Seite 168 von 281 Yersinia spp. Yersinia enterocolitica, Yersinia pseudotuberculosis. Klinik: Enteritis (Yersinia enterocolitica) mit wässrigen, selten blutigen Durchfällen Pseudoappendizitis (Yersinia pseudotuberculosis) Postinfektiöse Arthritis. Untersuchungsmethode: - Kultur mit Resistenzbestimmung der Isolate - Kultur nach Kälteanreicherung - Serum zum Nachweis von Antikörpern (siehe Leistungsverzeichnis Serologie). Untersuchungsmaterial: Stuhl bei V. a. disseminierte Infektion: Blut, Liquor, Punktate, Urin bei V. a. postinfektiöse Arthritis: Serum zum Antikörpernachweis. Probengefäße: Stuhlröhrchen, Blutkulturflaschen, Universal-Probenröhrchen mit blauem Verschluss, Serumröhrchen Lagerung und Transport: ≤ 2h bei RT, ist das nicht möglich, bis zu 24 h bei 4°C. Dauer der Untersuchung: Kultur: 2 Tage, Kälteanreicherung über 10 Tage; ein negativer Befund wird nach 10 Tagen erstellt. Meldepflicht! Seite 169 von 281 IV Untersuchungsmaterialien ------------------------------------------------------------------------------------------------------------------------- Abstriche --------------------------------------------------------------------------------------------------------------------------Augenabstriche (Konjunktivalabstriche) Pharynxabstrich Hautabstriche Rachenabstrich Hautblasen Rektalabstrich Mundabstrich Urethralabstrich Nasenabstrich Vaginalabstrich Nasopharyngealabstrich Wundabstrich Ohrabstrich (Gehörgang, Mittelohr) Zervikalabstrich --------------------------------------------------------------------------------------------------------------------------- Augenabstrich, Konjunktivalabstrich Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium) Materialentnahme: Augenlid ektropieren, mit einem sterilen Tupfer mehrfach über die Konjunktiva streichen, Tupfer in das Transportmedium geben und verschließen. Transport und Lagerung: ≤ 2 h bei RT, falls das nicht möglich, Lagerung bis 24 h bei RT --------------------------------------------------------------------------------------------------------------------------- Hautabstrich Hautabstriche sind nur bei offenen Wunden sinnvoll. Eine Kontamination der Untersuchungsprobe mit physiologischer Hautflora ist meist unvermeidlich. Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium) Materialentnahme: Tupfer entnehmen und mehrfach über das betroffene Hautareal streichen, Tupfer in das Transportmedium geben und verschließen. Transport und Lagerung: ≤ 2 h bei RT, falls das nicht möglich, bis 24 h bei RT Seite 170 von 281 Hautblasen Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium) Materialentnahme: Tupfer entnehmen und mehrfach über das offene Bläschen streichen (möglichst ohne Berührung der gesunden Haut, Tupfer in das Transportmedium geben und verschließen. Geschlossene Blasen mit einer sterilen Kanüle aufstechen; falls möglich Flüssigkeit mit der Spritze aspirieren. Transport und Lagerung: ≤ 2 h bei RT, falls das nicht möglich, Lagerung bis 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Mundabstrich Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium). Materialentnahme: Tupfer entnehmen und mehrfach über das betroffene Areal streichen (möglichst ohne Berührung der gesunden Schleimhaut), Tupfer in das Transportmedium geben und verschließen. Transport und Lagerung: ≤ 2 h bei RT, falls das nicht möglich, Lagerung bis 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Nasenabstrich Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium). Materialentnahme: Tupfer aus der Sterilverpackung entnehmen, mit dem Watteteil des Tupfers die Nasenhöhle des Patienten abstreichen, Tupfer in das Transportmedium stecken und fest verschließen. Bei Screening auf MRSA einen Tupfer für beide Nasenlöcher verwenden. Transport und Lagerung: ≤ 2 h bei RT, falls das nicht möglich, Lagerung bis 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Nasopharyngealabstrich Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium). Materialentnahme: Tupfer vorsichtig entlang der Nasenscheidewand und des Nasenbodens in den Nasopharynx vorschieben, dann rotierend abstreichen. Diese Abstriche dürfen nur ausgeführt werden, wenn die Epiglottis nicht entzündet ist! Transport und Lagerung: ≤ 2 h bei RT, falls das nicht möglich, Lagerung bis 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------Seite 171 von 281 Ohrabstrich (Gehörgang) Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium), Universal-Abstrichtupfer mit oranger Kappe (dünnere Tupfer). Materialentnahme: Gehörgang: - Ohrmuschel vorher desinfizieren, Krusten entfernen - mit einem Abstrichtupfer den Gehörgang rotierend abstreichen - bei einem tiefen Gehörgangabstrich Ohrtrichter verwenden, um eine Kontamination mit Keimen des Außenohres zu vermeiden. Tupferabstrich des Gehörgangs bei Ruptur des Trommelfells: Spekulum in Gehörgang einführen und durch dieses den Abstrich durchführen Transport und Lagerung: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Ohrabstrich (Mittelohr) Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium), Universal-Abstrichtupfer mit oranger Kappe (dünnere Tupfer). Materialentnahme: Punktion und Aspiration bei intaktem Trommelfell: Gehörgang mit Tupfer und physiologischer Kochsalzlösung säubern, dann Punktion und Inzision des Trommelfells (HNO-Arzt) und Aspiration der Mittelohrflüssigkeit. Ruptur des Trommelfells: direkte Aufnahme des Untersuchungsmaterials mit Hilfe eines Spekulums. Transport und Lagerung: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Pharynxabstrich bei Pharyngitis: Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium). Materialentnahme: - Mund mehrmals mit Leitungswasser ausspülen - Zunge mit Spatel nach unten drücken - Tupfer einführen ohne die Lippen, Mundschleimhaut oder Uvula zu berühren - Tupfer unter Druck von oben nach unten über Tonsillen oder horizontal über die Rachenwand streichen. Transport und Lagerung: ≤ 2 h bei RT, falls das nicht möglich, Lagerung bis 24 h bei RT. Seite 172 von 281 Rachenabstrich Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium). Materialentnahme: Mit dem Watteende des Tupfers mehrmals in den Rachen streichen. Kontamination mit gesunder Schleimhaut vermeiden. Abstrich bei Angina Plaut-Vincenti: Der Abstrichtupfer sollte in ein Transportmedium für Anaerobier gegeben werden. Außerdem sollte zur Sicherung der Diagnose ein Grampräparat angefordert werden und die Verdachtsdiagnose auf dem Antragsformular vermerkt werden. Abstrich bei Epiglottitis: Tupferabstriche dürfen nur unter laryngoskopischer oder bronchoskopischer Kontrolle entnommen werden; bei eitrigen Infektionen besteht die Gefahr der Atemwegsobstruktion, stattdessen Entnahme von Blutkulturen. Transport und Lagerung: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Rektalabstrich (MRSA-Screening) Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium). Materialentnahme: Mit dem Watteende des Tupfers mehrmals den Rektalbereich abstreichen. Transport und Lagerung: : ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis 24 h bei 4°C (Kühlschrank). --------------------------------------------------------------------------------------------------------------------------- Urethralabstrich Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium), Universal-Abstrichtupfer mit oranger Kappe (dünnere Tupfer). Materialentnahme: Der Abstrich sollte mindestens 1 h nach dem Wasserlassen abgenommen werden. - Hände desinfizieren und Einmalhandschuhe anziehen - mit dem Watteende des Tupfers in die Urethraöffnung streichen; dabei darauf achten, dass der Tupfer nicht mit der Haut in Berührung kommt (Kontamination mit Hautflora) - Tupfer in Gefäß stecken und Gefäß verschließen. Transport und Lagerung: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis 24 h bei RT. Besonderheiten: Zum Nachweis folgender Keime müssen gesonderte Urethralabstriche abgenommen und in speziellen Transportmedien verschickt werden. Seite 173 von 281 - Neisseria gonorrhoeae Ausstreichen auf Thayer-Martin-Agar oder Spezial-Agarplatte unmittelbar nach der Entnahme Transport ohne Transportmedium (TM) nicht möglich, Lagerung in TM bis zu 24 h bei RT - Chlamydia trachomatis (nativer Abstrich für LCX-PCR) Transport ohne TM ≤ 2 h bei RT, in TM Lagerung bis zu 24 h bei 4°C - Mycoplasma hominis und Ureaplasma urealyticum Transport in Transportmedium (TM) für anspruchsvoll wachsende Keime Transport ohne TM ≤ 2 h bei RT, falls das nicht möglich, bis zu 24 h bei 4°C - Gardnerella vaginalis und Anaerobier Transport ohne TM ≤ 2 h bei RT, falls das nicht möglich, Lagerung bis 24 h bei RT --------------------------------------------------------------------------------------------------------------------------- Vaginalabstrich Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium). Materialentnahme: Einweghandschuhe anziehen, Vagina mit den Fingern etwas spreizen, mit dem Watteende des Tupfers in die Vagina streichen, Kontamination mit der physiologischen Vaginalflora vermeiden. Transport und Lagerung: ≤ 2 h bei RT, falls das nicht möglich, Lagerung bis 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Wundabstrich Lokalisation bitte genau angeben! Ferner Angabe, ob es sich um eine oberflächliche oder tiefe Wunde bzw. um einen intraoperativ entnommenen Wundabstrich handelt. Abstriche tiefer und oberflächlicher Wunden werden im Labor mit unterschiedlichen Methoden bearbeitet! Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium). Materialentnahme: - Wundränder desinfizieren - oberflächlich Schorf abheben, ggf. Wundgrund kürettieren - evtl. vorhandenes Exsudat mit steriler Spritze aspirieren oder mit sterilem Abstrichtupfer entnehmen. Transport und Lagerung: ≤ 2 h bei RT, falls das nicht möglich, Lagerung bis 24 h bei RT. Seite 174 von 281 Zervikalabstrich Probengefäße: Universal-Abstrichtupfer mit blauer Kappe (enthält Transportmedium). Materialentnahme: Für die Entnahme von Zervixsekret müssen Kontaminationen durch Vaginalsekret (SpekulumEinstellung) vermieden werden. - Hände desinfizieren und Einmalhandschuhe anziehen - Vagina mit den Fingern leicht spreizen, Spekulum einführen - mit dem Watteende des Tupfers in die Öffnung des Zervixkanals streichen; dabei darauf achten, dass der Tupfer nicht mit der Schleimhaut der Vagina in Berührung kommt (Kontamination mit Vaginalflora), Tupfer in Gefäß stecken und versenden. Transport und Lagerung: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis 24 h bei RT. Seite 175 von 281 --------------------------------------------------------------------------------------------------------------------------- Materialien aus den Atemwegen --------------------------------------------------------------------------------------------------------------------------Broncho-alveoläre Lavage (BAL) Bronchialsekret Sputum Induziertes Sputum Magensaft Rachenspülwasser Trachealsekret --------------------------------------------------------------------------------------------------------------------------- Broncho-alveoläre Lavage (BAL) Die BAL ist das geeignetste Material für die Diagnostik der Pneumonie und gilt als beste Methode zum Nachweis alveolärer oder in den terminalen Bronchioli ablaufenden Infektionen. Es werden alle ätiologisch bedeutsamen Keime quantitativ erfasst; das Risiko einer Kontamination mit Keimen der Normalflora ist mit dieser Methode am geringsten; weiterhin kann die Kontaminationsrate durch Verwerfen der ersten Sekretportion gesenkt werden. Die BAL wird im Labor quantitativ angelegt. Probengefäße: Universal-Probenröhrchen mit blauem Deckel. Materialentnahme: Die BAL wird durch Spülung des distal der Bronchusspitze gelegenen Bronchialsystems und des Alveolarraumes mit dem Bronchoskop durchgeführt. Vorbereitung des Patienten, Bronchoskop in Subsubsegment-Bronchus einbringen, Alveolarraum mit 20-50 ml steriler physiologischer Kochsalzlösung spülen, das NaCl wieder mit dem Bronchoskop aspirieren und in das Probegefäß bringen. Untersuchungsmenge: Das Untersuchungsvolumen sollte ≥ 30 ml sein. Transport und Lagerung: - ≤ 2 h bei RT, ist dies nicht möglich, Lagerung bis zu 24 h bei RT - Materialien zur Untersuchung auf Tuberkulose oder für die PCR Lagerung bis zu 24 h bei 4°C --------------------------------------------------------------------------------------------------------------------------- Bronchialsekret Probengefäße: Universal-Probenröhrchen mit blauem Deckel Materialentnahme: Bronchialsekret wird während der Bronchoskopie durch direkte Absaugung (ohne Spülung) aus den Bronchien gewonnen. Das Sekret wird aspiriert und in das Probengefäß überführt. Untersuchungsmenge: Das Untersuchungsvolumen sollte ≥ 1 ml sein. Transport und Lagerung: - ≤ 2 h bei RT, ist dies nicht möglich, Lagerung bis zu 24 h bei RT - Materialien zur Untersuchung auf Tuberkulose oder für die PCR Lagerung bis zu 24 h bei 4°C --------------------------------------------------------------------------------------------------------------------------Seite 176 von 281 Sputum Es sollte nur eitriges Sputum eingesandt werden. Zur Beurteilung der Qualität wird jedes Sputum mikroskopisch untersucht. Die Anzahl der Plattenepithelzellen und Granulozyten gibt Auskunft über die Eignung der Probe; gut geeignete Sputumproben enthalten mehr als 25 Granulozyten und weniger als 10 Epithelzellen pro Gesichtsfeld. Ein erhöhter Anteil an Plattenepithelien spricht für Speichel. Zellarmes Sputum (keine Granulozyten und Plattenepithelien) kann bei Pneumonien durch sog. atypische Erreger, Mykobakterien oder Aspergillen, bei Patienten mit Immunsuppression (Fehlen einer entzündlichen Reaktion) und bei CF-Patienten auftreten. Probengefäße: Sputumröhrchen Materialentnahme: - Mundspülung mit Wasser zur Reduktion der apathogenen Keime der Normalflora - tief aus- und einatmen; nach jedem Einatmen den Atem für 3 - 5 Sekunden anhalten, diesen Vorgang mehrmals wiederholen (durch die Atemarbeit wird die Lunge gut entfaltet und die Produktion von Sputum angeregt, zum Schluss tief Luft holen und Sputum abhusten bei V. a. eine Tuberkulose sollte das Abhusten zur Gewinnung einer möglichst großen Probenmenge 2 - 3 x wiederholt werden bei V. a. auf atypische Mykobakterien (NTM) Mundspülung mit physiologischer Kochsalzlösung durchführen, um eine Kontamination mit den im Leitungswasser vorkommenden Mykobakterien zu vermeiden - das gewonnene Sputum sollte in einem sterilen Sputumröhrchen aufgefangen werden. Besonderheiten: Am besten geeignet ist frisches Morgensputum, das vor der ersten Mahlzeit gewonnen wird! Sammelsputen über 24 h sind unbrauchbar! - bei chronisch bakteriellen Prozessen und bei V. a. eine Lungenmykose oder auf eine Legionellose Abnahme von Sputumproben (besser BALs) an mehreren aufeinanderfolgenden Tagen, ggf. in 2bis 3-tägigen Intervallen - gelingt die Gewinnung von Sputum nicht, Gewinnung von induziertem Sputum - bei Kindern sind auch Rachenabstriche möglich - bei V. a. eine Pneumonie Blutkulturen abnehmen! Transport und Lagerung: - ≤ 2 h bei RT, ist dies nicht möglich, Lagerung bis zu 24 h bei RT - Materialien zur Untersuchung auf Tuberkulose oder für die PCR Lagerung bis zu 24 h bei 4°C --------------------------------------------------------------------------------------------------------------------------- Induziertes Sputum Probengefäße: Sputumröhrchen Seite 177 von 281 Materialentnahme: - Mundspülung mit Wasser Inhalation von 25 ml 3-10%iger Kochsalzlösung (37°C - 40°C) im Ultraschallvernebler (cave Infektionsgefahr!) über ca. 20 min - Abhusten von Sekret aus den tiefen Atemwegen innerhalb von 30 min nach der Inhalation - Überführen des Sekretes in ein steriles Weithalsgefäß. Untersuchungsmenge: Das Untersuchungsvolumen sollte ≥ 1 ml sein. Transport und Lagerung: - ≤ 2 h bei RT, ist dies nicht möglich, Lagerung bis zu 24 h bei RT - Materialien zur Untersuchung auf Tuberkulose oder für die PCR Lagerung bis zu 24 h bei 4°C --------------------------------------------------------------------------------------------------------------------------- Magensaft Die Einsendung von Magensaft dient zur Diagnose der Tuberkulose. Zur Erhöhung der Sensitivität sollte die Untersuchung an drei aufeinanderfolgenden Tagen durchgeführt werden. Probengefäße: Steriles Magensaft-Röhrchen mit Natriumphosphatlösung (Anforderung unter Tel.: 201 46918). Materialentnahme: - Hygienische Händedesinfektion und Verwendung von Einmalhandschuhen - Einführen der Sonde in ein Nasenloch - vorsichtiges Vorschieben der Sonde - den Patient schlucken lassen und gleichzeitig die Sonde zügig vorschieben (ca. 50 cm) - mit einer sterilen Spritze ca. 2 ml Magensaft aspirieren - Überführen des Magensekretes in das Magensaft-Röhrchen Transport und Lagerung: ≤ 2 h bei RT, ≤ 24 h bei 4°C; Materialien zur Untersuchung auf Tuberkulose oder für die PCR müssen bei 4° im Kühlschrank gelagert werden. --------------------------------------------------------------------------------------------------------------------------- Rachenspülwasser Probengefäße: Universal-Probenröhrchen mit blauem Verschluss Materialentnahme: - Mund mit physiologischer Kochsalzlösung ausspülen - Gurgeln mit 10 ml physiologischer Kochsalzlösung - Gurgelflüssigkeit in Sputumröhrchen überführen und schnell versenden. Transport und Lagerung: ≤ 2 h bei RT, ≤ 24 h bei 4°C. --------------------------------------------------------------------------------------------------------------------------- Trachealsekret Probengefäße: Universal-Probenröhrchen mit blauem Deckel Seite 178 von 281 Materialentnahme: Trachealsekret wird bei intubierten Patienten oder bei tracheotomierten Patienten durch Absaugung mit zwischengeschaltetem Auffanggefäß entnommen. Falls genügend Material vorhanden ist, sollte die erste Portion verworfen werden. Bei Frühgeborenen und Säuglingen ist auch die Entnahme mit sterilen Spritzen möglich. Untersuchungsmenge: Das Untersuchungsvolumen sollte ≥ 1 ml sein. Transport und Lagerung: ≤ 2 h bei RT, ≤ 24 h bei 4°C; Materialien zur Untersuchung auf Tuberkulose oder für die PCR müssen bei 4°C im Kühlschrank gelagert werden. --------------------------------------------------------------------------------------------------------------------------- Seite 179 von 281 Biopsien --------------------------------------------------------------------------------------------------------------------------Hautbiopsie Organbiopsie --------------------------------------------------------------------------------------------------------------------------- Hautbiopsien Probengefäße: Universal-Probenröhrchen mit blauem Verschluss. Materialentnahme: Hautdesinfektion, sterile Handschuhe anziehen, Biopsie nach den Leitlinien der Klinik durchführen, Biopsat in Probegefäß überführen und darauf achten, dass es ganz mit NaCl bedeckt ist. Transport und Lagerung: ≤ 2 h bei RT, falls das nicht möglich, Lagerung bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Organbiopsien (Hirnbiopsie) Probengefäße: Universal-Probenröhrchen mit blauem Verschluss. Materialentnahme: Hautdesinfektion, sterile Handschuhe anziehen, Biopsie nach den Leitlinien der Neurochirurgischen Klinik durchführen, Biopsat in Probegefäß überführen und darauf achten, dass es ganz mit NaCl bedeckt ist. Transport und Lagerung: ≤ 2 h bei RT, eine Lagerung ist nicht möglich. Außerhalb der Dienstzeiten ist der Dienstarzt des Instituts für Mikrobiologie zu benachrichtigen (Diensttelefon: 0172-6633567)! --------------------------------------------------------------------------------------------------------------------------- Blut /Stammzellen --------------------------------------------------------------------------------------------------------------------------Blutkulturen / Stammzellen EDTA-Blut Nativblut --------------------------------------------------------------------------------------------------------------------------- Blutkulturen Probengefäße: Blutkulturflaschen BacT/ALERT FA (aerobe Flasche), BacT/ALERT FN (anaerobe Flasche), BacT/ALERT PK (Kinder) der Firma bioMérieux. Seite 180 von 281 Zeitpunkt der Abnahme von Blutkulturen: - möglichst frühzeitig im Fieberanstieg (größte Keimdichte bei ständiger Anwesenheit der Erreger im Blut etwa eine Stunde vor dem Fieberanstieg; auf dem Höhepunkt des Fiebers sind die Erreger häufig nicht mehr nachweisbar) - vor Beginn einer antibiotischen Therapie - bei der Blutabnahme unter einer antibiotischen Therapie empfiehlt sich die Abnahme vor einer erneuten Antibiotika-Applikation (Zeitpunkt der niedrigsten Antibiotikaspiegel) - bei Fieber mit Continua mehrere Abnahmen im Abstand von mindestens 15 min; in Ausnahmefällen alle 3 Blutkulturen innerhalb von 30 min abnehmen! - bei neutropenischen Patienten und immunsupprimierten Kindern ist es sinnvoll, die Entnahme von einer bestimmten Fieberhöhe, z. B. 38,5°C, abhängig zu machen. Entnahmetechnik: - üblicherweise durch Punktion einer peripheren Vene - über einen intravasalen Katheter bei Verdacht auf eine Katheter-assoziierte Infektion (erhöhte Kontaminationsgefahr, daher nicht als Routinemethode empfohlen); bei Abnahme aus dem ZVK 2 Blutkulturpaare (aus ZVK und peripher) einsenden - bei Neugeborenen kann während der ersten Lebensstunden auch die Entnahme über einen Nabelarterienkatheter sinnvoll sein. - bei V. a. Fungämie kein Vorteil durch Abnahme von arteriellem Blut. - Entnahme von Stammzellen ist der Station und den behandelnden Ärzten bekannt. Abnahme (Blutkulturen/Stammzellen): - Händedesinfektion, Blutentnahme mit sterilen Einmalhandschuhen - Hautdesinfektion der Punktionsstelle mit 70% Ethanol (Einwirkungszeit mind. 2 min, alternativ bis zur Trocknung des Ethanols. - danach erneute Hautdesinfektion mit 70% Ethanol (konzentrisch vom Zentrum der zu desinfizierenden Fläche nach außen) mittels sterilem Tupfer; eine nochmalige Palpation der Punktionsstelle sollte vermieden werden. - Wechsel der Kanüle nach einer Fehlpunktion. Anzahl der Blutkulturflaschen: - bei Sepsis 3 Blutkulturpaare (je 3 aerobe und anaerobe Flaschen) innerhalb von 10 min; die Abnahme einer größeren Zahl verbessert die Ausbeute nicht. - bei akuter Endokarditis in rascher Folge Abnahme von 3 Paaren in 1-2 h - bei subakuter Endokarditis Abnahme von 3 Paaren innerhalb von 24 h - bei Fieber unklarer Genese 3 Blutkulturpaare in 24 h, wenn negativ, Abnahme von weiteren 3 Paaren in 24 h. Beimpfen der Blutkulturflaschen: Nach Entfernen der Schutzkappen muss der darunterliegende Gummi mit Ethanol desinfiziert werden (Einwirkzeiten beachten!). Die Beimpfung der Flaschen muss zur Reduktion der Kontaminationsrate Seite 181 von 281 mit einer neuen, ausgetauschten Kanüle erfolgen. Das Blut wird auf zwei Kultursysteme (aerobe und anaerobe Keime) verteilt. Reicht die entnommene Blutmenge nur für ein System aus, so sollte der aeroben Blutkulturflasche der Vorrang gegeben werden. Für Stammzellen wird nur eine Blutkulturflasche beimpft. Zuerst die anaeroben, dann die aeroben Flaschen beimpfen! Die Belüftung der aeroben Blutkulturflaschen ist bei den neuen Blutkultursystemen nicht mehr notwendig. Blutvolumen/Stammzellvolumen: Das Verhältnis von Blut und Kulturmedium sollte etwa 1:5 bis 1:10 sein (Neutralisation der bakteriziden Wirkung des Serums): Erwachsene: 10 - 12 ml (je 5 – 6 ml für eine aerobe und anaerobe Flasche) Kleinkinder: 3 - 4 ml (je 2 ml für eine aerobe und anaerobe Flasche für Kinder) Säuglinge: 1 - 2 ml (je 1 ml in eine aerobe und anaerobe Flasche für Kinder) Frühgeborene: 0,5 ml (nur aerobe Flasche) Stammzellen: größtmögliche Menge (Entscheidung durch den zuständigen Arzt der Transfusionsmedizin) Lagerung und Transport: ≤ 2 h gegen Abkühlung geschützt, falls das nicht möglich, Lagerung bis zu 18 h bei RT (keine Inkubation im Brutschrank!!) Versehentlich vorinkubierte Flaschen werden im Labor besonders bearbeitet, um ein positives Ergebnis zu gewährleisten. Es muss daher auf dem Antragsformular vermerkt werden, ob und wie lange Blutkulturflaschen vorinkubiert wurden. Dauer der Untersuchung: Nach Positivmeldung der Flasche durch das BactAlert-Gerät, Erstablesung der Kulturen nach 12 - 24 h, Differenzierung und Erstellung des Antibiogramms der isolierten Keime erfolgt nach 48 - 72 h, Normbebrütungszeit der Flaschen in der Regel 7 Tage (wenn keine Positivmeldung erfolgte), bei V. a. langsam wachsende Mikroorganismen 21 Tage, bei Stammzellen 14 Tage. Bei mikroskopischem oder kulturellem Nachweis von Mikroorganismen aus Blutkulturen (Stammzellen) wird der Einsender sofort telefonisch benachrichtigt! --------------------------------------------------------------------------------------------------------------------------- Seite 182 von 281 EDTA-Blut Probengefäße: EDTA-Blutröhrchen Materialentnahme: - Händedesinfektion, Blutentnahme mit sterilen Einmalhandschuhen - Hautdesinfektion der Punktionsstelle mit 70% Ethanol (Einwirkungszeit mind. 2 min, alternativ bis zur Trocknung des Ethanols. - danach erneute Hautdesinfektion mit 70% Ethanol (konzentrisch vom Zentrum der zu desinfizierenden Fläche nach außen) mittels sterilem Tupfer; eine nochmalige Palpation der Punktionsstelle sollte vermieden werden. - Wechsel der Kanüle nach einer Fehlpunktion. Transport und Lagerung: Bei Raumtemperatur bis zu 24 h --------------------------------------------------------------------------------------------------------------------------- Nativblut Probengefäße: Universal-Probenröhrchen, konisch mit rotem Schraubverschluss. Abnahme und Blutvolumen Entnahme von Blut mit steriler Kanüle aus der Vene oder aus einem liegenden venösen Katheter. Lagerung und Transport bei Raumtemperatur bis zu 24 h. --------------------------------------------------------------------------------------------------------------------------- Fremdkörper --------------------------------------------------------------------------------------------------------------------------Drainagespitze Katheterspitze Herzklappe Kontaktlinsen Intrauterinpessar (Spirale) Herzschrittmacher --------------------------------------------------------------------------------------------------------------------------- Drainagespitze Probengefäße: Universal-Probenröhrchen mit blauem Verschluss. Materialentnahme: Einweghandschuhe anziehen, Drainageschlauch aus der Wunde des Patienten vorsichtig herausziehen, so dass die Spitze nicht die Umgebung berührt, Drainagespitze mit einer sterilen Schere abschneiden und in ein steriles Gefäß überführen. Transport und Lagerung: bei Raumtemperatur bis zu 24 h. --------------------------------------------------------------------------------------------------------------------------- Seite 183 von 281 Herzklappe Probengefäße: Weithalsgefäße mit Herzklappenbouillon (Anforderung unter Tel. 201-46918). Materialentnahme: Herzklappe intraoperativ entnehmen und in das Transportgefäß überführen. Transport und Lagerung: ≤ 2 h bei RT, falls das nicht möglich, Lagerung bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Intrauterinpessar (Spirale) Probengefäße: Weithalsgefäße mit ca. 20 ml Ringerlösung füllen (NaCl beeinträchtigt den Nachweis von Aktinomyzeten). Materialentnahme: Intrauterinpessare unter sterilen Bedingungen entnehmen und in das Transportgefäß überführen. Transport und Lagerung: ≤ 2 h bei RT, falls das nicht möglich, Lagerung bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Katheterspitze Probengefäße: Erwachsene: Universal-Probenröhrchen mit blauem Verschluss Frühgeborene: Brain-Heart-Infusion-Medium (Anforderung unter Tel.: 201-46918) Materialentnahme: - Einmalhandschuhe anziehen - Katheter mit einer sterilen Pinzette vorsichtig ziehen; dabei darauf achten, dass die Spitze nicht mit unsterilem Material in Kontakt kommt - Transportgefäß öffnen - Katheterspitze (4-6cm) mit einer sterilen Schere vorsichtig abschneiden und in das Gefäß fallen lassen - Transportgefäß verschließen. Lagerung und Transport: Erwachsene: ≤ 1 h bei RT, ist das nicht möglich, Lagerung bei 4°C bis zu 24 h (optimal 2 h) Frühgeborene: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 37°C (Brutschrank). --------------------------------------------------------------------------------------------------------------------------- Kontaktlinsen Probengefäße: Universal-Probenröhrchen mit blauer Verschlusskappe. Materialentnahme: - Hände sorgfältig desinfizieren - Transportgefäß vorbereiten und mit wenig steriler Kochsalzlösung füllen - Kontaktlinse aus dem Auge entfernen und vorsichtig in das Transportgefäß fallen lassen Seite 184 von 281 Lagerung und Transport: ≤ 2 bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. Bei V. a. Acanthamöben-Infektion ≤ 1 h bei RT, eine Lagerung ist nicht möglich! --------------------------------------------------------------------------------------------------------------------------- Herzschrittmacher Probengefäße: Weithalsgefäße mit ca. 20 ml Ringerlösung füllen oder Weithalsgefäße mit Thioglykolatlösung (Anforderung unter Tel. 201-46918) verwenden. Materialentnahme: Schrittmacherdraht unter sterilen Bedingungen entnehmen und in das Transportgefäß überführen. Transport und Lagerung: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Haut und Nägel --------------------------------------------------------------------------------------------------------------------------Hautbiopsien Hautabstriche Hautgeschabsel, Hautschuppen, Nagelspäne --------------------------------------------------------------------------------------------------------------------------- Hautbiopsien Probengefäße: Universal-Probenröhrchen mit blauem Verschluss. Materialentnahme: Hautdesinfektion, sterile Handschuhe anziehen, Biopsie nach den Leitlinien der Klinik durchführen, Biopsat in Probegefäß überführen und darauf achten, dass es ganz mit NaCl bedeckt ist. Transport und Lagerung: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Hautabstriche Hautabstriche sind nur bei offenen Wunden sinnvoll. Eine Kontamination der Untersuchungsprobe mit physiologischer Hautflora ist meist unvermeidlich. Probengefäße: Universal-Abstrichtupfer mit blauer Kappe. Materialentnahme: Tupfer entnehmen und mehrfach über das betroffene Hautareal streichen, Tupfer in das Transportmedium geben und verschließen. Transport und Lagerung: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------Seite 185 von 281 Hautgeschabsel, Hautschuppen, Nagelspäne Probengefäße: Universal-Probengefäß mit blauem Schraubverschluss. Materialentnahme: - verdächtige Hautstellen mit Alkohol vorsichtig desinfizieren - danach Hornhautgeschabsel, Nagelspäne oder Hautschuppen vom entzündlichen Randwall abkratzen in ein trockenes Gefäß überführen, ggf. Zusatz von wenig NaCl - Lagerung und Transport ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Liquor --------------------------------------------------------------------------------------------------------------------------Probengefäße: Universal-Röhrchen aus Kunststoff mit blauem Schraubdeckelverschluss. Zeitpunkt der Lumbalpunktion: - bei akuten Entzündungen vor Beginn der antibiotischen Therapie - Ist eine Lumbalpunktion nicht möglich, sollte auf jeden Fall eine Blutkultur entnommen werden (90% der bakteriellen Meningitiden laufen im Rahmen einer Bakteriämie oder Sepsis ab) Kontrollpunktion: nach 12 - 48 Stunden bei: - Einsenden einer zu geringen Liquormenge (z. B. bei Verdacht auf Tuberkulose) - bei zweifelhaftem oder ungewöhnlichen Initialbefund - beim Nachweis von resistenten Erregern oder von Keimen mit einer ungewöhnlichen Resistenz (Kontrolle) - bei klinischer Verschlechterung des Krankheitszustandes trotz adäquater Therapie - in Ausnahmefällen zur Beurteilung der Effizienz der Therapie. Materialentnahme: Es sollte nach Möglichkeit kein blutiger Liquor eingesetzt werden. Die Entnahme erfolgt üblicherweise durch Lumbalpunktion, selten durch Ventrikel- oder Subokzipitalpunktion, in Sonderfällen aus Ableitungssystemen (Shuntliquor): - Hygienische Händedesinfektion - Mundschutz (notwendig für Untersuchungen mittels PCR) und sterile Einmalhandschuhe - Reinigung und Hautdesinfektion der Punktionsstelle (L4/5 oder L3/4) mit 70% Ethanol (konzentrisches Auftragen, Einwirkzeit 2 min) - nach der Punktion Entfernung von evtl. PVP-Jod-Resten mittels Äthanol getränktem Tupfer - Abdecken der Punktionsstelle mit einem sterilem Verbandsmaterial. Seite 186 von 281 Liquorvolumen: Wenn möglich, sollten immer die vorgeschriebenen Mindestmengen eingesandt werden. Nur so ist mit einem positiven Untersuchungsergebnis zu rechnen! Falls nur wenig Liquor zur Verfügung steht, sollten Prioritäten für den Nachweis der mit größter Wahrscheinlichkeit in Frage kommenden Erreger gesetzt werden. Mindestvolumen: - Bakterien ≥ 1 ml - Pilze ≥ 2 ml - Parasiten ≥ 5 ml - Mykobakterien ≥ 5 ml, besser 10 – 15 ml (je 5 ml für Mikroskopie, Kultur und PCR); Besonderheiten: Bei negativer Mikroskopie und bestehendem Verdacht auf eine tuberkulöse Meningitis, sollte erneut Liquor gewonnen und mindestens 15 ml (falls möglich, sonst soviel wie möglich!) für die Kultur verarbeitet werden. Ist nur wenig Liquor vorhanden, so ist der Kultur der Vorrang zu geben. Die Kultur gilt nach wie vor als Goldstandard, sie hat die größte Sensitivität. Lagerung und Transport: - V. a. bakterielle Meningitis: ≤ 2 h bei RT vor Licht geschützt, eine längere Lagerung ist nicht möglich! > 2 h: ein Aliquot des Liquors in Blutkulturflachen einimpfen, dann Lagerung bis zu 24 h bei RT - bei Transport in Blutkulturflaschen sind folgende Untersuchungen nicht möglich: mikroskopisches Präparat, Antigennachweis, quantitative Bestimmung der Erreger, Nachweis von Viren und von Parasiten; es sollte daher auch nativer Liquor parallel eingesandt werden - V. a. Meningitis durch Viren, Parasiten oder Pilze: Lagerung bis zu 24 h bei 4°C; bei V. a. Parasiten und Pilze Liquor nicht tieffrieren - DNA-Nachweis (PCR): Lagerung bis zu 24 h bei 4°C. Außerhalb der Dienstzeiten kann der Dienstarzt des Instituts für Mikrobiologie benachrichtigt werden (Diensttelefon: 0172-6633567)! --------------------------------------------------------------------------------------------------------------------------- Punktate --------------------------------------------------------------------------------------------------------------------------Abszesspunktat Knochenmark Aszitespunktat Perikardpunktat Gelenkpunktat Pleurapunktat Kammerpunktat (Auge) --------------------------------------------------------------------------------------------------------------------------Seite 187 von 281 Abszesspunktat Probengefäße: Universal-Röhrchen mit blauem Schraubverschluss, bei V. a. Anaerobier-Infektionen Port-A-CulMedium. Materialentnahme: - Desinfektion der Hautareale - Punktion und Sekretaspiration mit einer sterilen Spritze unter aseptischen Bedingungen - bei Abszessspaltung vorher Material für die mikrobiologische Untersuchung durch Punktion gewinnen, ggf. Inzision des Abszesses und Aufnahme des Abszessinhaltes in sterile Gefäße unter aseptischen Bedingungen. Lagerung und Transport: Material ohne Transportmedium ≤ 2 h bei RT, eine Lagerung ist nicht möglich! - Nativmaterial im Transportmedium für Anaerobier bis zu 24 h bei RT - bei Transportverzögerungen Einimpfen der Materialien in Blutkulturflaschen Lagerung bis zu 24 h bei RT - Abszessmaterial nicht einfrieren! --------------------------------------------------------------------------------------------------------------------------- Aszitespunktat Probengefäße: Universal-Röhrchen mit blauem Schraubverschluss, bei V. a. Anaerobier-Infektionen Port-A-CulMedium. Materialentnahme: Die Punktion erfolgt im linken Unterbauch nach Desinfektion der Einstichstelle unter Lokalanästhesie (Leitlinien der Klinik beachten), Auffangen der Flüssigkeit in einem sterilen Gefäß und Überführen des Aszites in das Untersuchungsröhrchen. Lagerung und Transport: Material ohne Transportmedium ≤ 2 h bei RT, eine Lagerung ist nicht möglich! - Nativmaterial im Transportmedium für Anaerobier bis zu 24 h bei RT - bei Transportverzögerungen Einimpfen der Materialien in Blutkulturflaschen Lagerung bis zu 24 h bei RT --------------------------------------------------------------------------------------------------------------------------- Gelenkpunktat Probengefäße: - Universalröhrchen mit blauem Schraubverschluss. Materialentnahme: - Desinfektion der Einstichstelle mit 70% Ethanol (Einwirkzeit 3 min, allenfalls orientierend bis zum Trocknen des Alkohols) - streng aseptisches Vorgehen (Händedesinfektion, Einmalhandschuhe, Mundschutz) Seite 188 von 281 Untersuchungsvolumen: Da in den meisten Fällen nicht mit einer hohen Keimzahl in Gelenkpunktaten etc. zu rechnen ist, sollten möglichst große Mengen an Untersuchungsmaterial entnommen und eingesandt werden. Lagerung und Transport: - ≤ 2 h bei RT, eine längere Lagerung ist nicht möglich! - Material im Transportmedium (z. B. Thioglykolatbouillon): Lagerung bis zu 24 h bei RT - Verimpfung der Materialien in Blutkulturflaschen: Lagerung bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Kammerpunktat (Auge) Probengefäße: Universal-Probenröhrchen mit blauem Verschluss, Blutkulturflaschen. Materialentnahme: Intraoperative Entnahme Lagerung und Transport: - Punktate im Probengefäß ≤ 1 h bei RT, eine längere Lagerung ist nicht möglich! - Punktate (i. d. R. sehr wenig) können in den Spritzen, mit denen sie entnommen wurden, transportiert werden (ohne Kanüle, gut verschlossen) und sofort nach Abnahme in das Labor gebracht werden - Spülflüssigkeit in Redon-Flaschen sammeln und ebenfalls schnell transportieren (≤ 1 h bei RT) - Ist der sofortige Transport nicht möglich, Verimpfen der Materialien in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT. Die Materialien dürfen nicht eingefroren werden und nur kurzzeitig bei 4°C aufbewahrt werden. Bei Endophthalmitis sollte außerhalb der Dienstzeiten der zuständige Mikrobiologe verständigt werden (Tel. Dienst-Handy 0172 - 6633567). --------------------------------------------------------------------------------------------------------------------------- Knochenmark Probengefäße: Sterile Spritze mit Schraubdeckel oder Blutkulturflaschen. Materialentnahme: Beckenkammpunktion und Sternalpunktion unter strengster Beachtung der Hygienevorschriften! - zur Punktion des hinteren Beckenkamms liegt der Patient in Seitenlage - gründliche Händedesinfektion, Anziehen steriler Handschuhe, Abdecken der Punktionsstelle mit einem sterilen Tuch, Lokalanästhesie (Infiltration des Periosts unter Aspiration) - 3-4 mm große Hautinzision mittels Skalpell, Vorschieben der Punktionsnadel unter druckvollen Drehbewegungen senkrecht bis auf das Periost (Punktionsrichtung ist hinten 15° nach kaudal und vorne 15° nach kranial) - nach Passieren der Kompakta Herausziehen des Obturators (enthält Knochenbiopsat für die hämatologische Diagnostik) und Aspiration von Knochenmark mit einer sterilen Spritze (Vorlage von EDTA zur Untersuchung von Parasiten) - Entfernen der Nadel, Kompression der Punktionsstelle mit sterilen Tupfern, Anlage eines sterilen Verbandes Seite 189 von 281 - Lagerung des Patienten auf einem Sandsack - Knochenmark in Blutkulturflaschen einimpfen oder nativ in der Spritze transportieren oder auf Objektträger ausstreichen. Lagerung und Transport: - ≤ 2 h bei RT, bei längerem Transport, Zwischenlagerung in Blutkulturflaschen (bis zu 24 h bei RT) oder auf Objektträgern möglich. ------------------------------------------------------------------------------------------------------------------------- Perikardpunktat Probengefäße: Universal-Probenröhrchen mit blauem Schraubverschluss, Blutkulturflaschen. Materialentnahme: - strengste Beachtung der Hygienevorschriften - Ortung des Ergusses mittels Echokardiographie - Lokalanästhesie der Punktionsstelle und Punktion unter sterilen Kautelen mit einer dicklumigen Nadel mit aufgesetzter Spritze - Abnahme der Punktatflüssigkeit und Verteilen in die Probengefäße - Entfernen der Kanüle und Anlegen eines sterilen Verbandes Lagerung und Transport: ≤ 2 h bei RT, eine Zwischenlagerung ist nicht möglich, ggf. Material in Blutkulturflaschen einimpfen, dann Lagerung bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Pleurapunktat Probengefäße: Universal-Probenröhrchen mit blauem Schraubverschluss, Blutkulturflaschen. Materialentnahme: - Patient sitzt und stützt sich nach vorne auf, Pleurapunktat mit Ultraschall kontrollieren - großflächige Desinfektion der Punktionsstelle - Anlegen eines Mundschutzes und Anziehen steriler Handschuhe - Abdecken der Punktionsstelle mit sterilen Tüchern (Lochtuch), Lokalanästhesie - Punktion der Pleuraflüssigkeit - Abnahme von Pleuraflüssigkeit mit steriler Spritze und Auffangen im Probengefäß Lagerung und Transport: ≤ 2 h bei RT, eine Zwischenlagerung ist nicht möglich, ggf. Material in Blutkulturflaschen einimpfen, dann Lagerung bis zu 24 h bei RT. Seite 190 von 281 Sekrete ---------------------------------------------------------------------------------------------------------------------------------------Bronchialsekret Muttermilch Dialysat Prostatasekret Drainagesekret Sinussekret Ejakulat Trachealsekret Gallensaft Urethralsekret Magensaft --------------------------------------------------------------------------------------------------------------------------- Bronchialsekret Probengefäße: Universal-Probenröhrchen mit blauem Deckel. Materialentnahme: Bronchialsekret wird während der Bronchoskopie durch direkte Absaugung (ohne Spülung) aus den Bronchien gewonnen. Das Sekret wird aspiriert und in das Probengefäß überführt. Untersuchungsmenge: Das Untersuchungsvolumen sollte ≥ 1 ml sein. Transport und Lagerung: - ≤ 2 h bei RT, ist dies nicht möglich, Lagerung bis zu 24 h bei RT (schlechtere Ausbeute infolge der langen Lagerungszeit) - Proben zum Nachweis auf Mykobakterien oder Proben für die PCR: Lagerung bis zu 24 h bei 4°C. --------------------------------------------------------------------------------------------------------------------------- Dialysat Probengefäße: Universal-Probenröhrchen mit blauem Verschluss, Blutkulturflaschen. Materialentnahme: Händedesinfektion, Einmalhandschuhe anziehen, dann Entnahme der Probe während der Dialyse mit einer sterilen Spritze, in das Transportgefäß überführen. Transport und Lagerung: CAP-Dialysaten sind hypertone Lösungen. Um ein Absterben oder eine Schädigung der Mikroorganismen zu verhindern, müssen die CAP-Dialysate ordnungsgemäß transportiert werden: ≤ 2 h bei RT, eine Zwischenlagerung ist nicht möglich. Bei längerem Transport Verimpfen des Dialysats in Blutkulturflaschen (5-10 ml), dann Lagerung bis zu 24 h bei RT. Seite 191 von 281 Drainagesekret Probengefäße: Universal-Probenröhrchen mit blauem Verschluss, Blutkulturflaschen, bei V. a. Infektionen durch Anaerobier Verwendung von Port-A-Cul-Medium. Materialentnahme: Händedesinfektion, Einmalhandschuhe anziehen, Sekret aus dem Drain mit einer sterilen Spritze abziehen und in das Transportgefäß überführen. Transport und Lagerung: ≤ 2 h bei RT, bei längerem Transport Einimpfen der Flüssigkeit in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Ejakulat Probengefäße: Universal-Probenröhrchen mit blauem Verschluss. Materialentnahme: - Hygienische Händedesinfektion durchführen und Einmalhandschuhe benutzen - nach sorgfältiger Reinigung der Genitalien mit Wasser und Seife Probe in einem sterilen Gefäß auffangen. Lagerung und Transport: Der Transport muss umgehend (≤ 2 h) bei Raumtemperatur erfolgen, eine Lagerung ist nicht möglich. --------------------------------------------------------------------------------------------------------------------------- Gallensaft Probengefäße: Universal-Probenröhrchen mit blauem Verschluss, Blutkulturflaschen. Bei V. a. Anaerobier-Infektion Port-A-Cul-Medium Materialentnahme: Endoskopische oder intraoperative Materialgewinnung bzw. Materialgewinnung aus dem Drainagesystem, Aspiration von Galle mit einer sterilen Spritze und Überführen in das Probengefäß. Lagerung und Transport: ≤ 2 h bei RT, bei längerem Transport Einimpfen in Blutkulturflaschen, dann Lagerung bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Magensaft Die Einsendung von Magensaft dient zur Diagnose der Tuberkulose. Zur Erhöhung der Sensitivität sollte die Untersuchung an drei aufeinanderfolgenden Tagen durchgeführt werden. Probengefäße: Magensaft-Röhrchen mit Natriumphosphatlösung (Anforderung unter Tel.: 201-46918) Materialentnahme: - Hygienische Händedesinfektion und Verwendung von Einmalhandschuhen - Einführen der Sonde in ein Nasenloch - vorsichtiges Vorschieben der Sonde Seite 192 von 281 - den Patient schlucken lassen und gleichzeitig die Sonde zügig vorschieben (ca. 50 cm) - mit einer sterilen Spritze ca. 2 ml Magensaft aspirieren - Überführen des Magensekretes in das Magensaft-Röhrchen Transport und Lagerung: ≤ 2 h bei RT, bei längerem Transport bis zu 24 h bei 4°C. --------------------------------------------------------------------------------------------------------------------------- Muttermilch Probengefäß: Universal-Probenröhrchen mit blauem Verschluss. Materialentnahme: - Händedesinfektion und gründliche Hautdesinfektion der Brustwarze - Entnahme von mindestens 2-10 ml Muttermilch mittels Saugpumpe oder durch Druck - Überführen der Muttermilch in das Transportgefäß. Transport und Lagerung: ≤ 2 h bei RT, bei längerem Transport Lagerung bis zu 24 h bei 4°C. --------------------------------------------------------------------------------------------------------------------------- Prostatasekret Probengefäße: Universal-Probenröhrchen mit blauem Verschluss. Materialentnahme: - Hygienische Händedesinfektion und Verwendung von Einmalhandschuhen - nach Reinigung der Harnröhrenmündung wird die Prostata vom Rektum aus massiert, das ausfließende Exprimat in sterilem Gefäß auffangen kleine Sekretmengen mit dem Abstrichtupfer aufnehmen und in das Transportmedium einbringen - Transport und Lagerung: ≤ 2 h bei Raumtemperatur, bei längerem Transport Lagerung bis zu 24 h bei 4°C. Besonderheiten: Zum Nachweis folgender Keime, müssen gesonderte Urethralabstriche abgenommen und in speziellen Transportmedien verschickt werden. - Neisseria gonorrhoeae Ausstreichen auf Thayer-Martin-Agar oder Spezial-Agarplatte unmittelbar nach der Entnahme Transport ohne Transportmedium (TM) nicht möglich, Lagerung in TM bis zu 24 h bei RT - Chlamydia trachomatis (nativer Abstrich für LCX-PCR) Transport ohne TM ≤ 2 h bei RT, in TM Lagerung bis zu 24 h bei 4°C - Mycoplasma hominis und Ureaplasma urealyticum Transport in Transportmedium (TM) für anspruchsvoll wachsende Keime Transport ohne TM ≤ 2 h bei RT, falls das nicht möglich ist, Lagerung bis zu 24 h bei 4°C - Gardnerella vaginalis und Anaerobier Transport ohne TM ≤ 2 h bei RT, falls das nicht möglich ist, Lagerung bis 24 h bei RT Seite 193 von 281 Sinussekret Probengefäße: Universal-Probenröhrchen mit blauem Verschluss, bei V. a. Infektionen durch Anaerobier Port-A-CulMedium Materialentnahme: Intraoperative Sekretgewinnung, Punktion der Nebenhöhlen und Aspiration von Sekret, Überführen der Flüssigkeit in die Probengefäße. Transport und Lagerung: ≤ 2 h bei Raumtemperatur, bei längerem Transport bis zu 24 h bei 4°C. --------------------------------------------------------------------------------------------------------------------------- Trachealsekret Probengefäße: Universal-Probenröhrchen mit blauem Verschluss. Materialentnahme: Trachealsekret wird bei intubierten Patienten oder bei tracheotomierten Patienten durch Absaugung mit zwischengeschaltetem Auffanggefäß entnommen. Falls genügend Material vorhanden ist, sollte die erste Portion verworfen werden. Bei Frühgeborenen und Säuglingen ist auch die Entnahme mit sterilen Spritzen möglich. Untersuchungsmenge: Das Untersuchungsvolumen sollte ≥ 1 ml sein. Transport: - ≤ 2 h bei RT, ist dies nicht möglich, Lagerung bis zu 24 h bei RT (schlechtere Ausbeute infolge der langen Lagerungszeit) - Proben zum Nachweis auf Mykobakterien oder Proben für die PCR Lagerung bis zu 24 h bei 4°C. --------------------------------------------------------------------------------------------------------------------------Urethralsekret Probengefäße: Universal-Probenröhrchen mit blauem Verschluss. Materialentnahme: - Hygienische Händedesinfektion und Verwendung von Einmalhandschuhen - nach Reinigung der Harnröhrenmündung mit Wasser und Seife wird die Harnröhre von hinten nach vorne ausgestrichen - das ausfließende Exprimat auffangen oder bei kleinen Mengen das Sekret mit dem Abstrichtupfer aufnehmen und in Transportmedium einbringen. Transport und Lagerung Abstriche: ≤ 2 h bei Raumtemperatur, ≤ 24 h bei 4°C. Besonderheiten: Zum Nachweis folgender Keime, müssen gesonderte Urethralabstriche abgenommen und in speziellen Transportmedien verschickt werden. Seite 194 von 281 - Neisseria gonorrhoeae Ausstreichen auf Thayer-Martin-Agar oder Spezial-Agarplatte unmittelbar nach der Entnahme Transport ohne Transportmedium (TM) nicht möglich, Lagerung in TM bis zu 24 h bei RT - Chlamydia trachomatis (nativer Abstrich für LCX-PCR) Transport ohne TM ≤ 2 h bei RT, in TM Lagerung bis zu 24 h bei 4°C - Mycoplasma hominis und Ureaplasma urealyticum Transport in Transportmedium (TM) für anspruchsvoll wachsende Keime Transport ohne TM ≤ 2 h bei RT, falls das nicht möglich ist, Lagerung bis zu 24 h bei 4°C - Gardnerella vaginalis und Anaerobier Transport ohne TM ≤ 2 h bei RT, falls das nicht möglich ist, Lagerung bis 24 h bei RT Seite 195 von 281 Gastrointestinaltrakt --------------------------------------------------------------------------------------------------------------------------Duodenalsaft Stuhl --------------------------------------------------------------------------------------------------------------------------- Duodenalsaft Probengefäße: Universal-Probenröhrchen mit blauem Verschluss, fest stehend. Materialentnahme: - Hygienische Händedesinfektion und Verwendung von Einmalhandschuhen - Endoskopische Einführung eines Schlauches aus Gummi oder flexiblem Kunststoff in den Zwölffingerdarm durch Mund oder Nase - nach erfolgter Einführung in den Magen (ca. 50-60 cm) folgt ein weiteres Vorschieben des Schlauches bei Beckenhoch- und Rechtsseitenlage des Patienten (bis zur Marke 70- 80 cm) - nach Duodenalsondierung Aspiration von Duodenalsaft Lagerung und Transport ≤ 24 h bei RT, ist dies nicht möglich, Lagerung bis zu 24 h bei RT. --------------------------------------------------------------------------------------------------------------------------- Stuhl Probengefäße: Stuhlröhrchen mit Löffel. Materialentnahme: - Stuhl in ein sauberes Gefäß entleeren - eine haselnussgroße Menge entnehmen, bei flüssigem Stuhl Röhrchen zur Hälfte füllen, blutige, eitrige oder schleimige Anteile bevorzugen! Transport und Lagerung: V. a. pathogene Darmkeime: ≤ 24 h bei RT, in der warmen Jahreszeit ≤ 12 h, bei längerer Transportdauer bis zu 24 h bei 4°C - im Transportmedium (Stuart-Medium) bis zu 24 h bei RT. Campylobacter: - ≤ 4 h bei RT, bei längerem Transport bis zu 24 h im Transportmedium bei RT Shigellen: - ≤ 4 h bei RT, bei längerem Transport bis zu 24 h im Transportmedium bei RT Cholera: bei V. a. Cholera ist das Labor sofort telefonisch zu verständigen (Tel.: 203-46918), die Probe muss schnellstens im Transportmittel (alkalisches Peptonwasser mit 1% NaCl) ins Labor gebracht werden C. difficile: kultureller Nachweis: ≤ 2 h bei RT, bei längerem Transport bis zu 24 h bei 4°C Toxinnachweis: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 48 h bei 4°C. Seite 196 von 281 -------------------------------------------------------------------------------------------------------------------------- Harnwege --------------------------------------------------------------------------------------------------------------------------Blasenpunktionsurin Erststrahlurin Dauerkatheterurin Mittelstrahlurin Einmalkatheterurin --------------------------------------------------------------------------------------------------------------------------- Blasenpunktionsurin Durch suprapubische Aspiration von Blasenurin ist eine Kontamination der Probe nahezu ausgeschlossen. Voraussetzung ist eine gut gefüllte Harnblase (ggf. sonographische Kontrolle). Probengefäße: Urinröhrchen, Urikult. Materialentnahme: - Palpation und Perkussion der Harnblase, ggf. sonographische Beurteilung des Füllungsstandes; eine suprapubische Punktion darf nur bei gefüllter Harnblase vorgenommen werden! - Desinfektion der Haut - Hygienische Händedesinfektion durchführen und Einmalhandschuhe anziehen - steriles Abdecken des Unterbauchs mittels Schlitztuch - 2 Querfinger oberhalb der Symphyse streng in der Mittellinie wird mit einer 10 cm langen Nadel die Infiltrationsanästhesie gesetzt, dann Vorschieben der Nadel bis in die Blase - Aspiration von Urin - Stichinzision der Haut mit einem Skalpell - Einführen des Punktionsbesteckes durch die Inzisionsstelle in die Blase - nach der Punktion wird ein Schlauch als Zystostomie belassen und die Punktionskanüle entfernt - Hautnaht und Fixation des Katheters, steriler Verband, Anschluss an ein geschlossenes Harnableitungssystem - Urinportion im Probengefäß auffangen. Transport und Lagerung: Nativurin: ≤ 2 h bei RT, ist das nicht möglich, Lagerung bis zu 24 h bei 4°C. Urikult: im Brutschrank bei 36°C bebrüten, bei sichtbarem Bakterienwachstum Urikult in die Bakteriologie einsenden. --------------------------------------------------------------------------------------------------------------------------- Dauerkatheterurin Um eine Einschleppung von Mikroorganismen in das System zu vermeiden, erfordert die Probenentnahme eine exakte Entnahmetechnik. Bei der Abnahme von Dauerkatheterurin ist darauf zu achten, dass der Urin frisch gewonnen wird. Es sollte kein Urin entnommen werden, der sich über einen längeren Zeitraum im Beutel befand, da im Beutel eine Vermehrung der Keime stattfindet. Probengefäße: Urinröhrchen, Urikult. Seite 197 von 281 Materialentnahme: - hygienische Händedesinfektion durchführen und Einmalhandschuhe anziehen - Uringewinnung durch Punktion des Katheters nach sorgfältiger Desinfektion an der bereits für die Punktion vorgesehenen Einstichstelle - bei länger liegendem Dauerkatheter gibt es folgende Indikationen zur Urinuntersuchung: bei symptomatischen Patienten mit Fieber, bei interventionellen Eingriffen, z. B. bei Katheterwechsel. Transport und Lagerung: - Nativurin: ≤ 2 h bei RT, bei längerem Transport Lagerung bis zu 24 h bei 4°C. - Urikult: Bebrütung im Brutschrank bei 36°C, bei sichtbarem Bakterienwachstum Einsendung in die Bakteriologie. --------------------------------------------------------------------------------------------------------------------------- Einmalkatheterurin Eine transurethrale Katheterisierung kann routinemäßig nicht empfohlen werden. Wegen der Gefahr der Keimeinschleppung sollte sie bei Männern oder Jungen zur diagnostischen Uringewinnung gar nicht und bei Frauen oder Mädchen nur in Ausnahmefällen durchgeführt werden, z. B. wenn eine MSU-Gewinnung oder eine Blasenpunktion nicht möglich sind. Probengefäße: Urinröhrchen, Urikult. Materialentnahme: Hygienische Händedesinfektion, sterile Unterlage ausbreiten, Übergießen der sterilen Tupfer mit Desinfektionsmittel, nach ausreichender Blasenfüllung wird das Orificium urethrae wie oben beschrieben gereinigt und die Umgebung sorgfältig mit einer Desinfektionslösung desinfiziert: Frauen - bei der Frau wird der letzte Tupfer in den Vaginaleingang gelegt - danach wird unter aseptischen Bedingungen der Katheter ca. 5 cm in die Urethra eingeführt; sobald Urin läuft, Katheter nicht mehr weiter schieben! - nach Einführen des Katheters wird die erste Urinprobe verworfen, dann wird der Urin in einem sterilen Behälter aufgefangen Männer - beim Mann erfolgt zunächst die Applikation eines Lokalanästhetikum-haltigen Gleitmittels mit einer sterilen Spritze in die Urethraöffnung - Einführen des Katheters mit einer sterilen Pinzette etwa 10 cm bis der Urin fließt - am Schluss Katheter durch leichten Zug entfernen Transport und Lagerung: - Nativurin: ≤ 2 h bei RT, bei längerem Transport Lagerung bis zu 24 h bei 4°C. - Urikult: Bebrütung im Brutschrank bei 36°C, bei sichtbarem Bakterienwachstum Einsendung in die Bakteriologie. --------------------------------------------------------------------------------------------------------------------------- Seite 198 von 281 Erststrahlurin Probengefäße: Urinröhrchen, Urikult. Materialentnahme: Frauen: - Unterwäsche ausziehen, Hände mit Wasser und Seife waschen, mit Einmalhandtuch abtrocknen - mit einer Hand Labien spreizen - mit der anderen Hand Vulva mittels eines mit Leitungswasser angefeuchteten Tupfers durch Wischen von vorne nach hinten reinigen, mit einem zweiten Tupfer nachreinigen und Harnröhrenöffnung mit einem dritten Tupfer nachtrocknen - um Harnrückfluss und damit mögliche Verunreinigung durch Fluor zu verhindern, den dritten Tupfer in den Introitus vaginae einlegen - erste Urinprobe (ca. 50 ml) gewinnen und in Probengefäß überführen. Männer: - Hände mit Wasser und Seife waschen, mit Einmalhandtuch abtrocknen - Vorhaut mit einer Hand zurückstreifen; Glans penis mit der anderen Hand mittels eines mit Leitungswasser angefeuchteten Tupfers reinigen, mit zweitem Tupfer nachreinigen und Harnröhrenöffnung mit einem dritten Tupfer trocknen - erste Urinprobe (ca. 50 ml) gewinnen und in Probengefäß überführen. Transport und Lagerung: - Nativurin: ≤ 2 h bei RT, bei längerem Transport Lagerung bis zu 24 h bei 4°C. - Urikult: Bebrütung im Brutschrank bei 36°C, bei sichtbarem Bakterienwachstum Einsendung in die Bakteriologie --------------------------------------------------------------------------------------------------------------------------- Mittelstrahlurin (MSU) Mittel der Wahl für die Uringewinnung ist die Gewinnung von Mittelstrahlurin (MSU), da es dabei zu keiner Beeinträchtigung der Patienten kommt. Bei Kindern wird die Gewinnung von MSU etwa ab dem 4. Lebensjahr empfohlen, wenn keine Balanitis oder Vulvitis vorliegt. Bei den Fällen, bei denen keine eindeutigen Befunde mittels MSU-Proben zu gewinnen sind oder die Gewinnung von MSU nicht möglich ist sowie bei Kindern unter 3 Jahren, müssen andere Verfahren angewandt werden. Am besten geeignet zur Untersuchung ist der Morgenurin. Im Idealfall sollte zwischen der Gewinnung der Urinprobe und der letzten Miktion mindestens 3 h liegen. Bei einer vorliegenden Pollakisurie ist dies allerdings nicht möglich. Die Urinentnahme sollte vor Beginn einer antibiotischen Therapie erfolgen. Bei positivem Hemmstofftest (Nachweis von antibiotischer Aktivität im Urin) muss die Urinuntersuchung nach Absetzen der Antibiotika wiederholt werden. Bei der Therapie mit Chinolonen oder Aminoglykosiden ist ein therapiefreies Intervall von 5 Tagen, bei den übrigen Antibiotika von 3 Tagen einzuhalten. Seite 199 von 281 Probengefäße: Urinröhrchen, Urikult. Materialentnahme: Die Entnahme von Mittelstrahlurin sollte zur Vermeidung von Kontaminationen sehr sorgfältig durchgeführt werden. Frauen: - Unterwäsche ausziehen, Hände mit Wasser und Seife waschen, mit Einmalhandtuch abtrocknen - mit einer Hand Labien spreizen - mit der anderen Hand Vulva mittels eines mit Leitungswasser angefeuchteten Tupfers durch Wischen von vorne nach hinten reinigen, mit einem zweiten Tupfer nachreinigen und Harnröhrenöffnung mit einem dritten Tupfer nachtrocknen - um Harnrückfluss und damit mögliche Verunreinigung durch Fluor zu verhindern, den dritten Tupfer in den Introitus vaginae einlegen - erste Urinprobe (ca. 50 ml) verwerfen, und ohne den Harnstrahl zu unterbrechen, Urinprobe ( 5 ml) in einem Einwegbecher mit einem weiten Lumen auffangen - Beschriften des Gefäßes und bis zum Transport in den Kühlschrank stellen Männer: - Hände mit Wasser und Seife waschen, mit Einmalhandtuch abtrocknen - Vorhaut mit einer Hand zurückstreifen; Glans penis mit der anderen Hand mittels eines mit Leitungswasser angefeuchteten Tupfers reinigen, mit zweitem Tupfer nachreinigen und Harnröhrenöffnung mit einem dritten Tupfer trocknen - erste Urinprobe (ca. 50 ml) verwerfen und, ohne den Harnstrahl zu unterbrechen, Urinprobe ( 5 ml) im sterilen Einwegbecher auffangen - Beschriften des Gefäßes und bis zum Transport in den Kühlschrank stellen Transport und Lagerung: - Nativurin: ≤ 2 h bei RT, bei längerem Transport Lagerung bis zu 24 h bei 4°C. - Urikult: Bebrütung im Brutschrank bei 36°C, bei sichtbarem Bakterienwachstum Einsendung in die Bakteriologie --------------------------------------------------------------------------------------------------------------------------- Seite 200 von 281 Serologie Abkürzungen: ASD: Ag: ASL: ELFA: ELISA: FTA-ABS: HAT: IE: IFT: KBR: PA: TPPA: VDRL: Antistreptokokken DNase Antigen Antistreptolysin-O-Reaktion Enzyme-linked fluorescence assay Enzyme-linked immunosorbent assay Fluoreszenz-Treponema-Antikörper-Absorptionstest Hämagglutinationstest Immunelektrophorese Immunfluoreszenztest Komplementbindungsreaktion Partikelagglutinationstest Treponema pallidum Partikelagglutinationstest Venereal-Disease-Research-Laboratory-Test I. Bakteriologie Bartonella henselae Patientenauswahl: Patienten mit V. a. Katzenkratzkrankheit (fieberhafte Lymphadenitis, ZNSBeteiligung, Endokarditis nach Katzenbiss oder -kratzer). Immunsupprimierte Patienten mit V. a. bazilläre Angiomatose (kutane blaurote Läsionen) bzw. Peliosis hepatis (bazilläre Hepatitis). Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: Immunfluoreszenztest (IgG und IgM) Die Serologie wird extern durchgeführt (Institut für Medizinische Mikrobiologie, Universitätsklinikum Tübingen, Elfriede-Aulhorn-Str.6, 72076 Tübingen). Borrelia burgdorferi Patientenauswahl: Patienten mit Facialisparese, lymphozytärer Meningitis/Meningoradikulitis, chron. Enzephalomyelitis, Arthralgien, Oligoarthritis, chron. rezidivierende Arthritis, Karditis, Myositis, Acrodermatitis chronica atrophicans. Die Serodiagnostik ist für das Erythema migrans in der Regel nicht von differentialdiagnostischer Bedeutung, da die Sensitivität mit ca. 50% zu niedrig ist! Untersuchungsmaterial: Serum 3 ml, Liquor 1 ml Untersuchungsverfahren: ELISA (IgG und IgM); Immunoblot (IgG und IgM) Befundinterpretation: Bewertung: Extinktion Probe: positiv: > Cut-off-Wert + 20 % Grenzwert: ≥ Cut-off-Wert bis Cut-off-Wert + 20 % negativ: < Cut-off-Wert Sensitivität: 97% für ELISA und Immunoblot (außer Erythema migrans, s. o.) Die Serodiagnostik wird im Sinne einer Stufendiagnostik durchgeführt (1. Stufe ELISA als ScreeningTest; 2. Stufe Immunoblot als Bestätigungsreaktion). EIA und Immunoblot differenzieren nach IgGund IgM-Antikörpern. IgM-Antikörper sind in der Regel im Stadium I und II nachweisbar, können aber auch länger persistieren. Der alleinige Nachweis von IgG-Antikörpern kann sowohl Ausdruck einer Seite 201 von 281 manifesten Infektion, als auch eines Durchseuchungstiters mit fehlender klinischer Symptomatik sein. Bei Verdacht auf Neuroborreliose wird im EIA die intrathekale Antikörperproduktion im Liquor überprüft und die gemessene Antikörperkonzentration mit der im Serum in Relation gesetzt. Erhöhte Serum/Liquor-Quotienten werden in nur etwa 65% bei neurologischen Manifestationen gefunden. Ein negativer Antikörperbefund im Liquor schließt deshalb eine Neuroborreliose nicht aus! Brucella abortus Patientenauswahl: Patienten mit rezidivierendem Fieber unklarer Genese, Patienten mit chronisch verlaufender Allgemeinerkrankung mit mäßig hohem Fieber (undulierende Fieberkurve!). Anamnestisch ist der Aufenthalt in Mittelmeerländern und der Verzehr von Rohmilchprodukten von Bedeutung. Die Serologie hat wegen des langsamen Wachstums der Erreger und häufigen falsch negativen kulturellen Befunden einen hohen Stellenwert. Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: KBR, Widal´sche Agglutinationsreaktion, Coombs-Test Befundinterpretation: Positive Bewertung: KBR-Titer > 16; Widal-Titer ≥ 160; Coombs-Test > 4 Titerstufen als Widal-Titer Die KBR weist hauptsächlich IgG-Antikörper nach und ist deshalb insbesondere zur Serodiagnostik der chronischen Brucellose geeignet. Die Widal´sche Agglutinationsreaktion weist insbesondere IgMAntikörper nach und ist daher für die Serodiagnostik einer akuten Brucellose geeignet. Der CoombsTest erfasst inkomplette Antikörper, insbesondere IgG und IgA. Dieser Test wird bei fortbestehendem klinischem Verdacht und negativem Widal-Test angeschlossen. Hier besteht häufig Übereinstimmung mit den Ergebnissen der KBR. Die mit Brucella abortus-Antigen durchgeführten Testverfahren erlauben auch die Diagnose einer durch B. melitensis und B. suis verursachten Erkrankung. Kreuzreaktionen bestehen u. a. mit Enterobacteriaceen und Francisella. Seite 202 von 281 Campylobacter jejuni Patientenauswahl: Patienten mit reaktiver Arthritis und Guillain-Barré-Syndrom nach vorangegangener Diarrhoe Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: Immunoblot (IgA und IgG) Befundinterpretation: Sensitivität: 78% (bezogen auf kulturell gesicherte Campylobacter Infektionen) IgA-Antikörper finden sich während akuter und ausheilender Infektionen, können aber bei Folgeerkrankungen (z.B. reaktive Arthritis) persistieren. Chlamydia trachomatis Patientenauswahl: Patienten mit chronischen und persistierenden Chlamydia trachomatis-Infektionen (reaktive Arthritis, Urethritis, Prostatitis, Salpingitis, Infertilität, Extrauteringravidität), Patienten mit follikulärer Konjunktivitis. Untersuchungsmaterial: Serum 3 ml, Bindehautabstriche (auf Objektträger abgerollt und fixiert). Untersuchungsverfahren: IgA-ELISA und IgG-ELISA (urogenitale Erkrankung, Pneumonie bei Frühund Neugeborenen, reaktive Arthritis), Antigen-IFT (okuläre Erkrankung). Befundinterpretation: Bewertung: negativ: < 22 AU/ml; grenzwertig: 22-28 AU/ml; positiv: > 28 AU/ml (Messbereich: 22 - 200 AU/ml) IFT: >10 apfelgrün fluoreszierende Chlamydia trachomatis-Zellen Spezifität: IgA (98%); IgG (95%) Sensitivität bei akuter lokaler Infektion: IgA: 18-26%; IgG: 77-82% Sensitivität bei chron. persistierender Infektion: IgA: 44-48%; IgG: 89-100% Die hohe Spezifität des Verfahrens ergibt sich aus der Verwendung eines Spezies-spezifischen Peptids (variable Domäne aus der immunodominanten MOMP-Region). Die frühe Phase der Infektion ist serologisch nur unsicher zu erfassen, da Spezies-spezifische Antikörper erst 3-6 Wochen nach Infektion gebildet werden. Der Nachweis von IgA- und IgG-Antikörpern weist auf eine akute oder chronisch persistierende Infektion hin. Der alleinige IgG- Nachweis ist als abgelaufene Infektion zu werten, ist aber auch bei chronisch persistierenden Infektionen anzutreffen. Die Antikörper–Prävalenz ist in der gesunden Bevölkerung aufgrund der breiten Durchseuchung hoch (IgA 40%, IgG 65%). Seite 203 von 281 Chlamydophila pneumoniae Patientenauswahl: Patienten mit persistierenden oder aktiven Chlamydophila pneumoniae-Infektionen (Bronchitis, Sinusitis, chronische obstruktive Atemwegserkrankungen, atypische Pneumonien und reaktive Arthritis). Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: ELISA (IgA und IgG) Befundinterpretation: Bewertung: negativ: < 22 AU/ml; grenzwertig: 22-28 AU/ml; positiv: > 28 AU/ml Spezifität: IgA (94,9%); IgG (96,8%) Sensitivität: IgA: 99%; IgG: 99% Die hohe Spezifität des Verfahrens ergibt sich aus der Verwendung eines hochaufgereinigten und spezifischen Antigens. Der Nachweis von IgA- und IgG-Antikörpern gegen C. pneumoniae erlaubt eine Abklärung des Infektionsstatus und des Therapieverlaufs. Coxiella burnetii Patientenauswahl: Patienten mit Verdacht auf Q-Fieber Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: KBR (Phase 1 AG / Phase 2 AG) Befundinterpretation: Bewertung: >20 positiv (KBR-Titer) Kreuzreaktionen mit anderen Mikroorganismen sind unbekannt. Die gegen Phase 1 und Phase 2 gerichteten spezifischen Antikörper dienen der Differenzierung von akutem, zurückliegendem sowie chronischem Q-Fieber. Antikörper ab 1 : 40 gegen Phase 2 sprechen für ein akutes Q-Fieber, Antikörper > 1 : 200 gegen Phase 1 werden als Indikator für einen chronischen Verlauf angegeben. Seite 204 von 281 Diphtherie-Antitoxin (Impfstatus) Patientenauswahl: Die Bestimmung des Diphtherie-Antitoxin-Titers ist indiziert bei unklarem Impfstatus und zur Kontrolle der Immunantwort bei bestimmten Grundkrankheiten (z. B. Malignomen, AIDS, hämatologischen Erkrankungen) oder therapeutischen Maßnahmen (z. B. Immunsuppression, Zytostatika, Bestrahlung). Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: ELISA Befundinterpretation: Die Testergebnisse werden als IE/ml angegeben. <0,1 IE/ml: Antikörper in niedriger Konzentration gegen Diphtherie-Toxin vorhanden. Der Antikörpernachweis ist kein Entscheidungskriterium für eine Auffrischimpfung. Hierfür kann nur die Impfanamnese hinzugezogen werden. >0,1 IE/ml: Antikörper gegen Diphtherie-Toxin vorhanden. Der Antikörpernachweis ist kein Entscheidungskriterium für eine Auffrischimpfung. Hierfür kann nur die Impfanamnese hinzugezogen werden. Seite 205 von 281 Escherichia coli O157 (EHEC) Patientenauswahl: Patienten mit V. a. enteropathisches hämolytisch-urämisches Syndrom (HUS) oder inkomplettem HUS. Untersuchungsmaterial: Serum 3 ml Untersuchung wird im Auftrag bei Prof. Dr. med. Helge Karch am Universitätsklinikum Münster, Institut f. Hygiene, Robert-Koch-Str. 41, 48149 Münster durchgeführt. Francisella tularensis Patientenauswahl: Patienten mit Verdacht auf Tularämie. Anamnestisch ist der Aufenthalt besonders in den USA und im Süden Russlands, sowie Kontakte mit infizierten Tieren (Jäger!) oder Insektenstichen von Bedeutung. Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: Widal´sche Agglutinationsreaktion Befundinterpretation: Antikörper lassen sich frühestens 2 Wochen nach Infektion nachweisen. Titer von ≥ 40 gelten als Hinweis. Ansteigende Antikörpertiter sichern die Diagnose. Kreuzreaktionen mit Brucellen sind häufig. Seite 206 von 281 Helicobacter pylori Patientenauswahl: Patienten mit Magenbeschwerden, bei denen keine Indikation oder eine Kontraindikation für die Gastroskopie besteht. In der Regel ist eine endoskopische Untersuchung mit H. pylori-Nachweis der serologischen Diagnostik vorzuziehen. Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: ELISA (IgG); Immunoblot (IgG) Befundinterpretation: Sensitivität: 90% Spezifität: 90% ELISA; 100% Immunoblot Die Serodiagnostik wird im Sinne einer Stufendiagnostik durchgeführt (1. Stufe ELISA als ScreeningTest; 2. Stufe Immunoblot als Bestätigungsreaktion). Der Nachweis von IgG-Antikörpern spricht für das Vorliegen einer chronischen Infektion mit Helicobacter pylori. Der Nachweis von IgA- oder IgMAntikörpern ist ohne praktische diagnostische Bedeutung. IgG-Antikörper gegen H. pylori bleiben auch nach erfolgreicher Eradikationstherapie u. U. noch monate- bis jahrelang nachweisbar, so dass sich die Serologie nur sehr eingeschränkt zur Kontrolle des Erfolgs einer Eradikationstherapie eignet. Für diese Fragestellung ist ein 13 C-Harnstoff-Atemtest vorzuziehen. Der Nachweis CagA-spezifischer Antikörper kann von Bedeutung sein, da Patienten mit Ulcus, Carcinom oder Lymphom in den meisten Fällen mit CagA-positiven Stämmen infiziert sind. Legionella pneumophila Patientenauswahl: Patienten mit atypischer Pneumonie Untersuchungsmaterial: 10 ml Urin (Antigennachweis) Untersuchungsverfahren: ELISA Befundinterpretation: positiv > cut-off Sensitivität: 70% Spezifität: 99,8% Der sensitive und sehr spezifische Legionellen-Antigennachweis ist eine wichtige Ergänzung zum kulturellen Erregernachweis, der weniger sensitiv ist. Da signifikante Antikörpertiter erst sehr spät (bis zu 6 Wochen) nach einer Infektion auftreten, wird für die Akutdiagnostik einer Legionellose kein Antikörper- sondern ein Antigen-Nachweis durchgeführt. Ein negatives Ergebnis schließt jedoch eine Legionelleninfektion nicht aus, da die Ausscheidung grundsätzlich zeitlich variabel sein kann. Die Sensitivität lässt sich durch Testwiederholung auf 95% steigern, kann aber bei der nosokomialen Infektion niedriger als bei der ambulant erworbenen Erkrankung liegen. Durch eine Makrolid-Therapie wird die Antigen-Ausscheidung nicht beeinflusst. Seite 207 von 281 Leptospira species Patientenauswahl: Patienten mit V. a. Leptospirose (hochfieberhafte, plötzlich einsetzende Allgemeinerkrankung mit Konjunktivitis, Hepatitis; auch Meningitis, Pneumonie nach Kontakt zu Nager- und Wildtierurin, bzw. damit kontaminierte Böden und Wasser). Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: Mikroagglutinationsverfahren, ELISA Die Serologie wird extern durchgeführt (Bayerisches Landesamt für Gesundheit und Lebensmittelsicherheit, Veterinärstr. 2, 85764 Oberschleißheim) Mycoplasma pneumoniae Patientenauswahl: Patienten mit schweren Infektionen der Atemwege (Pharyngitis, Otitis, Tracheobronchitis, interstitieller Pneumonie, Pleuraerguss) und Patienten mit neurologischen Manifestationen (unklare Meningitis, Encephalitis, Meningoencephalitis, transverse Myelitis, Hirnnervenlähmungen wie Facialisparese, Psychosen, Gilles de la Tourette-Syndrom, Guillain-BarréSyndrom, Hirnstammsymptomatik und Hirninfarkte). Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: Partikelagglutinationstest (PA), ELISA: IgG/IgA/IgM (Immunoblot) Befundinterpretation: Grenzwert: 40 (PA) Die serologische Diagnose der Mycoplasma pneumoniae-Infektion erfolgt stufenweise. Die erste Stufe besteht aus dem Partikelagglutinationstest (PA), einem Screening-Test mit guter Sensitivität (100%) und Spezifität (95,6%). Dieser Test erfasst vorwiegend IgM-, aber auch IgG-Antikörper. Die 2. Stufe besteht aus dem ELISA zum Nachweis von rekombinantem Antigen-Gemisch gegen M. pneumoniae. Dieser Test hat eine hohe Spezifität (IgA: 98%, IgG: 80 %)) und beruht auf dem Nachweis von Antikörpern gegen rekombinante Antigene (u. a. P 1). Ein 3 bis 4facher Titeranstieg im PA oder der Nachweis von IgM- und IgA-Antikörpern im ELISA bei einem Titer ≥ 40 im PA spricht für eine akute Infektion. Isolierte IgG-Antikörper-Nachweise über einen langen Zeitraum im ELISA sprechen für eine abgelaufene Infektion. Bei Infektionen mit M. pneumoniae sind isoliert erhöhte IgM-Werte ebenso möglich, wie IgG- und IgMReaktionen (bei erkrankten Kindern mit einer Erstinfektion). Bei Erwachsenen ist eine IgG- und IgMReaktion, aber auch eine Reaktion ohne IgM-Beteiligung, dafür aber eine IgA-Antikörperbildung vor allem bei Sekundärinfektionen möglich. Die frühe Phase einer Infektion wird mit serologischen Verfahren nicht erfasst, da die Antikörperantwort relativ spät nach Beginn der klinischen Symptomatik einsetzt. Seite 208 von 281 Neisseria gonorrhoeae Patientenauswahl: Patienten mit Verdacht auf chronische verlaufende Gonorrhoe, Arthritis Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: KBR Befundinterpretation: Bewertung: 20 Grenzwert; ≥20 positiv (KBR-Titer) Die Untersuchung ist nur sinnvoll für den beschriebenen Patientenkreis, jedoch für die Diagnostik der akuten Gonorrhoe nicht geeignet. Wegen zahlreicher Kreuzreaktionen mit anderen bakteriellen Erregern sind falsch positive Ergebnisse nicht selten. Rickettsia sp. Patientenauswahl: Patienten mit Verdacht auf Fleckfieber, Zeckenbissfieber oder Tsutsugamushi-Fieber Untersuchungsmaterial: Serum 3 ml Die Untersuchung wird am Bernhard-Nocht-Institut, Bernhard-Nocht-Straße 74, 20359 Hamburg durchgeführt. Seite 209 von 281 Salmonella spp Patientenauswahl: Patienten mit Verdacht auf Typhus/Paratyphus/Enteritis, Verdacht auf reaktive Arthritis nach vorangegangener Diarrhoe Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: Widal Befundinterpretation: Bewertung: Titer von >100 gelten als positiv, Titerbewegungen um 2 Stufen können ebenfalls hinweisend auf eine Infektion sein. Streptococcus pyogenes Patientenauswahl: Die serologische Untersuchung beschränkt sich auf Patienten mit Verdacht auf akutes rheumatisches Fieber, Chorea minor und akute Glomerulonephritis, da bei diesen postinfektiösen Krankheitsbildern die Streptokokken selbst oft kulturell nicht mehr nachweisbar sind. Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: Antistreptolysin-O-Reaktion (ASL); Antistreptokokken-DNase B (ASD) Befundinterpretation: Ein Titeranstieg um 2 Stufen gilt als signifikant. Stehen nur Einzelseren zur Verfügung, werden ASLTiter ≥ 200 IE und ASD-Titer ≥ 200 IE als positiv bewertet. Die Sensitivität der ASL-Reaktion beträgt 80%. Sie ist nicht spezifisch für S. pyogenes, da Streptoloysin-O auch von Gruppe C- und GStreptokokken gebildet wird und Kreuzreaktionen auch mit anderen Hämolysinen grampositiver Bakterien bestehen. Zur Erhöhung der Spezifität und Sensitivität wird zusätzlich der ASD (Sensitivität 80%) durchgeführt. Seite 210 von 281 Tetanus-Antitoxin (Impfstatus) Patientenauswahl: Die Bestimmung des Tetanus-Antitoxin-Titers ist indiziert bei unklarem Impfstatus und zur Kontrolle der Immunantwort bei bestimmten Grundkrankheiten (z. B. Malignomen, AIDS, hämatologischen Erkrankungen) oder therapeutischen Maßnahmen (z. B. Immunsuppression, Zytostatika, Bestrahlung). Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: ELISA Die Testergebnisse werden als IU/ml angegeben. <0,1 IU/ml Antikörper in niedriger Konzentration gegen Tetanus-Toxin vorhanden. Der Antikörpernachweis ist kein Entscheidungskriterium für eine Auffrischimpfung. Hierfür kann nur die Impfanamnese hinzugezogen werden. >0,1 IU/ml: Antikörper gegen Tetanus-Toxin vorhanden. Der Antikörpernachweis ist kein Entscheidungskriterium für eine Auffrischimpfung. Hierfür kann nur die Impfanamnese hinzugezogen werden. Seite 211 von 281 Treponema pallidum Patientenauswahl: Patienten mit Verdacht auf Syphilis, einschl. Neurosyphilis und konnatale Syphilis; Untersuchungen im Rahmen der Schwangerschaftsvorsorge Untersuchungsmaterial: Serum 3 ml, Liquor 1 ml Untersuchungsverfahren: TPPA, VDRL, FTA-ABS (IgG), IgM-Blot Befundinterpretation: Bewertung: positiv ≥80 (TPPA-Titer); 1 (VDRL-Titer); FTA-ABS Als Suchtest dient der TPPA, der im positiven Falle mit dem FTA-ABS bestätigt wird. Eine Unterscheidung zwischen florider Infektion und Serumnarbe ist mit diesen Verfahren nicht möglich. Hierzu wird der Nachweis antilipoidaler Antikörper (VDRL) durchgeführt. Kreuzreaktionen bei rheumatischen Erkrankungen, malignen Tumoren und der Borreliose können vorkommen. Da antilipoidale Antikörper jedoch erst ab der 3. Woche nach der Infektion gebildet werden, wird in Zweifelsfällen ein Treponemen-spezifischer IgM-Blot zur Diagnose einer frischen Infektion durchgeführt. Persistierende IgM-Antikörper sind jedoch beschrieben. Der serologische Befund muss daher immer zusammen mit der klinischen Symptomatik interpretiert werden. Zur Therapiekontrolle wird ebenfalls der VDRL herangezogen; ein Sinken um zwei Titerstufen gilt als signifikant. Bei infizierten Schwangeren besteht schon in der Frühschwangerschaft die Gefahr der Übertragung der Treponemen auf das ungeborene Kind. Die konnatale Syphilis ist serologisch durch das Vorhandensein von IgM neben positivem TPPA, FTA-ABS und VDRL im kindlichen Blut charakterisiert; sie muss von einem möglichen Leihtiter von der Mutter abgegrenzt werden (fehlendes IgM beim Neugeborenen). Bei Verdacht auf Neurosyphilis wird neben Serum auch Liquor untersucht (TPPA, FTA-ABS, VDRL). Für die Bestimmung des intrathekalen Antikörper (ITPA)-Index wird die Angabe von Gesamt-IgG aus Serum und Liquor benötigt; ein Index > 3,0 zeigt eine autochtone Antikörperproduktion im Liquor an. Seite 212 von 281 Yersinia enterocolitica/Y. pseudotuberculosis Patientenauswahl: Die Serologie hat Bedeutung insbesondere bei nichtenteritischen Yersiniosen (mesenteriale Lymphadenopathie, Pseudoappendizitis, chronisch rezidivierende Ileokolitis, extramesenteriale Manifestationen und Sepsis) sowie Folgeerkrankungen (reaktive Arthritis und andere Manifestationen aus dem rheumatischen Formenkreis) Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: ELISA (IgA u. IgG); Immunoblot (IgA u. IgG) Befundinterpretation: Die Diagnostik wird im Sinne einer Stufendiagnostik durchgeführt. Positive ELISA-Befunde (Screening) werden im Immunoblot verifiziert und eine Differenzierung der Immunglobulinklasse nach IgG und IgA durchgeführt. IgA-Antikörper finden sich während akuter und ausheilender Infektionen, können aber bei Folgeerkrankungen (z. B. reaktive Arthritis) persistieren. Serologisch ist eine Differenzierung zwischen Yersinia pseudotuberculosis und Y. enterocolitica nicht möglich. Seite 213 von 281 II. Mykologie Aspergillus fumigatus Patientenauswahl: Patienten mit Verdacht auf Aspergillus fumigatus-assoziierte Erkrankungen Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: ELISA (Antigennachweis), rekombinanter IgG-ELISA, KBR, IE (Antikörpernachweis) Befundinterpretation: Bewertung: KBR positiv ≥ 1:5; IE positiv ≥ 2 Banden; IgG-ELISA (semiquantitativ Index 0,8-1,0 grenzwertig, > 1,0 positiv); Antigennachweis (Index ≥ 0,5 positiv) Sensitivität: Ag-ELISA 90% Spezifität: Ag-ELISA 98,9 – 98,6% Das diagnostische Vorgehen besteht aus einer Kombination von Antigen und Antikörpernachweis. Der Antigennachweis kann schon vor Auftreten klinischer und radiologischer Zeichen einer Aspergillose positiv werden und ist deshalb zur Überwachung von Risikopatienten geeignet. Da die Diagnosestellung jedoch nicht in allen Erkrankungsphasen durch den Antigennachweis gelingt, muss die serologische Diagnostik durch den Nachweis von Antikörpern gegen Aspergillus fumigatus ergänzt werden. Seltene Aspergillus-Spezies Patientenauswahl: Patienten mit Verdacht auf eine durch Aspergillus niger oder Aspergillus versicolor hervorgerufene Erkrankung. Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: Immunelektrophorese (IE) Befundinterpretation: Spezifische Tests zum Nachweis von Antigenen dieser Spezies stehen nicht zur Verfügung. Fehlende Antikörper bei schwerer Immunsuppression schließen eine Infektion mit den genannten Spezies nicht aus. Seite 214 von 281 Außereuropäische Systemmykosen durch Coccidioides immitis oder Histoplasma capsulatum Patientenauswahl: Patienten mit Verdacht auf Infektion mit Coccidioides immitis oder Histoplasma capsulatum Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: KBR, IE Befundinterpretation: Hinweise auf eine Infektion mit Coccidioides immitis oder Histoplasma capsulatum können durch die Darstellung von Antikörpern erhoben werden. Geeignete Testsysteme zum Nachweis von Antigenen dieser Spezies stehen nicht zur Verfügung. Candida albicans Patientenauswahl: Patienten mit Verdacht auf Candida-assoziierte Erkrankungen Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: Latexagglutination (Antigennachweis), KBR, HAT, IE (Antikörpernachweis) Befundinterpretation: Bewertung: KBR positiv ≥ 20; HAT positiv ≥ 640, grenzwertig 320; IE positiv ≥ 2 Banden; LatexAntigen positiv ≥ 4 Da nicht alle Erkrankungsstadien und Krankheitsbilder mit einer fassbaren Antigenämie einhergehen, andererseits aber nicht alle Erkrankten in der Lage sind, Antikörper zu produzieren (Immunsuppression), sollte der serologische Nachweis einer Candidose durch eine Kombination von Antigen- und Antikörpernachweis geführt werden. Seite 215 von 281 Cryptococcus neoformans, C. gattii Patientenauswahl: Patienten mit Verdacht auf Cryptococcus neoformans -assoziierte Erkrankungen Untersuchungsmaterial: Serum 3 ml, Liquor 1 ml Untersuchungsverfahren: Antigennachweis (Latex-Agglutination im Serum und Liquor) Befundinterpretation: Bewertung: positiv ≥2 Die Diagnostik der Kryptokokkose basiert im Wesentlichen auf dem Nachweis von Cryptococcus neoformans-Antigen in Serum und Liquor. Ein positiver Befund beweist eine Kryptokokkose. Exogen Allergische Alveolitis Patientenauswahl: Patienten mit Verdacht auf eine exogen allergische Alveolitis (Farmerlunge, Vogelhalterlunge) hervorgerufen durch nachfolgend beschriebene Antigene: Aspergillus fumigatus, Aspergillus niger, Aspergillus versicolor, Candida albicans, Thermoactinomyces vulgaris, Aureobasidium pullulans, Micropolyspora faeni, Penicillium notatum, Histoplasma capsulatum, Coccidioides immitis, Taubenserum, Hühnerserum. Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: Immunelektrophorese (IE) Befundinterpretation: Das Einatmen organischer Stäube kann eine exogen-allergische Alveolitis hervorrufen. Dabei können u. a. Bestandteile von Mikroorganismen als Antigene fungieren. Bei der Erkrankung werden spezifische Antikörper (vor allem IgG) gebildet, die mittels IE nachweisbar sind. Seite 216 von 281 III. Parasitologie Echinococcus spp. Patientenauswahl: Personen mit Erkrankungen der Leber oder Raumforderungen in der Leber und/oder zystischen Veränderungen in anderen Organen; Risikopersonen (Jäger und Berufstätige in land- und forstwirtschaftlichen Betrieben in Endemiegebieten). Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: Echinococcus granulosus (rekomb. ELISA, HAT, Westernblot); Echinococcus multilocularis (ELISA; rekomb. ELISA, Westernblot) Befundinterpretation: Bewertung: > 160 HAT positiv; ELISA Index ≥1,0 positiv Die serologische Untersuchung wird im Sinne einer Stufendiagnostik durchgeführt. Die erste Stufe verwendet serologische Testverfahren (ELISA, HAT) mit Gesamtantigenpräparationen. Bei Verdacht auf eine alveoläre Echinokokkose sollen die Tests mit E. multilocularis-Larvenantigen, bei Verdacht auf eine zystische Echinokokkose mit Hydatidenflüssigkeit von E. granulosus durchgeführt werden. Fallen diese Untersuchungen positiv aus, stehen rekombinante Antigene zur Verfügung, die den Befund bestätigen und serologisch eine Art-Identifizierung erlauben. Die Sensitivität der ScreeningTests liegt für E. multilocularis bei > 95%, für E. granulosus bei ca. 80%. In 93% der im ScreeningTest positiven E. multilocularis Patientenseren und in 89% der im E. granulosus Screening-Test positiven Seren ist die serologische Differenzierung in der anschließenden 2. diagnostischen Stufe möglich. Bei keinem eindeutigen serologischen Ergebnis kann zusätzlich ein Westernblot durchgeführt werden. Entamoeba histolytica Patientenauswahl: Patienten nach Aufenthalt in tropischen und subtropischen Gebieten mit intestinalen Beschwerden (breiige Durchfälle mit blutig-schleimigen Auflagerungen); bei Verdacht auf Leberabszess (Schmerzen im Oberbauch, Fieber und Leukozytose). Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: IFT Befundinterpretation: Bewertung: Grenzwert 50, positiv ≥100 (IFT-Titer) Die Serologie ist vor allem zum Nachweis von Antikörpern bei der extraintestinalen Amöbiasis indiziert. Nicht invasive Infektionen führen nur ausnahmsweise zur Bildung von Antikörpern; invasive Infektionen, die sich auf den Darm beschränken, nur zu einem geringen Anteil (20-30%), während ein extraintestinaler Befall fast immer mit hohen Antikörpertitern einhergeht. Seite 217 von 281 Leishmania spp. Patientenauswahl: Patienten mit Verdacht auf viszerale und mukokutane Leishmaniose Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: Blot Befundinterpretation: Bewertung: 1 oder 2 gut sichtbare spezifische Banden (P14 oder P16) sprechen für eine Leishmaniose. Bei der kutanen Form sind Antikörper meist nicht oder nur in niedrigen Konzentrationen nachweisbar. Generalisierte Infektionen (viszerale und mukokutane Leishmaniose) führen dagegen zu einer ausgeprägten Antikörper-Antwort (Ausnahme: Patienten mit Immunsuppression). Schistosoma spp. Patientenauswahl: Patienten nach Aufenthalt in Endemiegebieten und Exposition. Die Serologie hat ihren Stellenwert insbesondere in der 3 Monate dauernden Präpatenz, solange noch keine Eier ausgeschieden werden. Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: HAT Befundinterpretation: 80-90% aller Fälle verlaufen serologisch positiv. HAT Titer ≥ 16 sind diagnostisch verwertbar. Serumtiter von an Bilharziose erkrankten Patienten liegen zwischen 256 und 1024. Für die Interpretation des serologischen Befundes muss die Anamnese, das klinische Bild und der positive bzw. fehlende Nachweis von Schistosoma-Eiern im Stuhl bzw. Urin hinzugezogen werden. Seite 218 von 281 Taenia solium Patientenauswahl: Patienten mit einer oder mehreren cerebralen Zysten und neurologischer Symptomatik sollten auf das Vorliegen einer Neurozystizerkose untersucht werden. Die Serologie ist nicht geeignet zum Nachweis eines Darmbefalls mit dem adulten Schweinebandwurm! Untersuchungsmaterial: Serum 3 ml, Liquor 1ml Untersuchungsverfahren: Immunoblot (IgG) Befundinterpretation: Serum: 2 gut sichtbare spezifische Banden sprechen für Zystizerkose Liquor: 1 gut sichtbare spezifische Bande spricht für Zystizerkose Aufgrund häufig fehlender Antikörperproduktion insbesondere in Fällen mit singulären Zysten (30% falsch negativ) spielt die serologische Laboratoriumsdiagnostik bei der Neurozystizerkose nur eine untergeordnete Rolle. Computertomographie und NMR des ZNS sollten als diagnostische Verfahren an erster Stelle stehen. Hilfreich bei der Diagnosestellung ist auch eine Weichteilaufnahme des Oberschenkels zum Nachweis von Verkalkungen in Muskulatur und Bindegewebe. Die Serologie als untergeordnetes diagnostisches Prinzip dient zur Bestätigung radiologischer Befunde und hat ihren Platz bei unklaren radiologischen Befunden. Der intrathekale Antikörpernachweis hat einen sehr hohen diagnostischen Stellenwert. Toxocara canis Patientenauswahl: Landwirtschaftlich tätige Personen, Hund-, Katzen,- Nutztierhalter und Personen aus Entwicklungsländern sind auf das Vorliegen einer Toxokarose bei folgender klinischer Symptomatik in Betracht zu ziehen: Fieber, respiratorische Symptome (Husten, Bronchitis, asthmatische Beschwerden), viszerale Erscheinungen (Abdominalschmerz, Hepatomegalie), dermatologische Symptome (urtikarielle Hautveränderungen), ophthalmologische Symptome. Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: ELISA (IgG) Befundinterpretation: 0,9 - 1,1 grenzwertig; > 1,1 positiv Kreuzreaktionen mit Antikörpern, die gegen andere Nematoden gerichtet sind, treten nur in begrenztem Maße auf, müssen aber differentialdiagnostisch abgegrenzt werden. Wegen der hohen Antikörperprävalenz in der Bevölkerung müssen die Differentialdiagnosen unbedingt berücksichtigt werden. Der Nachweis von Toxocara-spezifischen Antikörpern ohne klinische Symptomatik ist deshalb auch keine Indikation für eine Therapie. Seite 219 von 281 Toxoplasma gondii Patientenauswahl: Patienten mit Verdacht auf akute oder reaktivierte Toxoplasmose (Chorioretinitis, Lymphadenopathie, Enzephalitis, Myokarditis); Verdacht auf pränatale Toxoplasma-Infektion (Mikrooder Hydrocephalus mit intrazerebralen Verkalkungen, Chorioretinitis, Hepatitis, Myokarditis). Untersuchungsmaterial: Serum 3 ml, Liquor 1 ml Untersuchungsverfahren: Enzyme-linked fluorescence assay (ELFA): Competition, IgG, IgM, Aviditätsbestimmung; IgA-ELISA Befundinterpretation: Bewertung: Competition-ELFA (< 1,6 positiv, > 1,6 negativ); IgG-ELFA (< 4 U/ml negativ; ≥ 4 - 8 U/ml grenzwertig; ≥ 8 U/ml positiv); IgM-ELFA (< 0,55 negativ; ≥ 0,55-0,65 grenzwertig; ≥ 0, 65 positiv); Aviditätsbestimmung (< 0,2 niedrige Avidität; 0,2-0,3 grenzwertige Avidität; > 0,3 hohe Avidität). IgA positiv > 5,0 AU/ml. Die angegebenen Untersuchungsverfahren werden im Sinne einer Stufendiagnostik durchgeführt. Der Competition-ELFA dient als Suchtest für alle Antikörperklassen. Ist dieser Suchtest negativ, kann serologisch beim Immunkompetenten eine Toxoplasmose ausgeschlossen werden. Bei positivem Testresultat kommt als weiteres quantitatives Verfahren der IgG-ELFA und IgM-ELFA zur Anwendung. Bei positivem IgM wird die Aviditätsbestimmung von IgG-Antikörpern zur Differenzierung zwischen einer akuten Toxoplasmose und Erregerpersistenz durchgeführt, da im Laufe der Infektion die Avidität der Antikörper zunimmt. Bei der akuten Toxoplasmose sind bei Immunkompetenten in der Regel hohe IgM-, IgA- und IgGAntikörper mit im Verlauf der Infektion zunehmender Avidität nachweisbar. Es etabliert sich später ein Latenzstadium mit Persistenz des Erregers (niedriges IgG, fehlendes IgM, hohe Avidität). Eine Primärinfektion in der Schwangerschaft kann zu Fruchtschäden führen. Erbringt die Serologie in der Schwangerschaft ein negatives Ergebnis im Competition-, IgG- und IgM-ELFA, wird empfohlen, die Untersuchung alle 8 Wochen zu wiederholen. Die pränatale Infektion ist serologisch beim Neugeborenen durch das Vorhandensein von IgG-, IgM- und IgA-Antikörpern mit niedriger Avidität charakterisiert. Bei immunsupprimierten Personen können Reaktivierungen auftreten. Dabei sind IgG-Antikörper meist vorhanden und hochtitrig; IgM-Antikörper fehlen in der Regel. IgA-Antikörper sind meist deutlich erhöht, können aber fehlen. Die Avidität der Antikörper ist hoch. Seite 220 von 281 Trichinella spiralis Patientenauswahl: Patienten mit Fieber, Myositis, Bluteosinophilie, Gesichtsödem, rheumatischen Beschwerden (bei chronischen Verläufen). Häufig wird über den Genuss von rohem oder unzureichend gegartem Schweinefleisch im Ausland berichtet. In Deutschland kam es wiederholt zu Ausbrüchen durch Verzehr nicht untersuchten Fleisches von Wildschweinen. Untersuchungsmaterial: Serum 3 ml Untersuchungsverfahren: ELISA (IgG) Befundinterpretation: Spezifische Antikörper lassen sich meist erst ab der 3.-6. Krankheitswoche sicher nachweisen. Antikörper können jahrzehntelang nachweisbar bleiben. Indexwerte 0,9-1,1 grenzwertig; >1,1 positiv. Mycobacterium tuberculosis Patientenauswahl: Patienten mit Verdacht auf latente Tuberkulose vor dem Eintritt einer Immunsuppression, Patienten mit Verdacht auf akute Tuberkulose, Patienten nach Kontakt mit einem tuberkuloseinfizierten Patienten. Untersuchungsmaterial: Vollblut in speziellen Entnahmeröhrchen (BD) Untersuchungsverfahren: ELISPOT (Tb-SPOT, Oxford Immunotec) Befundinterpretation: Bewertung: Positivkontrolle: >20 Spots Negativkontrolle: < 10 Spots - Wenn Spotzahl Antigen A oder Antigen B – Spotzahl Negativ-Kontrolle ≥ 8 - Bei einer Negativ-Kontrolle von 6-9 Spots, wenn Antigen A oder Antigen B ≥ 2 x Spotzahl der Negativ-Kontrolle - Graubereich: wenn Spotzahl Antigen A oder Antigen B – Spotzahl Negativ-Kontrolle = 5-7 Sensitivität: >94%, Spezifität 96-100% Seite 221 von 281 Hygiene Leistungskatalog Hinweise für den Einsender -Dienstzeiten im Labor -Probentransport -Terminabsprache -Reklamationen Angaben auf den Probenbegleitschein Krankenhaushygiene - Hygiene-Überprüfung von Endoskopen - Umgebungsuntersuchungen (Abklatsch (RODAC)-Platten, Abstrichtupfer) - Lufthygienische Untersuchung - Biologische Überprüfung der Sterilisatoren - Überprüfung von Reingungs- und Desinfektions-Geräte - Überprüfung von Desinfektionsgeräten mittels Bioindikatoren - Überprüfung von Dialysierflüssigkeiten - Untersuchung von Desinfektionsmittelproben aus Desinfektionsmitteldosieranlagen auf Pseudomonaden und anderen Keimen - Untersuchung von Wasser aus Zahnarzteinheiten - Untersuchung von Trinkbrunnen in der Patientenversorgung Untersuchungen nach Europäischem Arzneibuch (Pharm.Eur.) - Sterilitätsprüfung - Untersuchung von Aqua purificata - Prüfung auf mikrobielle Verunreinigung bei nicht sterilen Naturprodukten oder Arzneimitteln Umwelthygiene - Untersuchung von Trinkwasser für den menschlichen Verbrauch nach der Trinkwasserverordnung vom 21.05.2001 - Untersuchung von Schwimm- und Badebeckenwasser nach DIN 19643/1 - Nachweis von Legionellen aus wasserführenden Systemen Untersuchung von Kakao, Schokolade, Zuckerwaren und Rohmassen auf Salmonellen Überprüfung von Blut und Blutkomponenten auf Sterilität Seite 222 von 281 Hinweise für den Einsender Dienstzeiten im Labor Montag - Freitag 08:00 – 16:30 Uhr Materialannahme nach telefonischer Rücksprache mit dem Hygiene-Labor Probentransport Grundsätzlich sollte der Transport so schnell wie möglich erfolgen. Ist dies nicht möglich, ist auf die richtige Lagerung des Untersuchungsmaterials zu achten. Der Probenversand sollte in sterilen Gefäßen erfolgen, die auf Wunsch von uns zur Verfügung gestellt werden können. Bei Versandt von Agarplatten, auf denen bereits Koloniewachstum zu beobachten ist, ist die Bestimmung nach UN 3373 zu beachten. Treten Sie bitte vorab mit dem Hygiene-Labor (0931/201 469 43) in Kontakt. Terminabsprache für Probennahme Um Ihre Aufträge zeitnah bearbeiten zu können, bitten wir um rechtzeitige Terminabsprache, Angaben über den Materialumfang und Ankündigung des Probeneingangs. Reklamationen Um Zufriedenheit unserer Kunden sind wir stets bemüht. Sollte dennoch etwas nicht nach Ihren Vorstellung erledigt worden sein, bitten wir sie es unserer QM-Beauftragten mitzuteilen. (Frau Keller 0931/201 469 37, [email protected]) Angaben auf den Probenbegleitschein Für das Hygiene-Labor stehen grüne Probenbegleitscheine zur Verfügung. http://www.hygiene.uni-wuerzburg.de/hygiene/download Bitte füllen Sie den Schein sorgfältig und vollständig aus! Einsender - Adresse - Telefonnummer, Ansprechpartner Material Kreuzen Sie bitte in diesem Abschnitt das zu untersuchende Material an oder ergänzen Sie ggf. die Platzhalter...... Seite 223 von 281 Bei den mit * gekennzeichneten Materialarten tragen Sie bitte ggf. ergänzende Angaben zur Herkunft auf der Rückseite „Probenbezeichnung“ Tabelle 1 ein. Zur Untersuchungen von Wasser füllen Sie bitte auf der Rückseite Tabellen 2 aus. Zur Untersuchung von Reinigungs-Desinfektionsgeräten füllen Sie bitte auf der Rückseite Tabelle 3 aus. Bitte notieren Sie auf der Rückseite im unteren Feld „Datum der Probennahme“ und den „Namen des Probennehmers“. Untersuchungsparameter Bitte kreuzen Sie hier die gewünschte Untersuchung an. Es sind mehrere Markierungen möglich. Ist für seltene Anforderungen kein Markierungsfeld verfügbar, notieren sie nach Absprache mit uns die gewünschte Untersuchung bitte im Feld „Zusatzinformationen“. Datum und Unterschrift auf der 1. Seite unten links bitte nicht vergessen! Krankenhaushygiene Hygiene-Überprüfung von Endoskopen Anforderung 1) nach RKI-Richtlinie Zur Sicherstellung der Hygienequalität bei der Durchführung von Endoskopien werden ¼-jährliche Kontrollen (gemäß der RKI-Richtlinie „Anforderungen an die Hygiene bei der Aufbereitung flexibler Endoskope und endoskopischen Zusatzinstrumentariums“ Bundesgesundheitsbatt 2002. 45, 395-411) und Stichproben im Rahmen der krankenhaushygienischen Untersuchungen als auch bei Verdacht auf Infektionen durchgeführt. Beschreibung der Untersuchung gemäß der RKI-Richtlinie (s.o.): Abstrich Am Distalende bei allen Endoskopen ( Duodenoskope: Nische beidseits des Albaranhebels) Optik-Spülsystem Spülprobe 20 ml steriles NaCl 0,9% aus Flasche durch Anschlussschlauch entnommen in neutralisierender Nährlösung laufen lassen. Instrumentierkanal Spülprobe 20 ml steriles NaCl 0,9% aus vom Kanaleingang zum Distalende in neutralisierender Nährlösung laufen lassen. Seite 224 von 281 Luft/Wasser-Kanal Spülprobe 20 ml steriles NaCl 0,9% aus Optikspülsystem in neutralisierender Nährlösung laufen lassen. 2) Untersuchung im Rahmen der QSHE (KVB) Die Überprüfung im Rahmen der Qualitätssicherung Hygiene in der Endoskopie erfolgt einmal pro Kalenderhalbjahr nach den Qualitätssicherungsvorgaben der Kassenärztlichen Vereinigung Bayerns (KVB). Die korrekte Probenentnahme darf nur von akkreditierten und von der KV anerkannten Laboratorien, zu denen das IHM gehört, durchgeführt werden. Hinweise zur Probennahme Im Rahmen der QSHE erfolgt die Probennahme nach Terminabsprache (0931/201 469 43) durch Mitarbeiter des IHM. Transport Die Proben sollten innerhalb von 4 h nach der Probennahme im Labor eintreffen. Bei Kühlung z. B. in Behältern aus Styropor mit Kühlelementen (Kühlpacks), wird eine Anlieferung innerhalb von 8 h akzeptiert. Befundung/ Beurteilung Beurteilung erfolgt gemäß der RKI-Richtlinie und den Vorgaben der KVB. Seite 225 von 281 Umgebungsuntersuchungen Abklatschuntersuchungen von Flächen / Händen Anforderung Quantitative Umgebungsuntersuchung von planen Arbeitsflächen, Gegenständen und Körperoberflächen mittels RODAC (= replicate organism detection and counting) und als Eigenkontrolle von aseptischen Arbeitsverfahren (z.B. Reinraum) durch Händeabklatsch auf Columbia Blutagar. Anwendungen: 1. Nachweis von nosokomialen Infektionserregern in der unbelebten Umgebung 2. Hygiene Monitoring von Reinräumen 3. Überprüfung von Reinigungs-, Desinfektions- und Sterilisationsmaßnahmen Routinemäßig werden RODAC-Platten (21 cm²) zum Abklatsch von Flächen benutzt: 1. Casoagar ( CTTS ) 2. Caso enthemmend ( BBL TSA W/ LEC + P 80) zum Nachweis auf desinfizierten Flächen 3. Nährboden zur Anzüchtung von Schimmelpilzen und Hefen ( CTS ) Für besondere Fragestellungen stehen weitere Nährmedien zur Verfügung. Abklatschuntersuchungen von Händen: Columbia Blutagar Hinweise zur Probennahme Die Planung und Durchführung vor Ort erfolgt in der Regel durch Hygienefachkräfte bzw. durch die anfordernde Einrichtung in Anlehnung an den Vorgaben des QMS der Einsender. Die RODAC bzw. Columbia-Blutagar- Platten werden vom IHM zur Verfügung gestellt. Der Probenbegleitschein sollte ggf. Angaben über die nachzuweisenden Bakterien oder Pilzarten enthalten. Durchführung Abklatsch: Die RODAC-Platten werden für circa 3 Sekunden auf den zu untersuchenden Gegenstand schräg aufgesetzt, und unter gleichmäßigen leichten Druck abgerollt. Beachte: Platte nicht verschieben, sonst wird der Agar beschädigt. Durchführung Händeabklatsch: Jeder Finger rechts und links wird vorsichtig und mit leichtem Druck auf Columbia-BlutagarPlatte gedrückt. Es wird pro Hand eine Agarplatte verwendet. Die Beschriftung (Nummerierung) der Platten darf nur auf der Bodenseite, nicht aber auf dem Deckel der Petrischale erfolgen, um spätere Verwechslungen bzw. Vertauschungen auszuschließen. Transport: Die Proben sollten möglichst am selben Tag im Labor eintreffen und in geschützten Behältnissen bei Umgebungstemperatur transportiert werden. Gegebenenfalls ist eine Lagerung im Kühlschrank und der Versand über 24 h möglich. Seite 226 von 281 Bei Versandt von Agarplatten, auf denen bereits Koloniewachstum zu beobachten ist, ist die Bestimmung nach UN 3373 zu beachten. Befundung/ Beurteilung Die Ergebnisse eines Abklatschtestes werden als koloniebildende Einheiten pro Fläche, ggf. mit Keimdifferenzierung, mitgeteilt. Die Bewertung erfolgt durch den Einsender nach eigenen Vorgaben. Untersuchung von Abstrichtupfern Anforderung Umgebungsuntersuchung von englumigen oder nicht –ebenem Material, zum Nachweis der Keimbelastung oder von speziellen Keimen. Hinweise zur Probennahme Die Durchführung vor Ort erfolgt durch geschultes Personal bzw. Hygienefachkräfte. Es sollten generell Abstrichtupfer mit Transportmedien verwendet werden. Die Probennahmestellen werden entsprechend der Fragestellung gewählt. Durchführung: Der angefeuchtete Abstrichtupfer (z.B. mit steriler NaCl 0,9%-Lösung) wird gleichmäßig unter Rollbewegungen über die zu untersuchende Probestelle bewegt. Transport: Die Proben sollten möglichst am selben Tag im Labor eintreffen. Gegebenenfalls ist eine Lagerung im Kühlschrank und der Versand über 24 h möglich. Befundung/ Beurteilung Die Bewertung erfolgt durch den Einsender nach eigenen Vorgaben. Seite 227 von 281 Lufthygienische Untersuchung Keimzahlbestimmung der Luft Anforderung Mikrobiologische Raumluftuntersuchungen dienen dazu, eine möglicherweise gesundheitsschädliche Belastung durch Mikroorgansimen (z.B. Schimmelpilze) zu erkennen. Des Weiteren ist die periodische mikrobiologische Überprüfung von RLT-Anlagen Teil der Qualitätssicherung in Eingriffsräumen mit erhöhten Anforderungen an die Raumluft. Impaktionsverfahren mittels Luftkeimsammler Zur Überprüfung der Luftkeimzahlwerte/m3 und der Funktionsfähigkeit von raumlufttechnischen Anlagen (RLT). Luftgetragene Mikroorgansimen werden durch Ansaugen von 500-1000 Litern Luft auf eine Agarplatte abgeschieden und quantitativ in KBE/m3 bestimmt. Sedimentationsverfahren Luftkeime sedimentieren in definierter Zeit (15 min -1h) auf Agarplatten. Zur orientierenden Routinekontrolle in Räumen mit besondere Infektionsgefährdung (Intensivstationen). Hinweise zur Probennahme Die Anzahl der Proben und die Festlegung der Probennahmestellen richten sich nach normativen Verfassungen (DIN, VDI) und nach der Fragestellung und der Größe der Räume. Bei Untersuchungen der Schimmelpilzbelastung in Innenräumen ist unbedingt zeitgleich auch eine Außenluftprobe zu nehmen. Je nach Einsatzbereich ist es wichtig, dass die zu beprobenden Räume vor und während der Messung nicht von anderen Personen betreten werden. Ggf. ist vor der Messung eine Scheuer-Wisch-Desinfektion des Raumes durchzuführen. Vor allem bei Schimmelpilzuntersuchungen müssen bestimmte Vorbedingungen (z.B. entfernen von Topfpflanzen und organische Materialien; Fenster und Türen über Nacht geschlossene halten) erfüllt sein, um die ermittelten Werte richtig beurteilen zu können. Die Durchführung vor Ort erfolgt durch Hygienefachkräfte bzw. geschulten Personal. Transport: Die Proben sollten möglichst am selben Tag im Labor eintreffen und in geschützten Behältnissen bei Umgebungstemperatur transportiert werden. Bei Versandt von Agarplatten, auf denen bereits Koloniewachstum zu beobachten ist, ist die Bestimmung nach UN 3373 zu beachten. Befundung/ Beurteilung Zur Befundbeurteilung sind unbedingt die Zeit- bzw. Volumen-Angaben auf dem Probenbegleitschein erforderlich. Seite 228 von 281 Je nach räumlicher Anforderung dürfen Grenz –und Richtwerte nicht überschritten werden. Erreger nosokomialer Infektionen dürfen nicht nachweisbar sein. Bei Untersuchung der Innenraumluft erfolgt nach Absprache mit dem Einsender eine orientierende Schimmelpilzdifferenzierung. Biologische Überprüfung von Sterilisatoren Anforderung Mikrobiologische Überprüfung von nicht validierten Heißluftsterilisatoren, Dampfsterilisatoren, Gassterilisatoren und Chemiklaven vor Inbetriebnahme, nach Reparaturen, in der Routine mindestens halbjährlich bzw. alle 400 Chargen. Grundsätzlich sind alle genutzten Programme der einzelnen Geräte zu testen. Bei den Bioindikatoren handelt es sich um geschlossene verpackte Teststreifen mit thermoresistenten, apathogenen Bakteriensporen, bei deren Abtötung von einer ausreichenden Funktion des Sterilisators ausgegangen werden kann. Die Funktionstestung von Sterilisatoren, in welchen Flüssigkeiten sterilisiert werden, erfolgt mit Bioindikatoren bestehend aus Ampullen mit Sporensuspension von Geobacillus stearothermophilus. Diese werden einem flüssigkeitsgefüllten Testgefäß zugegeben und mit sterilisiert. Für die Überprüfung von Gassterilisatoren sind spezielle Prüfkörper (Rezeptakel) notwendig. Diese Prüfkörper werden vom Labor zur Verfügung gestellt, eine Absprache ist erforderlich. Wichtige Angaben für die Bestellung von Bioindikatoren - Geräteart - Angabe über die Kammergröße oder die Bioinidikatormenge (s.u.) - Angabe über die Anzahl der zu testenden Programme Bestellung: Telefonisch: 0931/ 201 469 43 oder Fax: 0931/ 201 464 45 oder schriftlich: Institut für Hygiene und Mikrobiologie der Universität Würzburg Hygiene-Labor Josef-Schneider-Str. 2/ Gebäude E 1 97080 Würzburg Auf Wunsch ist es möglich, die Bioindikatoren in halbjährlichen Abständen automatisch zuzusenden. Bei der ersten Geräteerfassung wird im Labor eine Gerätespezifische „Registriernummer (is-…) vergeben, die bei Folgebestellungen angegeben werden sollte. Seite 229 von 281 Geräte: genormte Bioindikatoren mit ausgewählten Testkeimen: Dampfautoklav : Geobacter stearothermophilus Dampfsterilisation von Flüssigkeiten: Geobacillus stearothermophilus Heißluftsterilisator: Bacillus subtilis Ethyhlenoxid-Sterilisator: Bacillus atrophaeus Formaldehyd-Sterilisator: Geobacillus stearothermophilus Chemiklav: Bacillus subtilis (da keine Norm vorhanden angelehnt an DIN 58949, Plasmasterilisator) Die Anzahl der Bioindikatoren richtet sich nach dem Volumen der Sterilisierkammer: Gerät Dampf-Klein-Steri Liter <1 1-5 >5 Dampfsterilisator 0-54 55-216 217-430 431-648 > 648 Heißluftsterilisator bis 6 6-30 30-60 60-250 FO-/Chemiklav bis 60 60-150 ( Quelle: nach DIN 58949) Anzahl der Bioindikatoren je Programm + eine Transportkontrolle 1+1 3+1 5+1 4+1 8+1 10 + 1 16 + 1 22 + 1 3+1 6+1 9+1 12 + 1 5+1 10 + 1 Durchführung der Prüfung mit Bioindikatoren: • äußere Verpackung (Folie) des Bioindikators nicht aufreißen • Zur Angabe der Lokalisation im Gerät die Bioindikatoren nummerieren und die Lokalisation auf dem Begleitschein beschreiben • Transportkontrolle wird nicht mitsterilisiert • auf gleichmäßige Verteilung der Bioindikatoren (Pyramidenförmig) im Innenraum des Sterilisators achten • Prüfung unter maximaler Beladung durchführen • Sterilisation durchführen • nach Beendigung des Sterilisationsprozesses, Bioindikatoren entnehmen (Äußere Verpackung kann mit der Hand angefasst werden) • Rücksendung der trockenen Bioindikatoren, einschließlich Positivkontrolle und Prüfbericht Seite 230 von 281 Befundung/ Beurteilung Wird der Testkeim im Anreicherungsverfahren nach 7-tägiger Bebrütung nicht nachgewiesen, gibt es keinen Hinweis auf unzureichende Funktion des Programms. Überprüfung von Reinigungs-und Desinfektions-Geräten (RDG) 1) Überprüfung mittels Prüfkörpern nach pr DIN EN ISO 15833-1 Anforderung Die Wiederaufbereitung von semikritischen und kritischen Medizinprodukten beinhaltet die maschinelle Reinigung und Desinfektion. Vorzugsweise ist diese mit validierten Geräten durchzuführen. Ist eine Validierung nicht möglich, stellt die biologische Überprüfung der Reinigungsdesinfektionsleistung einen Baustein der Sicherstellung einer einwandfreien Funktion dar. Es kommen mit Blut oder RAMS (Rinderalbumin-Mucin-Maisstärke) angeschmutzte Prüfkörper (Schrauben, Schläuche, Edelstahlplättchen) zum Einsatz, die mit bestimmten Keimmengen von Enterococcus faecium kontaminiert sind. Die Reinigungsdesinfektionsleistung wird als erreicht angesehen, wenn bei einer Prüfung die Verringerung der festgelegten Prüfanschmutzung bestimmt worden ist. Die Auswahl der Keimträger sowie die Anzahl der Prüfkörper muss auf das mit dem jeweiligen Programm aufzubereitende Dekontaminationsgut abgestimmt werden. Es kann daher erforderlich sein, mehrere Prüfsets einzusetzen. Die Anforderungen an die Dekontaminationsleistung unterscheidet sind in Abhängigkeit vom geforderten A0-Wert. Verschiedene Prüfsets können im Hygienelabor (Tel. 0931/201 469 43) angefordert werden: Da wir die Prüfkörper über die Firma Hygiene Nord GmbH und Simicon GmbH beziehen, bitten wir Sie an eine rechtzeitige Anforderung zu denken. • • • • Edelstahlplättchen, kontaminiert mit RAMS und Enterococcus faecium 105 Schrauben, kontaminiert mit Hammelblut und Enterococcus faecium 108 Schrauben, kontaminiert mit Hammelblut und Enterococcus faecium 105 Schlauchabschnitte, kontaminiert mit Hammelblut und Enterococcus faecium 107 Bitte beachten Sie beim Einsatz der Prüfkörper folgende Aspekte: Die Prüfung darf nur von fachkundigem Personal durchgeführt werden. Die Prüfkörper sind mit dem Prüforganismus und einer spezifischen organischen Belastung angeschmutzt. Es handelt sich bei diesen Prüfkörpern um so genannte offene Prüfkörper. Dies bedeutet, dass im Rahmen der Anwendung dieser Prüfkörper eine Kontamination der Maschine oder auch des Spülgutes nicht ausgeschlossen werden kann. Durchführung der Prüfung: Die Bestückung der Geräte erfolgt nach der Ausführung der Loseblattsammlung Behr´s Verlag 2008 "Qualitätssicherung von Reinigungs- und Desinfektionsprozessen" herausgegeben von C. Höller, S. Krüger, H. Martiny und R. Zsachler. Seite 231 von 281 Die Schrauben sind in Siebe für chirurgische Kleinteile zu geben, damit sie nicht während des Spülgangs im Gerät herumgewirbelt werden und das Gerät oder andere Instrumente möglicherweise beschädigen. Die Schlauchstücke zur Überprüfung von Reinigungs-Desinfektions-Programmen für Anästhesie-Zubehör sind auf die entsprechenden Ansatzstücke zur Durchspülung von Hohlkörpern (z.B. Beatmungsschläuche) zu stecken. Die Edelstahlplättchen können auf die vom Hygiene-Labor zur Verfügung gestellten Kunststoffhalterungen fixiert werden. Diese wiederum werden mit Kabelschnellverbinder im RDG in Position gebracht werden. Die Kontaminationsflächen zeigen nach außen. Transportkontrolle darf dem Reinigungs-Desinfektions-Prozesses nicht ausgesetzt werden und wird lediglich in ein steriles Röhrchen um verpackt. Bei der Entnahme der einzelnen Prüfkörper ist sorgfältig darauf zu achten, dass es nicht zu einer Kontamination der später entnommenen Prüfkörper kommt. Es wird empfohlen, Schutzhandschuhe zu tragen, die nach jedem Kontakt von Prüfkörper zu Prüfkörper desinfiziert werden; zusätzlich ist ggf. die Verwendung steriler Pinzetten (Bei Entnahme der Schrauben und Schlauchstücke!) erforderlich. Visuelle Prüfung der optischen Sauberkeit Nach der Reinigung im RDG ist bei den Prüfkörpern eine Sichtprüfung vorzunehmen. Der Grad der optischen Sauberkeit wird entsprechend den Vorgaben auf der Rückseite des Probenbegleitscheines (Tabelle 3, Beuteilung der Reinigungsleistung) vermerkt. Der Probenbegleitschein muss vollständig ausgefüllt sein. Bitte die Rückseite nicht vergessen (Tabelle 3, Beurteilung der Reinigungsleistung). Bei der ersten Geräteerfassung wird im Labor eine Gerätespezifische „Registriernummer (is-…)“ Vergeben, die bei Folgebestellungen angegeben werden sollte. Befundung/ Beurteilung Die Reinigungswirkung des RDG ist als ausreichend zu betrachten, wenn der Prüfkörper keine sichtbaren Rückstände der Anschmutzungssubstanz auf den Außenseiten aufweist und eine Reduktion des aufgetragenen Keimes stattgefunden hat: A0-Wert von 600: Reduktion von 5 lg-Stufen bei Enterococcus faecium A0-Wert von 3000: Enterococcus faecium darf bei einer Ausgangskeimzahl von 108 nicht nachgewiesen werden Die Reinigungs- und Desinfektionskontrolle mittels angeschmutzter Prüfkörper kommt bei nicht validierten RDG zum Einsatz. Sie wird komplimentiert durch weit reichende Qualitätssicherungsmaßnahmen (periodische Temperaturkontrolle, Reinigungskontrolle, Wasserzustandskontrolle, Dosierkontrolle). Da pro Programm und RDG eine große Zahl von Prüfkörpern zum Einsatz kommt, hält das IHM ein quantitatives Auswertungsverfahren durch Verdünnungsreihen für unwirtschaftlich. Es werden daher in der Regel bei A0 600 Prüfkörper mit Belastung von 105, bei A0 3000 Prüfkörper mit 10 8 Keimen verwendet. Sollte die Auswertung über eine Verdünnungsreihe gewünscht werden, bittet das IHM um Mitteilung. Seite 232 von 281 Überprüfung von Desinfektionsgeräten mittels Bioindikatoren Dampfdesinfektion Anforderung Biologische Überprüfung der Funktionstüchtigkeit von Desinfektionsgeräten mittels Bioindikatoren. Grundsätzlich sind alle genutzten Programme der einzelnen Geräte entsprechend der Gerätegröße mit der jeweils erforderlichen Anzahl an Bioindikatoren zu testen. Bei den Bioindikatoren handelt es sich um geschlossene verpackte Teststreifen mit thermoresistenten Testkeimen, bei deren Abtötung von einer ausreichenden Funktion des Sterilisators ausgegangen werden kann. Bestellung: Telefonisch: 0931/ 201 469 43 oder Fax: 0931/ 201 464 45 oder schriftlich: Institut für Hygiene und Mikrobiologie der Universität Würzburg Hygiene-Labor Josef-Schneider-Str. 2/ Gebäude E 1 97080 Würzburg Auf Wunsch ist es möglich die Bioindikatoren in automatischen Abständen zuzusenden. Geräte genormte Bioindikatoren mit ausgewählten Testkeimen: Dampfdesinfektionsanlagen 105°C Dampfdesinfektionsanlagen 75°C Bacillus subtilis Enterococcus faecium Die Anzahl der Bioindikatoren richtet sich der Größe und dem Fassungsvermögen der zu testenden Anlage. Durchführung der Prüfung mit Bioindikatoren: • • • • • • • • äußere Verpackung (Folie) des Bioindikators nicht aufreißen Zur Angabe der Lokalisation im Gerät die Bioindikatoren nummerieren und die Lokalisation auf dem Begleitschein beschreiben Transportkontrolle wird nicht dem Desinfektionsprogramm ausgesetzt auf gleichmäßige Verteilung der Bioindikatoren im Innenraum achten Prüfung unter maximaler Beladung durchführen Desinfektionsprogramm durchführen nach Beendigung des Programms, Bioindikatoren entnehmen (Äußere Verpackung kann mit der Hand angefasst werden) Rücksendung der trockenen Bioindikatoren, einschließlich Positivkontrolle und Prüfbericht Seite 233 von 281 Befundung/ Beurteilung Wird der Testkeim nicht mehr nachgewiesen, gibt es keinen Hinweis auf unzureichende Funktion des Programms. Chemisch-thermischen Desinfektionsverfahren Anforderung Kontrolluntersuchung von Desinfektionsverfahren z.B. für Steckbeckenspülmaschinen, Endoskopwaschautomaten, Wäschedesinfektion, Bettgestelldesinfektionsanlagen, OPSchuhreinigungsautomaten. 1) Überprüfung mittels Des-Controller (Firma Meducomp GmbH) Hierfür werden „geschlossenen Keimträger“ verwendet. Der Testkeim (Enterococcus faecium) ist von einer thermischen, mechanischen und chemischen stabilen und dennoch flexiblen Membran umhüllt. Die Anzahl der DES-Control-Streifen richtet sich nach der Größe des Gerätes. Bestellung: Telefonisch: 0931/ 201 469 43 oder Fax: 0931/ 201 464 45 oder schriftlich: Institut für Hygiene und Mikrobiologie der Universität Würzburg Hygiene-Labor Josef-Schneider-Str. 2/ Gebäude E 1 97080 Würzburg Bei der ersten Geräteerfassung wird im Labor eine Gerätespezifische „Registriernummer (is-…) vergeben, die bei Folgebestellungen angegeben werden sollte. Durchführung der Prüfung: • • • • • Die Chargen-Nr. des jeweiligen verwendeten „Des-Controllers“ auf dem Prüfprotokoll vermerken Transportkontrolle bleibt unbehandelt In dem zu prüfenden Desinfektions-Gerät fixieren (so, dass er nicht weggespült werden kann) Nach Beendigung des Desinfektions-Programms den Indikator unter Leitungswasser abspülen und zwischen Zellstoff trocknen Rücksendung der trockenen Bioindikatoren, einschließlich Positivkontrolle und Prüfbericht Seite 234 von 281 Befundung/ Beurteilung Wird der Testkeim nicht mehr nachgewiesen, gibt es keinen Hinweis auf unzureichende Funktion des Programms. Die Reinigungsleistung kann nicht beurteilt werden. 2) Überprüfung mittels Prüfkörpern nach pr DIN EN ISO 15833-1 (siehe Überprüfung von Reinigungs- und Desinfektions-Geräten (RDG) Untersuchung von Dialysierflüssigkeiten Anforderung Flüssigkeiten, die bei der Hämodialyse verwendet werden, sind bei Herstellung, Lagerung und Zuleitung zum Dialysegerät verschiedenen Kontaminationsmöglichkeiten ausgesetzt. Die mikrobiologische Qualität wird mindestens 2 Mal jährlich als Routinekontrolle, nach Eingriffen am Leitungssystem oder zur Aufklärung unklarer Infektionen oder fieberhafter Reaktion von Dialysepatienten, kontrolliert. Analyt Permeat aus Ringleitung und Dialysierflüssigkeit - Bestimmung der Koloniezahl 22°C/ 36°C (nach TrinkwVO alte Fassung vom 05.12.1990) - Nachweis von Pseudomonas aeruginosa in 100 ml - Nachweis von E.coli/Colifomen in 100 ml Konzentrat, Substitutionslösung: - Sterilitätsprüfung (gemäß Europäischem Arzneibuch) Hinweise zu Probennahme: Die Probennahme sollte nur durch qualifizierte Probennehmer (z.B. Hygienefachpersonal) unter aseptischen Bedingungen durchgeführt werden. Die Proben dürfen nur in sterile Gefäße entnommen werden. Transport Die Proben sollten gekühlt bei 5 ± 3 °C und lichtgeschützt z. B. in Behältern aus Styropor mit Kühlelementen (Kühlpacks), transportiert werden und innerhalb von 8 h im Labor eintreffen. Probenmindestmenge: 250 ml Ein Endotoxinnachweis wird am IHM nicht durchgeführt. Seite 235 von 281 Befundung/ Beurteilung Die Ergebnisse werden nach dem Dialysestandart 2006 (der Deutschen Arbeitsgemeinschaft für klinische Nephrologie e.V. in Zusammenarbeit mit dem Verband Deutscher Nierenzentren der DDnÄ e.V. sowie der Gesellschaft für Pädiatrische Nephrologie (GPN)) beurteilt. Untersuchung von Desinfektionsmittelproben aus Desinfektionsmitteldosieranlagen auf Pseudomonaden und andere Keime Anforderung Primär oder sekundäre resistente Erreger gelingt es unter bestimmten Voraussetzungen, auch in Desinfektionsmittellösungen zu überdauern und sich sogar zu vermehren. Deshalb ist die regelmäßige Kontrolle von Desinfektionsmittelmischanlagen wichtiger Bestandteil der Qualitätssicherung in medizinischen Einrichtungen. Beachte: Durch die Wirkung des jeweiligen Desinfektionsmittels sind die vorhandenen Keime mit üblichen Methoden kaum anzüchtbar. Der Wirkstoffeffekt des Desinfektionsmittels muss deshalb mit einer Inaktivierungslösung unterbunden werden. Probennahme Sterile Glasflaschen, in denen die nötige Inaktivierungslösung (100 ml) vorgelegt wurde, erhalten sie nach Terminabsprache im Hygiene-Labor (0931/201 469 43). Bitte rechtzeitig Anfordern, da die Inaktivierungslösung immer frisch hergestellt werden muss. Die Probennahme sollte nur durch qualifizierte Probennehmer (z.B. Hygienefachpersonal) und unter aseptischen Bedingungen durchgeführt werden. Transport Die Probe sollte mit Inaktivierungslösung bei Umgebungstemperatur innerhalb von 24 h im Labor eintreffen. Mindestprobenmenge Pro Dosieranlage wird 100 ml entnommen und direkt in die dafür vorgesehene Glasflasche mit Inaktivierungslösung gefüllt. Befundung/Bewertung Nicht sporenbildende Bakterien dürfen nicht nachweisbar sein. Seite 236 von 281 Untersuchung von Wasser aus Zahnarzteinheiten Anforderung Die mikrobiologische Untersuchung von Zahnstühlen ist Gegenstand der RKI Richtlinie „Infektionsprävention in der Zahnheilkunde von 2006“ Danach sollte eine jährliche Untersuchung der Gesamtkeimzahl pro Zahnarztstuhl und eine Untersuchung auf Legionellen pro Versorgungseinheit durchgeführt werden. Analyt Koloniezahl /ml 36°C nach TrinkwV a. F. (5.12.1990) Legionellen in 1ml Mindestprobenmenge: ca. 10 ml pro Entnahmestelle Hinweis zur Probennahme Die möglichst sterile Probennahme erfolgt durch eingewiesene Zahnarzthelferinnen/-helfer oder anderes Personal. Nach Ablaufen des Wassers über einen Zeitraum von 20 sec. wird die Probe am Mundglasfüller entnommen. Der Probenbegleitschein muss vollständig ausgefüllt sein. Sterile Probengefäße können nach Absprache mit dem Hygiene-Labor (0931/201 464 45) zur Verfügung gestellt werden. Transport Die Proben sollten gekühlt bei 5 ± 3 °C und lichtgeschützt z. B. in Behältern aus Styropor mit Kühlelementen (künstliche Eispacks), transportiert werden und innerhalb von 8 h im Labor eintreffen. Befundung/ Beurteilung Die Ergebnisse werden entsprechend den Grenz- und Richtwerten der RKI-Richtline: „Infektionsprävention in der Zahnheilkunde-Anforderungen and die Hygiene“ (Bundesgesundheitsblatt 2006) beurteilt. Untersuchung von Trinkbrunnen in der Patientenversorgung Anwendung Untersuchung von Trinkbrunnen als kontinuierliches Hygienemonitoring im Klinikbereich. Seite 237 von 281 Analyt Koloniezahl /ml nach TrinkwV a. F. (5.12.1990) Pseudomonas aeruginosa Mindestprobenmengen: ca. 100 ml Hinweis zur Probennahme: Für Wasser, das mit Chlor desinfiziert wird, erhalten Sie sterile Flaschen mit NatriumThioslulfat nach Terminvereinbarung im Hygiene-Labor (0931/201 469 43) Die Flaschen sollten nicht bis über den Flaschenhals befüllt werden (ca. 5/6), um eine bessere Mischung der Probe zu ermöglichen. Probe möglichst steril entnehmen. Der Probenbegleitschein muss vollständig ausgefüllt sein (Tabelle 2, Trinkwasser/Badewasser). Transport: Die Proben sollten gekühlt bei 5 ± 3 °C und lichtgeschützt z. B. in Behältern aus Styropor mit Kühlelementen (Kühlpacks), transportiert werden und innerhalb von 8 h im Labor eintreffen. Befundung/ Beurteilung Die Beurteilung der Gesamtkeimzahl orientiert sich and den Grenzwerten der Trinkwasserverordnung. Jeder Nachweis von Pseudomonas aeruginosa weist auf eine Kontamination des Trinkbrunnen hin. Untersuchungen nach Europäischem Arzneibuch (EuAB) Sterilitätsprüfung nach EuAB Anforderung Im Rahmen der Zubereitung von Flüssigkeiten ist ggf. eine Kontrolle des Endproduktes auf Sterilität durchzuführen. 1) Membranfiltermethode (Steritest-Set der Firma Millipore) Die Membranfiltermethode wird bei Flüssigkeiten und wässrigen Lösungen oder Zubereitungen, die in Wasser oder anderen geeigneten Lösungsmittel löslich sind angewendet. Der Vorteil besteht darin, dass es sich um ein geschlossenes System mit geringer Kontaminationsgefahr handelt. Seite 238 von 281 2) Direktbeschickungsmethode Die Direktbeschickungsmethode wird bei Feststoffen, löslichen, unlöslichen, suspendierbaren oder emulgierbaren Zubereitungen sowie bei Cremes und Salben angewendet. Es wird eine definierte Menge des Materials in Flüssigmedien gegeben. Hinweise für den Einsender: Der Probenbegleitschein muss Angaben über die antimikrobielle Aktivität und Konservierungs-stoffe des zu untersuchenden Produktes enthalten. Jedes neue Produkt beinhaltet eine Validierungsprüfung. Die durch eine Kontamination durch mehrere Testkeime auf Eigenhemmung überprüft wird. Transport: Die Proben sollten in der Originalverpackung bei Umgebungstemperatur an das IHM gebracht bzw. versandt werden. Die Dauer des Transportes ist in den meisten Fallen unkritisch. Mindestprobenmenge: Richtet sich nach der eingesandten Chargengröße und nach der Füllmenge des Probenbehältnisses (vgl. EuAB) Beachte: Mindestens die gleiche Probenmenge ist bei Ersteinsendung, Änderungen in der Rezeptur oder bei Änderungen der experimentellen Bedingungen nochmals für die Validierungs-prüfung erforderlich! Ggf. Rücksprache mit dem Hygiene-Labor. Befundung/ Beurteilung Nach 14-tägiger Bebrütung bei 24° und 33°C darf kein Keimwachstum nachweisbar sein. Untersuchung von Aqua purificata in Anlehnung an das EuAB Anforderung Überprüfung von gereinigtem Wasser das zur Herstellung von Zubereitungen bestimmt ist. Dies muss weder steril noch pyrogenfrei sein. ( EuAB) Hinweise für den Einsender: Mindestprobenmenge: nach Vorgaben des QMS des Einsenders Die Flaschen sollten nicht bis über den Flaschenhals befüllt werden (ca. 5/6), um eine bessere Mischung der Probe zu ermöglichen. Sterile Flaschen erhalten sie nach Terminvereinbarung im Hygiene-Labor (0931/201 469 43). Seite 239 von 281 Transport Die Proben sollten gekühlt bei 5 ± 3 °C und lichtgeschützt z. B. in Behältern aus Styropor mit Kühlelementen (Kühlpacks), transportiert werden und innerhalb von 8 h im Labor eintreffen. Befundung/ Beurteilung Nach EuAB (6. Ausgabe Grundwerke 2008) gilt als angemessener Grenzwert zum Eingreifen eine Gesamtanzahl von 100 koloniebildender, aerober Keime je Milliliter. Ansonsten erfolgt die Beurteilung nach QMS des Einsenders. Prüfung auf mikrobielle Verunreinigung bei nicht sterilen Naturprodukten oder Arzneimitteln nach dem EuAB Anforderung Chargenkontrolle und zur Kontrolle des Herstellungsprozess von Arzneimitteln und Naturprodukten. Analyt 1. Gesamtkeimzahl: Bakterien Hefen und Schimmelpilze 2. Nachweis bestimmter Mirkoorganismen: Escherichia coli Salmonellen Galletolerante gramnegative Bakterien Staphylococcus aureus Pseudomonas aeruginosa Das EuAB (6. Ausgabe Grundwerke 2008) teilt die zu untersuchenden Materialien in verschiedene Darreichungsformen ein: Anwendungen in der Mundhöhle, Anwendung am Zahnfleisch, Kutane Anwendung, Anwendung in der Nase, Anwendung am Ohr höchstens 102 TAMC (GKZ aerober Mikroorganismen) KBE/ g bzw ml höchstens 101 TYMC (GKZ Pilze) KBE/ g bzw. ml in 1 g bzw. ml kein Staphylococcus aureus oder Pseudomonas aeruginosa Spezielle Kriterien der Ph. Eur. für Darreicherungsformen zum Einnehmen, Die Ausgangsstoffe natürlicher Herkunft (tierisch, pflanzlich oder mineralisch) enthalten, für die eine antimikrobielle Vorbehandlung nicht möglich ist und für deren Ausgangsstoff die zuständige Behörde einen TAMC-Wert von mehr als 103 KBE/ g oder ml akzeptiert. höchstens 104 TAMC (GKZ aerober Mikroorganismen) KBE/ g bzw ml höchstens 102 TYMC (GKZ Pilze) KBE/ g bzw. ml höchstens 102 KBE/ g bzw. ml gramnegative Bakterien, die gegen Gallensalze resistent sind in 10 g bzw. ml keine Salmonellen Seite 240 von 281 in 1 g bzw. ml kein Staphylocuccus aureus und Escherichia coli Spezielle Kriterien der Ph. Eur. für pflanzliche Arzneimittel, die ausschließlich aus einer oder mehreren pflanzlichen Droge/n bestehen (ganz, zerkleinert oder pulverisiert) und denen vor der Anwendung siedendes Wasser zugesetzt wird. höchstens 107 TAMC (GKZ aerober Mikroorganismen) KBE/ g bzw ml höchstens 105 TYMC (GKZ Pilze) KBE/ g bzw. ml höchstens 102 KBE/ g bzw. ml Escherichia coli Spezielle Kriterien der Ph. Eur. für pflanzliche Arzneimittel, die ausschließlich aus einer oder mehreren pflanzlichen Droge/n bestehen (ganz, zerkleinert oder pulverisiert) und denen vor der Anwendung kein siedendes Wasser zugesetzt wird höchstens 105 TAMC (GKZ aerober Mikroorganismen) KBE/ g bzw ml höchstens 104 TYMC (GKZ Pilze) KBE/ g bzw. ml höchstens 103 KBE/ g bzw. ml gramnegative Bakterien, die gegen Gallensalze resistent sind in 10 g bzw. ml keine Salmonellen in 1 g bzw. ml kein Escherichia coli Nicht wässrige Zubereitungen zum Einnehmen Wässrige Zubereitung zum Einnehmen Rektale Anwendung Vaginale Anwendung Transdermale Pflaster (Grenzwerte für 1 Pflaster einschließlich der Haft- und Trägerschicht) Anwendung durch Inhalation (spezielle Anforderungen für flüssige Zubereitungen zur Zerstäubung) Abkürzungen: TAMC = Total Aerobic Microbial Count, TYMC = Total combined Yeasts/ Mould Count GKZ = Gesamtkeimzahl Mindestprobenmenge: 20- 30 g Hinweise zur Probennahme Die Entnahme aus der entsprechenden Charge muss unter Beachtung steriler Kautelen geschehen. Die Einsendung sollte Montag – Donnerstag bis 12 Uhr, Freitag bis 11:00 Uhr erfolgen oder in eiligen Fällen nach Absprache mit dem Hygiene-Labor (0931/20146943). Der Probenbegleitschein muss Folgendes unbedingt enthalten: - Angabe bei vorhandener mikrobieller Aktivität - die Darreichungsform muss angegeben werden Probentransport: Der Transport erfolgt bei Umgebungstemperatur. Die Dauer des Transportes ist in den meisten Fällen unkritisch. Befundung/ Beurteilung Die Beurteilung erfolgt nach dem Europäischen Arzneibuch 6. Ausgabe Grundwerk 2008 Seite 241 von 281 Umwelthygiene Untersuchung von Trinkwasser für den menschl. Verbrauch nach der Trinkwasserverordnung Anforderung Routinemäßige bzw. periodische Untersuchung von Wasser aus kommunalen und Eigenversorgungsanlagen, welche der Untersuchung nach TrinkwV unterliegen. Analyt Koloniezahl /ml nach TrinkwV a. F. (5.12.1990) Bestandteil der routinemäßigen Untersuchung E.coli/Coliforme / 100 ml nach ISO 9308-1 Bestandteile der routinemäßigen Untersuchungen Enterokokken / 100 ml nach ISO 7899-2 Ist Bestandteil der periodischen Untersuchungen. Pseudomonas aeruginosa / 250 ml nach ISO 16266 Nur bei Trinkwasser, das zur Abfüllung in Flaschen oder sonstigen Behältnisse bestimmt ist, ist die Untersuchung Bestandteil der routinemäßigen Untersuchung. Clostridium perfringens / 100 ml nach Anlage 5 der TrinkwV 2001 Ist routinemäßig nur erforderlich, wenn das Wasser von Oberflächenwasser stammt oder von Oberflächenwasser beeinflusst wird Legionellen / 100 ml bzw. in 1 L (Risikobereich) nach ISO 11731-2 Das Probenvolumen hängt von der Art es Wasserverteilungssystems und dem Zweck der Untersuchung ab. Die Untersuchung erfolgt nach Anforderung. Hinweise zur Probennahme: Die Entnahme vor Ort erfolgt durch qualifizierte Probennehmer (ggf. nach Terminabsprache) nach DIN EN ISO 19458:2006. Wird die Entnahme von nicht akkreditierten Personen durchgeführt, so liegt die Probenentnahme in der Verantwortung des Auftraggebers. Die Flaschen sollten nicht bis über den Flaschenhals befüllt werden (ca. 5/6), um eine bessere Mischung der Probe zu ermöglichen. Für Wasser, das mit Chlor desinfiziert wird, erhalten Sie sterile Flaschen mit NatriumThioslulfat-Zusatz nach Terminvereinbarung im Hygiene-Labor (0931/201 469 43). Der Probenbegleitschein muss vollständig ausgefüllt sein. Die Angaben über die Entnahmestelle, Entnahmezeit, Temperatur, Einzel oder Zentralversorgung und Chlorierung sind auf der Rückseite zu notieren ( Tabelle 2, Trinkwasser/Badewasser). Seite 242 von 281 Mindestprobenmengen: 1. 200 ml für die Routineuntersuchung: Koloniezahl /ml nach TrinkwV a. F. (5.12.1990) E. coli/Coliforme / 100 ml nach ISO 9308-1 2. Bis zu 750 ml je nach gewünschter Anforderung Transport: Die Proben sollten gekühlt bei 5 ± 3 °C und lichtgeschützt z. B. in Behältern aus Styropor mit Kühlelementen (Kühlpacks), transportiert werden und innerhalb von 8 h im Labor eintreffen. Befundung/ Beurteilung Die Ergebnisse werden entsprechend den Grenzwerten der TVO beurteilt. Untersuchung von Schwimm- und Badebeckenwasser nach DIN 19643/1 Anforderung Die Untersuchung von Badebeckenwasser, insbesondere auch die Untersuchungsparameter und Probenhäufigkeit sind in der DIN 19643 (Aufbereitung von Schwimm- und Badebeckenwasser) geregelt. Mindestprobenmenge und Analyt Routineuntersuchung bei Reinwasser und Beckenwasser: Mindestprobenmenge 250 ml (ohne Legionellen) Koloniezahl /ml nach TrinkwV a. F. (5.12.1990) E.coli/ / 100 ml Pseudomonas aeruginosa / 100 ml Legionellen Mindestprobenmenge je nach Anforderung 1 ml bei Beckenwasser und 100 ml bei Filtrat (Anforderung bei Beckenwasser > 23°C) Hinweise zur Probennahme Die Entnahme vor Ort erfolgt durch Hygienefachkräfte bzw. geschultes Personal. Für Wasser das mit Chlor desinfiziert wird, erhalten Sie sterile Flaschen mit NatriumThioslulfat Zusatz nach Terminvereinbarung im Hygiene-Labor (0931/201 469 43). Die Flaschen sollten nicht bis über den Flaschenhals befüllt werden (ca. 5/6) um eine bessere Mischung der Probe zu ermöglichen. Reinwasser (aufbereitetes Wasser nach einmischen von Desinfektionsmittel) Die Probennahme erfolgt aus dem Zapfhahn der Reinwasserleitung unmittelbar vor Eintritt des Wassers in das Becken. Beckenwasser ( Wasser in Schwimm- und Badebecken) Die Probennahme erfolgt während der Hauptbelastungszeit des Beckens ca. 50 cm vom Beckenrand entfernt aus dem oberflächennahen Bereich als Schöpfprobe. Seite 243 von 281 Filtrat (aufbereitetes Wasser vor Einmischung des Desinfektionsmittels) Wasserprobe aus der Filtratleitung unmittelbar vor Einmischung des Desinfektionsmittels Der Probenbegleitschein muss vollständig ausgefüllt sein. Die Angaben über die Entnahmestelle, Entnahmezeit, Temperatur, Einzel oder Zentralversorgung und Chlorierung sind auf der Rückseite des zu notieren. ( Tabelle 2, Trinkwasser/Badewasser). Transport: Die Proben sollten gekühlt bei 5 ± 3 °C und lichtgeschützt z. B. in Behältern aus Styropor mit Kühlelementen (Kühlpacks), transportiert werden und innerhalb von 8 h im Labor eintreffen. Befundung/ Beurteilung Die Ergebnisse werden entsprechend den Grenzwerten von Schwimm- und Badewasser nach DIN 19643/1 beurteilt. Nachweis von Legionellen aus wasserführenden Systemen Anforderung: Die Untersuchung soll eine Aussage über eine mögliche Kontamination eines Systems mit Legionellen und deren Ausmaß liefern, um eine Bewertung und ggf. geeignete Abwehrmaßnahmen vornehmen zu können. Grundsätzlich sind die Vorgaben der Trinkwasserverordnung zu beachten, wonach Legionellenuntersuchungen in Hausinstallationen, aus denen Wasser an die Öffentlichkeit abgegeben wird (z.B. Schulen, Kindergärten, Krankenhäuser und sonstige Einrichtungen) jährlich vorgeschrieben sind. Mindestprobenmengen: 250 ml - 1000 L Ist abhängig von der Art des Wasserverteilungssystems und dem Zweck der Untersuchung. Hinweis zur Probennahme Die Proben sind gemäß der jeweils gültigen Fassung der Empfehlung des Umweltbundesamtes Nachweis von Legionellen in Trink- und Badebeckenwasser und unter Beachtung der Trinkwasserverordnung, durch akkreditierte Probennehmer, zu entnehmen. Für Wasser das mit Chlor desinfiziert wird, erhalten Sie sterile Flaschen mit NatriumThioslulfat-Zusatz nach Terminvereinbarung im Hygiene-Labor (0931/201 469 43) Die Flaschen sollten nicht bis über den Flaschenhals befüllt werden (ca. 5/6) um eine bessere Mischung der Probe zu ermöglichen Der Probenbegleitschein muss vollständig ausgefüllt sein ( Tabelle 2, Trinkwasser/Badewasser) Transport Die Proben sollten gekühlt bei 5 ± 3 °C und lichtgeschützt z. B. in Behältern aus Styropor mit Kühlelementen (Kühlpacks) transportiert werden und innerhalb von 8 h im Labor eintreffen. Seite 244 von 281 Befundung/ Beurteilung Bei der Untersuchung in Trinkwassererwärmungs- und Leitungsanlagen gelten die Angaben nach DVGW-Merkblatt W 551. Bei Kühltürmen erfolgt eine Bewertung nach dem „Informationsblatt für Betreiber von Verdunstungsrückkühlwerken (VRKW)“ des Bayerischen Landesamtes für Gesundheit und Lebensmittelsicherheit. (Stand: 1. Januar 2007). Es wird empfohlen den Richtwert von 1000 KBE/ Liter Legionella spezies zu unterschreiten. Untersuchung von Kakao, Schokolade, Zuckerwaren und Rohmassen auf Salmonellen Anforderung Chargenkontrolle bei der Produktion von Schokoladehaltigen Produkten. Um eine gesundheitliche Gefährdung der Verbraucher zu vermeiden, müssen Lebensmittel hygienisch-mikrobiologisch überwacht werden. Stichprobenumfang, Untersuchungsspektrum und ggf. Bewertungskriterien werden durch den Auftraggeber festgelegt. Die Durchführung der Untersuchung erfolgt nach den gemäß §64 des Lebensmittel- und Futtermittelgesetzbuches festgelegten Methoden oder gleichwertigen Verfahren. Der Probenbegleitschein muss eindeutig und vollständig mit dem gewünschten Parameter in der zu Untersuchenden Mengenangabe angegeben sein. Mindestprobenmenge: nach Vorgaben des QMS des Einsenders (100 g - 250 g) Hinweise für den Einsender: Die zu Untersuchende Menge ist auf dem Probenbegleitschein unbedingt zu vermerken. Transport Der Transport erfolgt bei Umgebungstemperatur. Die Dauer des Transportes ist in den meisten Fällen unkritisch. Befundung/ Beurteilung Salmonellen dürfen in der jeweiligen Menge nicht nachgewiesen werden Seite 245 von 281 Überprüfung von Blut und Blutkomponenten auf Sterilität Anforderung Im Rahmen der Qualitätssicherung (nach den Vorgaben des Arbeitskreises Blut, Bundesgesundheitsblatt 8/97) von Blut und Blutprodukten müssen Stichprobenuntersuchungen auf Sterilität durchgeführt werden. Mindestprobenmenge: 10 ml +/ - 1 ml Beutelinhalt pro Nährmedium Analyt 1. Sterilität von Blut- und Blutprodukten 2. Mikroorganismen: Aerobe und anerobe Bakterien Pilze Hinweise für den Einsender: Transport: Der Transport der Produkte erfolgt in doppelt verpackten Tüten, bei Umgebungstemperatur. Befundung/ Beurteilung Die Ergebnisse werden nach den Vorgaben des Arbeitskreises Blut, Bundesgesundheitsblatt 8/97 beurteilt. Seite 246 von 281 Molekularbiologie I. Präanalytik Die durchgeführten molekularbiologischen Erregernachweise beruhen auf dem Nachweis von ErregerDNA mittels verschiedener Nachweismethoden. DNA ist in den Patientenmaterialien in der Regel relativ stabil, so dass bei Transportzeiten < 24 Stunden eine Lagerung bei Raumtemperatur ausreichend ist. Bei längeren Transportzeiten sollte das Material gekühlt (4°C) oder gefroren (-20 oder -80°C) transportiert werden. Spezielle Transportmedien sind nicht erforderlich. Soll aus dem Material ausschließlich eine molekularbiologische Diagnostik durchgeführt werden, so sollte die Aufbewahrung im Falle der nicht unmittelbaren Verarbeitung bei 4°C (oder darunter) erfolgen. Wird zusätzlich zur molekularbiologischen Diagnostik eine Erregeranzucht angestrebt, so sollte das Material entsprechend den im Abschnitt Bakteriologie beschriebenen Vorschriften transportiert und aufbewahrt werden. In Zweifelsfällen empfiehlt sich eine Rücksprache mit dem zuständigen Mikrobiologen oder (außerhalb der Dienstzeiten) mit dem diensthabenden Mikrobiologen. Seite 247 von 281 II. Laufzeiten bei molekularbiologischen Untersuchungen 1. Probenannahme, Registrierung und Weiterleitung ca. 1h Die Probenannahme und Zuteilung zu den Labors erfolgt in der Pforte (Bereich Materialannahme). 2. DNA-Isolierung aus der Probe ca. 1h Die DNA-Isolierung erfolgt in der Regel am Tag des Probeneingangs. Bei Proben, die nach 15.00 Uhr im Labor eingehen, kann die DNA-Isolierung erst am Folgetag durchgeführt werden. 3. Nukleinsäureamplifikation (NAT) 5h (über Nacht) Die Nukleinsäureamplifikation wird in der Regel am Tag der DNA-Isolierung angesetzt und läuft über Nacht. Bei kommerziellen Systemen (Nachweis von Chlamydia trachomatis / Nachweis von Mycobacterium tuberculosis-Komplex) erfolgt die NAT je nach Probenaufkommen, mindestens jedoch zweimal wöchentlich. Diese Systeme beinhalten ein automatisiertes Nachweisverfahren sowie eine interne Spezifitätskontrolle, so dass die Untersuchung nach der NAT abgeschlossen ist. 4. Nachweis der Amplifikationsprodukte 2h Der Nachweis der Amplifikationsprodukte erfolgt im Anschluss an die NAT durch Gelelektrophorese. Bei negativem Testausfall (kein Amplifikationsprodukt nachweisbar) kann nach der Gelelektrophorese der Endbefund erstellt werden (in der Regel am Tag nach dem Probeneingang). Eine telefonische Vorabmitteilung positiver Befunde erfolgt in der Regel vor der Spezifitätskontrolle (siehe 6.). 5. Aufreinigung 1h Wird in der Gelelektrophorese ein Amplifikationsprodukt nachgewiesen (= positiver Testausfall), so wird dieses Produkt zur Durchführung einer Spezifitätskontrolle aufgereinigt. 6. Spezifitätskontrolle/Auswertung bei positiver NAT (Sequenzierung) 4h Die Spezifitätskontrolle (bzw. die Auswertung bei einer universellen PCR) erfolgt durch automatisierte DNA-Sequenzierung und Sequenzabgleich mit einer Datenbank. Nach erfolgreicher Spezifitätskontrolle wird der Endbefund erstellt (in der Regel 48h nach Probeneingang). Seite 248 von 281 AUSNAHMEN: - Am Wochenende (Samstag und Sonntag) sowie an Feiertagen werden keine molekularbiologischen Untersuchungen durchgeführt. - Molekularbiologische Untersuchungen, die zu Typisierungen durchgeführt werden (z. B. spaTypisierung bei MRSA-Isolaten) werden je nach Probenaufkommen im Bereich Molekularbiologie möglichst zeitnah durchgeführt. Seite 249 von 281 III. Angaben zu einzelnen Untersuchungen 1 Direktnachweise von Erregern aus diagnostischen Proben Aspergillus spp. Patientenauswahl: immunsupprimierte Patienten (V. a. Patienten mit Granulozytopenie) mit Verdacht auf Aspergillusinfektion Untersuchungsmaterial: EDTA-Blut, Liquor, bronchoalveoläre Lavage, transbronchiale Biopsie. Untersuchungsverfahren: DNA-Nachweis Zielgen: ribosomale DNA Befundinterpretation: Nachweisgrenze: ≤100 Genomäquivalente in wässriger Lösung Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis genusspezifischer DNA. Der kulturelle Erregernachweis ist relativ langwierig und weist eine geringe Sensitivität auf. Der molekularbiologische Nachweis kann ergänzend zu Mikroskopie, Kultur und Serologie Hinweise auf eine Aspergillusinfektion geben. Ein positives Ergebnis beweist die Gegenwart von Aspergillus-DNA in der Probe, eine Aussage zum Krankheitswert des Nachweises kann insbesondere beim Nachweis aus Atemwegsmaterialien nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik und anderer Befunde (Serologie, Kultur, Mikroskopie) erfolgen. Ein negativer DNA-Nachweis schließt eine Infektion nicht sicher aus. Literatur: Einsele et al., J Clin Microbiol. 1997;35:1353-60. Seite 250 von 281 Borrelia burgdorferi Patientenauswahl: Patienten mit Verdacht auf Borreliose (z. B. Z. n. Erythema chronicum migrans, Arthritis, neurologische oder ophthalmologische Manifestationen) Untersuchungsmaterial: Hautbiopsien, Gelenkpunktate, Liquor, Augenmaterial Untersuchungsverfahren: DNA-Nachweis Zielgen: Flagellin (fla) Befundinterpretation: Nachweisgrenze: 10 Genomäquivalente in wässriger Lösung Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis genusspezifischer DNA. Der kulturelle Erregernachweis ist kontaminationsanfällig, langwierig und zeichnet sich durch geringe Sensitivität aus. Methode der Wahl zur Diagnose einer Borreliose ist der serologische Antikörpernachweis, der durch die DNA-Diagnostik ergänzt werden kann. Ein positives Ergebnis beweist die Gegenwart von Borrelien-DNA in der Probe, eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik und anderer Befunde (Serologie) erfolgen. Ein negativer DNANachweis schließt eine Infektion nicht sicher aus. Ein positiver DNA-Nachweis aus Gelenkpunktaten bei negativer Serologie ist eine Rarität (seronegative Borrelien-Arthritis). Literatur: Karch und Huppertz 1993; Rheumatology 12:227-9. Seite 251 von 281 Chlamydophila pneumoniae Patientenauswahl: Patienten mit Verdacht auf Chlamydophila pneumoniae-Infektion, Verdacht auf atypische Pneumonie Untersuchungsmaterial: respiratorisches Material, Liquor nach Rücksprache Untersuchungsverfahren: DNA-Nachweis Zielgen: RNA-Polymerase β Befundinterpretation: Nachweisgrenze: ≤10 Genomäquivalente in wässriger Lösung Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis spezies-spezifischer DNA. Der kulturelle Erregernachweis ist kontaminationsanfällig, langwierig und zeichnet sich durch geringe Sensitivität aus. Der Aussagewert serologischer Methoden wird durch hohe Durchseuchungstiter eingeschränkt. Ein positiver DNA-Nachweis beweist die Gegenwart von C. pneumoniae-DNA in der Probe, eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik und anderer Befunde erfolgen. Ein negativer DNA-Nachweis schließt eine Infektion nicht sicher aus. Literatur: Maass et al., Angiology 1997; 48:699-706. Seite 252 von 281 Chlamydia trachomatis Patientenauswahl: Patienten mit urogenitalen Infektionen und V. a. C. trachomatis-Infektion, reaktive Arthritis Untersuchungsmaterial: Zervixabstriche, Erststrahlurin, Urethralabstriche Untersuchungsverfahren: PCR Zielgen: kryptisches Plasmid Befundinterpretation: Nachweisgrenze: Die Sensitivität der Methode wird in der Literatur mit >90% angegeben Spezifität: Die Spezifität der Methode liegt bei ≥95%. Der kulturelle Erregernachweis ist schwierig, langwierig und erfordert Zellkulturmethoden. Serologische Nachweise sind wegen hoher Durchseuchungstiter schwer zu interpretieren. Ein positiver DNA-Nachweis beweist die Gegenwart von C. trachomatis-DNA in der Probe. Ein negativer DNA-Nachweis schließt eine Infektion nicht sicher aus. Literatur: Jungkind et al., J. Clin. Microbiol. 1996; 34:2778-83. Seite 253 von 281 Enterohämorrhagischer Escherichia coli (EHEC) Patientenauswahl: - Patienten mit V. a. hämolytisch-urämisches Syndrom (HUS) oder thrombotisch-thrombozytopenische Purpura (TTP) - Patienten mit blutig, wässrigen Stühlen - endoskopisch nachgewiesene hämorrhagische Colitis - hospitalisierte Kinder bis zu 6 Jahren mit Diarrhoe - nekrotisierende Enterokolitis - Gastroenteritis-Ausbrüche in Gemeinschaftseinrichtungen - Diarrhoe in der Anamnese und hämolytische Anämie - Diarrhoe in der Anamnese und akutes Nierenversagen - Kontaktpersonen von Patienten mit nachgewiesenen EHEC-Infektionen Untersuchungsmaterial: Anreicherungskulturen und Kulturisolate aus Stuhl, Darmbiopsien Untersuchungsverfahren: DNA-Nachweis Zielgen: Shigatoxine 1 und 2, enterocyte attachment and effacement factor (stx1, stx2, eae) Befundinterpretation: Nachweisgrenze: entfällt Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis der Zielsequenz. Differenzierung von auf Selektivnährmedien kultivierten E. coli-Kolonien durch Shigatoxin 1-, Shigatoxin 2- und eae-NAT. Ein positives Ergebnis in eae-NAT und mindestens einer der Shigatoxin-NAT ist ein starker Hinweis für die Gegenwart von EHEC in der Probe. Eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik und anderer Befunde (Serologie) erfolgen. Ein negativer DNANachweis schließt eine Infektion nicht sicher aus. Positive Nachweise unterliegen der Meldepflicht nach §7 IfSG. Literatur: Oswald et al., Infect Immun 2000; 68:64-71. Seite 254 von 281 Enteropathogener E. coli (EPEC) Patientenauswahl: Hospitalisierte Kinder bis zu 2 Jahren mit Diarrhoe Untersuchungsmaterial: Anreicherungskulturen und Kulturisolate aus Stuhl, Darmbiopsien Untersuchungsverfahren: DNA-Nachweis Zielgen: enterocyte attachment and effacement factor (eae) Befundinterpretation: Nachweisgrenze: entfällt Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis des eae-Gens. Differenzierung der auf Selektivnährmedien kultivierten E. coli-Kolonien durch eae-NAT. Ein positives Ergebnis in der NAT beweist die Gegenwart eines E. coli-Stammes, der das eaeGen trägt (z. B. EPEC, EHEC). Zum Ausschluss einer EHEC-Infektion werden bei einer positiven eae-NAT die Shigatoxin 1- und Shigatoxin 2-NAT durchgeführt. Eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik erfolgen. Ein negativer DNA-Nachweis schließt eine Infektion nicht sicher aus. Ein positiver Nachweis unterliegt der Meldepflicht nach §7 IfSG. Literatur: Oswald et al., Infect Immun 2000; 68:64-71. Seite 255 von 281 Enterotoxischer E. coli (ETEC) Patientenauswahl: - Patienten mit wässriger Diarrhoe, besonders nach Auslandsaufenthalt - Patienten mit häufiger Stuhlentleerung Untersuchungsmaterial: Anreicherungskulturen und Kulturisolate aus Stuhl, Darmbiopsien Untersuchungsverfahren: DNA-Nachweis Zielgen: hitzestabiles und hitzelabiles Enterotoxin (ST, LT) Befundinterpretation: Nachweisgrenze: entfällt Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis der Zielsequenz. Differenzierung der auf Selektivnährmedien kultivierten E. coli-Kolonien durch NAT. Nachgewiesen werden die Gene für das hitzelabile Toxin (LT) und das hitzestabile Toxin (ST) enterotoxischer E. coli. Ein positives Ergebnis in einer oder in beiden NAT spricht für die Gegenwart von enterotoxischen E. coli (ETEC) in der Probe. Eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik erfolgen. Ein negativer DNA-Nachweis schließt eine Infektion nicht sicher aus. Positive Nachweise unterliegen der Meldepflicht nach §7 IfSG. Literatur: Frankel et al., Mol Microbiol 1998; 3:1729-34. Seite 256 von 281 Enteroinvasiver E. coli (EIEC) und Shigellen Patientenauswahl: Patienten mit ruhrartigen oder blutigen Durchfällen, Dysenterie, Fieber, Auslandsaufenthalt in der Anamnese Untersuchungsmaterial: Anreicherungskulturen und Kulturisolate aus Stuhl, Darmbiopsien Zielgen: Plasmid pInv, lal-Region Untersuchungsverfahren: DNA-Nachweis Befundinterpretation: Nachweisgrenze: entfällt Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis der Zielsequenz. Differenzierung der auf Selektivnährmedien kultivierten E. coli-Kolonien durch EIEC/Shigellaspezifische NAT (Nachweis der spezifischen lal-Sequenz). Ein positives Ergebnis in der NAT beweist die Gegenwart von enteroinvasiver E. coli -DNA oder von Shigella-DNA in der Probe. Eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik erfolgen. Ein negativer DNA-Nachweis schließt eine Infektion nicht sicher aus. Positive Nachweise unterliegen der Meldepflicht nach §7 IfSG. Literatur: Frankel et al., Mol. Microbiol. 1989; 3:1729-34. Frankel et al., J. Infect. Dis. 1990; 161:1252-6. Seite 257 von 281 Enteroaggregativer E. coli (EAEC) Patientenauswahl: -Hospitalisierte Kinder bis zu 2 Jahren mit wässriger Diarrhoe -HIV-Patienten mit unklarer Diarrhoe -Patienten mit persistierenden Diarrhöen (länger als 14 Tage) -Kleinkinder mit wässriger Diarrhoe mit Schleimbeimengungen Untersuchungsmaterial: Anreicherungskulturen und Kulturisolate aus Stuhl, Darmbiopsien Untersuchungsverfahren: DNA-Nachweis Zielgen: Plasmid pCVD Befundinterpretation: Nachweisgrenze: entfällt Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis der Zielsequenz. Differenzierung der auf Selektivnährmedien kultivierten E. coli-Kolonien durch pCVD432NAT. Ein positives Ergebnis in der NAT beweist die Gegenwart von DNA eines für die enteroaggregativen E. coli (EAEC) charakteristischen Plasmids und spricht für die Gegenwart von EAEC in der Probe. Eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik erfolgen. Ein negativer DNA-Nachweis schließt eine Infektion nicht sicher aus. Positive Befunde unterliegen der Meldepflicht nach §7 IfSG. Schmidt et al., J Clin Microbiol 1995; 33:701-5. Seite 258 von 281 Eubakterien Patientenauswahl: Primär steriles Material, aus dem sich keine Erreger mit konventionellen Methoden anzüchten lassen (z. B. aufgrund von Antibiotikatherapie oder da Infektionen mit nicht kultivierbaren Erregern vorliegen). Untersuchungsmaterial: Primär sterile Materialien Untersuchungsverfahren: DNA-Nachweis Zielgen: 16s rDNA Befundinterpretation: Nachweisgrenze: ≤1000 Genomäquivalente in wässriger Lösung Spezifität: Ein positives Amplifikat wird durch Sequenzanalyse und Vergleich mit der Genbank-Datenbank oder der RIDOM-Datenbank identifiziert. Eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik und anderer Befunde (z. B. Serologie) erfolgen. Ein negativer DNA-Nachweis schließt eine Infektion nicht sicher aus. Die eubakterielle PCR ist zur Vermeidung von falsch positiven Ergebnissen mäßig sensitiv eingestellt. Literatur: Goldenberger et al., J. Clin. Microbiol. 1997; 35:2733-9. Harmsen et al., J. Clin. Microbiol. 2001 ;39 :936-42. Seite 259 von 281 Legionella sp. Patientenauswahl: Patienten mit atypischer Pneumonie Untersuchungsmaterial: respiratorisches Material Untersuchungsverfahren: DNA-Nachweis, zusätzlich zu Antigennachweis aus Urin Zielgen: 16s rDNA (gattungsspezifisch) Befundinterpretation: Nachweisgrenze: ≤10 Genomäquivalente in wässriger Lösung Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis genusspezifischer DNA. Kultur des Erregers ist schwierig und langwierig. Die Kombination aus serologischen Antikörpernachweisen und DNA ermöglicht eine hohe Sensitivität der bakteriologischen Diagnostik. Ein positives Ergebnis beweist die Gegenwart von Legionellen-DNA in der Probe, eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik und anderer Befunde (Antigennachweis im Urin) erfolgen. Ein negativer DNA-Nachweis schließt eine Infektion nicht sicher aus. Positive Nachweise sind nach §7 IfSG meldepflichtig. Literatur: Jonas et al., J. Clin. Microbiol. 1995; 33:1247-52. Seite 260 von 281 Mycobacterium tuberculosis Patientenauswahl: Patienten mit Verdacht auf pulmonale Tuberkulose; in besonderen Fällen Tuberkulose anderer Organe Untersuchungsmaterial: N-Acetyl-L-Cystein vorbehandelte Proben (=NALC-Rest) von respiratorischen Materialien. Auf Anforderung kann der DNA-Nachweis auch aus extrarespiratorischen, vorbehandelten Materialien wie z. B. Magenspülungen, Gewebe, Perikarderguss, Pleurapunktat und Urin durchgeführt werden. Liquor wird nativ in die DNA-Präparation eingesetzt (> 5ml). Untersuchungsverfahren: PCR Zielgen: 16s rRNA Befundinterpretation: Nachweisgrenze: Die Sensitivität der Methode wird vom Hersteller (Fa. Roche) zwischen 66,7% und 86% angegeben. Spezifität: Die Spezifität der Methode wird vom Hersteller zwischen 97% und 99,6% angegeben. Mikroskopische und kulturelle Nachweise von M. tuberculosis sind die Methode der Wahl. Die kulturelle Anzucht ist die sensitivste Methode. Nur sie erlaubt die Resistenztestung und weitere epidemiologische Untersuchungen. Sie hat daher Vorrang. Die PCR erlaubt eine schnelle Bestätigung mikroskopischer Verdachtsdiagnosen. Sie kann zudem komplementär zur Sensitivitätssteigerung bei paucibazillären Infektionen verwendet werden, wenn ein dringender Verdacht auf Tuberkulose besteht oder Immunsuppressionen wie HIV-Infektionen vorliegen. Ein positiver DNA-Nachweis beweist die Gegenwart von M. tuberculosis-DNA in der Probe, eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik und anderer Befunde erfolgen. Ein negativer DNA-Nachweis schließt eine Infektion nicht sicher aus. Ein positiver Befund ist nach §7 IfSG meldepflichtig. Literatur: Jungkind et al., J. Clin. Microbiol. 1996; 34:2778-83. Seite 261 von 281 Mycoplasma pneumoniae (ZNS-Infektion) Patientenauswahl: Patienten mit neurologischen Manifestationen (unklare Meningitis, Encephalitis, Meningoencephalitis, transverse Myelitis, Hirnnervenlähmungen wie Facialisparese, Psychosen, Gilles de la Tourette-Syndrom, Guillain-Barré-Syndrom, Hirnstammsymptomatik und Hirninfarkte). Untersuchungsmaterial: Liquor Untersuchungsverfahren: DNA-Nachweis Zielgen: ATPase Befundinterpretation: Nachweisgrenze: ≤1 Genomäquivalent in wässriger Lösung Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis genusspezifischer DNA. Der kulturelle Nachweis von Mycoplasma pneumoniae ist schwierig und langwierig. Ein positives Ergebnis in der NAT beweist die Gegenwart von Mycoplasma pneumoniae-DNA in der Probe. Die Kombination aus Kultur, serologischen Antikörper- und Antigennachweisen und DNA-Amplifikation ermöglicht eine hohe Sensitivität der bakteriologischen Diagnostik. Eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik erfolgen. Ein negativer DNA-Nachweis schließt eine Infektion nicht sicher aus. Literatur: Bernet et al., J. Clin Microbiol 1989; 27:2492-6. Seite 262 von 281 Mycoplasma pneumoniae (Pneumonie) Patientenauswahl: Patienten mit Verdacht auf atypische Pneumonie Untersuchungsmaterial: Material aus dem Respirationstrakt Untersuchungsverfahren: DNA-Nachweis Zielgen: tuf Befundinterpretation: Nachweisgrenze: ≤100 Genomäquivalente in wässriger Lösung Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis genusspezifischer DNA. Der kulturelle Nachweis von Mycoplasma pneumoniae ist schwierig und langwierig. Ein positives Ergebnis in der NAT beweist die Gegenwart von Mycoplasma pneumoniae-DNA in der Probe. Die Kombination aus Kultur, serologischen Antikörper- und Antigennachweisen und DNA-Amplifikation ermöglicht eine hohe Sensitivität der bakteriologischen Diagnostik. Eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik erfolgen. Ein negativer DNA-Nachweis schließt eine Infektion nicht sicher aus. Literatur: Lüneberg et al., J. Clin. Microbiol. 1993 ; 31 :1088-94. Seite 263 von 281 Pneumocystis jirovecii (P. carinii f. sp. hominis) Patientenauswahl: Verdacht auf atypische Pneumonie bei HIV-Patienten Untersuchungsmaterial: respiratorisches Material von HIV-Patienten Untersuchungsverfahren: DNA-Nachweis (nested NAT) Zielgen: mitochondriale rDNA Befundinterpretation: Nachweisgrenze: ≤10 Genomäquivalente in wässriger Lösung Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis genusspezifischer DNA. Der kulturelle Nachweis von Pneumocystis jirovecii ist nicht möglich. Serologische Methoden sind nicht verfügbar. Ein positives Ergebnis in der NAT beweist die Gegenwart von Pneumocystis jirovecii -DNA in der Probe. Die NAT wird komplementär zur mikroskopischen Diagnostik verwendet. Eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik erfolgen. Positive Befunde sprechen bei Patienten mit HIV-Infektion für das Vorliegen einer Pneumocystis jiroveciiPneumonie. Bei HIV-negativen Patienten ist der Aussagewert gering. Ein negativer DNANachweis schließt eine Infektion nicht sicher aus. Literatur: Weig et al., J. Clin Microbiol. 1997; 35:1445-49. Seite 264 von 281 Toxoplasma gondii Patientenauswahl: Verdacht auf Toxoplasmose bei Schwangeren, Neugeborenen und immunsupprimierten Patienten Untersuchungsmaterial: Liquor, EDTA-Blut, Fruchtwasser, Gewebe (ZNS-, Herz- oder Lungenbiopsien, Abortmaterial), Augenkammerwasser, BAL Untersuchungsverfahren: DNA-Nachweis Zielgen: B1 Befundinterpretation: Nachweisgrenze: ≤100 Genomäquivalente in wässriger Lösung Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis genusspezifischer DNA. Der kulturelle Nachweis von Toxoplasma gondii ist nicht möglich. Ein positives Ergebnis in der NAT beweist die Gegenwart von Toxoplasma gondii-DNA in der Probe. Methode der Wahl ist die Serologie. Die NAT ergänzt besonders bei immunsupprimierten Patienten (z. B. HIV, Transplantation) und bei cerebralen Toxoplasmosen den serologischen Nachweis von Antikörpern. Eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik erfolgen. Ein negativer DNANachweis schließt eine Infektion nicht sicher aus. Literatur: Burg et al., J. Clin. Microbiol. 1989 ; 27 :1787-92. Seite 265 von 281 Tropheryma whipplei Patientenauswahl: Verdacht auf Morbus Whipple. Diese Patienten zeigen eine multisystemische Erkrankung mit Arthralgien, Pleuritis, Fieber, Gewichtsverlust und Lymphadenopathie, ggf. mit zusätzlicher Herz- und gastrointestinaler Beteiligung. Untersuchungsmaterial: Darmbiopsien, Hirnbiopsien, extraintestinale Materialien, Liquor, EDTA-Blut Untersuchungsverfahren: DNA-Nachweis Zielgen: 16s rDNA Befundinterpretation: Nachweisgrenze: ≤10 Genomäquivalente in wässriger Lösung Spezifität: Die Identität des Amplifikats wird durch Sequenzanalyse überprüft. Die Spezifität beträgt 100% für den Nachweis genusspezifischer DNA. Bis auf wenig spezifische histologische Färbemethoden sind keine konventionellen Methoden beschrieben, so dass nur NAT routinemäßig zum Einsatz kommen. Ein positives Ergebnis beweist die Gegenwart von Tropheryma whipplei-DNA in der Probe, eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik und anderer Befunde (Histologie) erfolgen. Ein negativer DNANachweis schließt eine Infektion nicht sicher aus. Literatur: Relman et al., New Engl J Med 1992; 327:293-301. Eck et al. Human Pathol. 1997; 28:1424-8. Seite 266 von 281 IV. Molekularbiologische Methoden zur Speziesdiagnostik, Feintypisierung und Resistenztestung Mycobacterium sp. 16s Patientenauswahl: Mykobakterien-Kulturisolate Untersuchungsmaterial: extrahierte DNA von mykobakteriellen Isolaten aus Flüssig- oder Festnährbodenkulturen Untersuchungsverfahren: DNA-Nachweis Zielgen: 16S rDNA Befundinterpretation: Nachweisgrenze: ≤1000 Genomäquivalente in wässriger Lösung Spezifität: Ein positives Amplifikat wird durch Sequenzanalyse und Vergleich mit der NCBIDatenbank oder RIDOM-Datenbank identifiziert. Die Methode dient der Speziesbestimmung von Mykobakterien durch Sequenzanalyse der 16S rRNA-Gene. Mit dieser Methode ist eine rasche und standardisierte molekulare Speziesdifferenzierung von Mykobakterienisolaten möglich. Literatur: Dostal et al., RIDOM Press, Würzburg 2003. Seite 267 von 281 Mycobacterium sp. - ITS Patientenauswahl: Mykobakterien-Kulturisolate (MOTT) Untersuchungsmaterial: extrahierte DNA von mykobakteriellen Isolaten aus Flüssig- oder Festnährbodenkulturen Untersuchungsverfahren: DNA-Nachweis Zielgen: intern transkribierte Spacer (ITS) Befundinterpretation: Nachweisgrenze: entfällt Spezifität: Ein positives Amplifikat wird durch Sequenzanalyse und Vergleich mit der NCBIDatenbank oder RIDOM-Datenbank identifiziert. Die Methode dient der Speziesbestimmung von Mykobakterien durch Sequenzanalyse der ITS Region. Mit dieser Methode ist eine rasche und standardisierte molekulare Speziesdifferenzierung von Mykobakterienisolaten, die sich anhand ihrer 16S rDNA-Sequenz nicht bis auf Speziesebene differenzieren lassen, möglich. Erlaubt auch die ITSSequenzierung keine eindeutige Speziesidentifizierung, so sollte ein Referenzlabor konsultiert werden. Literatur: Roth et al., J. Clin. Microbiol. 2000; 38:1094-1104. Seite 268 von 281 Mycobacterium tuberculosis - Komplex Patientenauswahl: Mykobakterien-Kulturisolate (M. tuberculosis-Komplex) Untersuchungsmaterial: extrahierte DNA von mykobakteriellen Isolaten aus Flüssig- oder Festnährbodenkulturen Untersuchungsverfahren: DNA-Nachweis Zielgen: gyrB Befundinterpretation: Nachweisgrenze: entfällt Spezifität: Ein positives Amplifikat wird durch Sequenzanalyse identifiziert (siehe SOP). Die Methode dient der Speziesbestimmung von Mykobakterien aus dem Tuberkulosekomplex durch Sequenzanalyse des gyrB Gens. Literatur: Kasai et al., J. Clin. Microbiol. 2000; 38:301-8. Seite 269 von 281 Mycobacterium bovis Patientenauswahl: M. bovis-Kulturisolate Untersuchungsmaterial: extrahierte DNA von M. bovis-Isolaten aus Flüssig- oder Festnährbodenkulturen Untersuchungsverfahren: DNA-Nachweis Zielgen: genomische Region RD1 Befundinterpretation: Nachweisgrenze: entfällt Spezifität: 100% Die Methode dient der Unterscheidung zwischen M. bovis und M. bovis BCG durch den Nachweis einer genomischen Deletion bei BCG-Stämmen. Literatur: Talbot et al., J. Clin. Microbiol. 1997 ; 35 :566-569. Seite 270 von 281 Eubakteriendifferenzierung durch 16S rRNA-Sequenzierung Patientenauswahl: Bakterien-Kulturisolate Untersuchungsmaterial: extrahierte DNA von bakteriellen Isolaten aus Flüssig- oder Festnährbodenkulturen Untersuchungsverfahren: DNA-Nachweis und Sequenzanalyse Zielgen: 16S rDNA Befundinterpretation: Nachweisgrenze: entfällt Spezifität: Ein positives Amplifikat wird durch Sequenzanalyse und Vergleich mit der Genbank-Datenbank oder der RIDOM-Datenbank identifiziert. Die Methode dient der raschen und standardisierten Speziesidentifizierung von Bakterienisolaten. Sie wird besonders bei Bakterienspezies eingesetzt, die mit konventionellen mikrobiologischen Methoden nicht oder nur mit großem Aufwand identifiziert werden können (z. B. strikt anaerobe Bakterien). Eine Aussage zum Krankheitswert des Nachweises kann nur vom behandelnden Arzt in Kenntnis der klinischen Symptomatik und anderer Befunde (Bakteriologie) erfolgen. Literatur: Goldenberger et al., J. Clin. Microbiol. 1997; 35:2733-9. Harmsen et al., J. Clin. Microbiol. 2001 ; 39 :936-42. Seite 271 von 281 Methicillin-resistenter Staphylococcus aureus (MRSA): mecA-Gen Patientenauswahl: entfällt Untersuchungsmaterial: S. aureus-Isolate mit V. a. Methicillin-Resistenz bei unklarem Phänotyp Untersuchungsverfahren: DNA-Nachweis, Amplifikation Zielgen: mecA (kodiert für alternatives Penicillin-Bindungsprotein PBP 2a) Befundinterpretation: Sensitivität: Es wird mit hinreichenden DNA-Mengen gearbeitet, die Frage der Sensitivität des Verfahrens ist daher zu vernachlässigen. Ein negatives Ergebnis der mecA-PCR wird nur dann analytisch freigegeben, wenn die spa-PCR des selben Stammes positiv ausfällt. Spezifität: Das von Jonas et al. 2002 publizierte Verfahren ist reproduzierbar und beweist spezifisch das Vorliegen des mecA-Gens eines S. aureus Stammes. Der phänotypische Nachweis einer Methicillin-Resistenz kann in Einzelfällen schwierig sein, wenn niedrige MHK-Werte nachgewiesen werden (z. B. bei Vorliegen einer heterogenen Resistenz) oder der PBP 2a-Antigennachweis zweifelhaft ausfällt. Zur Klärung solcher Befunde bietet der mecA Nachweis eine zwar aufwändige, aber zuverlässige Alternative. Literatur: Jonas et al. 2002. J. Clin. Microbiol. 40 : 1821-23 Seite 272 von 281 spa-Typisierung von Methicillin-resistenten Staphylococcus aureus Stämmen (MRSA) Patientenauswahl: Patientenisolate mit Methicillin-resistenten Staphylococcus aureus Untersuchungsmaterial: Bakterienisolate auf Festkulturnährmedium Untersuchungsverfahren: DNA-Nachweis und Sequenzanalyse Zielgen: repeat region des Protein A Gens (spa) Befundinterpretation: Diese Untersuchung ermöglicht die molekulare Typisierung von MRSAStämmen Nachweisgrenze: entfällt Spezifität: Ein positives Amplifikat wird durch Sequenzanalyse identifiziert und durch Vergleich mit einer Datenbank von Referenzsequenzen einem spa-Typ zugeordnet. Für die spa-Typ-Bestimmung wird eine 100%ige Übereinstimmung mit einer der Referenzsequenzen gefordert. Sollte es sich um eine neue Variante handeln, wird diese durch erneute Sequenzierung des Gegenstranges bestätigt und in die Referenzsequenzdatenbank aufgenommen. Literatur: Harmsen et al., J Clin Microbiol. 2003; 41:5442-8. Shopsin et al., J. Clin. Microbiol. 1999; 37:3556-3563. Seite 273 von 281 Vancomycin Resistenzgene für Enterokokken Untersuchungsmaterial: Vancomycin-resistente Enterokokkenisolate Untersuchungsverfahren: DNA-Nachweis Zielgene: vanA, vanB, vanC1, vanC2/3 Befundinterpretation: Spezifität: Die PCR muss ein Produkt der korrekten Länge für das jeweilige Zielgen liefern. Die Validierung der Methode ergab eine 100%ige Spezifität der positiven Zielsequenznachweise. Die Resistenztestung von Enterokokken gegen Vancomycin per MHK im Vitek oder mittels E-Test liefert bei Vancomycin resistenten Enterokokken oftmals grenzwertige und in unabhängigen Tests variable Ergebnisse. Darum sollten alle Enterokokken, die nicht eindeutig sensibel gegen Vancomycin und Teicoplanin getestet sind auf das Vorhandensein der Vancomycin Resistenz vermittelnden Gene mittels PCR untersucht werden. Die unterschiedlichen van-Gene kodieren für Ligasen die zur Synthese von alterierten Peptidoglykanen in der Zellwand von Enterokokken führen. Die unterschiedlichen Alterationen führen zu unterschiedlich starken Ausprägungen der Resistenzen gegen Vancomycin und Teicoplanin. VanA vermittelt eine high-level Resistenz gegen Vancomycin (MHK>32µg/ml) und Teicoplanin (MHK>16µg/ml). VanB vermittelt eine high-level Resistenz gegen Vancomycin und variable Resistenz gegen Teicoplanin. Die vanC Gene vermitteln eine low-level Resistenz gegen Vancomycin (MHK 4-8), Teicoplanin bleibt in der In-vitroTestung wirksam (MHK <8). E. gallinarum, E. casseliflavus und E. flavescens sind vermittelt durch die vanC-Gene immer low-level resistent gegen Vancomycin. Literatur: Dutka-Malen et al., J. Clin. Microbiol; 1995 33 :24-27 Sahm et al., Antimicrob Agents Chemother; 1995 39:1480-1485. Seite 274 von 281 Molekularer Direkt-Nachweis von MRSA (IDI MRSA, Becton Dickinson) Untersuchungsmaterial: Nasen- oder Wundabstriche (Amies-Medium) Patientenauswahl: Patienten mit Risikofaktoren für MRSA-Trägertum bei Aufnahme in das UKW oder Verlegung Untersuchungsverfahren: Real-time PCR (Smart Cycler ®) Zielgene: SCCmec, MRSA-spezifisch Nachweisgrenze: 15 Genomäquivalente pro Reaktion (entspricht 5CFU pro Reaktion) [Angaben des Herstellers] Sensitivität: 92,3% (Oberdorfer et al. 2006); 100% (Huletsky et al. 2005); 96% (Drews et al. 2006) Spezifität: 98,4% (Huletsky et al); 93,4% (Warren et al.); 96% (Drews et al. 2006; extranasale Abstriche); 98,6% (Oberdorfer et al. 2006) Literatur: 1. Huletsky et al., 2004. New real-time PCR assay for rapid detection of Methicillin-resistant Staphylococcus aureus from specimen containing a mixture of staphylococci. J Clin Microbiol. 42(5): 1875-84. 2. Huletsky et al., 2005. Identification of Methicillin-resistant Staphylococcus aureus carriage in less than 1 hour during a hospital surveillance progem. Clin Infect Dis. 40: 976-81 3. Warren et al., 2004. Detection of Methicillin-resistant Staphylococcus aureus directly from nasal swab specimens by a real-time PCR assay. J Clin Microbiol. 42(12): 5578-81. 4. Drews et al., 2006. Verification of the IDI-MRSA assay for detecting Methicillin-resistant Staphylococcus aureus in diverse specimen types in a core clinical laboratory setting. J Clin Microbiol. 44(10): 3794-96. 5. Oberdorfer et al., 2006. Evaluation of a single-locus real-time polymerase chain reaction as a screening test for specific detection of methicillin-resistant Staphylococcus aureus in ICU patients. Eur J Clin Microbiol Infect Dis. 25(10): 657-663. Seite 275 von 281 Typisierung von VRE mittels multilocus variable number of tandem repeat analysis (MLVA) Untersuchungsmaterial: Enterococcus faecium-Stämme Patientenauswahl: Bei V. a. auf VRE-Infektketten zur epidemiologischen Abklärung Untersuchungsverfahren: PCR, Agarosegelelektrophorese Zielgene: mehrere Repeat-Arrays des Enterokokkengenoms Diskriminationsfähigkeit: MLVA erlaubt das Verwerfen der Hypothese, dass ein epidemiologischer Link besteht. Aufgrund der Klonalität der Spezies im Krankenhaus ist der Beweis eines Links durch MLVA schwierig. Eine komplementäre Methode (MLST, PFGE) wird empfohlen. Simpson's index of diversity, 0.846; 95% confidence interval, 0.755 to 0.937 (eigene Daten, Abele-Horn et al. 2006) Literatur: Top J, Schouls LM, Bonten MJ, Willems RJ. Multiple-locus variable-number tandem repeat analysis, a novel typing scheme to study the genetic relatedness and epidemiology of Enterococcus faecium isolates. J Clin Microbiol. 2004 Oct;42(10):4503-11. Abele-Horn M, Vogel U, Klare I, Konstabel C, Trabold R, Kurihara R, Witte W, Kreth W, Schlegel PG, Claus H. Molecular epidemiology of hospital-acquired vancomycin-resistant enterococci. J Clin Microbiol. 2006 Nov;44(11):4009-13. Seite 276 von 281 NRZM (www.meningococcus.de) I. Meningokokken-Nachweis und Typisierung Indikation: Typisierung und Antibiotikaresistenzbestimmung von Neisseria meningitidis-Stämmen im Rahmen der nationalen Labor-Surveillance im Auftrag des Robert-Koch-Instituts (RKI). Direkter Nachweis und Typisierung von N. meningitidis bei kulturnegativem Material. Untersuchungsmaterial: - Vitale Bakterien isoliert aus: Blut, Liquor, nasopharyngealen Abstrichen, Rachen-, Gelenkpunktaten, Petechienaspirat, Biopsien, Lymphknoten. - Nativmaterial: Liquor, EDTA-Blut, Serum, Plasma und Biopsien Tonsillenabstrichen, Transport: Die Gefahrguttransportvorschriften sind zu beachten (s. VERSAND auf der Homepage). Genügend Material einer frischen Übernachtkultur sollte mittels Tupfer in ein Transportmedium (z.B. Amies Medium, Port-A-Cul, Port-A-Germ) eingebracht werden. Alternativ können die Bakterien als Übernachtkultur auf Schrägagar-Röhrchen mit Schraubverschluss (GC-Agar, Kochblutagar) versendet werden. Nativmaterial wird bei Raumtemperatur per Post transportiert (maximale Transportzeit: 48h). Untersuchungsmethoden: - Identifizierung von N. meningitidis und anderen Neisseria-Spezies aus invasiven Infektionen mittels biochemischer Methoden; Durchführung der 16S rRNASequenzierung - Serologische Bestimmung der Serogruppen (A, B, C, W135, Y) - Molekularbiologische Typisierung mittels porA- und fetA-Sequenzierung - Empfindlichkeitstestung mittels E-Test (getestete Antibiotika: Penicillin G, Ciprofloxacin, Cefotaxim und Rifampicin) und penA-Sequenzierung - fumC-Sequenzierung zur Identifizierung von ET-15 Meningokokken - Molekularbiologische Typisierung ausgewählter Isolate mittels MLST (Multi-LocusSequenz-Typisierung) zur Aufklärung der Populationsstruktur invasiver Isolate im europäischen und globalen Kontext - Durchführung der 16S rRNA-Sequenzierung zum molekularbiologischen Nachweis von N. meningitidis bei kulturnegativem Material. Bestimmung der Serogruppen B, C, W135 und Y mittels PCR sowie Typisierung mittels porA- und fetA-Sequenzierung. Untersuchungsdauer: Bei Kulturmaterial erfolgt die Serogruppenbestimmung innerhalb von 24h nach Eintreffen, das Antibiogramm 48h nach Eintreffen. Die porA- und fetA-Typisierung erfolgt innerhalb von 48h bei Ausbrüchen und dringenden Fällen, mindestens 1x wöchentlich bei sporadischen Fällen (abhängig von Arbeitsaufkommen und Logistik). Bei Ausbrüchen und dringenden Fällen erfolgt die molekulare Diagnostik von Nativmaterial innerhalb von 48h, bei sporadischen Fällen dauert sie ggf. länger. An Wochenenden ist das Labor nicht besetzt, doch es werden Materialien für das NRZM im Bereich Bakteriologie angenommen und angelegt. Ergebnismitteilung: Es erfolgt eine Übermittlung von Teil- und Endbefunden an die Einsender. Endbefunde werden an das für den Wohnort des Patienten zuständige Gesundheitsamt und an die jeweiligen Landesgesundheitsämter weitergeleitet. Jährliche Auswertungen werden dem Seite 277 von 281 Robert-Koch-Institut zur Verfügung gestellt und zudem auf der Homepage des NRZM veröffentlicht. Das NRZM führt Computer-gestützte Clusteranalysen durch, die an zuständige Gesundheitsämter, Landesbehörden und das RKI weitergeleitet werden. Jährlich wird ein Abgleich mit den Meldedaten des RKI durchgeführt. II. Meningokokken-Serologie Indikation: Nachweis von bakteriziden Antikörpern gegen die Kapselpolysaccharide von Serogruppe A, C, W-135 und Y Meningokokken. Die Untersuchung wird zur Überprüfung des Impferfolges nach Polysaccharidimpfung (konjugierte und nicht-konjugierte Impfstoffe) durchgeführt, wenn die Geimpften einen Immundefekt aufweisen. Untersuchungsmaterial: Serum, entnommen >4 Wochen nach Impfung. Optimal ist die Einsendung eines Serumpaares entnommen zum Zeitpunkt der Impfung und 4 Wochen danach. Versand: Serum wird bei Raumtemperatur versendet und sollte nicht länger als 24 h transportiert werden. Nach Erhalt im NRZM wird das Serum bei –20°C gelagert oder unmittelbar verarbeitet. Begleitinformationen: Ein Begleitschein steht unter www.meningococcus.de zu Verfügung. Labormethoden: Es werden Serumbakterizidietests (SBA) zum Nachweis bakterizid wirksamer Antikörper durchgeführt. Untersuchungsergebnisse: SBA-Ergebnisse werden als Titer angegeben. Titer ≥ 8 gelten als protektiv. Die SBA-Titer reflektieren funktionelle Antikörper und sind daher im Vergleich zu ELISA-Ergebnissen als valider einzustufen. III. Weitere Tätigkeiten im Sinne des Aufgabenkatalogs des RKI − − − − Beratungstätigkeit für den Öffentlichen Gesundheitsdienst, Laboratorien, niedergelassene Ärzte, Kliniken und Forschungsinstitute. Durchführung von Weiterbildungen und Öffentlichkeitsarbeit. In Abstimmung mit dem Robert Koch-Institut Auswertung und Interpretation der Daten mit dem Ziel, die epidemiologische Situation möglichst repräsentativ für Deutschland zu beschreiben. Initiierung von und Mitarbeit bei Surveillanceprojekten. Regelmäßige Berichterstattung sowie Beratung des Robert Koch-Instituts zu den entsprechenden Sachfragen und Mitwirkung bei der Erarbeitung von Empfehlungen des Robert Koch-Institutes für Diagnostik, Therapie und Prävention sowie allgemein in der angewandten Infektionsepidemiologie Abgabe von Referenzstämmen aus der Stammsammlung des Referenzzentrums für diagnostische und wissenschaftliche Zwecke auf Anfrage Seite 278 von 281 − Aufbau und koordinierende Pflege von Netzwerken diagnostischer Einrichtungen. (IBD-LabNet [ECDC], EMGM, RKI Netzwerk „Invasive bakterielle Infektionen“) Mitarbeiter des NRZM sind über den diensthabenden Arzt des Instituts für Hygiene und Mikrobiologie der Universität Würzburg auch außerhalb der regulären Dienstzeiten erreichbar (Telefonzentrale Uniklinik Würzburg 0931-201 0) IV. Literatur Arreaza L, Salcedo C, Alcalá B, Uría MJ, Abad R, Enríquez R, Vazquez JA. Sequencing of Neisseria meningitidis penA Gene: the key to success in defining penicillin G breakpoints. Antimicrob Agents Chemother. 2004 Jan;48(1):358-9. Claus H, Stummeyer K, Batzilla J, Mühlenhoff M, Vogel U. Amino acid 310 determines the donor substrate specificity of serogroup W-135 and Y capsule polymerases of Neisseria meningitidis. Mol Microbiol. 2009 Feb;71(4):960-71. Elias J, Harmsen D, Claus H, Hellenbrand W, Frosch M, Vogel U. Spatiotemporal analysis of invasive meningococcal disease, Germany. Emerg Infect Dis. 2006 Nov;12(11):1689-95. Harmsen D, Singer C, Rothgänger J, Tonjum T, de Hoog GS, Shah H, Albert J, Frosch M. Diagnostics of Neisseriaceae and Moraxellaceae by ribosomal DNA sequencing: ribosomal differentiation of medical microorganisms. J Clin Microbiol. 2001 Mar;39(3):936-42. Laude G, Kist M, Krause G. Etablierung von Referenznetzwerken aus Nationalen Referenzzentren mit assoziierten Konsiliarlaboratorien in Deutschland. Bundesgesetzbl 2009. 52:919-926 Maiden MC, Bygraves JA, Feil E, Morelli G, Russell JE, Urwin R, Zhang Q, Zhou J, Zurth K, Caugant DA, Feavers IM, Achtman M, Spratt BG. Multilocus sequence typing: a portable approach to the identification of clones within populations of pathogenic microorganisms. Proc Natl Acad Sci USA. 1998 Mar 17;95(6):3140-5. Thompson EA, Feavers IM, Maiden MC. Antigenic diversity of meningococcal enterobactin receptor FetA, a vaccine component. Microbiology. 2003 Jul;149(Pt 7):1849-58. Urwin R, Russell JE, Thompson EA, Holmes EC, Feavers IM, Maiden MC. Distribution of surface protein variants among hyperinvasive meningococci: implications for vaccine design. Infect Immun. 2004 Oct;72(10):5955-62. Vázquez JA, Arreaza L, Block C, Ehrhard I, Gray SJ, Heuberger S, Hoffmann S, Kriz P, Nicolas P, Olcen P, Skoczynska A, Spanjaard L, Stefanelli P, Taha MK, Tzanakaki G. Interlaboratory comparison of agar dilution and Etest methods for determining the MICs of antibiotics used in management of Neisseria meningitidis infections. Antimicrob Agents Chemother. 2003 Nov;47(11):3430-4. Vogel U, Claus H, Frosch M, Caugant DA. Molecular basis for distinction of the ET-15 clone within the ET-37 complex of Neisseria meningitidis. J Clin Microbiol. 2000 Feb;38(2):941-2. Vogel U, Elias J, Claus H, Frosch M. Laboratory diagnosis of Neisseria meningitidis from the viewpoint of the German Reference Laboratory. J Lab Med 2009 Sep;33(5):245-253. Stand 29.12.2009 Seite 279 von 281 KLHI (www.haemophilus-online.de) I. Haemophilus influenzae-Nachweis und Typisierung Indikation: Typisierung von Haemophilus influenzae-Stämmen im Rahmen der nationalen LaborSurveillance im Auftrag des Robert-Koch-Instituts (RKI). Untersuchungsmaterial: - Vitale Bakterien isoliert aus: Blut, Liquor, nasopharyngealen Abstrichen, Rachen-, Tonsillenabstrichen, Gelenkpunktaten, Petechienaspirat, Biopsien, Lymphknoten, Ohrabstrichen Transport: Die Gefahrguttransportvorschriften sind zu beachten (s. VERSAND auf der Homepage). Genügend Material einer frischen Übernachtkultur sollte mittels Tupfer in ein Transportmedium (z.B. Amies Medium, Port-A-Cul, Port-A-Germ) eingebracht werden. Alternativ können die Bakterien als Übernachtkultur auf Schrägagar-Röhrchen mit Schraubverschluss (Kochblutagar) versendet werden. Untersuchungsmethoden: - Identifizierung von H. influenzae und anderen Haemophilus-Spezies aus invasiven Infektionen mittels biochemischer Methoden; Durchführung der 16S rRNASequenzierung - Serologische Bestimmung der Serotypen (a, b, c, d, e, f) - Molekularbiologischer Nachweis von ompP2 und bexA - Molekularbiologische Serogenotypisierung mittels PCR - Molekularbiologische Typisierung ausgewählter Isolate mittels MLST (Multi-LocusSequenz-Typisierung) zur Aufklärung der Populationsstruktur invasiver Isolate im europäischen und globalen Kontext Untersuchungsdauer: Die Serotypbestimmung erfolgt innerhalb 24h nach Eintreffen. Die molekularbiologischen Untersuchungen werden erfolgen 1x wöchentlich (abhängig von Arbeitsaufkommen und Logistik). An Wochenenden ist das Labor nicht besetzt, doch es werden Materialien für das KLHI im Bereich Bakteriologie angenommen und angelegt. Ergebnismitteilung: Es erfolgt eine Übermittlung des Endbefundes an die Einsender. Endbefunde werden an das für den Wohnort des Patienten zuständige Gesundheitsamt und an die jeweiligen Landesgesundheitsämter weitergeleitet. II. Weitere Tätigkeiten im Sinne des Aufgabenkatalogs des RKI − − Beratungstätigkeit für den Öffentlichen Gesundheitsdienst, Laboratorien, niedergelassene Ärzte, Kliniken und Forschungsinstitute. Durchführung von Weiterbildungen und Öffentlichkeitsarbeit. In Abstimmung mit dem Robert Koch-Institut Auswertung und Interpretation der Daten mit dem Ziel, die epidemiologische Situation möglichst repräsentativ für Deutschland zu beschreiben. Initiierung von und Mitarbeit bei Surveillanceprojekten. Seite 280 von 281 − Regelmäßige Berichterstattung sowie Beratung des Robert Koch-Instituts zu den entsprechenden Sachfragen und Mitwirkung bei der Erarbeitung von Empfehlungen des Robert Koch-Institutes für Diagnostik, Therapie und Prävention sowie allgemein in der angewandten Infektionsepidemiologie − Abgabe von Referenzstämmen aus der Stammsammlung des Referenzzentrums für diagnostische und wissenschaftliche Zwecke auf Anfrage − Aufbau und koordinierende Pflege von Netzwerken diagnostischer Einrichtungen. (IBD-LabNet [ECDC], RKI Netzwerk „Invasive bakterielle Infektionen“) Mitarbeiter des KLHI sind über den diensthabenden Arzt des Instituts für Hygiene und Mikrobiologie der Universität Würzburg auch außerhalb der regulären Dienstzeiten erreichbar (Telefonzentrale Uniklinik Würzburg 0931-201 0) III. Literatur Falla TJ, Crook DW, Brophy LN, Maskell D, Kroll JS, Moxon ER. PCR for capsular typing of Haemophilus influenzae. J Clin Microbiol. 1994 Oct;32(10):2382-6. Hobson RP, Williams A, Rawal K, Pennington TH, Forbes KJ. Incidence and spread of Haemophilus influenzae on an Antarctic base determined using the polymerase chain reaction. Epidemiol Infect. 1995 Feb;114(1):93-103. Laude G, Kist M, Krause G. Etablierung von Referenznetzwerken aus Nationalen Referenzzentren mit assoziierten Konsiliarlaboratorien in Deutschland. Bundesgesetzbl 2009. 52:919-926 Meats E, Feil EJ, Stringer S, Cody A, Goldstein R, Kroll JS, Popovic T and Spratt BG. Characterization of encapsulated and noncapsulated Haemophilus influenzae and determination of phylogenetic relationships by multilocus sequence typing. J Clin Microbiol 2003 April;41(4):1623-1636 van Ketel RJ, de Wever B, van Alphen L. Detection of Haemophilus influenzae in cerebrospinal fluids by polymerase chain reaction DNA amplification. J Med Microbiol. 1990 Dec;33(4):271-6. Vogel U, Elias J. Claus H. Invasive Erkrankungen durch Haemophilus influenzae im Jahr 2008. Epidem Bull 2009. 35:357-358 Stand 29.12.2009 Seite 281 von 281