PDF anzeigen
Werbung

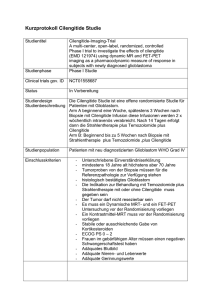
StudienID: 588, Studienkennung: EudraCT-No.: 2009-011898-33, UTRN: Grunddaten Kurztitel Titel Fragestellung HIT-HGG-CilMetro Cilengitide and Metronomic Temozolomide for Relapsed or Refractory High Grade Gliomas or Diffuse Intrinsic Pontine Gliomas in Children and Adolescents - A Phase II Study<br /> <br /> HIT-HGG-CilMetro - A Clinical Phase II Trial of the HIT-HGG Study Group Primary objektives: To evaluate the efficacy of a combined treatment with cilengitide and metronomic oral temozolomide as measured by 6 months overall survival (OS) after diagnosis of relapse or tumour progression in children and adolescents with relapsed or refractory high-grade malignant glioma and diffuse intrinsic pontine glioma. Secondary objectives: 1. To evaluate the safety and toxicity of the study treatment by common toxicity criteria (CTC; version 3.0). 2. To assess - the response rates at 6 months (continuous complete response = CCR, complete response = CR, partial response = PR, stable disease = SD, progressive disease = PD) and - progression-free survival (PFS) at 6 months, and - response rates, OS, and PFS at 12 months after relapse diagnosis or diagnosis of tumor progression. Response will be presented including histopathological variants. 3. To assess the pharmacokinetics of cilengitide administered as part of the study treatment. Auszeichnungen Gütesiegel A der Deutschen Krebsgesellschaft Aktueller Stand der Studie Eintragsdatum 04.11.2010 Beginn der Einbringung 01.01.2012 Gesamtpatientenzahl 33 Ende der Einbringung 31.12.2013 Aktuelle Pattientenzahl 0 Laufzeit in Monaten 37 Ein- Ausschlussalter 3 bis 18 Status offen Studiendaten Studienart Studiendesign Diagnosegruppen Therapiestudie • kurativer Therapieansatz • Folgetherapie • nicht - stratifiziert • nicht - randomisiert • prospektiv • multizentrisch Hirntumor / ZNS • Sonstige Hirntumoren • Glioblastom Studientyp Therapieverfahren Wirkstoffe(e) Phase II Operation - nicht ausgewählt Bestrahlung - nicht ausgewählt Chemotherapie - nicht ausgewählt Hormontherapie - nicht ausgewählt Immuntherapie - nicht ausgewählt • Temozolomid Kindliche Tumoren • Hirntumor / ZNS: Astrozytom Stadium Relapsed or refractory high grade glioma (WHO III or IV) or diffuse intrinsic pontine glioma Einschlusskriterien 1. Diagnosis of high-grade malignant glioma confirmed by central neuropathological review (last MRI diagnosis not older than 4 weeks) - including glioblastoma multiforme (WHO IV), anaplastic astrocytoma (WHO III), anaplastic oligodendroglioma (WHO III), anaplastic oligoastrocytoma (WHO III), anaplastic pilocytic astrocytoma (WHO III), anaplastic ganglioglioma (WHO III), anaplastic pleomorphic xanthoastrocytoma (analogous to WHO III), giant cell glioblastoma (WHO IV), and gliosarcoma (WHO IV) - or diagnosis of diffuse intrinsic pontine glioma confirmed by central neuroradiological review - refractory to standard treatment, or relapsed or progressive after first-line therapy. 2. Patient aged 3 years and older but under 18 years at time of relapse diagnosis 3. Written informed consent of the patient (mandatory from 16 years of age) or the parents (mandatory till 18 years of age). Ausschlusskriterien 1. Known hypersensitivity or contraindication to any study drugs 2. Other (simultaneous) malignancies 3. Pregnancy and / or lactation 4. Patients who are sexually active refusing to use effective contraception (oral contraception, intrauterine devices, barrier method of contraception in conjunction with spermicidal jelly or surgical sterile) 5. Current or recent (within 30 days prior to start of trial treatment) treatment with another investigational drug or participation in another investigational trial 6. Severe concomitant diseases (e.g. immune deficiency syndrome) or HIV infection 7. Severe psychological disease or neurological damage without possibility to communicate 8. Clinical signs of intracranial pressure 9. Intracerebral hemorrhage or history of intracerebral hemorrhage 10. Blood count: thrombocytes < 50 000/µl (< 50 Gpt/l) 11. Ongoing irradiation or chemotherapy (within the last 4 weeks) 12. Estimated life expectancy of less than 2 months Stratifizierung keine Studienziele Hauptziel(e) • Gesamtüberlebensrate • 6 month overall survival (OS) after diagnosis Nebenziel(e) • Nebenwirkungen • Ansprechrate • Zeit bis zur Progression / Rezidiv • Krankheitsfreie Überlebensrate • Safety and toxicity of the study treatment by common toxicity criteria (CTC; version 3.0) The response rates at 6 months (continuous complete response = CCR, complete response = CR, partial response = PR, stable disease = SD, progressive disease = PD) and progressionfree survival (PFS) at 6 months, and response rates, OS, and PFS at 12 months after relapse diagnosis or diagnosis of tumor progression. Die Studie wird in folgenden Ländern durchgeführt Bundesland Land • Baden-Württemberg • Bayern • Berlin • Brandenburg • Bremen • Hamburg • Hessen • MecklenburgVorpommern • Niedersachsen • Nordrhein-Westfalen • Rheinland-Pfalz • Saarland • Sachsen • Sachsen-Anhalt • Thüringen • Deutschland Publikationen -keine Angabe- • Schleswig-Holstein Kontaktadressen Studienleiter Herr Prof. Dr. Christof Kramm Universitätsklinik und Poliklinik für Kinder- und Jugendmedizin Universitätsklinikum Halle Ernst-Grube-Str. 44 06120 Halle, Deutschland Telefon 0345-557-2503 0345-557-2503 Fax 0345-557-2389 Email [email protected] Stand: 21.03.2012, 14:00 Uhr Nutzungsbedingungen Die über die Website abrufbaren Inhalte und Dokumente dürfen gespeichert, weitergegeben und vervielfältigt werden. Sie dürfen jedoch nicht verändert, verfälscht oder aus dem Zusammenhang herausgenommen dargestellt werden. Die Weitergabe oder Vervielfältigung ist nur unter deutlicher Angabe der Quelle zulässig. Haftungsbeschränkung Die Studiendaten dieser Website werden mit größtmöglicher Sorgfalt zusammengestellt, die Deutsche Krebsgesellschaft e.V. ist bemüht, die bereitgestellten Informationen stetig zu erweitern und zu aktualisieren. Hinsichtlich Aktualität, Vollständigkeit und Richtigkeit der abrufbaren Inhalte und Dokumente wird jedoch keine Gewähr übernommen. Haftungsansprüche gegen die Deutsche Krebsgesellschaft e.V., deren Mitarbeiter bzw. den Verantwortlichen dieser Website für Schäden materieller oder immaterieller Art, die direkt oder indirekt durch die Nutzung dieser Website entstehen, sind ausgeschlossen, soweit diese nicht auf Vorsatz oder grober Fahrlässigkeit beruhen. Die Haftung der Deutsche Krebsgesellschaft e.V. für Schäden aus der Verletzung des Lebens, des Körpers oder der Gesundheit, die auf einer fahrlässigen Pflichtverletzung der Deutsche Krebsgesellschaft e.V. oder einer vorsätzlichen oder fahrlässigen Pflichtverletzung deren Mitarbeitern bzw. den Verantwortlichen dieser Website beruhen, bleiben hiervon unberührt.