Chemie6_Synthese_Adipinsäure_Nylon
Werbung

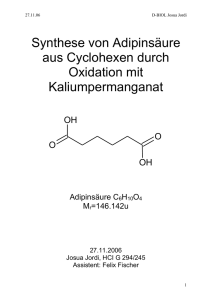
Praktikumsbericht Versuch 6 Synthese von Adipinsäure durch Oxidation von Cyclohexan mit Wasserstoffperoxyd und Nylonsynthese mit dem „nylon rope trick“ Assistent: Sandro Versuchsteilnehmer: Ruedi Stahel Patricia Doll E-Mail: [email protected] [email protected] Datum: 10/13.04.07 Versuch 6 Ruedi Stahel, Patricia Doll 1 Abstract Die Synthese der Adipinsäure konnte erfolgreich durchgeführt werden, die Ausbeute betrug 56.9%. Die Adipinsäure konnte ebenfalls im IR-Spektrum nachgewiesen werden, obwohl noch viele andere Peaks, welche nicht der Adipinsäure zugeordnet werden können, vorhanden waren. Die gemessene Schmelztemperatur betrug 149.6 etwa 3°C unter dem theoretischen Wert von 152.5 [2]. Die Synthese von Nylon6,10 gelang ebenfalls, wobei jedoch kein schöner Faden herausgezogen werden konnte. Um ein besseres Ergebnis zu bekommen müsste man ein anderes Verfahren anwenden. 2 Versuch 6 Ruedi Stahel, Patricia Doll 2 Einführung a. Synthese von Adipinsäure durch Oxidation von Cyclohexen mit Wasserstoffperoxid Bei der Synthese von Adipinsäure läuft ein Autooxidationsprozess ab. Dabei findet ein selektiver Transfer von Sauerstoffatomen statt, wobei diese nicht aus der Luft der Umgebung sondern von einem speziellen Oxidations-Reagenz genommen werden. In diesem Versuch stellt Wasserstoffperoxid dieses Oxidations-Reagenz. Der Sauerstofftransfer findet somit vom Wasserstoffperoxid zum Cyclohexan statt. Dabei wird das Cyclohexan zu Adipinsäure oxidiert (s. Abb. 1). COOH + 4 H202 + 4 H2O COOH Abbildung 1. Oxidation von Cyclohexan zu Adipinsäure mit Wasserstoffperoxid. OH H2O2 H2O O H 2O 2 O OH OH H2O2 O COOH H2O O H 2O 2 O COOH O O OH Abbildung 2. Die Oxidation von Cyclohexan zu Adipinsäure in einzelnen Schritten Die ebenfalls beigegebenen Chemikalien Natriumwolframat Dihydrat und Methyltrioctylammonium fungieren als Katalysator und Phasentransferkatalysator. Im Allgemeinen werden diese eingesetzt, wenn zwei Phasen nicht mischbar sind. Sie bewirken, dass die zu reagierenden Stoffe, in diesem Fall Cyclohexan und Wasserstoffperoxid, sich an der Phasengrenze konzentrieren. Dies um die Reaktion dieser beiden Stoffe hervorzurufen. Cyclohexan ist eine organische Phase und Wasserstoffperoxid eine nucleophile Phase. Nucleophile Phasen (Wasserlösliche Phase) und organische Phasen stossen sich gegenseitig ab. Die positiv geladenen Ammoniumionen des Methyltrioctylammonium bilden die Phasengrenze zur wässrigen (nucleophilen) 3 Versuch 6 Ruedi Stahel, Patricia Doll Phase und die Octylketten bilden die Grenze zur organischen Phase. So wird das Nucleophile Wasserstoffperoxid in die organische Phase transportiert. Die Reaktion kann stattfinden. Abbildung 3. Lewis-Formel von Methyltrioctylammonium [1] b. Synthese von Nylon 6,10 Nylon gehört zur Familie der Polyamide. In Abbildung 3 ist die Funktionelle Gruppe der Amide abgebildet. Bei Nylon ist der dritte Rest ein Wasserstoffatom. An den Rest 1,2 folgen die Kohlenstoffketten. O C R2 R1 N R3 Abbildung 3. Amid Gruppe oder auch Carbonsäureamide. Nylon bildet stabile Fasern, welche durch Wasserstoffbrücken, die zwischen den Wasserstoff und Stickstoffatomen ausgebildet werden, zusammengehalten werden. Die Amidbindung ist nicht nur für die Wasserstoffbrücken verantwortlich, sondern sie ermöglicht auch die Wassereinlagerung zwischen den einzelnen Polyamidsträngen. Diese Einlagerungen stört die Ausbildung eines kompakten Wasserstoffbrücken-Netz beim Nylon 6,6 (s.Abb.4) welches viele Amidbindungen hat, weshalb Nylon 6,10 (s.Abb.5) mit weniger Amidbndungen hergestellt wird. O H N * N H * n O Abbildung 4. Struktur von Nylon 6,6. Zwischen den Stickstoffatomen sind in der Kette jeweils sechs Kohlenstoffatome. 4 Versuch 6 Ruedi Stahel, Patricia Doll O H N * N H * n O Abbildung 5. Struktur von Nylon 6,10. Zwischen den Stickstoffatomen sind in der Kette jeweils sechs und zehn Kohlenstoffatome. Zur Herstellung von Nylon 6,10 wird eine Grenzflächensynthese durchgeführt. Dafür wird ein Diamin in Wasser und eine aktivierte Form einer Disäure (Disäurechlorid) in einem organischen Lösungsmittel gelöst. Wenn die beiden zusammen gegeben werden erfolgt die Polykondensation an der Phasengrenze zwischen Wasser und organischem Lösungsmittel (s.Abb.6). O NH2 N 2H Cl + Cl Sebacylsäuredichlorid Hexamethylendiamin O O H N * N H n* O Nylon 6,6 Abbildung 6. Darstellung der Nylonsynthese mit Strukturformeln. Die Ausgangstoffe sind Hexamethylendiamin und Sebacylsäuredichlorid. 5 Versuch 6 Ruedi Stahel, Patricia Doll 3 Material und Methode a. Synthese von Adipinsäure durch Oxidation von Cyclohexen mit Wasserstoffperoxid 3.1 Materialien 3.1.1 Geräte Um das Gemisch zu erwärmen wurde ein Magnetrührer mit Oelbad benutzt. Ebenfalls wurde eine Apparatur mit Kühlsystem benutzt. 3.1.2 Chemikalien Für den Versuch wurde Calciumchlorid und Watte benutzt. Von Fluka wurde Natriumwolframat Dihydrat ultra, Methyltrictylammonium Purum, Cyclohexan puriss p.a. und Kalumhydrogensulfat Ultra verwendet. Wasserstoffperoxid von Merck, puriss wurde auch verwendet. 3.2 Methode 3.2.1 Sicherheitsvorkehrungen Der ganze Versuch sollte im Abzug durchgeführt werden. Das abwägen von Cyclohexan sollte auch im Abzug geschehen, was jedoch versäumt wurde. 3.2.2 Aufbau der Apparatur Ein Magnetrührer mit Silicaoel und Kontaktthermometer wurde bereitgestellt. An einem Stativ wurde ein Dimmrotkühler mit einem Chlorcalciumrohr und einem Rundkolben befestigt. Der Dimmrothkühler wurde ans Wasser angeschlossen. 3.2.3 Ablauf des Versuches In das Chlorcalciumrohr wurde etwas Calciumchlorid und Watte getan. In den 50ml Rundklben wurden die folgenden Chemikalien wie folgt eingewogen: Natriumwalframat Dihydrat 0.50g, Methyltrioctylammonium 0.50 g, Wassersotffperoxid 12.00g und Kaliumhydrogensulfat 0.37g. Dabei wurde beachtet, dass das Methyltriactylammonium sofort in den Rundkolben gegeben wird. Das ganze wurde gerührt, bis es vollständig gelöst war. Danach wurde 2.0g Cyclohexan beigegeben wobei sich zwei Phasen bilden. Das Kühlwasser wurde nun eingestellt und das Gemisch während 1.5 Stunden bei 80°C erhitzt. Die warme Lösung wurde anschliessend in ein 25ml Becherglas gegeben und im Eisbad gekühlt. Nach 15-20min wurde die gefestigte Lösung durch eine Porzellannutsche mit Filterpapier gefiltert. Es wurde anschliessend noch mit gekühltem Wasser nachgewaschen. Die Kristalle auf dem Filterpapier werden in ein vorher gewogenes Pillenglas gegeben und in den Trockenschrank gestellt. 6 Versuch 6 Ruedi Stahel, Patricia Doll 3.2.4 Entsorgung Es gibt keine Abfälle welche besonders entsorgt werden müssen. Das Silicaoel kann wiederverwertet werden. 3.2.5 Berechnungen 3.2.5.1 Reaktionsausbeute der Adipinsäure Mol Cyclohexan/Adipinsäure: n m M Cyclohexan M=82.125g/mol, m=2.0g 2.0 n 0.024347mol 82.145 Adipinsäure M=146.143g/mol, m=2.0255g 2.0255 n 0.01386mol 146.143 Ausbeute: 0.01386 0.569 0.02435 56.9% Fehlerrechnung: m n M f m m ' 2 2 2.0 0.001 5.9 10 10 82.145 7 Versuch 6 Ruedi Stahel, Patricia Doll b. Synthese von Nylon 6,10 3.3 Materialien 3.3.1 Geräte Es werden keine speziellen Geräte benötigt 3.3.2 Chemikalien Es wurde Hexamethyldiamin von Fluka, puriss, Natrumcarbonat von Merck, pro analysi, Methylenchlorid von Baker, analyzed und Sebacylsäuredichlorid von Fluka, Purum verwendet. 3.4 Methode 3.4.1 Sicherheitsvorkehrungen Es wurden keine speziellen Sicherheitsvorkehrungen getroffen. 3.4.2 Ablauf des Versuches Bereits vorbereitet waren die Lösungen. Eine Lösung mit 0.1g Hexamethylendiamin und 0.2g Natriumcarbonat in 2 ml Wasser. Die andere Lösung mit 0.1ml Sebcylsäuredichlorid in 2ml Methylenchlorid. Dann wurde die erste Lösung sorgfältig zur zweiten gelehrt wobei mit einer Pinzette das gebildete Polymer um einen Glasstab gewickelt wurde. Die Bildung beginnt sehr schnell an der Grenzfläche der beiden Lösungen. 3.4.3 Entsorgung Die Lösung wurde in die Chlorierten Abfälle gegeben, da die Ausgangstoffe Chlor enthielten. 8 Versuch 6 Ruedi Stahel, Patricia Doll 4 Resultate a. Synthese von Adipinsäure durch Oxidation von Cyclohexen mit Wasserstoffperoxid Schmelztemperatur: Gemessener Wert: 149.6°C Ausbeute: Die Ausbeute betrug 56.9%. IR-Spektrum: Abbildung 7. IR-Spektrum der selbst hergestellten Adipinsäure. b. Synthese von Nylon6,10 Die Synthese von Nylon ergab ein Polymer das teilweise etwas klumpig und teilweise fadenförmig war. Das Polymer entwickelte sich sofort nach dem zusammengiessen der beiden Flüssigkeiten. Auch beim schnellen herausziehen wurde es sofort nachgebildet. 9 Versuch 6 Ruedi Stahel, Patricia Doll 5 Diskussion a. Synthese von Adipinsäure durch Oxidation von Cyclohexen mit Wasserstoffperoxid 5.1 Schmelztemperatur der Adipinsäure Tabelle 1. Gemessener Wert des Schmelzpunktes von der Adipinsäure verglichen mit dem Literaturwert Gemessener Wert Literaturwert 149.6°C 152.5°C [2] Der gemessene Wert liegt etwa 3°C unter dem Literaturwert. Eines Abweichung kann durch die Messmethode erklärt werden. Das Messen erfolgt mit dem Auge welches nicht eine genaue Art des Messens ist. Der Moment, in dem die Adipinsäure schmilzt kann teilweise nicht gut getroffen werden, da es schnell geht oder nichth gut erkennbar ist. Die etwas zu tiefe Schmelztemperatur kann allerdings auch mit Verunreinigungen zu tun haben. Cyclohexan hat eine Schmelztemperatur von 6,6°C [3]. Cyclohexan und andere Verunreinigungen können die Schmelztemperatur etwas senken, da sie die Ausbildung der starken Zwischenmolekularen Kräfte, den Wasserstoffbrücken beeinflussen könnten. 5.2 Ausbeute der Adipinsäure Die Ausbeute betrug 56.9%. Das ist ein guter Wert, fast üer die Hälfte von Cyclohexan konnte in Adipinsäure umgesetzt werden. Es ist auch ein guter Wert, da die Reaktion ziemlich schwierig abläuft. Bei einigen aus der Gruppe hat es nicht geklappt, das heisst es wurde kaum Adipinsäure gebildet. Dies könnte am Phasentransferkatalysator, Methyltrioctylammonium gelegen haben. Wenn dieses beim wägen nicht direkt beigegeben wurde, begann der Stoff zu schmelzen. Dies könnte seine Wirkung beeinflusst haben. Ebenfalls könnte es am Katalysator gelegen haben dem Natriumwolframat Dihydrat. Wobei hier keine Grnde gefunden werden können, warum dieser nicht vollständig wirken konnte. Ein anderes Problem könnte die Temperatur des Oelbades sein. Mit dem Kontaktthermometer konnte die Badtemperatur nicht genau auf 80°C gehalten werden. Das Oelbad nahm teilweise eine Temperatur von 100°C und mehr an, ebenfalls lag diese teilweise unter 80°C. Wenn die Temperatur zu tief was, könnte es sein, dass die Reaktion nicht ablaufen konnte. 10 Versuch 6 Ruedi Stahel, Patricia Doll 5.3 IR-Spektrum Die Adipinsäure besteht aus einer Kohlenstoffatomkette von sechs Atomen. Zwei davon gehören zu einer Carbonsäure, die anderen haben einfach je zwie Wasserstoffatome gebunden. Somit gehört die Adipinsäure zu den gesättigten Carbonsäuren. Gesättigt ist sie daher, da sie keine Dppelbindungen enthält. Diese zeigen im IR-Spektrum eine Wellenzahl von 1760-1700cm-1. Unser erhaltenes IRSpektrum zeigt in diesem Bereich einen Ausschlag bei 1718.2cm-1(s.Abb.7). Dieser Peak, könnte also den ungesättigten Carbonsäuren zugeordnet werden. Er könnte aber auch den Aldehyden, Ketonen und Carbonsäureestern zugeordnet werden, welche eine Wellenzahl von 1730-1710cm-1 aufweisen. Da aber Adipinsäure eine Carbonsäure ist, wird dieser Peak dieser Gruppe zugeordnet. Der Ausschlag ist in diesem Wellenbereich ist sehr klein, verglichen mit dem Auschlag auf dem theoretischen IR-Spektrum(s.Abb.8), wo dies der markanteste Peak ist. Die Peaks bei 2928.0 und 2857.9 können Alkanen Verbindungen zugewiesen wersen, welche bei 2926 und 2853 einen Peak haben. Die Adipinsäure besteht aus einer Kette von Alkanen, denn sie hat keine Doppelbindung. Dieser Peak ist kann also zugewiesen werden und ist auch im theoretischen IR-Spektrum vorhanden. Die anderen Werte im oberen Bereich können dem Lösungsmittel zugeordnet werden. Denn die meisten dieser Peaks werden Gruppen mit Stickstoff zugeordnet, welcher in Adipinsäure nicht vorhanden ist. Auch die Peaks im unteren Bereich welche Gruppen mit Stickstoff zugeordnet werden können nicht von der Adipinsäure sein, sonder müssen vom Lösungsmittel oder verunreinigungen stammen. Die anderen Peaks können entstanden sein, wenn die Synthese nicht sauber abgelaufen ist und Nebenprodukte entstanden sind. Dies können Ester oder auch Kohlenstoff Doppelbindungen haben. Auch wenn das gemessene IR-Spektrum viel mehr Peaks als das Theoretische Spektrum aufweist, kann man sagen, dass die Peaks welche Gruppen der Adipinsäure zugeordnet werden können, vorhanden sind. Abbildung 8. IR-Spektrum von Adipinsäure aus der Literatur. Zum Vergleich mit dem selber gemachten IR-Spektrum [4]. 11 Versuch 6 b. Ruedi Stahel, Patricia Doll Synthese von Nylon6,10 Die Synthese von Nylon wurde erfolgreich durchgeführt. Die Polymerisation begann sofort nach dem zusammengeben. Es konnte kein regelmässiger Faden erzeugt werden, da zum einen das Zusammengiessen sehr schnell gemacht wurde und das entstandene Polymer nicht sofort herausgezogen wurde. Wenn die Hexamethylendiamin-Lösung sehr langsam beigefügt werden würde, liefe die Polymerisation nicht so schnell ab. Somit könnte man eine bessere Fadenbildung erreichen. Ebbenfalls wäre eine automatisierte Vorrichtung zum hinaufziehen des Polymerfadens besser, da dies regelmässiger als von Hand ablaufen würde, auch dies hätte eine bessere Fadenbildung zur Konsequenz. Es gibt demnach noch viele Vorgänge die optimiert werden können. Die Polymerisation war jedoch gut ersichtlich somit ist das Ziel des Versuches erreicht. 12 Versuch 6 Ruedi Stahel, Patricia Doll 6 Referenzen 6.1 Internetverzeichnis 1.http://www.sigmaaldrich.com/catalog/search/ProductDetail?ProdNo=69485&Brand =FLUKA , April 16, 2007 2. http://de.wikipedia.org/wiki/Adipins%C3%A4ure , April 16, 2007 3. http://de.wikipedia.org/wiki/Cyclohexan , April 20, 2007 4.http://www2.unisiegen.de/dept/fb08/abteil/org/org1/Lehre/praeparate/adipinsaeureester.pdf, April 20, 2007 13