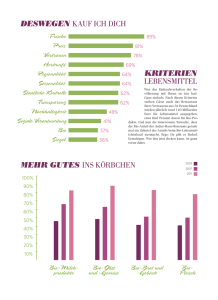
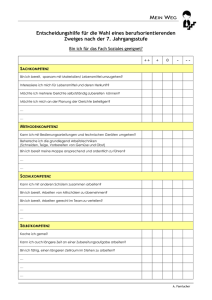
Artikel 1 – Gegenstand und Anwendungsbereich
Werbung

Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 Artikel 1 Gegenstand und Anwendungsbereich* © Behr's Verlag, Hamburg I. Gesetzestext (1) Mit dieser Verordnung werden die Rechts- und Verwaltungsvorschriften der Mitgliedstaaten über nährwert- und gesundheitsbezogene Angaben harmonisiert, um das ordnungsgemäße Funktionieren des Binnenmarktes zu gewährleisten und gleichzeitig ein hohes Verbraucherschutzniveau zu bieten. (2) Diese Verordnung gilt für nährwert- und gesundheitsbezogene Angaben, die in kommerziellen Mitteilungen bei der Kennzeichnung und Aufmachung von oder bei der Werbung für Lebensmittel gemacht werden, die als solche an den Endverbraucher abgegeben werden sollen. Auf nicht vorverpackte Lebensmittel (einschließlich Frischprodukte wie Obst, Gemüse oder Brot), die dem Endverbraucher und Einrichtungen zur Gemeinschaftsverpflegung zum Kauf angeboten werden, und auf Lebensmittel, die entweder an der Verkaufsstelle auf Wunsch des Käufers verpackt oder zum sofortigen Verkauf fertig verpackt werden, finden Artikel 7 und Artikel 10 Absatz 2 Buchstaben a und b keine Anwendung. Einzelstaatliche Bestimmungen können angewandt werden, bis gegebenenfalls Gemeinschaftsmaßnahmen zur Änderung nicht wesentlicher Bestimmungen dieser Verordnung, * Absatz 2 Unterabsatz 2 und Absatz 4 neu gefasst durch die 1. ÄnderungsVO, VO (EG) 107/2008 vom 15.01.2008, ABl. L 39 vom 13.02.2008 Praxiskommentar Health & Nutrition Claims, 4. Akt.-Lfg. 04/08 1 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 auch durch Ergänzung, nach dem in Artikel 25 Absatz 3 genannten Regelungsverfahren mit Kontrolle erlassen werden. (3) Handelsmarken, Markennamen oder Phantasiebezeichnungen, die in der Kennzeichnung, Aufmachung oder Werbung für ein Lebensmittel verwendet werden und als nährwert- oder gesundheitsbezogene Angaben aufgefasst werden können, dürfen ohne die in dieser Verordnung vorgesehenen Genehmigungsverfahren verwendet werden, sofern der betreffenden Kennzeichnung, Aufmachung oder Werbung eine nährwert- oder gesundheitsbezogene Angabe beigefügt ist, die dieser Verordnung entspricht. (4) Im Fall allgemeiner Bezeichnungen, die traditionell zur Angabe einer Eigenschaft einer Kategorie von Lebensmitteln oder Getränken verwendet werden und die auf Auswirkungen auf die menschliche Gesundheit hindeuten könnten, kann auf Antrag der betroffenen Lebensmittelunternehmer eine Ausnahme von Absatz 3, die eine Änderung nicht wesentlicher Bestimmungen dieser Verordnung durch Ergänzung bewirkt, nach dem in Artikel 25 Absatz 3 genannten Regelungsverfahren mit Kontrolle erlassen werden. Der Antrag ist an die zuständige nationale Behörde eines Mitgliedstaats zu richten, die ihn unverzüglich an die Kommission weiterleitet. Die Kommission erlässt und veröffentlicht Regeln, nach denen Lebensmittelunternehmer derartige Anträge stellen können, um sicherzustellen, dass der Antrag in transparenter Weise und innerhalb einer vertretbaren Frist bearbeitet wird. (5) Diese Verordnung gilt unbeschadet der folgenden Bestimmungen des Gemeinschaftsrechts: a) Richtlinie 89/398/EWG und Richtlinien, die über Lebensmittel erlassen werden, die für besondere Ernährungszwecke bestimmte sind; b) Richtlinie 80/777/EWG des Rates vom 15. Juli 1980 zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über 2 Praxiskommentar Health & Nutrition Claims, 4. Akt.-Lfg. 04/08 © Behr's Verlag, Hamburg Diese Verordnung gilt auch für Lebensmittel, die für Restaurants, Krankenhäuser, Schulen, Kantinen und ähnliche Einrichtungen zur Gemeinschaftsverpflegung bestimmt sind. Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 die Gewinnung von und den Handel mit natürlichen Mineralwässern; c) Richtlinie 98/83/EG des Rates vom 3. November 1998 über die Qualität von Wasser für den menschlichen Gebrauch. © Behr's Verlag, Hamburg d) Richtlinie 2002/46/EG. Praxiskommentar Health & Nutrition Claims, 4. Akt.-Lfg. 04/08 3 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 II. Kommentierung Übersicht © Behr's Verlag, Hamburg Rnr 1 Regelungsinhalt ......................................................................... 1 2 Ziele der Verordnung ................................................................ 2 3 Direkter Anwendungsbereich..................................................... 3 3.1 3.2 3.3 Nährwert- und gesundheitsbezogene Angaben ........................................... 4 Kommerzielle Mitteilung ............................................................................ 5-8 Bei der Kennzeichnung und Aufmachung von oder bei der Werbung .................................................................................................. 9-12 Lebensmittel .......................................................................................... 13-14 Futtermittel ................................................................................................. 15 Lebende Tiere ............................................................................................. 16 Pflanzen vor dem Ernten ............................................................................ 17 Arzneimittel im Sinne der RL 65/65/EWG und 92/73/EWG des Rates ........................................................................... 18-19 Kosmetische Mittel ................................................................................ 20-21 Tabak und Tabakerzeugnisse ..................................................................... 22 Betäubungsmittel und psychotrope Stoffe .................................................. 23 Rückstände und Kontaminanten ................................................................ 24 Exkurs: Abgrenzung zwischen Lebensmitteln und Arzneimitteln Definition von Lebensmitteln und Arzneimitteln...................................... 25-28 Die Zweifelsregelung ............................................................................. 29-31 Präsentationsarzneimittel ...................................................................... 32-38 Funktionsarzneimittel ............................................................................. 39-49 Zusammengefasst: Einzelfallbeurteilung maßgeblich ........................... 50-51 Dosierung entscheidend ........................................................................ 52-55 Auswirkungen von Zulassungen gemäß VO ......................................... 56-63 Übersicht Abgrenzung Lebensmittel – Arzneimittel Abgabe an den Endverbraucher .......................................................... 64-70d Unverpackte Lebensmittel ..................................................................... 71-73 3.4 3.4.1 3.4.2 3.4.3 3.4.4 3.4.5 3.4.6 3.4.7 3.4.8 3.5 3.5.1 3.5.2 3.5.3 3.5.4 3.5.5 3.5.6 3.5.7 3.5.8 3.6 3.7 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 1 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen 4 Anwendung auf Marken ................................................... 74-79a 4.1 Privilegien für Marken........................................................................... 74-74a 4.2 Verschiedene Kategorien von Marken ................................................. 74b-77 4.3 Strengeres Verbraucherleitbild als bei Art. 10 Abs. 3 VO ............................ 78 4.4 Beifügen ............................................................................................... 79-79a 5 Ausnahme für allgemeine Bezeichnungen ........................ 80-81 6 Verhältnis zu weiteren Bestimmungen des Gemeinschaftsrechts ......................................................... 82-83 6.1 RL 89/398/EWG und Richtlinien, die über Lebensmittel erlassen werden, die für besondere Ernährungszwecke bestimmt sind ......................................................................................... 84-91 RL 89/777/EWG ......................................................................................... 92 RL 98/83/EG ............................................................................................... 93 RL 2002/46/EG ........................................................................................... 94 Weitere Bestimmungen ......................................................................... 95-98 6.2 6.3 6.4 6.5 2 Praxiskommentar Health & Nutrition Claims, Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg Artikel 1 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 © Behr's Verlag, Hamburg II.1 Regelungsinhalt Art. 1 Absatz 1 VO legt die Ziele der Verordnung dar. Der Absatz 2 regelt den Anwendungsbereich, die Absätze 3 und 4 Ausnahmen von der generellen Anwendung der Verordnung für Handelsmarken, Markennamen oder Phantasiebezeichnungen unter bestimmten weiteren Voraussetzungen sowie für allgemeine Bezeichnungen, die herkömmlicherweise zur Angabe einer Eigenschaft einer Kategorie von Lebensmitteln oder Getränken verwendet werden. Weiterhin wird in Art. 1 Abs. 5 VO das Verhältnis der Vorschriften der Verordnung zu einigen anderen Bestimmungen des Gemeinschaftsrechts geregelt, insbesondere zu diätetischen Lebensmitteln, Mineral- und Trinkwasser sowie Nahrungsergänzungsmitteln. Praxiskommentar Health & Nutrition Claims, 5. Akt-Lfg. 08/08 1 Anwendungsbereich 1 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 © Behr's Verlag, Hamburg II.2 Ziele der Verordnung Die in Art. 1 Abs. 1 VO genannten Ziele werden in den Erwägungsgründen 1 und 2 näher erläutert. Die dortige Beobachtung, dass Lebensmittel in der Gemeinschaft zunehmend mit nährwertund gesundheitsbezogenen Angaben gekennzeichnet und beworben werden, entspricht dem Trend zu Wellness-Produkten und Functional Food.1 Die Beliebtheit dieser rechtlich nicht definierten Lebensmittel mit einem gesundheitlichen Zusatznutzen stehen im Zusammenhang mit zunehmenden Erkenntnissen der Ernährungswissenschaft und Medizin bezüglich des Einflusses der Ernährung auf Erkrankungen und Risikofaktoren für Erkrankungen. Gleichzeitig steigt das Bewusstsein für eine gesunde Ernährung in weiten Teilen der Bevölkerung. Nachdem die mit gesundheitlichem oder nährwertbezogenem Zusatznutzen beworbenen Produkte bei der Vermarktung von Lebensmitteln immer wichtiger werden, lag es für den europäischen Gesetzgeber nahe, die Handelshemmnisse2 in diesem Bereich aufgrund unterschiedlicher nationaler Werbevorschriften zu beseitigen. Zugleich sollte die Wahlfreiheit des Verbrauchers im Hinblick auf die Kennzeichnung und Bewerbung sowie die Sicherheit der Produkte gewährleistet werden. 2 Ziele Das genannte Ziel der Harmonisierung der Rechts- und Verwaltungsvorschriften der Mitgliedstaaten wird nicht mit der Vorschrift des Art. 1 Abs. 1 VO verwirklicht, sondern mit der Regelung des Art. 22 (siehe die dortige Kommentierung). 1 siehe zu diesem Begriff Erbersdobler/Meyer, Functional Food, Band 2, 1. Einleitung 2 siehe hierzu Hill/Knowlton, Study on nutritional, health and ethical claims in the European Union for the European Directorate General for Health and Consumer protection, April 2000 Praxiskommentar Health & Nutrition Claims, 5. Akt-Lfg. 05/08 1 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 II.3 Direkter Anwendungsbereich Art. 1 Ziff. 2 regelt den Anwendungsbereich der Verordnung dahingehend, dass diese für nährwert- und gesundheitsbezogene Angaben (3.1) in kommerziellen Mitteilungen (3.2) bei der Kennzeichnung, Aufmachung von oder bei der Werbung (3.3) für Lebensmittel (3.4, 3.5), die an den Endverbraucher abgegeben werden sollen sowie gleichgestellte Abnehmer (3.6) gilt. Für unverpackte Lebensmittel bestehen besondere Regelungen (3.7). 3 Übersicht © Behr's Verlag, Hamburg Die Voraussetzungen müssen kumulativ vorliegen, um den Anwendungsbereich der Verordnung zu eröffnen. II.3.1 Nährwert- und gesundheitsbezogene Angaben Die hier bereits verwendeten Begriffe der nährwert- und gesundheitsbezogenen Angaben werden in Art. 2 Abs. 2 Ziff. 4 VO sowie 2 Abs. 2 Ziff. 5 VO definiert. Auf die dortigen Erläuterungen wird verwiesen. II.3.2 4 Art. 2 Abs. 2 Ziff. 4 und 5 Kommerzielle Mitteilung Der Begriff der kommerziellen Mitteilung ist bislang weder normativ noch in der Rechtsprechung näher erläutert, findet sich aber auch in Art. 2 Buchst. d der RL 2005/29/EG über unlautere Geschäftspraktiken (siehe hierzu die Kommentierung bei Art. 3, Rnr. 8). Dort dient er als Oberbegriff für Werbung und Marketing. Erwägungsgrund 4 nennt als Beispiel kommerzieller Mitteilungen auch allgemeine Werbeaussagen für Lebensmittel und in Werbekampagnen „wie solchen, die ganz oder teilweise von Behörden gefördert werden“. Empfehlungen staatlicher Gesundheitsbehörden sollen aber nicht darunter fallen. Es kommt demnach auf den Urheber der Mitteilung an. Von dessen Person und seiner Stellung Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 5 Urheber 1 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 6 positive Abgrenzung Positiv kann eine kommerzielle Mitteilung angenommen werden, wenn der Urheber der betreffenden Mitteilung in der Kennzeichnung, Aufmachung oder Bewerbung von Lebensmitteln ein Lebensmittelunternehmen im Sinne des Art. 3 Ziff. 2 VO (EG) 178/2002 ist. Die dortige Definition umfasst „alle Unternehmen, gleichgültig, ob sie auf Gewinnerzielung ausgerichtet sind oder nicht und ob sie öffentlich oder privat sind, die eine mit der Produktion, der Verarbeitung und dem Vertrieb von Lebensmitteln zusammenhängende Tätigkeit ausführen“. Dieser Begriff kann hier mit der Ergänzung, dass der Katalog der Tätigkeiten um die Begriffe „Kennzeichnung, Aufmachung und Werbung“ zu ergänzen ist, zur Bestimmung des Urhebers der Mitteilung nutzbar gemacht werden. 7 negative Abgrenzung Negativ grenzt Erwägungsgrund 4 den Begriff der kommerziellen Mitteilung durch die Nennung von Beispielen für nichtkommerzielle Mitteilungen ab. Beispielhaft werden hier Ernährungsrichtlinien oder -empfehlungen von staatlichen Gesundheitsbehörden und -stellen oder nichtkommerzielle Mitteilungen und Informationen in der Presse und in wissenschaftlichen Veröffentlichungen genannt. Hierunter fallen z. B. Ernährungsempfehlungen der Deutschen Gesellschaft für Ernährung (DGE). 8 „unabhängige“ Dritte Auch Äußerungen unabhängiger Dritter wie Stiftungen oder redaktionelle Beiträge in Publikationen können Werbemaßnahmen und damit kommerzielle Mitteilungen darstellen 2 . So hatte der 1 so auch Rathke, in: Zipfel/Rathke, Lebensmittelrecht, C 111, Art. 1 Rnr. 11 2 vergleichbar bei Arzneimittelwerbung EuGH, Entscheidung vom 02.04.2009, Rs. C421/07 „Damgaard“ 2 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg im Wirtschaftskreislauf kann auf die kommerzielle oder nichtkommerzielle Zielrichtung der Mitteilung geschlossen werden. Auch Verlautbarungen von Vereinen, Erzeugergemeinschaften und Verbänden im Wege der Gemeinschaftswerbung können demnach eine kommerzielle Mitteilung darstellen.1 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 © Behr's Verlag, Hamburg EuGH bereits in dem Verfahren „Ter Voort“3 die Konstellation zu beurteilen, dass auf einer Verpackung eine unabhängige Stiftung angegeben war, die weiterführende Informationen für das betreffende Produkt auf Anfrage mitteilte. Die Äußerungen dieser unabhängigen Stiftung wurden zur Beurteilung des Produktcharakters herangezogen. Auch vermeintlich nichtkommerzielle Mitteilungen können sich daher als kommerzielle Mitteilungen darstellen, wenn die Äußerungen letztendlich von einem Unternehmen oder einer Person oder Vereinigung beeinflusst sind, bei denen sich die identische Äußerung als kommerzielle Mitteilung darstellen würde. Mit Empfehlungen durch Vereinigungen von Fachleuten der Bereiche Medizin, Ernährung oder Diätetik, karitativen gesundheitsbezogenen Einrichtungen sowie einzelnen Ärzten oder Vertretern medizinischer Berufe befassen sich eigens die Vorschriften der Art. 11, 12 c VO (siehe die dortige Kommentierung). II.3.3 8a Art. 11, 12c VO Bei der Kennzeichnung und Aufmachung von oder bei der Werbung Hinsichtlich des Begriffs Kennzeichnung kann Art. 1 Abs. 3 der RL 2000/13/EG herangezogen werden. Danach bedeutet der synonyme Begriff der Etikettierung4 „alle Angaben, Kennzeichnungen, Hersteller oder Handelsmarken, Abbildungen oder Bezeichnungen, die sich auf ein Lebensmittel beziehen und auf jegliche Art von Verpackung, Schriftstück, Tafel, Etikett, Ring oder Verschluss angebracht sind und dieses Lebensmittel begleiten oder sich auf dieses Lebensmittel beziehen“. 9 Etikettierung Der Begriff der Aufmachung von Lebensmitteln ist in Art. 2 Abs. 3 Buchst. a RL 2000/13/EG beispielhaft erläutert. Genannt werden hier „die Form oder das Aussehen dieser Lebensmittel oder ihrer Verpackung, das verwendete Verpackungsmaterial, die Art und 10 Aufmachung 3 EuGH, E. v. 28.10.1992, EuZW 1993, 776 4 so auch Rathke, in: Zipfel/Rathke, Lebensmittelrecht, C 111, Art. 1 Rnr. 7 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 3 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 11 Werbung Der in Art. 2 Abs. 3 Buchst. b RL 2000/13/EG verwendete Begriff der Werbung wird dort nicht weiter erläutert. Eine europarechtliche Definition für Werbung fand sich bereits in Art. 2 Ziff. 1 RL 84/450/EWG über irreführende Werbung. Dort wurde der Begriff – insoweit unverändert nunmehr übernommen in die Regelung des Art. 2 Buchst. a der RL 2006/114 – als „jede Äußerung bei der Ausübung eines Handels, Gewerbes, Handwerks oder freien Berufs mit dem Ziel, den Absatz von Waren oder die Erbringung von Dienstleistungen, einschließlich unbeweglicher Sachen, Rechte und Verpflichtungen zu fördern“, definiert. Die Werbung ist ein Unterfall der kommerziellen Mitteilung, wobei die genaue Trennlinie unklar ist. Mögliche Abgrenzungsprobleme ergeben sich in erster Linie im Hinblick auf nichtkommerzielle Mitteilungen, also Äußerungen, die nicht den Absatz von Waren fördern sollen. Nachdem der Begriff der kommerziellen und nicht kommerziellen Mitteilung in Erwägungsgrund 4 näher dargelegt ist, sind die dortigen Ausführungen auch bei der Abgrenzung von Werbung zu nicht kommerziellen Äußerungen heranzuziehen. 12 Etikettierung ≠ Werbung Nach der Rechtsprechung des Europäischen Gerichtshofs 5 ist noch6 zwischen den Begriffen der Etikettierung und der Werbung im Bereich der RL 2000/13/EG streng zu unterscheiden, da gemäß Art. 18 der RL 2000/13/EG für den Bereich der Etikettierung eine vollständige Harmonisierung erfolgt ist, für den Bereich der Werbung hingegen nicht. Der hierzu von Rathke7 geäußerten Auffassung, dass auch die produktbezogene Bewerbung Etikettierung im Sinne des Art. 1 Abs. 3 a RL 2000/13/EG darstelle, kann nicht gefolgt werden. Zwar ist die Definition der Etikettierung denkbar weit, indem „diese auch Angaben umfasst, die sich auf Lebensmittel“ beziehen. Gemeint sind hier aber nur, wie sich auch aus der 5 EuGH vom 15.07.2004, Rs. C-239/02 „Douwe Egberts N.V.“, ZLR 2004, 600, sowie Urteil vom 12.12.1990, Rs. C-141/89 „SARPP“ 4 6 ab dem 13.12.2014 ist gemäß LMIV von einer Vollharmonisierung auszugehen 7 in Zipfel/Rathke, Lebensmittelrecht, C 102, § 12 LFGB, Rnr. 35 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg Weise ihrer Anordnung sowie die Umgebung, in der sie feilgehalten werden.“ Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 vorstehend genannten Rechtsprechung des Europäischen Gerichtshofs ergibt, die Angaben in unmittelbarer räumlicher Nähe zu dem jeweiligen Produkt. Anderenfalls müssten in der produktbezogenen Werbung stets auch die Pflichtangaben gemäß Art. 3 RL 2000/13/EG wie Zutatenverzeichnis, Mindesthaltbarkeit etc. erfolgen. Dies ist erkennbar nicht gewollt. II.3.4 Lebensmittel © Behr's Verlag, Hamburg Der Begriff des Lebensmittels ist in Art. 2 VO (EG) 178/2002 definiert. Die Vorschrift des § 2 Abs. 2 LFGB verweist auf diese Definition, die wie folgt lautet: 13 Definition „Im Sinne dieser Verordnung sind ‚Lebensmittel' alle Stoffe oder Erzeugnisse, die dazu bestimmt sind oder von denen nach vernünftigem Ermessen erwartet werden kann, dass sie in verarbeitetem, teilweise verarbeitetem oder unverarbeitetem Zustand von Menschen aufgenommen werden. Zu ‚Lebensmitteln' zählen auch Getränke, Kaugummi sowie alle Stoffe, – einschließlich Wasser –, die dem Lebensmittel bei seiner Herstellung oder Ver- oder Bearbeitung absichtlich zugesetzt werden. Wasser zählt hierzu unbeschadet der Anforderungen der Richtlinie 80/778/EWG und 98/83/EG ab der Stelle der Einhaltung im Sinne des Artikels 6 der Richtlinie 98/83/EG. Nicht zu ‚Lebensmitteln' gehören: a) Futtermittel b) lebende Tiere, soweit sie nicht für das Inverkehrbringen zum menschlichen Verzehr hergerichtet worden sind, c) Pflanzen vor dem Ernten, d) Arzneimittel im Sinne der Richtlinie 65/65/EWG und 92/73/EWG des Rates, e) kosmetische Mittel im Sinne der Richtlinie 76/768/EWG des Rates, Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 5 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 f) Tabak und Tabakerzeugnisse im Sinne der Richtlinie 89/622/EWG des Rates, g) Betäubungsmittel und psychotrope Stoffe im Sinne des Einheitsübereinkommens der Vereinten Nationen über Suchtstoffe, 1961, und des Übereinkommens der Vereinten Nationen über psychotrope Stoffe, 1971, h) Rückstände und Kontaminanten.“ 14 ausgenommene Produktgruppen Die vorstehende Definition des Lebensmittels ist denkbar weit und führt letztendlich dazu, dass alle Erzeugnisse, die von Menschen aufgenommen werden, zunächst unter diese Begriffsbestimmung fallen. Zutreffend weist der EuGH 8 darauf hin, dass diese weite Begriffsbestimmung der Lebensmittel a priori eine Vielzahl von Produkten, einschließlich Arzneimittel, abdecken würden. Eine Eingrenzung des weiten Begriffs durch den nachfolgenden Katalog der vom Lebensmittelbegriff ausgeschlossenen Produkte war demnach notwendig. II.3.4.1 15 Futtermittel Futtermittel Gemäß Art. 3 Ziff. 4 der VO (EG) 178/2002 sind Futtermittel „Stoffe oder Erzeugnisse, auch Zusatzstoffe, verarbeitet, teilweise verarbeitet oder unverarbeitet, die zur oralen Tierfütterung bestimmt sind“. Maßgeblich für die Futtermitteleigenschaft ist die konkrete Zweckbestimmung des jeweiligen Erzeugnisses oder Stoffes zur Verfütterung an Tiere. 8 in seiner Entscheidung vom 09.06.2005, Rs. C-211/03, C-299/03 und C-316 bis C318/03 „HLH Warenvertrieb“, ZLR 2005, 435 = WRP 2005, 869 6 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg In der Auflistung der nicht zu den Lebensmitteln gehörenden Erzeugnisse fehlen Medizinprodukte im Sinne des § 3 MPG, die aber gleichfalls nicht zu den Lebensmitteln gehören. Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 II.3.4.2 Lebende Tiere Lebende Tiere gehören grundsätzlich nicht zu den Lebensmitteln, so z. B. auch Nutztiere, die in der Landwirtschaft gehalten werden. Die Ausnahme hiervon, nämlich die lebenden Tiere, die „für das Inverkehrbringen zum menschlichen Verzehr hergerichtet worden sind“ umfasst als einziges bislang diskutiertes Beispiel Austern. © Behr's Verlag, Hamburg II.3.4.3 Pflanzen vor dem Ernten Bei Pflanzen vor dem Ernten steht noch nicht fest, wie sie verwendet werden, z. B. als Lebensmittel, als Futtermittel oder in sonstiger Weise. Sie werden daher der Begriffsbestimmung des Lebensmittels und damit auch der Lebensmittelüberwachung entzogen. II.3.4.4 16 Austern 17 Pflanzen Arzneimittel im Sinne der RL 65/65/EWG und 92/73/EWG des Rates Die genannten Richtlinien waren bereits bei Inkrafttreten der VO (EG) 178/2002 durch den Gemeinschaftscodex für Humanarzneimittel RL 2001/83/EG abgelöst worden. Gemäß Art. 128 Abs. 2 RL 2001/83/EG gelten Bezugnahmen auf die aufgehobenen RL 65/65/EWG und 92/73/EWG als Bezugnahme auf die RL 2001/83/EG. Die dortige Definition des Arzneimittels ist mittlerweile durch die RL 2004/27/EG neu gefasst worden und lautet nunmehr wie folgt: 18 Gemeinschaftscodex Arzneimittel: i) a) Alle Stoffe oder Stoffzusammensetzungen, die als Mittel mit Eigenschaften zur Heilung oder Verhütung menschlicher Krankheiten bestimmt sind, oder j) b) alle Stoffe oder Stoffzusammensetzungen, die im oder am menschlichen Körper verwendet oder einem Menschen verabreicht werden können, um entweder die menschlichen physio- Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 7 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 logischen Funktionen durch eine pharmakologische, immunologische oder metabolische Wirkung wiederherzustellen, zu korrigieren oder zu beeinflussen oder eine medizinische Diagnose zu erstellen. Die Abgrenzung zwischen Lebensmitteln und Arzneimitteln ist schwierig und von hoher praktischer Relevanz. Die Einstufung hat hohe wirtschaftliche Auswirkungen, da Lebensmittel grundsätzlich vor ihrem Inverkehrbringen keiner Genehmigung bedürfen, 11 Arzneimittel in der Regel aber der Zulassung. Bei Einstufung eines Produktes als zulassungspflichtiges Arzneimittel ist das Erzeugnis regelmäßig mangels Zulassung nicht verkehrsfähig. 18a VO (EU) 432/12 Mit VO (EU) 432/12 wurde der erste Teil der Gemeinschaftsliste (siehe hierzu die Kommentierung bei Art. 28, Rrn. 20 c ff.) der sogenannten generischen gesundheitsbezogenen Angaben gemäß Art. 13 Abs. 1 a, 13 Abs. 2 VO verabschiedet. Dort wird in Erwägungsgrund 17 ausdrücklich festgehalten, dass die Zulassung einer gesundheitsbezogenen Angabe für einen bestimmten Stoff die Mitgliedstaaten nicht daran hindert, ein damit hergestelltes Erzeugnis als Arzneimittel einzustufen.12 9 EuGH, E. v. 09.06.2005, Rs. C-211/03, C-299/03 und C-316 bis C-318/03 „HLH Warenvertrieb“, ZLR 2005, 435 10 BGH, ZLR 2006, 411 – „Arzneimittelwerbung im Internet“; GRUR 2006, 513 = ZLR 2006, 411 11 Ausnahmen gelten z.B. für neuartige Lebensmittel und Zusatzstoffe 12 „Für den Zusatz von Stoffen zu Lebensmitteln bzw. ihre Verwendung in Lebensmitteln wie auch für die Einstufung von Produkten als Lebensmittel oder Arzneimittel gelten spezifische EU- und einzelstaatliche Rechtsvorschriften. Eine gemäß der Verordnung 8 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg Mit der Neufassung wurde in Abs. 1 der Begriff „bezeichnet“ (engl. „presented“) durch „bestimmt“ ersetzt, Abs. 2 durch Einfügen der Worte „durch eine pharmakologische, immunologische oder metabolische Wirkung“ ergänzt. Am Sinngehalt der Definition hat sich dadurch nach Auffassung des EuGH nichts geändert.9 Der BGH sieht darin eine stärkere Objektivierung des Arzneimittelbegriffs, d. h. die pharmakologischen Eigenschaften seien stärker zu gewichten.10 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 Nähere Ausführungen zur Abgrenzung von Lebensmitteln von Arzneimitteln finden sich in einem Exkurs unter 3.5. II.3.4.5 Kosmetische Mittel RL 76/768/EWG definiert in Art. 1 kosmetische Mittel wie folgt13: © Behr's Verlag, Hamburg 19 Mehr im Exkurs „Kosmetische Mittel sind Stoffe oder Zubereitungen, die dazu bestimmt sind, äußerlich mit den verschiedenen Teilen des menschlichen Körpers (Haut, Behaarungssystem, Nägel, Lippen und intime Regionen) oder mit den Zähnen und den Schleimhäuten der Mundhöhle in Berührung zukommen, und zwar zu dem ausschließlichen oder überwiegenden Zweck, sie zu reinigen, zu parfümieren, zu schützen, um sie in gutem Zustand zu halten, ihr Aussehen zu verändern oder den Körpergeruch zu beeinflussen“. Wesentliches Kriterium zur Abgrenzung von Lebensmitteln ist bei kosmetischen Mitteln demnach die äußerliche Anwendung. Probleme kann es z. B. bei der Einstufung von Produkten geben, die zumindest gelegentlich aufgenommen werden. Die unbeabsichtigte Aufnahme wird regelmäßig nicht zur Einstufung eines kosmetischen Mittels als Lebensmittel führen, so z. B. das ungewollte bzw. nicht intendierte Verschlucken von Zahnpasta. Zahnpflegeprodukten wie z. B. Zahnpflegekaugummi kann eine kosmetische Zweckbestimmung gegeben werden, wenn überwiegender Zweck der Schutz und die Erhaltung des guten Zustands der Zähne sowie das Verändern des Körpergeruchs ist. 20 Definition 21 äußerliche Anwendung (EG) Nr. 1924/2006 getroffene Entscheidung über eine gesundheitsbezogene Angabe, wie die Aufnahme in die Liste zulässiger Angaben gemäß Artikel 13 Absatz 3 der genannten Verordnung, ist nicht gleichbedeutend mit einer Zulassung für das Inverkehrbringen des Stoffes, auf den sich die Angabe bezieht, einer Entscheidung darüber, ob der Stoff in Lebensmitteln verwendet werden darf, bzw. einer Einstufung eines bestimmten Produkts als Lebensmittel.“ 13 Ab dem 11. Juli 2013 gilt die Definition gem. Art. 2 Abs. 1 lit. a VO (EG) 1223/2009 über kosmetische Mittel Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 9 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 II.3.4.6 22 Definition Tabak und Tabakerzeugnisse Die Begriffe werden in der RL 89/622/EWG wie folgt definiert: „Tabakerzeugnisse: Erzeugnisse, die zum Rauchen, Schnupfen, Lutschen oder Kauen bestimmt sind, sofern sie ganz oder teilweise aus Tabak bestehen“ II.3.4.7 23 Betäubungsmittel Diese Stoffe sind in § 1 Abs. 1 BtMG in Verbindung mit den Anhängen zum BtMG definiert. II.3.4.8 24 Rückstände Rückstände und Kontaminanten Die Aufführung von Rückständen und Kontaminanten erscheint systematisch verfehlt. 14 Rückstände und Kontaminanten von Lebensmitteln teilen das Schicksal des Lebensmittels; allenfalls wird das Lebensmittel aufgrund der Rückstände und Kontaminanten als nicht sicher im Sinne des Art. 14 VO (EG) 178/2002 anzusehen sein und deshalb als nicht verkehrsfähig. Die praktische Bedeutung der Vorschrift ist demnach gering. 14 10 Betäubungsmittel und psychotrope Stoffe so zutreffend Rathke, in: Zipfel/Rathke, Lebensmittelrecht, C-101, Rnr. 123 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg Gerade Tabakerzeugnisse, die zum Kauen bestimmt sind, aber auch solche zum Rauchen, können zumindest teilweise aufgenommen werden und deshalb begrifflich unter die Definition des Absatzes 1 fallen. Maßgebliches Abgrenzungskriterien ist hier die Zusammensetzung der Produkte. Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen © Behr's Verlag, Hamburg Artikel 1 II.3.5 Exkurs: Abgrenzung zwischen Lebensmitteln und Arzneimitteln II.3.5.1 Definition von Lebensmitteln und Arzneimitteln Rechtlicher Ausgangspunkt der Abgrenzung zwischen Lebensmitteln, einschließlich Produkten wie Nahrungsergänzungsmitteln oder diätetischen Lebensmitteln, und Arzneimitteln ist die Vorschrift des Art. 2 BasisVO, 15 die denkbar weit alle Stoffe oder Erzeugnisse als Lebensmittel definiert, die von Menschen aufgenommen werden. Allerdings sind Arzneimittel im Sinne des Gemeinschaftskodex16 gem. Art. 2 Buchst. d BasisVO ausdrücklich vom Lebensmittelbegriff ausgenommen. 25 BasisVO Dabei unterscheidet die Definition des Art. 1 Nr. 2 des Gemeinschaftskodex zwischen sog. Präsentationsarzneimitteln und Funktionsarzneimitteln. 26 Gemeinschaftskodex Der Begriff des Präsentationsarzneimittels erfasst den Normalfall, dass ein Erzeugnis als Arzneimittel in Verkehr gebracht wird und auch gemäß der subjektiven Zweckbestimmung des Inverkehrbringens ein Arzneimittel sein soll. Ob dieses Erzeugnis tatsächlich auch pharmakologisch, immunologisch oder metabolisch wirksam i. S. d. Art. 1 Abs. 2 Buchst. b des Gemein-schaftskodex ist, ist ggf. eine Frage der Zulassung, aber nicht Voraussetzung für die Einstufung als Präsentationsarzneimittel (deswegen können z. B. auch homöopathische Produkte als Arzneimittel in den Verkehr gebracht werden). 27 Präsentationsarzneimittel Zur Abgrenzung muss man auf den Begriff des Funktionsarzneimittels daher regelmäßig nur dann zurückgreifen, wenn Produkte als Arzneimittel wegen ihrer Wirkweise eingestuft werden sollen, die im Gewand eines anderen Erzeugnisses, meist eines 28 Funktionsarzneimittel 15 Art. 2 VO (EG) 178/2002 16 Richtlinie 2001/83/EG Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 11 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 Lebensmittels oder Kosmetikums, auf den Markt gebracht werden. Dabei hält es der EuGH nach wie vor für zulässig,17 dass nationale Behörden und Gerichte entscheiden, ob ein Erzeugnis als Arzneimittel einzustufen ist. Die gesetzlichen Definitionen, die dabei zur Anwendung kommen, sind allerdings unionsweit einheitlich,18 die nationalen Spielräume daher gering. Die Zweifelsregelung 29 gesetzgeberische Absícht gescheitert Der Gesetzgeber versuchte, die Abgrenzung der Produkte durch die Einführung einer sog. Zweifelsfallregelung zu vereinfachen, gemäß derer Erzeugnisse, die unter die Definition des Arzneimittels aber auch unter andere Definitionen, wie z. B. die des Lebensmittels fallen, als Arzneimittel gelten sollen.19 Allerdings hat die Rechtsprechung diese gut gemeinte Vorschrift zwischenzeitlich entkernt. 30 positive Einstufung notwendig Die neuere Rechtsprechung des EuGH20 stellte fest, dass die Zweifelsfallregelung nicht greift, wenn die Arzneimitteleigenschaft des betreffenden Produktes nicht zuvor wissenschaftlich positiv nachgewiesen ist. Die etablierten Kriterien zur Einstufung müssen demnach erst zur Einstufung als Arzneimittel führen, nur dann kann – wenn das Erzeugnis zugleich unter die Definition einer anderen Produktkategorie fallen würde – die Einstufung als Arzneimittel aufgrund der Zweifelsregelung erfolgen. Eine Einstufung „auf Verdacht“, wie zuvor vom OVG Lüneburg 21 erörtert, ist demnach nicht zulässig. 17 EuGH, „HLH Warenvertrieb“, ZLR 2005, 435 = WRP 2005, 18 so bereits BGH, Urteil vom 26.08.2008, „Arzneimittelwerbung im Internet“, ZLR 2006, 411 12 19 Eingeführt durch Richtlinie 2004/27/EG, umgesetzt mittlerweile in § 2 Abs. 3 a AMG 20 EuGH, Urteil vom 15.01.2009, Rs. C-140/07 („Red Rice III“)“), PharmaR 2009, 122 21 OVG Lüneburg, Urteil vom 23.03.2006, Az.: 11 LC 180/05 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg II.3.5.2 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 Nachdem der EuGH die Zweifelsfallregelung dergestalt ausgelegt hatte, hat das OVG Lüneburg im Ausgangsverfahren mittlerweile mit Urteil vom 03.02.201122 die streitgegenständlichen Red RiceKapseln, die als Nahrungsergänzungsmittel mit einem Monacolin K-Gehalt von 1,33 mg/Kapsel und einer Empfehlung von einem Verzehr von bis zu 3 Kapseln in Verkehr gebracht worden waren, als verkehrsfähiges Lebensmittel erachtet. Das Erzeugnis war weder als Präsentations- noch als Funktionsarzneimittel einzustufen. © Behr's Verlag, Hamburg II.3.5.3 31 OVG Lüneburg Präsentationsarzneimittel Wie bereits ausgeführt, ist das Präsentationsarzneimittel der Normalfall eines pharmazeutischen Erzeugnisses. Allerdings soll es sich nach der Rechtsprechung auch dann um ein Präsentationsarzneimittel handeln, „wenn beim durchschnittlich informierten Verbraucher auch nur schlüssig, aber mit Gewissheit der Eindruck entsteht, dass dieses Erzeugnis als Mittel zur Heilung oder zur Verhütung menschlicher und tierischer Krankheiten dient,23 sogenannte Präsentationsarzneimittel im weiteren Sinne.24 32 Präsentationsarzneimittel im weiteren Sinne Eine derartige Einstufung als Präsentationsarzneimittel 25 beruht regelmäßig auch auf außerhalb des Erzeugnisses selbst liegenden Umständen, wie z. B. einer massiven krankheitsbezogenen Werbung (z. B. „Vitamine gegen Krebs“). Diese kann zur Einstufung als Präsentationsarzneimittel führen, mit der der Werbende hinsichtlich der Wirkweise seines Erzeugnisses beim Wort genommen wird. 33 Bewerbung 22 OVG Lüneburg, Urteil vom 03.02.2011, Az.: 13 LC 92/03 23 EuGH, Urteil vom 30.11.1983, Slg. 1983, 3897 ff. – Van Benekom, Tz. 18 24 Meisterernst, GRUR 2001, 111 25 zur Kategorisierung der verschiedenen Produkte siehe grundlegend Meisterernst, GRUR 2001, 111 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 13 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen 34 Bewerbung durch Dritte Eine Bewerbung durch unabhängige Dritte reicht aber nicht aus, um ein Produkt als Präsentationsarzneimittel einzustufen. Nach Auffassung des VGH Mannheim 26 waren z. B. Internetbeiträge Dritter bei der Einstufung nicht zu berücksichtigen, im Gegensatz zu Produkthinweisen auf der Homepage des Herstellers. 35 „Franzbranntweingel“ Die Differenzierung zwischen Präsentations- und Funktionsarzneimitteln fällt in der Praxis oftmals schwer. Der BGH hat sich in seiner Entscheidung „Franzbranntweingel“27 bezüglich der Abgrenzung zwischen einem Kosmetikum und einem Arzneimittel mit dieser Frage befasst. In dem konkreten Fall wurde ein „Franzbranntweingel“, das als Kosmetikum aufgemacht war und vertrieben wurde, vom BGH als Arzneimittel nach der Präsentation eingestuft, da Franzbranntwein überragende Bekanntheit bei bundesdeutschen Verbrauchern als Arzneimittel habe. 36 Präsentationsarzneimittel Ein Präsentationsarzneimittel im weiteren Sinne kann demnach dann vorliegen, wenn ein Erzeugnis zwar nicht als Arzneimittel aufgemacht ist, die Verbraucher im Sinne der vorstehenden Rechtsprechung des EuGH aber mit Gewissheit davon ausgehen, dass es sich bei dem Produkt ungeachtet der abweichenden Aufmachung um ein Arzneimittel handelt. Dieser Eindruck kann sich ― aufgrund der stofflichen Zusammensetzung oder ― aufgrund der Produktaufmachung, Etikettierung und Bewerbung ergeben. 37 bekannter Arzneistoff Im ersten Fall der Einstufung eines Produkts als Präsentationsarzneimittel wegen der Verwendung eines überragend bekannten Arzneistoffs bei vergleichbarer Anwendung ist das Produkt 26 VGH ‚Mannheim, vom 11.02.2010, Az. 9 S 3331/08, „Kräuterteemischung“, DÖV 2010, 527 27 14 BGH, ZLR 2001, 417 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg Artikel 1 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 ungeachtet seiner pharmakologischen Wirksamkeit mangels Zulassung nicht verkehrsfähig.28 © Behr's Verlag, Hamburg Im zweiten Fall der arzneilichen Aufmachung und Etikettierung oder Bewerbung ist das Produkt in der jeweiligen Aufmachung mit der jeweiligen Etikettierung oder mit der betreffenden Werbung nicht verkehrsfähig.29 Dabei ist auf den Gesamteindruck des Produktes abzustellen, insbesondere dürfen einzelne Werbeaussagen nicht aus dem Zusammenhang gerissen werden.30 Soweit die Bewerbung nicht die Verbrauchererwartung so geprägt hat, dass es sich in jedem Fall (d. h. auch bei Abänderung der Bewerbung) weiterhin um ein Arzneimittel handelt,31 kann aber in diesen Fällen das Produkt in seiner stofflichen Zusammensetzung nach ordnungsgemäßer Abänderung weiter vertrieben werden.32 II.3.5.4 38 Bewerbung Funktionsarzneimittel Auch der Begriff des Funktionsarzneimittels wurde in der neueren Rechtsprechung des EuGH einer präziseren und zugleich engeren Auslegung unterzogen. Nach der grundlegenden Entscheidung „Knoblauchkapseln“ 33 ist eine pharmakologische Wirkung bei Stoffen, die auch mit der Nahrung aufgenommen werden, nur dann 39 EuGH „Knoblauchkapseln“ 28 in diesem Sinne unter Einbezug der Dosierung auch OLG Hamm, MD 2005, 219 für ein hochdosiertes Vitamin E-Präparat; aA OVG Münster, Urteil vom 17.03.2006, Az.: 13 A 2098/02 29 so auch Gröning, WRP 2005, 709, 717; OLG Hamburg, ZLR 2005, 491 mit Anmerkung Reinhart 30 BGH, „L-Glutamin“, GRUR 2003, 631, 632 = WRP 2003, 883 31 wie beispielsweise in der Entscheidung des KG Berlin, DLR 2005, 212 32 instruktiv: OLG Köln, „Glucosaminsulfat I“, ZLR 2004, 94 (Produkt mit 750 mg Glucosaminsulfat bei vergleichbarem auf dem Markt befindlichen Arzneimittel und arzneimitteltypischer Bewerbung ein Präsentationsarzneimittel); OLG Köln, „Glucosaminsulfat II“, MD 2005 1223 (identisches Produkt kein Funktionsarzneimttel) 33 EuGH, Urteil vom 15.11.2007, Rs. C-319/05 „Knoblauchkapseln“, GRUR 2008, 271 = ZLR 2008, 48 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 15 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 40 objektiv feststellbar? Der danach bei der Abgrenzung entscheidende Begriff der pharmakologischen Eigenschaften begegnet aus naturwissenschaftlicher Sicht Bedenken. 34 Die pharmakologische Wirkung einer Substanz kann im Ergebnis oftmals nur schwer oder gar nicht von ernährungsphysiologischen oder physiologischen Wirkungen abgegrenzt werden.35 So kann z. B. Calcium als Phospatbinder bei Dialysepatienten in einer Dosierung von 500 mg als Arzneimittel vertrieben werden; die gleiche Menge Calcium kann aber auch ohne weiteres in einem Nahrungsergänzungsmittel verwendet werden. Dies sollte aber nicht dazu verführen, den Begriff der „pharmakologischen Wirkung“ leichtfertig aufzugeben oder abzutun (rechtlich wäre dies ohnehin nicht möglich, da sich der Begriff der „pharmakologischen Eigenschaften“ in der Definition des Arzneimittels in der RL 2001/83/EG findet). 41 Zulassungen und Monographien Bei der Verwendung von Arzneistoffen, für die klinische Studien eine klar definierte Grenze der pharmakologischen Wirkung ergeben, kann die pharmakologische Eigenschaft eines Produkts bestimmt werden und das Kriterium zur Abgrenzung von Lebensmitteln herangezogen werden. Diese kann aus Arzneimittelmonographien36 oder Arzneimittelzulassung abgeleitet werden. Bestehen wissenschaftliche Zweifel, ob einem Produkt pharmakologische Eigenschaften zukommen, kann es nicht als Funktionsarzneimittel 34 siehe eingehend Röbel/Parzeller/Schulze, Arzneimittel oder Lebensmittel – Unterscheidung anhand der pharmakologischen Wirkung, StoffR 2005, 208 (Teil 1) und 233 (Teil 2); Gröning, WRP 2005, 709; Meisterernst/Schneider, DLR 2004, 302; Hahn, ZLR 2002,1; Zipfel/Rathke, C-101, § 2, Rnr. 77a 35 OLG Hamburg, ZLR 2009, 246, 253, bezeichnet demnach das Merkmal der ernährungsphysiologischen Wirkung als funktionalen Rechtsbegriff zur Abgrenzung von der pharmakologischen Wirkung 36 16 BVerwG, Urteil vom 25.07.2007, Vitamin E, ZLR 2008, 80 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg anzunehmen, wenn eine nennenswerte Beeinflussung der biologischen Funktionen des Organismus erfolgt. Im konkreten Fall wurde die Zufuhr von Allicin mittels Knoblauchkapseln, die einem Verzehr von 7,4 g frischem Knoblauch entsprach, als nicht pharmakologisch eingestuft. Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 © Behr's Verlag, Hamburg eingestuft werden. 37 Bei ambivalenten Stoffen, bei denen die pharmakologische Wirkung letztendlich nicht über eine vergleichbare ernährungsphysiologische Wirkung hinausgeht, ist das Kriterium jedoch zur Abgrenzung ungeeignet. Hier treten Sicherheitsaspekte in den Vordergrund.38 Im Einzelfall kann aber auch die Verwendung eines Stoffs unterhalb der therapeutischen Dosierung zur Einstufung als Arzneimittel führen.39 Gerichte behelfen sich zuweilen mit der Überlegung, ob die betreffende Menge des Nährstoffs auch mit der normalen Ernährung zugeführt werden könnte.40 Diese Auffassung ist zwar zutreffend, soweit es darum geht zu beurteilen, ob eine Zutat oder ein Stoff keine pharmakologische Wirkung hat; der Umkehrschluss ist jedoch nicht gerechtfertigt. 41 Denn die frühere deutsche Verwaltungspraxis, Vitamine mit einer Dosierung von mehr als dem Dreifachen der täglich empfohlenen Aufnahmemenge als Arzneimittel zu qualifizieren, wurde ausdrücklich als unionsrechtswidrig beanstandet. 42 Die empfohlenen täglichen Aufnahmemengen orientieren sich maßgeblich an der üblichen Aufnahmemenge des betreffenden Stoffs bei einer ausgewogenen und abwechslungsreichen Ernährung. Im Ergebnis würde diese Rechtsprechung demnach zurück zu einer „Einfachregel“ führen, die noch weit unter der früheren „Dreifachregel“ liegt. 42 Zufuhr mit normaler Ernährung möglich Diese Auffassung wird durch Art. 8 Abs. 1 AnreicherungsVO in Verbindung mit deren Erwägungsgrund 20 bestätigt: Anreicherung und Dosierung von Stoffen oberhalb der mit einer ausgewogenen und abwechslungsreichen Ernährung zu erreichenden Menge führt zu einer Beweislastumkehr für die Sicherheit des betreffenden 43 AnreicherungsVO 37 EuGH, Urteil vom 15.01.2009, Rs. 140/07, Red Rice III; PharmaR 2009, 122 OLG Köln, MD 2005, 1223 38 siehe hierzu Meisterernst/Schneider, DLR 2004, 302 39 so VG Braunschweig, LRE 64, 326 40 so z.B. Kammergericht Berlin, E. v. 8.11.2002, ZLR 2003, 604 41 3-fache Tagesdosis, ZLR 2001, 561 42 EuGH, E. v. 29.4.2004, „3-fache Tagesdosis“, Rs. C-387/99; BGH, „3-fache Tagesdosis“, ZLR 2001, 561 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 17 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 44 Einzelfallbeurteilung maßgeblich Vielmehr ist erforderlich, dass ein Erzeugnis entweder zur Verhütung oder Heilung von Krankheiten bestimmt ist oder die Zufuhr eines bestimmten Stoffes das ernährungsphysiologisch Sinnvolle und Mögliche weit übersteigt. 43 Es bedarf stets einer Beurteilung des Produkts im Einzelfall „unter Berücksichtigung aller seiner Eigenschaften“.44 45 BVerwG Dementsprechend vertrat auch das Bundesverwaltungsgericht in seiner Entscheidung „OPC“ 45 und „Lactobact Omni FOS“ die Auffassung, dass die Funktionsbedingungen des menschlichen Körpers „erheblich beeinflusst“ werden müssen und dass die betreffenden pharmakologischen Wirkungen durch belastbare wissenschaftliche Erkenntnisse belegt sein müssen.46 46 EuGH Auch der EuGH stellt darauf ab, dass ein Arzneimittel nach der Funktion „wirklich die Funktion der Verhütung oder Heilung“47 besitzt, und nicht nur Eigenschaften hat, die der Gesundheit im Allgemeinen förderlich sind. Bei Erzeugnissen, die auch als Lebensmittel verzehrt werden, sei dies regelmäßig nicht anzunehmen, wenn die mit dem Erzeugnis verzehrte Menge oder der mit dem Erzeugnis verzehrte Wirkstoff nicht Auswirkungen auf die physiologischen Funktionen hervorruft, die ein in angemessener Menge verzehrtes Lebensmittel gleichfalls auf diese Funktion haben kann. 43 so die Rechtssprechung des Hanseatischen OLG Hamburg sowie das Kammergericht Berlin: OLG Hamburg, Urteil 5.10.2000, LRE 40, Heft 2/3; ZLR 2001, 315 - “Muskelaufbau”; KG Berlin, Urteil vom 20.10.2000, ZLR 2001, 576 – „Anti-kataboler Muskelzellschutz“; OLG Hamburg, ZLR 2002, 75 – „Pflanzliche Östrogene“ 18 44 so auch Art. 2 RL 2001/83/EG 45 Bundesverwaltungsgericht, Urteil vom 25.07.2007, „OPC“, ZLR 2007, 757 46 so auch Bundesverwaltungsgericht „Vitamin E 400“, ZLR 2008, 80 47 EuGH „Knoblauchkapseln“, Urteil vom 15.11.2007, Rs. C-319/05, ZLR 2008, 48 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg Erzeugnisses zu Lasten des Lebensmittelunternehmers, aber nicht zu einer Einstufung als Arzneimittel. Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen © Behr's Verlag, Hamburg Artikel 1 Auch der Bundesgerichtshof schließt sich in seiner neueren Rechtsprechung48 dieser Auffassung an. 47 BGH Es muss demnach z. B. bei Nahrungsergänzungsmitteln für jedes einzelne Vitamin und bei jedem einzelnen Mineralstoff festgelegt werden, wo der therapeutische Einsatz beginnt. Eine Frage, die naturgemäß schwierig zu beantworten ist. So können etwa 100 mg Vitamin C bei einem Skorbutkranken durchaus eine therapeutische Wirkung haben. 48 Abgrenzungsprobleme bleiben Diese Rechtsprechung, die maßgeblich auf den Begriff der pharmakologischen Wirkung abstellt, ist jedoch bei ergänzenden bilanzierten Diäten, die eine besondere medizinische Zweckbestimmung haben, zur Abgrenzung von Arzneimitteln grundsätzlich nicht tauglich.49 49 ergänzende bilanzierte Diäten II.3.5.5 Zusammengefasst: Einzelfallbeurteilung maßgeblich Daher kommt es nach der etablierten Rechtsprechung auf die Eigenschaften eines Erzeugnisses im Wege einer Einzelfallbeurteilung hinsichtlich Zusammensetzung, pharmakologischer Eigenschaften, Modalitäten des Gebrauchs, Umfang der Verbreitung, Bekanntheit bei Verbrauchern und schließlich der Verwendung an. Es muss eine nennenswerte Beeinflussung menschlich physiologischer Faktoren erfolgen. 50 Kriterien Danach verbieten sich pauschalisierende Regelungen, wie die bereits genannte Dreifachregel, aber auch die generelle Einstufung von Stoffen als Arzneistoffe und damit als zulassungspflichtige Zutaten. In einer neueren Entscheidung des EuGH, betreffend eine Liste 51 keine pauschalisierenden Regelungen 48 BGH „L-Carnitin II“, Urteil vom 26.06.2008, I ZR 61/05; „HMB-Kapseln“, Urteil vom 26.06.2008, I ZR 111/05, GRUR 2008, 619 = ZLR 2009, 68 49 OLG Hamburg, U. v. 27.01.2005, ZLR 2005, 266; OLG München, U. v. 19.08.2003, Az.: 6 U 1532/04 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 19 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 verbotener Pflanzenstoffe des Königreichs Spanien50, wurde diese als unzulässige Einschränkung der Warenverkehrsfreiheit eingestuft, da bei jeder dort aufgeführten Arzneipflanze gesondert geprüft werden müsste, ob sie eine pharmakologische Wirkung habe. Dosierung entscheidend 52 Dosis entscheidend“ Nachdem eine pharmakologische Wirkung nur dosisabhängig zu bestimmen ist, kann die Einstufung als Funktionsarzneimittel nicht allein aufgrund der Verwendung einer Arzneipflanze erfolgen. Es muss jeweils geprüft werden, ob die Dosierung im konkreten Erzeugnis eine pharmakologische Wirkung begründet. Es gibt demnach keine pflanzlichen Zutaten, die abstrakt-generell als Arzneistoffe eingestuft werden und deswegen dosisunabhängig dem Arzneimittelbereich vorbehalten sind. 53 Ausnahme: Präsentationsarzneimittel Anders läge der Fall bei einer Pflanze, die so stark im Verbraucherbewusstsein als Arzneistoff verankert ist, dass ihre Verwendung und ggf. werbliche Auslobung zur Einstufung der betreffenden Produkte als Präsentationsarzneimittel führen würde.51 54 Novel Food Allerdings kann die Verwendung dieser Stoffe in Lebensmitteln aus anderen Gründen, z. B. als neuartige Lebensmittelzutat 52 wegen des fehlenden Gebrauchs in Lebensmitteln vor dem 15.05.1997 oder aus Gründen der Lebensmittelsicherheit unzulässig sein. 55 Verzehrsempfehlung Ist eine Verzehrsempfehlung unpräzise, kann eine Einstufung als Funktionsarzneimittel erfolgen, wenn das Überschreiten der Empfehlung – im konkreten Fall bei „Ginkgo“ – zu der Aufnahme 50 EuGH, Urteil vom 05.03.2009, Rs. C-88/07, „Kommission/Königreich Spanien, ZLR 2009, 321 51 In diesem Sinne BGH, ZLR 2001, 417 „Franzbranntweingel“ 52 VO (EG) 58/1997 über neuartige Lebensmittel und Lebensmittelzutaten, Novel Food VO 20 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg II.3.5.6 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 einer pharmakologisch wirksamen Menge führen kann. 53 Grundsätzlich ist aber bei der Beurteilung der Wirkung eines Erzeugnisses stets auf dessen normale Verwendung, d. h. Verwendung gemäß Verzehrsempfehlung, abzustellen. 54 Die von einem Erzeugnis ausgehende Gesundheitsgefahr ist dabei grundsätzlich kein relevantes Abgrenzungskriterium.55 © Behr's Verlag, Hamburg II.3.5.7 Auswirkungen von Zulassungen gemäß VO Als neuer Faktor bei der Abgrenzungsproblematik ist zu sehen, dass gemäß VO Stoffe beurteilt wurden, die mit gesundheitsbezogenen Angaben beworben werden können, die nach nationaler Auffassung als Arzneimittel einzustufen wären (wobei hier die Dosierung, wie bereits ausgeführt, eine entscheidende Rolle spielt). 56 Zulassung von Stoffen Angesichts unterschiedlicher Produkttraditionen in Europa hinsichtlich Pflanzen und Pflanzenextrakten in Lebensmitteln, Kräutertees, pflanzlichen Nahrungsergänzungsmitteln und/oder Arzneimitteln wurde die Bewertung von Pflanzenstoffen durch die Europäische Behörde für Lebensmittelsicherheit (EFSA) von der Kommission zurückgestellt. Der erste Teil der Gemeinschaftsliste gemäß Art. 13 Abs. 3 VO (VO (EU) 432/12) der zugelassenen gesundheitsbezogenen Angaben erfasst diese nicht. Inwieweit eine Neuregelung der VO vergleichbar der zu traditionellen pflanzlichen Arzneimitteln56 im Hinblick auf unterschiedliche Traditionen bei der Verwendung von Pflanzenstoffen in den Mitgliedsstaaten erfolgen wird, ist zurzeit offen. 57 Produkttraditionen für Pflanzen 53 BGH, Urteil vom 01.07.2010, I ZR 19/08 – „Ginkgo“, WRP 2010, 1243 = ZLR 2010, 613 54 EuGH, Urteil vom 30.05.2009, Rs. C-27/08 – „Bios“, ZLR 2009, 483; BVerwG, Urteil vom 26.05.2009, Az. 3 C 5.09 – „Red Rice Kapseln“ 55 so EuGH, Urteil vom 30.04.2009, Rs. C-27/08; „Bios“, ZLR 2009, 483; BGH, Urteil vom 14.01.2010, Az. I ZR 138/07 „Zimtpräparat“, ZLR 2010, 211 56 Zu dieser Problematik bereits Meisterernst, ZLR 2004, 43 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 21 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen 58 EuGH „HLH“ Zwar hat der EuGH in der Entscheidung „HLH Warenvertrieb“ 57 die Auffassung vertreten, dass es nach wie vor „möglich“ bzw. nicht zu vermeiden sei, dass eine unterschiedliche Qualifizierung von Erzeugnissen in den Mitgliedstaaten erfolgt. Da aber zugleich der Arzneimittelbegriff nach der Rechtsprechung des EuGH harmonisiert ist,58 ist an sich nur schwer vorstellbar, dass die Verwendung eines Stoffs in einer bestimmten Dosierung in dem einen Mitgliedstaat objektiv zutreffend pharmakologische Eigenschaften des jeweiligen Erzeugnisses begründet, in einem anderen hingegen nicht. 59 Befugnisse der Mitgliedstaaten Dessen ungeachtet hat der Unionsgesetzgeber bei Verabschiedung des ersten Teils der Gemeinschaftsliste (siehe hierzu die Kommentierung bei Art. 28, Rnr. 20 ff.) „klarstellend“ in Erwägungsgrund 17 59 zum Ausdruck gebracht, dass die Entscheidung über eine gesundheitsbezogene Angabe und insbesondere die Aufnahme in die Liste zulässiger Angaben „nicht gleichbedeutend mit einer Zulassung für das Inverkehrbringen des Stoffs, auf den sich die Angabe bezieht, eine Entscheidung darüber, ob der Stoff in Lebensmitteln verwendet werden darf, bzw. eine Einstufung eines bestimmten Produkts als Lebensmittel“ ist. 57 EuGH, „HLH Warenvertrieb“ u. a., WRP 2005, 863 58 EuGH, „HLH Warenvertrieb“ u. a., WRP 2005, 863; ebenso BGH, „L-Carnitin II“, Urteil vom 26.06.2008, I ZR 61/05; ZLR 2008, 679 = GRUR 2008, 830; BGH, „HMB-Kapseln“, Urteil vom 26.06.2008, I ZR 111/05; GRUR 2008, 834; BGH, Urteil vom 14.01.2010, Az.: I ZR 138/07 „Zimtpräparat“ 59 „Für den Zusatz von Stoffen zu Lebensmitteln bzw. ihre Verwendung in Lebensmitteln wie auch für die Einstufung von Produkten als Lebensmittel oder Arzneimittel gelten spezifische EU- und einzelstaatliche Rechtsvorschriften. Eine gemäß der Verordnung (EG) Nr. 1924/2006 getroffene Entscheidung über eine gesundheitsbezogene Angabe, wie die Aufnahme in die Liste zulässiger Angaben gemäß Artikel 13 Absatz 3 der genannten Verordnung, ist nicht gleichbedeutend mit einer Zulassung für das Inverkehrbringen des Stoffes, auf den sich die Angabe bezieht, einer Entscheidung darüber, ob der Stoff in Lebensmitteln verwendet werden darf, bzw. einer Einstufung eines bestimmten Produkts als Lebensmittel.“ 22 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg Artikel 1 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen © Behr's Verlag, Hamburg Artikel 1 Dies ist zwar formal zutreffend. Dennoch ist der Zulassung einer gesundheitsbezogenen Angabe für Lebensmittel zu entnehmen, dass der betreffende Stoff/das Lebensmittel bei den in der Zulassung vorgesehenen Verwendungsbedingungen, insbesondere einer dort festgelegten Dosierung, in einem oder einigen Mitgliedstaaten als Lebensmittel eingestuft wird. Wären nämlich alle Mitgliedstaaten der Auffassung, dass der Stoff in einer bestimmten Dosierung ausschließlich als Arzneimittel Verwendung finden könne, wäre eine Zulassung nicht erfolgt. 60 Bedeutung der Zulassung einer gesundheitsbezogenen Angabe Soweit Angaben auf die Behandlung von Krankheiten zielten, wurden sie jedenfalls abgelehnt.60 61 Behandlung von Krankheiten Spielraum für eine abweichende Entscheidung der Mitgliedstaaten scheint daher im Wesentlichen hinsichtlich der Einstufung als „Präsentationsarzneimittel“ zu bestehen. Die Tatbestandsmerkmale dieser Fallgruppe eröffnen Raum für den Einbezug kultureller Unterschiede, die zu voneinander abweichenden Ergebnissen führen können. Es bleibt Aufgabe der Rechtsprechung, die Friktionen bei Anwendung der VO – soweit dies möglich ist – behutsam aufzulösen. Eine Annäherung der Rechtsanwendungsbindungspraxis in den Mitgliedstaaten wäre wünschenswert. Hinsichtlich der Einstufung als Funktionsarzneimittel wäre eine weitere Harmonisierung des Unionsrechts hilfreich. Nachdem unterschiedliche Einstufungen nationaler Behörden und Gerichte aber meist auf der Grundlage voneinander abweichender Tatsachenbeurteilungen erfolgen, würde dies Kompetenzen einer unionsweit zuständigen Instanz voraussetzen. 62 verbleibende Spielräume 63 Ausblick 60 siehe EFSA Journal 2010; 8 (10): 1746 bezüglich der Angabe „treatment of cold sores and herpes“. „The panel considers that the claim does not comply with the criteria laid down in Regulation (EC) no. 1924/2006” Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 23 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 Übersicht Abgrenzung Lebensmittel – Arzneimittel © Behr's Verlag, Hamburg II.3.5.8 24 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 © Behr's Verlag, Hamburg II.3.6 Abgabe an den Endverbraucher Der Begriff des Endverbrauchers ergibt sich bereits aus der VO (EG) 178/2002 (Art. 3 Ziff. 18). Diese Definition wird überflüssigerweise auch noch in Art. 2 Ziff. 1 a VO wiederholend in Bezug genommen. Die betreffenden Lebensmittel müssen zur Abgabe an den Endverbraucher bestimmt sein. Hierzu gehören regelmäßig Lebensmittel in Fertigverpackungen im Sinne des § 6 Abs. 1 EichG. Danach sind Fertigpackungen „Erzeugnisse in Verpackungen beliebiger Art, die in Abwesenheit des Käufers abgepackt und verschlossen werden, wobei die Menge des darin enthaltenen Erzeugnisses ohne Öffnen oder merkliche Änderung der Verpackung nicht verändert werden kann“. Bei unverpackten Lebensmitteln gelten bei Abgabe an den Endverbraucher besondere Regelungen. 64 Begriff Endverbraucher Die weitere Gleichstellung, dass die Verordnung auch für Lebensmittel, die in Einrichtungen zur Gemeinschaftsverpflegung wie Restaurants, Krankenhäusern, Schulen, Kantinen etc. gelten soll, korrespondiert mit dem Begriff des „Einzelhandels“ gemäß Art. 13 Ziff. 7 VO (EG) 178/2002. 65 gleichgestellte Abnehmer Die Vorschrift ist an die Regelung des Art. 1 RL 2000/13/EG (Etikettierungs-Richtlinie) angelehnt. Auch dort wird im Anwendungsbereich darauf abgestellt, dass Lebensmittel „ohne weitere Verarbeitung an den Endverbraucher abgegeben werden sollen“. Aus der hier gewählten Formulierung „als solche an Endverbraucher abgegeben werden sollen“ ist jedenfalls zu entnehmen, dass die Vorschrift beim Vertrieb an gewerbliche Weiterverarbeitungsbetriebe – mit Ausnahme der, wie vorstehend dargelegt, gleichgestellten Abnehmer – nicht gelten soll. So fällt z. B. der Vertrieb von Backmischungen an Bäckereibetriebe nicht in den Anwendungsbereich der VO. 66 gewerbliche Abnehmer Fraglich ist allerdings, ob die VO grundsätzlich auch für Angaben gegenüber anderen Personen gilt, wenn diese nicht als Endverbraucher angesprochen werden, wie z. B. Ärzte, Apotheker oder Ernährungsberater (Nicht-Verbraucher). Der wesentliche Begriff der „kommerziellen Mitteilung” nimmt den Adressaten einer nährwert- oder gesundheitsbezogenen Angabe nicht in Bezug und 67 NichtVerbraucher Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 25 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 trägt daher zur Beantwortung der Frage, ob die Verordnung auch auf Nicht-Verbraucher anwendbar ist, zunächst nicht bei. 69 Aufmachung und Etikettierung 70 Nur Verbraucher soll geschützt werden Für eine Anwendbarkeit der VO spricht der Wortlaut der Vorschrift, die nicht darauf abstellt, ob die jeweiligen Lebensmittel an den Verbraucher abgegeben werden, sondern darauf, ob sie an den Verbraucher abgegeben werden sollen61. Werbung gegenüber z. B. Fachkreisen für Produkte, die letztendlich für den Endverbraucher bestimmt sind, würde gemäß dem Wortlaut in den Anwendungsbereich der Verordnung fallen. Damit könnte ein stärkerer Schutz der Verbraucher davor erzielt werden, dass unzutreffende Informationen von fachkundigen Personen weitergegeben werden. Der Wortlaut des Art. 1 Abs. 2 Satz 1 VO ist allerdings nur vermeintlich eindeutig. Die Vorschrift deckt sowohl die Aufmachung und Etikettierung als auch die Werbung ab. Für den Bereich der Aufmachung und Etikettierung, also der Angaben die sich auf oder in räumlicher Nähe zu dem Produkt finden, ist es völlig unstreitig, dass darauf abzustellen ist, ob die Produkte an den Endverbraucher abgegeben werden sollen (anders bei gewerblichen Weiterverarbeitern, siehe oben Rdnr. 66). Nur bei werbenden Angaben außerhalb der Verpackung stellt sich die Frage der Anwendung auf Nicht-Verbraucher und ob der Wortlaut streng auszulegen ist. Gegen eine Anwendung auch auf Werbeangaben gegenüber Nicht-Verbrauchen spricht die primäre Zielrichtung der Verordnung, der Verbraucherschutz. Die VO zielt darauf ab, ein hohes Schutzniveau für Verbraucher und ein Funktionieren des Binnenmarkts zu gewährleisten (siehe Erwägungsgrund 1, Art. 1 VO). Diese Ziele können zwar grundsätzlich unabhängig davon erreicht werden, ob Nicht-Verbraucher dem Anwendungsbereich unterliegen sollen oder nicht. Grundlegende Vorschriften der VO (z. B. Art. 5 Abs. 2, 13 Abs. 1 ii VO, Erwägungsgrund 16) nehmen jedoch ausdrücklich auf den Verbraucher und seine Vorstellung Bezug. Die Anwendung auf andere Parteien ist offensichtlich nicht vorgesehen. Hinzuweisen ist auch noch auf Erwägungsgrund 3 der VO, 61 26 So noch unsere Auffassung in der 5. Aktualisierungslieferung 08/08. Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg 68 Wortlaut Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 der direkt auf die Kennzeichnungsrichtlinie 2000/13/EG und Käufer – regelmäßig Verbraucher – von Produkten, die nicht irregeführt werden sollen, verweist. © Behr's Verlag, Hamburg Darüber hinaus ist zu beachten, dass Art. 11 und 12 der VO spezifische Vorschriften für Angaben festlegt, die von Nicht-Verbrauchern, nämlich in diesem Falle Fachkreisen, getätigt werden. Der Gesetzgeber hat demnach durchaus die Situation erkannt, dass ggf. gesundheitsbezogene Angaben von Angehörigen der Fachkreise getätigt werden können. Hätte er auch die umgekehrte Situation der Werbung gegenüber Fachkreisen erfassen wollen, hätte nahe gelegen, dies auch ausdrücklich festzulegen. Dabei ist in die Betrachtung einzubeziehen, dass die unterschiedliche Behandlung gegenüber Verbrauchern und anderen Parteien mittlerweile in der Rechtsetzung der Europäischen Union zum Standard gehört62. Das durchschlagende Argument liegt allerdings darin, dass es nach der VO keine Möglichkeit gibt, Angaben für sonstige Personen mit einem vom normalen Verbraucherverständnis abweichenden Empfängerhorizont zuzulassen. Wenn der Unionsgesetzgeber gewollt hätte, dass auch gesundheitsbezogene Angaben gegenüber z. B. Fachkreisen der Verordnung unterliegen sollten, müsste auch die Möglichkeit bestehen, dem speziellen Informationsbedürfnis sowie vorgebildetem Verständnis dieser Personengruppe durch die Zulassung entsprechend detaillierter und naturwissenschaftlich geprägter Angaben zu genügen. Nachdem die VO aber kein Verfahren vorsieht, in dem Angaben gegenüber Fachkreisen zugelassen werden könnten, wären gem. Art. 10 VO auch wissenschaftlich zutreffende Angaben gegenüber dieser Personengruppe deshalb unzulässig, da sie gemessen am Maßstab des Art. 5 Abs. 2, 13 Abs. 1 ii VO vom Verbraucher nicht verstanden werden. Dies kann nicht richtig sein und würde überdies gegen die unionsrechtlich anerkannten Grundrechte der Meinungs- und Informati- 62 70a Spezifische Regelungen für Angaben von Fachkreisen 70b Keine Zulassungsmöglichkeit für Angaben gegenüber Fachkreisen Siehe z. B. die Richtlinien 2006/114/EG sowie 2005/29/EG. Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 27 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 70c Anwendung nur auf Werbung gegenüber Endverbrauchern Für eine Anwendung der VO ausschließlich auf die Bewerbung gegenüber Endverbrauchern sprechen demnach die besseren Argumente. Letztendlich wird die Rechtsprechung diese Frage klären müssen. Es wäre wünschenswert gewesen, dass der Unionsgesetzgeber sich bei Erlass der Verordnung diesbezüglich eindeutig geäußert hätte, nachdem dieser Problematik erhebliche praktische Relevanz bei der Bewerbung von Gesundheitsprodukten zukommt. 70d diätetische Lebensmittel In Art. 6 Abs. 2 RL 89/398/EWG ist eine Ausnahme für zweckdienliche Angaben oder Empfehlungen, die ausschließlich für qualifizierte Personen auf dem Gebiet der Medizin, der Ernährung und der Arzneimittel bestimmt sind, vorgesehen, die allerdings nur für diätetische Lebensmittel gilt, siehe hierzu die Kommentierung bei Art. 1 Rn. 86. II.3.7 71 Frischprodukte Unverpackte Lebensmittel Für nicht vorverpackte Lebensmittel gelten einige Bestimmungen der Verordnung nicht. Der Anwendungsbereich ist insoweit in Art. 1 Abs. 2 Satz 2 VO auf Betreiben des Europäischen Parlaments entgegen den ursprünglichen Plänen der Kommission eingeschränkt worden. Beispielhaft nennt die Verordnung Frischprodukte wie Obst, Gemüse oder Brot. Die Vorschrift erfasst auch alle Lebensmittel, die an der Verkaufsstelle auf Wunsch des Käufers verpackt oder im Hinblick auf den sofortigen Verkauf fertig ver- 63 Siehe hierzu BGH, Beschluss vom 13. Januar 2011, WRP 2011, 344, Rz. 10, sowie Bundesverwaltungsgericht, Beschluss vom 23. September 2010, WRP 2011, 103 ff., Rz. 14, unter zusätzlichem Hinweis auf die Berufsfreiheit (Art. 15 Abs. 1) und die Unternehmerfreiheit (Art. 16) der Charta der Grundrechte der Europäischen Union; das Verbot der Bewerbung alkoholischer Getränke gem. Art. 4 Abs. 3 VO ist kein Verstoß gegen Grundrechte, EuGH, Urteil vom 6. September 2012, Rs. C-544/10, „Deutsches Weintor“, ZLR 2012, 602 = WRP 2012, 1368. 28 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg onsfreiheit gem. Art. 6 Abs. 3 AEUV i. V. m. Art. 10 EMRK verstoßen63 (siehe hierzu auch Art. 2 Rnr. 24). Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 packt werden. Hierzu gehören beispielsweise Fisch, Fleisch, Käse, Kaffee oder Tee in offenen Gebinden. © Behr's Verlag, Hamburg Weitere Voraussetzung ist, dass die betreffenden nicht fertig verpackten Lebensmittel dem Endverbraucher und/oder Einrichtungen zur Gemeinschaftsverpflegung zum Kauf angeboten werden (siehe hierzu 3.6). Auf diese so definierten Erzeugnisse sind die Regelungen des Art. 7 VO – obligatorische Nährwertkennzeichnung bei gesundheitsbezogenen Angaben – sowie die gemäß Art. 10 Abs. 2 Buchst. a und b VO obligatorischen Hinweise auf die Bedeutung einer abwechslungsreichen und ausgewogenen Ernährung und einer gesunden Lebensweise sowie bezüglich Informationen zur Menge des Lebensmittels und zum Verzehrmuster, die erforderlich sind, überhaupt eine positive Wirkung zu erzielen, nicht anwendbar. 72 nicht anwendbare Regelungen Die Regelung des Art. 1 Abs. 2 Satz 3 VO, die mit der Neuregelung des vorhergehenden Satz 2 in den Absatz eingefügt wurde, sieht vor, dass einzelstaatliche Bestimmungen angewandt werden können, bis ggf. nach den in Art. 25 Abs. 2 genannten Verfahren Unionsmaßnahmen erlassen werden. Diese Ausnahmebestimmung bezieht sich nach der Entstehungsgeschichte nur auf die in Art. 1 Abs. 2 Satz 2 VO geregelten nicht fertig verpackten Lebensmittel sowie die weiteren dort genannten Fallgruppen. Sie kann sich insbesondere nicht auf die Regelung des Art. 1 Abs. 2 Satz 1 VO beziehen, die allgemein die Anwendbarkeit der Verordnung auf nährwert- und gesundheitsbezogene Angaben festlegt. Anderenfalls wäre der Regelungszweck der Verordnung, eine einheitliche europäische Regelung für gesundheitsbezogene und nährwertbezogene Etikettierung und Bewerbung zu schaffen, völlig fehlgeschlagen. 73 einzelstaatliche Bestimmungen Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 29 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen © Behr's Verlag, Hamburg Artikel 1 II.4 Anwendung auf Marken II.4.1 Privilegien für Marken Ob und inwieweit die Regelungen der Health-Claims-Verordnung auch für Marken gelten sollten, war im Gesetzgebungsverfahren umstritten. Nach dem Vorschlag der Kommission sollte die Verordnung uneingeschränkt auf Marken anwendbar sein, während nach Auffassung des Europäischen Parlaments Marken vom Anwendungsbereich der Verordnung ausgenommen werden sollten. Im Rahmen der Kompromissfindung wurden die Übergangsfristen für bereits vor dem 1. Januar 2005 bestehende Handelsmarken oder Markennamen (aber nicht Phantasiebezeichnungen!) von 10 auf 15 Jahre nach Inkrafttreten der Verordnung verlängert (siehe hierzu die eingehende Kommentierung bei Art. 28 Abs. 2 VO). Die als Kompromiss gefundene Regelung des Art. 1 Abs. 3 VO unterwirft Kennzeichen und Phantasiebezeichnungen den Regelungen der Verordnung, gewährt aber Ausnahmen, sofern eine zugelassene nährwert- bzw. gesundheitsbezogene Angabe „beigefügt“ ist (so genannte „Koppelungslösung“). 1 Marken werden insoweit privilegiert. 74 Gesetzgebungsverfahren Die Regelung erfasst Handelsmarken, Markennamen oder Phantasiebezeichnungen, also nicht nur eingetragene Marken, sondern auch bloße Namen im Sinne des § 12 BGB sowie sonstige markenmäßige Kennzeichnungen und gattungsmäßige Bezeichnungen wie z. B. „Hustenbonbon“ oder „Digestiv“. Letzteres ergibt sich im Umkehrschluss aus der Regelung des Art. 1 Abs. 4 VO. 74a Reichweite 1 siehe hierzu auch Epping/Greifeneder, WRP 2006, 830, 832; Loosen, ZLR 2006, 527; Hauer, EFFL 2006, 356 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 1 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 Diese Bezeichnungen müssen „in der Kennzeichnung, Aufmachung oder Werbung für ein Lebensmittel“ verwendet werden (siehe bezüglich dieser Begriffe die Kommentierung unter 3.3). Verschiedene Kategorien von Marken 74b Inhalt maßgeblich Erfasst werden allerdings nur Handelsmarken, Markennamen oder Phantasiebezeichnungen, die als nährwert- oder gesundheitsbezogene Angabe aufgefasst werden können. Wie sich dem nachstehenden Halbsatz entnehmen lässt, sollen diese „ohne das in dieser Verordnung vorgesehene Zulassungsverfahren verwendet werden“ dürfen, soweit die weiteren Voraussetzungen eingehalten sind. Der Gesetzgeber unterstellt somit, dass es sich um Angaben handeln muss, die an sich entweder als nährwert- oder gesundheitsbezogene Angabe zulassungspflichtig wären. Ansonsten wäre eine Umgehung der Zulassungserfordernisse der Art. 10 Abs. 1, 8 Abs. 1 VO leicht möglich. 74c Grundsatz Hieraus ergibt sich auch, dass die beizufügende Angabe mit dem jeweils suggerierten oder mittelbar zum Ausdruck gebrachten Sinngehalt der Angabe im Zusammenhang stehen muss. Dies erfordert, dass ein Kennzeichen, das als nährwertbezogene Angabe zu verstehen ist, auch mit einer zugelassenen nährwertbezogenen Angabe zu versehen ist,2 sowie eine gesundheitsbezogene Angabe bei Kennzeichen, die einen Gesundheitsbezug suggerieren, beizufügen ist. 74d unkonkrete Kennzeichen Soweit Marken nur einen undifferenzierten Bedeutungsgehalt zum Ausdruck bringen, kann der inhaltliche Zusammenhang entsprechend schwach sein. 2 2 z.B. die Angabe „Vitamin C-Quelle“ für „Hohes C“ Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg II.4.2 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen © Behr's Verlag, Hamburg Artikel 1 Kennzeichen oder Phantasiebezeichnungen, die so konkret ausgestaltet sind, dass sie eine spezifische Angabe im Sinne der Art. 13 Abs. 1, 14 Abs. 1 VO beinhalten, muss eine spezifische Angabe beigefügt werden, die den Bedeutungsgehalt voll abdeckt. In einem solchen Fall bedarf die mit dem Kennzeichen kommunizierte spezifische gesundheitsbezogene Angabe einer Zulassung, d. h. das Kennzeichen stellt im Grunde nur eine vom Wortlaut der Zulassung abgedeckte Variante der jeweiligen gesundheits- oder nährwertbezogenen Angabe dar. 75 Kennzeichen als spezifische health claims In den meisten Fällen werden sich Kennzeichen aber als unspezifische gesundheitsbezogene Angaben3 (siehe hierzu die Kommentierung bei Art. 2 Rrn. 25) oder als nährwertbezogene Angabe darstellen. Auch dann muss ein inhaltlicher Bezug zwischen beigefügter Angabe und dem Bedeutungsgehalt des Kennzeichens bestehen. 76 unspezifische Claims Bei Kennzeichen mit einem sehr schwachen Bedeutungsgehalt sind die Anforderungen noch geringer. Denn worin sollte der spezifische inhaltliche Zusammenhang zwischen einer Marke wie z. B. „Gesundform“ und einem beigefügten Claim bestehen. Ein ausreichender Zusammenhang ist dann bereits anzunehmen, wenn die beigefügte Angabe die ggf. auch nur assoziierte Aussage der Marke unterstützt. 77 nicht immer inhaltlicher Zusammenhang erforderlich II.4.3 Strengeres Verbraucherleitbild als bei Art. 10 Abs. 3 VO Ein wesentlicher Unterschied zwischen den Regelungen der Art. 1 Abs. 3 VO und 10 Abs. 3 VO besteht allerdings. Während Art. 10 Abs. 3 VO darauf abstellt, ob unspezifische gesundheitsbezogene Angaben, die auf die Gesundheit im Allgemeinen oder das gesundheitsbezogene Wohlbefinden abstellen, verwendet werden, erfasst Art. 1 Abs. 3 VO alle Handelsmarken, Markennamen oder Phantasiebezeichnungen, die als nährwert- oder gesundheitsbezogene Angabe „aufgefasst werden können“. Es kommt demnach bei einer kenn3 78 anders als Art. 10 Abs. 3 VO siehe auch Meisterernst, ZLR 2012, 652, 655 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 3 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 zeichenmäßigen Angabe nur darauf an, ob Verbraucher das verwendete Kennzeichen möglicherweise in diesem Sinne verstehen. 79 Beifügen im jeweiligen Medium 79a räumliche Anordnung Beifügen Auch hinsichtlich des „Beifügens“ weicht die Vorschrift des Art. 1 Abs. 3 VO von der des Art. 10 Abs. 3 VO ab. Bei der Verwendung von Markennamen, Handelsmarken oder Phantasiebezeichnungen müssen die zugelassenen nährwert- oder gesundheitsbezogenen Angaben jeweils in dem gleichen Medium beigefügt werden, in dem die betreffenden Kennzeichen verwendet werden. Ausdrücklich sieht Art. 1 Abs. 3 VO nämlich vor, dass das Beifügen in „der betreffenden Kennzeichnung, Aufmachung oder Werbung“ zu erfolgen hat. Dementsprechend ist bei Verwendung von Marken mit Gesundheitsbezug z. B. in der TV-Werbung die zugelassene gesundheitsbezogene Angabe, die den Gebrauch der Marke rechtfertigt, beizufügen. Dies kann in Ton oder durch Einblendung eines Texts erfolgen. Gleiches gilt bei Marken, die als nährwertbezogene Angabe verstanden werden können. Wie der Begriff des „Beifügens“ auszulegen ist, ist nicht weiter geregelt. Eine bestimmte räumliche Beziehung zwischen der Handelsmarke, Marke oder Phantasiebezeichnung und der beigefügten Angabe bei Verwenden auf einer Packung wie z. B. Anbringen im gleichen Sichtfeld ist nicht vorgeschrieben. In einem Durchführungsbeschluss der Kommission vom 24. Januar 20134 wurde zwar für die Regelung des Art. 10 Abs. 3 HCV die Leitlinie aufgestellt, dass das Beifügen „neben oder unter“ der jeweiligen Angabe erfolgen soll. Dies ist jedoch auf die Verwendung von Kennzeichen nicht übertragbar. 4 Durchführungsbeschluss der Kommission vom 24. Januar 2013 zur Annahme von Leitlinien zur Umsetzung der in Artikel 10 der Verordnung (EG) Nr. 1924/2006 des Europäischen Parlaments und des Rates dargelegten speziellen Bedingungen für gesundheitsbezogene Angaben, ABl. L 22 vom 25.1.2013, S. 25 ff. 4 Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 © Behr's Verlag, Hamburg II.4.4 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 © Behr's Verlag, Hamburg II.5 Ausnahme für allgemeine Bezeichnungen Art. 1 Abs. 4 VO enthält besondere Vorschriften für allgemeine Bezeichnungen, die herkömmlicherweise zur Angabe einer Eigenschaft, einer Kategorie von Lebensmitteln oder Getränke verwendet werden, die Auswirkungen auf die menschliche Gesundheit haben können1. Die Regelung ist auf Betreiben des Europäischen Parlaments in den ursprünglichen Entwurf eingeführt worden. Korrespondierend ist Erwägungsgrund Nr. 5 aufgenommen worden, der den Zweck der Regelung näher erläutert. Danach handelt es sich bei den allgemeinen Bezeichnungen, die mit der Vorschrift gemeint sind, um traditionelle Angaben mit Gesundheitsbezug wie z.B. „Digestiv“ oder „Hustenbonbon“. Die Regelung bezieht sich unmittelbar nur darauf, dass Abs. 3 für derartige Angaben nicht anwendbar ist; dementsprechend könnte eine derartige Bezeichnung auch ohne beigefügte zugelassene Angabe verwendet werden. Faktisch ist aber der Ausschluss aus dem Anwendungsbereich der VO gewollt.2 80 traditionelle Angaben Im Umkehrschluss ergibt sich aus der Regelung, dass diese allgemeinen Bezeichnungen unter den Begriff der gesundheitsbezogenen Angabe fallen können (siehe hierzu die Kommentierung bei Art. 2 Ziff. 5 VO). Ob allerdings die angeführten Beispiele gut gewählt waren, muss bezweifelt werden. Denn die Bezeichnung als „Hustenbonbon“ wäre als Verkehrsbezeichnung im Sinne des § 4 Abs. 1 Ziff. 1 LMKV vom Begriff der Angabe gemäß Art. 2 Abs. 2 Ziff. 1 VO nicht umfasst und würde mithin an sich dem Anwendungsbereich der Verordnung nicht unterliegen. Ob eine Bezeichnung als „Digestiv“ eine gesundheitsbezogene Angabe im Sinne des Art. 2 Ziff. 1 1 2 Siehe hierzu ausführlich Hüttebräuker, PharmaR Sonderheft 2012, 25 ff. so auch Loosen, ZLR 2006, 521, 528 Praxiskommentar Health & Nutrition Claims, 21. Akt-Lfg. 11/13 1 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 Für solche eine Gattung kennzeichnende Angaben kann dennoch – unabhängig davon, ob die Voraussetzungen für eine Aufnahme in die Liste gemäß Art. 13 VO oder auch für die einzelne Zulassung gemäß Art. 15 ff. VO bestehen – eine Ausnahme von Art. 1 Abs. 3 VO vorgesehen werden. Ein diesbezüglicher Antrag kann von jedermann, insbesondere Unternehmen oder Verbänden gestellt werden, nachdem diesbezüglich Einschränkungen bei der Antragstellung nicht geregelt sind oder bestehen. Der Antrag ist gemäß Art. 1 Abs. 4 Satz 2 VO an die zuständige nationale Behörde eines Mitgliedstaats zu richten, die den Antrag an die Kommission weiterleitet. Die Entscheidung über den Antrag erfolgt im Verfahren des Art. 25. 81 ergänzende Regelung Zur Durchführung hat die Kommission gemäß Art. 1 Abs. 4 VO die VO (EU) Nr. 907/2013 zur Festlegung von Regeln für Anträge auf Verwendung allgemeiner Bezeichnungen erlassen (abgedruckt in A I 1.4). 3 So EuGH, U.v. 6. September 2012, Rs. C-544/10, ZLR 2012, 602 sowie BVerwG, U.v. 14. Februar 2013, 3 C 23.12, LRE 65, 208. 2 Praxiskommentar Health & Nutrition Claims, 21. Akt-Lfg. 11/13 © Behr's Verlag, Hamburg 5 VO darstellt, ist gleichfalls fraglich (siehe hierzu die dortige Kommentierung). Wäre diese Angabe etwa ebenso wie „bekömmlich“ 3 oder „die Verdauung fördernd“ zu verstehen, wäre sie als unspezifische gesundheitsbezogene Angabe (siehe hierzu die Kommentierung bei Art. 10 Rn. 22 ff.) für alkoholische Getränke gemäß Art. 4 Abs 3 VO verboten. Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 © Behr's Verlag, Hamburg II.6 Verhältnis zu weiteren Bestimmungen des Gemeinschaftsrechts Die Verordnung gilt „unbeschadet“ der in Buchst. a bis c des Art. 1 Abs. 5 VO genannten Vorschriften, nämlich der RL 89/398/EWG1 und der auf dieser Grundlage erlassenen Richtlinien („diätetische Lebensmittel“), der RL 80/777/EWG („Mineralwasser“), der RL 98/83/EG („Wasser für den menschlichen Gebrauch“) sowie der RL 2002/46/EG („Nahrungsergänzungsmittel“). Mit der Formulierung, dass die Verordnung „unbeschadet“ dieser Bestimmungen gelten soll, meint der europäische Gesetzgeber regelmäßig, dass die Verordnung auf die von den genannten Richtlinien erfassten Produkte grundsätzlich anwendbar ist, soweit dort nicht spezielle Tatbestände geregelt sind.2 Soweit demnach die genannten Richtlinien Bestimmungen über nährwert- und gesundheitsbezogene Angaben enthalten, sind die dortigen Regelungen vorrangig.3 82 „unbeschadet“ Nicht angesprochen ist in Art. 1 Abs. 4 VO das Verhältnis zwischen den Bestimmungen der Verordnung und weiteren Vorschriften der VO (EG) 178/2002 („Basisverordnung“), der VO (EG) 258/97 sowie der VO (EG) 1829/2003 und VO (EG) 1830/2003 („Rückverfolgbarkeit, Zulassung und Kennzeichnung von GVO“), der VO (EWG) 2092/91 („ökologischer Landbau“) sowie der RL 2000/13/EG („Etikettierung“) sowie weiterer spezifischer Etikettierungsvorschriften wie z.B. der VO (EG) 608/2004 über die Etikettierung von Lebensmitteln mit Phytosterinen und Phytostanolen. Auch das Verhältnis zur RL 90/496/EWG über die Nährwertkennzeichnung von Lebensmitteln ist - erstaunlicherweise nicht geregelt. 83 nicht genannte Vorschriften 1 Zwischenzeitlich neu gefasst durch RL 2009/39/EG 2 so auch Rathke, in: Zipfel/Rathke, Lebensmittelrecht, C 111, Art. 1 Rnr. 26 3 so jetzt auch das „Guidance Document“ des ständigen Lebensmittelausschusses, abgedruckt in „Empfehlungen und Materialien“ Praxiskommentar Health & Nutrition Claims, 13. Akt-Lfg. 04/11 1 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 84 gemäß RL erforderliche Angaben RL 89/398/EWG und Richtlinien, die über Lebensmittel erlassen werden, die für besondere Ernährungszwecke bestimmt sind Ausdrücklich genannt ist die EWG-Richtlinie für Lebensmittel zur besonderen Ernährung4, die zwischenzeitlich durch RL 2009/39/EG neu gefasst wurde. Zu den aufgrund dieser Rahmen-Richtlinie erlassenen weiteren Richtlinien gehört die Richtlinie über kalorienarme Lebensmittel RL 96/8/EG, die EG-Säuglingsnahrungs-Richtlinie RL 2006/141/EG, die Beikost-Richtlinie RL 2006/125/EG, die Richtlinie über diätetische Lebensmittel für besondere medizinische Zwecke RL 1999/21/EG sowie die EG-Richtlinie über Nährstoffe zu besonderen Ernährungszwecken RL 2001/15/EG. Soweit dort spezielle Regelungen bezüglich der Bewerbung oder Kennzeichnung von diätetischen Lebensmitteln getroffen wurden, gehen sie den Vorschriften der Verordnung vor. Dies gilt insbesondere für die Kennzeichnung als diätetisches Lebensmittel gemäß Art. 2 RL 2009/39/EG sowie für die Angaben gemäß Art. 7 Abs. 2 bis 4 RL 2009/39/EG über die Angabe der besonderen nutritiven Eigenschaften des diätetischen Lebensmittels sowie die verschiedenen spezifischen Bestimmungen der auf der Grundlage der RahmenRichtlinie erlassenen Einzelrichtlinien5 (siehe hierzu nachfolgend Rn. 91, 91a). Die Angaben des Anhangs bezüglich nährwertbezogener Angaben und der Bedingungen für ihre Verwendung gelten auch für diätetische Lebensmittel, soweit hierfür spezifische Bestimmungen in den Richtlinien fehlen. Soweit z. B. Art. 5 RL 2009/39/EG für den Natriumgehalt sowie die Glutenfreiheit spezielle Vorschriften vorsieht, gehen diese vor. Dies ergibt sich auch aus Erwägungsgrund 22. 4 siehe hierzu allgemein Mettke, ZLR 2007, 661 5 so heißt es hierzu auch im Guidance Document, abgedruckt in „Empfehlungen und Materialien” „Mandatory elements in the labelling, the presentation or the advertising of foods for special dietary uses required by Directive 89/398/EEC or by the specific PARNUTS Directives adopted on the basis of Directive 89/398/EEC, to describe the particular nutritional characteristics of these foods ort he purpose for which they are intended are of course outside the scope of Regulation 1924/2006.“ 2 Praxiskommentar Health & Nutrition Claims, 13. Akt-Lfg. 04/11 © Behr's Verlag, Hamburg II.6.1 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 © Behr's Verlag, Hamburg Die Regelung des Art. 1 Abs. 5 VO nimmt Bezug auf europäische Richtlinien, die noch der Umsetzung in nationales Recht bedurften. Nachdem den Richtlinien an sich keine unmittelbare Wirkung in den Mitgliedstaaten zukommt, ist die Bezugnahme auf diese Regelungen in einer unmittelbar geltenden europäischen Verordnung dogmatisch nicht geglückt. Im Ergebnis soll damit auf die jeweiligen nationalen Vorschriften, die der Umsetzung der in Bezug genommenen Richtlinien dienen, verwiesen werden. Dementsprechend sind die speziellen Vorschriften der DiätV vorrangig, soweit diese der Umsetzung der in Bezug genommenen europäischen Richtlinien dienen. 85 RL oder DiätV Da sowohl die Rahmen-RL 2009/39/EG als auch die weiter genannten Einzelrichtlinien teilweise sehr spezifische Bestimmungen hinsichtlich der Zusammensetzung, aber auch Bewerbung/Kennzeichnung der jeweilige Lebensmittel treffen, ist das Verhältnis zwischen den Regelungen der Verordnung und den Vorschriften über diätetische Lebensmittel komplex. Wie bereits dargelegt (Rnr. 70c) gilt die VO wohl nicht für Angaben gegenüber Fachkreisen im Sinne des § 12 Abs. 2 LFGB. Das allgemeine Verbot krankheitsbezogener Bewerbung von Lebensmitteln ergibt sich aus Art. 2 Abs. 3 RL 2001/13/EG („Etikettierungs-Richtlinie“). Diese Vorschrift gilt allerdings nicht für Lebensmittel für besondere Ernährungszwecke. Das Verbot der krankheitsbezogenen Bewerbung von diätetischen Lebensmitteln ergab sich aus der wesentlich älteren Vorschrift des Art. 6 Abs. 1 RL 89/398/EWG (jetzt Art. 8 Abs. 1 RL 2009/39/EG), die bezüglich der Kennzeichnung, Aufmachung und Bewerbung regelt, dass einem diätetischen Produkt keine Eigenschaften zur Vorbeugung, Behandlung oder Heilung einer menschlichen Krankheit zugeschrieben oder auf diese Eigenschaften hingewiesen werden darf. 86 Verbot krankheitsbezogener Werbung In einer Ausnahme hiervon sieht Art. 8 Abs. 2 RL 2009/39/EG vor, dass dieses Verbot bestimmten Angaben nicht entgegensteht, nämlich „zweckdienlichen Angaben oder Empfehlungen, die ausschließlich für qualifizierte Personen auf dem Gebiet der Medizin, der Ernährung und der Arzneimittel bestimmt sind“. Die Vorschrift des Art. 8 Abs. 2 RL 2009/39/EG ist somit eine spezielle Regelung und vorrangig gegenüber den Vorschriften der 87 Ausnahme des Art. 8 Abs. 2 RL 2009/39/EG Praxiskommentar Health & Nutrition Claims, 19. Akt.-Lfg. 02/13 3 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 88 zweckdienliche Angaben gegenüber Fachkreisen Die Richtigkeit dieser Auffassung ergibt sich auch aus einer weiteren Verweisungskette. Die Verordnung selbst regelt den Bereich der krankheitsbezogenen Bewerbung nicht, soweit sie nicht bezüglich der Angaben über die Reduzierung eines Krankheitsrisikos einen Teilbereich der bislang verbotenen krankheitsbezogenen Werbung unter bestimmten Voraussetzungen nach einem Zulassungsverfahren erlaubt. Wie Art. 14 Abs. 1 VO zeigt, werden derartige Angaben grundsätzlich ungeachtet des weiterhin vorrangigen Verbots der krankheitsbezogenen Bewerbung aus der RL 2000/13/EG zugelassen, d. h. der Gesetzgeber geht insoweit davon aus, dass es grundsätzlich bei dem Verbot der krankheitsbezogenen Bewerbung aus Art. 2 RL 2001/13/EG verbleibt. Eine Bezugnahme auf die RL 2009/39/EG findet sich in der Vorschrift des Art. 14 Abs. 1 VO hingegen nicht. Nachdem für den Bereich der krankheitsbezogenen Bewerbung mit Ausnahme der Angaben über die Reduzierung eines Krankheitsrisikos es demnach bei den weiteren Regelungen verbleibt und insoweit die Ausnahme des Art. 8 Abs. 2 der RL 2009/39/EG eingreift, sind diesbezügliche zweckdienliche Angaben oder Empfehlungen gegenüber Fachkreisen unabhängig von der weiteren Frage der generellen Anwendbarkeit der VO auf Werbung gegenüber Nichtverbrauchern (siehe hierzu Rnr. 64 ff.) zulässig. Ein Beispiel wäre hier die Angabe „zur Behandlung von Erkrankungen des rheumatischen Formenkreises“ als Werbung für eine ergänzende bilanzierte Diät in einer Fachzeitschrift für Apotheker. Wenn aber derartige krankheitsbezogene Angaben im engeren Sinne, die regelmäßig wesentlich stärkere Aussagen enthalten, als bloße Angaben bezüglich der Reduzierung eines Krankheitsrisikos, gegenüber Fachkreisen erlaubt sind, würde es einen Wertungswiderspruch darstellen, die zweckdienliche Angabe oder Empfehlung bezüglich der Reduzierung eines Krankheitsrisikos oder weitere gesundheitsbezogene Angaben gegenüber Fachkreisen bei diätetischen Lebensmitteln 6 4 so auch Rathke, in: Zipfel/Rathke, Lebensmittelrecht, C 111, Art. 1 Rnr. 26 Praxiskommentar Health & Nutrition Claims, 19. Akt-Lfg. 02/13 © Behr's Verlag, Hamburg Verordnung, 6 allerdings lediglich hinsichtlich „zweckdienlichen Angaben oder Empfehlungen“ gegenüber Fachkreisen. Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 © Behr's Verlag, Hamburg nicht zu erlauben. Zweckdienliche gesundheitsbezogene Angaben gegenüber Fachkreisen unterliegen demnach bei diätetischen Lebensmitteln keinesfalls der VO. Als weitere spezifische Vorschrift, die den Regelungen der Verordnung vorgeht, ist insbesondere die Vorschrift des Art. 1 Abs. 2 Buchst. a RL 2009/39/EG zu nennen. Danach müssen Lebensmittel, die für eine besondere Ernährung bestimmt sind, sich „aufgrund ihrer besonderen Zusammensetzung oder des besonderen Verfahrens ihrer Herstellung deutlich von den Lebensmitteln des allgemeinen Verzehrs unterscheiden“, „sich für den angegebenen Ernährungszweck eignen“ und „mit dem Hinweis darauf in den Verkehr gebracht werden, dass sie für diesen Zweck geeignet sind“. Angaben bezüglich des besonderen Ernährungszwecks eines diätetischen Lebensmittels (wie z.B. „für Diabetiker geeignet“) unterliegen daher nicht den Vorschriften der Verordnung.7 89 besonderer Ernährungszweck Entsprechendes gilt für spezielle Etikettierungsvorschriften gemäß § 21 DiätV wie z. B. bezüglich der Etikettierung von vollständigen und ergänzenden bilanzierten Diäten. 90 Etikettierungsvorschriften Bei der Beurteilung der Frage, ob die vorstehend beispielhaft genannten speziellen Vorschriften für diätetische Lebensmittel den Regelungen der Verordnung vorgehen, ist aber jeweils in Betracht zu ziehen, ob es sich bei den zu beurteilenden Angaben auf der Verpackung, in der Aufmachung oder der Bewerbung tatsächlich um Angaben im Sinne der jeweiligen speziellen Vorschrift handelt, oder um darüber hinausgehende, allgemeine Werbeaussagen und anpreisungen. Allerdings ist für die Kennzeichnung, Aufmachung und Bewerbung diätetischer Produkte von einem größeren Spielraum auszugehen. Darstellungen des besonderen Ernährungszwecks sind nicht als dem Anwendungsbereich der VO unterliegende Werbeaussagen einzustufen. Denn gesetzlich vorgeschriebene Angaben sind bereits als „obligatorisch“ vom Begriff der Angabe gem. Art. 2 Abs. 7 91 gesetzlich vorgeschriebene Angaben? 91a zweckdienliche Angaben so auch Loosen, ZLR 2006, 521, Mettke ZLR 2007, 661 Praxiskommentar Health & Nutrition Claims, 13. Akt-Lfg. 04/11 5 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 II.6.2 92 Mineralwasser 6 RL 80/777/EWG Hinsichtlich des grundsätzlichen Verhältnisses der Vorschriften der Verordnung zu der Richtlinie über die Gewinnung von und der Behandlung mit natürlichen Mineralwässern wird auf die vorstehenden Ausführungen unter Rnr. 82 verwiesen. Soweit in der dortigen Richtlinie bzw. in den bundesdeutschen Umsetzungsakten, nämlich der Mineral- und Tafelwasserverordnung spezielle Vorschriften für gesundheitsbezogene und nährwertbezogene Angaben bestehen, gehen diese den Vorschriften der Verordnung vor. Dies betrifft insbesondere die Bezeichnung als „Mineralwasser“ gemäß Art. 1 Abs. 1 RL, den Angaben bezüglich der Zusammensetzung gemäß Art. 7 Abs. 2 a RL und speziellen krankheitsbezogenen Angaben gemäß Art. 9 Abs. 2 Buchst. c RL. Als speziell anzusehen sind auch Angaben über die Eignung als natürliche Mineralwasser für die Säuglingsernährung gemäß Art. 9 Abs. 3 RL sowie die Angaben gemäß Anhang 3 zur RL 80/777/EWG. Ergänzend wird auf die Kommentierung bei Art. 8 VO verwiesen. Praxiskommentar Health & Nutrition Claims, 13. Akt-Lfg. 04/11 © Behr's Verlag, Hamburg 2 Ziff. 1 VO (siehe hierzu die Kommentierung bei Art. 2 Rn. 13) ausgenommen. Hätte der Gesetzgeber nur Pflichtangaben vom Anwendungsbereich der VO ausnehmen wollen, wäre die Nennung der Rahmenrichtlinie 2009/39/EG in Art. 1 Abs. 5 der VO überflüssig gewesen. Diese Regelung sollte daher offenbar auch Angaben, die keine Pflichtangaben sind, aber der Erläuterung der diätetischen Zweckbestimmung dienen, vom Anwendungsbereich der HCV ausnehmen. Zur Abgrenzung kann im Einzelfall der Begriff der zweckdienlichen Angabe gem. Art. 8 Abs. 2 RL 2009/39/EG zur Abgrenzung herangezogen werden, d. h. derartige zweckdienliche Angaben sollten nicht dem Anwendungsbereich der VO unterliegen (siehe hierzu Rnr. 88). Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 II.6.3 RL 98/83/EG Die RL 98/83/EG über die Qualität von Wasser für den menschlichen Gebrauch wurde mit der Trinkwasserverordnung in bundesdeutsches Recht umgesetzt. Hinsichtlich des grundsätzlichen Verhältnisses zwischen der Verordnung sowie den nationalen Rechtsvorschriften wird auf die oben stehenden Ausführungen unter Rnr. 82 verwiesen. Grundsätzlich sind die Bestimmungen der bundesdeutschen Trinkwasserverordnung vorrangig, soweit diese auf der Regelung der Richtlinie beruhen. © Behr's Verlag, Hamburg II.6.4 RL 2002/46/EG Die Vorschriften der Verordnung gelten unbeschadet der RL 2002/46/EG. Bezüglich des grundsätzlichen Verhältnisses, siehe die vorstehenden Rnr. 82. Im Ergebnis bedeutet dies jedenfalls, dass die Vorschriften der bundesdeutschen NemV vorrangig sind, soweit sie auf den Vorschriften der RL 2002/46/EG beruhen und spezielle Regelungen bezüglich nährwertbezogenen und/oder gesundheitsbezogenen Angaben enthalten. Dies gilt insbesondere für die Kennzeichnungsvorschriften des Art. 6 RL, der Mengenangaben und Beschreibung der Angaben gemäß Art. 8 und 9 RL. Soweit nach Art. 5 RL zukünftig Höchstmengen und Mindestmengen für Nährstoffe festgesetzt werden, wären diese gleichfalls vorrangig. II.6.5 93 Trinkwasser 94 Nahrungsergänzungsmittel Weitere Bestimmungen Das Verhältnis der Verordnung zu einer Reihe weiterer Vorschriften wird in Art. 1 Abs. 5 nicht weiter behandelt, insbesondere auch nicht zur VO (EG) 258/97 (Novel-Food-VO – NVO). Dies ist insbesondere auffällig, da in einem Verfahren auf Zulassung von Phytosterolen gemäß NFV in Streichfetten letztendlich die Anforderungen an die Zulassung einer im Grenzbereich zwischen gesundheits- und krankheitsbezogen angesiedelten Angabe erstmals durchexerziert wurde. Der in diesem Verfahren an den Antragsteller mit Entscheidung Praxiskommentar Health & Nutrition Claims, 13. Akt-Lfg. 04/11 95 Novel-FoodVerordnung 7 Kapitel 1 – Gegenstand, Anwendungsbereich und Begriffsbestimmungen Artikel 1 96 VO (EG) 608/2004 Phytosterole Mittlerweile ist die Etikettierung von Produkten mit Phytosterolen, Phytosterinester, Phytostanol und Phytostanolester in der VO (EG) 608/2004 eigens geregelt. Die dort in Art. 2 aufgenommene Etikettierungsvorschriften sind auch als speziell gegenüber den Vorschriften der Verordnung anzusehen. 97 Parallelverfahren Dementsprechend sollte es möglich sein, gleichzeitig mit der Antragstellung auf Zulassung eines Stoffes als Novel Food zugleich Angaben bezüglich der besonderen Nährstoffeigenschaften oder der gesundheitlichen Wirkungen des Stoffes zur Genehmigung zu stellen. Auch die Kommission geht bislang gemäß den Ausführungen im „Guidance Document“8 von einer parallelen Anwendbarkeit beider Zulassungsverfahren aus. 98 zwingende Angaben Bei der Beurteilung des Verhältnisses zwischen den Regelungen der VO und anderen Vorschriften ist dabei stets zu beachten, dass gemäß Art. 2 Abs. 2 Ziff. 1 nur diejenigen Angaben den Vorschriften der Verordnung unterliegen, die nach dem Gemeinschaftsrecht und den nationalen Vorschriften nicht obligatorisch sind. Zwingende Etikettierungsvorschriften im Sinne der VO (EG) 608/2004 sind demnach keine Angaben im Sinne der Verordnung und unterliegen den dortigen weiteren Bedingungen nicht. Das Gleiche gilt für die zwingende Nährwertkennzeichnung von Lebensmitteln gemäß RL 90/496/EWG bzw. deren Umsetzung in der Nährwert-Kennzeichnungsverordnung sowie weitere zwingende Vorschriften der VO (EWG) 2092/91 über den ökologischen Landbau sowie die allgemeinen Etikettierungsvorschriften der RL 2000/13/EG (siehe die weitere Kommentierung bei Art. 2 Abs. 2 Ziff. 1 VO). 8 „Request for authorisation of novel foods shall be submitted through Regulation (EC) No. 258/97. Any request for a claim relating to a novel food for wish or request for authorisation has been submitted shall be made separately and in accordance with the provisions of Regulation (EC) No. 1924/2006 on claims.” 8 Praxiskommentar Health & Nutrition Claims, 13. Akt-Lfg. 04/11 © Behr's Verlag, Hamburg 2000/500/EG als Auflage festgesetzte Pflichthinweis, dass das Produkt für Personen bestimmt ist, die den Cholesterinspiegel im Blut senken wollen, wurde aufgrund der vom Antragsteller vorgelegten wissenschaftlichen Nachweise in die Entscheidung aufgenommen.