Bundesrealgymnasium Imst Chemie 2010
Werbung

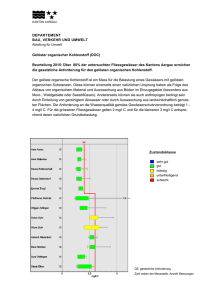
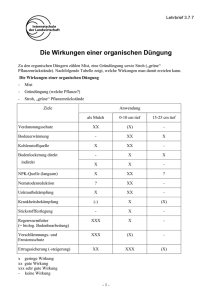
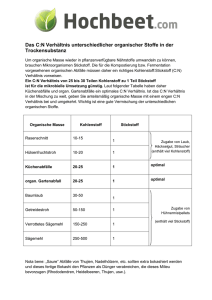
Bundesrealgymnasium Imst Chemie 2010-11 Klasse 8 Kohlenstoffchemie Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet wird, als dies im Skriptum der Fall ist. Ergänzungen zum Skriptum können während des Unterrichts durchgeführt werden. In diesem Skriptum sind nur wenige Diagramme und Zeichnungen enthalten. Die fehlenden Diagramme werden im Unterricht erarbeitet. Inhalt 1 Kohlenstoffchemie ............................................................................................................ 2 1.1 Einführung in die organische Chemie ........................................................................ 2 1.1.1 Die besondere Stellung des Kohlenstoffs im Periodensystem ............................. 2 1.1.2 Modifikationen ..................................................................................................... 3 1.2 Allgemeine Grundlagen der organischen Chemie ..................................................... 3 1.2.1 Verbindungen ....................................................................................................... 3 1.2.2 Namen, Formeln und Strukturen .......................................................................... 4 1.2.3 Elektronische Effekte ........................................................................................... 4 1.2.4 Der Isomeriebegriff .............................................................................................. 5 1.2.5 Vergleich von anorganischen und organischen Verbindungen ............................ 5 1.2.6 Sonderstellung des Kohlenstoffs .......................................................................... 5 Chemie Klasse 8 1 Kohlenstoffchemie Kohlenstoffchemie 1.1 Einführung in die organische Chemie Die organische Chemie ist die Chemie der Kohlenstoffverbindungen. Organische Stoffe besitzen charakteristische Bindungen zwischen Kohlenstoff-Atomen Kohlenstoff Atomen untereinander und zwischen Kohlenstoff und Wasserstoff-Atomen. Wasserstoff Zu Beginn des 19. Jh. war man überzeugt, dass organischen Stoffen im Gegensatz nsatz zu anorganischen Stoffen eine zusätzliche Kraft innewohnt: die Lebenskraft. Aus diesem Grund sollte es eigentlich unmöglich sein, organische Stoffe aus anorganischen herzustellen, bis… Am 22.02.1828 schrieb Friedrich Wöhler an seinen Lehrer Jöns Jakob Berzelius: „… und muss Ihnen sagen, dass ich Harnstoff machen, ohne dazu Nieren oder überhaupt ein Thier, sey es Mensch oder Hund, nötig zu haben.“ Damit war die organische Chemie geboren! 1.1.1 Die besondere Stellung des Kohlenstoffs im Periodensystem Kohlenstoff ist das erste Element der vierten Hauptgruppe im PSE. Seine ElektronenschalenElektronenschalen konfiguration ist 1s²2s²2p². Von den vier Valenzelektronen sind im Grundzustand zwei im SS Orbital, welches damit voll besetzt ist. Die beiden anderen teilen sich auf zwei p-Orbitale p auf, die damit noch Platz für jeweils ein Elektron hätten. Ein drittes p-Orbital p Orbital bleibt ganz leer. Abb. 1-1: Elektronenschalenbesetzung eines Kohlenstoffatoms im Grundzustand (links) und im angeregten Zustand (rechts). Es liegt der Schluss nahe, dass Kohlenstoff energetisch unterschiedliche Bindungen ausbildet. ausbildet Man beobachtet aber (normalerweise) vier absolut gleichwertige Bindungen. Dies kann mit der Bildung von Hybridorbitalen erklärt werden. werden. Kohlenstoff tritt von einem energetischen Grundzustand in einen angeregten Zustand über. Dabei wird das 2s-Orbital 2s auf das Energieniveau des 2p-Orbitals Orbitals angehoben und ein Elektron des 2s-Orbitals 2s Orbitals in das bisher unbesetzte 2p-Orbital Orbital übertragen. Damit stehen einem C-Atom C Atom vier Bindungen zur Verfügung, die sich tetraedrisch ausrichten und eine ausgeglichenen räumliche Struktur bilden. Andere Elemente, die ebenfalls Hybridorbitale bilden, besetzen zusätzlich noch das d-Orbital, d was zu abweichenden Raumstrukturen führt. Einem C-Atom C Atom stehen keine d-Orbitale d zur Verfügung. Dr. K.-H. Offenbecher Seite 2 Chemie Klasse 8 Kohlenstoffchemie 1.1.2 Modifikationen Polymorphie ist in den Werkstoffwissenschaften und der Mineralogie die Eigenschaft, dass eine Substanz in verschiedenen Erscheinungsformen (Modifikationen) vorkommen kann. Diese sind aus den gleichen Atomen aufgebaut, unterscheiden sich aber in der räumlichen Anordnung ihrer Struktur und haben somit unterschiedliche Eigenschaften. Unterschiedliche Gitterstrukturen können sich durch Einflüsse wie Druck und/oder Temperatur bilden. Elementarer Kohlenstoff existiert in drei Modifikationen, basierend auf den Bindungsstrukturen sp3 und sp2: Diamant, Graphit und Fulleren. Abb. 1-2: Erscheinungsformen elementaren Kohlenstoffs. a) Diamant; b) Graphit; d) Buckminster Fullerene. Diamant: besteht aus einer dreidimensionalen Raumnetzstruktur, in der jedes Kohlenstoffatom mit vier anderen C – Atomen kovalent verknüpft ist. Graphit: Ein Graphitkristall ist aus ebenen Schichten aufgebaut, in denen regelmäßige Sechsecke in einer Art Bienenwabe verknüpft sind. Die parallel gestapelten Schichten werden durch schwache (London‘sche) Kräfte zusammengehalten. Fullerene: Seit Anfang der 1990er ist eine dritte Kohlenstoff Modifikation bekannt. Robert Curl entdeckte die Fullerene, zuerst das so genannte Buckminsterfulleren, es besteht aus 60 Kohlenstoffatomen, die ein innen hohles Polyeder bilden. Die Außenflächen des Polyeders werden fünf- und sechseckigen Seitenflächen gebildet. An allen Eckpunkten befinden sich Kohlenstoffatome. Inzwischen sind Fullerene mit 70 und mehr C –Atomen bekannt. 1.2 Allgemeine Grundlagen der organischen Chemie 1.2.1 Verbindungen Alle organischen Verbindungen enthalten das Element Kohlenstoff. Allerdings werden nicht alle Kohlenstoffverbindungen zur organischen Chemie gerechnet. Oxide (CO, CO2), Carbide, Carbonate und Kohlensäure werden zur anorganischen Chemie gezählt. In fast allen organischen Stoffen kommt das Element Wasserstoff vor, weshalb die Stoffe auch als Kohlenwasserstoffe bezeichnet werden. Andere Elemente in einer org. Verbindung werden als Heteroatome bezeichnet. Zu den häufigsten Heteroatomen zählen die Halogene sowie Sauerstoff, Stickstoff, Schwefel und Phosphor. Metalle sind eher selten an organischen Dr. K.-H. Offenbecher Seite 3 Chemie Klasse 8 Kohlenstoffchemie Verbindungen beteiligt aber dennoch sehr wichtig. So würde es kein Hämoglobin ohne Eisen geben oder kein Chlorophyll ohne Magnesium. 1.2.2 Formeln, Namen und Strukturen Die Darstellung organischer Verbindungen ist aufgrund der großen Komplexität der meisten Verbindungen nicht ganz einfach. Drei Formelschreibweisen mit unterschiedlichem Informationsgehalt kommen zur Anwendung: Die Summenformel gibt die quantitative Zusammensetzung einer Verbindung mit den einzelnen Elementen an. Diese Schreibweise wird für stöchiometrische Berechnungen oder Molmassenbestimmungen benötigt. Summenformeln geben aber keinen Aufschluss über die innere Struktur einer Verbindung oder deren funktionelle Gruppen. z.B. Benzen: C6H6 In der vereinfachten Strukturformel werden die wichtigsten Bindungen sowie die funktionellen Gruppen dargestellt. z. B. Methanol: CH3 – OH Die ausführliche Strukturformel zeigt alle Bindungen zwischen den einzelnen Atomen und die freien Elektronenpaare an. z. B. Butan-1-ol: ol: Keine der drei genannten Formeln gibt Auskunft über die räumlichen Strukturen der Verbindungen. Aufgrund der tetraedrischen Koordination des Kohlenstoffatoms Kohlenstoffatoms ist die Darstellung schwierig. Für einfache Verbindung kann die Gerüst- bzw. die Skelettformel herangezogen werden. Dabei handelt es sich um eine vereinfachte vereinfachte Darstellung (Zick-Zack(Zick Struktur) des C-Skeletts Skeletts und der funktionellen Gruppen. H-Atome, C – H Bindungen und freie e- Paare werden weggelassen. Weiter Darstellungsformen sind die Sägebockschreibweise, die NewmanNewman-Projektion und die Fischer-Projektion. Um die Position von Mehrfachbindungen oder Funktionellen Gruppen werden die C-Atome C nach bestimmten estimmten Regeln durchnummeriert und mit Lokanten versehen. Das Kohlenstoffatom der funktionellen Gruppe wird als α–C – Atom bezeichnet. Enthält die funktionelle Gruppe selbst kein C – Atom ist das C1 - Atom auch das α – Atom. 1.2.3 Elektronische Effekte Das Reaktionsverhalten ktionsverhalten organischer Verbindungen wird im Wesentlichen durch zwei elektronische Effekte gesteuert. Die Wirkung eines Atoms oder einer Atomgruppe auf die Elektronenverteilung im Rest des Moleküls wird allgemein als induktiver Effekt (I-Effekt) bezeichnet. chnet. Er beruht auf Differenzen zwischen Elektronegativitäten EN benachbarter Atome oder Atomgruppen. Der induktive Effekt wird relativ zur EN des Wasserstoffatoms beurteilt. Beim +I-Effekt wird die Elektronendichte an der benachbarten Atomgruppe erhöht indem indem negative Ladung dorthin verschoben wird, beim –I-Effekt Effekt wird die Elektronendichte erniedrigt. Der mesomere Effekt (M-Effekt) Effekt) ist ebenfalls ein elektronischer Effekt, bei dem ein Heteroatom mit einem oder mehreren freien Elektronenpaaren auf die Elektronendichteverteilung onendichteverteilung im Molekül nimmt. Für das Molekül können mesomere Grenzformeln,, die Formalladungen aufweisen, formuliert werden. Der +M-Effekt +M erhöht die Elektronendichte im organischen Rest, der –M-Effekt verringert die Elektronendichte. Mesomerieeffekte treten immer an π-Elektronensystemen auf. Dr. K.-H. Offenbecher Seite 4 Chemie Klasse 8 Kohlenstoffchemie Effekts (links und des –M-Effekts Effekts (rechts) auf einen Benzenring als organischen Abb. 1-3: Wirkung des +M-Effekts Rest. 1.2.4 Der Isomeriebegriff Als Isomerie bezeichnet man die Erscheinung, dass Stoffe trotz gleicher Summenformel unterschiedliche physikalische und chemische Eigenschaften aufweisen. Ist die Isomerie auf unterschiedliche Atomverkettung zurückzuführen, spricht man von Strukturisomerie. Unterscheiden den sich die Isomere nur durch ihren räumlichen Aufbau, bezeichnet man dies als Stereoisomere. 1.2.5 Vergleich von anorganischen und organischen Verbindungen Das unterschiedliche chemische Verhalten lässt sich durch die unterschiedlichen Bindungsverhältnisse erklären: lären: Anorganische Verbindungen bestehen hauptsächlich aus Ionenbindungen Organische Moleküle sind durch Elektronenpaarbindung kovalent verknüpft. Beispiel: Das in Salzen als Chlorid Ion enthaltene Chlor kann als AgCl ausgefällt werden. Beim kovalent gebundenen undenen Chlor in organischen Verbindungen ist das nicht möglich NaCl + AgNO3 AgCl(Niederschlag) + NaNO3 CH3-CH2-Cl + AgNO3 keine Reaktion 1.2.6 Sonderstellung des Kohlenstoffs Die besonderen Eigenschaften des Kohlenstoffes lassen sich aus seiner Stellung im i Periodensystem ableiten. Im Vergleich mit einfachen Molekülen der benachbarten Atome Bor und Stickstoff zeigt sich, dass im Gegensatz zum neutralen Methanmolekül BF3 eine Lewis – Säure (Elektronenlücke) und NH3 eine Lewis – Base (zusätzliches Elektronenpaar) Elektronenp ist. Die Moleküle sind zwar neutral aber koordinativ nicht abgesättigt. Sie haben das Bestreben ein weiteres Teilchen anzulagern und bilden dabei Ionen. Würde man aus den Elementen Bor und Stickstoff Ketten bilden, erhält man entweder eine Reihe benachbarter chbarter koordinativ ungesättigter Zentren oder Ladungsanhäufungen. In beiden Fällen sind diese Ketten nicht stabil. Als benachbartes Element in der 4. Hauptgruppe unterscheidet sich aber auch Silizium vom maximal vierbindigen Kohlenstoff. Silizium kann Verbindungen Verbindungen mit der Koordinationszahl 6 bilden. Im Gegensatz zum unvollständig besetzten Elektronenniveau des Kohlenstoffs (n = 2) stehen dem Silizium (n = 3) neben des ss und p – Orbitalen auch noch die d – Orbitale zur Verfügung. Diese können Elektronen von von weiteren Teilchen aufnehmen. Dabei entstehen koordinativ gesättigte aber elektrisch geladene Komplex-Ionen. Komplex Kohlenstoff hat nicht die Möglichkeit d – Orbitale zu besetzten. Si-Si Si Bindungen sind auch schwächer als C-C C Bindungen. Dafür sind Si-O Si Bindungen stärker als C-O C Bindungen. Silizium eignet sich daher nicht sehr gut zum Aufbau von Si – Ketten und bildet bevorzugt SiSi O-Si-O… Ketten. Dr. K.-H. Offenbecher Seite 5 Chemie Klasse 8 Kohlenstoffchemie 1.2.7 Elementaranalyse Um die Zusammensetzung organischer Stoffe nicht nur qualitativ, sondern auch quantitativ angeben zu können, muss man das Mengenverhältnis der beteiligten Elemente feststellen. Diese Bestimmung bezeichnet man als Elementaranalyse. Sie wurde in ihren Grundzügen 1831 von Justus von Liebig entwickelt. Dem Österreicher Fritz Pregel verdanken wir die Entdeckung spezieller Techniken für die Elementaranalyse von sehr kleinen Stoffmengen. Er entwickelte 1910 die MikroElementaranalyse (Nobelpreis für Chemie 1923). Bei der Elementaranalyse wird eine genau gewogene Menge einer organischen Verbindung durch Oxidation zerlegt. Als Oxidationsmittel verwendet man Sauerstoff Beispiel: C6H12O6 6 O2 6 CO2 + 6 H2O Heute wird die Zusammensetzung einer organischen Verbindung mittels physikalischchemischer Methoden, wie z. B. Massenspektrometrie, ermittelt. Aufgaben 1. Was versteht man unter organischer Chemie? 2. Wie lässt sich die Vielzahl der organischen Verbindungen erklären? 3. Nennen Sie drei Dinge aus dem täglichen Leben, die der organischen Chemie zu verdanken sind! 4. Kann es ein Molekül aus 1C-, 1 H- und 1 N-Atom geben? Gehört es zur anorganischen oder organischen Chemie? 5. Was sind Heteroatome? Geben Sie 3 Beispiele dafür an! Durch welche Art der chemischen Bindung sind diese Elemente meist mit anderen Atomen verbunden? Dr. K.-H. Offenbecher Seite 6