PCR diagnostická souprava pro detekci kmenů - medac
Werbung

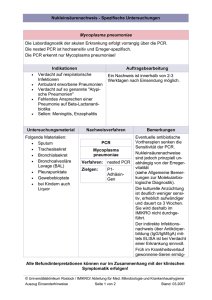
Mycoplasma pneumoniae PCR Kit Zur in-vitro Diagnostik Das Kit ist für den Einsatz in spezialisierten PCR-Laboratorien vorgesehen. Kit-Inhalt Kat.-Nr. Internal Standard zur Inhibitionskontrolle ist bereits im MasterMix enthalten MP/ISIN/025 MP/ISIN/050 MP/ISIN/100 25 Reaktionen 50 Reaktionen 100 Reaktionen MASTERMIX Mycoplasma pneumoniae Enthält ein separates Reaktionsgefäß Internal Standard zur Inhibitions- und Extraktionskontrolle MP/ISEX/025 MP/ISEX/050 MP/ISEX/100 25 Reaktionen 50 Reaktionen 100 Reaktionen 1 x 750 μl 2 x 750 μl 4 x 750 μl 1 x 750 μl 2 x 750 μl 4 x 750 μl 1 x 200 μl 1 x 200 μl 2 x 200 μl 1 x 200 μl 1 x 200 μl 2 x 200 μl - - - 1 x 1000 μl 1 x 1000 μl 2 x 1000 μl POSITIVE CONTROL Mycoplasma pneumoniae 102 copies/μl INTERNAL STANDARD Mycoplasma pneumoniae Lagerungs- und Transportbedingungen Die Transporttemperatur der Kits sollte -20°C bis -80°C betragen. Die Haltbarkeit des Kits beträgt bei korrekter Lagerung (-20°C) 12 Monate nach Herstellungsdatum. Wiederholtes Einfrieren und wieder Auftauen von MasterMix, Positive Control und Internal Standard führt zu verminderter Nachweisqualität. Daher wird empfohlen, den MasterMix in 30 µl Aliquots in PCR Reaktionsgefäße bei -20°C zu lagern. Positive Control und Internal Standard können bei 4°C gelagert werden. Hersteller: GeneProof a.s., Viniční 235, 615 00 Brno, Czech Republic Phone/Fax.: +420 543 211 679, e-mail: [email protected], www.geneproof.com Ausgabedatum: 4. Februar 2012 VERSION--02 Informationen zum Erreger Weltweit sind 20-50% aller atypischen Pneumonien auf Mycoplasma pneumoniae zurückzuführen. Es wird davon ausgegangen, dass M. pneumoniae auch ein Haupterreger der Ambulant Erworbenen Pneumonie (CAP) ist, besonders bei Kindern im Schulalter und jungen Menschen. Es wird auch über sporadisches Auftreten bei älteren und immungeschwächten Menschen berichtet. Trotz leichter Ansteckungsgefahr entwickeln nur ca. 3-20% der Infizierten eine Bronchopneumonie. Die meisten Infektionen verlaufen asymptomatisch oder mit leichten respiratorischen Beschwerden. Die Übertragung erfolgt überwiegend durch Tröpfcheninfektion. Die Inkubationszeit beträgt 2-3 Wochen, teilweise mit Anzeichen einer respiratorischen Erkrankung. Typische Symptome sind leichte Temperaturerhöhung, Mattigkeit, Husten oder eine verstopfte Nase. Charakteristisch für durch M. Pneumoniae verursachte atypische Pneumonien sind Erschöpfung und eindeutige Röntgenbefunde. Bei eindeutiger Mycoplasma-Diagnose ist mit komplikationsloser Therapie zu rechnen. Bei immungeschwächten Patienten kann die Infektion hingegen schwerwiegend verlaufen und sogar innerhalb kurzer Zeit zum Tode führen. Mycoplasmen sind auf mit Steroiden und Nukleinsäure-Vorstufen angereicherten Nährböden kultivierbar. Kulturen von Nasopharynxabstrichen oder Sputum werden aber aufgrund technisch schwieriger Kulturbedingungen und schlechter Erfolgsrate von maximal 60% selten angelegt. M. pneumoniae-Infektionen werden gewöhnlich mit serologischen Methoden (KBR, PAT oder ELISA) nachgewiesen. Bei der KBR gilt ein Titer von 1:64 als diagnostisch verdächtig und sollte nach 2-3 Wochen mit einem Zweitserum auf Titeranstieg kontrolliert werden. Mit Hilfe des ELISA können IgA Antikörper ca. 1 Woche und IgM Antikörper ca. 10 Tage nach Infektion nachgewiesen werden. In Ergänzung ist die PCR die vielversprechendste Methode für den Direktnachweis von M. pneumoniae in klinischen Proben und liefert schnelle Ergebnisse mit hoher Empfindlichkeit. Methode Das Kit dient zum Nachweis von Mycoplasma pneumoniae-DNA mittels real-time PCR. Der Nachweis von M. pneumoniae erfolgt durch Amplifikation einer spezifischen konservierten DNA-Sequenz, die das CARDS Toxin kodiert, und der Messung der Konzentration des Amplifikationsproduktes im PCR-Lauf mittels einer Fluoreszenz-markierten Sonde. Die Anwesenheit von M. pneumoniae-DNA in der Probe wird durch den Fluorezenzanstieg des FAM Fluorophors angezeigt. Im Reaktionsmix ist ein interner Standard (Internal Standard, IS) enthalten, um inhibitorische Substanzen im PCR-Ansatz nachzuweisen und die Effizienz der DNA-Extraktion zu kontrollieren. Eine positive IS-Amplifikation wird im Fluoreszenzkanal des JOE Fluorophors angezeigt. Das Nachweiskit nutzt den Vorteil der „hot start“ Technologie. Dadurch werden unspezifische Reaktionen minimiert und eine maximale Sensitivität erreicht. Uracil-DNA-Glycosylase (UDG) verhindert potentielle Kontamination der PCR-Reaktion durch Amplifikationsprodukte. Dadurch wird eine sehr hohe Sensitivität des labortechnischen M. pneumoniae-Nachweises aus klinischen Proben gesichert. Das Kit dient zur in-vitro Diagnostik und ermöglicht qualitative Ergebnisse. GeneProof PCR Kits können auf viele real-time Systeme verschiedener Hersteller eingesetzt warden. Das PCR Kit ist mit folgenden Geräten validiert: Rotor-GeneTM 3000 (Corbett Life Science) Rotor-GeneTM 6000 (Corbett Life Science) 7500 Real-Time PCR System (Applied Biosystems) LightCycler® 2.0 (Roche) LightCycler® 480 System (Roche) SLAN Real-time Quantitative PCR Fluorescent Detection System (Shanghai Odin Science & Technology Co.) Weitere Informationen zum Einsatz der PCR Kits auf den oben genannten Geräten finden Sie auf der Homepage des Herstellers (www.geneproof.com) oder erhalten Sie über medac Diagnostika www.medac.de Zu Informationen zum Einsatz auf anderen real-time Geräten kontaktieren Sie bitte: [email protected] oder [email protected] Hinweise: Das Kit ist nach den Richtlinien der EU Direktive 98/79/EEC on in vitro medical diagnostic device hergestellt. Die Positive Kontrolle und klinisches Probenmaterial bitte mit Vorsicht behandeln, um Kontaminationen und Schädigung der Testkomponenten oder des MasterMix zu vermeiden. Der Hersteller haftet nicht für Schäden infolge von Anwendungsfehlern. Die nationalen verbindlichen Arbeitsschutzvorschriften sind zu beachten. Die in diesem Produkt enthaltenen Chemikalien und Zubereitungen sowie die bei der Anwendung anfallenden Reste sind in der Regel Abfälle, die einer ordnungsgemäßen Entsorgung zugeführt werden müssen. Die Entsorgung solcher Abfälle unterliegt den nationalen abfallrechtlichen Gesetzen und Verordnungen. Die zuständigen Behörde oder Abfallbeseitigungsunternehmen informieren über die Entsorgung von Sonderabfällen. Testdurchführung Probenentnahme und Lagerung Als Probenmaterial für den Mycoplasma pneumoniae-Nachweis sind Sputum, bronchoalveoläre Lavage (BAL), Nasopharynx-Abstriche und Nasenschleimhautabstriche geeignet. Die Probenentnahme sollte in sterile Röhrchen ohne jegliche Transportmedien und der Probentransport innerhalb von 12 Stunden bei +4°C erfolgen. Von Körperflüssigkeiten wird eine Menge von 1 ml benötigt und für Abstriche sollten trockene, sterile Wattetupfer verwendet werden. Für die Langzeitlagerung müssen alle Proben bei -20°C eingefroren werden. DNA-Extraktion Die DNA-Extraktion kann mit kommerziell erhältlichen Extraktions-Kits unter Beachtung der spezifischen Protokolle für den in Frage kommenden Erreger erfolgen. Der Hersteller empfiehlt das PathogenFree DNA isolation Kit (GeneProof). Zur Überwachung auf eventuelle Inhibitoren im PCR-Ansatz und der Effizienz der Extraktion enthalten alle GeneProof PCR Kits einen internen Standard (IS). Der interne Standard ist ein präzise definiertes und quantifiziertes Plasmid mit Insert, hergestellt nach einem gentechnischen Verfahren. GeneProof hat PCR-Kits für zwei Basisversionen mit unterschiedlichem Konzept für den internen Standard entwickelt. PCR Kit ISIN (Cat. No. MP/ISIN...) In dieser PCR-Kitversion ist der interne Standard (IS) schon direkt im MasterMix Reaktionsgefäß enthalten. Diese Kitversion bietet eine effiziente Kontrolle potentieller Inhibitoren der PCR-Reaktion. PCR Kit ISEX (Cat. No. MP/ISEX...) Die Packung dieser PCR-Kitversion enthält den internen Standard (IS) in einem separaten Reaktionsgefäß. Mit dieser Kitversion können sowohl potentielle Inhibitoren der PCR-Reaktion als auch die Effizienz der DNA-Extraktion kontrolliert werden. Wird die ISEX PCR-Kitversion verwendet, muss der IS zu Beginn des Extraktionsprozesses direkt in die Probe gegeben werden, so dass am Ende 1 µl des resultierenden Elutionsvolumen 0.1 µl IS enthält: Elutionsvolumen Internal Standard 25 µl 2.5 µl 50 µl 5 µl 100 µl 10 µl 200 µl 20 µl PCR Kit ISIN PCR Kit ISEX Probe Probe Internal Standard 0.1µl IS per 1µl Evalutionsvol.. DNA Extraktion extrahierte DNA 30 µl MasterMix + PCR Amplifikation 10 µl DNA JOE Fluores c enc y Fluores c enc y JOE 4 3 2 1 0 2 8 14 20 26 32 38 44 50 Cy c le number PCR Inhibitionskontrolle 4 3 2 1 0 2 8 14 20 26 32 38 44 50 Cy c le number Kontrolle auf PCR Inhibition und DNA Extraktion PCR Amplifikation 1. 2. 30 l MasterMix und 10 l extrahierte DNA oder 10 l Positive Control in ein PCR Reaktionsgefäß pipettieren. Das Endvolumen des Reaktionsmixes beträgt 40 l. Das Reaktionsgefäß verschließen, kurz zentrifugieren, in den Cycler setzen und diesen wie folgt programmieren: Amplifikations-Programm: UDG decontamination initial denaturation 37°C/2 min. 95°C/10 min. denaturation annealing extension number of cycles 95 °C/5 sec. 60°C/40 sec. - reading of the fluorescence signal 72°C/20 sec. 45 Qualitative Auswertung der PCR-Reaktion FAM JOE Internal Standard 4 3,5 3 2,5 2 1,5 1 0,5 0 Fluorescency Fluorescency Mycoplasma pneumoniae 2 6 10 14 18 22 26 30 34 38 42 46 50 4 3,5 3 2,5 2 1,5 1 0,5 0 positiv 2 8 2 4 3,5 3 2,5 2 1,5 1 0,5 0 negativ 2 8 14 20 26 32 38 44 50 Fluorescency Fluorescency 2 8 14 20 26 32 38 44 50 Cycle number 8 14 20 26 32 38 44 50 Cycle number Cycle number 1 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 14 20 26 32 38 44 50 Cycle number Fluorescency Fluorescency Cycle number 1 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 Ergebnis 1 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 invalides Ergebnis 2 8 14 20 26 32 38 44 50 Cycle number