9 Aufbau der Atome (III): Orbitalmodell - chem.uni
Werbung

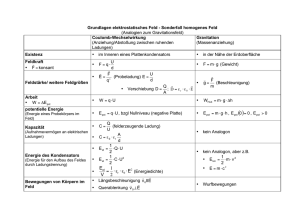
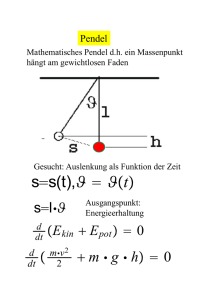
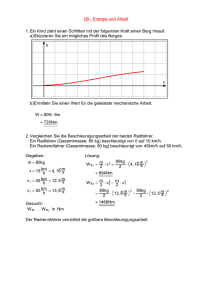
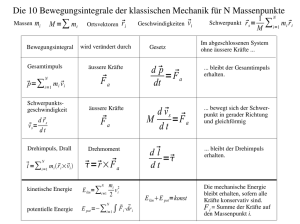
für internen Gebrauch 9 Aufbau der Atome (III): Orbitalmodell Grundlagen: a) Heisenberg, 1926: Unschärferelation Es ist unmöglich, von einem Objekt (z.B. einem Elektron) Ort und Impuls gleichzeitig exakt zu bestimmen. Δx@Δp$h/4π Bild - makroskopische Objekte: große Masse ÷ exakte Werte für x, p (klass. Mechanik, Newton) - Bohr: e- bewegt sich auf bestimmten Bahnen (zu starke Vereinfachung) - Quantenmechanik (besser): Das Elektron ist an einem bestimmten Ort des Atoms mit einer gewissen Wahrscheinlichkeit anzutreffen (dreidimensionale „Elektronenwolke“) b) de Broglie, 1924: „Materiewellen“ Teilchen haben Wellencharakter. λ=h/m@c - was domiert, hängt von m ab; - Davisson, Germer 1927: Bild Ein Elektronenstrahl wird an einer Al-Folie auf ähnliche Weise gebeugt, wie ein Röntgenstrahl (energiereiche, elektromagnetische Strahlung). c) Schrödinger, 1926: - Beschreibung des e- als dreidimensionale stehende Welle (stationärer Schwingungszustand) - Amplitude der stehenden Welle an einem Ort ist gegeben durch die Wellenfunktion (Analogie: schwingende Saite) Ψ (x,y,z) | Ψ | 2 = rel. Wahrscheinlichkeitsdichte des e- im Punkz x,y,z - Born, 1927: statistische Deutung der Quantenmachanik |Ψ|2= dW dτ W = Wahrscheinlichkeit, dτ = Raumelement E = E kin + E pot = 1 m @ v2 + E pot 2 p = m @ v oder v = p /m 2 (1) E= 1 p + E pot 2 m dem Impuls (z. B. in x-Richtung) entspricht der Differential-Operator p ¸ (2) h d dx @ 2π i h2 2 p ¸ - @ 4π 2 Operator = math. Vorschrift d2 dx 2 analog in y- und z- Richtung ableiten; (2) in (1) einsetzen: E= - h2 2 8π m @ d2 + E pot dx 2 Operator wirkt auf Wellenfunktion Ψ (- (- - h2 8π 2 m h2 8π 2 m h2 8π 2 m d2Ψ dx 2 d2Ψ d x2 @ @ @ d2 dx 2 d2 dx 2 d2Ψ d x2 + E pot ) Ψ = E Ψ umstellen + E pot ) Ψ - E Ψ = 0 ausmultiplizieren + E pot Ψ - E Ψ = 0 umstellen, ausklammern - Ψ (E - E pot) ( - + 8π 2 m h2 8π 2 m h2 ) = 0 umstellen (E - E pot) Ψ = 0 eindimensionale Schrödinger-Gleichung es ist jedoch die partielle Differentiation auch nach den Raumkoordinaten y und z erforderlich, d.h. px ¸ h 2π i @ δ , analog py .... , pz ... δx δ 2Ψ δ 2Ψ δ 2Ψ 8π 2 m + + + (E - E pot) Ψ = 0 h2 δ y2 δ x2 δ x2 dreidimensionale Schrödinger-Gleichung Laplace-Operator: Differenzieren nach allen drei Variablen ! ΔΨ + 8π 2 m h2 Randbedingungen: (E - E pot) Ψ = 0 Ψ endlich W = I Ψ2 dτ = 1 (Normierungsbedingung) Im Einelektronensystem gibt es eine exakte Lösung der Schrödinger-Gleichung. Man erhält Lösungsfunktionen (Eigenfunktionen). Das Potential, in dem sich das e- im H-Atom befindet, ist kugelsymmetrisch. Deshalb ist die Transformation der kartesischen Koordinaten in Kugelkoordinaten günstig: Ψ (x, y, z) ÷ Ψ (r, θ, Φ) Skizze Ψ als Produkt von zwei Funktionen darstellen (Separieren): Ψ n,l,m (r, θ, Φ) = R n,l (r) @ Y l,m (θ, Φ) Radial- Winkelfunktion* Funktion * nur hier erscheint Energie Produkt der Lösungsfunktionen = Eigenfunktionen Ψ n,l,m (Atomorbitale) Quantenzahlen ergeben sich als Eigenschaften der Funktionen R und Y. Schlußfolgerungen aus der Schrödinger-Gleichung: (1) Die durch die drei Quantenzahlen n, l und m charakterisierten Quantenzustände werden als Atomorbitale (AO) bezeichnet. n, l und m = Orbitalquantenzahlen (2) Die Atomorbitale unterscheiden sich hinsichtlich Größe, Gestalt und räumlichen Orientierung der Ladungswolken. Diese Eigenschaften werden durch die Quantenzahlen bestimmt. (3) Das Atomorbital Ψ n,l,m kann als ein durch Konturen eingegrenzter Aufenthaltsraum der Elektronen aufgefaßt werden ( | Ψ | 2 ). (4) Durch die Begrenzungslinien (Konturen) wird meist ein Wahrscheinlichkeitsparameter, die e- innerhalb dieses Raumes anzutreffen, von 90 bis 99 % angegeben. (5) Innerhalb dieses durch Ψ n,l,m festgelegten Raumes können sich 2 e- aufhalten (Ausnahme: H-Atom). Sie unterscheiden sich durch einen entgegengesetzten Spin („Eigendrehimpuls“, + 1 2 oder - 1 2 ). Bedeutung der Quantenzahlen: s. S. 63