Wie erklärt man die Wertigkeiten (+2/+3) natürlich vorkommender
Werbung

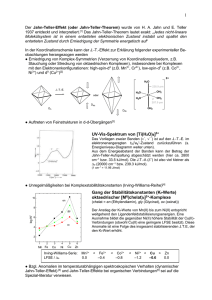
Wie erklärt man die Wertigkeiten (+2/+3) natürlich vorkommender Eisenverbindungen? Michael Kalcher 7AM Inhalt Eisen - Eigenschaften Wertigkeit und Oxidationszahl Übergangsmetalle Komplexe Ionen Ligandenfeldtheorie Erdgeschichtliche Entwicklung von Fe(II) und Fe(III) Bedeutung von Fe(II) und Fe(III) für den Menschen Quellenverzeichnis 2 2 3 4 4 7 8 9 “Es ist alles sehr kompliziert.“ -frei nach Fred Sinowatz (österreichischer Bundeskanzler von 1983 bis 1986)- Eisen - Eigenschaften p. 2 Fe engl. (IUPAC): Iron Ordnungszahl: Relative Atommasse: Dichte: Schmelzpunkt Kelvin: Siedepunkt Kelvin: Elektronenkonfiguration: Oxidationszahlen: Metalleigenschaften: 26 55,847 g/mol 7,87 g/cm3 1808 K 3023 K [Ar] 3d6 4s2 6, 4, 5, 3, 2, 1, 0, -1, -2 (Übergangs-)Metall Tabelle 1: Eigenschaften von Fe Bild 1: Periodensystem der Elemente Michael Kalcher 7AM | 2008 Wertigkeit und Oxidationszahl „Die Wertigkeit, auch Valenz, eines Atoms eines chemischen Elements gibt an, wie viele Atome es im Falle einer chemischen Bindung an sich binden kann, bzw. wie viele Einfachbindungen es mit anderen Atomen eingehen müsste, um einen stabilen Zustand zu erreichen.“ Zitat 1 „Die Oxidationszahl Nox (auch Oxidationsstufe, Oxidationswert) gibt an, wie viele Elementarladungen ein Atom innerhalb einer Verbindung formal aufgenommen beziehungsweise abgegeben hat, zum Beispiel bei einer Redoxreaktion. Sie entspricht somit der hypothetischen Ionenladung eines Atoms in einem Molekül bzw. der tatsächlichen Ladung einatomiger Ionen.“ Zitat 2 Die Oxidationszahl gibt an, wie viele Elektronen ein Atom abgibt oder aufnimmt , also wie viele „Bindungen“ es in einer Ionenbindung eingeht. Somit ist die Oxidationszahl der Valenz insofern gleichzusetzen, als das z.B. Na und Cl jeweils die Valenz eins haben, und das Cl das Valenzelektron des Na aufnimmt, und somit beide die Oxidationszahl (+/-) eins haben: Na(-I)+Cl(I)-. Übergangsmetalle Im Periodensystem steht Eisen an 26. Stelle, in der vierten Periode in der achten Nebengruppe. Die Elemente in der dritten bis zur zwölften Nebengruppe werden auch als d-Block Elemente oder Übergangsmetalle bezeichnet. „Die chemischen Elemente mit den Ordnungszahlen von 21 bis 30, 39 bis 48, 57 bis 80 und 89 bis 112 werden üblicherweise als Übergangselemente bezeichnet. Da diese Elemente alle Metalle sind, wird auch der Ausdruck Übergangsmetalle benutzt. Dieser Name ist in ihrer Position im Periodensystem begründet, da sich dort der Übergang durch die aufeinanderfolgende Zunahme von Elektronen im d-Atomorbital entlang jeder Periode zeigt. Übergangselemente werden chemisch als Elemente, die zumindest ein Ion mit einer teilweise gefüllten d-Schale ausbilden, definiert.“ Zitat 3 Bei den Metallen im d-Block und der höheren Perioden kann es aber auch zu halb besetzten Schalen kommen, da auch dieser Zustand sehr stabil ist. Michael Kalcher 7AM | 2008 Zitat 4 Bild 2: d-Block im Periodensystem Bei den d-Block-Elementen von Scandium bis Zink, werden die d-Orbitale entlang der Periode aufgefüllt. Außer Kupfer und Chrom haben alle d-BlockElemente zwei Elektronen in ihrem äußeren s-Orbital, selbst Elemente mit unvollständigen 3d-Orbitalen. Das ist ungewöhnlich: niedrigere Orbitale werden normalerweise vor den äußeren Schalen aufgefüllt. Die s-Orbitale in den d-Block-Elementen befinden sich aber in einem niedrigeren Energiezustand als die d-Unterschalen. Da Atome bestrebt sind, einen möglichst niedrigen Energiezustand einzunehmen, werden die s-Schalen zuerst aufgefüllt. [...] Im Gegensatz zu Elementen der II. Gruppe wie p. 3 Calcium gibt es die Ionen der Übergangselemente in zahlreichen Oxidationszuständen. Calciumionen verlieren üblicherweise nicht mehr als zwei Elektronen, wohingegen Übergangselemente bis zu neun abgeben können. […]Übergangselemente dagegen haben wegen der geringen Energiedifferenz zwischen den 3d- und 4sOrbitalen ziemlich linear ansteigende Ionisationsenergien entlang ihrer s- und d-Orbitale. Übergangselemente kommen daher auch mit sehr hohen Oxidationszahlen vor. Zitat 5 Das bedeutet, dass Übergangsmetalle mehrere Möglichkeiten haben, einen Zustand zu erreichen, der stabil ist, der aber nicht unbedingt ein Edelgas- oder Oktettzustand ist. Nun das heißt wiederum, dass es weitere Möglichkeiten gibt, um Elektronen mit anderen Atomen „zu teilen“. Komplexe Ionen A complex ion has a metal ion at its centre with a number of other molecules or ions surrounding it. These can be considered to be attached to the central ion by co-ordinate (dative covalent) bonds. The molecules or ions surrounding the central metal ion are called ligands. Zitat 6 Also bekommt das Eisenion durch die Liganden die restlichen benötigten Elektronen, um einen stabilen Zustand zu erreichen. Michael Kalcher 7AM | 2008 Ligandenfeldtheorie Die Ligandenfeldtheorie beschreibt die Wechselwirkung der d-Elektronen mit den Liganden des Zentralatoms. [...] Am häufigsten treten Übergangsmetallkomplexe auf, die unvollständig aufgefüllte d-Orbitale haben. Zitat 7 Liganden bilden am häufigsten oktaedrische, mit 6 Liganden, oder tetraedische, mit 4 Liganden, Komplexe. Zitat 8 Bild 3: Oktaedrischer Komplex Bild 4: Tetraedrischer Komplex p. 4 Bild 5: dx²y² Orbital im Oktaeder Bild 6: dx²y² Orbital im Tetraeder Bild 7: dxy Orbital im Oktaeder Bild 8: dxy Orbital im Tetraeder Bild 9: dxz Orbital im Oktaeder Bild 10: dxz Orbital im Tetraeder Bild 11: dyz Orbital im Oktaeder Bild 12: dyz Orbital im Tetraeder Bild 13: dz² Orbital im Oktaeder Bild 14: dz² Orbital im Tetraeder Michael Kalcher 7AM | 2008 p. 5 Die Liganden erzeugen ein elektrostatisches Feld das auf die d-Orbitale des Zentralions wirkt. Die d-Orbitale splitten sich nun in energetisch höhere und energetisch abgesenkte Unterschalen. Die Aufteilung in Untergruppen hängt von der Stärke des Feldes, sowie der geometrischen Form des Komplexes ab. p. 6 Zitat 9 Die Liganden nähern sich stärker den Orbitalen, die auf den Koordinatenachsen, also der x-y-oder z-Achse, liegen. Das sind die dz² und die dx²y² Orbitale. Das bedeutet, dass die Abstoßung stärker wird und die Orbitale somit energetisch angehoben werden, also ungünstiger werden. Die d-Elektronen haben aber das Bestreben, sich bevorzugt in den Orbitalen aufzuhalten, die sehr weit von den Liganden entfernt sind. Das sind die dxy, dxz und die dyz- Orbitale. Hier ist die Abstoßung bedeutend geringer, d.h. die Orbitale sind energetisch günstiger. Zitat 10 Im tetraedrischen Ligandenfeld nähern sich die Liganden dem dxy, dxz, und dem dyz Orbital stärker als dem dz² bzw. dem dx²y². Das bedeutet, daß das dz² und das dx²y² Orbital günstiger ist und energetisch abgesenkt wird. Zitat 11 energetisch höher dxy dxz dyz dx²y² dz² energetisch abgesenkt energetisch höher 7AM | 2008 dx²y² dz² Δ dxy dxz dyz energetisch abgesenkt Bild 15 & 16: Die Aufsplittung der d-Orbitale in einem oktaedrischen bzw. Michael Kalcher tetraedrischen Komplex Wenn man die d-Orbitale im oktaedrischen Ligandenfeld besetzt, werden immer zuerst die Orbitale besetzt, die energetisch günstiger, also energetisch niederer sind. Das sind die dxy, dxz, und die dyz-Orbitale. Dies erfolgt nach der Hund‘schen Regel: Man besetzt die Orbitale einer Unterschale immer mit maximaler Anzahl ungepaarter Elektronen. Zitat 12 Δ Das bedeutet nun, dass im oktaedrischen Komplex ein 3-wertiges Eisenion Platz finden wird, da alle d-Orbitale der energetisch begünstigten Unterschale ungepaart aufgefüllt werden können: Fe3+ 3d 4s energetisch höher dx²y² dz² Bild 17: Aufteilung Δ dxy dxz dyz der Elektronen energetisch abgesenkt Hier sind die Elektronen hauptsächlich nicht gepaart, d.h. es liegt ein high-spin Komplex vor. Zitat 13 Im Gegensatz dazu, wird man im tetraedrischen Komplex ein 2-wertiges Eisenion finden, da die energetisch abgesenkte Unterschale komplett aufgefüllt werden kann: Fe2+ 3d 4s energetisch höher dxy dxz dyz Bild 18: Aufteilung der Elektronen Δ dx²y² dz² 7AM | 2008 energetisch abgesenkt Hier sind die Elektronen hauptsächlich gepaart, d.h. es liegt ein low-spin Komplex vor. In diesem Zustand besitzt das Zentralion die geringstmögliche Zahl an ungepaarten Elektronen, d.h. es wird der Hund‘schen Regel entgegengewirkt. Michael Kalcher Zitat 14 Erdgeschichtliche Entwicklung und Fe(III) von Fe(II) Vor der Photosynthese bzw. vor den Cyanobakterien waren mehr oder weniger alle Eisenverbindungen zweiwertig, da es die erste stabile Oxidationsstufe ist. Weiters war die Atmosphäre nicht oxidierend (es gab keinen Sauerstoff), also wurde das Eisen auch nicht weiter zu Fe(III) oxidiert. Dies geschah erst mit der Ent- p. 7 wicklung der Photosynthese (durch den frischen Sauerstoff wurde die Atmosphäre oxidierend). Heute sind noch in Sedimentgesteinen Relikte des damaligen Fe(II) zu finden. Zitat 15 Bedeutung Menschen von Fe(II) und Fe(III) für den Der Mensch benötigt für all seine körpereigenen Redox-Reaktionen (z.B.: Zellatmung) Eisen als Katalysator. Dadurch dass das Eisen sehr leicht zwischen den Oxidationsstufen wechseln kann, ist es bei fast allen chemischen Vorgängen im Körper beteiligt. Außerdem ist es in lebenswichtigen Komplexen vertreten, wie z.B. im Hämoglobin. Michael Kalcher 7AM | 2008 Zitat 16 p. 8 Quellenverzeichnis p. 9 Tabelle 1: Andy Hoppe, Eisen http://www.periodensystem.info/elemente/eisen.htm 03.01.08 15:19 überprüft mit H. J. Streiff, Chemie für dich Band 49 Benzinger Taschenbücher Seite 138 Zitat 1: Wertigkeit (Chemie) http://de.wikipedia.org/wiki/Wertigkeit_%28Chemie%29 02.01.08 11:19 überprüft mit Persönliches Gespräch mit Ao.Univ.-Prof. Dr.phil. Kurt KALCHER 03.01.08 Zitat 2: Oxidationszahl http://de.wikipedia.org/wiki/Oxidationszahl 02.01.08 11:33 überprüft mit Persönliches Gespräch mit Ao.Univ.-Prof. Dr.phil. Kurt KALCHER 03.01.08 Zitat 3, 5: Übergangsmetalle http://de.wikipedia.org/wiki/%C3%9Cbergangsmetalle 02.01.08 11:33 überprüft mit Persönliches Gespräch mit Ao.Univ.-Prof. Dr.phil. Kurt KALCHER 03.01.08 Zitat 4: Grundlagen der Chemie http://de.wikipedia.org/wiki/Grundlagen_der_Chemie 03.01.08 15:43 überprüft mit Persönliches Gespräch mit Ao.Univ.-Prof. Dr.phil. Kurt KALCHER Michael Kalcher 7AM | 2008 03.01.08 Zitat 6: Introducting transition metals http://www.chemguide.co.uk/inorganic/transition/features.html 02.01.08 13:21 überprüft mit Persönliches Gespräch mit Ao.Univ.-Prof. Dr.phil. Kurt KALCHER 03.01.08 Zitat 7: Ligandenfeldtheorie http://www.ddesignmedia.de/Komplex_Chemie/HTML/GMS/Ligandenfeldtheorie/Ligthe.htm 03.01.08 15:47 überprüft mit Persönliches Gespräch mit Ao.Univ.-Prof. Dr.phil. Kurt KALCHER 03.01.08 Zitat 8: Persönliches Gespräch mit Ao.Univ.-Prof. Dr.phil. Kurt KALCHER 03.01.08 p. 10 Zitat 9: Ligandenf.an okt. Komplexen http://www.ddesignmedia.de/Komplex_Chemie/HTML/GMS/Ligandenfeldtheorie/Lig2.htm 03.01.08 15:54 überprüft mit Persönliches Gespräch mit Ao.Univ.-Prof. Dr.phil. Kurt KALCHER 03.01.08 Zitat 10: Aufspaltung okt. Ligandenfeld http://www.ddesignmedia.de/Komplex_Chemie/HTML/GMS/Ligandenfeldtheorie/Lig3.htm 03.01.08 15:57 überprüft mit Persönliches Gespräch mit Ao.Univ.-Prof. Dr.phil. Kurt KALCHER 03.01.08 Zitat 11: Tetraedrisches Ligandenfeld http://www.ddesignmedia.de/Komplex_Chemie/HTML/GMS/Ligandenfeldtheorie/TLF.htm 03.01.08 15:58 überprüft mit Persönliches Gespräch mit Ao.Univ.-Prof. Dr.phil. Kurt KALCHER 03.01.08 Zitat 12: Besetzung der d-Orbitale http://www.ddesignmedia.de/Komplex_Chemie/HTML/GMS/Ligandenfeldtheorie/Lig4.htm 03.01.08 16:00 überprüft mit Persönliches Gespräch mit Ao.Univ.-Prof. Dr.phil. Kurt KALCHER 03.01.08 Zitat 13, 14: high-low-spin 7AM | 2008 Michael Kalcher http://www.ddesignmedia.de/Komplex_Chemie/HTML/GMS/Ligandenfeldtheorie/Higlows.htm 03.01.08 16:00 überprüft mit Persönliches Gespräch mit Ao.Univ.-Prof. Dr.phil. Kurt KALCHER Bild 1, 2: http://www.periodensystem.info/periodensystem.htm 03.01.08 Zitat 15, 16: Persönliches Gespräch mit Ao.Univ.-Prof. Dr.phil. Kurt KALCHER 03.01.08 Bild 3 - 14 http://www.ddesignmedia.de/Komplex_Chemie/HTML/GMS/Ligandenfeldtheorie/Lig2.htm http://www.ddesignmedia.de/Komplex_Chemie/HTML/GMS/Ligandenfeldtheorie/TLF.htm Bild 15-18 selbst gezeichnet mit Vorlage: http://www.ddesignmedia.de/Komplex_Chemie/HTML/GMS/Ligandenfeldtheorie/Lig3.htm