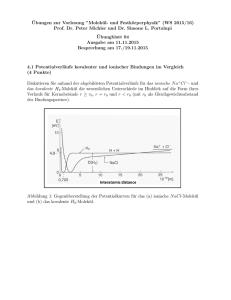
Ubungsblatt 14
Werbung

Physik V (Atomphysik)
Übungsblatt 14
09. Februar 2006
1. Linearer Starkeffekt
Betrachten Sie ein Wasserstoffatom in einem statischen, ortsunabhängigen
~ = Ez . Der Störoperator ist V (z) = −eEz z.
elektrischen Feld E
(a) Skizzieren Sie das effektive Potential – also die Summe aus dem CoulombPotential des Kerns und dem Potential für das externe elektrische Feld.
(b) Nehmen Sie nun an, das Wasserstoffatom befinde sich in einem Feld der
Stärke E = 6 kV/m. Wo liegt der Sattelpunkt des Potentials? Atome die in
hohe Quantenzahlen n angeregt sind werden als Rydbergatome bezeichnet.
Können Sie sich vorstellen, wie man einen zustandssensitiven Detektor für
Rydbergatome bauen kann?
(c) Betrachten Sie nun die Niveaus (2, `, m) und berechnen Sie die Energiekorrekturen
erster Ordnung. Gehen Sie dazu nach folgendem Rezept“ vor:
”
• Stellen Sie den Hamiltonoperator in Matrixform dar
Tipp: Sie müssen hier im Prinzip eine 4 × 4 Matrix berechnen. Letztlich
ergibt sich jedoch nur ein 2 × 2 Unterraum, in dem der Hamiltonian
nicht diagonal ist. Benutzen Sie zur Berechnung der Matrixelemente die
Erwartungswerte des Kommutators [Lz , z].
• Diagonalisieren Sie die Matrix
• Berechnen Sie die Eigenvektoren der Matrix
(d) Welches Kriterium ist notwendig für das Auftreten des in Aufgabenteil (c)
behandelten linearen Starkeffekts?
(e) Wie groß ist die Aufspaltung nach Teil (c) für ein elektrisches Feld mit der
Stärke 6 kV/m? Welches Magnetfeld wäre nötig, um mit dem Zeeman-Effekt
eine entsprechende Aufspaltung zu bekommen?
2. Born-Oppenheimer Näherung
~ j }) =
Betrachten Sie die Born-Oppenheimer Näherung in der Forumlierung Ψk ({~ri }, {R
~ j }) · Ψ0 ({~ri }, {R
~ j }) mit den Elektronen-Koordinaten {~ri } und den Kernχ({R
k
~ j }. Die Wellenfunktion der Kernbewegung wird mit χ({R
~ j })
Koordinaten {R
~ j }) bezeichnet die Wellenfunktion der Elektronen mit dem
bezeichnet. Ψ0k ({~ri }, {R
Satz Quantenzahlen k in einem starren“ Molekül mit der festen Kernkonfiguration
”
~ j } als Parametersatz.
{R
Zeigen Sie, dass mit diesem Produktansatz die Schrödingergleichung für das H+
2
Molekülion separiert. Und zwar in eine Schrödingergleichung für die elektronische
Wellenfunktion des starren Moleküls und in eine Schrödingergleichung für die
Wellenfunktion der Kernbewegung.
3. H+
2 -Molekülion – Separation in elliptischen Koordinaten
(a) Geben Sie den Hamilton-Operator für das H+
2 Molekülion in der BornOppenheimer Näherung an (wie in der Vorlesung) und erläutern Sie die Terme.
(b) Schreiben Sie den Hamilton-Operator um in elliptische Koordinaten (µ, ν, ϕ) =
((rA + rB )/R, (rA − rB )/R, arctan(y/x)), wobei rA und rB die Abstände des
Elektrons zu den Protonen sind und R der Abstand der beiden Protonen ist.
In elliptischen Koordinaten
ist:i
n h
o
µ2 −ν 2
∂
∂
∂
∂
∂2
4
2
2
+ ∂ν
(1 − ν 2 ) ∂ν
+ (µ2 −1)(1−ν
∇ = R2 (µ2 −ν 2 ) ∂µ (µ − 1) ∂µ
2 ) ∂ϕ2
(c) Zeigen Sie, dass die Schrödingergleichung in elliptischen Koordinaten
separiert, Ψ(µ, ν, ϕ) = M (µ)N (ν)Φ(ϕ). Welche Gemeinsamkeiten und
welche Unterschiede gibt es zur Separation der Schrödingergleichung für das
Wasserstoffatom in Kugelkoordinaten?
Fragen zur Vorlesung:
• Wie sehen beim H+
2 -Molekülion die Knotenflächen der Wellenfunktion jeweils für
den 3 d σ, 4 f σ und 3 p σ Zustand aus?
• Wie ist die Bindungsenergie für das Elektron im H+
Molekülion beim
2
Gleichgewichtsabstand der Protonen im Vergleich zu den Grenzfällen vereinigter
Protonen (R = 0) und weit getrennter Protonen (R → ∞)?