BIOCHEMIE I (NATURSTOFFE)
Werbung

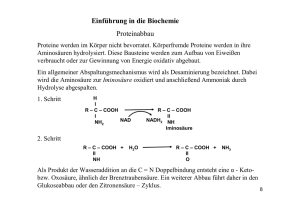
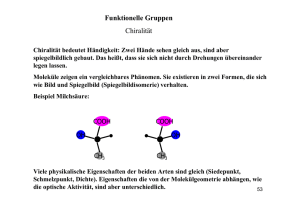
1 Vorlesung BIOCHEMIE I (NATURSTOFFE) (für Chemiker vor dem Vordiplom, 4. Semester, neuer Studiengang) Thomas Ziegler Erstmals gehalten im Sommersemester 2005 INHALT 1. 2. 2.1. 2.2. 2.2.1. 2.2.2. 2.3. 2.4. 2.5. 2.6. 2.6.1 2.6.2. 2.6.3. 2.7. 2.7.1. 2.7.2. 2.8. 3. 3.1. 3.2. 3.3. Allgemeines – Organische Chemie / Biochemie Wichtige Stoffklassen der Biochemie Aminosäuren / Peptide Proteine Enzyme Coenzyme Nucleinsäuren Porphyrine CO2 und Zitronensäurecyclus Fette und Lipide Auf- und Abbau Phospholipide, Glycolipide, Membranen Isoprenoidlipide, Steroide, Carotinoide Zucker Monosaccharide Oligo- und Polysaccharide Hormone, Mineralien, Vitamine Biochemische Reaktionstypen Biologische Oxidation Proteinstoffwechsel und Proteinbiosynthese Photosynthese Anmerkung zur Vergabe von Kreditpunkten: Die Vorlesung Biochemie I (2 SWS) bildet zusammen mit dem Praktikum Biochemie I (2 Versuche im Anschluß an die Versuche im Grundpraktikum) die Lehrveranstaltung Biochemie 1 im 4. Fachsemester, für die ein benoteter Leistungsnachweis (Schein) ausgestellt und insgesamt 5 Kreditpunkte vergeben werden. Am Ende des Sommersemesters findet ein mündliches Kolloquium über den Stoff der Vorlesung und der Praktikumsversuche statt, für das je eine Note für die Vorlesung (Theorienote) und das Praktikum (Praktikumsnote) vergeben wird. Alternativ erfolgt die Notenfindung über ein schriftliches Testat am Ende des Sommersemesters. Die Theorienote wird mit 3 Kreditpunkten gewichtet, die Praktikumsnote mit 2 Kreditpunkten. Die gewichtete Gesamtnote für diese Lehrveranstaltung wird aus der Summe der gewichteten Einzelnoten gebildet, die Gesamtnote durch Division mit 5. Beispiel: vergebene Noten: Theorienote 1,0 / Praktikumsnote 3,0 gewichtete Noten: Theorie 3,0 (1,0 x 3) / Praktikum 6,0 (3,0 x 2) gewichtete Gesamtnote: 9,0 (3,0 + 6,0) Gesamtnote für Schein: 1,8 (9,0:5) 2 1. Allgemeines Weiterführende Literatur: P. Karlson, D. Doenecke, J. Koolman; Kurzes Lehrbuch der Biochemie; Georg Thieme Verlag 1994 A. L. Lehninger; Biochemie; VCH 1985 (2. Auflage) B. Alberts, D. Bray, J. Lewis, M. Raff, K. Roberts, J. D. Watson; Molekularbiologie der Zelle; VCH 1986 (1. Auflage) Habermehl, Hammann; Naturstoffchemie; Springer Verlag 1992 Die Biochemie ist Teil der Organischen Chemie, da sie sich ebenso mit der Chemie von Kohlenstoffverbindungen befasst. Die Biochemie ist jedoch auch Teil der Biologie (Lehre vom Leben), da sie die chemischen Vorgänge lebender Organismen erforscht. Die Biochemie wird in 2 Teilgebiete unterteilt: Deskriptive Biochemie: beschreibt die chemische Natur der Zellbestandteile (Naturstoffe) Dynamische Biochemie: beschreibt die Stoffwechelvorgänge und die „Dynamik“ einer Zelle und der Organismen. 2. Wichtige Stoffklassen der Biochemie Wichtige Stoffgruppen in der Biochemie sind: • • • • • Proteine (Aminosäuren, Peptide) Lipide (Fette, Terpene) Nucleinsäuren (DNA, RNA) Saccharide (Kohlenhydrate) Mineralien, Vitamine, Heterocyclen Wichtige Organich-Chemische Strukturen in der Biochemie sind: • • Funktionelle Gruppen Cyclische Verbindungen Wichtige Reaktionen in der Biochemie sind: • • • • • Kondensationsreaktionen Redoxreaktionen Substitutionen/Eliminierungen C-C-Bindungsbildung Stereoselektive Reaktionen 3 Einige wichtige Funktionelle Gruppen OH O O Alkohole Carbonyle Säuren OH NH2 Amine NH Imine C N Nitrile Einige wichtige cyclische Verbindungen H N H N H N 5-Ringe S N N Pyrrolidin Pyrrol Imidazol Thiazol H N N N O 5-Ringe O Furan N Piperidin Pyridin Pyrimidin H N 5+6-Ringe Pyran H N N N N Inden Indol Purin N 6+6-Ringe N N N Naphthalin Chinolin N Pteridin höhere Systeme Anthracen Phenanthren Gonan O N N N H Isoalloxazin NH O NH N N HN Porphyrin 4 Einige wichtige Carbonsäuren: Dicarbonsäuren (Salze) Monocarbonsäuren (Salze) H COOH COOH HOOC COOH Ameisensr. (Formiate) HOOC Essigsr. (Acetate) COOH Propionsr. (Propionate) COOH Buttersr. (Butyrate) COOH Valeriansr. (Valeriate) COOH Isovaleriansr. (Isovaleriate) Oxalsr. (Oxalate) COOH HOOC HOOC Malonsr. (Malonate) COOH Bernsteinsr. (Succinate) COOH COOH Maleinsr. (Maleinate) Fumarsr. (Fumarate) HOOC COOH Glutarsr. (Glutarate) HOOC Hydroxy- Ketocarbonsäuren (Salze) OH O Milchsr. (Lactate) COOH COOH Brenztraubensr. (Pyruvate) OH HO Glycerinsr. (Glycerinate) COOH HOOC OH HOOC OH COOH COOH Citronensr. (Citrate) COOH Äpfelsr. (Malate) OH HOOC COOH Weinsr. (Tartrate) OH Merke! Säurestärke von Säuren wird durch den pKS-Wert ausgedrückt R-COOH + H2O → R-COO- + H3O+ KS = [R-COO-] [H3O+] [R-COOH] typische pKS-Werte: pKS = -lgKS Salzsäure Salpetersäure Phosphorsäure Ameisensäure Essigsäure Kohlensäure Blausäure Wasser Ammoniak -7,0 (starke Säure) -1,3 +2,1 +3,8 +4,8 +6,5 +9,5 +15,7 +23,0 (schwache Säure) 5 Einige wichtige Reaktionen Kondensation Veresterung / Verseifung: R OH + R' COOH R' COOR Amidbildung / Spaltung: R NH2 + R' COOH R' CONHR Veretherung / Etherspaltung: R OH + R' X R' OR Acetalbildung / Spaltung: 2 R OH + R' O R'' R' OR R'' OR X Eliminierungen / Addition R' R R' R Redox-Reaktion Hydrierung / Dehydrierung: R' R R Reduktion / Oxidation: O + H2 R + H2 R - OH O O + 2e O R' O C-C-Knüpfung Aldolkondensation: Claisenkondensation: + R'' O R R'' R'' R' R' O O OH O R O + R OEt O O R'' OEt OEt R O O Knoevenagelkondensation: O + ROOC R'' R'' R' R' ROOC O Carboxylierung: CO2 + R O OEt Beachte! O HO OEt R Informieren Sie sich über diese Reaktionen in Lehrbüchern der OC 6 Einige wichtige Stereochemische Aspekte Enantiomere Fischer-Prokjektion (DL-Nomenklatur) CHO CHO H OH HO H OH OH D- COOH COOH H NH2 H2N D- L-Glycerinaldehyd H L-Alanin sterische Schreibweise (RS-Nomenklatur) HO H HO H2N H HO H HO CHO R- H2N H COOH CHO S-Glycerinaldehyd COOH R- S-Alanin Diastereomere COOH COOH COOH HOOC Fumarsäure Maleinsäure HO H HOOC COOH H OH HO H COOH L-(+)- COOH HO H H OH COOH D-(-)-Weinsäure HO H COOH H OH H COOH 2R,3R-Weinsäure L-(+)-Weinsäure OH COOH meso-Weinsäure Traubensäure HO O HO OH OH β-Ribofuranose HO O HO OH OH α-Ribofuranose Beachte! Informieren Sie sich aus OC Lehrbüchern über Stereochemie und arbeiten Sie nochmals die Vorlesung Organische Chemie 1 (2. Semester) durch. 7 2.1. Aminosäuren / Peptide In der Natur, insbesondere in Peptiden und Proteinen, finden sich fast ausschließlich α-Aminosäuren. Es gibt jedoch auch entsprechende β-, γ-, δ-, etc. Aminosäuren. β δ COOH NH2 COOH COOH H2N α γ β-Alanin (achiral) α-Alanin (chiral) Chemische Eigenschaften von Aminosäuren: Aminosäuren sind meist kristalline Feststoffe und liegen als Zwitterionen vor. Da Aminosäuren eine saure Carboxylatgruppe und eine basische Aminfunktion tragen, können sie pH-abhängig in drei Formen vorliegen. Den pH-Wert, bei dem eine Aminosäure in der (nach außen ungeladenen) zwitterionischen Form vorliegt wird Isoelektrischer Punkt (IP) genannt. Der IP ist für jede Aminosäure charakeristisch. R COOH NH3 -H+ +H R NH3 + im Sauren COO "neutral" pH = IP -H+ +H+ R COO NH2 im Basischen pKS-Werte und IPs einiger Aminosäuren: die α-Carboxylgruppe von Aminosäuren ist ungewöhnlich sauer. Weitere Carboxalgruppen (β- oder γ-) sind weniger sauer je weiter entfernt sie von Cα sind. allgemein: α-Carboxylgruppe: pKS = 1,7 – 2,6 (saurer als Ameisensäure!) α-Aminofunktion: pKS = 8,9 – 10,6 (als Ammoniumion) andere Grp.: β-Carboxylgruppe (Asp): γ-Carboxylgruppe (Glu): Thiolgruppe –SH (Cys): Hydroxylgrp. –OH (Tyr): ε-Ammonium (Lys): Guanidinogruppe (Arg): Imidazolgruppe (His): pKS = 3,86 (ungefähr wie Ameisensäure) pKS = 4,24 (ungefähr wie Essigsäure) pKS = 8,33 pKS = 10,07 pKS = 8,33 pKS = 12,48 pKS = 6,01 (als Imidazolium) Isoelektrischer Punkt IP: IP = ½ (pKS1 + pKS2) z.B. Glycin (Gly): 6.06 Phenylalanin (Phe): 5,91 Asparaginsäure (Asp): 2,98 Histidin (His): 7,64 8 Einteilung der Aminosäuren: Da fast alle Aminosäuren chiral sind (Ausnahme: Glycin) werden AS der L- bzw. DReihe zugeordnet. In der Natur kommen fast ausschließlich nur die L-Formen vor. Von allen möglichen Aminosäuren sind 20 besonders häufig. Sie werden als proteinogene (Protein-bildende) Aminosäuren bezeichnet. Aminosäuren können in „essentielle AS“ und „nicht-essentielle AS“ unterteilt werden. Essentielle AS sind solche, die der menschliche Organismus nicht produzieren kann und die deshalb mit der Nahrung aufgenommen werden müssen. Essentielle Aminosäuren: L-Valin, L-Leucin, L-Isoleucin, L-Phenylalanin, L-Threonin, L-Methionin, L-Tryptophan, L-Lysin AS warden “besser” nach ihren chemischen Eigenschaften unterteilt: a) AS mit unpolarem Rest: H H2N COOH L-Glycin (Gly) H CH3 H2N COOH H H2N L-Alanin (Ala) COOH L-Valin (Val) H H H2N H COOH L-Isoleucin (Ile) H2N H2N COOH L-Leucin (Leu) COOH HN COOH L-Prolin (Pro) L-Phenylalanin (Phe) b) AS mit polarem, nicht ionisierbarem Rest: OH OH H H H2N COOH L-Serin (Ser) H2N SH S H COOH L-Threonin (Thr) CH3 H H2N COOH L-Cystein (Cys) H2N COOH L-Methionin (Met) OH O O NH H H2N H H COOH L-Tryptophan (Trp) H2N NH2 COOH L-Tyrosin (Tyr) H2N NH2 H COOH L-Asparagin (Asn) H2N COOH L-Glutamin (Gln) 9 c) polare saure AS mit ionisierbarem Rest: O O OH OH H H H2N COOH H2N L-Asparaginsäure (Asp) COOH L-Glutaminsäure (Glu) d) polare basische AS mit ionisierbarem Rest: H2N NH2 NH NH NH N H H2N H COOH H2N L-Lysin (Lys) H COOH H2N L-Arginin (Arg) COOH L-Histidin (His) Trennung von Aminosäuren: Aminosäuren können chromatographisch aufgrund ihrer unterschiedlichen IPs an Ionentauschern getrennt werden. Als Ionentauscher für präparative Trennungen werden Chromatographiesäulen, die mit Polystyrol, das saure Sulfonsäuregruppen trägt beladen sind verwendet. Die Detektion der einzelnen Aminosäuren erfolgt entweder physikalisch (Brechungsindex, Drehwert, MS) oder über eine Farbreaktion. Ninhydrinreaktion zum Nachweis von AS: O R COOH + 2 NH2 OH OH O Ninhydrin Beachte! O H2O HO N + R-CHO + CO2 O O Farbstoff Formulieren Sie den Reaktionsmechanismus der Ninhydrinreaktion 10 Trennung von Aminosäuren über eine Ionentauschersäule: 11 Beachte! Informieren Sie sich aus Lehrbüchern über Amide und Peptide Allgemeine Methoden zur Synthese von Amiden R COOH + R' NH2 Erhitzen oder Kondensationsmittel O R HN R' O R R' + NH2 evtl. Hilfsbase O R X HN R' X = Hal, OR'' R N + H2O O Erhitzen R NH2 Allgemeine Methoden zur Synthese von Aminosäuren Beachte! • • • • • • • Informieren Sie sich aus Lehrbüchern über folgende Synthesen: Strecker-Synthese Hydantoin-Synthese Azlacton-Synthese Erlenmeyer-Synthese Hell-Vollhardt-Zellinski-Reaktion / Substitution mit Aminen und Amiden Aminosäuren durch reduktive Aminierung von Ketosäuren Hydrierung von Dehydroaminosäuren Allgemeine Methoden zur Synthese von Peptiden Problem: 2 unterschiedliche Aminosäuren ergeben 2 unterschiedliche Dipeptide O H2N COOH H2N N H Gly H2N COOH Ala COOH Gly-Ala O H2N NH COOH Ala-Gly 12 → orthogonale Schutzgruppen für NH2 und COOH Aminschutzgruppen: H N Bezeichnung: Einfürung: Z Benzyloxycarbonyl Cl O O H N O Hydrierung Boc2O CF2COOH O O Boc t-Butoxycarbonyl O H N Abspaltung: H N O Fmoc Fluorenylmethoxycarbonyl O O O Piperidin Carboxylschutzgruppen: O Methylester Veresterung Verseifung t-Butylester Boc2O CF2COOH O O O O Benzylester Hydrierung Veresterung O Prinzip der Synthese von Peptiden mit orthogonaler Schutzgruppentechnik: 1. H2N COOH Fmoc-Cl H2N 3. Fmoc-Gly-OH + Ala-OtBu H2N DCC Entschützen: Fmoc-Gly-Ala-OtBu DCC: Dicyclohexylcarbodiimid Fmoc-Gly-OH O Fmoc-Gly-Ala-OtBu 1. Piperidin 4. COOH O Isobuten, H+ 2. COOH FmocNH 2. Hydrierung N C N Gly-Ala-OH Ala-OtBu 13 Peptidbindung: Peptide sind Amide aus zwei Aminosäuren: Struktur der Amidbindung: • • • • Die C-N Bindung in Amiden besitzt Doppelbindungscharakter (ca. 40%) Rotation um die C-N Bindung ist gehindert (2 Konformere möglich) Das trans-Konformere ist thermodynamisch stabiler NH ist nicht protonierbar O N N 121° 3 1,5 OH O 1,3 2 117° N H 7 1,4 O O N N 120° trans H H H cis Die Peptidgruppe ist fast eben gebaut. In Peptiden stehen die Substituenten der Aminosäuren ober- bzw. unterhalb dieser Ebene H O R' OH H2N N R H H O 14 Einige natürlich vorkommende Peptide NH2 Glutathion (biol. Redoxsystem) O H N HOOC N H O SH Glu Gly Cys H N H2N Carnosin (Neurotransmitter) COOH H N O N β-Ala His HOOC Cys Ocytocin (Hypophysenhormon) Tyr S Ile S Gln Cys COOH Asp Pro Leu Gly NH2 2.2. PROTEINE Die Bezeichnung Protein kommt aus dem Griechischen: (proteuo) = „ich nehme den ersten Platz ein“ 15 Einteilung: 1. Skleroproteine (faserartig, Stützstrukturen, wasserunlöslich) z.B.: Keratin (Fingernägel) 2. Sphäroproteine (sphärisch gebaut, wasserlöslich, denaturierbar) z.B.: Eiklarproteine Chemische Struktur: aus einzelnen peptidisch gebundenen Aminosäuren 1 R H2N O R3 O H N R N H 2 N H 4 O R5 O H N R N H 6 O R7 O H N R COOH wegen der Planarität der peptidischen Einheiten und der Rotationsbarriere um die CN Bindung können sich leicht Wasserstoffbrücken zwischen zwei Proteinketten oder intramolekular ausbilden. → Faltblattstruktur oder Helix 1 R O H N H2N O 3 R H O N H R R O R H R5 O H O N H β-Faltblatt (antiparallel oder parallel) R R N COOH 6 O R H R3 N 4 7 O H N N 4 N 6 5 O H N N 2 R7 HOOC R O H O N H R1 H N 2 R NH2 O α-Helix 16 Beispiel: Kollagenfasern Strukturen von Proteinen: 1. Primärstruktur: Aminosäuresequenz 2. Sekundärstruktur: räumliche Anordnung der Kette (Flatblatt, Helix) nur peptidisches Rückgrat, nicht räuml. Anordnung der AS Seitenketten 3. Tertiärstruktur: Gestalt des Proteins (räuml. Anordnung aller Atome) 4. Quartärstruktur: Aggregate aus mehreren Proteinen (Dimere, Trimere, etc.) Beispiel für Protein mit Quartärstruktur aus 4 Proteinketten (Untereinheiten): Hämoglobulin