pdf-File - BMO München
Werbung

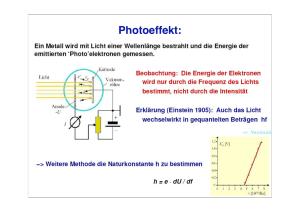
PN 2 Einführung in die Experimentalphysik für Chemiker und Biologen 13. Vorlesung – 13.7.07 Nadja Regner, Thomas Schmierer, Gunnar Spieß, Peter Gilch Lehrstuhl für BioMolekulare Optik Department für Physik Ludwig-Maximilians-Universität München Informationen zur Klausur Klausur findet am 6.8.07 von 10-12 Uhr im Liebig- und Buchner-Hörsaal statt. Wiederholungsklausur am 12.10.07 von 11-13 Uhr im Liebig- und Buchner-Hörsaal Hilfmittel: • Taschenrechner • mathematische Formelsammlung • ein beidseitig handschriftlich beschriebenes DIN A4-Blatt Biologen müssen sich bei Krankheit mit Attest entschuldigen. Atteste bitte nur an an das Prüfungssekretariat! Probeklausur mit Lösungen nächste Woche im Netz! Erinnerung cv = f (T ) M. Arndt et al. Nature 401 (1999) 680 Wärmekapazität Schwarzer Strahler Welle-Teilchen-Dualismus Lichtelektrischer Effekt Linienspektren ∆x • ∆p x ≥ h 2 Unschärfe-Relation Chemische Bindung Grenzen der klassischen Physik Hˆ ψ = Eψ Schrödinger-Gleichung Von der Welle zur Quantisierung Was heißt quantisiert? n=∞ n=7 n=6 n=5 n=4 Energie Linienspektrum des H-Atoms Quantenzahlen Experiment Linienspektrum n=3 n=2 n=1 Neben der Energie können auch weitere Größen quantisiert sein, z.B. der Drehimpuls! Die diskreten Linien in den Spektren von Atomen sind die Folge von Übergängen zwischen stationären Zuständen. Die Energie dieser Zustände kann nur diskrete Werte einnehmen – sie ist quantisiert! s,p,d,f-Orbitale Folge dieser Quantisierung Nicht quantisiert: Das freie Teilchen Wir betrachten ein (mikroskopisches) Teilchen der Masse m, das sich im kräftefreien Raum mit der Geschwindigkeit v bewegt. Impuls des Teilchens: Wellenlänge des Teilchens: Energie des Teilchens: Wellenfunktion (Lösung der zeitabhängigen Schrödinger-Gl.) Teilchen nach links − h ∂ψ = Hˆ ψ i ∂t Teilchen nach rechts Re(Ψ(x)) [a.u.] Aufenthaltwahrscheinlichkeit ψψ* 0 -10 -8 -6 -4 -2 0 2 4 6 8 10 Position xz [a.u.] Position [a.u] Ausbreitungsgeschwindigkeit der Welle: Lichtwelle ⇔ Materiewelle Licht Eigenschaft Wellenfunktion Physikalische Bedeutung der Wellenfunktion Was wird transportiert? Phasengeschwindigkeit im Vakuum Materiewelle Ein hilfreiches Modell: Teilchen im Kasten Die 1D-Bewegung des Teilchens sei jetzt durch zwei „unendlich“ harte Wände beschränkt! Klassisch wird das Teilchen an den beiden Wänden „reflektiert“ (elastischer Stoß) und fliegt „für immer“ zwischen den Wänden hin und her. Potenzielle Energie a 0 z Die Wellenfunktion des Teilchens im Kasten Die Wellenfunktion ψ ist außerhalb des Kastens gleich null. Wegen Stetigkeit daher: Experiment Stehende Welle Für die Einhüllende der stehenden Welle haben wir folgende Gleichungen gefunden: 0 a z Der Normierungsfaktor N ergibt sich aus der Forderung, das das Teilchen „irgendwo“ im Kasten sein muss. Wellenlängen λn der stehenden Welle: Betrag des Impulses (de-Broglie auf den Kopf gestellt): Hˆ ψ = Eψ Energie: Ergibt sich auch beim Lösen der Schrödinger-Gleichung! Einschränkung der Bewegungsfreiheit eines Teilchens führt zu Quantisierung der Energieniveaus! Einiges zu gebundenen Zuständen • die Energien En steigen mit der Zahl der Knoten • der Zustand n hat n-1Knoten (wenn Zählung bei n=1 beginnt) Die niedrigste Energie E1 ist ungleich null. Nullpunktsenergie! Diese Nullpunktsenergie folgt aus der Heisenbergschen Unschärfe-Relation. Sie spielt bei der chemischen Bindung eine große Rolle! 0 a x Siehe Übung! 2D- und 3D-Kästen Das Teilchen im Kasten ist nicht nur ein „Spielzeugsystem“ – sondern es lassen sich mikroskopische Objekte finden, deren Verhalten sich gut genähert über das „Teilchen im Kasten“-Modell erklären lassen. 2D 3D Auf einer Cu-Oberfläche befindet sich ein Ring aus 48 Fe-Atomen. Innerhalb des Rings beobachtet man mit einem Tunnelmikroskop eine oszillierende Elektronendichte. Nanopartikel sind extrem kleine oft kristalline Partikel, deren Eigenschaften stark von ihrer Größe abhängen. Das Photo rechts zeigt die Fluoreszenz von CdSe-Nanopartikeln verschiedener Größe. Kästen mit endlicher Tiefe: Gebundene und ungebundene Zustände V Der Kasten habe jetzt eine endliche „energetische Tiefe“ (potenzielle Energie) V. Gebundene Zustände: a Ungebundene Zustände: Das Teilchen im „endlich tiefen Kasten“ dringt in klassisch verbotene Bereiche vor! Tunneln Der Radfahrer kann (ohne zu treten) den Berg überwinden, wenn gilt: a Quantenmechanisch hätte er auch anderenfalls eine Chance! V Transmissionskoeffizient T: QMFahrer Große Bedeutung bei Radioaktivität! Atome und Quantisierung Im Wasserstoff-Atom bewegt sich das Elektron im Coulombfeld des Protons. Das Coulombpotenzial schränkt die Bewegungsfreiheit des Elektrons ein. Es kommt zur Quantisierung. + e2 1 V (r ) = − 4πε 0 r 1 0 -1 -2 Potential Energy V [eV] -3 -4 -5 Energieeigenwerte En (gebundene Zustände): -6 -7 -8 -9 -10 -11 -12 -13 -14 -15 -12 -10 -8 -6 -4 -2 0 2 Distance r [A] 4 6 8 10 12 Orbitale sind 3D-Wellenfunktionen Aus der Lösung der Schrödinger-Gleichung erhält man die Energieeigenwerte En und die zugehörigen Wellenfunktionen ψn. Diese sind komplexwertige Funktionen, die von (mindestens) den drei Raumkoordinaten abhängen. Verknüpfung mit der Aufenthaltswahrscheinlichkeit Mögliche Darstellung von Orbitalen: Flächen gleicher Amplitude Orbitale und Knoten Auch bei den Wasserstoff-Wellenfunktionen (Orbitale) steigt die Zahl der Knoten mit der Quantenzahl n. Man unterscheidet zwischen radialen und winkelabhängigen Knoten. 3p-Orbital O Winkelabhängige Knoten: Wie viele Nullstelle auf einem Halbkreis? Radiale Knoten: Wie viele Nullstellen auf dem Weg von O nach ∞? Winkelabhängige Knoten geben Information über den Drehimpuls! Orbitale und Drehimpuls Das Elektron im H-Atom kann einen Drehimpuls annehmen. Sein Betrag kann nur folgende diskrete Werte annehmen: l Drehimpulsquantenzahl Der Wert für l ergibt sich aus den winkelabhängigen Knoten. 2s 2p Die Ausrichtung des Drehimpulses im Raum wird durch die magnetische Quantenzahl ml beschrieben. 3d Beim H-Atom hängt die Energie nur von der Gesamtzahl der Knoten ab (Hauptquantenzahl n)! To do (Die Kollegen aus der PC) Verhalten des H-Atoms Berücksichtigung des Spin, Pauli-Prinzip Verhalten von Mehr-Elektronen-Atomen Überlagerung von Atom-Orbitalen Verhalten von Molekülen