Patientenspezifische iPS-Zellen und de - ren
Werbung
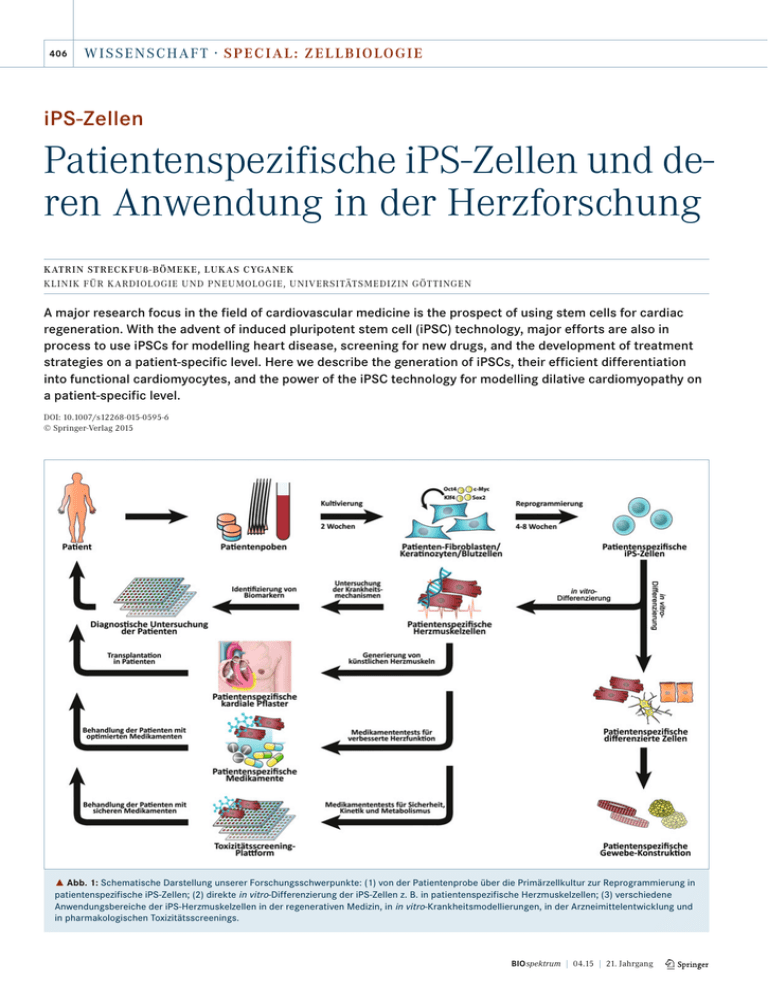
406 W I S S ENS CHAFT · S PECIA L : ZELLBIOLO GIE iPS-Zellen Patientenspezifische iPS-Zellen und deren Anwendung in der Herzforschung KATRIN STRECKFUß-BÖMEKE, LUKAS CYGANEK KLINIK FÜR KARDIOLOGIE UND PNEUMOLOGIE, UNIVERSITÄTSMEDIZIN GÖTTINGEN A major research focus in the field of cardiovascular medicine is the prospect of using stem cells for cardiac regeneration. With the advent of induced pluripotent stem cell (iPSC) technology, major efforts are also in process to use iPSCs for modelling heart disease, screening for new drugs, and the development of treatment strategies on a patient-specific level. Here we describe the generation of iPSCs, their efficient differentiation into functional cardiomyocytes, and the power of the iPSC technology for modelling dilative cardiomyopathy on a patient-specific level. DOI: 10.1007/s12268-015-0595-6 © Springer-Verlag 2015 ˚ Abb. 1: Schematische Darstellung unserer Forschungsschwerpunkte: (1) von der Patientenprobe über die Primärzellkultur zur Reprogrammierung in patientenspezifische iPS-Zellen; (2) direkte in vitro-Differenzierung der iPS-Zellen z. B. in patientenspezifische Herzmuskelzellen; (3) verschiedene Anwendungsbereiche der iPS-Herzmuskelzellen in der regenerativen Medizin, in in vitro-Krankheitsmodellierungen, in der Arzneimittelentwicklung und in pharmakologischen Toxizitätsscreenings. BIOspektrum | 04.15 | 21. Jahrgang Pluripotente Stammzellen ó Die Entdeckung der Selbsterneuerung von lebenden Zellen war eine der bahnbrechendsten Durchbrüche in der Zellbiologie, die 1961 von Till und Mc Culloch publiziert wurde [1]. Spätere Studien erweiterten das Potenzial dieser Zellen zu der Fähigkeit, in Zelltypen aller drei Keimblätter zu differenzieren, und zur Selbsterneuerung ohne Alterung und definierten sie als Stammzellen. Stammzellen werden aufgrund ihres Ursprungs in adulte Stammzellen und embryonale Stammzellen eingeteilt, und ihr Differenzierungspotenzial lässt eine weitere Einteilung in unipotente, multipotente, pluripotente und totipotente Stammzellen zu [2]. Totipotent werden Zellen genannt, wenn sie sowohl in embryonales als auch in extra-embryonales Gewebe, wie die Plazenta, differenzieren können und so einen Embryo und später einen reifen Organismus produzieren können (Zygote bis Acht-Zell-Stadium). Pluripotente Stammzellen können dagegen in alle Zelltypen des adulten Körpers differenzieren. Diese Eigenschaft existiert nur während einer spezifischen kurzen Zeitspanne in den Zellen, die die innere Zellmasse des frühen Embryos bilden. Während der Differenzierung in verschiedene Zelllinien sinkt das Selbsterneuerungspotenzial aufgrund epigenetischer Veränderungen, was wiederum zum Pluripotenzverlust in adulten Stammzellen führt. 1981 wurden embryonale Stammzellen aus der inneren Zellmasse von murinen Blastozysten isoliert und kultiviert [3], und die Herstellung von humanen embryonalen Stammzellen (hES-Zellen) folgte ganze 20 Jahre später [4]. Für die Erzeugung von hES-Zellen sind humane Embryonen notwendig, und somit traten ethische Probleme auf. Der wissenschaftliche Fokus war nun also auf die Suche nach einer alternativen adulten Stammzelle mit den Eigenschaften von hES-Zellen gelenkt, um diese ethische Hürde zu umgehen. Der größte Durchbruch dabei war die Herstellung von induzierten pluripotenten Stammzellen (iPS-Zellen) in der Gruppe des Japaners Shinya Yamanaka, der hierfür einige Jahre später, 2012, den MedizinNobelpreis erhielt [5]. iPS-Zellen können aus somatischen Zellen der Maus, BIOspektrum | 04.15 | 21. Jahrgang des Primaten oder des Menschen hergestellt werden, indem verschiedene Reprogrammierungsfaktoren in die Zellen „eingeschleust“ werden. Ebenso wie hES-Zellen haben iPS-Zellen das Potenzial zur Selbsterneuerung und zur Differenzierung und können somit als ethisch unbedenkliche Alternative für hES-Zellen für verschiedene Anwendungen benutzt werden. Vom Patienten zu patientenspezifischen iPS-Zellen Für die Reprogrammierung von ausgereiften menschlichen Zellen in einen den embryonalen Stammzellen ähnlichen pluripotenten Zustand sind vier essenzielle Transkriptionsfaktoren (Oct4, Sox2, c-Myc und Klf4) notwendig [5]. Diese iPS-Zellen können aus somatischen Zellen unterschiedlichen Ursprungs, wie z. B. aus HautFibroblasten, Haarwurzelzellen oder mononukleären Blutzellen, hergestellt werden. Mittels dieser Methode lassen sich also von jedem Menschen die jeweiligen körpereigenen Stammzellen in der Kulturschale herstellen, welche das identische Genom des Spenders und somit auch die gleichen genetischen Varianten oder Defekte in sich tragen [6]. Wir rekrutieren in unserem Labor Patienten mit genetisch bedingten Herzerkrankungen sowie gesunde Probanden und legen aus den gespendeten nur wenige Millimeter kleinen Hautbiopsien, Haarproben oder Blutproben die jeweiligen Primärzellkulturen an. Mithilfe von nicht-integrierenden Viren, DNA-Plasmiden oder RNA-Proben werden die vier essenziellen Pluripotenzfaktoren in die patienteneigenen Zellen „geschleust“. Diese wandeln sich anschließend über den Zeitraum von ungefähr drei bis vier Wochen in patientenspezifische iPS-Zellen um. Die erzeugten iPS-Zelllinien werden in unserem Labor in den folgenden Monaten auf ihre Stammzell-typischen Eigenschaften überprüft, vervielfacht und bis zur weiteren Anwendung in großen, mit flüssigem Stickstoff gefüllten Tanks bei –155 °C aufbewahrt. Somit konnten wir in den letzten Jahren eine Biobank mit iPS-Zellen von Patienten mit unterschiedlichen genetischen Herzerkrankungen sowie von 408 W I S S ENS CHAFT · S PECIA L : ZELLBIOLO GIE ˚ Abb. 2: Reprogrammierung der Patienten-Ursprungszellen in patientenspezifische iPS-Zellen sowie die anschließende in vitro-Differenzierung zu patientenspezifischen Herzmuskelzellen aufgenommen als lebende Zellen in Durchlicht oder als Immunfluoreszenz-gefärbte Zellen mit einem konfokalen Mikroskop. A B C D ˚ Abb. 3: Modellierung verschiedener Ausprägungen der dilatativen Kardiomyopathie (DCM) mittels patientenspezifischer iPS-Herzmuskelzellen. A, schematische Darstellung des alternativen Spleißfaktors RBM20 mit 14 verschiedenen Exons. Farblich markiert sind konservierte Bereiche zwischen verschiedenen Spezies (P-rich: Prolin-reich; ZnF: Zinkfinger; RRM: RNA-recognition motif; RS: Arginin-Serin-reich). Die Lokalisation der Mutationen der beiden untersuchten RBM20Patienten ist mit roten Pfeilen markiert. B, Desorganisierte α-Aktinin-Sarkomerstruktur in iPSHerzmuskelzellen von Patient 1 und 2 visualisiert in Immunfluoreszenz-gefärbten Zellen mit einem konfokalen Mikroskop. C, Quantifizierung der Regularität von iPS-Herzmuskel-Sarkomerstrukturen mittels der Fast-Fourier-Methode; n = 7 ± Standardfehler, ***: p < 0,001. D, verringerte mRNAExpression bestimmter Spleißformen des Titin-Gens (TTN) in iPS-Herzmuskelzellen von Patient 1; n = 5 (Kontrolle) n = 3 (1-RBM20/2-RBM20) ± Standardfehler, **: p < 0,01. zahlreichen gesunden Spendern aufbauen (Abb. 1). Nach heutigem Forschungsstand ist man bereits in der Lage, die iPS-Zellen ganz gezielt in vielerlei unterschiedliche Zelltypen, wie Nervenzellen, Leberzellen oder Herzmuskelzellen, zu entwickeln. Von patientenspezifischen iPS- zu Herzmuskelzellen Aus zahlreichen Experimenten der letzten Jahrzehnte an unterschiedlichen Tiermodellen werden die Herzentwicklung im menschlichen Embryo und die damit verbundenen wichtigen Signalwege immer besser verstanden [7]. Dies macht es uns heute möglich, die Entwicklung in der Kulturschale nachzuahmen und aus iPS-Zellen gezielt Herzmuskelzellen herzustellen (Abb. 2). Durch eine zeitlich exakt abgestimmte Beeinflussung der kanonischen Wnt/β-Catenin-Signalwegkaskade können wir pluripotente Stammzellen mithilfe kleiner chemischer Moleküle zunächst in Zellen des Mesoderms und anschließend in Richtung von Herz-Vorläuferzellen entwickeln lassen. Bereits nach acht Tagen können von selbst „schlagende“, kontrahierende Herzmuskelzellen beobachtet werden [8]. Zudem ist es uns gelungen, gezielt bestimmte kardiale Subtypen – Herzkammeroder Herzvorhofzellen – herzustellen und diese in Kultur weiter ausreifen zu lassen. Wir erreichen eine relativ homogene Population von funktionellen Herzmuskelzellen in hoher Anzahl und Reinheit, welche viele molekulare, strukturelle und funktionelle Eigenschaften normaler, im Körper entwickelter Zellen aufweisen und somit ein einzigartiges Modell für alle weiteren Anwendungen bieten [9]. Durch die Verwendung patientenspezifischer iPS-Zellen in der biomedizinischen Grundlagenforschung ist es möglich, die jeweiligen patienteneigenen Herzmuskelzellen in vitro herzustellen, hierdurch den Krankheitsphänotyp zu rekapitulieren und ein besseres Verständnis der Entstehung, Entwicklung und des Fortschreitens der Herzerkrankungen, wie Herzinsuffizienz und Herzrhythmusstörungen, zu gewinnen. Mit dem zukünftigen Ziel einer personalisierten Medizin lassen sich diese Zellen bei der Entwicklung neuer Behandlungsstrategien und Medikamente für die Bekämpfung menschlicher Krankheiten sowie bei Arzneimitteltoxizitätstestungen verwenden. Die stammzellbasierte Therapie wird als innovative Option BIOspektrum | 04.15 | 21. Jahrgang in therapeutischen Ansätzen der Herzregeneration betrachtet, wobei insbesondere die Herstellung von künstlichem Herzgewebe an immer größerer Bedeutung gewinnt. Derzeit testen wir in Zusammenarbeit mit weiteren Arbeitsgruppen die Anwendung und Transplantation von aus iPS-Zellen hergestellten patientenspezifischen Herzmuskel-Pflastern zur Verbesserung der geschädigten Herzfunktion, z. B. nach einem Herzinfarkt. Diese Einblicke zeigen die vielfältigen Einsatzmöglichkeiten der patientenspezifischen iPS-Zellen als vielversprechendes Werkzeug in regenerativen Anwendungen, in Krankheitsmodellierungen in der Kulturschale, in der Arzneimittelentwicklung und in pharmakologischen Toxizitätsscreenings (Abb. 1). In vitro-Krankheitsmodellierung mit patientenspezifischen Herzmuskelzellen Wie bereits erwähnt, stellt ein mögliches Anwendungsgebiet von iPS-generierten Herzmuskelzellen das Etablieren eines in vitro-Krankheitsmodells dar, um die zugrunde liegenden pathophysiologischen Mechanismen zu entschlüsseln und anschließend wirksamere Strategien für die Prävention und Behandlung der Erkrankungen zu entwickeln. Ein Fokus unserer wissenschaftlichen Arbeit ist die dilatative Kardiomyopathie (DCM), eine Erkrankung, bei der das Myokard betroffen ist und bei der es zu einer Vergrößerung des Volumens im linken Ventrikel kommt. Dadurch ist die systolische Pumpfunktion eingeschränkt, was oft in Herzversagen und damit verbundener Herztransplantation resultiert. Etwa 30 Prozent aller DCM-Fälle haben einen genetischen Hintergrund. Die Ursache sind Mutationen in bislang etwa 30 verschiedenen Genen, die in unterschiedlichen Signalwegen eine Rolle spielen. Eines dieser betroffenen Gene ist das Gen für das RNA-bindende Motiv 20 (RBM20). RBM20 ist ein alternativer Spleißfaktor und somit in viele verschiedene Regulationsmechanismen involviert [10]. Mittels des patientenspezifischen iPSZellsystems war es uns im StammzellLabor der Kardiologie möglich, somatische Haut-Fibroblasten von zwei DCM- BIOspektrum | 04.15 | 21. Jahrgang Patienten mit verschiedenen RBM20Mutationen in unterschiedlich stark konservierten Bereichen dieses Proteins in iPS-abgeleitete Herzmuskelzellen zu differenzieren, um den krankheitsspezifischen Phänotyp zu untersuchen. Die beiden Patienten haben unterschiedliche Ausprägungen der Erkrankung von einer sehr schwerwiegenden DCM-Form mit Mutation in einem konservierten RBM20-Bereich bis hin zu einer milden Ausprägung in dem zweiten Patienten mit Mutation in einer wenig konservierten Region des RBM20-Proteins (Abb. 3A). Wir haben uns die Fragen gestellt, ob die Lokalisation der Mutation ausschlaggebend für den Phänotyp ist und ob es möglich ist, mittels des iPSZellsystems diese unterschiedlichen DCM-Phänotypen darzustellen. Wir konnten zeigen, dass die generierten patientenspezifischen iPS-Herzmuskelzellen eine desorganisierte Sarkomerstruktur haben (Abb. 3B), die mittels mathemathischer Formeln (Fast-FourierMethode) bestimmt und grafisch aufgezeigt werden kann (Abb. 3C). Des Weiteren weisen die patientenspezifischen iPS-Herzmuskelzellen einen Spleißdefekt anhand des kardialen Titins auf (Abb. 3D). Darüber hinaus können Unterschiede zwischen iPS-Herzmuskelzellen von verschiedenen Patienten aufgezeigt werden, je nachdem, wo die Mutation im RBM20 lokalisiert ist. Somit wird der unterschiedliche Schweregrad der Erkrankung beim Patienten auch in vitro widergespiegelt. Mithilfe dieses Systems ist es nun nachfolgend möglich, auf patientenspezifischer Ebene einen therapeutischen Ansatz zu entwickeln. ó Literatur [1] Till JE, McCulloch EA (1961) A direct measurement of the radiation sensitivity of normal mouse bone marrow cells. Radiat Res 14:213–222 [2] Lan ML, Acharya MM, Tran KK et al. (2012) Characterizing the radio response of pluripotent and multipotent human stem cells. PLoS One 7:e50048 [3] Evans MJ, Kaufman MH (1981) Establishment in culture of pluripotential cells from mouse embryos. Nature 292:154–156 [4] Thomson JA, Itskovitz-Eldor J, Shapiro SS et al. (1998) Embryonic stem cell lines derived from human blastocysts. Science 282:1145–1147 [5] Takahashi K, Tanabe K, Ohnuki M et al. (2007) Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 31:861–872 [6] Robinton DA, Daley GQ (2012) The promise of induced pluripotent stem cells in research and therapy. Nature 481:295–305 [7] Vincent SD, Buckingham ME (2010) How to make a heart: the origin and regulation of cardiac progenitor cells. Curr Top Dev Biol 90:1–41 410 W I S S ENS CHAFT · S PECIA L : ZELLBIOLO GIE [8] Lian X, Hsiao C, Wilson G et al. (2012) Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proc Natl Acad Sci USA 109:E1848–1857 [9] Streckfuss-Bömeke K, Wolf F, Azizian A et al. (2013) Comparative study of human-induced pluripotent stem cells derived from bone marrow cells, hair keratinocytes, and skin fibroblasts. Eur Heart J 34:2618–2629 [10] Guo W, Schafer S, Greaser ML et al. (2012) RBM20, a gene for hereditary cardiomyopathy, regulates titin splicing. Nat Med 18:766–773 Korrespondenzadresse: Dr. Katrin Streckfuß-Bömeke Dr. Lukas Cyganek Klinik für Kardiologie und Pneumologie Universitätsmedizin Göttingen Robert-Koch-Straße 40 D-37075 Göttingen Tel.: 0551-39-66380 (K. Streckfuß-Bömeke), -66280 (L. Cyganek) [email protected], [email protected] www.herzzentrum-goettingen.de/de/content/ forschung/142.html www.herzzentrum-goettingen.de/de/content/ forschung/1277.html AUTOREN Katrin Streckfuß-Bömeke 1996–2002 Biologiestudium an der Universität Göttingen, dort 2006 Promotion und Postdoc in der Mikrobiologie und Genetik. 2006–2012 wissenschaftliche Mitarbeiterin im Stammzell-Labor der Kardiologie und Pneumologie, Universitätsmedizin Göttingen, dort seit 2013 unabhängige Gruppenleiterin „Translationale Stammzellforschung“. Lukas Cyganek 2004–2009 Chemie- und Biologiestudium (Lehramt) an der Universität Göttingen, dort 2012 Promotion am European Neuroscience Institute. Seit 2013 Projekt-Koordinator in der Stem Cell Unit – Göttingen des Deutschen Zentrums für Herz-Kreislaufforschung und der Universitätsmedizin Göttingen sowie wissenschaftlicher Mitarbeiter im Stammzell-Labor der Kardiologie und Pneumologie, Universitätsmedizin Göttingen. BIOspektrum | 04.15 | 21. Jahrgang