Elektrophoresen
Werbung

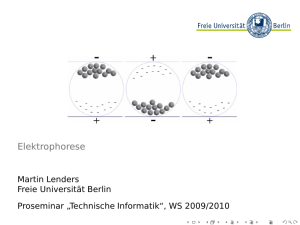
Elektrophoresen Was ist das? Wozu dient es? Wie wird’s gemacht? Welche Aussage erhalten wir? Was ist Elektrophorese? Definition: Labortechnik, bei der Gemische von Stoffen oder Teilchen aufgetrennt werden, weil sie in einem elektrischen Feld unterschiedlich schnell wandern Geschichte:ca. 1930 vom Schweden Arne Tiselius eingeführt -> „TiseliusSystem“ Name: -phor= griechisch= „tragen“, „Elektro-“Æ Methode funktioniert durch Anlegen eines elektrischen Feldes Medizinische Anwendungen: Serum-Eiweiß-Elektrophorese -> Serumproteine Serum-Immunelektrophorese -> Immunglobuline Serum-/Urin- Immunfixationselektrophorese -> Imm.glob. Urin-LDS-Elektrophorese („Disk-Elpho“) -> Urinproteine Lipoprotein-Elektrophorese („Lipid-Elpho“) -> „Blutfette“ Hämoglobin-Elektrophorese -> Hämoglobinketten Erbsubstanz -> Blotting Das Prinzip (allgemein) Verschiedene Stoffe wandern im elektrischen Feld verschieden schnell. Das ist die Grundlage der Auftrennung von Stoffen bei der Elektrophorese. Allgemeines Im elektrischen Feld wandern bewegliche, elektrisch geladene Teilchen zum entgegengesetzt geladenen Pol. Positiv-geladene Teilchen (Kationen) wandern zum Minus-Pol (Kathode), negativgeladene Teilchen (Anionen) wandern zum Plus-Pol (Anode). Aber verschiedene Teilchen wandern verschieden schnell. Und es sind besonders zwei Eigenschaften eines Teilchens, die seine Wanderungsgeschwindigkeit bestimmen: Je größer die Ladung, desto schneller die Wanderung Die Ladung Stoffe mit größerer negativer Ladung wandern schneller zum Plus-Pol als die schwächer geladenen: Am Ende der Elektrophorese sind die stärker geladenen Teilchen weiter gewandert. Je kleiner das Teilchen, desto schneller ist die Wanderung Größe Kleinere Teilchen wandern schneller als größere: Am Ende der Elektrophorese ist das kleinere Teilchen weiter gewandert. Völlig verschiedene Stoffe können in der Elektrophorese gleich schnell wandern: Da sowohl die Ladung als auch die Größe eines Stoffes Einfluss auf die Wanderungsgeschwindigkeit haben, kann man bei zwei gleich schnell wandernden Stoffen nicht sicher sagen kann, ob sie einander sehr ähnlich sind, oder ob sie sich in Sachen Größe und Ladung stark aber gegenläufig unterscheiden. So kann z.B ein großer stark geladener Stoffe genauso schnell wandern wie ein kleiner aber nur schwach geladener. Wozu dient die SerumeiweißElektrophorese? •Erkennung und Beobachtung des Verlaufs von "abnormen„ Proteinen (Paraproteinen) •Erkennung und Beobachtung von Eiweißverlusten Eiweiß kann z.B. über die Niere, über den Darmtrakt oder über die Haut verloren gehen. Das Muster der im Blut verbleibenden Eiweißstoffe, kann Hinweise auf die Ursache des Eiweißverlusts liefern. •Erkennung und Beobachtung von Entzündungen Akute (=plötzliche, kurz dauernde) und chronische (=lang dauernde Entzündungen) zeigen bestimmte Muster in der Serumeiweiß-Elektrophorese •Abklärung auffälliger Laborbefunde Das Prinzip der SerumeiweißElektrophorese Bei der Serumeiweiß-Elektrophorese versucht man, die verschiedenen Eiweißstoffe (Proteine) der Blutflüssigkeit durch ein elektrisches Feld aufzutrennen. Die Proteine müssen dazu elektrisch geladen sein Damit eine Auftrennung funktioniert, muss man dafür sorgen, dass alle Proteine im geladenen Zustand vorliegen. Das hängt davon ab, wie der pH-Wert der Lösung ist. Ungeladenes Protein Dieser Eiweißstoff ist in der Summe ungeladen. Er hat zwar zwei negativ geladene Gruppen (COO-), aber durch Anlagerung von 2 positiven H-Ionen besitzt er auch zwei positiv geladene Gruppen (NH3+). Dies ist für die Elektrophorese ungünstig, weil das Protein so nicht wandern würde. Der Elektrophorese-Puffer Der pH der Lösung muss im alkalischen Bereich liegen Damit eine Elektrophorese von Proteinen gelingt, sorgt man dafür, dass die Lösung, in der die Proteine gelöst sind und in der sie wandern sollen, relativ knapp an H-Ionen ist, d.h. einen alkalischen pH-Wert aufweist. Dann verlieren die Proteine ihre H-Ionen, sind daher negativ geladen und wandern in der Elektrophorese einheitlich zum Plus-Pol. Die Trennung von Proteinen wird bei der Elektrophorese also in einer Lösung durchgeführt, die einen alkalischen pH haben muss. Und dieser pH darf sich während der Elektrophorese auch nicht ändern. Die Trennung der Proteine Das Serum wird in der Nähe des Minus-Pols aufgetragen. Spannung wird angelegt. Die verschiedenen Proteine wandern unterschiedlich schnell. Nach Ende der Elektrophorese sind verschiedene Proteingruppen voneinander getrennt. Die Cellulose-Azetat-FolienElektrophorese Nach der Auftrennung wird die Cellulose-Azetat-Folie aus dem Elektrophorese-Apparat genommen und mit einem Proteinfarbstoff (z.b. Ponceau-Rot) gefärbt. So sieht eine gefärbte Serumeiweiß-Elektrophorese auf Cellulose-Azetat aus. Rechts die Proteine, die am schnellsten und daher am weitesten gewandert sind. Abtrennung der wichtigsten ProteinFraktionen Die Elektrophoresekurve Durch Abtasten der transparent gemachten Folie in einem Photometer oder einem Scanner entsteht aus den Unterschieden der Färbeintensität in der Folie eine Kurve - die Elektrophoresekurve. Welche Eiweißstoffe befinden sich in den einzelnen Fraktionen? (1) w w w Albuminfraktion: Wie der Name sagt, dominiert in der Albuminfraktion das Albumin,das den größten Teil des Serumeiweißes ausmacht Alpha-1-Fraktion (Alpha-1-Globulin): alpha-1-Lipoprotein (HDL) alpha-1-Glykoprotein (=Orosomukoid) alpha-1-Antitrypsin Alpha-2-Fraktion (Alpha-2-Globulin): Alpha-2-Makroglobulin Coeruloplasmin Haptoglobin Welche Eiweißstoffe befinden sich in den einzelnen Fraktionen? (2) w w w w Alpha-2-Fraktion bzw. Übergang von Alpha-2 zu Beta: prä-Beta-Lipoprotein (VLDL/Triglyzeride) Beta-Fraktion (Beta-Globulin): Hämopexin Transferrin Beta-Lipoprotein (LDL) Komplement Am Übergang von Beta zu Gamma: Antikörper der Klasse IgA Fibrinogen (nur bei der Plasmaeiweiß-Elektrophorese) Gamma-Fraktion (Gamma-Globuline): Antikörper der Klasse IgG und IgM Beispiele von SerumeiweißElektrophoresen (1) Normale Elektrophorese Es dominiert die Albuminfraktion (ca. 60%). Die Alpha-1-Globuline machen etwa 4% aus, die Alpha-2-Globuline 8%, die Beta-Globuline 12% und die Gamma-Globuline 16%. Beispiele von SerumeiweißElektrophoresen (2) Akute Entzündung Die Alpha-1- und die Alpha2-Globuline sind im Vergleich zur normalen Kurve (grün) deutlich erhöht. Das kann bei jeder Art von akuter Entzündung vorkommen, besonders bei bakterieller Entzündung. Virale Entzündungen zeigen geringere Veränderungen. Auch nicht-infektiöse Entzündungen (z.B. Verbrennungen, Herzinfarkt) können dieses Bild zeigen. Beispiele von SerumeiweißElektrophoresen (3) Beta-Gamma-Typ Vom Beta-Gamma-Typ spricht man, wenn der BetaGipfel ohne klare Abtrennung in den GammaBereich übergeht. Der BetaGamma-Typ findet sich bei Leberzirrhose verschiedener Ursache. Verursacht wird dies durch die Erhöhung der Immunglobuline. Beispiele von SerumeiweißElektrophoresen (4) Paraproteinämie Mann nennt es auch MProtein und die Zacke der Kurve M-Gradient, wobei das M für monoklonal steht ("1 Klon"). Paraproteine kommen vor bei Lymphomen (Krebs der Lymphozyten in Lymphknoten und/oder Blut) und beim Plasmozytom (Krebs der Plasmazellen; meist im Knochenmark). Die monoklonale Gammopathie (Paraproteinämie) Definition: Erhöhte Konzentration monoklonaler (= aus einem B-Zellklon) Immunglobuline Monoklonale Immunglobuline:bei neoplastischer Vermehrung einer immunkompetenten B-Zelle -> bildet funktionell/strukturell einheitliche Immunglobuline (je 2 Schwer- und Leichtketten) Schwerkettentypen: IgA(α), IgG (γ), IgM (µ) , (IgE, IgD) Leichtkettentypen: Kappa (κ), Lambda (λ) Einteilung monoklonaler Gammopathien (MG): Maligne/symptomatische MG (Plasmozytom, Immunozytom...) Fakultativ/begleitende MG (CLL, NHL, Mamma-, Colon-Ca.) MG unbestimmter Signifikanz (MGUS) Passagere MG (Hepatitis, Vaskulitis, chron. Infekte...) Kryoglobulinämie (s.o., Virusinfekte: EBV, CMV,autoimm, idiop.) Labordiagnostik monoklonaler Gammopathien Serumeiweißelektrophorese: M-Gradient (nicht immer nachweisbar!) Immunelektrophorese (Serum, qualitativ) Immunfixationselektrophorese (Serum, qualitativ) Æ Klassifizierung des monoklonalen Immunglobulins: - > Ausschluss freier Leichtketten*: Immunfixationselektrophorese im Urin (qualitativ) Quantitativer Nachweis freier Leichtketten in Serum und Urin *“Freie Leichtketten“: durch ineffektive oder gestörte Immunglobulinsynthese werden bei einigen Gammopathien sog. freie Leichtketten (d.h. ohne Schwerketten) produziert. Diese sind oft Ursache einer begleitenden Amyloidose mit nachfolgenden schweren Nieren-, Gefäß- oder Lungenerkrankungen --> Marker für eine schlechte Prognose der Erkrankung Ausscheidung im Urin-> BENCE-JONES-PROTEINURIE ! Immunelektrophorese (nach Grabar): Die Antigene werden zunächst im elektrischen Feld aufgrund ihrer unterschiedlichen Ladung aufgetrennt Nach Beendigung der Elektrophorese wird parallel zur Laufstrecke in eine Rinne das Antiserum eingefüllt. Während der nachfolgenden Inkubation diffundiert jedes der vorher elektrophoretisch aufgetrennten Antigene jeweils radial nach allen Seiten, während die Antikörper in einer parallel zur Rinne verlaufenden Front aus der Rinne herausdiffundieren. Dort wo die Diffusionszonen sich treffen, entstehen längliche, halbmondförmige Präzipitatlinien. Monoklonale Leicht- und Schwerketten sind an Verdickungen und schüssel- oder löffelförmigen Deformationen der Präzipitate zu erkennen Immunelektrophorese (nach Grabar): Immunfixations-Elektrophorese Man erhält Präzipitate innerhalb von ca.1 Stunde (Immunelektrophorese dauert mindestens 1 Tag) weniger Artefakte, deutlichere Aussage über Monoklonalität Meistens 5 Antiseren verwendet (Frage: monoklonale Gammopathie) 3 Ak gegen schwere Ketten (AntiIgG, Anti-IgA, Anti-IgM 2 Ak gegen leichte Ketten (Anti-Igkappa, Anti-Ig-lambda) Erkennen freier Leichtketten im Urin -> BENCE-JONES-PROTEINE homogene, scharfe Banden im diffusen Präzipitat: sprechen für monoklonale Gammopathie