„Erste-Klasse-Ticket“ für Antigene: Zelluläre Stationen
Werbung
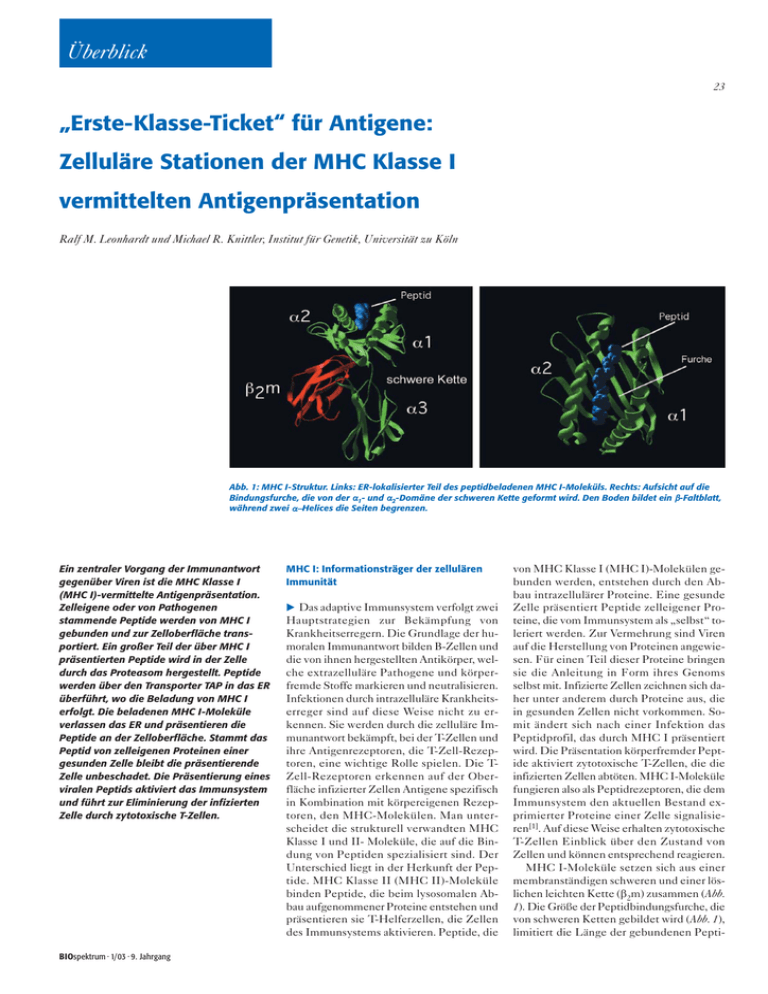
Überblick 23 „Erste-Klasse-Ticket“ für Antigene: Zelluläre Stationen der MHC Klasse I vermittelten Antigenpräsentation Ralf M. Leonhardt und Michael R. Knittler, Institut für Genetik, Universität zu Köln Abb. 1: MHC I-Struktur. Links: ER-lokalisierter Teil des peptidbeladenen MHC I-Moleküls. Rechts: Aufsicht auf die Bindungsfurche, die von der α1- und α2-Domäne der schweren Kette geformt wird. Den Boden bildet ein β-Faltblatt, während zwei α−Helices die Seiten begrenzen. Ein zentraler Vorgang der Immunantwort gegenüber Viren ist die MHC Klasse I (MHC I)-vermittelte Antigenpräsentation. Zelleigene oder von Pathogenen stammende Peptide werden von MHC I gebunden und zur Zelloberfläche transportiert. Ein großer Teil der über MHC I präsentierten Peptide wird in der Zelle durch das Proteasom hergestellt. Peptide werden über den Transporter TAP in das ER überführt, wo die Beladung von MHC I erfolgt. Die beladenen MHC I-Moleküle verlassen das ER und präsentieren die Peptide an der Zelloberfläche. Stammt das Peptid von zelleigenen Proteinen einer gesunden Zelle bleibt die präsentierende Zelle unbeschadet. Die Präsentierung eines viralen Peptids aktiviert das Immunsystem und führt zur Eliminierung der infizierten Zelle durch zytotoxische T-Zellen. BIOspektrum · 1/03 · 9. Jahrgang MHC I: Informationsträger der zellulären Immunität Das adaptive Immunsystem verfolgt zwei Hauptstrategien zur Bekämpfung von Krankheitserregern. Die Grundlage der humoralen Immunantwort bilden B-Zellen und die von ihnen hergestellten Antikörper, welche extrazelluläre Pathogene und körperfremde Stoffe markieren und neutralisieren. Infektionen durch intrazelluläre Krankheitserreger sind auf diese Weise nicht zu erkennen. Sie werden durch die zelluläre Immunantwort bekämpft, bei der T-Zellen und ihre Antigenrezeptoren, die T-Zell-Rezeptoren, eine wichtige Rolle spielen. Die TZell-Rezeptoren erkennen auf der Oberfläche infizierter Zellen Antigene spezifisch in Kombination mit körpereigenen Rezeptoren, den MHC-Molekülen. Man unterscheidet die strukturell verwandten MHC Klasse I und II- Moleküle, die auf die Bindung von Peptiden spezialisiert sind. Der Unterschied liegt in der Herkunft der Peptide. MHC Klasse II (MHC II)-Moleküle binden Peptide, die beim lysosomalen Abbau aufgenommener Proteine entstehen und präsentieren sie T-Helferzellen, die Zellen des Immunsystems aktivieren. Peptide, die von MHC Klasse I (MHC I)-Molekülen gebunden werden, entstehen durch den Abbau intrazellulärer Proteine. Eine gesunde Zelle präsentiert Peptide zelleigener Proteine, die vom Immunsystem als „selbst“ toleriert werden. Zur Vermehrung sind Viren auf die Herstellung von Proteinen angewiesen. Für einen Teil dieser Proteine bringen sie die Anleitung in Form ihres Genoms selbst mit. Infizierte Zellen zeichnen sich daher unter anderem durch Proteine aus, die in gesunden Zellen nicht vorkommen. Somit ändert sich nach einer Infektion das Peptidprofil, das durch MHC I präsentiert wird. Die Präsentation körperfremder Peptide aktiviert zytotoxische T-Zellen, die die infizierten Zellen abtöten. MHC I-Moleküle fungieren also als Peptidrezeptoren, die dem Immunsystem den aktuellen Bestand exprimierter Proteine einer Zelle signalisieren[1]. Auf diese Weise erhalten zytotoxische T-Zellen Einblick über den Zustand von Zellen und können entsprechend reagieren. MHC I-Moleküle setzen sich aus einer membranständigen schweren und einer löslichen leichten Kette (β2m) zusammen (Abb. 1). Die Größe der Peptidbindungsfurche, die von schweren Ketten gebildet wird (Abb. 1), limitiert die Länge der gebundenen Pepti- Überblick 24 Wie können diese Proteine von solchen unterschieden werden, die noch nicht abgebaut werden sollen? Dies erfolgt durch die Kennzeichnung mittels einer Polypeptidkette, deren Untereinheit das konservierte Ubiquitin ist. Ein Protein mit einer solchen Markierung wird vom 19S Komplex erkannt und vom 26S Proteasom abgebaut. Ein wichtiger Schritt nach der ErAbb. 2: Das Proteasom. Das 20S Proteasom setzt sich aus vier Ringen kennung einer Inzusammen. Die beiden äußeren Ringe bestehen aus 7 α- und die beiden fektion ist die Alarinneren aus 7 β-Untereinheiten. Das 26S-Proteasom entsteht durch Anfügen von 19S-Komplexen an das 20S Proteasom. Nach Stimulation mit mierung des ImInterferon-γ nehmen LMP2, LMP7 und MECL-1 den Platz der konstitutiv munsystems. Hierzu exprimierten β-Untereinheiten X, Y und Z ein und es bildet sich das beginnen Zellen des Immunoproteasom. Eine weitere induzierbare Komponente ist der PA28Immunsystems mit Komplex. der Ausschüttung von Interferon-γ. In Zellen, die dieses de auf 8–11 Aminosäuren. Innerhalb der Bin- Signal empfangen, wird die Herstellung von dungsfurche von MHC I befinden sich hy- Proteinen induziert, die wichtige Funktiodrophobe Taschen, die von den variablen nen bei der Immunabwehr ausüben. Zu dieAnteilen des Proteins gebildet werden. Die sen zählen die Proteasomuntereinheiten Bindungsfurche kann über diese Taschen LMP2, LMP7 und MECL-1. Sie ersetzen mit passenden Aminosäuren eines Peptids die konstitutiv exprimierten aktiven β-Uninteragieren. Damit ein Peptid gebunden tereinheiten X, Y und Z[2] (Abb. 2). Das so wird, muss es Verankerungsreste aufweisen. veränderte Proteasom, das ImmunoproteaBesonders wichtig sind die C-terminalen som, spaltet Polypeptide bevorzugt hinter Aminosäuren, die meist einen hydrophoben oder basischen Charakter besitzen, während die restlichen Aminosäuren variabel sind. hydrophoben und basischen Aminosäuren. Möglicherweise sind die erzeugten Peptide besser für die MHC-Beladung geeignet als Peptide, die durch das eigentliche Proteasom gebildet werden. Eine weitere proteasomale Komponente, die induziert wird, ist der PA28 Komplex[2] (Abb. 2). Er bindet an die Seiten des Grundkomplexes und bewirkt vermutlich die Ausführung von Doppelschnitten durch das Proteasom. Wahrscheinlich wird so die Entstehung von Peptiden mit geeigneter Länge für die MHCBeladung begünstigt. Das Anzeigen einer Infektion erfolgt nicht nur über den Abbau gealterter Fremdproteine. Durch „Fehler“ während der Translation entstehen defekte Proteinprodukte (Abb. 3), die proteasomal abgebaut werden und einen schnellen Nachschub für MHC I liefern[3]. Da die Fehlerrate bis zu 30% erreicht, könnte dieser Weg eine direkte Abkürzung zwischen Proteinsynthese und Antigenpräsentation darstellen. TAP: Ein ABC-Transporter im Dienste der Antigenpräsentation Die ER-Membran bildet eine Barriere, die den unkontrollierten Eintritt zytosolischer Substanzen ins ER verhindert. Somit können Peptide nicht ohne weiteres zu den MHC I-Molekülen gelangen und müssen eingeschleust werden. Diese Aufgabe übernimmt TAP (Transporter assoziiert mit Antigenprozessierung)[4]. TAP gehört zur Familie der ATP-Bindungs-KassettenTransporter (ABC-Transporter), die die größte Gruppe verwandter Proteine darstellt. ABC-Transporter arbeiten unter ATP- Herstellung von Peptidantigenen: Proteinabbau mit „Wiederverwertung“ Eine entscheidende Rolle beim zellulären Proteinabbau spielt das Proteasom (Abb. 2). Es ist wichtig für den Proteinmetabolismus und für die Herstellung von Peptidantigenen. Das 20S Proteasom besteht aus zwei äußeren Ringen mit je sieben α-Untereinheiten und zwei inneren Ringen mit je sieben β-Untereinheiten. Es besitzt verschiedene proteolytische Aktivitäten, die Polypeptide hinter hydrophoben, basischen oder sauren Aminosäuren spalten. Dieser Grundkomplex kann mit anderen regulatorischen Proteinen assoziieren und das 26S Proteasom bilden (Abb. 2). Dieses entsteht durch Anfügen von 19S Komplexen an beiden Enden des 20S Proteasoms. Die 19S Komplexe erkennen „ausgemusterte“ Proteine und führen sie dem proteasomalen Abbau zu. Abb. 3: Fehlerhafte Proteinsynthese liefert Peptidantigene. Defekte ribosomale Produkte (DRiPs) werden mit Ubiquitin markiert und über das Proteasom direkt abgebaut. Nach dem Transport ins ER gelangen die Peptide über MHC I zur Zelloberfläche. BIOspektrum · 1/03 · 9. Jahrgang Überblick 25 hängiger Weise die Bindung von Peptiden kontrolliert, während vermutlich die ATPHydrolyse durch TAP1 die Peptidtranslokation begleitet. Nach Peptidtransport wird TAP2 wieder in die Lage versetzt ATP zu binden, was die Rückkehr des Transporters in die Ausgangssituation veranlasst (Abb. 5). Der Beladungskomplex: Knotenpunkt der Antigenpräsentation Abb. 4: Peptidtransporter TAP. Oben: TAP setzt sich aus TAP1 und TAP2 zusammen, die je eine Transmembrandomäne (TMD) und eine Nukleotidbindedomäne (NBD) besitzen. Die NBDs besitzen konservierte Sequenzabschnitte, bestehend aus Walker A- (A), Walker B-Motiv (B) und C-loop (C), die als ATP-Bindungs-Kassette zusammengefasst werden und an der Umsetzung von ATP beteiligt sind. Unten: Anordnungen gepaarter TAP-Domänen in antiparalleler Orientierung. Hydrolyse und haben verschiedene Transportfunktionen. Alle ABC-Transporter besitzen die selbe modulare Struktur, aus zwei Transmembran- (TMD) und zwei Nukleotidbindungsdomänen (NBD). Bei TAP steuern die beiden Untereinheiten TAP1 und TAP2 je eine TMD und eine NBD bei (Abb. 4). Die NBDs besitzen konservierte Sequenzbereiche, die als ATP-BindungsKassette zusammengefasst werden und an der Umsetzung von ATP beteiligt sind (Abb. 4A). Die Peptidbinderegion wird von den C-terminalen zytosolischen Schleifen (Abb. 4) der TMDs beider Untereinheiten gebildet[5]. Neue Untersuchungen deuten auf eine antiparallele Orientierung der gepaarten Domänen hin[6] (Abb. 4). TAP besitzt die höchste Spezifität für Peptide, die die optimale Länge für eine MHC-Beladung aufweisen. Zudem erkennen TAP und MHC I sehr ähnliche Sequenzmerkmale der Peptide. Es zeigte sich, dass (i) beide TAPNBDs benötigt werden und nicht unabhängig voneinander aktiv sind, dass (ii) die TAPUntereinheiten ein sehr unterschiedliches ATP-Bindeverhalten zeigen und dass (iii) die Anwesenheit ein und derselben Mutation in TAP1 oder TAP2 zu unterschiedlichen Transportaktivitäten führt[7, 8]. Hieraus kann geschlossen werden, dass die beiden TAP-Untereinheiten unterschiedliche Aufgaben während des Peptidtransports überBIOspektrum · 1/03 · 9. Jahrgang nehmen. Darüber hinaus stimuliert die Aufnahme von Peptiden die ATP-Hydrolyse des Transporters[9]. Es lässt sich ein Arbeitsmodell entwerfen bei dem TAP2 in ATP-ab- Neusynthetisierte MHC I-schwere Ketten interagieren im ER mit dem Chaperon Calnexin[10]. Diese Interaktion unterstützt die Assoziation zwischen schweren Ketten und β2m. MHC I-Moleküle bilden anschließend einen Komplex mit Calreticulin[10], das ebenfalls als Chaperon fungiert. MHC I-Moleküle binden letztlich an TAP. Dieser Komplex ist abhängig von Tapasin[10], das eine „Brückenfunktion“ zwischen MHC I und TAP übernimmt. Als bisher letzte Komponente des Beladungskomplexes (Abb. 6) wurde die Oxidoreduktase ERp57 beschrieben[11], die die Bildung von Disulfidbrücken in MHC I unterstützt. Es ist sehr wichtig, dass MHC I-Moleküle ihre Peptide stabil binden, damit sie diese nicht auf dem Weg zur Zelloberfläche verlieren. Neuere Arbeiten zeigen, dass der Beladungskomplex eine Art „Qualitätskontrolle“ ausübt und die Beladung von MHC I mit stabil bindenden Peptiden optimiert[12]. Wie der Beladungskomplex Einfluss auf die Peptidbindung von MHC I nimmt ist unklar, jedoch weisen Untersuchungen darauf hin, dass die Peptid- Abb. 5: Transportzyklus von TAP. Nach Peptidbindung durch TAP liegt TAP1 (Schwarz) vermutlich in der ATP- und TAP2 (Rot) in der ADP-Form vor. ATP-Hydrolyse durch TAP1 begleitet die Translokation des Peptids und erlaubt den Nukleotidaustausch in TAP2. Nach ATP-Hydrolyse durch TAP2 bindet der Transporter erneut Peptid und es wird ein weiterer Transportzyklus initiiert. Überblick 26 Literatur [1] Rammensee, H. G., Falk, K. und Rötzschke, O. (1993): MHC molecules as peptide receptors. Curr Opin Immunol. 5: 35–44. [2] Kloetzel, P. M. (2001): Antigen processing by the proteasome. Nat Rev Mol Cell Biol. 2: 179–187. [3] Yewdell, J. W., Schubert, U. und Bennink, J. R. (2001): At the crossroads of cell biology and immunology: DRiPs and other sources of peptide ligands for MHC class I molecules. J Cell Sci. 114: 845–851. [4] Howard, J. C. (1995): Supply and transport of peptides presented by class I MHC molecules. Curr Opin Immunol. 7: 69–76. [5] Nijenhuis, M. und Hämmerling, G. J. (1996): Multiple regions of the transporter associated with antigenprocessing (TAP) contribute to its peptide binding site. J. Immunol. 157: 5467–5477. Abb. 6: Der Beladungskomplex. MHC-schwere Ketten interagieren mit Calnexin (1). Nach Assoziation der schweren Kette mit β2m wird Calnexin durch Calreticulin ersetzt (2) und der Komplex bindet über Tapasin an TAP (3). Der Beladungskomplex bildet sich aus der Interaktion eines Präkomplexes (4) und Calreticulin-gebundenen MHC I. Die Interaktion von MHC I mit TAP ist an den Transportzyklus gekoppelt (5), so dass Peptidtransport und MHC-Beladung (6) miteinander koordiniert werden. Nach der Beladung werden MHC I-Moleküle zur Zelloberfläche transportiert (7). [6] Daumke, O. und Knittler, M. R. (2001): Functional asymmetry of the ATP-binding-cassettes of the ABC transporter TAP is determined by intrinsic properties of the nucleotide binding domains. Eur J Biochem. 268: 4776–4786. [7] Alberts, P., Daumke, O., Deverson, E. D., Howard, J. C. und Knittler, M. R. (2001): Distinct functional properties of the TAP subunits coordinate the nucleotide dependent transport cycle. Curr Biol. 11: 242–251. [8] van Endert, P., Saveanu, L., Hewitt, E. und Lehner, P. (2002): Powering the peptide pump: TAP beladung und die anschließende Ablösung beladener MHC I-Moleküle an den Transportzyklus von TAP gekoppelt ist[7]. Möglicherweise werden MHC I-Moleküle während des Transportzyklus in eine Konformation gebracht, die es erlaubt Peptide auf ihre stabile Bindung hin zu überprüfen. Diejenigen Peptide, die nicht die richtige Länge für die MHC-Bindung besitzen, können im ER durch Aminopeptidasen am N-Terminus verkürzt werden[13]. Beim „Zurechtschneiden“ der Peptide spielt die Interferon-γ-induzierbare Aminopeptidase ERAAP vermutlich eine entscheidende Rolle. Sie verkürzt Peptide auf eine Länge von 8–9 Aminosäuren und produziert so geeignete Antigene für die MHC I-Beladung[14]. Nach erfolgreicher Peptidbeladung verlassen die MHC I-Moleküle den Beladungskomplex und werden zur Zelloberfläche transportiert. ladungskomplex optimiert? Antworten hierauf könnten einmal gezielte therapeutische Eingriffe in die zelluläre Immunität ermöglichen. [9] Gorbulev, S., Abele, R. und Tampé, R. (2001): Allosteric crosstalk between peptide-binding, transport, and ATP hydrolysis of the ABC transporter TAP. Proc Natl Acad Sci U S A. 98: 3732–3737. [10] Sadasivan, B., Lehner, P. J., Ortmann, B., Spies, T. und Cresswell, P. (1996): Roles for calreticulin and a novel glycoprotein, tapasin, in the interaction of MHC class I molecules with TAP. Immunity. 5: 103–114. [11] Lindquist, J. A., Jensen, O. N., Mann, M. und Hämmerling, G. J. (1998): ER-60, a chaperone with thiol-dependent reductase activity involved in MHC class I assembly. EMBO J. 17: 2186–2195. [12] Tan, P., Kropshofer, H., Mandelboim, O., Bulbuc, N., Hämmerling, G. J. und Momburg, F. Dr. Michael R. Knittler Biologiestudium und Promotion an der Universität zu Köln. Seit 2000 Gruppenleiter im Institut für Genetik der Universität zu Köln. (2002): Recruitment of MHC class I molecules by tapasin into the transporter associated with antigen processingassociated complex is essential for optimal peptide loading. J Immunol. 168: 1950–1960. [13] Serwold, T., Gaw, S. und Shastri, N. (2001): ER aminopeptidases generate a unique pool of peptides for MHC class I molecules. Nat Immunol. 2: 644–651. [14] Serwold, T., Gonzalez, F., Kim J., Jacob, R. und Shastri, N. (2002): ERAAP customizes peptides for Fazit Durch umfassende Forschungsarbeiten konnten die verschiedenen Stationen der MHC I vermittelten Antigenpräsentation zu einem Gesamtbild zusammen getragen werden. Trotzdem gibt es noch offene Fragen: Wie finden Peptide ihren Weg zu TAP? Wie funktioniert der Peptidtransportmechanismus von TAP? Welche strukturellen Eigenschaften besitzt der Beladungskomplex? Wie wird die MHC I-Beladung im Be- crosstalk with energetic nucleotides. Trends Biochem Sci. 27: 454. MHC class I molecules in the endoplasmatic reticulum. nature 419: 480–483. Korrespondenzadresse: Ralf M. Leonhardt Studium an der Universität zu Köln. Seit 2002 Doktorand in der Gruppe von Dr. Knittler. Dr. Michael R. Knittler Institut für Genetik Abteilung für Zellgenetik Zülpicher Str. 47 D-50674 Köln Tel.: 0221-470-5292 Fax: 0221-470-5015 [email protected] BIOspektrum · 1/03 · 9. Jahrgang











