VL Serumenzyme ws1213 - Universitätsklinikum Düsseldorf
Werbung

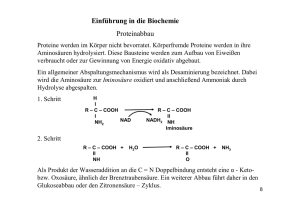
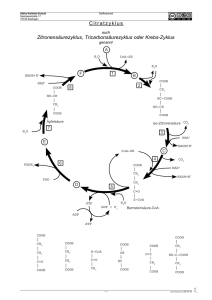
Vorlesung Serumenzyme Diagnostik, Messung, Anwendung und Interpretation Wintersemester 2012/2013 Universitätsklinikum Düsseldorf Institut für Laboratoriumsdiagnostik / Zentrallabor Enzyme - Eigenschaften • Die Bestimmung von Enzymaktivitäten in Serum, Plasma oder Harn hat für die Diagnostik und zur Verlaufs- und Therapiebeurteilung einen vorrangigen Stellenwert. • Die Menge von Enzymen im Plasma ist sehr gering, wenn man sie in Konzentrationen angibt – z.B. ALAT (GPT) 100 µg/ Liter (Gesamteiweiß 60-80 g/l) • Funktion des Enzyms: Katalysator biochemischer Reaktionen A + B Edukte („Substrat“) Enzym C + D Produkte Aktivität eines Enzyms Aktivität = Arbeit = Zeit U = Substratumsatz Zeit µmol min 1 internationale Einheit (U) ist diejenige Enzymaktivität, die pro Minute unter definierten Bedingungen die Umwandlung von 1 µmol Substrat katalysiert. (Dies wird für Plasma und Serum auf 1 Liter bezogen). Die Messtemperatur ist 37 °C Photometrische Messung Quelle: Wikipedia, „Photometrische Messung“ Transmission T = I I0 I0 Extinktion E = log I 1 T 1 Unit = diejenige Enzymmenge die 1 µmol Substrat pro Minute umsetzt trübung Reagenz inkomplettes Proben- E inkompletter Reaktionsansatz Substratstart Substrat vollständig verbraucht min Berechnung der Aktivität E = ε .c . d c= aufgelöst nach c: Veränderung der Konzentration : Konzentrationsänderung pro Minute: (Aktivität) „Volumenaktivität“ [U/l] : Δc= Δc min Δc min V . = = E ε .d ΔE ε .d ΔE ε . d . min ΔE ε . d . min . V Substrat verbraucht E Substrat verbraucht Schematische Darstellung des Reaktionsablaufes bei unterschiedlicher Enzymaktivität Kinetik: Steigung der Kurve Aktivität = 0 20 U/l 10 U/l min Enzyme – Messung der Aktivität • In klinisch-chemischen Vollautomaten wird alles automatisch geregelt. Die Temperierung der Messzelle (37°C) findet automatisch statt. Das Gleiche gilt für das Pipettieren der Reagenzien, eventuelle Verdünnungen und Umrechnung der Ergebnisse. • Es gibt verschiedene Messmöglichkeiten: kontinuierliche Verfahren (Kinetik); diskontinuierliche Verfahren (2-Punkt Messung) oder Endpunktverfahren. Enzyme – Messung der Aktivität • • • • • • • Die Internationale Union für Biochemie (IUB) hat schon 1961 Empfehlungen für die optimierte Bestimmung von Enzymaktivitäten erarbeitet. Die Bedingungen für diese optimierten Methoden sind: Optimaler pH-Wert Definierte Temperatur d.h. 37 °C Optimale Substratkonzentration Optimale Coenzymkonzentration Optimale Konzentration an Aktivatoren Beispiel: Enzymaktivitätsbestimmung der AST Reaktion: AST α-Ketoglutarat + Aspartat Glutamat + Oxalacetat COOH COOH COOH COOH C=O CH – NH2 CH – NH2 C=O CH2 CH2 CH2 CH2 CH2 COOH CH2 COOH COOH COOH Indikatorreaktion: + Oxalacetat + NADH + H MDH Malat + NAD+ COOH COOH C=O CH - OH CH2 CH2 COOH COOH Beispiel: Enzymaktivitätsbestimmung der AST Reaktion: α-Ketoglutarat + Aspartat AST Glutamat + Oxalacetat COOH COOH COOH COOH C=O CH – NH2 CH – NH2 C=O CH2 CH2 CH2 CH2 CH2 COOH CH2 COOH COOH Störende Nebenreaktion: Pyruvat + NADH + H+ COOH LDH Lactat + NAD+ COOH COOH C=O CH - OH CH3 CH3 Messung der AST: Analysenablauf • Die Probe wird zum Reagenz gegeben. Dieses enthält alles was für die Reaktion notwendig ist im Überschuss, außer eines der beiden Edukte (α-Ketoglutarat), sodass die Reaktion nicht ablaufen kann. • Um eine wichtige Nebenreaktion, welche auch NADH +H+ oxidiert und damit die Messung verfälscht auszuschalten, enthält das Reagenz größere Mengen an LDH, um diese Reaktion blitzartig ablaufen zu lassen. • Nun wird gewartet bis die Extinktion konstant bleibt, welches anzeigt, das alle Nebenreaktionen vollständig abgelaufen sind. Messung der AST: Analysenablauf • Nun wird das fehlende Reagenz (Startreagenz) hinzugegeben und damit die Reaktion in Gang gesetzt. Es kann nun die Abnahme der Extinktion (bei 334 nm) über die Zeit gemessen werden. • Diese wird in Units/Liter (Volumenaktivität) angegeben. Zusammengesetzter optischer Test mit Indikatorreaktion Enzyme - Nomenklatur • • • • • • • • Die Enzyme Commission (EC)-Nummer beschreibt die Funktion eines Enzyms. Die ganze Liste befindet sich im „Enzyme Nomenclature“ [1972] sowie dem „Enzyme Handbook“ und seinen „Supplements“ (Springer-Verlag). Die EC-Nummer hat 4 Komponente: Stelle 1 definiert die Funktion – z.B. 1 = Oxidoreduktasen Stelle 2 definiert die Donorgruppe – z.B. 1 = CH-OH Stelle 3 definiert die Akzeptorgruppe – z.B. 1 = NAD(P) Stelle 4 ist die Enzymnummer innerhalb der Gruppe. Beispiel: EC 1.1.1.71 = Alkoholdehydrogenase (NAD(P)) oder Alkohol: NAD(P) Oxidoreduktase Reaktion Alkohol + NAD(P) = Aldehyd + reduziertes NAD(P) Enzyme - Einteilung • • • • • • • Die Hauptgruppen von Enzymen sind: 1. – Oxidoreduktasen (z.B. GLDH, LDH) 2. – Transferasen (z.B. Gamma-GT, AST, ALT) 3. – Hydrolasen (z.B. alkalische Phosphatase, α-Amylase, Lipase) 4. – Lyasen (z.B. Adenylatcyclase) 5. – Isomerasen (z.B. Glucose-6-Phosphat Isomerase) 6. – Ligasen / Synthetasen (z.B. Harnstoff-carboxylase) Enzyme - Pathophysiologie • Enzyme mit physiologischer Funktion im Blut – z.B. Thrombin, Plasmin, Cholinesterase – zeigen bei Schädigung der Ursprungszellen einen Abfall der Aktivität im Blut. • Enzyme von sekretorischen (exokrinen) Drüsen – z.B. Pankreasamylase, -lipase – zeigen bei Schädigung der Ursprungszellen einen Anstieg der Aktivität im Blut. • Enzyme mit physiologischer Funktion in der Zelle – z.B. LDH, AST, ALT, CK - zeigen bei Schädigung der Ursprungszellen einen Anstieg der Aktivität im Blut. Enzyme – Pathophysiologie • Das Erscheinen bzw. Verschwinden von Enzymen im bzw. aus dem Serum kann wichtige Vorgänge im Körper anzeigen. • Nicht nur die Geschwindigkeit des An- oder Absteigens eines Enzyms, sondern das Verhältnis von Enzymen zueinander, gibt zusätzliche Information zu einem Krankheitsverlauf bzw. zur Effizienz einer Therapie. Leitenzyme von Organen Halbwertzeit Leitenzyme wichtiger Organe • -Amylase - Pankreas und Speicheldrüsen • ALT – Leber • AST – Leber, Muskel • AP– Leber, Knochen, Darm, Niere • CK – Skelettmuskel, Herz, glatter Muskel • Cholinesterase – Leber • GLDH – Leber • -GT - Leber • LDH – Leber, Herz, Skelettmuskel, Erythrozyten, Thrombozyten, Lymphknoten • Lipase – Pankreas (nach L. Thomas: Labor und Diagnose; 7. Auflage) Serumenzyme – Halbwertszeiten • • • • • • • • • -GT – 3-4 d AP – 3-7 d ALT – 50 h AST – 12-14 h CK – 12 h CK-MB – 10 h GLDH – 14-18 h LDH-1 (HBDH) – 4-5 d LDH-5 – 10 h (nach L. Thomas: Labor und Diagnose; 7. Auflage) Serumenzyme – Referenzbereiche für gesunde Erwachsene – 37 °C • • • • • • • • • -GT – M: < 60 U/l; F: < 40 U/L AP – M: 40–130 U/l; F: 55-105 U/L ALT – M: < 45 U/L; F: < 34 U/L AST – M: < 43 U/L; F: < 36 U/L CK – M: <190 U/L; F: <170 U/L CK-MB – M: < 24 U/L; F: < 24 U/L GLDH – M: < 7 U/L; F: < 5 U/L LDH – M: < 248 U/L; F: < 247 U/L LDH-1 (HBDH) – M: < 50 U/L; F: < 50 U/L (nach L. Thomas: Labor und Diagnose; 7. Auflage) Isoenzyme: multiple Enzymformen • Einige Enzyme kommen als Isoenzyme vor – das heißt, dass sie die gleiche Reaktion katalysieren. Sie kommen in verschiedenen Geweben bzw. Organen vor (unterschiedliche Genloci) z.B. Typ M und Typ H der Lactatdehydrogenase, die als Tetramer in 5 verschiedenen Isoformen vorkommt. • Man kann die LDH elektrophoretisch trennen, um das Herkunftsorgan herauszubekommen. • LDH-1 kommt überwiegend im Herzmuskel und Erythrozyten, LDH-5 dagegen in der Leber und Skelettmuskulatur vor. • Die Isoformen sind H4 (LDH-1), H3M (LDH-2), H2M2 (LDH-3), HM3 (LDH-4) und M4 (LDH-5) (H=Herz; M=Muskel) Enzyme – Messung der Aktivität Kinetisch-Optischer Test - IFCC Methode • • • • • • • Die Bestimmung der LDH-Aktivität im Serum. Reaktion: Lactat + NAD+ Pyruvat + NADH + H+ Messprinzip: Die Zunahme der Extinktion durch das Entstehen des Coenzyms NADH bei 334 nm im Spektralphotometer. Als Substrat dient Lactat. Im Prinzip kann man die Reaktion in die entgegengesetzten Richtung steuern. Man muss dann Pyruvat im Überschuss haben und einen anderen pH-Wert einstellen. NAD+ - Nicotinamid-Adenin-Dinukleotid - oxidierte Form NADH – NAD reduzierte Form Isoenzyme: CK • • Creatinkinase - CK CK kommt in hoher Aktivität in der Skelettmuskulatur, im Herzmuskel und im Gehirn • 3 Isoenzyme: CK-MB (Myokardtyp), CK-MM (Muskeltyp) und CK-BB (Gehirntyp) • Skelettmuskelerkrankungen: Rhabdomyolyse, Myositis, progressive Muskeldystrophie, Polytrauma, Muskeltrauma (inkl. i.m. Injektionen) • Herzmuskelerkrankungen: akuter Myokardinfarkt (Diagnostik und Verlaufskontrolle), Kontrolle einer Thrombolysetherapie, Myokarditis Enzyme – Messung der Aktivität Zusammengesetzter optischer Test mit Hilfs- und Indikatorreaktion • Bestimmung der Creatinkinase (CK) im Serum: • • • • • • Reaktion: Enzym Creatinkinase Creatinphosphat + ADP Creatin + ATP Hilfsreaktion: Enzym Hexokinase ATP + D-Glucose ADP + D-Glucose-6-Phosphat Indikatorreaktion: Enzym G-6-P-dehydrogenase G-6-P + NADP+ 6-Phosphogluconat + NADPH + H+ • Messprinzip: Messung der Extinktionszunahme bei 334 nm (Reduktion des NADP zu NADPH) IFCC Methode – Creatin Kinase • • • • • • • • • Messbedingungen für die CK Temperatur: 37,0 °C ± 0,1 °C Wellenlänge: 339 nm ± 1 nm Bandbreite: 2 nm Lichtweg (in der Kuvette): 10,00 mm ± 0,01 mm Inkubationszeit: 180 s Verzögerungszeit: 120 s Messinterval: 120 s Anzahl der Messpunkte: mindestens 6 Enzyme – Messung der Aktivität Verfahren zur Messung im Bereich des sichtbaren Lichtes • Bestimmung der alkalischen Phosphatase im Serum: • Reaktion: p-Nitrophenylphosphat (pNPP) pNP + PO4 • pNPP ist farblos; pNP dagegen gelb bei pH 10 • Messprinzip: AP katalysiert die Hydrolyse von pNPP bei pH 9,8 unter Zunahme der Farbe (Extinktion) bei 405 nm) • Kontinuierliche (kinetische) Messung • Als Cofaktoren werden Mg+2 und Ca+2 benötigt • EDTA- bzw. Citratplasma können, wegen ihrer komplexierenden Eigenschaften nicht als Probe benutzt werden.