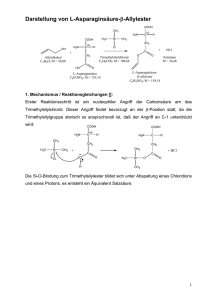
Die Proteine aller Organismen sind aus 20 verschiede- nen
Werbung
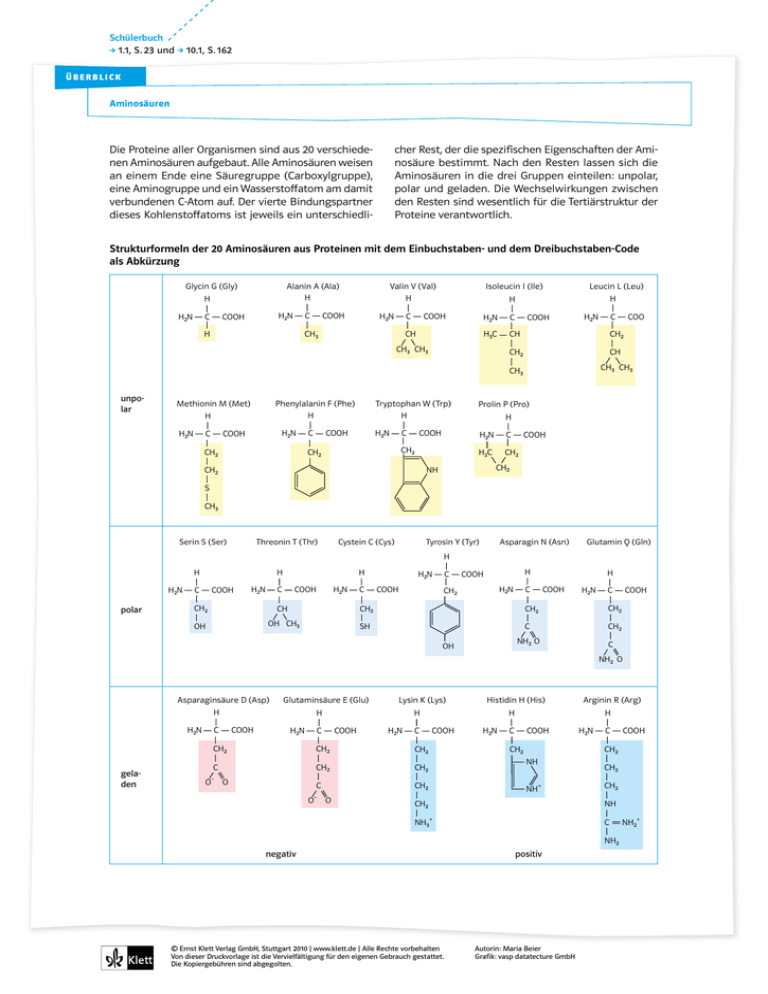
Schülerbuch 1.1, S. 23 und 10.1, S. 162 überblick Aminosäuren cher Rest, der die spezifischen Eigenschaften der Aminosäure bestimmt. Nach den Resten lassen sich die Aminosäuren in die drei Gruppen einteilen: unpolar, polar und geladen. Die Wechselwirkungen zwischen den Resten sind wesentlich für die Tertiärstruktur der Proteine verantwortlich. Die Proteine aller Organismen sind aus 20 verschiedenen Aminosäuren aufgebaut. Alle Aminosäuren weisen an einem Ende eine Säuregruppe (Carboxylgruppe), eine Aminogruppe und ein Wasserstoffatom am damit verbundenen C-Atom auf. Der vierte Bindungspartner dieses Kohlenstoffatoms ist jeweils ein unterschiedli- Strukturformeln der 20 Aminosäuren aus Proteinen mit dem Einbuchstaben- und dem Dreibuchstaben-Code als Abkürzung Glycin G (Gly) Alanin A (Ala) H H COOH C H2N COOH C H2N H Valin V (Val) H CH3 Methionin M (Met) C H3C CH CH Phenylalanin F (Phe) H H H2N COOH C H2N CH2 Tryptophan W (Trp) H COOH C H2N CH2 C COOH CH2 CH2 CH CH3 CH3 CH3 COOH C CH2 H2C CH2 NH CH2 H2N H H2N CH2 COOH Prolin P (Pro) COOH C H H2N CH3 CH3 unpolar Leucin L (Leu) H COOH C H2N Isoleucin I (Ile) S CH3 Serin S (Ser) Threonin T (Thr) Cystein C (Cys) Tyrosin Y (Tyr) Asparagin N (Asn) Glutamin Q (Gln) H H2N polar H H H COOH C H2N COOH C H2N C CH2 CH CH2 OH OH CH3 SH C H2N COOH H COOH COOH C H2N CH2 H H2N CH2 CH2 C CH2 NH2 O OH COOH C C NH2 O Asparaginsäure D (Asp) H H2N C COOH Glutaminsäure E (Glu) COOH CH2 C O– O O H2N C CH2 C CH2 O COOH H2N H COOH C H2N C COOH CH2 CH2 NH NH CH2 + CH2 NH CH2 NH3 Arginin R (Arg) H CH2 CH2 – Histidin H (His) H C H2N CH2 geladen Lysin K (Lys) H + C NH2 negativ © Ernst Klett Verlag GmbH, Stuttgart 2010 | www.klett.de | Alle Rechte vorbehalten Von dieser Druckvorlage ist die Vervielfältigung für den eigenen Gebrauch gestattet. Die Kopiergebühren sind abgegolten. positiv Autorin: Maria Beier Grafik: vasp datatecture GmbH NH2+