Phytohormones
Werbung

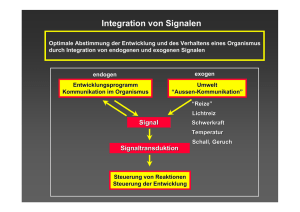
Phytohormone 1. Eigenschaften: - niedermolekulare Substanzen - Vorkommen in niedrigen Konzentrationen - übernehmen zellübergreifende Steuerungsfunktionen - Rezeptorbindung - Informationsaustausch zwischen Organen - ortsgebundene Signalträger: Reaktion der Pflanze auf biotische und abiotische Signale Phytohormone 2. Klassen von Phytohormonen: - Auxine - Gibbereline - Cytokinine - Abscisinsäure - Ethylen - Jasmonat - Brassinosteoide - Salicylsäure Phytohormone - Phytorhormonklassen bestehen aus mehreren, eng verwandten Verbindungen - große Heterogenität bei Gibberelinsäuren (mehr als 80 Formen bekannt) - Frage nach der in planta wirkenden Verbindung? - Modifikation in planta (z. B. glykosidiert) - vorliegen als Konjugate - Zucker, Amine, Amide - IES: Klonierung der Amidohydroxylase [Freisetzung von Indol-3-Essigsäure (IES = Auxin) aus ihrem Konjugat] -Biotests (Streckenwachstum einer Koleoptile nach Auxingabe) 3. Wirkungsspektren: - breites Wirkungsspektrum - z. T. überlappende Wirkungen - z. T. antagonistische Wirkungen - Auxin/Cytokininverhältnisse steuern die Organbildung - neue Phytohormone werden entdeckt werden 4. Rezeptoren: - spezifische reversible Hormonbindung - hohe Affinität - Initiation von Signalketten - lösliche Rezeptoren (Auxin- und Steroidhormone) - membranassoziierte Rezeptoren - prokaryotische Signalweiterleitung: Zweikomponentensystem - Sensorkinase und Antwortregulatorprotein - 2 Möglichkeiten der Identifikation: 1. Affinitätssäulen mit Rezeptoren - Photoaffinitätsmarkierung 2. Arabidopsis Mutanten: Beispiel Ethylenwirkung 5. Ethylensignalkette als Modellsystem: - triple response: Suche nach Mutanten, bei denen drei unabhängige Ethylenantworten gleichzeitig gestört sind. - Hemmung des Hypokotyl- und Wurzelwachstums - Verdickung des Hypokotyls - Hypokotylhaken krümmt sich übermäßig - 2 Klassen von Mutanten: - triple response auch ohne Ethylen (ctr, eto) - konstitutiv in der Hormonproduktion oder eines aktiven Intermediates - keine triple response trotz Ethylen (ein-etr, ain) - Defekt zwischen Hormonperzeption und Signaltransduktion - genetische Analysen: Feststellung der Proteinsequenz - ETR1: Rezeptor - ähnelt Sensorkinasen von zwei Komponentensystem - CTR1: besitzt Ähnlichkeiten zur Raf-Kinasefamilie (MAPKinasen) Ethylen - früh entdeckt, spät durchgesetzt - im Intrazellularraum - Biosynthese: Methionin -Früchte, Blüten, Blätter: vor der Seneszenz Ethylen ↑↑ 1. Beschleunigung der Fruchtreife und andere Seneszenzprozesse Apfel/Tomate Apfel, Bananen werden unreif geerntet Blockade der Acc. Oxidase in transgenen Tomaten 2. Auslösung von Stressreaktionen Stressethylen (Überflutung, pathogener Pilzbefall) triple-Reaktion < Produkt der ACCSynthase < Produkt der ACCOxidase < Funktion der ACCSynthase sense: schnellere Reifung Without ethylene: With ethylene: - receptor on - receptor off - CTR1 active - CTR1 inactive - inhibits MAPKK - MAPKK active Histidin Aspartat Unterschied: Ethylen: two component system tierischen Systeme: GProteine Gemeinsam: MAPKinaseweg Cytokinine 1950: Kokusnussmilch: Stimulation von Zellteilung 1963: Zeatin: natürlich vorkommender Stimulator der Zellteilung Adeninderivat mit einer Seitenkette auf Isoprenoidbasis Cytokinin/Auxin – Verhältnis bestimmt Spross-/Wurzeldifferenzierung Produktionsorte: Wurzel apikale Sprossmeristeme Wurzel → Xylentransport → grünes Gewebe Kontrolle der Apikaldominanz Hemmung der Seneszenz Zeatinsynthese aus Adenosin-5’-monophosphat und Dimethylallyl-diphosphat Eingangsenzym: hohe Spezifität (Isopentenyl-Transferase, ipt) Isolation aus Pflanzen Cytokinine - Fortsetzung Vorkommen in Agrobakterien: ipt-Gen wird transferiert in die Pflanzenzelle: Gallenbildung Pseudomonas: ipt-homologes tzs Gen: Gallenbildung ohne Gentransfer ipt-Genexpression durch Tetracyclin-induzierbaren Promotor ⇒ lokale Cytokininproduktion > 50 x ⇒ lokale Antworten ⇒ Xylemtransport in Frage gestellt. -Cytokinin Oxidase: -entfernt die Seitenkette -Inaktivierung -Kontrolle des bioaktiven Cytokininpools: Glykosylierung der Seitenketten-OH-Gruppe inaktiviert Cytokinine reversibel Speicherung des Derivats Derivat ist geschützt vor Abbau (kein Substrat für die Cytokininoxidase) Auxin Went: (1926): Wuchsstoff Inkompetenter Bildungsort Kompetenter Wirkort Biotest: Quantifizierung des Hormons (1934): Indol-3-Essigsäure (IAA) Isolation aus Urin + Hefe (1941): IAA in Pflanzen Synthetische Auxine: 2,4 D - 2,4 D ist wirksamer, da nicht abgebaut Biosynthese: Tryptophan-abhängiger und unabhängiger Weg Try-Mutante macht dennoch IAA Mehrere Synthesewege Bedeutung des Hormons, Synthese schlecht blockierbar < Agrobakterien < Zwischenprodukte des Abbaus Auxin Freies (Biotest) vs. gebundenes IAA: IAA-Glycosylester (inaktive Speicher) IAA-Peptide (inaktive Speicher) IAA oxidative Decarboxylierung → verschiedene Abbauprodukte IAA-Wirkung abhängig von Neusynthese 1932 (Went) - polarer Transport 10 – 20 mm · h-1 aktiv (atmungsabhängig) Parenchymtransport (Zellpolarität) Bildung in der Spitze Neusynthese oder Freisetzung aus Konjugaten Wirkung: Steuerung von Wachstumsprozessen - Unterdrückung des Austreibens von Seitenknospen apikale Dominanz) - Fruchtentwicklung - Mitoseaktivität (↑) - Differenzierung von Xylem + Phloem BL > Transport von Auxin zur Schattenseite > Förderung des Wachstums Auxin Kompetenz: Wirkungsweise Rezeptor: Kern/Cytoplasma IAA-Bindeprotein (ABP1) Überexpression in Tabak: > IAA-Bindung < Wachstum Genexpression: detektierbar nach 4 – 8 min. Transkriptionsfaktoren Theorie des polaren Transports • Protonenpumpen säuern Apoplasten an • Influx ungeladenes IAAH ins Cytoplasma • IAA- bleibt im Cytoplasma (Ionenfalle) • Effluxtransporter an basaler Zellseite • basipetaler Transport Auxin works in a cell by binding specifically to a protein called TIR1. The combination of TIR1 and auxin, along with a couple of other proteins, destroys a repressor protein that stops growth genes from being expressed. Once these growth genes are activated, they are expressed and produce proteins that control plant growth. Growth genes could include those that promote cell elongation and division, or differentiation. Phytohromone I - Klassifizierung Synth.-/Wirkungsort Biotest Zweikomponenten - loss of function - Funktion Heterogenität überlappende Wirkung Affinitätsreinigung - gain of function - Rezeptortheorien Modifikationen antagon. Wirkg. triple response Ethylen - Lokalisation - Fruchtreife - two component - Synthese aus Meth. - Acc. Oxidase - MAP Kinaseweg - Seneszenz - Stressrkt. Cytokinin - Klassifizierung Adeninderivat Transport ipt/tzs Tetracyclinpromotor Schutz vor Abbau - Zellteilung - Spross-/Wurzeldiff. - Apikaldominanz - Agrobakterien - Cytokininoxidase - Gewebekultur - Zeatin Syntheseorte Seneszenzhemmung Gallenbildung Cytokininderivate Organogenese Auxin - Lokalisation geb. IAA ox. Decarboxylaierung Wachstumssteuerug Mitose IAA Bindeprotein - IAA, IES - Biotest Speicherung - Glykosylester - Modell: pol. Transport- Parenchymtransport Apikale Dominanz - Fruchtentwicklung Differenzierung Xylem/Phloem Phototropismus - Interaktion mit BL Abscisinsäure - 2 x unabhängig entdeckt „Abscisin“ – Fruchtabscission bei Baumwolle Dormin – Ahorn + Birke → leitet Knospenruhe ein -ABA → Sesquiterpen -Ausgangsverb. Mevalonsäure (C5) -Leichter Transport im Apoplasten (Xylem/Phloem) - Stresshormon - Trockenstress - CAM-Pflanzen: Umstellung von C3 → C4 – Photosynthese -Trockenstress: Reduktion der stomatären Transpiration - Aktivierung von Stressgenen Die Stomaschließung wird durch - Dunkelheit - ABA (Abscisinsäure; Hormon) -hohe interne CO2-Konzentration - geringe Luftfeuchtigkeit hervorgerufen. Stomata stellen lebenswichtige Organe der höheren Pflanzen dar, da sie die CO2-Versorgung für die Photosynthese sicherstellen. Durch die offenen Poren verdunstet jedoch gleichzeitig Wasser, so dass die Öffnungsweite der Stomata einer strengen Kontrolle durch endogene Signale und Umweltfaktoren unterworfen ist. Hierzu zählen Lichtqualität und -quantität, die CO2-Konzentration sowie die Phytohormone Auxin und Abszisinsäure. Die Öffnung der Stomata wird durch eine reversible Volumenzunahme in den beiden Schließzellen ermöglicht. Die Grundlage hierfür stellt die Akkumulation von Kaliumsalzen zunächst im Cytosol und schließlich in der Vakuole dar, die dann den Wassereinstrom und damit die Volumen- und Turgorzunahme der Zelle treibt, so dass eine zentrale Pore geöffnet wird. Die Kalium-Aufnahme wird durch Chlorid-Ionen und die Malat-Synthese elektrisch neutralisiert. Während die Stomata im Licht und in niedrigen CO2-Konzentrationen öffnen, löst das Trockenstress-Hormon Abszisinsäure sowie hohe CO2-Konzentrationen den Stomaschluss aus. Die Zellen wurden mit dem pH-Indikator Acridinorange gefärbt. Guard cell signaling Gibberellins Gibbereline 1926 in Japan entdeckt pathogener Pilz Fusarium verursacht langes Pflanzenwachstum „Krankheit der verrückten Keimlinge“ 1954/55 Strukturaufklärung Biotests: Samen und Früchte ubiquitär große Zahl an Komponenten (> 100) tetracyclisches Ringsystem Gibbereline sind Diterpene (Cyclisierung von Geranyl-geranyl-diphosphat) Biosyntheseweg ist aufgeklärt (Mangelmutanten) Transport in Xylem (Phloem) [GA] ↑ → Phasen mit aktivem Wachstum Zwergmutanten (Mais/Erbse) steril, durch Fütterung mit GA heilbar Speicherstoffmetabolisierung im Samen Steigerung des Internodienwachstums (limitiert durch endogenes GA) (Rosettenpflanzen → Schießen, Blühen) Phytohormone können Gene aktivieren - Beispiel: Speicherstoffmetabolismus in Karyopsen von Gerste - Gibberellin GA3 - löst im Scutellum und in der Aleuronschicht die Produktion hydrolytischer Enzyme aus -alpha-Amylase: Reservestoffabbau im Endospern - in vitro-System: Zugabe von Gibbereline: Transkription von Amylasegenen - run-on Transkriptionsversuche - Abscisinsäure als Antagonist Brassinosteroide Chory: det-Mutanten (det2) Gen: ähnelt Steroid-5α-Reduktase aus Sängern (Testosteron → Dihydrotestosteron) CPD-Mutante: Gen mit Homologien zu P450-Proteinen 1979: Brassinolid aus Rapspollen (Funktion war unbekannt) Hormon ist beteiligt an: Zellstreckung Seneszenz Zellteilung Blühinduktion Hemmung des Wurzelwachstums pt-Entwicklung Xylembildung Brassinosteroid - Fortsetzung det2 und cpd kodieren für Enzyme des BrassinosteroidStoffwechsels Fütterungsexperimente Syntheseschema > 60 Hormone bekannt Syntheseweg größtenteils unbekannte Mutantenscreens → 22 Mutanten, alle waren allelisch transmembranes LRR (leucine-rich repeat) Rezeptor (Plasmamembran) 2 Mechanismen: (a) Reiz → Membranrezeptor → intrazelluläre Signaltransduktion (b) Reiz → Steroid::Rezeptor → Komplex im Cytoplasma → Kerntransport → Transkription Salicylsäure - Medikament → Rolle in Pflanzen weniger bekannt -erste Beobachtungen - Einfluss auf die Thermogenese bei Lilien - Pathogenabwehr - Verzögerung der Seneszenz - Grund: Reduktion der Ethylensynthese - SA blockiert die Umwandlung von ACC → Ethylen - Induktion der Blütenbildung bei Spirodela polyrrhiza - Thermogenese bei Lilien - ungewöhnlicher Syntheseweg - in der Summe: Energie des photosynthetischen Elektronentransports → Wärme -induziert Blütenbildung - Temperatur der Blüte bis zu 14 °C über Normal - Insekten werden angelockt - Temperaturanstieg nur am Tag Salicylsäure - exogene Applikation vom wasserlöslichen SA - Krankheitsresistenz - Nekrosen durch Pilze, Bakterien und Viren - lokale Antwort → Zelltod - systemische Antwort: Gesamtorganismus reagiert - Synthese von PR-Proteinen - PR-Proteinsynthese korreliert mit SA Synthese - zunächst beobachtet am TMV/Tabak-System - Syntheseweg: noch nicht vollständig aufgeklärt - Methyl-Salicylsäure (aktiv oder Speicher?) -GC-MS zur Analyse von radioaktiven Intermediaten - Ausgangssubstanz: cis- oder trans-Zimtsäure Fine-Tuning Plant Defence Signalling: Salicylate versus Jasmonate G. J. M. Beckers, S. H. Spoel Plant Biol 8, 1-10 Abscisinsäure - Lokalisation - Trockenstress - ABI1 - Pollenschlauchentw. - - Mevalonsäurederivate -Stresshormon LEA Proteine - Stomata Calcium als second messanger - Ca-Speicher Calmodulin siehe: Rolle von Abscisinsäure in der Samenbildung und Testa - doppelte Befr. triploides Endosperm - 4 Phasen der Samenreifung Keimungshemmung - ABI3 Mikropyle - Vernalisation –keimung: - Zygote - Dormanz - Radikula Gibberelinsäure -Lokalisation - Biotest - Zwergwachstum - gr. Zahl an Derivate - Synthese - Samen und Früchte - Fütterungsexperimente - Internodienwachstum - Samenentwicklung - Speicherstoffmetabolismus in Karyopsen - Scutellum - alpha-Amylase - Reservestoffe d. Pfl. - run-on assays - Aleuronschicht - Testa - Endosperm - Hydrolasen Embryogenese bei Arabidopsis Differenzierung des Embryos und des Samens Einteilung in der Vorlesung: 1. Vor der Samenbildung 2. Samen (Bezug: Abscisinsäure) 3. Lebenszyklus einer Pflanze und Musterbildung Phasen der Embryogenese: Zygote Einzellstadium Zweizellstadium Oktant Dermatogen Kugelstadium Triangel Herzstadium Torpedo Keimling Körperorganisation längs: Sprossmeristem Keimblätter Hypokotyl Wurzel Wurzelmeristem Körperorganisation quer: Epidermis Grundgewebe Leitgewebe Basale Zellen des Oktantenstadiums bilden die Wurzel RZ = Ruhezone Meristeme: zentrale und laterale Wurzelhaube Querschnitt: Epidermis, Cortex, Endodermis, Perizykel Zentrale Zone, periphere Zone, Rippenzone. L1 = Epidermis; L2, L3 subepidermal B1, B2 = Blattprimordien Blattprimordium (oben) = Blütenprimordium (unten) Vegetative Meristem (oben) = Influoreszenzmeristem (unten) Wirtel 1: Sepale Wirtel 2: Petale Wirtel 3: Stamen Wirtel 4: Karpelle ABC-Modell zur Blütenentwicklung Entwicklungsbiologie Phasen der Embryogenese: Zygote, Einzellstadium, Zweizellstadium, Oktant, Dermatogen, Kugelstadium, Triangel,Herzstadium, Torpedo, Keimling Samenentwicklung und –keimung (kommt jetzt) Körperorganisation längs: Sprossmeristem, Keimblätter, Hypokotyl, Wurzel, Wurzelmeristem Körperorganisation quer: Epidermis, Grundgewebe, Leitgewebe Trichomentwicklung,Blattmeristem, Blattanlage, Wurzelmeristem Vegetativer Spross und Blütenstand: Blattprimordium = Blütenprimordium; vegetative Meristem = Influoreszenzmeristem Blütendiagramm: Wirtel 1: Sepale; Wirtel 2: Petale; Wirtel 3: Stamen; Wirtel 4: Karpelle ABC-Modell der Blütenentwicklung Samenbildung bei Angiospermen „Als Samen bezeichnet man die reife Samenanlage mit dem Embryo, einem mehr oder weniger gut ausgebildeten Endosperm und der Samenschale (Testa).“ - doppelte Befruchtung mit zwei Spermakernen - diploide Zygotenbildung - triploide Endospern - Abbau des Endosperms, Resorption der Inhaltsstoffe durch den Embryo - Vorgänge bis zur Bildung des ruhenden Samens - generell: Entwicklung eines Embryos mit Wurzel, Spross und Kotyledonen Samenbildung bei Angiospermen (späte Phasen der Entwicklung) 1. Reifephase: - hohe Abscisinsäure-Konzentration - Wasserverlust - Speicherlipid und –proteinsynthese 2. Postabszissionsphase: - Chlorophyll-Abbau - Verhärtung der Testa - Synthese von LEA-Proteinen (late-embryo-abundant) - Mutation in LEA-Proteinen: keine Austrockungstoleranz 3. Vortrocknungsphase: - weitere Austrocknung 4. Trocknungsphase: - Abschalten der Genexpression - Herunterfahren des Stoffwechsels - Erreichen des endgültigen Zustands - Dormanz - Zeit, in der die Samen nicht auskeimen Frage nach den globalen Regulatoren der späten Samenentwicklung -Keimungshemmung durch hohe Abscisinsäurelevel - abi3-Mutante: Abscisinsäure-unempfindlich - keine Dormanz - Auskeimen aus der Mutterpflanze - ausgetrocknete abi3-Mutanten: lethal - veränderte Genexpression - abi3-Locus. Transkriptionsfaktor - Steuerung der Transkriptionsfaktoraktivität durch Abscisinsäure Keimung „Das Austreten der Radicula aus der Mikropyle wird häufig als operationales Kriterium für den Beginn der Keimung verwendet.“ - primär wird Dormanz durch Abscisinsäure vermittelt - Aufrechterhaltung durch eine Vielzahl weiterer Sperrmechanismen - häufig umweltbedingt - Wasseraufnahme - Sauerstoff - Ausbildung von Sperrschichten, die verrotten oder bakteriell abgebaut werden - chemische Keimungshemmer, z. B. Blausäure reduziert Stoffwechsel des Kimlings - Vernalisation (Mechanismus unbekannt)