• Komponenten und Aufbau des Immunsystems • Initiation von
Werbung
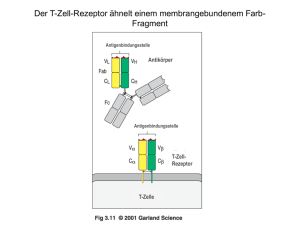
• Komponenten und Aufbau des Immunsystems • Initiation von Immunantworten • lymphatische Organe • Erkennungsmechanismen • Lymphozytenentwicklung • Entstehung und Verlauf adaptiver Immunantworten 81 Ehrlichs Seitenkettentheorie… 83 Immunglobulinmolekühle bestehen aus zwei verschiedenen Arten von Polypeptidketten, den schweren Ketten und den leichten Ketten leichte Ketten Disulfidbrücken schwere Ketten 84 spezifische Antikörper bakterielle Toxine Zelle mit Toxinrezeptoren Neutralisierung Bakterien im extrazellulären Raum Antikörper können auf drei Arten an der Immunabwehr beteiligt sein Bakterien im Plasma Makrophage Opsonisierung Aktivierung des Komlementssystems Komplement 85 serum amyloid protein 86 Überblick: Komplementkaskade 87 Klassischer Weg: Initiiert durch C1 88 Klassischer Weg: Generierung von C3-Konvertase (=C4bC2b) Protease-Kaskade: Signal-Amplifikation (vgl. Blutgerinnung) Regulation: Aktiv nur an Oberflächen körpereigene Zellen tragen Regulatoren 89 Spaltung des C5 Leitet die späte Kaskade ein. In C5-Spaltung konvergieren die 3 Wege der Komplementkaskade. 90 Spaltung des C5 Leitet die späte Kaskade ein. In C5-Spaltung konvergieren die 3 Wege der Komplementkaskade. Anaphylatoxine: Chemotaxis Aktivierung des „membrane attack complex 91 Der fertige „membrane-attack -Komplex erzeugt ein Loch in der Zellmembran 92 Überblick: Komplementkaskade, die wichtigsten Komponenten und Aktivitäten 93 Therapeutische Antikörper anti-TNFα • Neutralisierend • infliximab, adalumimab • Behandlung von bislang etwa 1 Mio Menschen, Umsatz etwa 1 Mrd. $ • Nebenwirkungen: Infektionserkrankungen (v.a. Tb) Zellspezifische Depletion mAk zur Immunsuppression: • ATG • Campath-1H (depletierend, anti-CD52, humanisiert) • OKT3γ1 (blockierend, anti-CD3, chimär, mutiert im Fc-Teil) GvHD - die andere Seite der Medaille 98 99 Das Y-förmige Immunoglobulin kann durch Protease-Spaltung funktionell aufgespalten werden proteolytische Spaltung mit Papain proteolytische Spaltung mit Pepsin 100 In den variablen Domänen gibt es definierte hypervariable Bereiche V-Region der leichten Ketten Variabilität Variabilität V-Region der schweren Ketten Aminosäure Aminosäure 101 Antigene können in Taschen, Gruben oder an ausgedehnten Oberflächen innerhalb der Bindungsstellen von Antikörpern binden 102 Der T-Zell-Rezeptor ähnelt einem membrangebundenem FabFragment Antigenbindungsstelle Antigenbindungsstelle Antikörper Antigenbindungsstelle T-ZellRezeptor T-Zelle 103 Die Struktur des T-Zell-Rezeptors Kohlenhydrat α-Kette β-Kette variable Region (V) konstante Region (V) Gelenk (H) Transmembranregion Cytoplasmatischer Schwanz Disulfidbrücke 104 Unterschiede in der Antigenerkennung zwischen Immunglobulinen und T Zell Rezeptoren 105 Unterschiede in der Antigenerkennung zwischen Immunglobulinen und T Zell Rezeptoren Oberflächen Immunglobuline innere Strukturen TCR 106 Lebend Immunogenizität Heterogenität des Pathogens Epitope Risiko Lebend- Tot attenuiert Vektor Peptid Zwei Hauptgruppen von T-Zellen erkennen Peptid, das an Proteinen von zwei unterschiedlichen Klassen von MHC Molekülen gebunden ist 108 MHC-Moleküle präsentieren die Peptidfragmente von Antigenen auf der Zelloberfläche MHC-Klasse I MHC-Klasse II Peptid Zellmembran 109 MHC-I-Molekül präsentieren Antigene, die aus Proteinen im Zytosol stammen Im Zytosol werden virale Proteine synthetisiert Virus infiziert eine Zelle endoplasmatisches Reticulum MHC-I bindet Peptidfragmente viraler Proteine im ER Zellkern MHC-I transportiert gebundene Peptide and die Zelloberfläche 110 Bakterium infiziert Makrophagen und dringt in Vesikel ein; Peptidfragmente entstehen MHC-II bindet bakterielle Fragmente in den Vesikel MHC-II transportiert gebundene Fragmente an die Zelloberfläche an B-Zell-Rezeptor gebundenes Antigen Antigen wird aufgenommen und zu Peptidfragmente abgebaut Fragmente binden an MHC-II und werden an die Oberfläche transportiert MHC Klasse II Moleküle präsentieren Antigen aus intrazellulären Vesikeln Antikörper B-Zelle 111 Grundzüge der Strukturen der CD4- und CD8-Corezeptormoleküle 112 Cytotoxische T-Zellen erkennen Antigene, die von MHC-I-Molekülen präsentiert werden, und töten die Zelle ab Cytotoxische T-Zelle erkennt Komplex aus viralem Fragment und MHC-I und tötet infizierte Zelle tötet MHCKlasse-I 113 Cytotoxische T-Zellen erkennen Antigene, die von MHC-I-Molekülen präsentiert werden, und töten die Zelle ab Cytotoxische T-Zelle erkennt Komplex aus viralem Fragment und MHC-I und tötet infizierte Zelle tötet CD8 MHCKlasse-I 114 TH1- und TH2-Zellen erkennen Antigene, die von MHC-II-Molekülen präsentiert werden TH1-Zelle erkennt Komplex aus bakteriellem Fragment und MHC-II und aktiviert Makrophagen aktiviert MHCKlasse-II TH2-Helferzelle erkennt Komplex aus antigenem Fragment und MHC-II und aktiviert die B-Zelle T-Helferzelle aktiviert MHCKlasse-II 115 TH1- und TH2-Zellen erkennen Antigene, die von MHC-II-Molekülen präsentiert werden TH1-Zelle erkennt Komplex aus bakteriellem Fragment und MHC-II und aktiviert Makrophagen aktiviert CD4 MHCKlasse-II TH2-Helferzelle erkennt Komplex aus antigenem Fragment und MHC-II und aktiviert die B-Zelle T-Helferzelle aktiviert CD4 MHCKlasse-II 116 Die Expression von MHC-Molekülen unterscheidet sich in verschiedenen Geweben Gewebe MHC-Klasse I MHC-Klasse II Lymphatisches Gewebe T-Zellen B-Zellen Makrophagen andere antigenpräsentierende Zellen (z.B. Langerhans-Zellen) epitheliale Zellen des Thymus andere kernhaltige Zellen Neutrophile Zellen Hepatocyten Niere Gehirn kernlose Zellen rote Blutkörperchen 117 Der T-Zell-Rezeptor-Komplex besteht aus Proteinen, die das Antigen erkennen, und unveränderlichen Proteinen, die Signale aussenden Erkennung 118 Signalgebung Die Aggregation des T-Zell-Rezeptors und eines Corezeptors setzt die Verbreitung von Signalen in der Zelle in Gang in ruhenden T-Zellen sind die ITAMs nicht phosphoryliert Bindung des Liganden an den Rezeptor führt zur Phosphorylierung der ITAMs durch rezeptorassoziiete Kinasen ZAP-70 bindet an die phosphorzlierten ITAMs der ζKette; es wird durch Lck phosphoryliert und aktiviert, sobald der Corezeptor an den MHC-Liganden gebunden hat antigenpräsentierende Zelle T- Zelle 119 angeboren erworben lebensnotwendig gut es zu haben „ready to go braucht etwas mehr Zeit Zellen besitzen Effektorfunktion (Phagozyten) Keine basale EffektorFunktion (Lymphozyten) Erkennung über „PAMPs hoch variable Erkennungsrezeptoren 120 Gene der variablen Regionen werden aus Gensegmenten aufgebaut leichte Ketten schwere Ketten Keimbahn-DNA Somatische Rekombinatione DJ-verknüpfte umgeordnete DNA Somatische Rekombinatione VJ- oder VDJ-verküpfte umgeordnete DNA Primäres RNA-Transkript Spleißen mRNA Polypeptidkette 121 Die Anzahl funktioneller Gensegmente für die variablen Regionen der schweren und leichten Ketten in menschlicher DNA Zahl der funktionsfähigen Gensegmente in menschlichen Immunglobulinloci Segment leichte Ketten schwere Kette V-Segmente D-Segmente J-Segmente 122 Die genomische Organisation der Loci für die schweren und leichten Immungloblinketten in der Keimbahn des Menschen Locus der leichten λ-Kette Locus der leichten κ-Kette Locus der schwerenKette 123 Rekombinations-Signal-Sequenzen - Die 12/23-Regel 124 Gensegmente für variable Regionen werden durch Rekombination verknüpft 125 Gensegmente für variable Regionen werden durch Rekombination verknüpft SCID 126 Gensegmente für variable Regionen werden durch Rekombination verknüpft SCID Leukämie 127 Die Einführung von P- und N-Nucleotiden an den Verknüpfungen zwischen Gensegmenten während der Immunglobulingenumlagerung Anfügen von N-Nucleotiden durch TdT RAG-Komplexe binden und spalten Rekombinationssignalsequenzen, sodass eine DNA-Haarnadelstruktur ensteht Paarung der Stränge die RAG-vermittelte Spaltung der Haarnadelstruktur erzeugt palindromartige P-Nucleotide Durch Exonucleasespaltung, DNA-Synthese und DNA-Ligation ensteht die codierende Verknüpfungssequenz 128 Umordnung und Expression der Gene für die α- und β-Kette des T-Zell-Rezeptors Keimbahn-DNA Rekombination umgeordnete DNA Transkription Spleißen Translation Protein (T-Zell-Rezeptor) Transkription Spleißen Translation umgeordnete DNA Rekombination Keimbahn-DNA 129 Die Anzahl der menschlichen T-Zell-Rezeptor-Gen-Segmente und die Ursachen der T-Zell-Rezeptor-Vielfalt im Vergleich zu den Immunglobulinen Immunglobulin α:β - Rezeptoren Element V-Segmente D-Segmente D-Segmente, in drei Rastern gelesen selten oft J-Segmente Verknüpfung mit N- und PNucleotiden 50% der Verknüpfungen Anzahl der V-Genpaare junktionale Diversität Gesamtvielfalt 130 Veränderungen in den Immunglobulin- und T-Zell-Rezeptor-Genen, die während der B-Zell- und T-Zell-Entwicklung und –Differenzierung erfolgen Vorgang erfolgt in Vorgang Art der Änderungen B-Zellen T-Zellen somatische Rekombination von DNA irreversibel ja ja junktionale Diversität unpräzise Verknüpfungen, Insertion von N-Sequenzen in die DNA irreversibel ja ja transkriptionelle Aktivierung Aktivierung des Promotors durch Nähe zum Enhancer irreversibel, aber reguliert ja ja IsotypwechselRekombination somatische Rekombination von DNA irreversibel ja nein Somatische Hypermutation DNA-Punktmutation irreversibel ja nein IgM-, IgD-Expressionen auf der Oberfläche Differenzielles Spleißen von RNA reversibel, reguliert ja nein Membrangebundene oder sezernierte Form Differenzielles Spleißen von RNA reversibel, reguliert ja Ereignis Zusammensetzung der VRegionen nein 132 Veränderungen in den Immunglobulin- und T-Zell-Rezeptor-Genen, die während der B-Zell- und T-Zell-Entwicklung und –Differenzierung erfolgen Vorgang erfolgt in Vorgang Art der Änderungen B-Zellen T-Zellen somatische Rekombination von DNA irreversibel ja ja junktionale Diversität unpräzise Verknüpfungen, Insertion von N-Sequenzen in die DNA irreversibel ja ja transkriptionelle Aktivierung Aktivierung des Promotors durch Nähe zum Enhancer irreversibel, aber reguliert ja ja IsotypwechselRekombination somatische Rekombination von DNA irreversibel ja nein Somatische Hypermutation DNA-Punktmutation irreversibel ja nein IgM-, IgD-Expressionen auf der Oberfläche Differenzielles Spleißen von RNA reversibel, reguliert ja nein Membrangebundene oder sezernierte Form Differenzielles Spleißen von RNA reversibel, reguliert ja Ereignis Zusammensetzung der VRegionen nein 133 Der Aufbau der wichtigsten menschlichen Immunglobulinisotypen 134 Der Aufbau der wichtigsten menschlichen Immunglobulinisotypen Opsonisierung Komplement mucosale Immunität Mastzell-Aktivierung 135 IgM- und IgA-Moleküle können Multimere bilden IgM-Pentamer J-Kette IgA-Dimer J-Kette 136 Veränderungen in den Immunglobulin- und T-Zell-Rezeptor-Genen, die während der B-Zell- und T-Zell-Entwicklung und –Differenzierung erfolgen Vorgang erfolgt in Vorgang Art der Änderungen B-Zellen T-Zellen somatische Rekombination von DNA irreversibel ja ja junktionale Diversität unpräzise Verknüpfungen, Insertion von N-Sequenzen in die DNA irreversibel ja ja transkriptionelle Aktivierung Aktivierung des Promotors durch Nähe zum Enhancer irreversibel, aber reguliert ja ja IsotypwechselRekombination somatische Rekombination von DNA irreversibel ja nein Somatische Hypermutation DNA-Punktmutation irreversibel ja nein IgM-, IgD-Expressionen auf der Oberfläche Differenzielles Spleißen von RNA reversibel, reguliert ja nein Membrangebundene oder sezernierte Form Differenzielles Spleißen von RNA reversibel, reguliert ja Ereignis Zusammensetzung der VRegionen nein 137 Keimzentren als Orte der somatischen Hypermutation Keimzentren als Orte der somatischen Hypermutation schwere Kette Immunisierung primäre sekundäre tertiäre leichte Kette Affinität