Pharmakologie der Blutzuckerregulation Insulin
Werbung

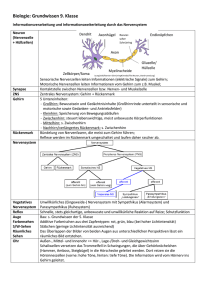
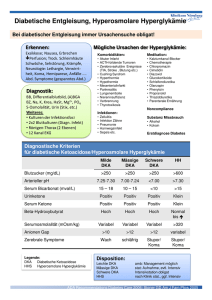
Pharmakologie der Blutzuckerregulation Autor: C. Nanoff Institut für Pharmakologie, Medizinische Universität Wien (siehe Freissmuth, Offermanns, Böhm, Pharmakologie & Toxikologie Kapitel 54, S. 602-622) Insulin 1.) Chemie Insulin ist ein Protein aus 51 Aminosäuren, die auf zwei Ketten (A und B) verteilt sind. Die beiden Ketten sind durch Disulfidbrücken verknüpft. Die -Zelle des Pankreas stellt Proinsulin her. In Granula gepackt wird die einzelne Peptidkette des Proinsulins an zwei Punkten gespalten: Es entstehen Insulin und das sog. C-Peptid. Wenn Insulin sezerniert wird, wird auch ein äquimolarer Anteil des C-Peptids freigesetzt. Das C-Peptid hat keine bekannte physiologische Funktion, sein Nachweis kann diagnostisch bedeutsam sein. Halbwertszeit des Insulins = 3-5 Minuten. Insulin wird in den Granula als Zinkkristall gespeichert (6 Moleküle Insulin: 2 Moleküle Zn2+). Der wesentlichste physiologische Reiz zur Freisetzung aus der -Zelle ist ein erhöhter Blutzuckerspiegel (> 6.1 – 7.0 mmol/l = Hyperglykämie). Erst wenn der Blutzucker erhöht ist, produziert die -Zelle ausreichend ATP, um die Sekretion einzuleiten. ATP schließt einen ATP-empfindlichen Kaliumkanal und führt so zur Depolarisation der -Zelle. Ca2+ strömt ein und vermittelt die Freisetzung des Granulainhalts nach außen. Pharmakologisch bedeutsam ist, dass Sulfonylharnstoffe den ATP- empfindlichen Kaliumkanal durch einen allosterischen Mechanismus indirekt blockieren. Gesteigerte Insulinsekretion ist ein Teil ihrer antidiabetischen Wirkung . 2.) Wirkungen Wenn das körpereigene Insulin fehlt oder eine ausgeprägte Insulinresistenz besteht, muss Insulin substituiert werden. Insulin wird zugeführt, um die physiologischen Wirkungen zu erhalten, wobei ein entscheidender Unterschied in der Steuerung der Insulinfreisetzung liegt: Beim Gesunden erfolgt sie durch Rückkoppelung, beim Insulin-pflichtigen Patienten muss die Autoregulation aber durch präzise Therapieplanung ersetzt werden. Insulin senkt den Blutzucker unabhängig vom Ausgangswert und hat anabole, gewebsaufbauende Wirkungen. Insulin-empfindliche Zellen (Leber, Fettgewebe, Skeletmuskel, Herzmuskel) sind mit dem Insulinrezeptor, Signal-vermittelnden Komponenten und Effektoren ausgestattet (siehe Abbildung I). Durch Bindung an den Rezeptor, eine Rezeptor-Tyrosinkinase, und deren Aktivierung vermehrt Insulin die Glucose-Transporter, Aminosäuretransporter und die Na+/K+-ATPase an der Zelloberfläche; Insulin stimuliert den Glykogenaufbau, hemmt die Lipolyse und die hepatische Gluconeogenese. Zumindest einige dieser akuten Stoffwechseleffekte sind unabhängig von der Neubildung von Funktionsproteinen und erfolgen sehr rasch. Darüber hinaus steuert Insulin die Expression von Genen des Intermediärstoffwechsels und beeinflusst Zellproliferation und steigert die Proteinsynthese (Beispiel: unbehandelter Schwangerschaftsdiabetes Stimulation der fetalen Zelle des Kindes Insulin , hohes Geburtsgewicht und vorzeitige Differenzierung von Geweben). Sekunden Tage Stunden Minuten Legende Insulin bindet an seinen Rezeptor und führt zu dessen Aktivierung. Der Rezeptor entfaltet Tyrosinkinase-Aktivität, wodurch seine Untereinheit und dann nachgeschaltete Signalkomponenten (IRS = Insulinrezeptorsubstrat) phosphoryliert werden. Der Insulinempfindliche Glucosetransporter wird aus intrazellulären Vesikeln an die Zelloberfläche (Muskel, Fettgewebe) gebracht und enzymatische Stoffwechselvorgänge (z.B. Hemmung der Glykogenolyse, der Lipolyse) reguliert werden. Andere Effekte, die durch Steuerung der Zellkernaktivität zustande kommen und anabole Wirkungen des Insulins vermitteln, benötigen länger und werden durch eine dauerhafte Aktivierung des Insulinrezeptors begünstigt (Abbildung aus Freissmuth, Offermanns, Böhm, Kapitel 54S. 602-622 3.) Insulin-Präparate zur subkutanen Verabreichung Typ Ultra-kurz wirksam Insulin lispro Insulin aspart Insulin glulisin Wirkung, in Stunden * Beginn Max. Dauer Aussehen der pH Lösung Zusätze Klar Neutral Keine „Spritz-Essabstand“ = praktisch keiner 1 2-4 „Spritz-Essabstand“ = 0.5-0.7 2-4 5-8 Kurz wirksam Regulär=Normalinsulin =Altinsulin Präparat für i.v.-Gabe Intermediär wirksam NPH (Isophan) Lente-Insulin Klar Neutral Keine Trüb Trüb Neutral Neutral Protamin in Phosphat-Puffer 1-2 Mischung aus amorphem und 1-2 kristallinem Zn2+-Insulin in Azetat Puffer 6-12 6-12 18-24 18-24 Lang wirksam Ultralente-Insulin Trüb Neutral 4-6 16-18 20-36 Insulin glargin Klar Sauer 4-6 5-24 24-36 Insulin detemir Klar Neutral Kristallines Zn2+-Insulin in Azetat Puffer Keine; wegen pH nicht mischbar Keine 1-2 8-10 20 * Diese Angaben haben große Schwankungsbreiten, sie sind daher nicht sehr verlässlich: es gibt Schwankungen von Patient zu Patient sowie beim individuellen Patienten über die Zeit hinweg: die Insulintherapie muss individuell eingestellt und der Patient geschult werden. Die erhältlichen Insulin-Präparate werden rekombinant hergestellt (in Hefe oder Bakterien). Ihre Peptidsequenz entspricht der des humanen Moleküls, bzw. des humanen Moleküls mit geringfügigen Veränderungen der Peptidsequenz (lispro, aspart, glulisin, glargin) oder durch Konjugation mit einer Fettsäure (Insulin detemir). Zum Beispiel: Lispro (für Lysin-Prolin) = humanes Insulin, in dessen B-Kette zwei Aminosäuren Platz getauscht haben. Rekombinante Insuline mit vom Original abweichender Struktur werden als Insulin-Analoga bezeichnet. Was bestimmt den Wirkungseintritt nach subkutaner Verabreichung? - Die Auflösung der Insulinkomplexe und die Freisetzung des monomeren Insulins. Insulin bildet hexamere (hexa= 6) Komplexe. Diese Komplexbildung wird durch Zink gefördert; nach subkutaner Injektion muss sich das Hexamer zuerst auflösen, bevor Insulin in seiner aktiven, monomeren Form in den Blutstrom gelangt. Dieser Depoteffekt wird ausgenützt, um den Wirkungseintritt zu verzögern. Alternativ kann Insulin zur Verzögerung der Anflutung mit einem basischen Protein (Protamin) komplexiert werden. Insulin lispro, aspart, glulisin: durch Ändern der Aminosäuresequenz liegt Insulin mono- bzw. dimerisch vor, aber nicht in Form des Hexamers rasche Anflutung. Alle anderen Eigenschaften entsprechen denen von Humaninsulin. Insulin glargin (Lantus ) – bildet auch ohne Zusätze ein stabiles Hexamer. Sehr langsames Lösen und Anflutung 24 hr Wirkdauer ohne Wirkgipfel Insulin detemir – bindet als „Fettsäure-Derivat“ an Serumalbumin Zunahme der t1/2. Mit Ausnahme der ultra-kurz wirksamen Insulinanaloga gilt für alle subkutan verabreichten InsulinPräparate: Mit zunehmender Dosis nimmt auch die Wirkungsdauer zu. Insulindosierung erfolgt nach Internationalen Einheiten (IU). 1 mg ~ 28 IU. 1 IU entspricht jener Menge Insulin, die durch den Zuckergehalt von einer Broteinheit (1 BE = 12 g Kohlenhydrate = eine dünne Scheibe Brot) aus dem Pankreas freigesetzt wird. 1 BE erhöht den BZ um 2 mmol/l Durchschnittlicher Tagesbedarf beim Typ I Diabetes = 0.7 IU/ kg Zur s.c. Verabreichung kann außer der Spritze auch der sog. Insulin-Pen verwendet werden (nicht „Pen-fähig“: Zink-Präparate) Ziel ist mit möglichst wenigen s.c. Injektionen eine Kontrolle von Nüchternblutzucker und von postprandialen Blutzuckerspitzen zu erzielen (Minimum = 2, siehe Abbildung weiter unten). Zur Anwendung gelangen daher Kombinationen von rasch wirksamen und Verzögerungsinsulinen. Insulinpumpen: kontinuierliche selbst steuerbare s.c. Infusion von ultrakurz wirksamem Insulin Haltbare Fertig-Kombinationen: Humanes Mischinsulin: Kombi. aus NPH Insulin und Normal-Insulin. Mischinsulinanaloga: Lispro und NPL-Insulin; Aspart und NPA-Insulin (mit Protamin komplexiertes Insulin lispro, Insulin aspart als verzögert wirksame Komponenten). Nicht mischbar: (Ultra)Kurz-wirksames Insulin und Glargin (pH = inkompatibel) Nicht mischbar: (Ultra)Lente und Normal-Insulin führt zu einer Verzögerung der rasch wirksamen Komponente (Spritz-Essabstand wird länger) 3. Unerwünschte Wirkungen der Insulintherapie Hypoglykämischer Zwischenfall Lipodystrophie Reaktionen an der Injektionsstelle (Lipoatrophie, Lipohypertrophy) - selten. Zur Vermeidung: Rotation der Injektionsstelle (im selben Areal), Intensivierung der Behandlung Cave: Wechseln des Injektionsareals variable Resorptionskinetik (Resorptionsgeschwindigkeit: Bauchhaut>Glutäalregion>Oberschenkel) weitere Variable: Heißes Bad, Bewegung, Massage kutane Zirkulation Insulin Allergie = seltenes Ereignis Präparate von rekombinantem Human-Insulin können immunogen sein (denaturiertes Protein, Kontaminanten, Konservierungsmittel) akute Hautreaktionen Enstehung von Anti-Insulin IgG Dosissteigerung notwendig Abfall des Serum-Kaliums (bei intravenöser Anwendung) Antidiabetika für Typ II-Diabetes Indikation = NIDDM (Typ II-Diabetes) Wenn Ziel I = BZ-Kontrolle durch Gewichtsabnahme (Bewegung und Diät) nicht erreichbar, dann sind orale Antidiabetika indiziert. [Ein Maß für die Verlaufskontrolle = Anteil der glykosylierten Form am Gesamthämoglobin (= HbA1c).] Arzneimittel Wirkort Wirkung Metformin Leberstoffwechsel Insulinresistenz HbA1C , % GesamtHb 1,1 Glitazone Fettgewebe (PPAR) Insulinresistenz 1 Sulfonylharnstoffe Repaglinid (Meglitinide) GLP-1-Rezeptoragonisten -Zelle Insulinfreisetzung 1,5 -Zelle Insulinfreisetzung 0,5 - 1,3 Nerven, -Zelle (GLP-1-Rez) Insulinfreisetzung 0,5 – 1,2 DPP-IV Hemmer Zelloberflächen 0,5 – 0,9 -Glucosidasehemmer SGLT-2 Hemmer Darmlumen Insulinfreisetzung Resorption von Monosacchariden Ausscheidung von Glucose Tubulusepithel der Niere 0,8 0,5 – 0,8 1. Metformin (ein Biguanid) Angriffspunkt: Mitochondrienmembran – bevorzugt in der Leber Aktivierung der AMP-abhängigen Proteinkinase verminderte Gluconeogenese, Fettsäuresynthese Verwertung der Brenztraubensäure gehemmt Rückstau von Milchsäure Mechanismen der Blutzucker-Senkung: Hemmung der Glukoneogenese in der Leber, verbesserte Glucoseverwertung im Muskel Legende: Transkriptionelle Steuerung der Gluconeogenese durch ein Hormon (Glucagon) bzw. durch Zellstress (Verarmung an ATP Zunahme von AMP) AMP (Adenosinmonophosphat) ein Signal für Zellstress steigert die zelluläre Glucoseaufnahme, die Fettsäure-Oxidation im Muskel, hemmt Fettsäuresynthese und Gluconeogenese. Sein Effektor = AMP abhängige Kinase, die den Koaktivator der Transkription, TORC2 (= Transducer of Regulated CREB activity 2) inaktiviert. Das Antidiabetikum Metformin führt indirekt zu einer AMPK-Aktivierung; sein Angriffspunkt = Mitochondrienmembran. Wichtig für den Patienten: Metformin wirkt ... 1. “insulinsparend” – Vermeidung des anabolen Insulineffekts (=Gewichtszunahme) – Metformin erleichtert das Abnehmen 2. “euglykämisierend” – hypoglykämische Zwischenfälle kommen sehr selten vor (nach Alkoholexzess, da Alkohol selbst den BZ senkt) 3. reduzierend auf Triglyzeridspiegel (-20 %) 4. präventiv gegen makrovaskuläre Spätkomplikationen Dosierung: 1*500 mg/ d bis 3*850 mg/d Nebenwirkungen 1. Übelkeit, Diarrhoe, Völlegefühl, Obstipation, metall. Geschmack, Vitamin B12 Mangelabsorption Einnahme zu den Mahlzeiten 2. Kopfschmerz, Schwäche, Schweißausbrüche (1., 2. → „Metformin-Unverträglichkeit“) 3. Laktatazidose durch Hypoxämie (z.B. akute Herzinsuffizienz, Sepsis, Pneumonie): CAVE: Kontraindikationen Kontraindikationen 1. Herzinsuffizienz, Niereninsuffizienz, Leberinsuffizienz 2. Ventilatorische Insuffizienz (z.B. Emphysem) 3. Herzinfarkt 4. Lebensalter > 70 Jahre 5. Fasten (= niedrigstkalorische Diät) 6. Alkoholkonsum 2. Sulfonylharnstoff-Derivate (und. 3. Meglitinide) Effekte Angriffspunkt = SUR1, Untereinheit des ATP-empfindlichen Kalium-Kanals der -Zelle 1. Insulinfreisetzung aber: sukzessiver Wirkungsverlust (reversibel, Down-Regulation von SUR1) 2. Fortgesetzte Anwendung: Insulinresistenz (= Insulinspiegel bei normaler Plasmaglucose, vermutlich durch reduzierte Glukosetoxizität) 3. Sinken des zirkulierenden Glucagons 1., 2., 3. Sinken des BZ-Spiegels– Verlust der Wirksamkeit möglich Sulfonylharnstoffe senken den euglykämischen (normalen) Blutzucker, sind aber wirksamer bei Hyperglykämie Vertreter Sulfonylharnstoff Glibenclamid Glipizid Glimepirid Glinide = Insulin-Releaser t ½ (h) 9 2-4 5-8 1 Wirkdauer (h) 24 10-24 24 Sehr kurz Kleinste Einzeldosis (mg) 2 5 1 0,5 Pharmakokinetik Wirkdauer > Verweildauer, Anwendung = 1* täglich; Hypoglykämie-Zwischenfall erfordert längere Behandlung! Ausnahme davon sind die Glinide, deren Wirkdauer erst durch Hemmung des Leberstoffwechsels Nebenwirkungen Hypoglykämie: Warnsymptome = Heißhunger, Tremor, Schweißausbruch Hypoglykämische Zwischenfälle sind die häufigste Nebenwirkung von Sulfonylharnstoffen wobei es Unterschiede zwischen den Präparaten gibt (z.B.:Glibenclamid > Glimepirid). Grund: Selbst bei niedriger Plasmaglukose fördert Glibenclamid die Insulinfreisetzung und unterdrückt die Glucagonfreisetzung, Glimepirid hingegen hat diesen Effekt nicht. bei älteren Patienten und/oder schwachen Warnsymptomen „neuroglykopenische Symptomatik“ = Schlaganfall-artig: Dysphasie, Lähmungen, Verwirrtheit (DD!): weil Verlust der Warnsymptome durch diabetische Neuropathie (mangelhafte Sympathikusaktivierung) Hypoglykämie hält lange an. Selten: Ausschlag, Alkoholunverträglichkeit Leukopenie u.a. Blutbildveränderungen Hepatopathie (Übelkeit, Ikterus) Kontraindikation Schwangerschaft Leber- und Niereninsuffizienz (Dosierungsprobleme Vergleich des akuten Effekts von einem Meglitinid und einem Sulfonylharnstoff Zeit (Stunden) 4. Acarbose, Miglitol: Hemmstoffe von -Glukosidasen (z.B. Amylase, Maltase) Reduzieren Aufschluss von Disaccharid und höheren Oligosacchariden im Darm Kohlenhydratresorption verzögert Einnahme nach dem ersten Bissen der Mahlzeit Ausgleich von postprandialen BZ-Spitzen Nebenwirkungen: Flatulenz, Darmdistension, selten Diarrhoe (Dosisteigerung) Verstärkt die hypoglykämische Wirkung von Sulfonylharnstoffen Cave: Hemmt Resorption von Metformin Miglitol -Glucosidasehemmer Glucose 5. Pioglitazon (Thiazolidin-Dion) Angriffspunkt: PPAR (Peroxisomen-Proliferator-Aktivator-Rezeptor) in Adipozyten = Liganden gesteuerter Transkriptionsfaktor PPAR verantwortlich für die Differenzierung von Adipozyten: Zellzahl, Zellgröße, induziert Adipozytokin (Adiponectin) Glitazone... erhöhen die Insulinempfindlichkeit von Leber und Muskel maximaler Blutzucker-Effekt erst nach 12 Wochen können dem manifest Werden von Typ II Diabetes vorbeugen können den Insulinbedarf reduzieren Wichtig für den günstigen Effekt: 1. Adiponectin aktiviert AMPK Glukoseausstoß der Leber 2. Abnahme der Freien Fettsäuren, Abnahme von proinflammatorischen Zytokinen 3. Glucoseverwertung im Muskel Nebenwirkungen Neigung zu systemischen Oedemen Peripheres Fettgewebe → GW (Blutdruck ) Reversible Leberschäden (TA = KI) (Regeneration von Knochenzellvorstufen - Osteoporose) (Regeneration von Knochenmarkstammzellen - Hämatokrit ) Blasenkrebsrisiko? Kontraindikation Leberschäden Herzinsuffizienz, deshalb Kombination mit Insulin verboten! 6. Pharmakologie von Glucagon-like peptide 1 (GLP-1) • Endogene Quelle: L-Zellen des Darmepithels, Neurone des Ncl. Tractus solitarii • Abbau durch Dipeptidyl Peptidase IV (CD26) an Zelloberflächen, geringer Übertritt über BHS • Effekte an afferenten Nerven 1. Fördert Insulinfreisetzung durch Zucker, Aminosäuren 2. Hemmung der Magenentleerung/ Dünndarmperistaltik 3. ZNS: Appetithemmung Neben GLP-1 steigert auch GIP (Glucose-abhängiges insulinotropes Peptid) die Insulinfreisetzung und wird durch DPP IV abgebaut GLP1-Agonisten : • Exenatide t/2 = 2 hr • Liraglutide t/2 = 10 hr (im Plasma an Protein gebunden) • neu: Lixisenatide NW: Hypoglykämie – Risiko = gering (cave: Kombi mit Sulfonylharnstoff) Gewichtsabnahme GLP1-Agonisten (Peptide, Anwendung s.c., VD ~0.2 L/kg, ZNS-Wirkung) Anorexie, Übelkeit, Durchfall Pankreatitis?, KI = Nierenschäden (aggraviert) DPP-IV Hemmer (Gliptine) Sita, Vildagliptin - Elimination = renal Saxagliptin - CYP3A4-abhängige Aktivierung und Metabolisierung – cave WW Linagliptin – Elimination unabhängig von Niere und Leber nebenwirkungsarm KI = Niereninsuffizienz (Vilda), Angiooedem