Reaktionstypen der organischen Chemie
Werbung
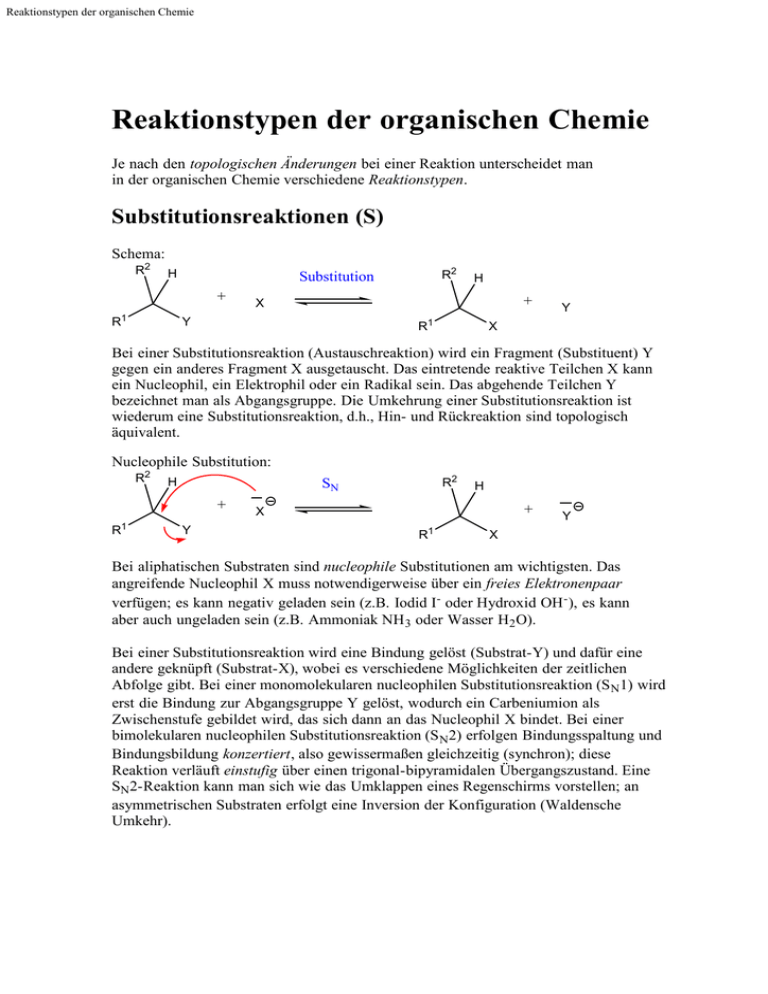
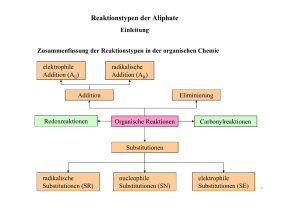
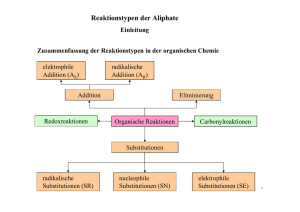
Reaktionstypen der organischen Chemie Reaktionstypen der organischen Chemie Je nach den topologischen Änderungen bei einer Reaktion unterscheidet man in der organischen Chemie verschiedene Reaktionstypen. Substitutionsreaktionen (S) Schema: R2 H + R1 R2 Substitution H + X Y R1 Y X Bei einer Substitutionsreaktion (Austauschreaktion) wird ein Fragment (Substituent) Y gegen ein anderes Fragment X ausgetauscht. Das eintretende reaktive Teilchen X kann ein Nucleophil, ein Elektrophil oder ein Radikal sein. Das abgehende Teilchen Y bezeichnet man als Abgangsgruppe. Die Umkehrung einer Substitutionsreaktion ist wiederum eine Substitutionsreaktion, d.h., Hin- und Rückreaktion sind topologisch äquivalent. Nucleophile Substitution: R2 H + R1 R2 SN Y H + X 1 R Y X Bei aliphatischen Substraten sind nucleophile Substitutionen am wichtigsten. Das angreifende Nucleophil X muss notwendigerweise über ein freies Elektronenpaar verfügen; es kann negativ geladen sein (z.B. Iodid I- oder Hydroxid OH - ), es kann aber auch ungeladen sein (z.B. Ammoniak NH 3 oder Wasser H2 O). Bei einer Substitutionsreaktion wird eine Bindung gelöst (Substrat-Y) und dafür eine andere geknüpft (Substrat-X), wobei es verschiedene Möglichkeiten der zeitlichen Abfolge gibt. Bei einer monomolekularen nucleophilen Substitutionsreaktion (S N1) wird erst die Bindung zur Abgangsgruppe Y gelöst, wodurch ein Carbeniumion als Zwischenstufe gebildet wird, das sich dann an das Nucleophil X bindet. Bei einer bimolekularen nucleophilen Substitutionsreaktion (S N2) erfolgen Bindungsspaltung und Bindungsbildung konzertiert , also gewissermaßen gleichzeitig (synchron); diese Reaktion verläuft einstufig über einen trigonal-bipyramidalen Übergangszustand. Eine SN2-Reaktion kann man sich wie das Umklappen eines Regenschirms vorstellen; an asymmetrischen Substraten erfolgt eine Inversion der Konfiguration (Waldensche Umkehr). Reaktionstypen der organischen Chemie Additionsreaktionen (A) Schema: R1 R3 Addition + R2 R1 X Y R3 R2 H X H Y Bei einer Additionsreaktion wird ein Teilchen (X-Y, zuweilen auch nur ein zweibindiges Atom wie z.B. O) zu einem Substrat hinzugefügt, also "addiert". Das Substrat verfügt in der Regel über eine Mehrfachbindung (also eine Doppel- oder Dreifachbindung, z.B. C=C oder C=O); bei der Reaktion wird eine π-Bindung im Substrat gelöst, dafür werden zwei σ -Bindungen (zu X und zu Y) gebildet. (Im Prinzip findet eine weitere Bindungsspaltung im angreifenden Teilchen X-Y statt.) Die Umkehrung einer Additionsreaktion ist eine Eliminierungsreaktion (s.u.). Besonders erwähnenswerte spezielle Additionsreaktionen sind die Hydrierung (Addition von Wasserstoff H2 ) und die Hydratisierung (Addition von Wasser H2 O). Je nach der Natur des (im entscheidenden Schritt) angreifenden Teilchens unterscheidet man elektrophile, nucleophile und radikalische Additionsreaktionen. Auch bei gewissen Ringöffnungsreaktionen, speziell an Dreiringen, finden Additionsreaktionen statt. Eliminierungsreaktionen (E) Schema: R1 R3 Eliminierung R1 R3 + R2 X Y H X Y R2 H Bei einer Eliminierungsreaktion wird ein Teilchen (X-Y, zuweilen auch nur ein zweibindiges Atom wie z.B. O) aus einem Substrat abgespalten, also "eliminiert". Dabei bildet sich im Substrat in der Regel eine Doppelbindung aus (bzw. eine Dreifachbindung, wenn die Eliminierung an einer Doppelbindung abläuft). Die Eliminierungsreaktion ist also die Umkehrung der Additionsreaktion. Besonders erwähnenswerte spezielle Eliminierungsreaktionen sind die Dehydrierung (Abspaltung von Wasserstoff H2 ) und die Dehydratisierung (Abspaltung von Wasser H2 O). Bei gewissen Eliminierungsreaktionen können sich Ringe anstelle von Mehrfachbindungen bilden (z.B. Dreiringe bei γ-Eliminierungen); bei αEliminierungen bilden sich (z.B.) Carbene (CR2 ). Reaktionstypen der organischen Chemie Kondensationsreaktionen Schema: Kondensation R1 X + Y R2 R1 R2 X + Y Solvolyse Bei einer Kondensationsreaktion werden zwei Fragmente (R1 und R2 ) miteinander verknüpft, wobei ein kleines Molekül (z.B. Wasser H 2 O oder ein Alkohol R-OH) abgespalten wird. Bei einer Kondensationsreaktion erfolgt zuerst eine Addition, der eine Eliminierung folgt. Die Umkehrung der Kondensationsreaktion ist die Solvolyse, deren wichtigster Spezialfall die Hydrolyse ist (also die Umsetzung mit Wasser). Beispiel: O R2 R1 O H2N O Peptidbildung + H2N NH + H2O R1 Peptidhydrolyse OH OH OH NH2 R2 Ein typisches Beispiel einer Kondensationsreaktion ist (formal) die Bildung eines Dipeptids aus zwei Aminosäure- Molekülen. Weitere Beispiele sind die (säurekatalysierte) Veresterung und die Esterkondensation (Claisenkondensation). Umlagerungsreaktionen (R) Schema: R Umlagerung R Bei einer Umlagerungsreaktion wandert ein Fragment R unter Umbildung des Bindungsgerüsts, d.h. einer Änderung der Konnektivitäten. Es findet also eine Isomerisierung statt. Eine Tautomerisierung (z.B. die Keto-Enol- Tautomerisierung) ist eine reversible Umlagerungsreaktion, bei der meist ein Wasserstoffatom (bzw. Proton) wandert. Beispiel: R R Cope-Umlagerung Ein schönes Beispiel für eine Umlagerungsreaktion bietet die Cope-Umlagerung. Sie ist eine pericyclische Reaktion, bei der sozusagen drei π-Bindungen konzertiert cyclisch umklappen (mit einem Sechsring als Übergangszustand). O Reaktionstypen der organischen Chemie Redoxreaktionen (Oxidation und Reduktion) Schema: Reduktion + + X - e X Oxidation Bei einer Redoxreaktion werden - zumindest formal - Elektronen übertragen: Bei einer Oxidation werden Elektronen abgegeben, bei einer Reduktion werden Elektronen aufgenommen. Oxidation und Reduktion sind stets miteinander gekoppelt; man bezieht sich daher jeweils auf das interessierende Substrat. Das benötigte Oxidations- oder Reduktionsmittel kann ein anorganisches Reagenz sein, aber auch ein organisches. Ob eine Oxidation oder Reduktion des Substrats stattfindet, ergibt sich aus der Änderung der Oxidationszahlen am Reaktionszentrum. (Oxidation = Zunahme der Oxidationszahl, Reduktion = Abnahme.) Redoxreaktionen fallen insofern aus der systematischen Klassifikation der Reaktionstypen heraus, als sie nicht immer "orthogonal" dazu sind. Damit ist gemeint, dass Redoxvorgänge häufig Begleiterscheinungen von anderweitig klassifizierten Reaktionen sind; beispielsweise ist eine Hydrierung auch eine Reduktion und umgekehrt eine Dehydrierung eine Oxidation. Beispiel: O OH (+2) (+1) Reduktion + 2 H+ + 2 e- Oxidation (+2) O (+1) OH Ein typisches Beispiel für eine (auch biologisch relevante) reversible Redoxreaktion findet man im System Chinon/Hydrochinon. Es sei angemerkt, dass in diesem System das Redoxpotential pH-abhängig ist (Nernstsche Gleichung). Index: Organisch-chemische Reaktionen