Versuch 6 - Leitenzyme
Werbung

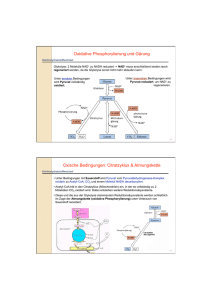
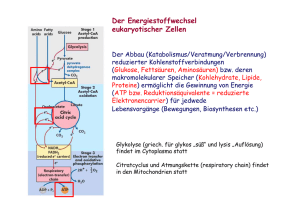
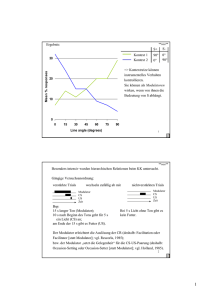
Versuch 6 „Leitenzyme“ Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann [email protected] X X X Dr. Kojro Einleitung Ziel dieses Versuches ist der Nachweis von bestimmten Leitenzymen im Cytosol von Leberzellen und im Plasma von Mitochondrien aus Leberzellen. Leitenzyme sind Enzyme, deren Vorkommen typisch für einen bestimmten Zelltyp und ein bestimmtes Organell ist. Zum Beispiel sind Enzyme der Glykolyse typisch für das Cytoplasma, Enzyme des Citratcyklus dagegen sind Leitenzyme des Mitochondrienplasmas. Zur Gewinnung von reinem Cytoplasma und reinem Mitochondrienplasma bedient man sich der Methode der Aufschließung und Homogenisation von Zellen und Zellorganellen und der fraktionierten Zentrifugation dieser. Speziell werden bei diesem Versuch die Glutamat-, die Lactat- und die IsocitratDehydrogenase untersucht. Bei allen drei Enzymen handelt es sich um Oxyreduktasen. Material und Methode Der Versuch wurde exakt nach Versuchsanleitung durchgeführt. Die genaue Vorgehensweise bei der fraktionierten Zentrifugation ist detailliert in der Versuchsanleitung dargestellt. Die gesamte Trennung wird unter ständiger Kühlung durchgeführt um Abbauprozesse zu verhindern. Der Nachweis der Enzyme erfolgt mit dem optischen Test am Photometer. Als Chromophor dient NAD(P)H dessen Konzentration in der Lösung direkt proportional zur Konzentration an entstandenem Produkt ist. NAD(P)H zeigt ein Absorbtionsmaximum für Licht der Wellenlänge 350nm, während dies für NAD(P)+ nicht der Fall ist. Entsteht bei der Reaktion die reduzierte Form des Coenzyms so wird dem Reaktionsansatz die Extinktion E=0 zugeordnet, wird jedoch der Chromophor (NAD(P)H) oxidiert und verliert somit seine Eigenschaften als solcher, wird dem Reaktionsansatz eine Extinktion > 0 zugeordnet. Somit ist beides Mal der Betrag der Änderung der Extinktion direkt proportional zur Reaktionsgeschwindigkeit. Ergebnisse b) Glutamat-Dehydrogenase-Test Reaktionsansatz 1 (wird der Extinktion E = 0,7 bei 366nm zugeordnet, da NADH verbraucht wird) + Cytosol Zeit (s) 0 20 40 60 + Mitochondrienplasma Zeit (s) 0 20 40 60 80 100 120 140 160 180 200 220 240 260 280 300 320 340 360 380 400 420 Extinktion 0,550 0,520 0,520 0,520 Extinktion 0,690 0,650 0,610 0,570 0,520 0,475 0,445 0,420 0,390 0,380 0,355 0,345 0,330 0,320 0,310 0,305 0,295 0,292 0,290 0,285 0,285 0,285 Glutamat-Dehydrogenase-Test 0,8 0,7 Extinktion 0,6 0,5 0,4 0,3 0,2 0,1 0 0 50 100 150 200 250 300 350 400 Zeit (s) Glutamat Dehydrogenase (Cytosol) Glutamat Dehydrogenase (Mitochondrien) 450 c) Isocitrat-Dehydrogenase-Test Reaktionsansatz 3 (wird der Extinktion E = 0 bei 366nm zugeordnet, da NADPH entsteht) + Cytosol Zeit (min) 0 0,5 1 1,5 2 2,5 3 3,5 + Mitochodrienplasma Extinktion 0,050 0,155 0,250 0,320 0,360 0,380 0,390 0,390 Zeit (min) 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 5,5 6 6,5 7 7,5 Extinktion 0,020 0,055 0,090 0,120 0,155 0,190 0,220 0,250 0,280 0,300 0,320 0,335 0,345 0,355 0,360 0,360 Isocitrat-Dehydrogenase-Test 0,45 0,4 0,35 Extinktion 0,3 0,25 0,2 0,15 0,1 0,05 0 0 1 2 3 4 5 6 7 Zeit (min) Isocitrat-Dehydrogenase (Cytosol) Isocitrat-Dehydrogenase (Mitochondrien) 8 d) Lactat-Dehydrogenase-Test Reaktionsansatz 5 (wird der Extinktion E = 0,7 bei 366nm zugeordnet, da NAPH verbraucht wird) + Cytosol Zeit (min) 0 0,5 1 1,5 2 2,5 3 3,5 + Mitochondrienplasma Extinktion 0,690 0,460 0,340 0,260 0,220 0,205 0,200 0,200 Zeit (min) 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 5,5 6 6,5 7 Extinktion 0,700 0,680 0,670 0,660 0,642 0,630 0,610 0,600 0,590 0,580 0,560 0,550 0,540 0,525 0,510 Lactat-Dehydrogenase-Test 0,8 0,7 Extinktion 0,6 0,5 0,4 0,3 0,2 0,1 0 0 1 2 3 4 5 6 7 Zeit (min) Lactat-Dehydrogenase (Cytosol) Lactat-Dehydrogenase (Mitochondrien) 8 Auswertung Zu b): Glutamat-Dehydrogenase (GDH) Test Die GDH besteht bei Vertebraten aus sechs identischen Untereinheiten und wird allosterisch reguliert. ATP und GTP sind allosterische Inhibitoren, ADP und GDP dagegen allosterische Aktivatoren. Die GDH katalysiert die oxidative Desaminierung von Glutamat bei der eine Aminogruppe in Form eines Ammoniumions freigesetzt wird. Dazu benötigt sie H2O Ungewöhnlicher Weise kann sie als Elektronenakzeptor (donor) entweder NAD+ oder NADP+ verwenden. Die Freisetzung der Aminogruppe erfolgt nur in der mitochondrialen Matrix der Leber durch die Glutamat-Dehydrogenase. Reaktion der Glutamat-Dehydrogenase: Glutamat + NAD+ (oder NADP+) + H2O NH4 + α-Ketoglutarat + NADH (oder NADPH) + H+ + In unserem Versuch lief die Reaktion genau umgekehrt, da NADH, NH4+ und a-Ketoglutarat zugegeben wurden. Bei Zugabe von Mitochondrienplasma zum Reaktionsansatz fiel die Extinktion vom Anfangswert (E = 0,7 = Extinktion des Reaktionsansatzes) bis auf den Wert 0,3 ab. Die Stoffe im Ansatz befinden sich somit bei diesen Endbedingungen im chemischen Gleichgewicht. Bei Zugabe von Cytosol zum Reaktionsansatz fiel die Extinktion vom Anfangswert E=0,7 schlagartig auf 0,55 ab. Dann änderte sie sich nicht mehr. Deshalb kann man davon ausgehen, dass es zu keiner Reaktion kam und die Extinktionsänderung durch zufälliges Berühren des Kalibrationsrädchens am Photometer zustande kam. Die Erklärung, dass die plötzliche Extinktionsänderung auf Verunreinigungen (Flourophore) im Cytoplasma zurückzuführen ist, ist unlogisch, denn sonst würde man dies auch bei den anderen Reaktionen bei Zugabe von Cytoplasma beobachten, was aber nicht der Fall ist. Aus den Ergebnissen lässt sich darauf schließen, dass die GDH nur im Mitochodrienplasma, nicht aber im Cytosol der Leberzellen vorkommt, was auch der Theorie entspricht. Zu d): Lactat-Dehydrogenase (LDH) Test Im kontrahierenden Skelettmuskel übersteigt unter anaeroben Bedingungen- etwa bei starker Anstrengung- die Geschwindigkeit der Pyruvatproduktion durch die Glykolyse die Rate der Pyruvatoxidation durch den Citratcyklus. Ferner ist die Geschwindigkeit der NADH-Bildung in der Glykolyse unter diesen Bedingungen größer als die Rate der NADH-Oxidation in der Atmungskette. Die Fortdauer der Glykolyse hängt davon ab, ob genügend NAD+ zur Oxidation des Glycerinaldehyd-3-phpsphats zur Verfügung steht. Die Anhäufung von NADH und Pyruvat wird durch die Lactat-Dehydrogenase unterbunden, die NADH zu NAD+ oxidiert und Pyruvat zu Lactat reduziert. Die Lactatbildung ist im Stoffwechsel ein totes Gleis. Das Lactat muss in Pyruvat zurückverwandelt werden, bevor es metabolisiert werden kann. Der einzige Zweck der Reduktion von Pyruvat zu Lactat ist die Regenerierung von NAD+, so dass die Glykolyse im aktiven Skelettmuskel und in den Erythrocyten fortschreiten kann. Die Lactatbildung bringt nur Zeitgewinn und verlagert einen Teil der Stoffwechsellast von der Muskulatur auf die Leber. Aufgrund des hohen NADH/NAD+-Verhältnisses im kontrahierenden Muskel wird dort weit mehr Lactat als Pyruvat abtransportiert. Das in die Leber eingetretene Lactat wird zu Pyruvat oxidiert, eine Reaktion, die durch das niedrige NADH/NAD+Verhältnis im Cytosol der Leber begünstigt ist. Das Pyruvat wird dann durch die Gluconeogenese in der Leber in Glucose umgewandelt. Die Umwandlung von Lactat zu Pyruvat und umgekehrt wird durch Unterschiede in den katalytischen Eigenschaften der Lactat-Dehydrogenasen verschiedener Gewebe erleichtert. Die Lactat-Dehydrogenase ist ein Tetramer aus zwei verschiedenen 35kD-Untereinheiten: Der H-Typ dominiert im Herzmuskel, der homologe M-Typ im Skelettmuskel und in der Leber. Diese Untereinheiten schließen sich zu fünf verschiedenen Tetrameren zusammen: H4, H3M1, H2M2, H1M3 und M4. Man nennt diese Typen Isoenzyme. Das H4-Isoenzym (Typ 1) besitz eine höhere Affinität zu den Substraten als das M4Isoenzym (Typ5). Ein weiterer Unterschied besteht darin, dass H4 von hohen Pyruvatkonzentrationen allosterisch gehemmt wird, M4 dagegen nicht. Die Eigenschaften der anderen Isoenzyme liegen dazwischen, je nach dem Verhältnis der beiden Kettentypen. Die Vermutung liegt nahe, dass speziell H4 Lactat zu Pyruvat oxidiert, das dann vom Herzmuskel als Brennstoff verwendet werden kann. Der aerobe Stoffwechsel des Herzens erlaubt, dass Pyruvat in den Citratcyklus eingeschleust wird. Dagegen ist M4 prädestiniert, in umgekehrter Richtung zu arbeiten, also Pyruvat in Lactat umzuwandeln, so dass die Glykolyse unter anaeroben Bedingungen weiterlaufen kann. Reaktion der Lactat-Dehydrogenase in unserem Versuch: Pyruvat + NADH + H+ Lactat + NAD+ Bei Zugabe von Leberzellen-Cytosol zum Reaktionsansatz fiel die Extinktion schnell ab (Reaktion = Anwesenheit von LDH), bei Zugabe von Mitochondrienplasma fiel die Extinktion auch ab, allerdings nicht so schnell wie bei Zugabe des Cytosols. Verunreinigung durch LDH oder andere Dehydrogenase oder andere Substanz die auf den optischen Test reagiert. Dies entspricht auch der Theorie, denn die LDH katalysiert in der Leber die Bildung von Pyruvat aus Lactat. Das Pyruvat wird dann in der Gluconeogenese weiterverarbeitet zu Glucose. Die Gluconeogenese findet im Cytosol statt, daher ist es naheliegend, das Pyruvat auch dort aus Lactat herzustellen. Es ist also viel LDH im Cytosol- keine im Mitochondrienplasma der Leberzellen. Zu c): Isocitrat-Dehydrogenase (IDH) Test Die Isocitrat-Dehydrogenase ist aus zwei identischen α- und β-Untereinheiten zusammengesetzt. Jedes der beiden aktiven Zentren des Enzyms besteht aus den Aminosäuren Asp311, Asp283 und Asp307. Jeweils zwei Aminosäuren (Asp311, Asp307) stammen aus der einen Kette, die dritte (Asp283) aus der jeweils anderen. In eukaryotischen Zellen gibt es zwei Isoenzyme der Isocitrat-Dehydrogenase, wobei beide dieselbe Reaktion katalysieren, nämlich die Decarboxylierung von Isocitrat zu α-Ketoglutarat. Das eine Isoenzym benötigt NAD+ als Cofaktor und katalysiert im Citratzyklus (in den Mitochondrien) einen geschwindigkeitsbestimmenden Schritt, der unter anderem durch Feedback-Hemmung vom Produkt, durch einen hohen NADH/NAD+ Spiegel und durch ADP gehemmt wird. Teilsequenzen des Citratzyklus sind auch extramitochondrial gelegen, so dass sie an anabolen Vorgängen teilhaben können. z.B. Citrat α-Ketoglutarat Fumarat Oxalacetat Die zweite Isoform der Isocitrat-Dehydrogenase hat als Cofaktor NADP+. Sie kommt sowohl im Mitochondrienplasma wie auch im Cytosol vor. Sie katalysiert die α-Ketoglutarat Bildung im Cytosol. Diese ist wichtig für den Aminosäurestoffwechsel. Ein weiteres Produkt der Reaktion ist NADPH2, welches als Reduktionsäquivalent für anabole Stoffwechselwege im Cytosol wie zB. die Fettsäurebiosynthese dient. Reaktion der Isocitrat-Dehydrogenase im Versuch: Isocitrat + NADP+ α-Ketoglutarat + CO2 + NADPH + H+ Bei Zugabe von Leberzellen-Cytosol zum Reaktionsansatz stieg die Extinktion schnell an (Reaktion = Anwesenheit von IDH), bei Zugabe von Mitochondrienplasma stieg die Extinktion auch an, allerdings nicht so schnell wie bei Zugabe des Cytosols. Das lässt darauf schließen, dass im Mitochondrienplasma der Leberzellen weit weniger NADP+ spezifische IDH vorhanden ist, als im Cytosol dieser. Die NADP+ spezifische IDH im Cytosol ist notwendig für die Bildung von Reduktionäquivalenten für anabole Stoffwechselwege wie zB. die Fettsäurebiosynthese, die aucch im Cytosol ablaufen. Daher ist es logisch, dass dort eine hohe Konzentration an diesem Enzym vorhanden ist. Das Vorkommen von NADP+ spezifischer IDH im Mitochondrienplasma könnte man dadurch erklären, dass die hier die Hauptfunktion der IDH die Bereitstellung von α-Ketoglutarat für den Citratcyklus ist. Die NADP+ spezifische IDH katalysiert hier also eine anaplerotische Reaktion. Fazit Kennt man die Enzyme eines bestimmten Zelltyps und eines Organells, kann man durch Nachweise der Leitenzyme erstens nachweisen, ob die gewonnene Fraktion frei von anderen Bestandteilen ist und zweitens, um welchen Zelltyp, welche Organellen, bzw. um welches Plasma es sich handelt. Daher benutzt man nur Enzyme, die in einem Kompartiment vorkommen, in einem anderen nicht (hier die Glutamat- und die Lactat-Dehydrogenase). Allerdings kann man zur Probe aber auch ein Enzym benutzen, das in beiden Kompartimenten allerdings in verschiedenen Konzentrationen vorkommt (hier die Isocitrat Dehydrogenase). Literatur: -Skript zum Biochemischen Grundpraktikum, Institut für Biochemie, J.-G.-Universität-Mainz -Biochemisches Praktikum, Kleber, Schlee, Schöpp, Verlag: Gustav Fischer, 1997 -Biochemie, Stryer, Verlag: Spektrum, 1994 (2. durchgesehene Auflage)