Synthese und Komplexierungsverhalten von rigiden und nicht
Werbung

Synthese und Komplexierungsverhalten von
rigiden und nicht-rigiden funktionalisierten
Phosphanliganden
DISSERTATION
zur Erlangung des Grades eines
Doktors der Naturwissenschaften
der Fakultät für Chemie
der Ruhr-Universität Bochum
Vorgelegt von
Diplom-Chemiker Felix Franke
aus Berlin
Referent: Prof. Dr. M. Drieß
Korreferent: Prof. Dr. W.S. Sheldrick
Tag der mündlichen Prüfung: 6. 12. 2000
Die vorliegende Arbeit entstand in der Zeit von März 1997 bis Dezember 2000 am
Lehrstuhl für Anorganische Chemie I der Ruhr-Universität-Bochum unter Leitung von
Herrn Prof. Dr. Matthias Drieß.
Herrn Prof. Dr. M. Drieß gilt mein aufrichtiger Dank für die Themenstellung, die wissen-schaftliche Anleitung und die stete Bereitschaft zur klärenden Diskussion.
Inhaltsverzeichnis
I
Inhaltsverzeichnis
1. Einleitung
1
2. Aufgabenstellung
5
3. Beschreibung der Ergebnisse
7
3.1 Neuartige Synthese und Komplexierungsverhalten eines aliphatischen Dipyridylphosphans
7
3.1.1
Kenntnisstand
7
3.1.2
Synthese von CyPPy2 23 durch Pd-katalysierte Kreuzkupplung
14
3.1.3
Molekülstruktur von 23
16
3.1.4
Synthese von [M2(µ-CyPPy2)2(CH3CN)2]2+
(M = Cu:26, Ag: 27, Co: 28)
17
3.1.5
Molekülstrukturen von 26, 27 und 28
20
3.1.6
Magnetische Suszeptibilitätsmessung von 28
28
3.1.7
Synthese von [Cu2(η-CyPPy2)2I2] 29
29
3.1.8
Molekülstruktur von 29
31
3.1.9
Synthese von [Co(CyPPy2)Cl2] 30
34
3.1.10 Molekülstruktur von 30
35
3.1.11 Cyclovoltammetrie von 30
37
3.1.12 Synthese von [cis-Mo(CyPPy2)2(CO)4] 31
39
3.1.13 Molekülstruktur von 31
40
3.2 Synthese und Komplexierungsverhalten rigider
Bis(dipyridylphosphan)liganden
3.2.1
Kenntnisstand
3.2.2
Synthese von ortho- und para-(Py2PCH2)C6H4(CH2PPy2)
45
45
24 und 25
50
3.2.3
Molekülstrukturen von 24 und 25
52
3.2.4
Synthese von [Cu(ortho-(PyPCH2)2C6H4)2](OTf) 55
55
3.2.5
Molekülstruktur von 55
56
3.2.6
Reaktionen von 25 mit Metallsalzen
58
3.2.6.1
Reaktion mit CuI
58
3.2.6.2
Reaktion von 25 mit CoCl2
60
Inhaltsverzeichnis
II
3.3 Synthese und Reaktionen eines funktionalisierten flexiblen Triphosphans
61
3.3.1
Kenntnisstand
61
3.3.2
Synthese von [Mo(CO)3(PhP(C2H4PH2)2)] 77
67
3.3.3
Synthese von PhP(C2H4P(SiMe3)2)2 81
68
3.3.4
Synthese von [(CO)3M (PhP(C2H4P(SiMe3)2)2)] (M = Cr: 82,
M = Mo: 83) und [(CO)3M(PhP(C2H4P(SiMe3)(C2H4PHSiMe3)]
3.3.5
(M = Cr: 84, M = Mo: 85)
70
Molekülstrukturen von 85 und 84
76
4. Zusammenfassung
82
5. Experimenteller Teil
87
5.1 Allgemeines
87
5.2 Ausgangsverbindungen
88
5.3 Beschreibung der Versuche
89
6. Literaturverzeichnis
Abkürzungen
acac
Acetylacetonat
ber.
berechnet
Bu
Butyl
BuLi
n-Butyllithium
B. M.
Bohrsche Magnetonen
COD
1,4-Cyclooctadien
Cp
Cyclopentadienyl
Cy
Cyclohexyl
dppe
1,2-Bis(diphenylphosphino)ethan
dppm
Bis(diphenylphosphino)methan
dppp
1,3- Bis(diphenylphosphino)propan
dppy
Diphenyl-(2-Pyridyl)-phosphan
EI
Elektronenstoßionisation
Et
Ethyl
FAB
Fast-Atom-Bombardment
107
Inhaltsverzeichnis
III
gef.
gefunden
h
Stunde
Hz
Hertz
LM
Lösemittel
m/z
Masse/Teilchenladung
Me
Methyl
Mes
Mesityl, 2,4,6-Trimethylbenzyl
MHz
Megahertz
min
Minute
mmol
Millimol
MS
Massenspektrum
MTBE
Methyl-tert.-Butyl-Ether
NEt3
Triethylamin
NMR
Kernresonanz
s = Singulett d = Dublett t = Triplett
q = Quartett quin = Quintett m = Multiplett
pbpp
Phenyl-(bipyridyl)-phosphan
Ph
Phenyl
Py
2-Pyridyl
RT
Raumtemperatur
Sdp.
Siedepunkt
Smp.
Schmelzpunkt
t-dppee
trans-Bis(diphenylphosphino)ethen
THF
TRIPHOS
Tetrahydrofuran
Phenylbis(ethanyldiphenylphosphino)phosphan PhP(C2H4PPh2)2
1. Einleitung
1
1. Einleitung
Die Verwendung von Aryl- oder Alkylphospankomplexen als homogene Katalysatoren ist seit langem in Industrie und Forschung etabliert. Besonders in den letzten
Jahren stellten sich 2-Pyridylphosphane des Typs 1a – c (im folgenden Pyridylphosphane genannt) für eine Reihe von Umsetzungen als effizientere und selektivere Liganden für homogene Katalysatoren heraus.[1]
So fanden Budelzaar et al. kürzlich, daß bei der
Methoxycarbonylierung von Propin zu Methacryl-
N
n
P(R)3-n
säure-Methylester der Austausch der bisher verwendeten Triphenylphosphanliganden am Pd(II)-
n = 1: 1a, 2: 1b, 3: 1c
Katalysator gegen Pyridylphosphane selbst bei
niedrigerer Temperatur eine Steigerung der Pro-
duktivität um das 4000fache und der Produktselektivität zugunsten des erwünschten
Methacrylsäure-Methylesters von 89% auf 98.9% bewirkt.[2]
O
Katalysator
+ CO + CH3OH
O
Die Besonderheit der Pyridylphosphane ist, daß neben dem weichen PDonatorzentrum mit den Pyridyl-N-Atomen ein oder mehrere harte Donatorzentren
am Liganden vorhanden sind. Ein solches hartes Donatoratom kann leichter vom
Metall dissoziieren und so vorübergehend eine freie Koordinationsstelle zur Bindung
an ein Substrat zur Verfügung stellen. Die festere Metall-Phosphor-Bindung verhindert dabei eine vollständige Dissoziation des Liganden vom Metall.
Für ebensolche Verbindungen führte Rauchfuss im Jahre 1979 den Begriff der hemilabilen Liganden ein.[3] Ursprünglich war diese Bezeichnung für Phosphan-Aminound Phosphan-Ether-Liganden verwendet worden. Die Fähigkeit, freie Ligandenstellen am Metall temporär verfügbar zu machen, wie auch die Möglichkeit der verbrükkenden Koordination mehrerer Metallzentren sind sowohl für industrielle Anwendungen wie auch für die Forschung von Interesse.[4]
Pyridylphosphane haben daher in den letzten Jahren eine stets steigende Aufmerksamkeit erfahren. Die Nähe der verschiedenartigen Donatoratome zueinander und
1. Einleitung
2
gleichzeitige Rigidität der Struktur machen diesen Ligandentyp ungemein vielseitig
und lassen eine Vielzahl verschiedener Koordinationsmodi zu. [1, 5]
P
N
N
P
N
P
N
P
N
P
N
P
N
M
M
M
M
M'
M
M
P
N
M
N
N
NN
P
M
M'
N
Abb. 1: Mögliche Koordinationsmodi für Pyridylphosphane
Die Herstellung erfolgt im allgemeinen durch Salzeliminierungsreaktionen aus 2Pyridyllithium und den entsprechenden Alkylhalogenphosphanen. Diese Synthesemethode ist allerdings limitiert auf Reaktanden, die keine weiteren funktionellen
Gruppen tragen, die von lithiierten Organylen ihrerseits angegriffen werden.
Br
BuLi
Li
N
ClnPR3-n
N
PR3-n
N
n = 1, 2, 3
Bisher sind erst vereinzelt einkernige pyridylphosphansubstituierte P, N-Chelatkomplexe isoliert worden. Die bei einer P, N-Chelatisierung entstehenden viergliedrigen
Metallacyclen weisen eine beträchtliche Ringspannung und dadurch bedingt eine
hohe Reaktivität auf. So reagiert der in der Arbeitsgruppe Balch synthetisierte Rh(II)Komplex 2 schon bei milden Bedingungen mit weiterem Pyridylphosphan unter Bildung von 3.[6] 3 seinerseits reagiert mit [Pd(dba)2] (dba = Dibenzylidenaceton) zum
Zweikernkomplex 4.[7]
Ph
Ph
Ph
P
Rh
Cl
CO
Ph2PPy
Cl
N
Cl
Rh
CO
Cl
P
Ph
2
Ph
P
CO
N
Ph
CO
N
Pd(dba)2
CO
CO
Ph
P Cl N
Rh
Pd
N
Cl
P
Ph
Ph
3
Ph
4
1. Einleitung
3
Die Struktur von 4 stellt einen bei zweikernigen Pyridylphosphankomplexen häufig
gefundenen Strukturtyp dar, der in vielen Fällen eine Metall-Metall-Bindung aufweist.
Hierbei ist die Kopf-Schwanz-Orientierung der verbrückenden Pyridylphosphanliganden thermodynamisch bevorzugt. Gerade in den letzten Jahren ist das Interesse
an bimetallischen Komplexen stark gestiegen. Aufgrund von Synergieeffekten zwischen den beiden Metallen weisen solche Verbindungen als Katalysatoren oft eine
höhere Aktivität auf als einkernige Komplexe. Zum Beispiel fanden Zhang et al., daß
der Zweikernkomplex [FeRh(PhPPy)2(CO)4Cl] dem Einkernkomplex [Rh(Ph3P)3Cl]
als Katalysator der Carbonylierung von Ethanol zu Propionsäure-Ethyl-Ester sowohl
in Aktivität wie auch in Selektivität weit überlegen ist.[8]
In Komplexen, in denen nur die P-Atome koordinieren, wird durch das Vorhandensein der polaren Pyridylreste eine erhöhte Wasserlöslichkeit erzielt, was die Abtrennung des Katalysators aus einer Reaktionsmischung oder die Verwendung in Zwei-
2+
Py Py
phasenreaktionen erleichtert. Auch in medi-
P
zinischen Anwendungen ist eine hohe Wasserlöslichkeit oft erwünscht wie im Disilber-
PPy2
PPy2
Ag
Ag
P
Py
Py
Py
Py
P
P
PPy2
PPy2
Py
Py
komplex 5, der in ersten Studien als Antitumorreagenz gegenüber dem analogen Phe-
5
nylposphankomplex eine deutlich bessere Wirksamkeit zeigte. Wie die Arbeitsgruppe
von Berners-Price zudem feststellte, ist ein weiterer Vorteil von 5 seine geringere
hepatotoxische (leberschädigende) Wirkung.[9]
Trotz der Vielfältigkeit der Pyridylphosphane und
ihrer Komplexe sind pyridylsubstituierte Diphos-
Ph
Ph
P
PN
phane bisher kaum bekannt. Eine der wenigen
N
Ausnahmen stellt 5 dar, in dem die N-Atome aller-
Cl
N
Rh
Rh
N P
P
Ph
Cl
Ph
dings keine koordinierende Funktion haben. Sie
könnten harte und weiche Metalle selektiver binden als die einfachen Pyridylphosphane. Wie in
dem von Budelzaar et al. synthetisierten Komplex
6
6 erkennbar ist, erzwingt die Kohlenwasserstoff-
brücke zwischen den P-Atomen jeweils eine Kopf-Kopf-Koordination der einzelnen
Bis-(pyridylphosphan)-einheiten an die Metallzentren.[10]
1. Einleitung
4
Eine weitere Klasse von mehrzähnigen Liganden, die eine vielfältige Koordinationschemie aufweisen, sind Polyphosphanliganden. Sie dienen in einer Vielzahl von
Komplexen als stabilisierende Chelatliganden wie zum Beispiel im Mo-Komplex 7,
der als Intermediat bei der katalytischen Reduktion von Distickstoff zu Hydrazin isoliert werden konnte.[11, 12] Er enthält als Ligand das ungewöhnliche Hydrazin-Dianion
NNH22-.
Triphosphane des Typs PhP(C2H4PPh2)2, TRIPHOS, sind auch in der Lage, als
Brückenliganden zu fungieren und bimetallische Komplexe zu bilden, wie der erst
kürzlich von Baker et al. vorgestellte Fe-W-Komplex 8 zeigt.[13]
PPh2
I
NNH2
PhP
Mo
CO
PPh3
W
Cl
PPh
PH2P
Fe(CO)4
I
PPh2
PPh2
7
8
Während lineare Triphosphane mit Alkyl- und Arylgruppen an den P-Zentren umfangreich untersucht wurden, ist die Chemie solcher Verbindungen, die funktionelle
2+
P(NMe2)2
Gruppen an den terminalen P-Atomen tragen und
somit weitere Derivatisierung zulassen, bisher auf
Alkoxy- und Aminsubstituenten beschränkt.[14] Dem-
PhP
Pd
NCCH3
entsprechend sind Koordinationsverbindungen derivatisierter linearer Triphosphane noch nahezu unbe-
P(NMe2)2
9
kannt. Der 1995 von DuBois et al. vorgestellte Pd(II)Komplex 9 stellt eines der wenigen Beispiele dar.[15]
Eine Derivatisierung der Ligandensphäre könnte zu neuen Synthesekonzepten führen wie im Fall der Cyclisierung der Liganden durch Templatsynthesen oder die Entwicklung maßgeschneiderter Katalysatoren.
2. Aufgabenstellung
5
2. Aufgabenstellung
Ziel dieser Arbeit war es, neue Synthesekonzepte zu mehrzähnigen Komplexliganden zu erschließen, die als Chelat- oder Brückenliganden koordinieren können.
Weiterhin sollten die Koordinationseigenschaften dieser Liganden untersucht werden. Folgende Aspekte standen hierbei im Vordergrund:
! Entwicklung eines neuen Synthesekonzepts für Pyridylphosphanliganden, bei
dem keine Metallorganyle als Zwischenstufen auftreten, und das auch die problemlose Synthese aliphatisch substituierter Pyridylphosphane zuläßt.
! Untersuchung
der
Koordinationseigenschaften
aliphatisch
substituierter
Di(pyridyl)phosphane an verschiedenen Metallzentren und der Einfluß der Anionen auf das Koordinationsverhalten.
! Synthese und Koordinationsverhalten von Bis(dipyridylphosphan)liganden, bei
denen die Pyridylphosphaneinheiten durch rigide Kohlenwasserstoffbrücken verbunden sind.
! Synthese von funktionalisierten linearen Triphosphanen und deren Koordinationsverhalten insbesondere im Hinblick auf eine weitere Derivatisierung an den PZentren.
Pyridylphosphane wurden bisher durch Salzeliminierungsreaktionen aus Pyridyllithium und entsprechenden Phosphorhaligeniden bei sehr niedrigen Temperaturen
hergestellt. Diese Synthesemethode war beschränkt auf Reaktanden, die keine funktionellen Gruppen wie OH-, COOH-, NH2- oder andere Gruppen tragen, die üblicherweise von metallorganischen Reagentien leicht angegriffen werden. Es sollte nun
eine neue Synthesestrategie gefunden werden, die einerseits auf aliphatisch substituierte Phosphane angewandt werden kann und die andererseits die erwähnten
Nachteile der Salzmetathese vermeidet.
2. Aufgabenstellung
6
?
RPH2 + 2
X
N
RP
N
N
X = Halogen
R = Alkyl
Das Koordinationsverhalten dieser aliphatisch substituierten Pyridylphosphane sollte
an verschiedenen Metallsalzen untersucht werden.
Weiterhin sollte eine einfache Synthesemethode zu bisher kaum bekannten Bis(dipyridylphosphan)liganden gefunden und deren Koordinationsverhalten insbesondere bezüglich der Komplexierung mehrerer Metallzentren untersucht werden.
N
N
P
P
N
MAn
?
N
MAn = Metallsalz
Ferner sollten Derivate linearer Triphosphanliganden synthetisiert werden, die als
mehrzähnige Liganden koordinieren können. An Komplexen dieser Verbindungen
sollte die Möglichkeit einer weiteren Derivatisierung und ihre Eignung zum Aufbau
cyclischer Systeme erprobt werden.
PR12
PR
MLn
R2 X ?
?
RP
R12P
PR22
MLm
RP
MLm
R12P
R = z. B. SiMe3 ≠ Alkyl, Aryl
1
PR12
PR22
PR1
M = Metall
L = Ligand
X
X
?
RP
MLm
PR1
3. Beschreibung der Ergebnisse
7
3. Beschreibung der Ergebnisse
Zunächst wird über eine alternative Synthesemethode und die Komplexierungseigenschaften von aliphatischen Pyridylphosphanen berichtet. Es folgt die Beschreibung der Synthese zweier neuartiger pyridylsubstituierter Diphosphane, wobei auch
hier die Ergebnisse erster Komplexierungsreaktionen folgen. Abschließend wird die
Herstellung und die Chemie eines silylsubstituierten linearen Triphosphans beleuchtet. Zu jedem einzelnen thematischen Abschnitt soll ein kurzer Überblick zum jeweiligen Kenntnisstand erfolgen.
3.1 Neuartige Synthese und Komplexierungsverhalten eines aliphatischen Dipyridylphosphans
3.1.1 Kenntnisstand
Der Begriff Pyridylphosphan wird, sofern nicht ausdrücklich erwähnt, in dieser Arbeit
für 2-Pyridylphosphane vom Typ 1a - c verwendet, bei denen das P-Atom direkt in 2Stellung an einen oder mehrere Pyridylringe gebunden ist.
Das erste Pyridylphosphan 11 wurde bereits 1944 von Davies und Mann im Zuge
ihrer Untersuchungen bezüglich der optischen Aktivität von tertiären Phosphanen
synthetisiert.[16] 1948 stellten dieselben Wissenschaftler 10a - c vor, die aus den entsprechenden Phenylchlorphosphanen und Pyridylmagnesiumbromid hergestellt wurden.[17] 1970 bis 1973 wurde die Synthese der Pyridylphosphane maßgeblich von
Holm et al. systematisch untersucht und die Verwendung von Pyridyllithium bei sehr
niedriger Temperatur (- 65 bis - 100°C) anstatt der weniger reaktiven Grignardverbindungen etabliert. [18, 19, 20, 21]
N
P
N
n
P
Br
3-n
n = 1: 10a
n = 2: 10b
n = 3: 10c
11
3. Beschreibung der Ergebnisse
8
Diese Synthesemethode, die Ausbeuten zwischen 20% und 85% ergibt, wurde bis
heute kaum modifiziert. Bowen et al. fanden 1998, daß durch die Zugabe von
TMEDA (Tetramethylethylendiamin) zur Reaktionsmischung neben 2-Pyridylphosphanen auch die sonst nur schwer zugänglichen 3- und 4-Pyridylphosphane in Ausbeuten von knapp 50% bis über 90% zugänglich sind.[22] Problematisch ist jedoch die
Synthese von substituierten Pyridylphosphanen.
Zwar lassen sich durch geeignete Wahl der Reaktionsbedingungen Dihalogenpyridine selektiv einfach oder zweifach lithiieren und phosphanylieren,[23] doch viele funktionelle Gruppen werden auch bei sehr niedrigen Temperaturen bereits von Butyllithium oder lithiierten Phosphanen angegriffen und sind somit nicht als Reaktanden
in dieser Reaktion verwendbar.
n-Buli
Li
N
Li
THF, -90°C
Br
N
Br
n-Buli
Et2O, -90°C
PCl3
Br
N
Br
Li
P
N
3
Eine weitere Methode der C-E-Bindungsknüpfung (E = Pnictogen) ist die Übergangsmetall-katalysierte Kreuzkupplung, die in den letzten Jahren immer mehr an Bedeutung erlangt hat.[24] In der Stille-Kupplung z. B. reagiert ein Aryliodid oder
-bromid mit einem silyl- oder stannylsubstituierten Arylphosphan unter Bildung einer
C-P-Bindung.[25] In dieser Reaktion werden funktionelle Gruppen wie COOR, CF3,
RC(O)R oder COONR2 nicht angegriffen noch stören sie die Reaktion.
Ar-X + R3EPAr'2
Pd(PPh3)4, Base
- R3EX
E = Si, Sn
Ar-PAr'2
X = Halogen
Stelzer et al. erweiterten die Anwendungsbreite dieser Reaktion und führten analoge
Umsetzungen auch mit primären und sekundären Phosphanen in Gegenwart weiterer funktioneller Gruppen wie OH, NH2, COOH, SO3Na am Arylhalogenid in guten
Ausbeuten von bis zu 98% durch.[26, 27] Der Mechanismus dieses Reaktionstyps beinhaltet eine oxidative Addition (A) an den aktiven Pd0-Katalysator und eine reduktive
Eliminierung (E) von dem dabei entstehenden PdII-Komplex. Abbildung 2 zeigt den
schematischen Ablauf des Katalysecyclus.
3. Beschreibung der Ergebnisse
9
LnPd0(solv)
Ar-PRR'
Ar-I
E
A
+ L; + solv
- L; - solv
II
(Ln-1)PdII
L(n-1)Pd -PRR'
I
R, R‘ = H, Ar
Ar
Ar
Ar-I = X-C6H4-I oder XY-C6H3-I
X, Y = OH, NH2, COOH, Alk, etc.
L = Phosphanligand
R
HB+I-
H + Base B
P
solv = Lösemittel (Base)
R'
0
[26]
Abb. 2: Mechanismus der Pd -katalysierten Kreuzkupplung am Phosphan (nach Stelzer et al.
)
Bereits 1981 war das Diethylpyridylphosphonat 12 neben anderen Aryldialkylphosphonaten von Hirao et al. über eine Pd0-katalysierte Reaktion aus Diethylphosphit
und 2-Brompyridin hergestellt worden,[28] doch ist die Anwendbarkeit dieser Reaktion
begrenzt, da bei der zum Erhalt von Phosphanen notwendige Reduktion reduzierbare funktionelle Gruppen am Pyridylring angegriffen würden.
Pd0(PPh3)4
NEt3
O
OEt
+
H
P
OEt
Br
N
O
OEt
Reduktion
P
- HBr·NEt3
PH2
OEt
N
N
12
Das bis heute andauernde und in den letzten Jahren stark gestiegene Interesse an
Pyridylphosphanen[1] ist durch ihre besonderen Eigenschaften als Liganden begründet. Durch die Kombination von harten (N) und weichen (P) Donatorzentren in einem
Molekül wird eine große Bandbreite von Koordinationsmodi ermöglicht.
P
N
N
P
P
N
N
P
N
P
N
P
N
M
M
M
A
M
B
M'
C
M
D
M
P
N
M
N
N
N
E
F
G
Abb. 3: Mögliche Koordinationsmodi für Pyridylphosphane
NN
P
M
M'
H
3. Beschreibung der Ergebnisse
10
Je nach Anzahl der Pyridylreste am P-Atom ist eine einzähnige (P- oder Ngebundene (A, B)), zweizähnige (N, N‘- / N, P-chelatisierende (D, E) / verbrückende
(C)) oder dreizähnige (N, N‘, N‘‘- / N, N‘, P-chelatisierende (E, F) / verbrückende(H))
Koordination möglich (Abbildung 3). Der postulierte Koordinationsmodus (H) konnte
bisher nicht nachgewiesen werden.
2+
1966 beschrieben Uhlig und Maaser den ersten
Ph
Komplex mit Pyridylphosphanen 13.[29] Dieser Kom-
N
Ph
P
plex unterscheidet sich insofern von den hier be-
Ni
schriebenen Pyridylphosphankomplexen, daß die
P
N
Pyridylgruppen von den P-Atom durch eine EthylenPh
Ph
gruppe getrennt sind.
Erst
die
Einführung
routinemäßiger
Einkristall-
13
röntgenstrukturanalysen in den 70er Jahren insbesondere in Kombination mit der Etablierung der
31
P-NMR-Spektroskopie in den 80er
Jahren erlaubte die Untersuchung einer Fülle von weiteren Pyridylphosphankomplexen.[5] So wurden die bereits 1975 von Bogess et al. beschriebenen Komplexe 14, [30] in denen Tripyridylphosphan als dreizähniger N,N‘,N‘‘-Chelatligand fungiert, erst 1992 (M = Zn2+),[31] 1995 (M = Cu2+)[32] bzw. 1997 (M = Co2+)[33] strukturell
charakterisiert.
Komplexe vom Typ 15 stellen einen häufig beobachteten Strukturtyp von Komplexen
mit verbrückenden Pyridylphosphanen dar. Die Ligandenbrücken zwingen die Metallionen in derartige räumliche Nähe, daß sich in fast allen Fällen eine M-M-Bindung
ausbildet. Die Orientierung der Pyridylphosphanliganden kann dabei in Kopf-KopfRichtung (15a) oder in Kopf-Schwanz-Richtung (15b) zueinander vorkommen.
Ph
Ph
Ph
Ph
P
N
LxM
M'Ly
P
P
L xM
N
Ph
M'Ly
P
N
Ph
Ph
14 (M = Cu2+, Zn2+, Co2+)
N
15a
Ph
15b
3. Beschreibung der Ergebnisse
11
Balch et al. stellten 1980 den Komplex 4 her.[34] Bei dieser Reaktion ändert sich die
Orientierung eines der Pyridylphosphanliganden, so daß ausschließlich das Produkt
mit der thermodynamisch stabileren Kopf-Schwanz-Konfiguration entsteht.
Ph
Ph
Ph
Ph
P
Cl
N
P
Cl
Rh
+
CO
Pd·COD
Cl
P
N
Cl
Cl
Rh
CO
N
N
Pd Cl
P
Ph
Ph
Ph
COD = 1,4-Cyclooctadien
Ph
4
Wird in dieser Reaktion statt [PdCl2·COD] (COD = 1.4-Cyclooctadien) als Reaktand
[PdCl2(PhCN)2] mit leichter dissoziierenden, einzähnigen Liganden eingesetzt, so
entstehen die Kopf-Kopf- und Kopf-Schwanz-konfigurierten Produkte etwa zu gleichen Teilen.[35] Dies läßt den Schluß zu, daß zunächst der kinetisch favorisierte KopfKopf-Komplex entsteht und die Umlagerung des Brückenliganden erst am Zweikernkomplex stattfindet. Balch postulierte als instabiles Zwischenprodukt einen Zweikernkomplex ohne Rh-Pd-Bindung, den er allerdings nicht nachweisen konnte.[34]
Neben den Ergebnissen der Arbeitsgruppe von Balch, die verschiedene homo- (RhRh, Pd-Pd, Pt-Pt) und heterobimetallische (Pd-Pt, Pd-Rh, Pd-Ru, Rh-Pt) Komplexe
dieses Strukturtyps untersuchten,[36, 37, 7, 38] finden sich weitere Arbeiten von Faraone
et al. (Ir-Pd, Ir-Hg, Ir-Cu, Ir-Tl)[39], Mak et al. (Fe-Cu(I), Fe-Ag(I), Fe-Hg(II))[40],
Schmidbaur et al. (Au-Au)[41], Zhang et al. (Fe-Mo, Fe-Ni, Fe-Rh, Fe-Cu, Fe-Hg)[8],
Cotton et al. (Mo-Mo, Re-Re-Vierfachbindung)[42] und anderen.
Der erste strukturell charakterisierte Komplex mit überbrückendem Diphenylpyridylphosphan ohne Metall-Metall-Bindung war der 1982 von Alcock et al. beschriebene
1
Komplex [Ag2(µ-Cl)2(µ-Ph2PPy)(η -PhPPy)2] 16, bei dem neben einer Pyridyl-
phosphanbrücke noch zwei verbrückende Cl-Atome den Metall-Metall-Abstand
bestimmen.[43]
Obwohl Komplexe mit verbrückenden Pyridylphosphanen ohne M-M-Bindung eher
eine Ausnahme bilden,[44] ist bislang noch kein Ag-oder Cu-Pyridylphosphankomplex
mit eindeutiger M-M-Bindung beschrieben worden. Cu(I)- Komplexe, bei denen die
Metalle ausschließlich über Pyridylphosphane verbrückt sind, wurden 1989 von Gi-
3. Beschreibung der Ergebnisse
12
meno et al. erstmals beschrieben.[45] Weder in [Cu2(µ-dppy)3(CH3CN)]2+ 17 noch in
[Cu2(µ-dppy)2(CH3CN)2]2+ 18, das erst 1993 von Munakata et al. röntgenstrukturanalytisch untersucht wurde, finden sich Cu-Cu-Abstände, die auf eine M-M-Bindung
schließen lassen. [46]
2+
Ph
N
P
Ag
Cl
Cl
PyPPh2
Ph
Ph
Ph
N
2+
P
Cu
Ag
N
Ph
Cu
Ph2P
Ph
PPh2
NCCH3
CH3CN
N
P
N
Cu
Cu NCCH3
N
P
Ph
PyPPh2
Ph
16
17
18
Che et al. beschrieben 1998 den Cu(I)-Tris(diphenylphosphinonaphthyridin)komplex
19, der zwischen den N, N‘-verbrückten Cu-Zentren einen Abstand von 2.449 Å aufweist. Dieser Abstand entspricht etwa der Summe der Kovalenzradien von 2.48 Å
und weist somit auf eine Cu-Cu-Bindung hin.
Die zwei dreifach Kopf-Kopf-(P, N)-verbrückten Cu-Ionen mit einem Cu-Cu-Abstand
von 2.721 Å zeigen dagegen keine bindende intermetallische Wechselwirkung.[47]
P
N
N
P
CH3CN
Cu
P
Ph
N
Cu
C
Ph
N
P
Cu
N
O
O N
N
O
N
O
Ag
Ag
N O
O
N
P
Ph
Ph
P N N = Ph2P
N
N
19
20
Auch in der von Zhang et al. 1992 hergestellten und röntgenstrukturanalytisch charakterisierten Ag-Verbindung 20 liegt trotz der Verbrückung mit Pyridylphosphanen
keine Ag-Ag-Bindung vor (Ag-Ag-Abstand: 3.146 Å).[48]
3. Beschreibung der Ergebnisse
13
Im Gegensatz zu der großen Zahl von Komplexen mit verbrückenden zweizähnigen
Pyridylphosphanliganden sind Verbindungen mit P, N, N‘ dreifach koordinierenden
Di- oder Tripyridylphosphanen kaum beschrieben. Strukturell charakterisiert ist einzig
der P, N, N‘-Chelatkomplex 21, der 1997 in der Arbeitsgruppe von James synthetisiert wurde. Er weist wie erwartet wegen der zwei stark gespannten viergliedrigen PC-N-M-Heterocyclen eine deutliche Verzerrung der oktaedrischen Koordinationsgeometrie am Ru sowie eine durch die hohe Ringspannung hervorgerufene geringe
Stabilität auf.[49]
Ph
Ph
N
P
N
P
N
N
Ru
Ph3P
N
N
Mo
PPh3
Cl
21
CO
CO
CO
22a
PhP
N
CO
Mo
N
CO
CO
n
22b
Espinet et al. untersuchten 1993 die Koordination von Phenyldipyridylphosphan am
Molybdän(0)-Zentrum. Da keine Röntgenstrukturanalysen der Verbindungen angefertigt werden konnten, war es nicht möglich, anhand der vorliegenden analytischen
Ergebnisse zwischen den zwei vorgeschlagenen Koordinationsmodi 22a und 22b
eindeutig zu unterscheiden. [50]
3. Beschreibung der Ergebnisse
14
3.1.2 Synthese von CyPPy2 23 durch Pd-katalysierte Kreuzkupplung
Analog zu Stelzer et al., die Pd-katalysierte Kreuzkupplungen an aromatisch substituierten Phosphanen durchgeführt hatten[27], sollte ein aliphatisch substituiertes Dipyridylphosphan hergestellt werden, um die grundsätzliche Eignung dieses Synthesekonzepts auch für aliphatisch substituierte primäre Phosphane zu erproben.
So reagiert Cyclohexylphosphan mit zwei Äquivalent 2-Brompyridin in CH3CN zu
dem gewünschten CyPPy2 23 in 98% Ausbeute. Als Katalysator wurde Pd(PPh3)4
eingesetzt, als Base zum Abfangen des entstandenen HBr diente NEt3.
+ 2 NEt3
kat. Pd(PPh3)4
PH2 + 2
Br
N
P
- 2 NEt3·HBr
N
N
(CH3CN, 14 h)
23
Die Reaktion läßt sich
31
P-NMR-spektroskopisch anhand der Abnahme des Signals
von CyPH2 (δ = - 109.4; 1JPH = 194.3 Hz) und des entstehenden Singuletts für das
Produkt (δ = - 3.2) gut verfolgen. Während der Reaktion kann auch das Dublett der
Zwischenstufe CyPHPy (δ = - 26.8; 1JPH = 212.6 Hz) beobachtet werden.
Tab.1: NMR-Daten von 23 (CDCl3, RT)
31
P-NMR (101.3 MHz)
1
H-NMR (250 MHz)
- 3.2 (s)
CH(CH2)5
1.2 - 2.2 (m, 10H)
CH(CH2)5
3.2 (m, 1H)
H4 (Py)
6.6 (m, 2H)
H5 (Py)
7.0 (tm, 2H, 3JHH = 7.5 Hz)
H3 (Py)
7.4 (dm, 2H, 3JHH = 6.6 Hz)
H6 (Py)
8.5 (d, 2H, 3JHH = 4.7 Hz)
H4
Numerierungsschema für 23:
H3
H5
P
H6
N
2
3. Beschreibung der Ergebnisse
15
Nach Entfernung des NEt3·HBr durch Filtration wird das Produkt destilliert. Es kristallisiert in Hexan in Form farbloser Kristalle, die an der Luft einige Tage stabil sind.
Die chemische Verschiebung des Produktsignals in
31
P-NMR-Spektrum liegt im Be-
reich der vergleichbaren Verbindungen PPy3 (δ = - 1.3), PhPPy2 (δ = - 2.9) und
Ph2PPy (δ = - 4.1).[51] Im 1H-NMR-Spektrum können alle Signale eindeutig zugewiesen werden. Details sind in Tabelle 1 zusammengefaßt.
Im EI-Massenspektrum findet sich der Molekülpeak bei m/z = 270 mit einer relativen
Intensität von 35%. Wie in Abbildung 4 zu erkennen ist, bilden sich weitere Fragmente durch schrittweise Abspaltung der Substituenten am P-Zentrum. Die Zusammensetzung konnte weiterhin durch eine hochaufgelöste Massenbestimmung bestätigt werden (ber. 270.1283; gef. 270.1281).
- Py
193 (80%)
M+ (35%)
- C6H11
- C6H11
- Py
187 (100%)
109 (75%)
83 (18%) C6H11
78 (78%) Py
-HCN (aus Py)
160 (59%)
Abb. 4: Schematische Darstellung des Massenspektrums von 29
27 (98%) HCN (aus Py)
3. Beschreibung der Ergebnisse
16
3.1.3 Molekülstruktur von 23
Geeignete Kristalle der Verbindung 23 konnten in Hexan erhalten werden. Die durch
eine Einkristallröntgenstrukturanalyse ermittelten Abmessungen der Elementarzelle
sind mit weiteren Angaben zur Strukturbestimmung in Tabelle 2 zusammengefaßt.
Die Verfeinerung der Struktur erfolgte für die Nicht-Wasserstoffatome anisotrop, während die H-Atome in berechneten Lagen isotrop verfeinert wurden. Die Kristallstruktur
ist in Abbildung 5 dargestellt. Ausgewählte Bindungsabstände und -winkel gibt Tabelle 3 wieder.
Tab. 2: Kristallographische Daten und Angaben zur Strukturbestimmung von 23. Z = Anzahl der Moleküle pro Elementarzelle
Zellvolumen [Å3]
732.8(3)
Kristallsystem monoklin
Z
2
a [Å]
8.777(2)
Unabhängige Reflexe
2090
b [Å]
10.057(2)
Beobachtete Reflexe
1971
c [Å]
9.194(2)
mit I > 2σ(I)
α [°]
90.00
Parameter
172
R1
0.0610
wR2
0.1680
Meßtemperatur [°C]
-70
Raumgruppe
β [°]
γ [°]
Pn
115.45(3)
90.00
In 23 ist das P-Zentrum pyramidal koordiniert, wobei die Winkelsumme mit 300.6°
etwas kleiner ist als in PPy3 (305.6°)[52] und Ph2PPy (306.2°)[53]. Die Winkelsummen
der benzylsubstituierten Dipyridylphosphane p- und o-(Py2PCH2)2C6H4 24 und 25 (s.
Kap. 3.3), die 301.1° bzw. 301.7° betragen, sind aber nahezu identisch mit der von
23. Der C1-P1-C6-Winkel in 23 ist mit 97.6° um ca. 3° kleiner als die C11-P1-C6(101.6°) und C11-P1-C1-Winkel (101.4°), was darauf zurückgeführt werden kann,
daß der Cyclohexylsubstituent mehr Platz beansprucht als die Pyridylreste.
Die Stickstoffzentren der Pyridylringe in 23 weisen in die dem freien Elektronenpaar
des P-Atoms entgegengesetzte Richtung. Eine Wechselwirkung zwischen dem entsprechenden Proton H11 und den freien Elektronenpaaren der N-Zentren der Pyridylreste in Lösung konnte NMR-spektroskopisch nicht festgestellt werden.
3. Beschreibung der Ergebnisse
17
Abb. 5: Molekülstruktur von 23 im Kristall
Tab. 3: Ausgewählte Abstände (Å) und Winkel (°) in 23
Abstände
Winkel
P1-C11
1.847(4)
C11-P1-C6
101.6(1)
P1-C6
1.851(4)
C6-P1-C1
97.6(1)
P1-C1
1.854(5)
C11-P1-C1
101.4(1)
ΣP1
300.6
3.1.4. Synthese von [M2(µ
µ-CyPPy2)2(CH3CN)2]2+ (M = Cu: 26, Ag: 27, Co: 28)
Um die Koordinationseigenschaften von 23 zu untersuchen, wurden Metallsalze mit
schwach koordinierenden Anionen wie Trifluormethylsulfonat bzw. Tetrafluoroborat
mit dem Liganden bei RT in CH3CN umgesetzt. Co(BF4)2 wurde in Lösung aus CoCl2
und zwei Äquivalent AgBF4 hergestellt. Das ausgefallene AgCl wurde vor der Zugabe
des Liganden abfiltriert.
Es entstanden in allen drei Fällen klare farblose (27, 26) bzw. rosafarbene (28) Lösungen, aus denen nach dem Einengen farblose Kristalle isoliert werden konnten.
Während die Kupfer- und Silberverbindung bereits bei RT kristallisierte, konnten von
28 erst bei mehrtägiger Kühlung auf - 25°C Kristalle erhalten werden.
3. Beschreibung der Ergebnisse
18
Die Ausbeuten betrugen für 26 82%, für 27 79% und für 28 47%.
n+
2 MA + 2
P
N
RT, 12h
N
CH3CN
N
N
P
CH3CN M
M NCCH3
P
N
+nA
N
26: M = Cu+, A = OTf –
27: M = Ag+, A = BF428: M = Co2+, A = 2 BF4Die Komplexe sind als Feststoff mäßig, in Lösung dagegen sehr hydrolyse- und oxidationsempfindlich. Alle Verbindungen sind ausschließlich in CH3CN unzersetzt löslich. Die Charakterisierung der Verbindungen erfolgte durch Elementaranalyse, Einkristallröntgenstrukturanalyse und für 26 und 27 über Multikern-NMR-Spektroskopie.
Aussagekräftige Massenspektren der Komplexe konnte mit keiner der erprobten Ionisierungsarten (EI, FAB und CI) erhalten werden. Von 28 konnten wegen der paramagnetischen Co(II)-Kerne (d7-Elektronenkonfiguration) kein NMR-Spektrum erhalten werden.
Mehrere Versuche, cyclovoltammetrische Untersuchungen der Komplexe 26, 27 und
28 durchzuführen, erbrachten wegen zu niedriger Löslichkeit der Verbindungen in
Gegenwart verschiedener Leitsalze keine aussagekräftigen Ergebnisse.
Die
P-NMR-Spektren von 26 und 27 zeigen stark verbreiterte Singuletts bei δ = 0.2
31
für 26 und bei δ = 23.6 für 27, was die P-Koordination durch die Tieffeldverschiebung
der Signale gegenüber dem freien Liganden bestätigt. Die starke Linienverbreiterung
ist auf die hohen Quadrupol-Momente der
63/65
Cu- und der
107/109
Ag-Kerne zurückzu-
führen. Abkühlung der Substanzproben auf - 50°C erbrachte keine Änderung der Linienbreite, so daß dynamische Effekte ausgeschlossen werden können. Die chemischen Verschiebungen der Signale liegen im erwarteten Bereich für vergleichbare
Cu(I)- bzw. Ag(I)-Komplexe wie im Fall von [Cu2(µ-Ph2Ppy)3CH3CN]2+ (δ=5.45)[45] und
[Ag2(µ-Ph2Ppy)2]2+ (δ = 25.7).[54] Auch die nahezu identischen 1H-NMR-Spektren zeigen deutlich verbreiterte Signale. Die Halbwertsbreite aller 1H-NMR-Signale ist etwa
w1/2 ≈ 20 Hz. Tabelle 4 faßt die NMR-Daten von 26 und 27 zusammen.
3. Beschreibung der Ergebnisse
19
Tab. 4: NMR-Werte von 26 und 27 (250 MHz, CD3CN)
26
31
P-NMR (101.3 MHz)
27
0.2 (s)
23.6 (s)
w1/2 = 23.8 Hz w1/2 = 23.6 Hz
1
H-NMR (250 MHz)
CH(CH2)5
1.2-2.2 (m)
1.2-2.2 (m)
CH(CH2)5
3.1 (m, 1H)
3.2 (m, 1H)
CH3CN (nicht-koord.) 1.96 (s)
1.96 (s)
CH3CN (koord.)
2.19 (s, 3H)
2.19 (s, 3H)
H (Py)
7.9 (m, 4H)
7.9 (m, 4H)
H (Py)
7.5 (m, 2H)
7.5 (m, 2H)
H6 (Py)
8.7 (m, 2H)
8.7 (m, 2H)
H4
Numerierungsschema für 26 und 27:
H3
H5
P
H6
N
2
Während sich die Signale der Protonen H6 gegenüber dem Spektrum des freien Liganden nur um 0.2 ppm nach tiefem Feld verschieben, fallen die Signalgruppen
zweier anderer Pyridyl-Protonen zu einem Signal zusammen. Eine eindeutige Zuordnung der Signale für H3, H4 und H5 ist wegen der nicht erkennbaren Feinaufspaltung
nicht möglich.
Eine deutliche Tieffelderschiebung der Protonen H6 am Pyridyl, wie sie für einige Pyridylphosphankomplexe wie [RuCl2(L)(PPy3-N, N‘, N‘‘)] (L = PPh3, CO, CH3CN,
PhCN) gefunden wurde (δ (H6) = 9.47 - 10.22, CDCl3), gilt im allgemeinen als deutlicher Hinweis auf die Koordination des N-Zentrums im Pyridin.[55] Andere Beispiele
wie die 1992 von Beer et al. beschriebenen Ag- und Cu-Bipyridylkomplexe zeigen
chemische Verschiebungen von δ = 8.68 – 8.84,[56] so daß die H6-Signale für 26 und
27 durchaus im Bereich der für koordinierte Pyridine gefundenen chemischen Verschiebungen liegen.
3. Beschreibung der Ergebnisse
20
3.1.5 Molekülstrukturen von 26, 27 und 28
Geeignete Einkristalle der Verbindungen 26, 27 und 28 konnten in CH3CN erhalten
werden. Die durch Einkristallröntgenstrukturanalysen ermittelten Abmessungen der
jeweiligen Elementarzellen sind mit weiteren Angaben zur Strukturbestimmung in Tabelle 5 zusammengefaßt.
Tab. 5: Kristallographische Daten und Angaben zur Strukturbestimmungen von 26, 27 und 28.
Z = Anzahl der Moleküle pro Elementarzelle
26
27
28
Raumgruppe
P1
P21/c
P21/c
Kristallsystem
triklin
monoklin
monoklin
a [Å]
9.667(2)
11.170(4)
14.65(4)
b [Å]
15.321(4)
10.083(3)
19.39(5)
c [Å]
5.610(6)
38.188(12)
9.71(2)
α [°]
81.904(5)
90.00
90.00
β [°]
84.210(4)
90.478(1)
105.69(5)
γ [°]
72.204(5)
90.00
90.00
Zellvolumen [Å3]
3569.0(2)
4301(2)
2657(11)
Z
2
4
4
Unabhängige Reflexe
12478
7552
4498
Beobachtete Reflexe
8002
6571
3368
Parameter
897
507
308
R1
0.0502
0.0552
0.1319
wR2
0.1207
0.1110
0.3397
Meßtemperatur [°C]
- 70
- 50
- 70
mit I > 2σ(I)
Die Verfeinerung der Strukturen von 26, 27 und 28 erfolgte für die Nicht-Wasserstoffatome anisotrop, während die H-Atome in berechneten Lagen isotrop berücksichtigt
wurden. Die Molekülstrukturen der Verbindungen sind in den Abbildungen 6, 7 und 8
und ausgewählte Bindungslängen in den Tabellen 6, 7 und 9 widergegeben.
H-Atome wurden zur besseren Übersichtlichkeit nicht dargestellt.
3. Beschreibung der Ergebnisse
21
2+
Abb. 6: Molekülstruktur von [Cu2(µ-CyPPy2)2(CH3CN)2]
26 im Kristall
Tab. 6: Ausgewählte Abstände (Å) und Winkel (°) in 26
Abstände
Winkel
Cu2···Cu1
3.225(7)
N3-Cu2-N4
90.74(13)
Cu2-N3
2.083(3)
N3-Cu2-N5
96.19(15)
Cu2-N4
2.094(3)
N4-Cu2-N5
99.05(15)
Cu2-N5
2.093(4)
N3-Cu2-P1
125.22(10)
Cu2-P1
2.202(1)
N4-Cu2-P1
127.90(10)
Cu1-N2
2.060(3)
N5-Cu2-P1
111.05(11)
Cu1-N1
2.072(3)
N2-Cu1-N1
94.25(13)
Cu1-N6
2.094(4)
N2-Cu1-N6
97.11(15)
Cu1-P2
2.186(1)
N1-Cu1-N6
96.33(15)
N2-Cu1-P2
123.69(10)
N1-Cu1-P2
126.16(10)
N6-Cu1-P2
112.80(11)
3. Beschreibung der Ergebnisse
22
2+
Abb. 7: Molekülstruktur von [Ag2(µ-CyPPy2)2(CH3CN)2]
27 im Kristall
Tab. 7: Ausgewählte Abstände (Å) und Winkel (°) in 27
Abstände
Winkel
Ag1···Ag2
2.932(8)
N3-Ag2-N4
87.36(15)
Ag2-N3
2.361(4)
N3-Ag2-N5
88.36(19)
Ag2-N4
2.387(5)
N4-Ag2-N5
91.3(2)
Ag2-N5
2.373(6)
N3-Ag2-P1
135.15(11)
Ag2-P1
2.382(2)
N4-Ag2-P1
126.55(11)
Ag1-N2
2.398(5)
N5-Ag2-P1
115.51(16)
Ag1-N1
2.395(5)
N2-Ag1-N1
86.69(15)
Ag1-N6
2.466(7)
N2-Ag1-N6
115.95(19)
Ag1-P2
2.390(1)
N1-Ag1-N6
88.2(2)
N2-Ag1-P2
134.57(11)
N1-Ag1-P2
129.50(11)
N6-Ag1-P2
115.95(19)
3. Beschreibung der Ergebnisse
23
Die Molekülstrukturen von 26, 27 und 28 im Kristall weisen ein identisches Grundgerüst auf. In allen drei Komplexkationen werden zwei Metallzentren von zwei Liganden
23 in Kopf-Schwanz-Orientierung koordiniert, wobei das P- wie auch die N-Zentren
beider Pyridylsubstituenten als Donatoren wirken. Sie stellen somit die ersten Beispiele für den eingangs erwähnten Koordinationsmodus H (Abbildung 3) dar.
Zusätzlich trägt jedes Metallzentrum ein CH3CN-Molekül als Liganden, so daß die
Metallatome verzerrt tetraedrisch koordiniert sind. In 26 sind die Kupfer-(I)-Ionen von
einem P- und drei N-Atomen umgeben, wobei die Cu-Ionen nur 0.48 Å außerhalb der
Ebene liegen, die vom P-Atom und den Py-N-Atomen aufgespannt wird. Hierbei sind
die N-Cu-N-Winkel zwischen den Pyridylringen mit 90.7° bis 99.1° deutlich kleiner als
die N(Py)-Cu-P-Winkel, die zwischen 111.1° und 127.9° variieren. Diese Tendenz
entspricht den Erwartungen, da die P-Atome wegen der drei großen Substituenten
mehr Raum beanspruchen als die Pyridylringe. Ähnliche Beobachtungen wurden
auch in [Cu2(µ-dppy)3(CH3CN)]2+ 17 (dppy = Diphenyl(2-pyridyl)phosphan) gemacht,
in dem sich ein Cu-Zentrum in einer verzerrt tetraedrischen Umgebung befindet,
während das andere annähernd trigonal planar umgeben ist.[45] Auch in [Cu2(µdppy)2-(CH3CN)2]2+ 18, in dem beide Cu-Ionen trigonal umgeben sind,[46] zeigt sich
ein entsprechender Unterschied. Der interatomare Cu···Cu-Abstand ist mit 3.225(7) Å
deutlich länger als in [Cu2(µ-dppy)3(MeCN)]2+ 17 (2.721 Å)[45], aber kürzer als in
[Cu2(dppy)2(CH3CN)2]2+ 18 (3.584 Å)[46], [Cu2(µ-Ph2PCH2PPh2)2(CH3CH)4]2+ (3.757
Å)[57]
und
[Cu2(dpbp)2(CH3CN)2]2+
(3.941
Å),
(dpbp
=
Diphenyl-(bipyridyl)-
phosphan)[58]. Der geringere Cu···Cu-Abstand in 26 gegenüber letzteren Komplexen
ist eher auf die Ligandengeometrie zurückzuführen, da die Distanz deutlich zu groß
ist für eine bindende Metall-Metall-Wechselwirkung am Kupfer. Die Summe der Kovalenzradien zweier Cu-Atome beträgt 2.48 Å.
Die Winkel am P-Atom sind gegenüber dem freien Liganden merklich verändert. Die
Winkelsumme der C-P-C-Winkel ist im Komplex 26 mit durchschnittlich 308.6° um
etwa 8° größer als in 23. Die Bindungslängen im koordinierten Liganden sind gegenüber dem freien 23 praktisch unverändert.
Der Silberkomplex 27 zeigt eine deutlich stärkere Verzerrung der tetraedrischen Koordination an den Metallzentren. Während die Winkel P-Ag-N(Py) zwischen 126.5°
und 135.5° liegen und größer als die entsprechenden Winkel in der Kupferverbindung 26 sind, betragen die kleineren N(Py)-Ag-N(Py)-Winkel 86.7° bzw. 87.4°. Auch
die Geometrie des Liganden 23 ist in 27 gegenüber der freien Verbindung stärker
3. Beschreibung der Ergebnisse
24
verändert als in 26. Die Koordinationssphäre des Metallzentrums kann auch in 27
alternativ als verzerrt trigonal pyramidal bezeichnet werden. Die Silberionen liegen
nur 0.43 Å (Ag1) bzw. 0.40 Å (Ag2) außerhalb der Ebenen N(Py)-P-N(Py).
Der Ag···Ag-Abstand liegt mit 2.933 Å in einem ähnlichen Bereich wie in anderen
Komplexen mit verbrückenden Pyridylphosphanliganden wie [Ag2(µ-Ph2Ppy)2](NO3)2
(3.146 Å),[48] [Ag2(η1-Ph2Ppy)(µ-Ph2Ppy)2](ClO4)2, (3.072 Å)[54] und
L)2(Ch3CN)2](ClO4)2
(2.964
Å)
(L
=
[Ag2(µ-
2-(diphenyl-phosphino)-6-(pyrazol-1-
yl)pyridine).[59] Der in 27 ermittelte Ag···Ag-Abstand ist jedoch bedeutend größer als
die Summe der Kovalenzradien von 2.68 Å: eine Metall-Metall-Bindung kann daher
ausgeschlossen werden. Unerwarteterweise führt die Einführung des schwereren
Homologen Silber zu einer Verkürzung des M···M-Abstandes um 0.29 Å gegenüber
26. Diese Tatsache könnte auf eine anziehende Wechselwirkung zwischen den AgZentren mit signifikantem Anteil relativistischer Effekte hinweisen,[60] jedoch ist es bei
ligandverbrückten Komplexen schwierig, wenn nicht gar unmöglich, zwischen ligandinduzierten Effekten und direkten d10-d10-Wechselwirkungen der Metallzentren zu
unterscheiden.[61] Eine ähnliche Beobachtung liegt auch von den isotypen Komplexen [Cu2(µ-L)2(Ch3CN)2](ClO4)2 (3.599Å)
[62]
und [Ag2(µ-L)2(Ch3CN)2](ClO4)2 (L = 2-
(diphenyl-phosphino)-6-(pyrazol-1-yl)pyridine) (2.964Å) vor.[59]
Bemerkenswert ist die Tatsache, daß, im Gegensatz zu den Verbindungen 26 und
28, in 27 eines der koordinativ gebundenen CH3CN-Moleküle einen auffällig kleinen
Ag-N-C-Winkel von nur 125.9° aufweist. Nicht-linear end-on koordinierte CH3CNLiganden wurden schon früher beobachtet. Der Cu-(I)-Komplex [Cu(acac)(phen)(Ch3CN)](ClO4) (acac = Acetylacetonat; phen = 1.10-Phenanthrolin) weist einen Cu-N-C-Winkel am CH3CN von nur 129.2° auf, [63] doch für Ag-Komplexe wurden
entsprechende Winkel unter 140° bisher nicht beschrieben (Tabelle 8).
3. Beschreibung der Ergebnisse
25
Tab. 8: Korrelation zwischen Ag-N-C-Bindungswinkel und der Ag-N-Bindungslänge an Ag-koordinierten CH3CN-Liganden
Ag-N-C (°)
Ag-N (Å)
Verbindung
ref.
174.5
2.084
[Ag(CF(CF3)2)CH3CN]
[64]
156.2
2.109
[Ag3L1(CH3CN)3] [a]
[65]
178.8
2.140
[Rh6(CO)15{Ag(CH3CN)2}2]
[66]
+
165.3
2.253
[Ag(CH3CN)4]
162.0
2.275
[Ag2L2(CH3CN)2](BF4)2 [b]
[68]
146.1
2.274
[Ag(CH3CN)2L3]n[c]
[59]
162.7
2.285
[AgL4(CH3CN)2] (SbF5) [d]
[69]
152.5
2.285
[AgL4(CH3CN)2] (SbF5) [d]
[69]
158.9
2.373
27
156.0
2.412
[AgL52(CH3CN)]2(ClO4)2 [e]
[48]
140.7
2.419
[Ag2 L6(ClO4)2][f]
[70]
125.9
2.466
27
L = µ3-6.13.20-Trimethoxycalix(3)pyridin,
[a] 1
cycloicosaphan,
[67]
diese Arbeit
diese Arbeit
L = µ2-1.11-(1.2)Ph-3,6,9,13,16,19-hexathia-
[b] 2
L = µ4-3.6-Bis(dipyridylphosphino)-Pyridazin,
[c] 3
5-aza-2,8-dioxa-1-phosphabicyclo(3.3.0)octa-2,4,6-trien,
pyrazolyl-pyridin,
[f]
L = µ2-3,7-Di-tert-butyl-
[d] 4
L = µ2-2-Diphenyphosphino-6-
[e] 5
µ2-2,6-Diphenylphosphino-pyridin
Gimeno et al. bemerkten bereits, daß der Bindungswinkel des CH3CN offensichtlich
im Zusammenhang mit der M-N-Bindungslänge steht: Je länger die Bindung, um so
kleiner der Winkel M-N-C, desto größer die Abweichung vom erwarteten linear koordinierten CH3CN.[45] Tabelle 8 zeigt, daß bei einem Vergleich verschiedener AgVerbindungen mit gewinkelt koordiniertem CH3CN ein solcher Trend, in den sich die
Werte für 27 problemlos einfügen, grundsätzlich zu erkennen ist. Doch Ausnahmen
wie [Ag[CH3CN)2{µ4-3.6-(Ph2P)2pyr}]n[c] oder [Ag3L1(CH3CN)3] [a] mit auffallend kleinen
Ag-N-C-Winkeln trotz relativ kurzer Ag-N-Bindungen[59, 65] oder [AgL3(CH3CN)2](SbF5)
[d]
, das an verschiedenen koordinierten CH3CN trotz gleicher Ag-N-Bindungslänge
unterschiedliche Ag-N-C-Winkel aufweist,[69] zeigen, daß offensichtlich noch andere
Einflüsse wie etwa Packungseffekte den Bindungswinkel des koordinierten CH3CN
am Metallion bestimmen. Ein Vergleich der Packungen von 26, 27 und 28 ist wegen
der unterschiedlichen Raumgruppen nur bedingt aussagekräftig und ließ keine eindeutigen Rückschlüsse zu.
3. Beschreibung der Ergebnisse
26
4+
Abb. 8: Molekülstruktur von [Co2(µ-CyPPy2)2(CH3CN)2]
28 im Kristall
Tab. 9: Ausgewählte Abstände (Å) und Winkel (°) in 28
Abstände
Winkel
Co1···Co1A
2.976(5)
N1-Co1-N3
87.6(4)
Co1-N3
2.352(1)
N1-Co1-N2
86.3(3)
Co1-N6
2.355(1)
N3-Co1-N2
87.8(4)
Co1-N5
2.435(1)
N1-Co1-P1
130.8(2)
Co1-P1
2.398(6)
N3-Co1-P1
118.5(4)
N2-Co1-P1
131.6(2)
Der Cobalt-Komplex 28 weist die gleiche Struktur auf wie die Verbindungen 26 und
27. 28 besitzt als einziger dieser Komplexe ein kristallographisches Inversionszentrum; leider war die Kristallqualität mangelhaft.
Auch in 28 findet sich eine Verzerrung der tetraedrischen Umgebung der Metallzentren zu einer verzerrt trigonal-planaren Anordnung. Die Summe der Winkel N(Py)-Co-
3. Beschreibung der Ergebnisse
27
N(Py) und N(Py)-Co-P beträgt 348.8°. Das Co-Zentrum liegt um 0.44 Å außerhalb
der Ebene N(Py)-P-N(Py).
Die Ligandengeometrie ist in 28 gegenüber dem freien Liganden in ähnlicher Weise
verzerrt wie in 27, die Winkelsumme der C-P-C-Winkel beträgt 314.7°.
Der Co···Co-Abstand beträgt 2.976 Å. Zu den wenigen bisher beschriebenen Dikobaltkomplexen, in denen Pyridylphosphane als verbrückende Liganden fungieren,
gehören
[CoICo0(µ-Ph2PPy)2(µ-CO)(CO)Cl][71]
und
[Co02(µ-Ph2PPy)(η2-µ-
HC≡CSiMe3)][72], bei denen in beiden Fällen ein dritter Brückenligand die Co-Zentren
verbindet. Die Co-Co-Abstände betragen 2.530 Å für die Carbonylverbindung bzw.
2.449 Å für den Acetylenkomplex, woraus die Autoren auf eine intermetallische Bindung schlossen. Der Acetylenkomplex ist zudem diamagnetisch, was ein weiterer
Hinweis auf eine Co-Co-Bindung ist, da die einzelnen ungepaarten Elektronen der
Co0-Zentren (d9-Elektronenkonfiguration) in einer solchen Bindung antiparallelen
Spin aufweisen müssen. Den Pyridylphosphankomplexen strukturell vergleichbare
Verbindungen stellen Dipyridylamidkomplexe wie [Co3(Py2N)4Cl2] dar, der ebenfalls
zwei Co-Co-Bindungen von 2.290 Å bzw. 2.472 Å aufweist.[73] Der in 28 beobachtete
Co···Co-Abstand ist auch im Vergleich zu der Summe der Kovalenzradien (2.42 Å)
eindeutig zu groß, um eine Co-Co-Bindung zu postulieren.
3. 1. 6 Magnetische Suszeptibilitätsmessung von 28
Mit einer Messung der magnetischen Suszeptibilität sollte untersucht werden, ob es
zwischen den beiden Co(II)-Zentren zu einer direkten oder indirekten, ligandvermittelten Spin-Spin-Wechselwirkung (Superaustausch) zwischen den d7-Metallzentren kommt. Das Ergebnis der Messung ist in Abbildung 9 dargestellt.
Der bei Raumtemperatur erreichte Wert für das effektive magnetische Moment von
ηeff = 5.5 Bohrschen Magnetonen ist relativ groß im Vergleich zu anderen, einkernigen tetraedrischen Co(II)-Komplexen, die Werte zwischen ηeff = 4.3 und 5.2 B. M.
aufweisen.[74,
75]
Simulationsrechnungen ergeben für Co(II)-Ionen im tetraedrischen
Ligandenfeld (high spin) einen Wert von µber. = 4.82 B. M., jedoch ist je nach Ligandenfeld experimentell ein höherer Wert zu erwarten, nicht jedoch ein kleinerer. Der
Einfluß der Spin-Bahn-Kopplung, der das gemessene magnetische Moment gegen-
3. Beschreibung der Ergebnisse
28
über dem reinen Spin-Only-Wert ebenfalls erhöht, tritt für Komplexe der 3d-Metalle
hinter den stärkeren Einfluß des Ligandenfeldes zurück.[75]
5.60
µeff [B. M.]
5.20
4.80
4.40
4.00
0.00
100.00
200.00
300.00
T [K]
Abb. 9: Magnetische Eigenschaften von 28 (µeff = effektives magnetisches Moment [Bohrsche Magnetonen] in Abhängigkeit von der Temperatur [K]
Das hohe magnetische Moment von 5.5 B. M. bei RT sowie eine rechnerische Anpassung an die gemessenen Werte zeigen, daß es sich bei 28 um einen tetraedrischen High-Spin-Komplex von Co(II)-Ionen handelt. Eine Spinkopplung zwischen
den Metallzentren ist daher auszuschließen.[76]
3.1.7 Synthese von [Cu2(η
η-CyPPy2)2I2] 29
Da 26, 27 und 28 ausschließlich in CH3CN löslich sind, sollte versucht werden, die
Löslichkeitseigenschaften der Komplexe zu verbessern. Durch Reaktion von CuI mit
23 in heißem THF entstand eine zitronengelbe Lösung, in der innerhalb eines Tages
zitronengelbe Kristalle von [Cu2(η-CyPPy2)2I2] 29 entstanden. 29 ist in THF, CH2Cl2,
CH3Cl und Aceton in der Kälte mäßig, in der Hitze jedoch gut löslich.
3. Beschreibung der Ergebnisse
29
Die Verbindung wurde mittels C, H-Elementaranalyse, FAB-Massenspektrum und
Multikern-NMR-Spektroskopie identifiziert. Zusätzlich konnten in CH2Cl2 Kristalle erhalten werden, von denen eine Einkristallröntgenstrukturanalyse angefertigt werden
konnte.
Das
P-NMR-Spektrum von 29 zeigt ein verbreitertes Singulett bei δ = 1.5. Wie bei
31
26 rührt die Verbreiterung der NMR-Signale von dem starken Quadrupol-Moment der
65/63
Isotope
Cu her (I = 3/2). Die chemische Verschiebung weicht nur 1.7 ppm von
der für 26 beobachteten ab.
Das 1H-NMR-Spektrum ähnelt erwartungsgemäß stark dem von 26, es zeigt verbreiterte Signale für 29, die Halbwertsbreite der Signale liegt bei etwa w1/2 ≈ 20 Hz.
Das Signal des H6-Atoms zeigt mit δ = 9.1, anders als in 26 und 27, eine deutliche
Tieffeldverschiebung gegenüber dem freien Liganden; eine Aufspaltung konnte nicht
aufgelöst werden. Eine solche Tieffeldverschiebung des H6-Atoms am koordinierten
Pyridyl kann als ein Hinweis auf eine N-Koordination interpretiert werden, [55] doch ist
umgekehrt die fehlende Tieffeldverschiebung kein eindeutiger Beweis für eine NichtKoordination der Pyridyl-N-Atome wie bei den 1992 von Beer et al. beschriebenen
Ag- und Cu-Bipyridylkomplexen (δ = 8.68 - 8.84),[56] und was auch bei 26 bzw. 27
(δ = 8.7) gefunden wurde.
1
Tab. 10: H-NMR-Daten von 29 (CDCl3, RT)
31
P-NMR (101.3 MHz)
1
H-NMR (250 MHz)
1.5 (s, w1/2 = 22.8 Hz)
CH(CH2)5
1.2 - 2.2 (m)
CH(CH2)5
3.1 (m, 1H)
THF (Solvat)
2.0 (quin)
THF (Solvat)
3.9 (quin, 4H)
H (Py)
7.8 (m, 4H)
H (Py)
7.2 (br, 2H)
H6 (Py)
9.1 (br, 2H)
H4
Numerierungsschema für 28:
H3
H5
P
H6
N
2
3. Beschreibung der Ergebnisse
30
Sowohl das 1H-NMR-Spektrum als auch die C, H-Elementaranalyse der in THF erhaltenen Kristalle von 29 zeigen, daß es sich um ein THF-Solvat handelt.
Das FAB-Massenspektrum zeigt zwar kein Signal des Molekülions, aber das Fragmention [M – I]+ ist bei m/z = 793 mit einer relativen Intensität von 2% in der erwarteten Isotopenverteilung zu erkennen. Weitere Fragmentionen sind Abbildung 10 zu
entnehmen.
-I
- 2 Py
333 (8%)
793 (2%)
- Cu/ -L
523 (6%)
177 (26%)
128 (70%) = I
- Py
715 (2,5%)
Abb. 10: Schematische Darstellung des Massenspektrums von 29
3.1.8 Molekülstruktur von 29
Durch Kristallisation in CH2Cl2 konnten für eine Röntgenstrukturanalyse geeignete
Einkristalle von 29 erhalten werden. 29 kristallisiert in CH2Cl2 als Solvat mit einem
Lösemittelmolekül pro Komplexmolekül. Tabelle 11 faßt neben den Angaben zur
Strukturbestimmung die kristallographischen Daten der Einkristallröntgenbeugungsanalyse zusammen.
Tab. 11: Kristallographische Daten und Angaben zur Strukturbestimmung von 29. Z = Anzahl der
Moleküle pro Elementarzelle
Raumgruppe
Pbca
Zellvolumen [Å3]
7596.8
Kristallsystem orthorhombisch Z
8
a [Å]
17.473(8)
Unabhängige Reflexe
6756
b [Å]
20.397(2)
Beobachtete Reflexe
4875
c [Å]
21.314(6)
mit I > 2σ(I)
α [°]
90.00
Parameter
406
β [°]
90.00
R1
0.0410
γ [°]
90.00
wR2
0.1098
Meßtemperatur [°C]
-70
3. Beschreibung der Ergebnisse
31
Die Verfeinerung der Struktur von 29 erfolgte für die Nichtwasserstoffatome anisotrop, hierbei sind die H-Atome in berechneten Lagen in die Verfeinerung eingegangen. Zur besseren Übersicht ist das Ergebnis der Röntgenstrukturanalyse in Abbildung 11 ohne die H-Atome dargestellt. Ausgewählte Bindungsabstände und
-winkel sind in Tabelle 12 aufgeführt.
29 weist eine im wesentlichen analoge Molekülstruktur zu 26, 27 und 28 auf. In 29
sind die koordinierten CH3CN-Moleküle aber durch Iodid-Ionen ersetzt. Der Cu···CuAbstand ist mit 3.333 Å um mehr als 0.1 Å größer als der in 26. Die anderen Bindungslängen zeigen keine Besonderheiten und liegen im selben Bereich wie in 26.
Die tetraedrische Umgebung der Cu-Zentren ist auch in 29 deutlich verzerrt. Bemerkenswert ist, daß sich diese Verzerrung an beiden Cu-Zentren unterschiedlich manifestiert; während am Cu1 die I2-Cu2-N3- und I2-Cu2-N4-Winkel mit 105.88° bzw.
101.08° deutlich größer sind als die entsprechenden N2-Cu1-I1- (96.73°) und N1Cu1-I1-Winkel (96.76°) an Cu2, weist der P1-Cu1-I1-Winkel mit 109.12° einen weit
kleineren Wert auf als der I2-Cu1-P2-Wert (120.64°). Auch die N3-Cu2-N4-Winkel
(93.93°) und der entsprechende N1-Cu2-N2-Winkel (100.79°) unterscheiden sich
merklich. Die N(Py)-Cu-N(Py)-Winkel sind mit 93.93° bzw. 100.79° deutlich größer
als die in 26 mit 90.74° bzw. 94.25°, was auf die größeren Iodid-Ionen in 29 anstelle
der N-Atome der CH3CN-Liganden in 26 zurückgeführt werden kann.
Verschiedene Versuche, die Iodid-Ionen in 29 durch Reaktion mit Phenylacetylen,
Lithiumphenylacetylid, Butyllithium oder Methyllithium gegen organische Substituenten auszutauschen, erbrachten keine einheitlichen, isolierbaren Produkte.
3. Beschreibung der Ergebnisse
32
Abb. 11: Molekülstruktur von [Cu2(µ-CyPPy2)2I2] 29 im Kristall
Tab. 12: Ausgewählte Abstände (Å) und Winkel (°) in 29
Abstände
Winkel
Cu1···Cu2
3.333(5)
N3-Cu2-N4
93.93(17)
Cu2-N3
2.107(5)
N3-Cu2-I2
105.88(13)
Cu2-N4
2.099(4)
N4-Cu2-I2
101.08(12)
Cu2-I2
2.698(1)
N3-Cu2-P1
116.55(13)
Cu2-P1
2.218(2)
N4-Cu2-P1
127.51(12)
Cu1-N2
2.044(5)
I1-Cu2-P1
109.12(04)
Cu1-N1
2.060(4)
N2-Cu1-N1
100.79(17)
Cu1-I1
2.720(2)
N2-Cu1-I1
96.73(12)
Cu1-P2
2.189(2)
N1-Cu1-I1
96.76(12)
N2-Cu1-P2
114.64(13)
N1-Cu1-P2
122.49(13)
I2-Cu1-P2
120.64(05)
3. Beschreibung der Ergebnisse
33
3.1.9 Synthese von [Co(CyPPy2)Cl2] 30
Zur Untersuchung des Einflusses der Anionengröße auf das Koordinationsverhalten
von 23 wurde CoCl2 unter sonst identischen Bedingungen mit 23 in CH3CN zur Reaktion gebracht. In der intensiv blauen Lösung kristallisiert 30 in Form dunkelblauer
luft- und hydrolysestabiler Kristalle, die in den meisten gängigen organischen Lösemitteln löslich sind, in 93% Ausbeute. Die Zusammensetzung ist durch eine C, HElementaranalyse und ein EI-Massenspektrum gesichert. Zusätzlich wurde eine Einkristallröntgenbeugungsanalyse durchgeführt, da erwartungsgemäß keine aussagekräftigen NMR-Spektren der paramagnetischen Co(II)-Verbindung (d7) erhalten wurden und daher der Koordinationsmodus auf andere Weise nicht zweifelsfrei festgestellt werden konnte.
M+ (0,5%)
- Cl
364 (3%)
- Cl
327 (10%)
- Co
270 (80%) CyPPy2
193 (82%) CyPPy
187 (100%) PPy2
109 (78%) PPy
Abb. 12: Schematische Darstellung des Massenspektrums von 30
Das EI-Massenspektrum zeigt das Molekülion bei m/z = 400 mit der erwarteten Isotopenverteilung in einer relativen Intensität von 0.5%. Weitere Fragmentionen entstehen durch sukzessive Abspaltung der Cl--Ionen und des Liganden sowie aus dem
Zerfall des Liganden selbst. Eine schematische Darstellung des Massenspektrums ist
in Abbildung 12 wiedergegeben.
Bei der Reaktion von 30 mit zwei Äquivalent AgBF4 in CH3CN entsteht neben ausfallendem AgCl der Dicobaltkomplex 28. Umsetzungen mit weiteren Übergangsmetallverbindungen wie NiCl2, Pd(OAc)2 oder [(CO)4Mo(C7H8)] (C7H8 = Norbornadien)
erbrachten keine einheitlichen, isolierbaren Produkte.
3. Beschreibung der Ergebnisse
34
3.1.10 Molekülstruktur von 30
Durch Kristallisation in CH3CN konnten für eine Röntgenstrukturanalyse geeignete
Einkristalle von 30 erhalten werden. Tabelle 13 faßt neben den Angaben zur Strukturbestimmung die kristallographischen Daten der Einkristallröntgenbeugungsanalyse
zusammen.
Tab. 13: Kristallographische Daten und Angaben zur Strukturbestimmung von 30. Z = Anzahl der
Moleküle pro Elementarzelle
Zellvolumen [Å3]
1784.2(1)
Kristallsystem monoklin
Z
4
a [Å]
8.997(4)
Unabhängige Reflexe
3172
b [Å]
14.310(6)
Beobachtete Reflexe
2083
c [Å]
13.967(6)
mit I > 2σ(I)
α [°]
90.00
Parameter
275
β [°]
97.168(8)
R1
0.0374
γ [°]
90.00
wR2
0.0763
Meßtemperatur [°C]
- 70
Raumgruppe
P21/n
Die Verfeinerung der Struktur von 30 erfolgte für die Nichtwasserstoffatome anisotrop. Hierbei sind die Heteroatome in beobachteten Lagen und die H-Atome in berechneten Lagen in die Verfeinerung eingegangen. Zur besseren Übersicht ist das
Ergebnis der Röntgenstrukturanalyse in Abbildung 13 ohne die H-Atome dargestellt.
Tabelle 14 listet einige ausgesuchte Bindungslängen und -winkel auf.
3. Beschreibung der Ergebnisse
35
Abb. 13: Molekülstruktur von 30 im Kristall
Tab. 14: Ausgewählte Abstände (Å) und Winkel (°) in 30
Abstände
Winkel
Co-Cl1
2.213(1)
Cl1-Co-Cl2
113.34(5)
Co-Cl2
2.222(1)
Cl1-Co-N1
116.32(8)
Co-N1
2.034(3)
Cl1-Co-N2
115.18(8)
Co-N2
2.028(3)
Cl2-Co-N1
104.25(8)
P-C7
1.843(3)
Cl2-Co-N2
106.70(8)
P-C12
1.837(3)
N1-Co-N2
99.52(11)
P-C1
1.857(3)
C1-P-C7
101.13(15)
C1-P-C12
100.15(14)
C7-P-C12
104.86(14)
In 30 ist das Co-Zentrum verzerrt tetraedrisch von zwei Cl- und zwei N-Atomen umgeben: Der Ligand 23 koordiniert in 30 anders als in 28.
Das Metallzentrum bildet mit dem Chelatliganden einen sechsgliedrigen Metallacyclus, der in der Boot-Konformation vorliegt. Die Struktur ähnelt erwartungsgemäß
3. Beschreibung der Ergebnisse
36
stark der von [Co(N,N‘-PhPPy2)Cl2],[77] bei der allerdings der Phenylring am PZentrum etwa parallel zur Cl-Co-Cl-Ebene angeordnet ist. In 30 befindet sich der Cyclohexylrest zu dieser Ebene etwa in einem Winkel von 80°. Die Bindungslängen liegen alle im erwarteten Bereich für tetraedrisch koordinierte Dipyridylkomplexe von
Co(II) wie in [Co(4-Vinylpyridin)2Cl2] [78] oder [Co(4-Methylpyridin)2Cl2].[79] Im Vergleich
zu den beiden letztgenannten Verbindungen ist die tetraedrische Umgebung des CoZentrums in 30 stärker verzerrt. Insbesondere der N1-Co-N2-Winkel von 99.5° gibt
eine deutliche Verzerrung wieder, die auf die Verknüpfung der Pyridylringe über das
P-Atom in 2-Stellung zurückzuführen ist. Eine entsprechende Winkelstauchung mit
94.8° wurde auch bei [Co[N,N‘-PhPPy2)Cl2] beobachtet.[77]
3. 1. 11 Cyclovoltammetrische Untersuchung von 30
600.00
10.
9.
8.
400.00
7.
6.
5.
i [µA]
4.
3.
200.00
2.
1.
0.00
-200.00
-600.00
-400.00
-200.00
0.00
200.00
0
n(E – E ) [mV]
Abb. 14: Cyclovoltammogramm (10 Zyklen) von 30 in CH3CN (10 mmol/l), Pt-Elektrode 1mm,
25 mV/s, Leitsalz: LiClO4 (100 mmol/l), RT, Referenzelektrode: Ag/AgCl
3. Beschreibung der Ergebnisse
37
Das Cyclovoltammogramm von 30 in CH3CN zeigt im Bereich von - 800 bis + 900
mV zunächst keinerlei Redox-Vorgänge. Erst im zweiten Cyclus wird ein Reduktionssprung bei n(E – E0) = - 120 mV erkennbar, der bei weiteren Durchläufen an
Stromintensität zunimmt und sich leicht nach positivem Potential verschiebt. Ein
Oxidationsschritt ist nicht zu erkennen (Abbildung 14).
Ein solches Verhalten kann entweder auf eine Reduktion mit anschließender
irreversibler Folgereaktion oder auf eine Abscheidung an der Elektrode im ersten
Cyclus hinweisen, wobei in den folgenden Cyclen die abgeschiedene Substanz auf
der Elektrode reduziert wird. Um zwischen diesen Möglichkeiten zu unterscheiden,
wurde eine Chronamperometrie, Anlegen einer Oxidationsspannung von - 600 mV
(Dauer: 60 s) durchgeführt. Bei einer anschließenden erneuten Cyclovoltammetrischen Untersuchung zeigt sich die Reduktion bereits im ersten Cyclus mit hoher
Intensität, um im zweiten Cyclus zunächst abzufallen und ab dem dritten Durchlauf
die schon vorher beobachtete Steigerung zu erfahren (Abbildung 15).
600.00
1.
i [µA]
400.00
4.
3.
2.
200.00
0.00
-200.00
-600.00
-400.00
-200.00
0.00
200.00
n(E – E0) [mV]
Abb. 15: Cyclovoltammogramm (4 Zyklen) von 30 nach Chronamperometrie (s. Text) in CH3CN
(10 mmol/l), Pt-Elektrode 1mm, 25 mV/s, Leitsalz: LiClO4 (100 mmol/l), RT, Referenzelektrode: Ag/AgCl
3. Beschreibung der Ergebnisse
38
Dieser Befund zeigt, daß es sich hier um eine Ablagerung an der Elektrode handeln
muß, die während der Chronamperometrie erfolgt ist. Es handelt sich also nicht um
eine diffusionskontrollierte Reaktion, so daß ein Vergleich der Werte mit anderen
Untersuchungen nur bedingte Aussagekraft besitzt. Ob im Zuge der Ablagerung eine
Oxidation stattfindet oder nicht, ist anhand der erhaltenen Ergebnisse nicht eindeutig
festzulegen.
3.1.12 Synthese von [cis-Mo(CyPPy2)2(CO)4] 31
Verschiedene Molybdän-Komplexe mit PhPPy2 10b waren schon 1993 von Espinet
beschrieben worden,[50] darunter auch eine Verbindung, in der alle drei Donatorzentren des Liganden koordinieren. Da keine Röntgenstrukruranalysen angefertigt worden waren, konnte von Espinet et al. nicht zweifelsfrei geklärt werden, ob es sich dabei um monomere Chelatkomplexe oder um Poly- oder Oligomere mit überbrückendem PhPPy2 10b handelte. Da die Cu- und Ag-Zweikernkomplexe von 23 eine recht
hohe Stabilität aufweisen, sollte untersucht werden, ob ähnliche Dimerverbindungen
mit Molybdän ebenfalls zugänglich sind.
Bei der Reaktion von [Mo(CO)3(CH3CN)3] mit 23 in CH3CN bei RT kristallisierte 31 in
gelblichen, luft- und hydrolyseempfindlichen Kristallen. Weitere Verbindungen konnten in der Reaktionsmischung
31
P-NMR-spektroskopisch zwar in geringem Maße be-
obachtet, jedoch nicht isoliert werden. 31 entsteht unter CO-Austausch, was die relativ geringe Ausbeute von 34% und die Bildung von elementarem Molybdän erklärt.
31 wurde mittels Massenspektrometrie, IR- und Multikern-NMR-Spektroskopie charakterisiert. Zusätzlich konnte eine Einkristallröntgenstrukturanalyse durchgeführt
werden.
Das
P-NMR-Spektrum von 31 zeigt ein Singulett bei δ = 48.5. Dieser Wert liegt in
31
dem selben Bereich wie die Signale ähnlicher Molybdänphosphankomplexe. Die entsprechende Verbindung mit PhPPy2 10b als Ligand zeigt eine chemische Verschiebung von δ = 44.6 [50], während [Mo(CO)4(PPy3)2] ein Signal bei δ = 49.7 zeigt.[80] Das
1
H-NMR-Spektrum unterscheidet sich erwartungsgemäß praktisch nicht vom 1H-
NMR-Spektrum des freien Liganden.
Im IR-Spektrum werden für die Streckschwingungen der Carbonylgruppen am MoAtom vier Absorbtionsbanden bei ν = 2019, 1944, 1919 und 1895 cm-1 beobachtet.
3. Beschreibung der Ergebnisse
39
Dieser Befund steht in Einklang mit einer lokalen C2v-Symmetrie am Mo-Zentrum, für
die vier IR-aktive Banden für die Carbonyl-Streckschwingungen erwartet werden
(2A1, B1 und B2). Die CO-Schwingungsbanden einiger Tetracarbonylmolybdänkomplexe sind in Tabelle 15 zusammengefaßt.
Tab. 15: Vergleich der νCO-Frequenzen (in cm ) von cis-L2Mo(CO)4-Komplexen
-1
νCO (cm-1)
Ref.
[(PMe3)2Mo(CO)4]
2019, 1922, 1905, 1899
[81]
[(PCy3)2Mo(CO)4]
2002, 1898, 1881, 1851
[82]
[(PhPPy2)2Mo(CO)4]
2024, 1928, 1914, 1883
[50]
[(Ph2PCH2PPh2)Mo(CO)4] 2020, 1920, 1907, 1879
[83]
[(CyPPy2)2Mo(CO)4 31
2019, 1944, 1919, 1895
diese Arbeit
Im FAB-Massenspektrum von 31 ist der Molekülpeak bei m/z = 751 mit der errechneten Isotopenverteilung und einer Intensität von 4% zu erkennen. Weitere markante
Molekülfragmente sind in Abbildung 16 dargestellt.
- Cy
612 (7%)
[M+H]+ (4%)
- 2 CO
- 2 CO
692 (6%)
635 (5%)
481 (8%)
Abb. 16: Schematische Darstellung des Massenspektrums von 31
3.1.13 Molekülstruktur von 31
Geeignete Kristalle von 31 wurden in CH3CN bei RT erhalten. Die in einer Einkristallstrukturanalyse ermittelten kristallographischen Daten sind in Tabelle 16 zusammengefaßt. Dabei sind die Nicht-Wasserstoffatome anisotrop, die H-Atome in berechne-
3. Beschreibung der Ergebnisse
40
ten Lagen isotrop in die Verfeinerung eingegangen. Abbildung 17 zeigt die Molekülstruktur von 31, wobei wegen der besseren Übersichtlichkeit auf die Darstellung der
H-Atome verzichtet wurde. Ausgewählte Winkel und Bindungslängen sind in Tabelle
17 zusammengefaßt .
Tab. 16 Kristallographische Daten und Angaben zur Strukturbestimmung von 31. Z = Anzahl der Moleküle pro Elementarzelle
Raumgruppe
Cc
Zellvolumen [Å3]
3460.7(1)
Kristallsystem
monoklin
Z
2
a [Å]
13.703(3)
Unabhängige Reflexe
4169
b [Å]
16.473(4)
Beobachtete Reflexe
3928
c [Å]
16.010(4)
mit I > 2σ(I)
α [°]
90.00
Parameter
424
β [°]
106.745
R1
0.0292
γ [°]
90.00
wR2
0.0803
Meßtemperatur [°C]
- 70
Das Mo-Zentrum in 31 ist nahezu ideal oktaedrisch von den sechs Liganden umgeben, wobei die Cyclohexyldipyridylphosphanliganden in cis-Stellung zueinander stehen. Die den P-Zentren trans angeordneten C33- und C36-Atome weisen mit 1.944
und 2.007 Å etwas geringere Mo-P-Bindungslängen auf als die trans zueinander stehenden C34- (2.057 Å) und C35-Atome (2.023Å). Ein solcher Effekt wurde bereits
früher an vergleichbaren Komplexen beobachtet und ist auf das schlechtere πAkzeptorvermögen des Phosphans im Vergleich zu CO zurückzuführen. Die Beobachtung entspricht somit den Erwartungen.
Die Pyridylsubstituenten sind so angeordnet, daß jeweils zwei zu verschiedenen
Phosphanliganden gehörende Ringe parallel zueinander angeordnet sind. Während
drei Pyridylringe so orientiert sind, daß die freien Elektronenpaare der N-Atome auf
das Mo-Zentrum gerichtet sind, ist der vierte um 180° um die C-P-Bindung gedreht.
Die Abstände zwischen den jeweils parallel angeordneten Pyridylringen beträgt in
beiden Fällen ca. 3.7 Å. Die unterschiedliche Orientierung hat offensichtlich keinen
Einfluß auf die Struktur der Verbindung.
3. Beschreibung der Ergebnisse
41
Abb. 17: Molekülstruktur von 31 im Kristall
Tab. 17: Ausgewählte Abstände (Å) und Winkel (°) in 31
Abstände
Winkel
Mo1-C33
1.944(1)
P2-Mo1-P1
90.9(0)
Mo1-C36
2.007(7)
C36-Mo1-P2
91.4(3)
Mo1-C35
2.023(1)
C35-Mo1-P2
89.6(3)
Mo1-C34
2.057(8)
C34-Mo1-P2
92.2(2)
Mo1-P1
2.557(3)
C33-Mo1-P2
176.6(3)
Mo1-P2
2.548(3)
C33-Mo1-P1
92.4(3)
P1-C11
1.817(9)
C34-Mo1-P1
90.7(2)
P1-C6
1.822(1)
C35-Mo1-P1
92.3(3)
P1-C1
1.826(1)
C36-Mo1-P1
177.7(3)
P2-C22
1.858(8)
C33-Mo1-C36
85.3(1)
P2-C17
1.868(9)
C33-Mo1-C35
90.7(4)
P2-C27
1.908(7)
C36-Mo1-C35
87.5(4)
C33-Mo1-C34
87.2(4)
C36-Mo1-C34
89.4(3)
C35-Mo1-C34
176.5 (2)
3. Beschreibung der Ergebnisse
42
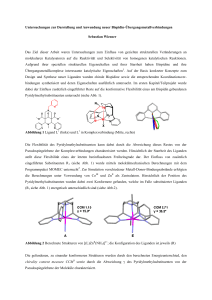
Woodward postulierte 1994 anhand einiger
Beispiele, daß die Mo-P Bindungslängen parallel zum sog. Kegelwinkel ΘKegel ansteigen.[82]
Tolman definierte den Kegelwinkel als den
Winkel, den ein wie in Abbildung 18 um die
van-der-Waals-Radien des kompletten Liganden geschlagener Mantel aufweist. Dieser ist
ein Maß für die Raumbeanspruchung eines
Abb. 18: Zur Veranschaulichung des Kegelwinkels
Liganden.[84]
Cotton hatte bereits 1982 festgestellt, daß
Phosphinoliganden mit gleichen Substituenten am P-Atom eine solche Abhängigkeit
zeigten. Tragen die P-Zentren verschiedene Substituenten, fügen die beobachteten
Mo-P-Bindungslängen sich allerdings nicht in die Reihe ein, sondern weisen zum Teil
deutlich geringere Verzerrungen auf als nach Tolmans Konzept zu erwarten wäre.
Nach Cotton ist entweder eine raumsparendere Anordnung der verschiedenen Substituenten im Komplex hierfür verantwortlich - er nennt es den „effektiven Kegelwinkel“ - oder eine Unzulänglichkeit in Tolmans Definition. Entsprechend Tolmans Modell sollten die Kegelwinkel für Liganden mit unterschiedlichen Substituenten durch
Mittelwertbildung zwischen den Kegelwinkeln für Liganden mit drei gleichen Substituenten am P-Atom errechnet werden.[81]
Der Kegelwinkel ist ein rein sterisches Kriterium. Geht man davon aus, daß der Kegelwinkel von 31 rechnerisch vergleichbar ist mit dem des Phenylanalogen CyPPh2
(ΘKegel = 153°),[85] so sollte der sterische Anspruch von 23 größer sein als der von
PPh3 mit ΘKegel = 145°. Somit müßte der zu erwartende Winkel P-Mo-P wie auch die
Mo-P-Bindungslängen in 31 größer sein als in [cis-Mo(CO)4(PPh3)2]. Das ist jedoch
nicht der Fall.
Der Winkel P1-Mo1-P2 in 31 besitzt mit 90.9° einen der kleinsten in Tetracarbonylcis-diphosphino-Molybdän-Komplexen gefundenen Werte. Vergleichbare Komplexe
weisen entsprechende P-Mo-P-Winkel zwischen 90.5° (L = PPhCl(NHi-Pr))[86] und
105.1° (L = PCy3) auf.[82] Eine Übersicht über P-Mo-P-Winkel an vergleichbaren
Komplexen ist Tabelle 18 zusammengestellt.
Die C-P-C-Winkel im koordinierten Liganden sind gegenüber dem freien 23 sogar
vergrößert. Die Summe der C-P-C-Winkel beträgt in 31 309.0° im Vergleich zu
300.6° im freien Liganden.
3. Beschreibung der Ergebnisse
Der
bemerkenswert
43
kleine
P-Mo-P-Winkel,
die
unerwartet
kurzen
Mo-P-
Bindungsabstände in 31 und auch die relativ große C-P-C-Winkelsumme im koordinierten Pyridylphosphanliganden weisen auf eine für derartig raumfüllende Liganden
geringe Abstoßung untereinander hin. Die in Abbildung 17 erkennbare gestaffelte,
parallele Anordnung der Pyridylreste könnte der Grund hierfür sein.
Tab. 18: Vergleich der Winkel an verschiedenen Komplexen des Typs [Mo(CO)4cis-(L)2]
ΘKegel (°)
P-Mo-P (°)
Ref.
ca. 102
90.5
[86]
PMe3
118
97.5
[81]
PEt3
132
100.3
[81]
P(n-Bu)3
132
99.3
[81]
PMe2Ph
122
94.8
[81]
PMePh2
136
92.5
[81]
PPh3
145
104.6
[81]
ca. 153
90.9
diese Arbeit
170
105.1
[82]
L
PPhCl(NHiPr)
PCyPy2 23
PCy3
Die
Phenylringe
in
[cis-Mo(CO)4(PPh3)2],
[cis-Mo(CO)4(PPh2Me)2]
und
[cis-
Mo(CO)4(PPhMe2)2] zeigen keine solche Anordnung, jedoch ist der P-Mo-P-Winkel in
[cis-Mo(CO)4(PPh2Me)2] mit 92.52° ca. 2.3° kleiner als in [cis-Mo(CO)4(PPhMe2)2].
Nach dem Konzept des Kegelwinkels von Tolman wäre genau das Gegenteil zu erwarten gewesen. Die Anordnung der Substituenten an den P-Atomen ermöglicht
dennoch eine stärkere Annäherung der Liganden aneinander.[87]
Somit stützen die hier beschriebenen Ergebnisse die Beobachtungen Cottons, der
neben dem Kegelwinkel auch nicht näher bestimmte elektronische Effekte als Einflußgrößen auf die Abstoßung zweier Liganden am Metallzentrum vermutete. Eine
klare Trennung zwischen sterischen und elektronischen Ursachen ist nicht eindeutig
möglich.
3. Beschreibung der Ergebnisse
44
3.2 Synthese und Komplexierungsverhalten rigider Bis(dipyridylphosphan)liganden
3.2.1 Kenntnisstand
Wie im vorhergehenden Abschnitt 3.1 beschrieben, zeigen pyridyl-substituierte
Phosphane eine umfangreiche Koordinationschemie. Die Kombination zweier Pyridylphosphaneinheiten in einem Molekül sollte nun die Variationsbreite erhöhen. 1990
wurden von Budelzaar et al. mit (PhPyP)2(CH2)n (n = 1, 2, 3) 32a - c die ersten
Di(pyridylphosphan)liganden synthetisiert.[10] 32a bildet mit [Rh(CO)2Cl2]2 den Dirhodiumkomplex 33, in dem die Pyridylphosphaneinheiten in Kopf-Schwanz-Orientierung
an die quadratisch-planar umgebenen Metallatome koordinieren. Der Rh-Rh-Abstand
liegt mit 3.09 Å außerhalb der doppelten Van-der-Waals-Radien. [10]
(CH2)n
N
P
P
N
P
Cl
Rh
N
CO
Rh
Cl Rh
N
n = 1: 32a
N CO P Cl
PN
P
N
Rh Cl
N P
P
n = 2: 32b
n = 3: 32c
33
34
Dagegen wurde bei [RhCl((PhPyP)2(CH2)3)]2 34 ein Metall-Metall-Abstand von 2.65 Å
ermittelt, der einer Rh-Rh-Bindung entspricht. In 34 sind die Pyridylphosphaneinheiten jeweils eines Liganden in Kopf-Kopf-Orientierung angeordnet, während die zwei
Ligandmoleküle untereinander in Kopf-Schwanz-Anordnung zueinander stehen.[10]
Bei der Reaktion von 32a - c mit [acacRh(COD)] (acac = Acetylacetonat, COD = 1.4Cyclooctadien) entsteht ein Komplex vom Typ [acacRh(PhPyP)2(CH2)n] (n = 1, 2, 3)
35a - c, in dem nur die P-Atome koordinieren. Dieser reagiert mit Methylenchlorid
weiter
zum
oktaedrischen
(n = 1, 2, 3) 36a - c.
Ylidkomplex
[(acac)ClRh(CH2Cl)(PhPyP)2(CH2)n]
3. Beschreibung der Ergebnisse
45
Py
O
Rh·COD
O
(PyP)2(CH2)n
n = 1, 2, 3
O
Rh
O
P
(CH2)n
P
Py
ClCH2 Py
Ph
O
CH2Cl2
Rh
O
Ph
P
(CH2)n
P
Cl Py Ph
Ph
n = 1: 35a
n = 1: 36a
n = 2: 35b
n = 2: 36b
n = 3: 35c
n = 3: 36c
Durch spontane Abspaltung von Cl- und intramolekulare Quarternisierung eines Pyridyl-N-Atoms entstehen schließlich die ungewöhnlichen Komplexe 37a - c.[88]
N+
ClCH2 Py
O
O
Rh
H2C
Ph
P
(CH2)n
P
Cl Py Ph
O
- Cl-
Rh
O
Ph
P
(CH2)n
P
Cl Py Ph
n = 1: 36a
n = 1: 37a
n = 2: 36b
n = 2: 37b
n = 3: 36c
n = 3: 37c
Ebenfalls nur P-Koordination liegt in den von Berners-Price et al. hergestellten Silberund Goldkomplexen 38 und 39 vor, die vielversprechende Eigenschaften als wasserlösliche Antitumorreagentien aufweisen.[89, 90] Der Vorteil dieser Komplexe gegenüber
entsprechenden Bis(diphenylphosphino)ethan-Komplexen ist eine deutlich niedrigere
hepatotoxische (leberschädigende) Wirkung.[9] In diesen Komplexen koordiniert an
jedem Metallzentrum ein Ligand als P, P‘-Chelat, zwei weitere wirken als P, P‘Brückenliganden. Die nicht-koordinierenden N-Atome der Pyridysubstituenten bewirken zudem eine hohe Wasserlöslichkeit.
In der Arbeitsgruppe von James wurde 1998 der ungewöhnliche vierkernige Pt(II)Ag(I)-Komplex 40 synthetisiert. Er stellt das bisher einzige bekannte Beispiel eines
Bis(dipyridylphosphan)-Komplexes mit verschiedenen Metallzentren dar. Seine
Grundstruktur ähnelt dem oben beschriebenen Rh-Komplex 34, an den noch zwei
AgNO3-Eineiten angelagert sind.
3. Beschreibung der Ergebnisse
46
4+
N
AgNO3
2+
N
P
Py Py
P
PPy2
PPy2
M
M
P
Py
Py
Py
Pt
N
P
P
P
PPy2
Py
PPy2
Py
N
P
N
Pt
Py
N
N
P
NO3Ag N
M = Ag: 38; M = Au: 39
40 (
N =
N
)
Es wurde ein Pt-Pt-Abstand von nur 2.77 Å ermittelt, der deutlich kürzer ist als die
Summe der van-der-Waals-Radien (3.5 Å). James et al. kommen daher zu dem
Schluß,
daß
in
40
ein
bindender
Pt-Pt-Kontakt
vorliegt.[91]
Eine
Pt-Ag-
Wechselwirkung kann dagegen ausgeschlossen werden.
Py
Py
Py
P
P
Cl
Py
P
Ru
N
Cl
42
PPh2
N
PPh3
Py
P
Ru
PPh3
N
Cl
43
PPh2
ortho: 44a; para: 44b
1999 konnten James et al. zeigen, daß 1.2-Bis(dipyridylphosphino)cyclopentan 41
neben P, P‘-Koordination auch Chelatkomplexe ausbildet, in denen es als dreizähniger P, P‘, N – und vierzähniger P, P‘, N, N‘ - Chelatbildner fungiert wie die verzerrt
oktaedrischen Ru-Komplexe 42 und 43 zeigen.[92]
α, α‘-Bis(diphenylphosphino)xylole 44 stellen Phenyl-Analoga der bisher nicht beschriebenen α, α‘-Bis(dipyridylphosphino)xylole dar. Obwohl sowohl die ortho-Verbindung 44a[93] wie auch das para-Isomer 44b[94] schon lange bekannt sind, wurden
Komplexe mit diesen Verbindungen als Liganden kaum beschrieben.
44a bildet als Chelatligand C4P2M-Siebenringe, die die Geometrie der Komplexe
durch die Veränderung des P–M–P-Bindungswinkels in anderer Weise beeinflussen
als Chelatliganden, die kleinere Metallacyclen bilden oder einzähnige Liganden. So
zeigt der Pt-Komplex 45 mit quadratisch planarer Koordinationsgeometrie einen P-Pt-
3. Beschreibung der Ergebnisse
47
P-Winkel von 115.0° gegenüber einem Winkel von 111.6°, den die entsprechende
Verbindung mit einzähnigen Liganden [PtCl2(PPh3)2] aufweist. [95]
Ph Ph
Ph Ph
P
P
CH2
Pt
Ph Ph
Cl
Ag
CH2
P
P
Ph Ph
Ph Ph
P
Ag
Cl
P
Ph Ph
45
46
Der Silberhalogenidkomplex 46 besitzt einen P-Ag-P-Winkel von 111.8°, der gegenüber einem idealen Tetraederwinkel nur wenig aufgeweitet ist. Der entsprechende
Winkel in der Vergleichsverbindung [AgCl(PPh3)2]2 beträgt 122.9°.[96] Der Chelatligand bewirkt hier eine deutliche Abnahme des Bindungswinkels gegenüber den einzähnigen Liganden. Die Cl-Ag-Cl-Winkel der Verbindungen verhalten sich genau
umgekehrt, sie betragen 103.0° (46) bzw. 88.0° ([AgCl(PPh3)2]2).
Im Ru-Komplex 47, in dem die Ru-Zentren verzerrt trigonal-bipyramidal umgeben
sind, steht eines der Chelat-P-Atome in axialer, das andere in äquatorialer Stellung.
Die P-Ru-P-Winkel betragen 97.5° bzw. 101.7°, sind also gegenüber dem idealen
Winkel für diese Anordnung aufgeweitet.
Komplexe, in denen die P-Zentren von 44a verbrückend koordinieren und an verschiedene Metallzentren koordinieren, sind bisher ebenso wenig beschrieben worden
wie Verbindungen mit einem Metall/Ligand-Verhältnis von 2:1 und einer vierfachen PKoordination am Metallzentrum.
Ph
Ph Ph
Ph Ph
P
P
Cl
Ph3P
Cl
Au
Ph
Cl
Ru
Ru
P
P
P
Ph Ph
Ph Ph
Cl
PPh3
Ph
Ph
P
Ph
Au
Ph
47
48
3. Beschreibung der Ergebnisse
48
Der relativ große Abstand der P-Atome im para-Isomer 44b verhindert eine Chelatbildung, erlaubt aber die Verbrückung zweier Metallzentren. So stellte Schmidbaur
1995 den Goldkomplex 48 vor, der auch strukturell charakterisiert werden konnte.[97]
Ähnliche Verbindungen verwendeten Dahmen et al. für den Aufbau von 49 - 51 in
denen die Diphosphanliganden zur Verbrückung von Pt3-Clustern dienen.
Pt
Pt
Pt
M
Ph
Ph2P
P
Ph
PPh2
(CO)4Mo
Ph
P
M = Cu: 51
Ph
M
Pt
M = Ag: 52
Pt
M = Au: 53
Pt
Mo(CO)4
Ph2P
PPh2
Pt
Pt
52
= [Pt3(µ-CO)3(PCy3)3]
Pt
Auch die Ausbildung dimerer Aggregate sollte möglich sein, sie wurde bei Komplexen anderer Diphosphanliganden beobachtet. Als Beispiel sei hier die Verbindung
[(CO)4Mo(Ph2PCH2C≡CCH2PPh2)]2 52 angeführt.[98]
Trans-Bis(diphenylphosphino)ethen (t-dppee) bildet einen zu 52 analogen Komplex
[Mo2(CO)8(µ-t-dppee)2], im Gegensatz zu dem entsprechenden cis-Diphosphan cdppee, welches ausschließlich als Chelatligand koordiniert.[99]
(CH2)6
Ph2P
Ph2P
Cu
I
PPh2
PPh2
Cu
PPh2
PPh2
Ph2P
PPh2
Mo(CO)4
(CO)4Mo
I
Ph2P
PPh2
(CH2)6
53
54
1999 stellten Comba et al. mit [Cu2(dppe)3I2] 53 (dppe = Bis(diphenylphosphino)ethan einen Komplex vor, in dem auch das sonst meist als Chelatligand koordinierende dppe eine Brücke zwischen den Cu-Zentren bildet.[100]
3. Beschreibung der Ergebnisse
49
Bemerkenswert ist in diesem Zusammenhang, daß die Aufweitung der Kohlenwasserstoffketten zwischen den P-Atomen auf sechs CH2-Gruppen eine Veränderung
der Koordination am Mo-Zentrum zur Folge hat: In [(CO)4Mo(Ph2P(CH2)6PPh2)]2 54
stehen die P-Atome in trans-Stellung am Mo-Zentrum,[101] während sie in [(CO)4Mo(Ph2PCH2C≡CCH2-PPh2)]2 52 in cis-Stellung angeordnet sind.
3.2.2 Synthese von ortho- und para-(Py2PCH2)C6H4(CH2PPy2) 24 und 25
Die Verbindungen 24 und 25 wurden analog zu ortho- und para-(Ph2PCH2)C6H4(CH2PPh2)[102] aus ortho- bzw. para-α,α‘-Dichlormethylbenzol und zwei Äquivalent
Lithium-dipyridylphosphanid[103] in THF als farblose Plättchen erhalten. Sie sind in
THF, CH2Cl2 und CH3CN gut, in Ether, Hexan und Aceton erst in der Hitze löslich.
Die Verbindungen wurden durch Massenspektrometrie, hochaufgelöste Massenbestimmung, Multikern-NMR-Spektroskopie und auch durch Einkristallröntgenstrukturanalysen charakterisiert.
Tab. 19: NMR-Daten von 24 und 25 (CDCl3)
24
31
P-NMR
25
- 2.6 (s)
- 5.4 (s)
(101.3 MHz)
1
CH2
3.95 (s, 4H)
3.72 (s, 4H)
(250 MHz)
C6H4
6.69 (m, 4H)
6.96 (s, 4H)
H5
7.15 (tm, 4H)
7.19 (tm, 4H)
H-NMR
JHH ≈ 6.3 Hz
(Lsm.)
JHH ≈ 6.3 Hz
3
3
7.29 (s)
7.29 (s)
7.46 (dm, 4 H)
7.38 (dm, 4 H)
3
3
7.54 (tm, 4 H)
7.56 (tm, 4 H)
3
H
4
H
6
H
JHH = 7.4 Hz
JHH ≈ 7.5 Hz
JHH = 7.4 Hz
JHH ≈ 7.5 Hz
3
3
8.67 (d, 4 H)
8.23 (d, 4 H)
JHH ≈ 5.0 Hz
3
JHH ≈ 5.0 Hz
3
3. Beschreibung der Ergebnisse
50
Die 31P-NMR-Spektren zeigen Singuletts bei δ = - 2.6 (24) bzw. δ = - 5.4 (25) was mit
den chemischen Verschiebungen von 23 mit δ = 3.2 und von Bis(dipyridylphosphino)ethan mit δ = - 6 vergleichbar ist.[22] Die 1H-NMR-Spektren zeigen keine ungewöhnlichen Signale. Die Signale der Methylen-Protonen liegen mit δ = 3.95 (24) und
δ = 3.72 (25) in ähnlichen Bereichen wie die chemischen Verschiebungen der entsprechenden Protonen in 44b (δ = 3.34, s)[104] und ortho-(Ph2PCH2)C6H4(CH2PPh2) (δ
= 3.34; s);[95] die anderen Zuordnungen sind in Tabelle 19 zusammengestellt.
M+ (1%)
- PPy2 -H
- Py
290 (42%)
212 (50%)
-Py
400 (100%)
187 (62%) [PPy2]
109 (26%) [PPy]
78 (19%) Py
Abb. 19: Schematische Darstellung des Massenspektrums von 24
In den Massenspektren zeigen sich in beiden Fällen die Molekülionen bei m/z = 478
mit relativen Intensitäten von 1% (24) bzw. 19% (25). Weitere Fragmentierungen sind
in den Abbildungen 19 und 20 schematisch zusammengefaßt. Die hochaufgelösten
Massenbestimmungen ergaben für 24: m/z = 478.1472 (ber. 478.1476), für 25: m/z =
478.1478 (ber. 478.1476) und bestätigen somit ihre Zusammensetzung.
M+ (19%)
- PPy2
291 (82%)
187 (100%) [PPy2)
109 (26%) [PPy]
78 (22%)
Abb. 20: Schematische Darstellung des Massenspektrums von 25
Py
3. Beschreibung der Ergebnisse
51
3.2.3 Molekülstrukturen von 24 und 25
Für Einkristallröntgenstrukturbestimmungen geeignete Kristalle der Verbindungen 24
und 25 konnten durch langsame Abkühlung von gesättigten, heißen Lösungen in
Hexan erhalten werden. Die Abmessungen der Elementarzellen und weitere Angaben zur Strukturbestimmung sind in Tabelle 20 zusammengefaßt. Die Verfeinerung
der Strukturen erfolgte für die Nicht-Wasserstoffatome anisotrop, während die HAtome in berechneten Lagen isotrop berücksichtigt wurden. Die Molekülstrukturen
sind in Abbildungen 21 und 22 der Übersichtlichkeit halber ohne H-Atome dargestellt.
Ausgewählte Bindungsabstände und -winkel sind in den Tabellen 21 und 22 aufgeführt.
Tab. 20: Kristallographische Daten und Angaben zur Strukturbestimmungen von 24 und 25.
Z = Anzahl der Moleküle pro Elementarzelle
24
25
Raumgruppe
C2/c
P1
Kristallsystem
monoklin
triklin
a [Å]
14.317(5)
7.808(3)
b [Å]
10.246(4)
8.318(4)
c [Å]
17.151(6)
9.458(4)
α [°]
90.00
β [°]
107.018(8)
γ [°]
90.00
87.721(10)
84.866(10)
78.896(10)
Zellvolumen [Å3]
2405.7(14)
600.2(4)
Z
4
1
Unabhängige Reflexe
1595
1472
Beobachtete Reflexe
1290
1157
Parameter
158
154
R1
0.0482
0.0627
wR2
0.1399
0.1883
Meßtemperatur [°C]
- 70
- 70
mit I > 2σ(I)
3. Beschreibung der Ergebnisse
52
In der Molekülstruktur von 24 ist erkennbar, daß die benzylständigen Dipyridylphosphinogruppen in trans-Stellung zueinander angeordnet sind, was die sterische Abstoßung dieser Gruppen untereinander minimiert.
Abb. 21: Molekülstruktur von 24 im Kristall
Tab. 21: Ausgewählte Abstände (Å) und Winkel (°) in 24
Abstände
Winkel
P1-C2
1.851(3)
C2-P1-C6
102.2 (1)
P1-C9
1.858(3)
C2-P1-C9
98.5 (1)
P1-C6
1.857(3)
C6-P1-C9
100.9 (1)
C3-C6-P1
109.1(2)
ΣP1
301.6
Die P-C-Bindungen entsprechen mit 1.85 – 1.86 Å den Werten, die für
Py2PC2H4PPy2 gefunden wurden.[92] Auch die Winkelsumme am P-Atom ist mit 301°
denen in Py2PC2H4PPy2 und 23 mit 302° bzw. 300° annähernd identisch.
Ähnlich wie auch in 23 stehen die N-Zentren in 24 auf der den freien Elektronenpaaren der P-Atome abgewandten Seite. Der Winkel C3 - C6 - P1 am Benzyl-C-Atom
3. Beschreibung der Ergebnisse
53
entspricht mit 109.1° dem idealen Tetraederwinkel. Der Diederwinkel zwischen dem
Phenylring und der C6-P1-Bindung beträgt 81°.
Auch in 25 sind die Dipyridylphosphangruppen an der Xylyliden-Brücke trans zueinander angeordnet, wobei das Molekül ein kristallographisches Inversionszentrum
besitzt. Die C-P-Abstände sind mit denen in 24 und Py2PC2H4PPy2 identisch.[92]
Abb. 22: Molekülstruktur von 25 im Kristall
Tab. 22: Ausgewählte Abstände (Å) und Winkel (°) in 25
Abstände
Winkel
P1-C1
1.840(5)
C1-P1-C6
98.2(2)
P1-C6
1.842(5)
C1-P1-C11
100.3(2)
P1-C11
1.854(4)
C6-P1-C11
102.7(2)
C12-C11-P1
111.0(3)
ΣP1
301.2
Anders als in 23 und 24 ist nur jeweils einer der Pyridylringe so angeordnet, daß das
N-Atom auf der dem freien Elektronenpaar am Phosphoratom entgegengesetzten
Seite steht. Der zweite Pyridylring ist so gedreht, daß die Atome dieses Ringes, das
P1- und das Benzyl-C-Atom in einer Ebene liegen, die gegenüber dem Phenylring
um einen Diederwinkel von 56.5° verdreht ist. Eine ähnliche Anordnung findet sich
bei Py2PC2H4PPy2.
3. Beschreibung der Ergebnisse
54
Auch in 25 unterscheidet sich die Winkelsumme am P1-Zentrum mit 300° praktisch
nicht von denen in 23, 24 und Py2PC2H4PPy2.
3.2.4 Synthese von [Cu(ortho-(PyPCH2)2C6H4)2](OTf) 55
Cu(I)-trifluormethylsulfonat reagiert mit zwei Äquivalent 24 in CH2Cl2 zu einer farblosen Reaktionsmischung, in der nach einigen Tagen 55 in Form farbloser Kristalle
erhalten wurde. Die Verbindung wurde durch Multikern-NMR-Spektroskopie, C,HAnalyse und eine Einkristallröntgenstrukturanalyse charakterisiert. Ein aussagekräftiges Massenspektrum konnte mit keiner der erprobten Ionisationsarten (FAB, EI) erhalten werden.
Tab. 23: NMR-Daten von 57 (CDCl3, RT)
55
31
P-NMR (101.3 MHz)
1
H-NMR (250 MHz)
Das
- 2.9 (s); w1/2 = 22.0 Hz
CH2
3.8 (s, 4H)
C6H4
6.5 (m, 4H)
5
H
7.0 (tm, 4H)
(Lsm.)
7.29 (s)
H3
7.3 (m, 4 H)
H4
7.4 (m, 4 H)
H6
8.5 (s, 4 H)
P-NMR-Spektrum von 55 zeigt ein verbreitertes Singulett bei δ = - 2.9 (w1/2 =
31
22.0 Hz). Die starke Verbreiterung des Signals ist wie in den anderen Cu(I)Komplexen 26 und 29 auf den signalverbreiternden Effekt der hohen QuadrupolMomente der
63/65
Cu-Kerne zurückzuführen. Zudem zeigt diese Veränderung gegen-
über dem scharfen Signal des freien Liganden die Koordination aller P-Atome an das
Metall an.
Die chemische Verschiebung des
31
P-NMR-Signals liegt in einem ähnlichen Bereich
wie die für [Cu(dppe)2]+ (dppe = Bis(diphenylphosphino)ethan) und [Cu(dppp)2]+
(dppp = Bis(diphenylphosphino)propan) gefundenen Werte von δ = 7.5 bzw.
δ = - 8.5.[100]
3. Beschreibung der Ergebnisse
55
Die 1H-NMR-Spektren gleichen im wesentlichen denen des freien Liganden, Die Signale sind allerdings ebenfalls verbreitert und weisen eine Halbwertsbreite von etwa
w1/2 ≈ 20 Hz auf. Tabelle 23 faßt die NMR-Daten von 55 zusammen.
3.2.5 Molekülstruktur von 55
In CH2Cl2 konnten Kristalle von 55 erhalten werden, die für eine Einkristallröntgenstruktur geeignet waren. Die kristallographischen Daten sind mit weiteren Angaben
zur Strukturbestimmung in Tabelle 24 zusammengefaßt.
Tab. 24: Kristallographische Daten und Angaben zur Strukturbestimmung von 57. Z = Anzahl der
Moleküle pro Elementarzelle
Zellvolumen [Å3]
2926.8(2)
Kristallsystem monoklin
Z
6
a [Å]
15.140(5)
Unabhängige Reflexe
4899
b [Å]
11.131(4)
Beobachtete Reflexe
3625
c [Å]
18.619(7)
mit I > 2σ(I)
α [°]
90.00
Parameter
343
R1
0.1215
wR2
0.3401
Meßtemperatur [°C]
- 70
Raumgruppe
β [°]
γ [°]
P2n
111.134(7)
90.00
Bei 55 erfolgte die Verfeinerung der Strukturen für die Nicht-Wasserstoffatome anisotrop. Die H-Atome sind in den berechneten Lagen isotrop in die Verfeinerung eingegangen. Die geringe Güte der Röntgenstrukturanalyse ist auf eine Orientierungsfehlordnung des CF3SO3--Anions zurückzuführen. Das Ergebnis der durchgeführten
Röntgenstrukturanalyse ist zur besseren Übersicht ohne H-Atome in Abbildung 23
dargestellt. Ausgesuchte Bindungslängen und -winkel sind in Tabelle 25 zusammengefaßt.
In 55 ist das Cu-Atom von zwei Molekülen 24 umgeben, wobei nur die P-Zentren koordinieren. Die tetraedrische Koordinationsgeometrie des Cu-Atoms ist dabei merklich verzerrt. Die symmetrieäquivalenten P1A- und P2A-Zentren werden durch eine
zweizählige Drehachse und eine Gleitspiegelung erzeugt. Die siebengliedrigen
3. Beschreibung der Ergebnisse
56
Cu4P2Cu-Ringe, die von den Chelatliganden aufgespannt werden, liegen in der thermodynamisch bevorzugten Sesselkonformation vor. Bisher sind Metallacyclen dieser
Größe an Cu-Zentren nicht bekannt
Abb. 23: Molekülstruktur von 57 im Kristall
Tab. 25: Ausgewählte Abstände (Å) und Winkel (°) in 57
Abstände
Winkel
Cu1-P1
2.267(2)
P1-Cu1-P2
105.93(7)
Cu1-P2
2.282(2)
P1-Cu1-P2A
108.54(7)
P1-C1
1.865(7)
P1-Cu1-P1A
123.51(1)
P1-C9
1.826(8)
P1A-Cu1-P2A
105.93(7)
P1-C15
1.825(8)
P2-Cu1- P1A
108.54(7)
P2-C27
1.833(8)
P2-Cu1-P2A
102.52(1)
P2-C21
1.848(8)
P2-C8
1.850(7)
3. Beschreibung der Ergebnisse
57
Die intracyclischen Winkel P1-Cu-P2 und P1A-Cu-P2A sind symmetriebedingt identisch und weisen einen Wert von 105.9° auf. Diese Winkel sind kleiner als der ideale
Tetraederwinkel wie er in Cu(I)-Komplexen mit einzähnigen Phosphanliganden gefunden wird. Hierzu zählen z. B. [Cu(PPh3)4](ClO4)[105]
[106]
(X = Cl, Br, I),
und [Cu(PMe3)4]X
welche Abweichungen vom idealen Tetraederwinkel von unter
2°aufweisen.
Die im Vergleich zu 55 kleineren endocyclischen P-Cu-P-Winkel in Chelatkomplexen
wie [Cu(dppe)2]+ (90.4°) und [Cu(dppp)2]+ (97.8°) (dppe = Bis(diphenylphosphino)ethan, dppp = Bis(diphenylphosphino)propan) sind auf die Ausbildung kleinerer fünfund sechsgliedriger Chelat-Metallacyclen zurückzuführen.[100] Die Tendenz zur Aufweitung des endocyclischen P-Cu-P-Winkels mit zunehmender Ringgröße ist offensichtlich. Der Wert des entsprechenden Winkels von 105.93° in 55 steht mit dieser
Beobachtung im Einklang. Die geringere Flexibilität der rigiden, ungesättigten Kohlenwasserstoffkette zwischen den P-Atomen in 55 läßt einen Vergleich mit solchen
Liganden, die gesättigte Brücken tragen, allerdings nur bedingt zu.
Die Verzerrung der exocyclischen P1-Cu1-P1A- (123.51°) und P2-Cu1-P2A-Winkel
(102.52°) ist vermutlich auf die Verdrehung der beiden Chelatringe zueinander zurückzuführen.
Offensichtlich
bewirkt
die
Abstoßung
zwischen
den
Pyridyl-
Substituenten der Liganden diese Verzerrung. Die Cu-P-Bindungslängen betragen
2.27 Å bzw. 2.28 Å. Die Cu-P(Chelat)-Abstände in verwandten Verbindungen wie
[Cu(PMe3)4][CuMe2][107], [Cu(dmpe)2]22+ (dmpe = Bis(dimethylphosphino)ethan),[108]
[Cu(c-dppee)2]+ (c-dppee = cis-Bis(diphenylphosphino)ethen)[107] und [Cu(dppe)2](ClO4)[108] ähneln denen in 55. Auch die in 55 gefundenen P-C-Bindungslängen von
1.824 Å bis 1.864 Å liegen im erwarteten Bereich.
3.2.6 Reaktionen von 25 mit Metallsalzen
3.2.6.1 Reaktion mit CuI
Bei der Reaktion von 25 mit CuI in CH3CN/Ethanol wurde eine gelbe Lösung erhalten, aus der ein gelber, luft- und hydrolyseempfindlicher Niederschlag 56 ausfiel, der
in CH2Cl, Ethanol und CHCl3 mäßig löslich ist. Die elementare Zusammensetzung
des Niederschlages ist mit der Formel [CuI(25)] in Einklang. Ein aussagekräftiges
3. Beschreibung der Ergebnisse
58
Massenspektrum wurde mit keiner der erprobten Ionisierungsarten (EI, FAB) erhalten. Trotz mehrfacher Kristallisationsversuche konnten bisher keine für eine
Einkristallröntgenstrukturanalyse geeigneten Kristalle erhalten werden.
Tab. 26: NMR-Daten von 58 (CDCl3, RT)
25
31
0.4 (s); w1/2 ≈ 20 Hz
P-NMR (101.3 MHz)
1
H-NMR (250 MHz)
CH2
4.05 (s, 4H)
C6H4
6.25 (s, 2H)
6.60 (s, 2H)
H5
7.15 (m, 4H)
(C6D6)
7.29 (s)
H3
7.30 (m, 4 H)
4
H
7.40 (m, 4 H)
H6
8.35 (s, 4 H)
H4
Numerierungsschema für 56:
H5
P
H6
Das
H3
R
N
2
P-NMR-Spektrum der Verbindung zeigt ein verbreitertes Singulett bei δ = 0.4
31
(w1/2 ≈ 20 Hz), was auf eine Koordination der P-Atome an das Metall hinweist. Die
starke Verbreiterung ist wie in 55 auf das starke Quadrupolmoment der
63/65
Cu-
Kerne zurückzuführen. Das 1H-NMR-Spektrum ähnelt dem von 25. Allerdings weisen
die Signale im Spektrum von 55 eine Halbwertsbreite von etwa w1/2 ≈ 20 Hz auf. Die
Verbreiterung der Signale liegt in der selben Größenordnung wie für die anderen hier
beschriebenen Cu(I)-Komplexe.
Der markanteste Unterschied zum Spektrum des freien Liganden ist, daß die Protonen am Xylylidenring nicht mehr magnetisch äquivalent sind. Dieser Effekt ist bei einer Koordination der P-Atome auch zu erwarten. Die Signale der H-Atome am Xylylidenring liegen bei δ = 6.25 bzw. 6.6.
3. Beschreibung der Ergebnisse
59
Das Signal für die H6-Atome an den Pyridylringen zeigt mit δ = 8.35 praktisch dieselbe Verschiebung wie im freien Liganden 25 (δ = 8.23). Eine Koordination der PyridylN-Atome kann so zwar nicht ausgeschlossen werden, ist aber unwahrscheinlich. Eine Tieffeldverschiebung des Signals des H6-Atoms kann als Hinweis für eine NKoordination am Pyridylrest gewertet werden.[55] Die NMR-Daten von 56 sind in Tabelle 26 zusammengefaßt.
Mit den bisher vorliegenden Ergebnissen kann nicht eindeutig bestimmt werden, ob
es sich bei 56 um ein Dimer der Zusammensetzung [Cu2I2(25)2] oder um ein Oligomer handelt. Auch kann eine Koordination der Pyridyl-N-Atome nicht zweifelsfrei
ausgeschlossen werden. Die Signale der H6-Kerne in 26 und 55 sind ebenfalls kaum
gegenüber denen des freien Liganden verschoben, obwohl die N-Koordination durch
eine Röntgenstrukturanalyse nachgewiesen ist.
3.2.6.2 Reaktion von 25 mit CoCl2
Bei der Reaktion von 25 mit CoCl2 in CH2Cl2 wurde ein schwer löslicher intensiv
blauer Niederschlag der Zusammensetzung [(CoCl2)2(25)] erhalten. Ein aussagekräftiges Massenspektrum wurde mit keiner der erprobten Ionisierungsmethoden (FAB,
EI) erhalten. Die Lösungen ergaben wegen der paramagnetischen Co(II)-Kerne (d7)
keine aussagekräftigen NMR-Spektren. Wie sich aus der Struktur der Verbindung 30
vermuten läßt, ist eine reine N, N‘-Koordination der Pyridyl-N-Atome denkbar. Eine
solche Anordnung kann aber anhand der bisher vorliegenden Ergebnisse nicht bestätigt werden, da trotz mehrfacher Kristallisationsversuche noch keine für eine Einkristallröntgenstrukturanalyse geeigneten Kristalle erhalten wurden.
Die bisher erhaltenen Ergebnisse zeigen, daß die einfach zugänglichen pyridylsubstituierten Oligophosphane ein großes Synthesepotential besitzen und daß die Koordinationschemie dieser Verbindungen ein interessantes und vielversprechendes Gebiet für weitere Untersuchungen darstellt.
3. Beschreibung der Ergebnisse
60
3.3 Synthese und Reaktionen eines funktionalisierten flexiblen Triphosphans
3.3.1 Kenntnisstand
Einen anderen, mehrzähnigen Ligandentyp, der eine Fülle von verschiedenen Koordinationsmöglichkeiten aufweist, stellen die linearen Triphosphane der Formel
RP(C2H4PR‘2)2 dar, in denen die Phosphorzentren jeweils durch eine Ethylenbrücke
miteinander verbunden sind. Eine Fülle von Verbindungen mit verschiedensten Substituenten R und R‘ sind bekannt. In den meisten Fällen handelt es sich dabei um
Alkyl- oder Arylreste wie Methyl- oder Phenylgruppen.[109, 110] Der wohl bekannteste
Ligand dieses Typs ist der auch kommerziell erhältliche Ligand TRIPHOS
PhP(C2H4PPh2)2. Doch auch Verbindungen reaktiverer Natur am Phosphor wie
PhP(C2H4PH2)2,[111] PhP(C2H4P(N(CH3)2)2 oder PhP(C2H4P(OCH3)2)2[14] sind bekannt.
Erst kürzlich stellten Katti et al. mit dem hydroxymethylsubstituierten Triphosphan
PhP(C2H4P(CH2OH)2)2 einen wasserlöslichen Liganden dieses Typs vor.[112]
Als „zwei Triphosphane in einem“ können Verbindungen wie das von Stanley et al.
1985 erstmals synthetisierte CH2(P(C2H4PEt2))2
1971 als Ligand verwendete
[113]
und das von King et al. bereits
Oligophosphan (CH2)2(P(C2H4PEt2))2
[114]
aufgefaßt
werden.
Die Synthese des Grundgerüsts beinhaltet als zentralen Schritt eine Hydrophosphinierung einer Vinyl-Phosphan- oder Vinyl-Phosphonat-Komponente an ein primäres
oder sekundäres Phosphan.[110]
(EtO)2PO
+ 2 H2PR
PR
KH
(EtO)2PO
PR
LiAlH4
(EtO)2PO
H2P
PH2
+ 4 BuLi
R = Ph, NEt2
+ 4 XR'
- 4 LiX
R' = Alk, Ph
PR
X = Halogen
KH
RP
+ 2 HPR'2
R'2P
R'2P
Triphosphane dieses Typs können am Metallzentrum als einzähnige, zweizähnige
oder dreizähnige Liganden binden. Weiterhin ist die Möglichkeit der verbrückenden
3. Beschreibung der Ergebnisse
61
Koordination gegeben. Eine Reihe von TRIPHOS-Komplexen mit Übergangsmetallzentren in verschiedenen Koordinationsmodi wurde bereits 1971 von King et al. hergestellt und beschrieben.[115] Die Verbindungen wurden aber nicht strukturell charakterisiert.
PPh2
Ph
Ph2P
P
PPh2
NNH2
PPh2
PhP
M
Mo
Cl
PPh3
PhP
Cl
Cr
Cl
PPh2
PPh2
CO CO CO
M = Mo: 57, M = Cr: 58
Cl
59
60
Bei dreizähniger Koordination bestimmt zunächst die Koordinationsgeometrie des
Metalles die Anordnung des Liganden. Doch auch hier bieten sich verschiedene
Möglichkeiten. So ist im oktaedrischen Mo(0)-Komplex [Mo(CO)3(TRIPHOS)] 57
ebenso wie in der analogen Cr(0)-Verbindung 58 der dreizähnige Ligand facial angeordnet,[116] während in [MoCl(NNH2)(TRIPHOS)(PPh3)]+ 59 eine meridionale Anordnung der Triphosphan-Donatoratome am oktaedrisch koordinierten Mo(III)-Zentrum
vorliegt.[11] Der Cr(III)-Komplex [CrCl3TRIPHOS] 60 zeigt ebenfalls eine meridionale
Koordination des dreizähnigen Liganden,[117] so daß für die Metalle der Gruppe 6 offensichtlich eine Abhängigkeit der Anordnung der Triphosphanliganden von der Oxidationsstufe des Metalls vorzuliegen scheint.
2+
CN
PPh2
PPh2
PhP
Ni
X
PPh2
X = Cl: 61a, X = I: 61b
PhP
Ni
CN
PPh2
62
Bei der Reaktion von TRIPHOS mit Ni(II)-Halogeniden wird eines der Anionen aus
der Koordinationssphäre des Metalls verdrängt, so daß sich ein einfach positiv geladenes Komplexkation [NiX(TRIPHOS)]+ (X = Cl, I) 61a - b bildet, das eine quadra-
3. Beschreibung der Ergebnisse
62
tisch planare Geometrie aufweist.[118] Anders verhält sich der von Stanley et al. 1993
vorgestellte Komplex [Ni(CN)2(EtP(C2H4PPh2)2)] 62,[119] der eine verzerrt trigonal pyramidale Koordination am Ni-Zentrum aufweist, bei der der Triphosphanligand in facialer Anordnung vorliegt.
Ebenfalls Fünffach-Koordination an einem Metall der
Gruppe 10 zeigt [Pt(CN)2(TRIPHOS)], während [PtCl(TRIPHOS)]Cl[120] die gleiche
quadratisch planare Anordnung aufweist wie das analoge 61a.
In den letzten Jahren wuchs das Interesse an wasserlöslichen Phosphankomplexen,
die besonders interessante Eigenschaften für Katalysereaktionen in wässrigen oder
Zweiphasensystemen haben.[121] Dies kann in den hier betrachteten Triphosphanen
durch Variation der Reste R an den P-Zentren erreicht werden. Es können entweder
die Reste an den äußeren P-Zentren durch Hydroxyalkyl- oder Aminoreste ersetzt
werden wie in [MCl(Ph(C2H4P(CH2OH)2)2]z+ (M = Pd, Pt, Rh)[122] und [Pd(CH3CN)(Ph(C2H4P(NMe2)2)2]2+ oder auch am mittleren P-Atom wie in [Pd(CH3CN)(RP(C2H4PEt2)2]2+ (R = NMe2, C3H6OH).[15] Diese Komplexe zeigen alle quadratisch
planare Koordination am Metallzentrum.
Die gleiche quadratisch planare Geometrie wie in 61a besitzt der analoge Rh(I)Komplex [RhCl(TRIPHOS)] 63 ,[123] der bei Reaktion mit CpNa (Cp = Cyclopentadienyl) zu [Rh(µ5-Cp)(P, P‘-TRIPHOS)] 64 reagiert. Die Weiterreaktion mit einem weiteren Äquivalent 63 zu [Rh(µ5-Cp)(µ2,η-TRIPHOS)Rh(µ3-TRIPHOS)]+ zeigt eindrucksvoll die Variationsbreite dieses Ligandentypus.
+
PPh2
CpNa
PhP
Rh
Cl
- NaCl
PPh2
63
+ 65
+ NaBPh4
Rh
Ph2P
P
PPh2
- NaCl
Ph2P
Rh
Ph2P
Ph
64
P Ph2P
Ph
Rh
PPh BPh4
Ph2P
65
Eine ähnlich chelatisierend-verbrückende Koordination wie 65 weisen auch die 1995
von Ueng et al. charakterisierten gemischten Komplexe der Gruppe 6 [M(CO)3(µ2,ηTRIPHOS)M‘(CO)5] (M = Cr, Mo; M‘ = Cr, Mo, W) auf.[124]
1991 wurden von DuBois et al. und Hart et al. unabhängig voneinander zweikernige
Komplexe ähnlicher Konfiguration vorgestellt, in denen das Triphosphan als zweizähniger und als verbrückender Ligand gleichzeitig koordiniert. Es entstehen die
Verbindungen [Pd(TRIPHOS)]22+ 66[125] und [CuCl(TRIPHOS)]2 67.[126]
3. Beschreibung der Ergebnisse
63
Ph
2+
Ph
P
PPh2
Pd
Pd
P
PPh2
Cu
Cu
Cl
Ph2P
Ph2P
PPh2
PPh2
Cl
Ph2P
P
Ph2P
P
Ph
Ph
66
67
Die quadratisch-planare Koordinationsgeometrie der Pd-Zentren in 66 ermöglicht
eine Annäherung der Metallatome auf 2.62 Å und damit die Ausbildung einer Pd-PdBindung. Die Cu(I)-Zentren in 67 dagegen sind verzerrt tetraedrisch umgeben. Dies
führt dazu, daß die gesamte Geometrie der Verbindung gegenüber der des PdKomplexes derart verändert ist, daß die Cu-Zentren einen deutlich weiteren Abstand
voneinander aufweisen und keine Cu-Cu-Bindung ausbilden.
Die Kombination zweier Triphosphaneinheiten in einem Hexaphosphan des Typs
(CH2)n(P(C2H4PR2))2 (R = Et, Ph; n = 1, 2) erlaubt die Koordination zweier dreizähnig
chelatgebundener Metallzentren in einem Molekül.[113] Dabei können verschiedene
Konformationen A - C eingenommen werden. Die sogenannte „geschlossene“ Konformation A liegt nur selten vor, während die „offenen“ Formen B und C, in denen die
Metallzentren 4 bis 7 Å Abstand zueinander haben, die „Regel“ sind.[127]
PR2
M
R2 P
R2 P
M
M
P
P
PR2
PR2
M
R 2P
M
P
P
R 2P
A
PR2
PR2
P
P
PR2
R2 P
R2 P
B
M
C
Einen weiteren, ungewöhnlichen Koordinationsmodus zeigt das von Stanley et al.
1987 hergestellte [Cr2Cl6(CH2(PC2H4PEt2)2] 68, in dem die einzelnen Triphosphaneinheiten verbrückend koordinieren.[128] Ueng et al. stellten 1997 den Sechskernkomplex 69 vor, in dem alle sechs P-Zentren des Hexaphosphanliganden jeweils
ein {W(CO)5}-Fragment tragen.[129]
3. Beschreibung der Ergebnisse
Et2P
PEt2
Cl
Cl Cr
Cl
64
P
P
((CO)5W)PEt2
Cl
Cr Cl
P
((CO)5)W(Et2P)
Cl
Et2P
W(CO)6
Et2P(W(CO)5)
P
W(CO)6
PEt2
68
Et2P(W(CO)5)
69
So vielfältig die Koordinationschemie dieser Triphosphane mit Alkyl- und Arylgruppen
als Substituenten an den P-Zentren ist, so wenig wurden Verbindungen dieses Typs
untersucht, die als Substituenten an den äußeren P-Atomen funktionelle Gruppen
tragen und so eine weitere Derivatisierung am P-Zentrum zulassen. King et al. charakterisierten 1977 eine Reihe von Triphosphanen des hier beschriebenen Typs mit
NMe2- und OMe-Gruppen an den terminalen P-Atomen.[14]
2+ Die einzigen bisher beschriebenen Komplexe von
P(NMe2)2
funktionalisierten Triphosphanliganden sind die
von King und Bibber 1982 durch C, H-Analyse,
PhP
Pd
NCCH3
UV/Vis- und IR-Spektroskopie charakterisierten
Verbindungen [MCl(RP(C2H4P(OMe)2)2)]+ (R = Ph,
Me; M = Ni, Fe, Co)[130] und der 1995 von DuBois
P(NMe2)2
et al. synthetisierte Pd(II)-Komplex 70.[15]
72
Lineare Triposphane mit anderen Substituenten an
den terminalen P-Atomen wie Silylgruppen sind bisher nicht bekannt.
Komplexe mit silylsubstituierten Phosphanliganden sind allerdings rar. Zu den weni[131]
gen bekannten Silylphosphankomplexen zählen z. B. [(Fe(CO)4P(SiMe3)3],
[TiCl3(P(SiMe3)2)],[132] [VOCl2(P(SiMe3)2)]
[133]
und der durch eine Insertion von
Phenylacetylen in eine Zr-P-Bindung entstandene Metallacyclus 73.[134]
Cl
Cl
PhCCH
Cp2Zr
Cp2Zr
P(SiMe3)2
P(SiMe3)2
Ph
H
73
Nachdem Stelzer et al. 1977 die Synthese eines Tetracarbonylmolybdänkomplexes
eines 1,4-Diphospha-2,3,5,6-tetrasila-cyclohexan-Derivates gelang,[135] der auch von
West et al. kristallographisch untersucht wurde,[136] konnten in den 90er Jahren in
3. Beschreibung der Ergebnisse
65
unserer Arbeitsgruppe eine Reihe von Komplexen mit Silaphosphacyclen als Liganden hergestellt werden.
M(CO)3
P
Cy
R
Si
P
Cy
R
Si
H
H
(CO)3
Mo
P
Cy
Si
S
R
Cy P
Si
Me2
Me2 Si
H
72a
72b
72c
R
Mes
Ph
Ph
M
Mo
Mo
Cr
P
Si
Me2
P
Si
Me2
Cy
SiMe2
Si
Me2
Cy
73
Hierzu gehören Komplexe der Triphosphatrisilacyclohexanderivate 72a - c,[137, 138, 139]
und der Mo-Komplex des 1,4,7-Triphosphahexasilacyclononans 73.[140,
141]
Das die-
sem Liganden analoge organische 1,4,7-Triphosphacyclononan konnte erst 2000
von Edwards et al. in einer Templatsynthese im Form des Fe-Komplexes 74 erstmals
hergestellt werden.[142]
H
Me
Si
H
Cy
Me
Si
P
Cy
P
Fe+
P
P Cy
P TfO
Me
H
P
P
H
M
M
Si
Si
Me
OTf
P
Cy
Cy
P
Si
Me
74
Si
Cy
H
Me
H
M = Cu: 75, Ag: 76
Mit der Herstellung von 75 und 76 gelang ebenfalls in unserer Arbeitsgruppe die erste Synthese eines Silylposphankomplexes eines Münzmetalls, der einen außergewöhnlichen Si6P6-Ring als Liganden aufweist.[140,141]
3. Beschreibung der Ergebnisse
66
3.3.2 Synthese von [Mo(CO)3(PhP(C2H4PH2)2)] 77
Das einfachste Phosphan des Typs PhP(C2H4PR2)2 (R ≠ Alkyl, Aryl) ist das
PhP(C2H4PH2)2 78, das bereits 1973 von King et al. hergestellt wurde.[111]
Bei der Reaktion von [Mo(CO)3(CH3CN)3] mit 78 in CH3CN wurde ein farbloser Feststoff erhalten, der in keinem gängigen organischen Lösemittel löslich ist. Durch die
Anfertigung eines EI-Massenspektrums konnte das Produkt als [(PhP(C2H4PH2)2)Mo(CO)3] 77 identifiziert werden. Das Molekülion zeigt ein Signal mit einer relativen
Intensität von 5% bei m/z = 412, dessen Isotopenverteilung gut mit der erwarteten
übereinstimmt. Weitere Fragmentionen ergeben sich durch sukzessive Abspaltung
von CO und Fragmentierung des Phosphanliganden. Das Massenspektrum von 77
ist in Abbildung 34 schematisch dargestellt.
Im IR-Spektrum erhält man für die PH-Streckschwingungen eine Bande bei
νPH = 2262 cm-1. Aufgrund der lokalen C3v-Symmetrie am Mo-Zentrum finden sich
zwei Banden für die CO-Streckschwingungen bei ν = 1950 und 1872 cm-1. Diese
Befunde sind im Einklang mit den für [(CyPH2)3Mo(CO)3] gefundenen Werten[140] und
bestätigen die Koordination aller drei P-Atome an das Mo-Zentrum.
M+
- CO
- CO - 2 H
384 (3,%)
- CO - 2 H
324 (6%)
354 (6%)
- C2H4
-P
160 (4%)
191 (5%)
- C6H5
268 (7%)
- C2H4
296 (5%)
77 (3%) C6H5
28 (100%) CO, C2H4
Abb. 24: Schematische Darstellung des Massenspektrums von 79
Da eine Weiterreaktion von Komplexen mit PhP(C2H4PH2)2 78 wegen der Unlöslichkeit nicht möglich war, sollten nun die P-ständigen H-Atome durch Substituenten ersetzt werden, die eine bessere Löslichkeit versprechen. Es sollte andererseits aber
auch die Möglichkeit gegeben sein, diese Substituenten möglichst schonend zu substituieren. Hier bot sich der Trimethylsilylrest am Phosphoratom an, der diese Anforderungen erfüllen sollte.
3. Beschreibung der Ergebnisse
67
3.3.3 Synthese von PhP(C2H4P(SiMe3)2)2 79
Durch Lithiierung von 78 und anschließende Reaktion mit Chlortrimethylsilan konnte
81 in guter Ausbeute von 81% erhalten werden. Es stellte sich dabei heraus, daß
eine zweifache Umsetzung mit jeweils zwei Äquivalent BuLi und Chlortrimethylsilan
in THF zu besseren Ausbeuten und sauberen Produkten führt als einstufige Variante
mit vier Äquivalent der Reagentien, da die vierfach lithiierte Zwischenstufe nicht löslich ist. Wie
31
P-NMR-spektroskopisch zu erkennen war, entsteht als Zwischenpro-
dukt nicht einheitlich das symmetrisch bis(monosilylierte) Produkt, sondern ein nicht
trennbares Produktgemisch. Dies ist auf eine inter- und intramolekulare Umlithiierung
der P-Zentren untereinander während der Reaktion zurückzuführen.[140]
81 wurde als luft- und hydrolyseempfindliches farbloses Öl mit einem Siedepunkt von
187 - 190°C / 6·10-2 mbar erhalten, das an der Luft zur Selbstentzündung neigt. Es
wurde durch Multikern-NMR-Spektroskopie und Massenspektrometrie charakterisiert.
Tab. 28: NMR-Daten für 81 (CDCl3, RT)
81
31
P{1H}-NMR
P(SiMe3)2
-165.0 (d)
3
(CDCl3, 101.3 MHz)
JPP = 26.3 Hz
PhP
-16.2
(t)
3
JPP = 26.3 Hz
31
P(SiMe3)2
(CDCl3, 101.3 MHz)
PhP
1
Si(CH3)3
P-NMR
H-NMR
-165.0 (m)
-16.2 (m)
0.27 (d, 36 H)
3
(CDCl3, 250 MHz)
JP-H = 4.4 Hz
PCH2CH2P
1.0 – 2.2 (m,)
p/o-H, Ph
7.20 (m, 3H)
m-H, Ph
7.65 (t, 2H)
3
JH-H = 7.5 Hz
Im
31
P-NMR-Spektrum von 81 zeigen sich zwei Multipletts mit chemischen Verschie-
bungen von δ = - 16.2 und - 165.0.
3. Beschreibung der Ergebnisse
68
Die starke Hochfeldverschiebung von δ = - 165 ist typisch für disilylsubstituierte
Phosphane und fast identisch mit der Verschiebung von δ = - 164 für (Me3Si)2PC2H4P(SiMe3)2.[143] Die chemische Verschiebung des phenylsubstituierten P-Atoms ist
erwartungsgemäß gegenüber dem Edukt (δ = - 20.7) nur unwesentlich verändert.[111]
Im
P{1H}-NMR-Spektrum ist das Signal bei δ = - 16.2 zum Triplett, das bei
31
δ = - 165.0 zum Dublett mit einer Kopplungskonstante von jeweils 3JPP = 26.3 Hz
aufgespalten. Ähnliche Werte werden für PhP(C2H4P(CH2OH)2)2 (28 Hz)[122],
PhP(C2H4P(OCH3)2)2 (26 Hz) und verwandte Verbindungen gefunden.[14]
Detaillierte Angaben zu den NMR-Spektren von 81 sind in Tabelle 28 zusammengefaßt.
Im EI-Massenspektrum findet sich das Signal des Molekülions M+ bei m/z = 518 mit
einer relativen Intensität von m/z = 1%. Weitere Fragmentionen sind in Abbildung 25
schematisch dargestellt.
M+ (1%)
- SiMe3
- CH3
445 (1%)
503 (5%)
-SiMe3
- CH3
372 (2%)
488 (3%)
-SiMe3
299 (2%)
- CH3 - H
472 (6%)
- Ph - H
221 (15%)
147 (100%) [P(EtP)2 - 2 H]
75 (75%)
[C6H5 - 2 H]
73 (69%)
SiMe3
Abb. 25: Schematische Darstellung des Massenspektrums von 81
3. Beschreibung der Ergebnisse
69
3.3.4 Synthese von [(CO)3M (PhP(C2H4P(SiMe3)2)2)] (M = Cr: 80, M = Mo: 81) und
[(CO)3M(PhP(C2H4P(SiMe3)(C2H4PHSiMe3)] (M = Cr: 82, M = Mo: 83)
Zur Untersuchung des Koordinationsverhaltens vom 81 wurden verschiedene Reaktionen mit Mo- und Cr-Tricarbonylkomplexen und 81 durchgeführt. [Cr(CO)3C7H8],
[Mo(CO)3Mes] wie auch [Mo(CO)3(CH3CN)3] reagieren hierbei in gleicher Weise, wobei das Lösemittel keinen Einfluß auf das zunächst erhaltene Produkt hat. Es wurden
31
sowohl in Hexan und THF wie auch in CH3CN identische
P-NMR-Spektren der Re-
aktionsmischungen erhalten.
Man erhält als Niederschläge die Komplexe 82 und 83, die durch Massenspektrometrie, IR- und Multikern-NMR-Spektroskopie charakterisiert wurden.
Tab. 29: NMR-Daten für 82 und 83 (C6D6, RT)
31
P{1H}-NMR P(SiMe3)2
82
83
- 81.3 (d)
- 102.2 (d)
3
JPP = 10 Hz
3
JPP = 4 Hz
108.7 (t)
PhP
31
P-NMR
1
3
(t)
JPP = 4 Hz
P(SiMe3)2
- 81.3 (m)
- 102.2 (m)
PhP
108.7 (m)
88.6 (m)
0.4 (d, 18 H)
0.3 (d, 18 H)
3
3
0.5 (d, 18 H)
0.5 (d, 18 H)
3
3
PCH2CH2P
1.0 - 2.2 (m,)
1.0 - 2.2 (m,)
p/m-H, Ph
7.6 (m, 3H)
7.4 (m, 3H)
o-H, Ph
7.7 (m, 2H)
7.8 (m, 2H)
Si(CH3)3
H-NMR
JPP = 10 Hz
88.6
3
JP-H = 4.5 Hz
Si(CH3)3
JP-H = 4.5 Hz
JP-H = 4.4 Hz
JP-H = 4.4 Hz
Beide Verbindungen zeigen erwartungsgemäß zwei Signalgruppen, die gegenüber
denen des freien Liganden stark nach relativ tiefem Feld verschoben sind. In den
31
P{1H}-Spektren zeigen sich jeweils ein Triplett und ein Dublett, deren Kopplungs-
konstanten mit
3
JPP = 10 Hz für 82 bzw. 3JPP = 4 Hz für 83 erheblich kleiner als im
freien Liganden 81 (3JPP = 26 Hz) sind.
3. Beschreibung der Ergebnisse
70
Sowohl die starke Tieffeldverschiebung beider Signalgruppen gegenüber denen des
freien Liganden 81 wie auch die deutliche Abnahme der Kopplungskonstanten zeigen eine Koordination aller drei P-Zentren an das Metall an. Bei den analogen Komplexen [M(CO)3(MeP(CH2CH2PPh2)2] (M = Cr: 84, Mo: 85) finden sich Kopplungskonstanten von 3JPP = 12 Hz (84) bzw. 3JPP ≈ 6 Hz (85) gegenüber 3JPP = 22 Hz beim
freien Liganden.[144] In den 1H-gekoppelten
31
P-NMR-Spektren sind wegen der Über-
lagerung mit P-H-Fernkopplungen und der größeren Linienbreite keine Kopplungskonstanten mehr bestimmbar.
Die 1H-NMR-Spektren von 82 und 83 unterscheiden sich kaum voneinander. Tabelle
29 zeigt die Zuordnungen der Signale. Auffällig ist hier, daß die Methyl-Protonen der
Trimethylsilylgruppen zwei Dubletts zeigen, die dieselbe Kopplungskonstante von
JPP ≈ 4.4 Hz zeigen wie das entsprechende Signal im freien Liganden. Die Koordi-
3
nation P-Zentren bewirkt, daß die disilylsubstituierten P-Atome zu prochiralen Zentren und die Trimethylsilylgruppen somit diastereotop werden. Die anderen chemischen Verschiebungen der 1H-NMR-Signale entsprechen im wesentlichen denen im
freien Liganden.
Die IR-Spektren von 82 und 83 zeigen für die CO-Schwingungen zwei Banden, was
mit der lokalen C3v-Symmetrie des [M(CO)3]-Fragmentes vereinbar ist.
Tab. 30: Vergleich der νCO-Frequenzen (in cm ) von fac-L3Mo(CO)3-Komplexen
-1
vCO [cm-1]
Ref.
[(MeP(C2H4PMe2)2)Cr(CO)3]
1918, 1824
[145]
[(PhP(C2H4PPh2)2)Cr(CO)3]
1929, 1834
[115]
82
1896, 1809
diese Arbeit
(PPh3)3Mo(CO)3]
1949, 1835
[146]
[(PhP(C2H4PMe2)2)Mo(CO)3]
1926, 1831
[145]
[(PhP(C2H4PPh2)2)Mo(CO)3]
1942, 1848
[115]
[(Me4Si2PCy]3Mo(CO)3] 87
1927, 1837
[140]
83
1922, 1831
diese Arbeit
Die Wellenzahlen von ν = 1896 und 1809 cm-1 für 82 bzw. ν = 1922 und 1831 cm-1
für 83 liegen bei jeweils etwas kleineren Wellenzahlen als die für vergleichbare Komplexe gefundenen Werte mit Aryl- oder Alkylsubstituenten an den P-Atomen. Dies ist
3. Beschreibung der Ergebnisse
71
auf eine geringere π-Akzeptorfähigkeit der silylsubstituierten P-Zentren zurückzuführen. Daraus resultiert eine Stärkung der trans-ständigen M-C-Bindung und damit eine
Schwächung der C-O-Bindung. Die Verringerung der C-O-Bindungsstärke zeigt sich
im IR-Spektrum in einer Verschiebung der νCO-Absorbtionsbanden zu kleineren
Wellenzahlen.[147] Eine ähnliche Beobachtung wurde bei dem Silylphosphankomplex
[(Me4Si2PCy]3Mo(CO)3] 73 gemacht. In Tabelle 30 sind einige Ergebnisse ähnlicher
Verbindungen zusammengefaßt.
In den EI-Massenspektren von 82 und 81 sind die Signale der Molekülionen M+ mit
relativen Intensitäten von 0.5% (82) bzw. 1% (83) zu erkennen. Weitere Zerfallsfragmente sind in den Abbildungen 26 und 27 schematisch zusammengefaßt. Es fällt
auf, daß die isostrukturellen Komplexe jeweils unterschiedliche Zerfallsmuster zeigen. Hier spiegelt sich die höhere Bindungsstärke der Cr-(CO)-Bindung gegenüber
der Mo-(CO)-Bindung wider.
M+ (0,5%)
- Ph
577 (0,5%)
- SiMe3 - H
503 (1,5%)
- SiMe3 - H
429 (25%)
- SiMe3
- 2 CH3 -H
546 (3,5%)
355 (3,5%)
147 (100%) [P(EtP)2 - 2 H]
oder [PSi2Me5]
75 (78%)
[Ph - 2 H]
73 (77%)
SiMe3
28 (95%)
CO
- SiMe3
281 (3,5%)
Abb. 26: Schematische Darstellung des Massenspektrums von 82
M+ (1%)
- SiMe3
628 (1%)
- SiMe3 - CH3
539 (1,5%)
- SiMe3
-H
-CO
- CO
672 (1,5%)
-SiMe3
600 (1,2%)
- 2 CH3
669 (1,5%)
147 (55%) [P(EtP)2 - 2 H]
oder [PSi2Me5]
180 (6%)
Mo(CO)3
73 (100%) SiMe3
Abb. 27: Schematische Darstellung des Massenspektrums von 83
465 (1,5%)
3. Beschreibung der Ergebnisse
72
Beim Versuch, 82 und 81 in CH3CN umzukristallisieren, um geeignete Kristalle für
eine Einkristallröntgenstrukturanalyse zu erhalten, kristallisierten jeweils gelbliche
Kristalle. Ihre Röntgenstrukturanalyse ergab, daß es sich hierbei um die partiell hydrolisierten Verbindungen 84 und 85 handelte. Der Austausch einer Trimethylsilylgruppe durch ein H-Atom erfolgte dabei durch Reaktion mit versehentlich eingeschleppten Wasserspuren im Lösemittel. Für eine Röntgenstrukturanalyse geeignete
Kristalle von 82 und 83 konnten trotz mehrfacher Kristallisationsversuche in verschiedenen Lösemitteln bisher nicht erhalten werden.
Ph
(Me3Si)2P
Ph
P
P(SiMe3)2
M
C
O
C
O
+ H2O
(CH3CN)
(Me3Si)2P
O
M = Cr: 82, Mo: 83
PHSiMe3
M
- Me3SiOH
C
P
C
O
C
O
C
O
M = Cr: 84, Mo: 85
Neben den Einkristallröntgenstrukturanalysen wurden die Komplexe 84 und 83 durch
Massenspektrometrie, IR- und Multikern-NMR-Spektroskopie charakterisiert. Es handelt sich hier um die ersten strukturell charakterisierten asymmetrisch substituierten
Komplexe mit Di(phosphinoethyl)phosphan-Gerüst im Liganden.
Die
31
P-NMR-Spektren von 84 und 85 zeigen wie erwartet drei Signalgruppen: Zwei
Singuletts, die bei praktisch derselben chemischen Verschiebung auch in den Spektren von 82 und 83 zu finden sind, und weiterhin ein Dublett mit einer Kopplungskonstante von 1JPH = 248 Hz (84) bzw. 1JPH = 256 Hz (85). Die chemische Verschiebung
dieses Dubletts liegt für 84 bei δ = 36.1 und für 85 bei δ = - 63.8. Das
31
P-NMR-
Spektrum von 85 ist in Abbildung 28 widergegeben.
In den
31
P{1H}-NMR-Spektren sind die verschiedenen P-P-Kopplungen zu erkennen,
die im 1H-gekoppelten Spektrum wegen der größeren Linienbreite nicht aufgelöst
werden können. Es zeigen sich drei Dubletts von Dubletts, die anhand ihrer unterschiedlichen chemischen Verschiebung eindeutig zugeordnet werden können. Eine
Analyse des Spektrums ergibt die in Tabelle 31 dargestellten Werte für die jeweiligen
Kopplungskonstanten.
Auffällig ist, daß die Kopplungskonstanten zwischen den nur über das Metallzentrum
koppelnden P1- und P3-Kerne jeweils einen größeren Betrag aufweisen als die über
3. Beschreibung der Ergebnisse
73
das Metallzentrum und eine Ethylengruppe koppelnden P1/P2- und P2/P3-Kerne.
Dies ist darauf zurückzuführen, daß eine 2J-Kopplung anders als eine 3J-Kopplung
oft ein negatives Vorzeichen hat. Die aus dem Spektrum bestimmten Kopplungskonstanten für P1/P2 und P2/P3 sind daher aus zwei Kopplungen unterschiedlicher Vorzeichen zusammengesetzt. Ein Vergleich mit anderen Komplexen ist nicht uneingeschränkt möglich, da diese Verbindungen die ersten derartigen Komplexe chemisch
nicht-äquivalenten terminalen P-Zentren sind.
Tab. 31: NMR-Daten für 84 und 85 (C6D6, RT)
84
31
P{1H}-NMR P(SiMe3)2
JP3-P1a
JP3-P2a = 14.3 Hz
2
PHSiMe3
3
JP1-P3a = 29.3 Hz
2
PhP
JP2-P1a
86.0
JP2-P1a
= 23.1 Hz
JP2-P3a = 14.3 Hz
2
P(SiMe3)2
= 10.1 Hz
JP2-P3a = 5.9 Hz
-104.4 (s)
-36.1 (d)
-63.8 (d)
JPH = 248 Hz
PhP
(dd)
-82.6 (s)
1
1
JPH = 256 Hz
112.4 (s)
86.1 (s)
0.36 (d, 9 H)
0.21 (d, 9 H)
JP-H ≈ 5 Hz
JP-H ≈ 5 Hz
3
3
0.39 (d, 9 H)
0.23 (d, 9 H)
JP-H ≈ 5 Hz
JP-H ≈ 5 Hz
3
3
0.55 (d, 9 H)
0.37 (d, 9 H)
3
3
PCH2CH2P
1.0 – 2.2 (m)
1.0 – 2.2 (m)
p/m-H, Ph
7.0 – 7.2 (m, 3H)
7.0 – 7.2 (m, 3H)
o-H, Ph
8.2 (m, 2H)
8.0 (m, 2H)
JP-H ≈ 5 Hz
a
JP1-P3 a = 24.0 Hz
3
2
Si(CH3)3
JP1-P2a = 10.1 Hz
112.4 (dd)
3
Si(CH3)3
-63.8 (dd)
JP1-P2a = 23.0 Hz
2
H-NMR
JP3-P2a = 5.9 Hz
-36.1 (dd)
3
1
JP3-P1a = 24.0 Hz
= 29.3 Hz
3
2
P-NMR
-104.4 (dd)
-82.6 (dd)
3
31
85
P1 = PHSiMe3, P2 = PPh, P3 = P(SiMe3)2
JP-H = 5.6 Hz
3. Beschreibung der Ergebnisse
Abb. 28:
31
74
P-NMR-Spektrum von 85 (101.3 MHz, C6D6, RT)
Die IR-Spektren zeigen erwartungsgemäß zwei Banden für die C-O-Schwingungen,
die mit νCO = 1897 und 1810 cm-1 für 84 bzw. νCO = 1910 und 1822 cm-1 für 85 mit
denen von 82, 83 und ähnlicher Verbindungen vergleichbar sind. In den Spektren
von 84 und 85 ist zusätzlich noch eine Bande für die P-H-Streckschwingung zu erkennen. Diese Bande liegt für 84 bei νPH = 2263 cm-1 und für 85 bei νPH = 2267 cm-1.
Diese Werte liegen im selben Bereich wie die für 77 gefundenen.
M+ (1,5%)
- 3 CO - H
498 (12%)
- SiMe3
398 (5%)
- SiMe3
- 3 CO - H
510 (3%)
426 (17%)
[PhP(C2H4P)2SiMe3 -H]
147 (100%) [P(EtP)2 - 2 H]
oder [PSi2Me5]
77 (30%)
Ph
73 (43%)
SiMe3
Abb. 29: Schematische Darstellung des Massenspektrums von 84
In den Massenspektren von 84 und 83 sind die Signale der Molekülionen jeweils bei
m/z = 582 (1.5%) (84) bzw. m/z = 628 (7%) (85) zu erkennen. Weitere Fragmente
sind in den Abbildung 29 und 30 schematisch zusammengefaßt. Auch hier zeigt sich
wie in 82 und 83 die unterschiedliche M-CO-Bindungsstärke der Verbindungen in
unterschiedlichen Zerfallsmustern.
3. Beschreibung der Ergebnisse
[M]+ (7%)
- CO
600 (17)
75
- CO
- SiMe3
572 (3%)
526 (5%)
- CO
526 (5%)
- SiMe3
498 (10%)
- SiMe3
- 2 Me
- 2 Me
440 (4%)
468 (20%)
147 (20%) [P(SiMe)3SiMe]
77 (58%) Ph
73 (100%) SiMe3
Abb. 30: Schematische Darstellung des Massenspektrums von 85
3.3.5 Molekülstrukturen von 83 und 82
Geeignete Kristalle von 84 und 85 wurden aus Lösungen von 82 und 83 in CH3CN
erhalten. Die ermittelten Abmessungen der Elementarzellen sind mit weiteren Angaben zur Strukturbestimmung in Tabelle 32 zusammengefaßt.
Die Verfeinerung der Strukturen erfolgte für die Nicht-Wasserstoffatome anisotrop.
Die H-Atome an den Phosphorzentren sind in beobachteten Lagen und alle weiteren
H-Atome in den berechneten Lagen in die Verfeinerung eingegangen.
Die Ergebnisse der durchgeführten Röntgenstrukturanalysen sind in Abbildungen 31
und 32 wegen der besseren Übersichtlichkeit ohne H-Atome (Ausnahme: H1 am P1
in 84) dargestellt. Das P-gebundene H1 in 85 wurde nicht gefunden und daher nicht
dargestellt. Das
31
P-NMR- wie auch das IR- Spektrum zeigen aber eindeutig die PH-
Funktionalität an. Ausgewählte Bindungslängen und Winkel wurden in den Tabellen
33 und 34 zusammengestellt.
In den isotypen Verbindungen 84 und 85 sind alle drei P-Donatorzentren des Liganden facial an das Metallzentrum gebunden. Die Metallzentren weisen eine verzerrt
oktaedrische Koordinationsgeometrie auf, die wegen der facialen Koordination der
Liganden auch als trigonales Antiprisma aufgefaßt werden kann.
3. Beschreibung der Ergebnisse
76
Tab. 32: Kristallographische Daten und Angaben zur Strukturbestimmungen von 84 und 85. Z = Anzahl der Moleküle pro Elementarzelle
84
85
Raumgruppe
Cc
Cc
Kristallsystem
monoklin
monoklin
a [Å]
25.016(5)
25.008(6)
b [Å]
7.672(2)
7.808(2)
c [Å]
20.206(4)
20.412(4)
α [°]
90.00
90.00
β [°]
127.95(3)
127.20(1)
γ [°]
90.00
Zellvolumen [Å3]
3058.0(1)
Z
4
4
Unabhängige Reflexe
5015
2479
Beobachtete Reflexe
4742
1755
Parameter
283
291
R1
0.0269
0.0762
wR2
0.0598
0.2022
Meßtemperatur [°C]
- 70
- 70
90.00
3174.7(1)
mit I > 2σ(I)
3. Beschreibung der Ergebnisse
77
Abb. 31: Molekülstruktur von 84 im Kristall
Tab. 33: Ausgewählte Abstände (Å) und Winkel (°) in 84
Abstände
Winkel
Cr1-P1
2.352(1)
P2-Cr1-P1
81.10(3)
Cr1-P2
2.345(1)
P2-Cr1-P3
82.05(3)
Cr1-P3
2.438(1)
P1-Cr1-P3
98.34(4)
Cr1-C21
1.832(3)
C21-Cr1-P1
84.92(8)
Cr1-C22
1.833(3)
C22-Cr1-P1
168.54(8)
Cr1-C20
1.849(3)
C20-Cr1-P1
89.95(8)
Si1-P1
2.270(1)
C21-Cr1-P2
90.72(8)
P3-Si2
2.277(1)
C22-Cr1-P2
98.78(8)
P3-Si3
2.280(1)
C20-Cr1-P2
168.79(8)
O1-C20
1.155(3)
C21-Cr1-P3
171.48(8)
O3-C22
1.153(3)
C22-Cr1-P3
92.97(8)
O2-C21
1.169(3)
C20-Cr1-P3
92.67(9)
3. Beschreibung der Ergebnisse
78
Abb. 32: Molekülstruktur von 85 im Kristall
Tab. 34: Ausgewählte Abstände (Å) und Winkel (°) in 85
Abstände
Winkel
Mo1-P1
2.509(6)
P2-Mo1-P1
78.7(2)
Mo1-P2
2.478(7)
P2-Mo1-P3
79.3(2)
Mo1-P3
2.576(7)
P1-Mo1-P3
97.3(2)
Mo1-C21
1.93(3)
C21-Mo1-P1
84.1(8)
Mo1-C22
1.90(3)
C22-Mo1-P1
168.6(9)
Mo1-C20
2.04(3)
C20-Mo1-P1
88.8(7)
Si1-P1
2.29(1)
C21-Mo1-P2
92.7(7)
P3-Si2
2.29(1)
C22-Mo1-P2
100.7(7)
P3-Si3
2.27(1)
C20-Mo1-P2
165.4(7)
O1-C20
1.13(3)
C21-Mo1-P3
171.4(8)
O3-C22
1.21(3)
C22-Mo1-P3
93.7(8)
O2-C21
1.19(3)
C20-Mo1-P3
95.1(7)
3. Beschreibung der Ergebnisse
79
Die den silyl- und disilylsubstituierten P-Zentren P1 und P3 trans-ständigen Carbonylgruppen weisen um ca. 0.15 Å kürzere M-C-Bindungslängen auf als die dem
rein organisch substituierten P2 trans-koordinierte, was auf das unterschiedliche πAkzeptorverhalten der verschieden substituierten P-Donatorzentren zurückzuführen
ist. Trans-ständige Liganden und Carbonylgruppen konkurrieren miteinander um die
Elektronen desselben Metall-d-Orbitals im oktaedrischen Komplex. Ist der transständige Ligand ein schwacher π-Akzeptor wie es bei den silylsubstituierten PZentren P1 und P3 der Fall ist, so führt dies zu einer Stärkung der M-C(CO)-Bindung
und zu einer Schwächung der C-O-Bindung des trans-ständigen Carbonyl-Liganden,
in diesem Falle C21-O2 und C22-O3. Im Falle der C-O-Bindungen, die weniger sensibel auf Änderungen in der Rückbindung reagieren, sind die Unterschiede nicht signifikant.
Ein gegenläufiger Trend ist in den M-P-Bindungen zu erkennen: Die jeweils längste
M-P-Bindung ist diejenige zum disilylsubstituierten P3-Atom, die kürzeste jeweils
diejenige zum phenylsubstituierten P2-Atom, das in diesem Falle die größte πBasizität aufweist.
(CO)4
(CO)3
Mo
Cr
H
P
Cy
Si
Mes
Cy
Si
P
H
Mes
P
Si
H
86
Cy
Mes
P
Cy
Me
Me
Si
Si
Me
Me
Me
Si
P
Me
Cy
Si
Me
Me
87
Der Cr-P3-Abstand in 84 ist mit 2.44 Å auffällig groß. Im Silylphosphankomplex
[Cr(CO)3((SiHMes)3(PCy)3)] 86 wurde ein ähnlich großer Cr-P-Abstand von 2.41 Å
beobachtet.[138] Die Mo-P3-Bindungslänge ist mit 2.576 Å sogar etwas kleiner als die
in [Mo(CO)4((PCy)2(SiMe2)4)] 87 gefundenen Werte von 2.581Å zw. 2.603 Å.[140]
Die P-M-P-Winkel zwischen den nicht durch Ethylengruppen verbundenen P-Zentren
P1 und P3 sind erwartungsgemäß mit 98.3° in 82 und 97.3 ° in 83 um ca. 16°-18°
größer die als zwischen den ethylenverbrückten P1/P2- bzw. P2/P3-Atomen. Letztere
sind jeweils deutlich kleiner als der ideale Oktaederwinkel von 90°. Im Vergleich mit
den ähnlichen Komplexen [Cr(CO)3triphos] und [Mo(CO)3triphos] (triphos = Bis(2-
3. Beschreibung der Ergebnisse
80
diphenylphosphinoethyl)phenylphosphan), bei denen dieser Trend ebenfalls erkennbar ist,[116] ist der Winkel P1-M-P3 etwas größer, was auf die stärkere Abstoßung der
sehr sperrigen Trimethylsilylsubstituenten an P1 und P3 zurückzuführen ist.
Die im Vergleich zu den Cr-P-Bindungslängen jeweils um ca. 0.15 Å größeren Mo-PAbstände in 85 bewirken, daß die P-Mo-P-Winkel um 1°-3° kleiner sind als in die entsprechenden P-Cr-P-Winkel.
Erste Derivatisierungsversuche von der Komplexe 82 - 85 wie zum Beispiel die Bildung eines 1,4,7-Triphosphacyclononans durch Einschub einer Ethylengruppe zwischen die P1- und P3-Atome führten bisher noch nicht zu den erwünschten Produkten. Dennoch stellen die hier vorgestellten Verbindungen eine fruchtbare Basis für
weitere Untersuchungen dar.
4. Zusammenfassung
81
4. Zusammenfassung
Die vorliegende Arbeit beschäftigt sich mit der Synthese und den Komplexierungseigenschaften mehrzähniger, potentiell verbrückender Phosphan- und Pyridylphosphanliganden.
Zunächst wird über eine einfache Synthesemethode für aliphatische Dipyridylphosphane berichtet. So konnte in einer Pd(0)-katalysierten Kreuzkupplungsreaktion das
bisher unbekannte Cyclohexyldipyridylphosphan 23 in quantitativer Ausbeute erhalten werden.
+2 NEt3
kat. Pd(PPh3)4
PH2 + 2
Br
N
N
P
N
- 2 NEt3·HBr
(CH3CN, 14 h)
23
23
Das Koordinationsverhalten von 23 gegenüber verschiedenen Metallsalzen wurde
eingehend untersucht. 23 bildet mit Cu(OSO2CF3), Ag(BF4) und Co(BF4)2 die strukturell verwandten zweikernigen Komplexe 26, 27 und 28. Ihre Molekülstrukturen zeigen, daß jeweils zwei Ligandmoleküle zwei Metallzentren in Kopf-SchwanzOrientierung verbrücken. Hierbei koordinieren erstmalig in verbrückenden Pyridylphosphankomplexen sowohl das P- als auch die beiden N-Donatorzentren. Zusätzlich ist an jedem Metallzentrum ein Molekül CH3CN terminal gebunden, wodurch eine
verzerrt tetraedrische Koordinationssphäre resultiert.
4. Zusammenfassung
Dikation in 26
82
29
Die Koordination der P- und N-Zentren wird auch bei der Reaktion von 23 mit CuI
unter Ausbildung des Komplexes 29 beobachtet.
Die dirigierende Wirkung des Anions läßt sich bei der Reaktion von 23 mit Co(II)Salzen erkennen. Während sich mit Co(BF2)2 der Dikobaltkomplex 28 bildet, führt die
Umsetzung mit CoCl2 zum Einkernkomplex 30, in dem lediglich die Pyridyl-N-Zentren
koordinieren.
Tetrakation in 28
30
Die vielseitigen Koordinationsmöglichkeiten des Pyridylphosphanliganden sind auch
mit der Bildung von cis-[(CO)4Mo(CyPPy2)2] 31 dokumentiert, das aus 23 und fac[(CH3CN)3Mo(CO)3] unter CO-Austausch gebildet wird.
4. Zusammenfassung
83
31
In 31 koordinieren lediglich die P-Atome der Pyridylphosphanliganden, so daß der
Komplex dem entsprechenden cis-Bis(triphenylphosphan)derivat ähnelt. Die Koordinationsgeometrie am Metallzentrum in 31 weicht nur wenig vom idealen Oktaeder
abweicht.
Ein weiteres Ziel dieser Arbeit war die Synthese neuer Bis(dipyridylphosphan)liganden mit rigiderem Grundgerüst.
Cl
Cl
N
N
P
P
N
N
24
N N
2
P
Li
N N
P
Cl
Cl
P
N N
25
4. Zusammenfassung
84
So konnten die neuartigen potentiellen Liganden 24 und 25 durch Salzmetathesereaktionen erhalten und spektroskopisch sowie röntgenstrukturanalytisch charakterisiert werden. Untersuchungen zum Koordinationsverhalten dieser Liganden ergaben
bei der Umsetzung von 25 mit CuOTf den einkernigen Komplex 55, in dem zwei über
das Cu-Zentrum tetraedrisch-spiroverknüpfte Chelat-Metall-Siebenringe vorliegen. Im
Gegensatz zu 26 – 28 koordinieren in 55 ausschließlich die P-Zentren zum Metallatom.
55
Weiterhin sollte in dieser Arbeit das Koordinationsverhalten nicht-rigider mehrzähniger Phosphanliganden und der Einfluß einer Funktionalisierung an den P-Zentren
untersucht werden. Als Ligandsystem wurde ein lineares Triphosphan gewählt, bei
dem die P-Zentren durch Ethylengruppen getrennt sind.
Die Unlöslichkeit des Komplexes [(CO)3Mo(PhP(C2H4PH2)2] 77 machte es nötig, die
PH2-Wasserstoffatome durch funktionelle Gruppen zu ersetzen, die die Löslichkeit in
organischen Lösemitteln erhöhen und gleichzeitig eine Derivatisierung am P-Zentrum
begünstigen. Durch zweifache Lithiierung von PhP(C2H4PH2)2 78 und anschließende
Reaktion des P-lithiierten Triphosphans mit Trimethylchlorsilan konnte 81 synthetisiert werden, das als dreizähniger Chelatligand die Komplexe 82 und 83 bildet. In
den Komplexen sind die P-Donatoratome facial an die Metallzentren gebunden.
4. Zusammenfassung
85
Ph
Ph
P
(SiMe3)2P
P
P
Si
Si
Si
P
P(SiMe3)2
M
Si
81
CO CO CO
M = Cr: 82. Mo: 83
Durch teilweise Hydrolyse der Verbindungen 82 und 83 entstanden 84 und 85, die
die ersten asymmetrisch koordinierten chiralen Komplexe dieses Ligandentyps repräsentieren.
Ph
+ H2O
(SiMe3)2P
P
P(SiMe3)2
M
- SiMe3OH
CO CO CO
M = Cr: 82, Mo: 83
M = Cr: 84, Mo: 85
5. Experimenteller Teil
86
5. Experimenteller Teil
5. 1. Allgemeines
Alle Versuche wurden unter nachgereinigtem Argon (4.8) (BTS-Katalysator) in ausgeheizten Apparaturen mit allgemeinen Schlenk-Techniken durchgeführt. Die Lösemittel und Edukte wurden nach gängigen Methoden getrocknet und unter Argon gelagert. Luft- bzw. hydrolyseempfindliche Feststoffe wurden in einer Glovebox unter
Inertgas gehandhabt oder unter Argon umgefüllt. NMR-Proben wurden unter Inertgasatmosphäre abgefüllt. Als Standard für die 1H-NMR- und
13
C-NMR-Spektroskopie
diente das Lösemittelsignal, dessen chemische Verschiebung auf Tetramethylsilan
skaliert wurde. Für die
29
19
Si-NMR-Spektren diente Tetramethylsilan, für die
F-NMR-
31
Spektren CFCl3 und für die
P-NMR-Spektren H3PO4 (85%ige wäßrige Lösung) als
externer Standard. Die NMR-spektroskopischen Untersuchungen wurden an einem
Bruker Avance 250 durchgeführt.
Tab. AA: Meßfrequenzen der NMR-Spektren
Bruker Avance 250
Kern
Frequenz [MHz]
1
H
250.1
31
P
101.3
13
C
62.9
29
Si
49.7
19
F
235.4
Für IR-spektroskopische Messungen wurden die Proben unter Inertgas als KBrPreßlinge präpariert und anschließend am Gerät Bruker IFS66 aufgenommen.
Die massenspektrometrischen Untersuchungen wurden am Gerät Varian MATCH 7
durchgeführt. Die Elementaranalysen wurden am Gerät CHNO-Rapid der Firma
Heraeus ausgeführt. Die Messung der Intensitäten der durchgeführten Röntgenstrukturanalysen erfolgte mit einem Bruker-axs-SMART Flächenzähler Mo-KαStrahlung (λ = 71.07 pm, Graphitmonochromator). Die Verfeinerung erfolgte mit dem
Programm SHELXTL 97 gegen F2. Dabei ergibt sich der R-Wert mit R1 = (Σ(|F0||Fc|)/Σ|Fc|), und für alle Reflexe errechnet sich der wR2-Wert über den Zusammenhang wR2 = (Σ(w(|F0|2-|Fc|2)2)/Σ(w(|Fc|2)2))1/2.
5. Experimenteller Teil
87
5.2 Ausgangsverbindungen
Folgende Ausgangsverbindungen wurden nach literaturbekannten Synthesevorschriften hergestellt:
Tris(2-pyridyl)phosphan, P(py)3, ist aus 2-Pyridyllithium und PCl3 in MTBE erhältlich.[148]
Di(2-pyridyl)phosphan, HP(py)2, wird aus Tris(2-pyridyl)phosphan und Lithium in refluxierendem THF hergestellt.[103]
Tris(acetonitril)-tricarbonylmolybdän(0) [Mo(CH3CN)(CO)3] und Tricarbonyl-mesitylmolybdän(0) [MoC9H12(CO)3] wurden aus [Mo(CO)6] durch Rückflußkochen in
CH3CN bzw. Mesitylen erhalten.[149]
Cycloheptatrienyl-tricarbonylchrom(0) [Cr(CO)3C7H8] entsteht bei der Reaktion von
[Cr(CO)6] mit Cycloheptatrien.[150]
Phenylbis(ethanylphosphino)phosphan PhP(C2H4PH2)2 78 wurde durch Hydrophosphinierungsreaktion von zwei Äquivalent Diethylvinylphosphonsäureester mit Phenylphosphan hergestellt.[111]
Diethylvinylphosphonsäureester C2H3PO(OC2H5) wurde durch Michaelis-ArbuzowReaktion aus Triethylphosphit P(OC2H5)3 mit 1.2-Dibromethan und anschließender
HBr-Eliminierung mit Triethylamin synthetisiert.[151]
Alle anderen Chemikalien konnten käuflich erworben werden.
H4
Numerierungsschema für Pyridyl-Protonen:
H3
H5
P
H6
N
2
R
5. Experimenteller Teil
88
5.3 Beschreibung der Versuche
Versuch 1: Herstellung von CyPPy2 23
Ansatz:
1g
(8.6 mmol)
CyPH2
2.7 g
(17.2 mmol)
2-BrPy
1.8 g
(17.8 mmol)
NEt3
ca. 0.1g
Pd(PPh3)4
20 ml
CH3CN
CyPH2, NEt3 und 2-BrPy wurden in CH3CN gelöst und dreimal mit flüssigem Stickstoff eingefroren und entgast. Hierauf wurde der Katalysator zugegeben, erneut entgast und 12 h unter Rückfluß erhitzt. Nach dem Abkühlen wurde der Niederschlag
von NEt3·HBr abgefiltert und das Lösemittel im Vakuum entfernt.
Das Produkt wurde im Vakuum in eine Säbelvorlage destilliert und in heißem Hexan
aufgenommen. Bei langsamer Abkühlung erhält man das Produkt in quantitativer
Ausbeute in Form farbloser Kristalle.
Ausbeute:
2.25 g (8.3 mmol, 97%)
Eigenschaften:
Farblose, mäßig luftstabile Kristalle
Smp.:
82°C
Sdp.:
146°C / 0.03 mbar
1
δ = 1.2 - 2.2 (m, 10H, CH(CH2)5), 3.2 (m, 1H, CH(CH2)5),
H-NMR (C6D6):
6.60 (m, 2H, H4), 7.00 (tm, 2H, H5, 3JHH = 7.5 Hz),
7.43 (dm, 2H, H3, 3JHH = 6.6 Hz), 8.52 (d, 2H, H6,
3
JHH = 4.7 Hz)
31
δ = 3.2 (s)
MS (EI, 70 eV):
m/z = 270 (M+, 35%), 193 ([M-C6H4N]+, 80%), 187 ([M-
P-NMR (CDCl3):
C6H11]+, 100%), 109 ([M- C6H11-C6H4N]+, 75%)
Hochaufgelöstes EI-MS: ber. 270.1283 für C16H19PN2
(EI, 70 eV)
gef. 270.1281
5. Experimenteller Teil
89
Versuch 2: Herstellung von [Cu2(η
η-CyPPy2)2(CH3CN)2](OTf)2 26
Ansatz:
0.66 g
(1.3 mmol)
(CuOTf)3·C6H6
0.35 g
(1.3 mmol)
CyPPy2 23
30 ml
CH3CN
(CuOTf)3·C6H6 wurde in 20 ml CH3CN gelöst und bei RT mit einer Lösung von 23 in
10 ml CH3CN versetzt. Die Lösung wurde 12 h bei RT gerührt, auf ca. 3 ml eingeengt. Man erhält das Produkt in quaderförmigen, farblosen Kristallen.
Ausbeute:
1.11 g (0.53 mmol, 82%)
Eigenschaften:
Farblose, luft- und hydrolyseempfindliche Kristalle, die ausschließlich in CH3CN löslich sind.
1
H-NMR (CD3CN):
δ = 1.2 - 2.2 (m, CH(CH2)5), 3.1 (m, 1H, CH(CH2)5), 1.96
(CH3CN, nicht-koord.), 2.19 (s, 3H, CH3CN, koord.), 7.5 (m,
2H, H (Py)), 7.9 (m, 4H, H (Py)), 8.7 (m, 2H, H6, 3JHH = 4.7 Hz),
für alle Signale gilt: w1/2 ≈ 20 Hz
31
δ = 0.2 (s, w1/2 = 23.8 Hz)
C, H-Analyse (%):
C38H44Cu2F6N4O6P2S2 (1048.0)
P-NMR (CD3CN)
Ber.
C 43.55
H 4.23
N 8.02
Gef.
C 43.05
H 4.18
N 7.90
5. Experimenteller Teil
90
Versuch 3: Herstellung von [Ag2(η
η-CyPPy2)2(CH3CN)2](BF4)2 27
Ansatz:
0.20 g
(1.0 mmol)
AgBF4
0.30 g
(1.0 mmol)
CyPPy2 23
30 ml
CH3CN
AgBF4 wurde in 20 ml CH3CN gelöst und bei RT mit einer Lösung von 23 in 10 ml
CH3CN versetzt. Die Reaktionsmischung wurde 12 h bei RT gerührt, auf ca. 3 ml
eingeengt. Man erhält das Produkt in quaderförmigen, farblosen Kristallen.
Ausbeute:
0.80 g (0.4 mmol, 79%)
Eigenschaften:
Farblose, luft- und hydrolyseempfindliche Kristalle, die ausschließlich in CH3CN löslich sind.
1
H-NMR (CD3CN):
δ = 1.2 - 2.2 (m, CH(CH2)5), 3.2 (m, 1H, CH(CH2)5), 1.96
(CH3CN, nicht-koord.), 2.19 (s, 3H, CH3CN, koord.), 7.5 (m,
2H, H (Py)), 7.9 (m, 4H, H (Py)), 8.7 (d, 2H, H6, 3JHH = 4.7 Hz),
für alle Signale gilt: w1/2 ≈ 20 Hz
31
P-NMR (CD3CN):
δ = 23.62 (s, w1/2 = 32.6 Hz)
C, H-Analyse (%):
C36H44Ag2B2F8N6P2 (1012.1)
Ber.
C 42.72
H 4.38
N 8.30
Gef.
C 43.21
H 4.35
N 8.35
5. Experimenteller Teil
91
Versuch 4: Herstellung von [Co2(η
η-CyPPy2)2(CH3CN)2](BF4)4 28
Ansatz:
0.26 g
(1.0 mmol)
CoCl2
0.40 g
(2.0 mmol)
AgBF4
0.30 g
(1.0 mmol)
CyPPy2 23
30 ml
CH3CN
Zu einer tiefblauen Lösung von CoCl2 in CH3CN wurde eine Lösung von AgBF4 in
CH3CN gegeben, worauf die Lösung sich rosa verfärbte und ein weißer Niederschlag
von AgCl ausfiel. Der Niederschlag wurde abgefiltert und zu der verbleibenden klaren
Lösung wurde eine Lösung von 23 in CH3CN gegeben. Nach Rühren über 12 h und
Einengen der Lösung auf ca. 3 ml und Kühlung auf – 25°C konnte das Produkt in
Form weißer Kristalle erhalten werden.
Ausbeute:
0.34 g (0.58 mmol, 58%)
Eigenschaften:
Farblose, luft- und hydrolyseempfindliche Kristalle, die
ausschließlich in CH3CN löslich sind.
C, H-Analyse (%):
C36H42Co2B4F16N6P2 (1086.17)
(Solvat mit 1 CH2Cl2)
Ber.
C 39.77
H 3.95
N 7.74
Gef.
C 39.36
H 4.19
N 7.51
5. Experimenteller Teil
92
Versuch 5: Herstellung von [Cu2(η
η-CyPPy2)2I2] 2
Ansatz:
0.70 g
(3.7 mmol)
CuI
0.99 g
(3.7 mmol)
CyPPy2 23
150 ml
THF
CuI wurde in 120 ml THF bei ca. 50°C gelöst und mit einer Lösung von 23 in 30 ml
THF versetzt. Die Lösung verfärbte sich umgehend zitronengelb und nach langsamem Abkühlen über 12 h kristallisierte das Produkt in Form zitronengelber Kristalle,
die wenig luft- und hydrolyseempfindlich und in polaren organischen Lösemitteln mäßig löslich sind..
Ausbeute:
1.75 g (1.64 mmol, 89%)
Eigenschaften:
Zitronengelbe, wenig luft- und hydrolyseempfindliche Kristalle
1
δ = 1.2 - 2.2 (m, CH(CH2)5), 2.0 (quin, nicht integrierbar, THF),
H-NMR (CDCl3):
3.1 (m, 1H, CH(CH2)5), 3.9 (quin, 4H, THF), 7.5 (m, 2 H,
H (Py)), 7.8 (m, 4H, H (Py)), 9.1 (m, 2H, H6)
31
δ = 1.5 (s, w1/2 = 22.8 Hz)
C, H-Analyse (%):
C40H54Cu2I2N4O2P2 (1065.7)
P-NMR (CD3CN)
(Solvat mit 2 THF)
Ber.
C 45.08
H 5.12
N 5.26
Gef.
C 44.14
H 5.10
N 5.36
5. Experimenteller Teil
93
Versuch 6: Herstellung von [Mo(CO)4(CyPPy2)2] 31
Ansatz:
0.3 g
(1.0 mmol)
[Mo(CH3CN)(CO)3]
0.54 g
(2.0 mmol)
CyPPy2 23
30 ml
CH3CN
Zu einer Lösung von [Mo(CH3CN)(CO)3] in 20 ml CH3CN wurde bei RT eine Lösung
von 23 in CH3CN zugetropft und 12 h gerührt. Eine leichte Trübung wurde mittels
einer Glasfritte abgetrennt, und die klare gelborangene Lösung auf ca. 5 ml eingeengt. Nach einigen Tagen erhielt man gelborangene Kristalle des Produktes.
Ausbeute:
0.25 g (0.34 mmol, 34%)
Eigenschaften:
gelbliche, luft- und hydrolyseempfindliche Kristalle
1
δ = 1.2 - 2.2 (m, 10H, CH(CH2)5), 3.2 (m, 1H CH(CH2)5), 6.60 (m,
H-NMR (C6D6):
2H, H4), 7.00 (tm, 2H, H5, 3JHH = 7.5 Hz), 7.43 (dm, 2H, H3,
JHH = 6.6 Hz), 8.52 (d, 2H, H6, 3JHH = 4.7 Hz)
3
31
δ = 62.5 (s)
MS (FAB):
m/z = 751 ([M + H]+, 4%), 692 ([M - 2 CO]+, 6%), 635 ([M
P-NMR (C6D6):
- 4 CO]+, 5%), 612 ([M - 2 CO - Cy]+, 7%), 481 ([M - CyPPy2]+,
8%)
IR (cm-1)
ν = 3043 (m), 2926 (s), 2819 (s), 2049 (m), 1944 (s), 1919 (m),
1895 (vs), 1816 (vs), 1575 (s), 1448 (s), 1421 (s), 1196 (m), 1152
(m), 989 (m), 765 (m), 744 (s), 625 (m), 575 (m), 559 (m), 513 (3),
463 (m)
5. Experimenteller Teil
94
Versuch 7: Herstellung von [CoCyPPy2]Cl2 30
Ansatz:
0.13 g
(1.0 mmol)
CoCl2
0.27 g
(1.0 mmol)
CyPPy2 23
30 ml
CH3CN
CoCl2 wurde in 20 ml CH3CN gelöst und bei RT mit einer Lösung von 23 in 10 ml
CH3CN versetzt. Die Lösung wurde 12 h bei RT gerührt, auf ca. 5 ml eingeengt. Das
Produkt kristallisiert in dunkelblauen Kristallen
Ausbeute:
0.37 g (093 mmol, 93%)
Eigenschaften:
Dunkelblaue, luft- und hydrolysestabile Kristalle
MS (EI, 70 eV):
m/z = 399 (0.5%, [M]+), 364 (3%, [M - Cl]+), 327 (10%,
[M - 2Cl]+), 270 ([CyPpy2]+, 80%), 193 ([CyPpy2 C6H4N]+, 82%), 187 ([CyPpy2 - C6H11]+, 100%), 109
([CyPpy2 - C6H11 - C6H4N], 78%)
C, H-Analyse (%):
C16H19Cl2CoN2P (400.158)
Ber.
C 48.03
H 4.79
N 7.00
Gef.
C 47.80
H 5.22
N 6.99
5. Experimenteller Teil
95
Versuch 8: Herstellung von ortho - (Py2PCH2)2C6H4 24
Ansatz:
1.29 g
(6.9 mmol)
HPPy2
4.2 ml
(6.9 mmol)
n-BuLi in Hexan (1.6 m)
0.61 g
(3.4 mmol)
o-(ClCH2)2C6H4
70 ml
THF
HPPy wurde bei Eiskühlung in 50 ml THF mit BuLi versetzt und zwei Stunden bei RT
gerührt. Zu der tiefroten Lösung wurde bei –20°C eine Lösung von o-(ClCH2)2C6H4 in
20 ml THF gegeben, auf RT gebracht und 12 h gerührt. Nach Abziehen des Lösemittels im Vakuum wurde der Rückstand in Ether digeriert und das unlösliche LiCl
über eine GIV-Umkehrfritte abgetrennt. Nach Abziehen des Ethers wurde der Rückstand in heißem Ethanol gelöst und das Produkt kristallisierte in farblosen Plättchen.
Ausbeute:
1.09 g (2.38 mmol, 67%)
Eigenschaften:
Farblose, mäßig luftstabile Plättchen
1
δ = 3.95 (s, CH2. 4H), 6.69 (m, C6H4. 4H), 7.15 (tm, H5,
H-NMR (CDCl3):
4H, 3JHH = 6.3 Hz), 7.29 (Lsm.), 7.46 (dm, H3, 4 H,
JHH = 7.4 Hz), 7.54 ((tm, H4, 4 H, 3JHH = 7.5 Hz), 8.67 (d,
3
H6, 4 H)
31
δ = - 5.39 (s)
MS (EI, 70 eV:
m/z = 478 (M+, 1%), 400 ([M - Py]+, 100%) 290 ([M - Ppy2
P-NMR (CDCl3)
- H]+, 42%), 212 ([C6H4(CH2)2Ppy]+, 50%), 187 ([Ppy2]+,
62%), 109 ([PPy], 26%)
Hochaufgelöstes EI-MS: ber.: 478.1476 für C28H24N4P2
(EI, 70 eV)
gef.: 478.1472
5. Experimenteller Teil
96
Versuch 9: Herstellung von [Cu(o-(Py2PCH2)2C6H4]OTf 55
Ansatz:
0.18 g
(0.7 mmol)
(CuOTf)3·C6H6
0.68 g
(1.4 mmol)
ortho-(Py2PCH2)2C6H4 24
30 ml
CH2Cl2
(CuOTf)3·C6H6 wurde in 10 ml CH2Cl2 gelöst und bei RT zu einer Lösung von 24 in
20 ml gegeben. Nach 3h Rühren bei RT wurde die Lösung auf ca. 3 ml eingeengt
und das Produkt kristallisierte in Form farbloser Kristalle.
Ausbeute:
0.63 g (0.52 mmol, 75%)
Eigenschaften:
Farblose, luft- und hydrolyseempfindliche Kristalle
1
δ = 3.8 (s, 4H, CH2), 6.5 (m, 4H, C6H4), 7.0 (tm, 4H, H5), 7.29
H-NMR (CDCl3):
(s, Lsm.), 7.3 (m, 4 H, H3), 7.4 (m, 4 H, H4), 8.5 (s, 4 H, H6),
für alle Signale gilt: w1/2 ≈ 20 Hz
31
δ = - 2.9 (s), w1/2 = 22.0 Hz
C, H-Analyse (%):
C58H50ClCuF3N8O3P4S (1219.1)
P-NMR (CDCl3)
(Solvat mit 1 CH2Cl2)
Ber.
C 57.15
H 4.13
N 9.19
Gef.
C 57.86
H 4.67
N 8.88
5. Experimenteller Teil
97
Versuch 10: Herstellung von para - (Py2PCH2)2C6H4 25
Ansatz:
1.29 g
(6.9 mmol)
HPPy2
4.2 ml
(6.9 mmol)
n-BuLi in Hexan (1.6 m)
0.61 g
(3.4 mmol)
p-(ClCH2)2C6H4
70 ml
THF
HPPy wurde bei Eiskühlung in 50 ml THF mit BuLi versetzt und zwei Stunden bei RT
gerührt. Zu der tiefroten Lösung wurde bei –20°C eine Lösung von p-(ClCH2)2C6H4 in
20 ml THF gegeben, auf RT gebracht und 12 h gerührt. Nach Abziehen des Lösemittels im Vakuum wurde der Rückstand in Ether digeriert und das unlösliche LiCl
über eine Glas-Umkehrfritte abgetrennt. Nach Abziehen des Ethers wurde der Rückstand in heißem Ethanol gelöst und das Produkt kristallisierte in farblosen Plättchen.
Ausbeute:
1.26 g (2.65 mmol, 78%)
Eigenschaften:
Farblose, mäßig luftstabile Plättchen
1
δ = 3.72 (s, CH2, 4H), 6.96 (s, C4H4. 4H), 7.19 (tm, H5, 4H,
H-NMR (CDCl3):
JHH = 6.3 Hz), 7.29 (Lsm.), 7.38 (dm, H3, 3JHH = 7.4 Hz),
3
7.56 ((tm, H4, 3JHH = 7.5 Hz), 8.23 (d, H6, 3JHH = 5.0 Hz)
31
δ= - 2.59 (s)
MS (EI, 70 eV):
m/z = 478 (M+, 19%), 291 ([M-Ppy2]+, 82%), 187 ([Ppy2]+,
P-NMR (CDCl3)
100%), 109 ([PPy], 20%)
Hochaufgelöstes EI-MS: C28H24N4P2
(EI, 70 eV)
ber.: 478.1476
gef.: 478.1478
5. Experimenteller Teil
98
Versuch 11: Reaktion von para - (Py2PCH2)2C6H4 25 mit CuI
Ansatz:
0.22 g
(0.5mmol)
para - (Py2PCH2)2C6H4 25
0.10 g
(0.5 mmol)
CuI
20 ml
Ethanol
10 ml
CH3CN
Zu einer Lösung von CuI in Ethanol wurde bei RT eine Lösung von 25 in CH3CN gegeben. Nach dreistündigem Rühren wurde die Lösung auf ca. 3 ml ml eingeengt und
ein gelber Niederschlag erhalten, der in polaren organischen Lösemitteln wie CH2Cl2.
CH3CN oder CHCl3 mäßig löslich ist.
Ausbeute:
0.26 g (82%)
Eigenschaften:
Gelber Feststoff
1
δ = 4.05 (s, 4H, CH2), 6.25 (s, 2H, C6H4), 6.60 (s, 2H, C6H4),
H-NMR (CDCl3):
7.15 (m, 4H, H5), 7.29 (s, Lsm.), 7.30 (m, 4 H, H3), 7.40 (m, 4 H,
H4) , 8.35 (s, 4 H, H6), für alle Signale gilt w1/2 ≈ 20 Hz
31
P-NMR (CDCl3):
δ = 0.4 (s), w1/2 ≈ 20 Hz
C, H-Analyse (%)
C28H24CuIN4P2 (669.12)
Ber.
C 50.28
H 3.62
N 8.38
Gef.
C 50.20
H 3.80
N 8.43
5. Experimenteller Teil
99
Versuch 12: Reaktion von para - (Py2PCH2)2C6H4 25 mit CoCl2
Ansatz:
0.19 g
(0.4 mmol)
para - (Py2PCH2)2C6H4 25
0.10 g
(0.8 mmol)
CoCl2
20 ml
Ethanol
Zu einer tiefblauen Lösung von CoCl2 in Ethanol wurde bei RT eine Lösung von 25 in
Ethanol gegeben. Nach 15-minütigem Rühren bei RT begann ein blauer Niederschlag auszufallen. Einengen der Lösung auf ca. 3 ml erbrachte 86% Ausbeute eines
blauen Feststoffes, der in Ethanol wenig, in anderen organischen Lösemitteln dagegen kaum löslich ist.
Ausbeute:
0.25 g (86%)
Eigenschaften:
blauer Feststoff
C, H-Analyse (%)
C28H24Cl4Co2N4P2 [CoCl2(25)CoCl2] (738.16)
Ber.
C 45.56
H 3.28
N 7.59
Gef.
C 44.65
H 2.48
N 7.33
5. Experimenteller Teil
100
Versuch 13: Herstellung von [Mo(CO)3(PhP(C2H4PH2)2)] 77
Ansatz:
0.48 g (1.6 mmol)
[Mo(CO)3(CH3CN)3]
0.36 g (1.6 mmol)
PhP(C2H4PH2)2
50 ml
Toluol
Zu einer Lösung von PhP(C2H4PH2)2 in 40 ml Toluol wurde bei RT eine Lösung von
[Mo(CO)3(CH3CN)3] in 10 ml Toluol zugetropft und die innerhalb weniger Sekunden
entstandene Suspension über nacht bei RT gerührt, das Produkt als farbloser Feststoff abgefiltert im Vakuum getrocknet. Das Produkt ist weder in Toluol, noch in
Hexan, THF, Ether, Methanol, Ethanol, Dimethylformamid, Wasser oder CH3CN löslich.
Ausbeute:
0.86 g (1.57 mmol), 98%
Eigenschaften: Farbloses, in organischen Lösemitteln unlösliches, luft- und hydrolyseempfindliches Pulver
MS (EI, 70 eV):
m/z = 412 (4%, [M]+), 384 (3%, [M - CO]+), 354 (5%, [M - 2 CO - 2
H]+), 324 (7%, [M - 3 CO - 4 H]+), 296 (8%, [M - 3 CO - 4 H C2H4]+), 286 (10% [M - 3 CO - 4 H - 2 C2H4]+), 191 (4% [M - 3 CO 4 H - 2 C2H4 - C6H5]+), 160 (4% [M - 3 CO - 4 H - 2 C2H4 C6H5 - P]+), 28 (100% [CO]+)
IR (cm-1)
ν = 3052 (w), 2954 (s), 2897 (s), 2262 (s), 1950 (vs), 1872 (vs),
1431 (m), 1420 (m), 1240 (m), 1100 (w), 843 (s), 694 (s)
5. Experimenteller Teil
101
Versuch 14: Herstellung von PhP(C2H4P(SiMe3)2)2 79
Ansatz:
4.34 g (19.0 mmol)
47 ml (76.0 mmol)
8.36 g (76.0 mmol)
70 ml
PhP(C2H4PH2)2
BuLi als Lösung in Hexan
ClSiMe3
THF
Zu einer Lösung von PhP(C2H4PH2)2 in THF wurde bei - 20°C genau die Hälfte der
BuLi-Lösung gegeben, die Lösung auf RT gebracht und 1 h gerührt, auf - 50°C gekühlt und die Hälfte des ClSiMe3 zugegeben. Nach langsamem Erwärmen auf RT
und einstündigem Rühren wurde der Vorgang wiederholt und 12 h bei RT gerührt.
Nach Entfernen des THF wurde der Rückstand in Ether aufgenommen, das entstandene LiCl durch Filtration abgetrennt und das Produkt im Vakuum als farbloses, äußerst luft- und hydrolyseempfindliches Öl destilliert. Es neigt an der Luft zu spontaner
Selbstentzündung.
Ausbeute:
7.97 g (15.3 mmol), 81%
Eigenschaften:
Farbloses, luft- und hydrolyseempfindliches Öl
Sdp:
187 - 190°C / 6·10-2 mbar
H-NMR (250MHz, CDCl3): δ = 0.27 (d, 36 H, Si(CH3)3, 3JP-H = 4.4 Hz), 1.0 - 2.2 (m,
1
PCH2CH2P), 7.2 (m, Ph), 7.65 (t, 2H, m-H, Ph,
3
JHH = 7.5 Hz)
31
δ = - 16.2 (m, PhP), - 165.0 (m, (Me3Si)2P)
31
δ = - 16.2 (t, PhP, 3JPP = 26.3 Hz), - 165.0 (d, (Me3Si)2P,
P-NMR (CDCl3):
P{1H}-NMR (CDCl3):
3
JPP = 26.3 Hz)
MS (EI, 70eV)
m/z = 518 (1%, [M]+), 503 (5%, [M - CH3]+), 488 (3%,
[M - 2 CH3]+ ), 472 (6%, [M - 3 CH3 - H]+ ), 445 (1.2%,
[M - Si(CH3)3]+), 372 (2%, [M - 2 Si(CH3)3]+), 299 (2%, [M
- 3 Si(CH3)3]+), 221 (15%, [M - 3 Si(CH3)3 Ph - H]+), 147 ( 100%, [M - 4 Si(CH3)3 - Ph - 2 H]+), 75
(75%, [C6H5 - 2 H]+), 73 (69%, [Si(CH3)3]+)
5. Experimenteller Teil
102
Versuch 15: Herstellung von [Cr(CO)3(PhP(C2H4P(SiMe3)2)2)] 80
Ansatz:
0.16 g (0.7 mmol)
[Cr(CO)3C7H8]
0.36 g (0.7 mmol)
PhP(C2H4P(SiMe3)2)2 81
30 ml
n-Hexan
Zu einer Lösung von [Cr(CO)3C7H8] in Hexan wurde bei RT tropfenweise 81 hinzugegeben und 12 h bei RT gerührt, wobei das Produkt als gelblicher Niederschlag
ausfiel. Er wurde abgefiltert und im Vakuum getrocknet.
Ausbeute:
0.30g (0.4 mmol), 57%
Eigenschaften:
Gelblicher, luft- und hydrolyseempfindlicher Feststoff
1
δ = 0.4 (d, Si(CH3)3. 18 H, 3JP-H = 4.5 Hz), 0.5 (d, Si(CH3)3. 18
H-NMR (C6D6):
H, 3JP-H = 4.5 Hz): 1.0 - 2.2 (m, PCH2CH2P), 7.6 (m, PhenylH, 3H), 7.7 (m, Phenyl-H, 2H)
31
P{1H}-NMR (C6D6): δ = - 81.3 (d, P(SiMe3)2. 3JPP = 10 Hz), 108.7 (t, PhP,
3
JPP = 10 Hz)
31
δ = - 81.3 (m, P(SiMe3)2), 108.7 (m, PhP)
MS (EI, 70 eV):
m/z = 654 (0.3%, [M]+), 577 (0.5%, [M - Ph]+), 546 (3.5%, [M
P-NMR (C6D6):
- 2 CH3 - H]+, 503 (1.5%, [M - Si(CH3)3 - H]+), 429 (2.5%, [M 2 Si(CH3)3 - 2 H]+), 355 (5%, [M - 3 Si(CH3)3 - 2 H]+), 281 (5%,
[M - 4 Si(CH3)3 - 2 H]+), 147 (100%, [P(Si(CH3)3SiCH3]+ oder
[P(C2H4P)2 - 2 H]+), 75 (78%, [C6H5 - 2 H]+), 73 (77%,
[Si(CH3)3]+)
IR (cm-1)
ν = 3053 (w), 2953 (s), 2898 (s), 1896 (vs), 1809 (vs), 1432
(m), 1412 (m), 1243 (s), 1101 (m), 840 (vs), 740 (s), 696 (s),
658 (s), 547 (w)
5. Experimenteller Teil
103
Versuch 16: Herstellung von [Mo(CO)3(PhP(C2H4P(SiMe3)2)2)] 81
Ansatz:
1.00 g (3.3 mmol)
[Mo(CO)3Mes]
1.7 g (3.3 mmol)
PhP(C2H4P(SiMe3)2)2 81
30 ml
n-Hexan
[Mo(CO)3Mes] wurde in heißem Hexan gelöst und in der Siedehitze 81 langsam zugetropft. Beim Abkühlen der Lösung fiel das Produkt als hellgelber Niederschlag aus,
der abgefiltert und im Vakuum getrocknet wurde.
Ausbeute:
1.56 g (2.2 mmol), 68%
Eigenschaften:
Hellgelber, luft- und hydrolyseempfindlicher Feststoff
1
δ = 0.3 (d, 18 H, Si(CH3)3. 3JP-H = 4.4 Hz), 0.5 (d, 18 H,
H-NMR (C6D6):
Si(CH3)3, 3JP-H = 4.4 Hz),
31
P-NMR (C6D6):
δ = - 102.2 (m, P(SiMe3)2), 88.6 (m, PhP)
P{1H}-NMR (C6D6): δ = - 102.2 (d, P(SiMe3)2. 3JPP = 3.9 Hz), 88.6 (m, PhP,
31
3
JPP = 3.9 Hz)
MS (EI, 70 eV):
m/z = 700 (1%, [M]+), 672 (1.5%, [M - CO]+), 669 (1.5%, [M 2(CH3)]+), 628 (1%, [M - Si(CH3)3]+), 600 (1.2%, [M - Si(CH3)3
- CO]+), 539 (1.5%, [M - 2 Si(CH3)3 - CH3]+), 465 (1.6%, [M - 3
Si(CH3)3 - CH3 - H]+), 331 (1.5%, [M - 4 Si(CH3)3 - Ph]+), 180
(6%, [Mo(CO)3]+), 164 (52%, [PhP(C2H4)2]+), 147 (55%,
[P(Si(CH3)3SiCH3]+), 73 (100%, [Si(CH3)3]+)
IR (cm-1)
ν = 3055 (w), 2952 (s), 2896 (s), 1922 (vs), 1831 (vs), 1433
(m), 1410 (m), 1247 (vs), 1099 (m), 838 (vs), 742 (s), 696 (s),
659 (s), 550 (w)
5. Experimenteller Teil
104
Versuch 17: [Cr(CO)3(PhP(C2H4P(SiMe3)(C2H4PHSiMe3)] 82
Das Produkt wurde nach einer Woche beim Versuch der Umkristallisation von
[Cr(CO)3(PhP(C2H4P(SiMe3)2)2)] 82 in CH3CN als gelbliche Kristalle erhalten.
Eigenschaften:
Gelbliche, luft- und hydrolyseempfindliche Kristalle
1
δ = 0.36 (d, Si(CH3)3. 9 H, 3JP-H ≈ 5 Hz), 0.39 (d, Si(CH3)3. 9
H-NMR (C6D6):
H, 3JP-H ≈ 5 Hz), 0.55 (d, Si(CH3)3. 9 H, 3JP-H ≈ 5 Hz), 1.0 - 2.2
(m, PCH2CH2P), 7.0 - 7.2 (m, Phenyl-H, 3H), 8.2 (m, PhenylH, 2H)
P{1H}-NMR (C6D6): δ = - 82.6 (dd, P3, 2JP3-P1 = 29.3 Hz, 2JP3-P2 = 14.3 Hz), - 36.1
31
(dd, P1, 3JP1-P2 = 23.0 Hz, 2JP1-P3 = 29.3 Hz), 112.4 (dd, P2,
2
JP2-P1 = 23.1 Hz, 2JP2-P3 = 14.3 Hz)a
31
P-NMR (C6D6):
δ = - 82.6 (s, P3), - 36.1 (d, P1, 1JP-H = 248 Hz), 112.4 (s,
P2)a
MS (EI, 70 eV):
m/z = 582 (1.5%, [M]+), 510 (3%, [M - Si(CH3)3]+), 498 (12%,
[M - 3 CO - H]+), 426 (17%, [M - 3 CO - Si(CH3)3 - H]+), 298
(5%, [PhP(C2H4P)2Si(CH3)3 - H]+), 147 (100%,
[P(Si(CH3)3SiCH3]+), 77 (30%, [C6H5]+), 73 (43%, [Si(CH3)3]+)
IR (cm-1)
ν = 3057 (w), 2954 (m), 2897 (m),2263 (m), 1897 (vs), 1810
(vs), 1431 (m), 1417 (m), 1215 (s), 1100 (m), 842 (vs), 801
(m), 782 (m), 695 (s), 671 (s), 657 (s), 452 (m)
a
P1 = PHSiMe3. P2 = PPh, P3 = P(SiMe3)2
5. Experimenteller Teil
105
Versuch 18: [Mo(CO)3(PhP(C2H4P(SiMe3)(C2H4PHSiMe3)] 83
Das Produkt wurde nach einer Woche beim Versuch einer Umkristallisation von
[Cr(CO)3(PhP(C2H4P(SiMe3)2)2)] 83 in CH3CN als gelbliche Kristalle erhalten.
Eigenschaften:
Gelbliche, luft- und hydrolyseempfindliche Kristalle
1
δ = 0.21 (d, Si(CH3)3, 9 H, 3JP-H ≈ 5 Hz), 0.23 (d, Si(CH3)3,
H-NMR (C6D6):
9 H, 3JP-H ≈ 5 Hz), 0.37 (d, Si(CH3)3. 9 H, 3JP-H = 5.6 Hz), 1.0 2.2 (m, PCH2CH2P), 7.0 - 7.2 (m, Phenyl-H, 3H), 8.0 (m,
Phenyl-H, 2H)
31
P-NMR (C6D6):
δ = - 104.4 (s, P3, - 63.8 (d, P1, 1JP-H = 256 Hz), 86.1 (s, P2)a
P{1H}-NMR (C6D6): δ = - 104.4 (dd, P3, 2JP3-P1 = 24.4 Hz, 2JP3-P2 = 5.9 Hz), - 63.8
31
(dd, P1, 2JP3-P1 = 24.4 Hz, 2JP2-P3 = 10.8 Hz), 86.1 (dd, P2
2
JP2-P1 = 10.8 Hz, 2JP2-P3 = 5.9 Hz)a
MS (EI, 70 eV):
m/z = 628 (7%, [M]+), 600 (17%, [M - CO]+), 572 (3%,
[M - 2 CO]+), 526 (5%, [M – CO - Si(CH3)3]+), 498 (10%,
[M - 2 CO - Si(CH3)3]+), 468 (20%, [M - 2 CO - Si(CH3)3 2 CH3]+), 440 (4%, [M - 3 CO – Si(CH3)3 - 2 CH3]+), 396 (5%,
[M - 2 CO - 2 Si(CH3)3 - 2 CH3]+), 147 (20%,
[P(Si(CH3)3SiCH3]+), 77 (58%, [C6H5]+), 73 (100%, [Si(CH3)3]+)
IR (cm-1)
ν = 3053 (m), 2957 (m), 2895 (m), 2267 (m), 1910 (vs), 1822
(vs), 1434 (m), 1417 (m), 1245 (m), 1101 (w), 844 (s), 804
(w), 782 (w), 695 (m), 614 (m)
a
P1 = PHSiMe3, P2 = PPh, P3 = P(SiMe3)2
6. Literaturverzeichnis
106
6. Literaturverzeichnis
[1]
P. Espinet, K. Soulantica, Coord. Chem. Rev., 1999, 193 – 195, 499
[2]
P. Arnoldy, E. Drent, P. H. M Budelzaar, J. Organomet. Chem., 1999, 455, 247
[3]
J. C. Jeffrey, T. B. Rauchfuss, Inorg. Chem., 1979, 18, 2658
[4]
D. W. Stephan, Coord. Chem. Rev., 1989, 95, 41
[5]
G. R. Newcome, Chem. Rev., 1993, 93, 2067
[6]
A. L. Balch, J. P. Farr, A. Maisonnat, M. M. Olmstead, Inorg. Chem., 1981, 20,
4060
[7]
A. L. Balch, J. P. Farr, C. T. Hunt, A. Maisonnat, M. M. Olmstead, Inorg.
Chem., 1982, 21, 3961
[8]
H. G. Jiang, K. Y. Wang, R. J. Wang, Y. Wu, H. P. Xi, Z. Z. Thang, W. J. Zhao,
J Organomet. Chem., 1993, 454, 221
[9]
B. C. Baguley, S. J. Berners-Price, R. J. Bowen, W. Brouwer, M. J. McKeage,
P. Galettis, L. Ding, J. Inorg. Biochem., 1997, 67, 154
[10]
P. H. M. Budelzaar, J. H. G. Frijns, A. G. Orpen, Organometallics, 1990, 9,
1222
[11]
K. Gebreyes, J. Zubieta, T. A. George, L. M. Koczon, R. C. Tisdale, Inorg.Chem., 1986, 25, 405
[12]
T. A. George, L. M. Koczon, R. C. Tisdale, K. Gebreyes, L. Ma, S. N. Shaikh,
J. Zubieta, Polyhedron, 1990, 9, 545
[13]
P. K. Baker, M. M. Meehan, Inorg. Chim. Acta, 2000, 303, 17
[14]
R. B. King, W. F. Masler, J. Am. Chem. Soc., 1977, 4001
[15]
D. L. DuBois, A. M. Herring, A. Miedaner, B. D. Steffey, S. A. Wander, Inorg.
Chem., 1995, 34, 1100
[16]
W. C. Davies, F. G. Mann, J. Chem. Soc., 1944, 276
[17]
F. G. Mann, J. Watson, J. Org. Chem., 1948, 13, 502
[18]
R. H. Holm, J. E. Parks, B. E. Wagner, J. Am. Chem. Soc., 1970, 92, 3500
[19]
R. H. Holm, G. N. LaMar, E. Larson, B. E. Wagner, Inorg. Chem., 1972, 11,
2652
[20]
R. H. Holm, J. E. Parks, B. E. Wagner, J. Organomet. Chem., 1973, 56, 53
[21]
R. H. Holm, J. E. Parks, B. E. Wagner, Inorg. Chem., 1971, 10, 2472
6. Literaturverzeichnis
[22]
107
R. J. Bowen, A. C. Garner, S. J. Berners-Price, I. D. Jenkins, R. E. Sue, J. Organomet. Chem., 1998, 554, 181
[23]
G. R. Newcome, J. M. Roper, J. Organomet. Chem., 1980, 186, 147
[24]
D. Barañano, J. F. Hartwig, G. Mann, Curr. Org. Chem., 1997, 1, 287
[25]
J. K. Stille, S. E. Tunney, J. Org. Chem, 1987, 52, 748
[26]
O. Herd, A. Hessler, M. Hingst, O. Stelzer, M. Tepper, J. Organomet. Chem.,
1996, 522, 69
[27]
O. Herd, A. Hessler, M. Hingst, P. Machnitzki, O. Stelzer, M. Tepper, Catalysis
Today, 1998, 43, 413
[28]
T. Agawa, T. Hirao, T. Masunaga, Y. Ohshiro, Synthesis, 1981, 56
[29]
M. Maaser, E. Uhlig, Z. Allg. Anorg. Chem., 1966, 344, 205
[30]
R. T. Bogess, D. A. Zatko, J. Coord. Chem., 1975, 4, 217
[31]
R. Gregorzik, H. Vahrenkamp, J. Wirbser, Chem Ber., 1992, 125, 1575
[32]
T. Astley, H. Headlam, M. A. Hitchman, F. R. Keene, J. Pilbrow, H. Stratemeier, E. R. T. Tiekink, Y. C. Zhong, J. Chem. Soc., Dalton Trans., 1995, 3809
[33]
K. R. Adam, P. A. Anderson, T. Astley, I. M. Atkinson, J. M. Charnock, C. D.
Garner, J. M. Gulbis, T. W. Hambley, M. A. Hitchman, F. R. Keene, E. R. T.
Tiekink, J. Chem. Soc., Dalton Trans., 1997, 519
[34]
A. L. Balch, J. P. Farr, M. M. Olmstead, J. Am. Chem. Soc., 1980, 102, 6655
[35]
A. L. Balch, J. P. Farr, F. E. Wood, Inorg. Chem., 1983, 22, 3387
[36]
A. L. Balch, J. P. Farr, C. H. Hunt, M. M. Olmstead, Inorg. Chem., 1981, 20,
1182
[37]
A. L. Balch, J. P. Farr, A. Maisonnat, Inorg. Chim. Acta, 1981, 53, L217
[38]
A. L. Balch, J. P. Farr, M. M. Olmstead, F. E. Wood, J. Am. Chem. Soc., 1983,
105, 792
[39]
C. G. Arena, G. Bruno, D. Drommi, F. Faraone, G. Franciò, R. Scopellitti, Organomet.,1998, 17, 338
[40]
S.-L. Li, T. C. W. Mak, Z.-Z. Zhang, J. Chem. Soc., Dalton Trans., 1996, 3475
[41]
Y. Inogushi, B. Milewski-Mahrla, H. Schmidbaur, Chem. Ber., 1982,115, 3085
[42]
F. A. Cotton, E. V. Dikarev, G. T. Jordan, C. A. Murillo, M. A. Petrukhina, Inorg. Chem., 1998, 37, 4611
[43]
N. W. Alcock, K. F. Mok, P. Moore, P. A. Lampe, J. Chem. Soc, Dalton
Trans.,1982, 207
6. Literaturverzeichnis
108
[44]
H. Cheng, Z. Z. Zhang, Coord. Chem. Rev., 1996, 147, 1
[45]
M. P. Gamasa, J. Gimeno, E. Lastra, M. Lanfranchi, A. Tiripicchio, J. Chem
Soc, Dalton Trans., 1989, 1499
[46]
S. Kitagawa, M. Maekawa, M. Munakata, T. Yonezawa, Bull. Chem. Soc.
Jpn., 1991, 64, 2286
[47]
W.-H. Chan, C.-M. Che, S.-M. Peng, J. Chem. Soc., Dalton Trans., 1998, 2867
[48]
M. S. Huang, H. F. Liu, W. Liu, P. Zhang, L. X. Zhen, J. Xiamen Univ.(Nat.
Sci), 1992, 31, 57
[49]
James, B. R., Joshi, A. M., Rettig, S. J., Schutte, R. P., Inorg. Chem., 1997,
36, 5809
[50]
P. Espinet, P. Gómez-Elipe, F. Villafañe, J. Organomet. Chem., 1993, 450,
145
[51]
H. Schmidbaur, Y. Inoguchi, Z. Naturforsch, 1980, 35b, 1329
[52]
F. R Keene, M. R. Snow, R. T. Tiekink, Acta cryst. Sect. C, 1988, 44, 757
[53]
J.-P.Charland,
J.-L.Roustan,
N.Ansari,Acta
Crystallogr.,Sect.C
(Cr.Str.Comm.),1989, 45, 680
[54]
A. Del Zotto, E. Zangrando, Inorg. Chim. Acta, 1998, 277, 111
[55]
B. R. James, S. J. Rettig, R. P. Schutte, Can. J. Chem., 1996, 74, 2064
[56]
P. D. Beer, J. W. Wheeler, C. P. Moore, J. Chem. Soc., Dalton Trans., 1992,
2667
[57]
J. Díez, M. P. Gamasa, J. Gimeno, A Tiripicchio, M. Tiripicchio Camellini, J.
Chem Soc, Dalton Trans., 1987, 1275
[58]
J. S. Field, R. J. Haines, C. J. Parry, S. H. Sookraj, Polyhedron, 1993, 12,
2425
[59]
S. Kuang, T.C.W. Mak, Q. Wang, Z.
Zhang, J.Chem.Soc., Dalton Trans.,
1998, 2927
[60]
a) B. Ahrens, P. G. Jones, Acta Crystallogr. Sect. C 1998, 54, 16
b) D. Fenske, F. Simon, Angew. Chem. 1997, 109, 240;
[61]
P. Pyykkö, Chem. Rev. 1997, 97, 5970
[62]
S. Kuang, T.C.W. Mak, Q. Wang, Z. Zhang, J. Chem. Soc., Dalton Trans.,
1998, 1115
[63]
C. Su, S. Wu, C. Wu, T. Chang, Polyhedron, 1994, 14, 267
[64]
R. R. Burch, J. C. Calabrese, J. Am. Chem. Soc., 1986, 108, 5359
6. Literaturverzeichnis
[65]
109
H. Stephan, H. Kruger-Rambusch, K. Gloe, W. Hasse, B. Ahlers, K. Cammann, K. Rissanen, G. Brodesser, F. Vögtle, Chem. Eur. J., 1998, 4, 434
[66]
A. Fumagalli, S. Martinengo, V. G. Albano, D. J. Braga, Chem. Soc., Dalton
Trans., 1988, 1237
[67]
A. Blaschette, P. G. Jones, T. Hamman, M. Naveke, D. Schomburg, H. K.
Cammenga, M. Epple, I. Steppuhn, Z. Anorg. Allg. Chem., 1993, 619, 912
[68]
B. De Groot, S. J. Loeb, G. K. H. Shimizu, Inorg.Chem., 1994, 33, 2663
[69]
A. J. Arduengo III, H. V. R. Das, J. C. Calabrese, Inorg. Chem., 1991, 30, 4880
[70]
S. Kuang, T. C. W. Mak, Q. Wang, Z. Zhang, Chem. Commun., 1998, 581
[71]
Z.-Z. Zhang, H.-K.Wang, Z. Xi, X.-K. Yao, R.-J. Wang, J. Organomet. Chem.,
376, 1989, 123
[72]
R.-E.Chang, Y.-C. Chang, F.-E. Hong, F.-L. Liao, C.-C. Lin, S.-L. Wang, J.
Organomet. Chem., 1999, 588, 160
[73]
M.-C. Cheng, S.-M. Peng, M.-S. Tsai, E.-C. Yang, J. Chem. Soc., Chem.
Commun., 1994, 2377
[74]
A. Weiss, H. Witte, Magnetochemie – Grundlagen und Anwendungen, Verlag
Chemie, Weinheim, 1972
[75]
H. Lueken, Magnetochemie – Eine Einführung in Theorie und Anwendung, B.
G. Teubner Verlag, Stuttgart, Leipzig, 1999
[76]
Privatmitteilung Prof. P. Chaudhuri
[77]
M. G. Ehrlich, F. R. Fronczek, S. F. Watkins, G. R. Newcome, D. C. Hager,
Acta Cryst., 1984, C40, 78
[78]
L. J. Admiraal, G. Gafner, J. Chem. Soc., Chem. Comm., 1968, 1221
[79]
J. R. Allan, C. L. Jones, L. Sawyer, J. Inorg. Nucl. Chem., 1981, 43, 2707
[80]
J. A. Cesares, P. Espinet, R. Hernando, G. Iturbe, F. Villafañe, Inorg. Chem.
1997, 36, 44
[81]
F. A. Cotton, D. J. Darensbourg, S. Klein, B. W. S. Kolthammer, Inorg. Chem.,
1982, 21, 2661
[82]
M. Watson, S. Woodward, G. Conole, M. Kessler, G. Sykara, Polyhedron,
1994, 13, 2455
[83]
K. K.- Cheung, T. F. Lai, K. S. Mok, J. Chem. Soc. A, 1971, 1644
[84]
C. A. Tolman, Chem. Rev., 1977, 77, 313
[85]
A. L. Seligson, W. C. Trogler, J. Am. Chem. Soc., 1991, 113, 2520
6. Literaturverzeichnis
[86]
110
T. G. Hill, R. C. Haltiwanger, T. R. Prout, A. D. Norman, Inorg. Chem, 1989,
28, 3461
[87]
F. A. Cotton, D. J. Darensbourg, S. Klein, B. W. S. Kolthammer, Inorg.Chem.,
1982, 21, 294
[88]
P. H. M. Budelzaar, P. J. Fennis, J. H. G. Frijns, A. G. Orpen, J. Organomet.
Chem., 1990, 393, 287
[89]
S. J. Berners-Price, R. J. Bowen, P. J. Harvey, P. C. Healy, G. A. Koutsantonis, J. Chem. Soc., Dalton Trans., 1998, 1743
[90]
S. J. Berners-Price, R. J. Bowen, P. J. Hambley, P. C. Healy, J. Chem. Soc.,
Dalton Trans., 1999, 1337
[91]
B. R. James, N. D. Jones, S. R. Rettig, J. Clust. Sc., 1998, 9, 243
[92]
B. R. James, N. D. Jones, K. S. McFarlane, M. B. Smith, R. P. Schutte, S. J.
Rettig, Inorg. Chem., 1999, 38, 3956
[93]
A. M. Aguiar, M. G. R. Nair, J. Org. Chem., 1968, 33, 579
[94]
Karpov, Kuzop, Bull. Acad. Sci. USSR, Div. Chem. Sci., (Engl. Trans.), 1972,
21, 639
[95]
M. Camalli, S. Chaloupka, F. Caruso, E. M. Leber, H. Rimml, L. M. Venanzi,
Helv. Chim. Acta, 1990, 73, 2263
[96]
M. Camalli, F. Caruso, H. Rimml, L. M. Vevanzi, Inorg. Chem, 1995, 34, 673
[97]
S. Hofreiter, M. Paul, H. Schmidbaur, A. Sladek, J. Organomet. Chem., 1995,
501, 47
[98]
G. Hogarth, J. Y. Pang, J. Organomet. Chem., 1996, 515, 193
[99]
G. B. Jacobsen, B. L. Shaw, M. Thornton-Pett, J. Organomet. Chem., 1987,
323, 313
[100] P. Comba, C. Katsichtis, B. Nuber, H. Pritzkow, Eur. J. Inorg. Chem., 1999,
777
[101] C.-H. Ueng, G.-Y. Hwang, J. Chem. Soc., Dalton Trans.,1991, 1643
[102] T. Hayashi, Y. Kawabata, T. Isoyama, I. Ogata, Bull. Chem. Soc. Jap., 1981,
54, 3438
[103] D. Stalke, A. Steiner, J. Chem. Soc., Chem. Comm., 1993, 444
[104] U. Burckhardt, K.-H- Dahmen, D. Imhof, F. Joho, R. Nesper, Inorg. Chem.,
1997, 36, 1813
6. Literaturverzeichnis
111
[105] L. M. Engelhardt, C. Pakawatchai, A. H. White, P. C. Healy , J. Chem. Soc.,
Dalton Trans., 1985, 125
[106] G. A. Bowmaker, P. C. Healy, L. M. Engelhardt, J. D. Kildea, B. W. Skelton, A.
H. White , Aust. J. Chem., 1990, 43, 1697
[107] S. J. Berners-Price, L. A. Colquhoun, P. C. Healy, K. A. Byriel, J. V. Hanna ,
J.Chem.Soc.,Dalton Trans., 1992, 3357
[108] B. Mohr, E. E. Brooks, N. Rath, E. Deutsch, Inorg.Chem., 1991, 30, 4541
[109] R. B. King, J. C. Cloyd, Jr., J. Am. Chem. Soc., 1975, 53
[110] P. N. Kapoor, R. B. King, J. Am. Chem. Soc., 1971, 58
[111] J. C. Cloyd, Jr., R. B. King, P. N. Kapoor, J. Chem. Soc., Dalton Trans., 1973,
2226
[112] K. V. Katti, V. S. Reddy, C. J. Smith, Chem. Comm., 1996, 2557
[113] F.R.Askham, G.G.Stanley, E.C.Marques, J.Am.Chem.Soc., 1985, 107, 7423
[114] R. B. King, M. S. Saran, Inorg. Chem., 1971, 10, 1861
[115] P. N. Kapoor, P. N. Kapoor, R. B. King, Inorg. Chem., 1971, 19, 1841
[116] M. C. Favas, D. L. Kepert, B. W. Skelton, A. H. White, J.Chem.Soc., Dalton
Trans., 1980, 447
[117] L. R. Gray, A. L. Hale, W. Levason, F. P. McCullough, M. Webster,
J.Chem.Soc., Dalton Trans., 1984, 47
[118] G.-I. Bertinsson, Acta Cryst., 1983, C39, 563
[119] B. Juma, F. R. Fronczek, G. G. Stanley, Acta Crystallogr., Sect.C,1993, 49,
1325
[120] Z. Berente, Z. Csók, L. Jánosi, L. Kollár, G. Petöcz, W. Weissensteiner, Inorg.
Chim. Acta, 2000, 303, 300
[121] H. Gali, K. V. Katti, Main Gp. Chem. News, 1999, 7, 21
[122] K. V. Katti, V. S. Reddy, C. J. Smith, J. Chem Soc., Dalton Trans., 1998, 1365
[123] S. Anderson, T. B. Marder, G. Stringer, N. J. Taylor, S. A. Westcott, Inorg.Chem., 1994, 33, 4589
[124] D.-N. Horng, C.-H. Ueng, Inorg. Chim.Acta, 1995, 232, 175
[125] D. L. DuBois, R. C. Haltiwanger, A. Medianer, J.Am.Chem.Soc., 1991, 113,
8753
[126] R. D. Hart, B. W. Skelton, A. H. White, Aust.J.Chem., 1991, 44, 919
[127] S. A. Laneman, S. E. Saum, G. G. Stanley, Inorg.Chem.,1990, 29, 5065
6. Literaturverzeichnis
112
[128] F. R. Askham, A. W. Maverick, G. G. Stanley, Inorg.Chem.,1987, 26, 3963
[129] J.-K. Lai,C.-H. Ueng, Inorg.Chim.Acta,1997, 9, 266
[130] J. W. Bibber, R. B. King, Inorg.Chim.Acta,1982, 59, 197
[131] A. R. Barron, A. H. Cowley, C. M. Nunn ,Acta Crystallogr., Sect.C, 1988, 44,
750
[132] D. Fenske, A. Grissinger, E. M. Hey-Hawkins, J. Magull, Z. Anorg. Allg.
Chem., 1991, 595, 57
[133] W. Plass, W. Schwarz, Z. Anorg. Allg. Chem., 1996, 622, 1756
[134] a) F. Lindenberg, E. Hey-Hawkins, J.Organomet.Chem. ,1992, 435, 291
b) F. Lindenberg, E. Hey-Hawkins, Z. Anorg. Allg. Chem., 1995, 621, 1531
[135] G. Johannsen, O. Stelzer, Chem. Ber., 1977, 110, 3438
[136] J. C. Calabrese, R. T. Oakley, R. West, Can. J. Chem., 1979, 57, 1909
[137] M. Drieß, H. Pritzkow, M. Reisgys, Chem. Ber., 1991, 124, 1931
[138] M. Drieß, H. Pritzkow, M. Reisgys, Angew. Chem., 1992, 104, 1514
[139] M. Reisgys, Dissertation, Universität Heidelberg, 1994
[140] M. Faulhaber, Dissertation, Universität Heidelberg, 1998
[141] M. Drieß, M. Faulhaber, H. Pritzkow, Angew. Chem. Internat. Ed. Engl., 1997,
36, 1892
[142] P. G. Edwards, P. D. Newman, K. M. A. Malik, Angew. Chem., 2000, 112,
3044
[143] G. Fritz, W. Hölderlich, Z. Anorg. Allg. Ch., 1977, 431, 76
[144] J. C. Cloyd, R. B. King, Inorg. Chem., 1975, 14, 1550
[145] J. C. Cloyd, R. B. King, J. A. Zinich, Inorg. Chem., 1975, 14, 1554
[146] E. W. Abel, M. A. Benett, G. Wilkinson, J. Chem. Soc., 1959, 2835
[147] C. Elschenbroich, A. Salzer, Organometallchemie, Teubner Verlag, Stuttgart,
1988
[148] F. R. Keene, M. R. Stephenson, P. J. Stephenson, E. R. T. Tiekink, Inorg.
Chem., 1988, 27, 2040
[149] R. B. King, Organomet. Chem., 1967, 8, 139; A. Pidcock, J. D. Smith, B. W.
Taylor, J. Chem. Soc., 1967, 872
[150] A. Pidcock, J. D. Smith, B. W. Taylor, J. Chem. Soc., 1967, 872
[151] A. H. Ford-Moore, J. H. Williams, J. Chem. Soc., 1947, 1465
6. Literaturverzeichnis
113
Lebenslauf
Name:
Felix Franke
geboren am:
30.10.1967 in Berlin
Familienstand:
ledig
Schulausbildung:
08/1974 – 7/1978:
Grundschule in Hohn und Fockbek bei Rendsburg
08/1978 – 06/1988 Gymnasium Herderschule in Rendsburg,
Abschluß: Allgemeine Hochschulreife
Wehrdienst:
07/1988 – 09/1989 Grundwehrdienst als Sanitätssoldat in Eckernförde
Studium:
10/1989 – 03/1993 Grundstudium der Chemie an der Georg-August-Universität
Göttingen, Vordiplomprüfung, Gesamtnote: gut
04/1993 – 01/1997 Hauptstudium der Chemie an der Ruprecht-Karls-Universität
Heidelberg, Diplom, Gesamtnote: gut
seit 04/1998
Zusatzstudium
„Wirtschaftswissenschaften
für
Naturwissen-
schaftler und Ingenieure“ an der Fern-Universität Hagen
Promotion:
seit 03/1997
Promotion am Lehrstuhl Anorganische Chemie I der RuhrUniversität Bochum bei Prof. Dr. M. Drieß
Auslandsaufenthalte:
09/1985 – 07/1986 Aufenthalt am Haileybury College Hertford/England
10/1994 – 03/1995 Auslandssemester an der Universidad de Santiago de Compostela/Spanien