stickstoff-stoffwechsel - Ruhr
Werbung

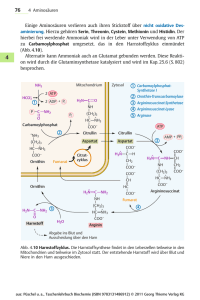
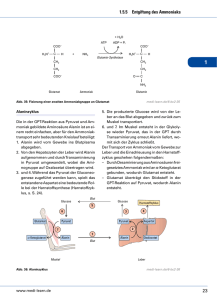
5 STICKSTOFF-STOFFWECHSEL BIOCHEMISCHE GRUNDLAGEN HARNSTOFFZYKLUS Beim Abbau von Aminosäuren und anderen stickstoffhaltigen Verbindungen entsteht Ammoniak. Ammoniak in höheren Konzentrationen (>50 µmol/l) ist eine äußerst toxische Substanz. Soweit das entstehende Ammoniak nicht für die Biosynthese anderer stickstoffhaltiger Verbindungen gebraucht wird, erfolgt Einbau von Ammoniak in Harnstoff. Auf diese Weise wird Ammoniak in eine nichttoxische Verbindung überführt. Nur die Leber besitzt eine enzymatische Ausstattung für eine vollständige und bedeutsame Bildung von Harnstoff. Ammoniak kann auch unverändert über die Niere ausgeschieden werden. Bei der Bildung von Harnstoff handelt es sich um eine zyklische Reaktionsfolge, die als Harnstoffzyklus bezeichnet wird. Im Verlauf des Harnstoffzyklus wird Harnstoff aus einem Molekül Ammoniak und Bicarbonat sowie aus dem -Aminostickstoff von Aspartat zusammengesetzt. Eine der Reaktionen, bei welcher in der Leber ein erheblicher Anteil an Ammoniak entsteht, ist die NAD+-abhängige oxydative Desaminierung von Glutamat. Das Enzym Carbamylphosphat-Synthetase (in Gegenwart von N-Acetylglutamat als allosterischem Aktivator) katalysiert die Bildung von Carbamylphosphat aus Ammoniak und Bicarbonat unter Verbrauch von zwei Molekülen ATP (Abb. 1). Diese Reaktion läuft in den Mitochondrien der Hepatozyten ab. Vom Carbamylphosphat wird die Carbamyl-Gruppe auf Ornithin unter Bildung von Citrullin und Freisetzung von Phosphat übertragen. Diese Reaktion wird durch das Enzym Ornithin-Transcarbamylase katalysiert. Citrullin wird aus den Mitochondrien in das Zytosol transportiert. Eine zweite Aminogruppe wird durch Aspartat in den Zyklus eingeschleust. Die Aminogruppe von Asparatat kondensiert mit der Carbonylgruppe des Citrullins, wobei Argininosuccinat entsteht. Diese Reaktion erfordert ein Molekül ATP und als Enzym Argininosuccinat-Synthetase. Argininosuccinat wird durch Argininosuccinatlyase in Fumarsäure und Arginin gespalten. Harnstoffausscheidende Organismen besitzen eine hohe Aktivität des Enzyms Arginase, durch dessen Wirkung Arginin hydrolytisch in Harnstoff und Ornithin gespalten wird; das Gleichgewicht liegt weit auf der Seite von Harnstoff und Ornithin. Der Harnstoff wird ausgeschieden, während das Ornithin wieder in die Mitochondrien transportiert wird. 6 Die Biosynthese eines Moleküls Harnstoff nach der Gleichung 2 NH3 + HCO3- + 3 ATP CO(NH2)2 + 2 ADP + AMP + 4 Pi erfordert 3 Moleküle ATP bzw. die Spaltung von vier energiereichen Bindungen. Dabei sind die Energetik der Biosynthese des Aspartats aus Fumarat und die Transportvorgänge durch die Mitochondrienmembran noch nicht berücksichtigt. In folgenden Versuchen wird die Harnstoffsynthese in Leberextrakten untersucht. Ausgehend von verschiedenen Zwischen- und Vorprodukten des Kreisprozesses wird die Bildung von Harnstoff nachgewiesen. Dieser wird quantitativ bestimmt. Daraus wird die spezifische enzymatische Aktivität errechnet. Abb. 1: Harnstoffbiosynthese Enzyme: 1 = Carbamylphosphat-Synthetase I 2 = Ornithin-Carbamyl-Transferase 3 = Argininosuccinat-Synthetase 4 = Argininosuccinat-Lyase 5 = Arginase 7 AMINOTRANSFERASEN (TRANSAMINASEN) Für die Einschleusung von Aminogruppen in den Harnstoffzyklus müssen diese entweder in Form von Aspartat zugeführt werden oder aber als Ammoniak aus Aminosäuren abgespalten werden (z.B. durch die Glutamatdehydrogenase-Reaktion aus Glutamat). Damit haben Aminotransferasen, die zur Bildung von Glutamat führen, eine besondere Bedeutung im Stoffwechsel (Abb. 2). (Transaminasen ist eine ältere aber immer noch verwendete Bezeichnung für Aminotransferasen). Aminotransferasen übertragen mit Hilfe von Pyridoxalphosphat als Coenzym reversibel die Aminogruppe einer Aminosäure 1 auf eine -Ketosäure 2 unter Bildung der -Ketosäure 1 und der Aminosäure 2 (Mechanismus siehe Lehrbücher). Aminosäure 1 + -Ketosäure 2 -Ketosäure 1 + Aminosäure 2 Eines dieser Enzyme ist die Alanin-Aminotransferase ALT (frühere Bezeichnung GlutamatPyruvat-Transaminase GPT). Sie übernimmt den Aminogruppentransfer von Alanin auf Ketoglutarat unter Bildung von Pyruvat und Glutamat. Eine zweite wichtige Aminotransferase ist die Aspartat-Aminotransferase AST (früher Glutamat-Oxalacetat-Transaminase GOT). Sie benutzt Glutamat und Oxalacetat als Substrate und führt zur Bereitstellung von -Ketoglutarat und Aspartat. Dieses kann dann zur Harnstoffsynthese verwendet werden. Bestimmung von ALT und AST (GPT und GOT) hat im klinisch-chemischen Labor eine praktische Bedeutung. Erhöhte Aktivitäten dieser Enzyme im Serum deuten auf Organschädigungen, wie Herzinfarkt oder Erkrankungen der Leber (Leberzirrhose, Hepatitis) hin. Aus dem Verhältnis der enzymatischen Aktivitäten von AST (GOT) und ALT (GPT) im Serum kann auf das geschädigte Organ geschlossen werden: In der Leber findet sich hauptsächlich ALT, während im Herzmuskel und Skelettmuskel AST und ALT in annähernd gleich hohen Aktivitäten vorkommen. Abb. 2 Aminotransferasen im Stoffwechsel 8 9 ALLGEMEINE FRAGESTELLUNGEN Welche energiereichen (Ver)bindungen kommen im Harnstoffzyklus vor? Um welchen chemischen Bindungstyp handelt es sich dabei? Für welche Biosynthese wird sonst noch Carbamylphosphat benötigt? Durch welche Reaktionen werden Aminogruppen aus Aminosäuren als Ammoniak abgespalten? Durch welche Reaktionen im Stoffwechsel wird Ammoniak gebunden? Kommen die Aminosäuren Ornithin, Citrullin und Arginin in Proteinen vor? Worin besteht eine Wechselbeziehung zwischen Harnstoffzyklus und Citratzyklus? Welche klinischen Symptome beobachtet man bei Enzymdefekten des Harnstoffzyklus (genetisch bedingt oder erworben)? Wie lassen sich diese Erkrankungen behandeln? Aus welchen Gründen ist die Harnstoffbestimmung im Serum von klinischer Bedeutung? Welches Coenzym wird von Aminotransferasen benötigt? Von welchen Enzymen wird dieses Coenzym ebenfalls benötigt? Welche Stoffwechselstörungen beim Abbau der Aminosäuren kennen Sie? Welche Bedeutung hat die Bestimmung von Aminosäuren? In welchen Körperflüssigkeiten sind diese Bestimmungen sinnvoll? 10 ZIELSETZUNG DER EXPERIMENTE Harnstoffzyklus: Bestimmung von Harnstoff Im Leberrohextrakt soll die Entstehung von Harnstoff unter unterschiedlichen Bedingungen verfolgt werden, und anschließend soll die entstandene Menge an Harnstoff pro Stunde und per mg Protein im Leberextrakt berechnet werden. Harnstoff bildet mit -Isonitrosopropiophenon einen Farbstoff, dessen Extinktion im Photometer bestimmt werden kann. PROTEINBESTIMMUNG (BIURETREAKTION) Proteine bilden mit Kupfer-II-Ionen in alkalischer Lösung violette Komplexverbindungen, die sich vom blauen Kupfer-Tartrat-Komplex, wie er im Biuretreagenz enthalten ist, eindeutig unterscheiden. Diese auf der Bildung von Protein-Kupfer-Komplexen beruhende Proteinbestimmungsmethode wird als Biuretreaktion bezeichnet, da die Verbindung Biuret H2N-CO-NH-CO-NH2 (Säureamidbindung!) mit Biuretreagenz (alkalische Kupfer-Tartrat-Lösung) eine Färbung ergibt, die der Farbe der Protein-Kupfer-Komplexe ähnelt. Die Absorptionsspektren der meisten Protein-KupferKomplexe sind sehr ähnlich, so dass man eine Serumalbuminlösung als Proteinstandard verwenden und auf Korrekturfaktoren in der Regel verzichten kann. 11 AMINOTRANSFERASEN Qualitativer Nachweis der Alaninaminotransferase Die Übertragung der Aminogruppe von Glutamat auf Pyruvat unter Bildung von Alanin und -Ketoglutarat sowie die Umkehrung dieser Reaktion sollen nachgewiesen werden. Dazu werden Substrate und Produkte der Reaktion durch Dünnschichtchromatografie voneinander getrennt. Auf den Chromatogrammen werden die Aminosäuren Alanin und Glutamat durch Reaktion mit Ninhydrin nachgewiesen. Ninhydrin bildet beim Erhitzen mit Aminosäuren einen blauvioletten Farbstoff. VERSUCHSDURCHFÜHRUNG UND VERSUCHSPROTOKOLL Harnstoffzyklus Mitbringliste: Kittel, Lineal, Taschenrechner ENZYMATISCHE REAKTION Nach dem Pipettierplan 1 werden die Lösungen in die Eppendorf Cups 1-10 gegeben. Als letztes wird Leberextrakt zupipettiert, wodurch die Reaktion gestartet wird. Nach der Zugabe von Leberextrakt werden die Ansätze gemischt und die Reaktionsgefäße dann 30 min bei 37°C inkubiert. Puffer und Salze enthalten: 0,1 mol/l, Kaliumphosphatpuffer (pH 7.8), 0.02 mol/l L-Asparatat, 0,0075 mol/l MgSO4 und 0,003 mol/l ATP zusammen mit den Enzymen Glycerat-3-phosphat-Mutase, Enolase und Pyruvatkinase, die ebenfalls im Enzymextrakt enthalten sind, als ATPQuelle.) 12 Pipettierplan 1 (Angaben in Mikrolitern µl) Eppendorfcup Nr Reagenzien µl Puffer und Salze 1 2 3 4 5 6 7 8 9 10 350 350 350 350 350 350 350 350 350 350 25 25 25 25 25 25 µl L-Citrullin (0,1 mol/l) µl L-Arginin (0,1 mol/l) 25 25 25 µl L-Ornithin (0,1 mol/l) µl Carbamylphosphat 25 (0,06 mol/l) 25 25 µl NH4HCO3 (0,2 mol/l) µl N-Acetylglutamat 25 (0,05 mol/l) µl H2O dest. µl Leberextrakt 525 525 75 75 50 75 75 25 50 100 450 450 450 450 450 450 450 450 Am Ende der Inkubationszeit werden die Reaktionen durch Zugabe von je 100 µl 50 %iger Phosphorsäure zu allen Ansätzen gestoppt. Die Proben werden gut durchgemischt (Eppendorf Cups verschließen, mehrfach umdrehen, nicht heftig schütteln!) und 5 min zentrifugiert. Der Überstand wird zur Harnstoffbestimmung verwendet. Schutzbrille tragen! 13 PHOTOMETRISCHE HARNSTOFFBESTIMMUNG Während der Inkubation der Enzymansätze werden die Reagenzgläser für die Bestimmung des in der Enzymreaktion gebildeten Harnstoffs vorbereitet. Die Reagenzgläser werden mit wasserfestem Stift beschriftet. Gemäß Pipettierplan 2 werden in jedes Reagenzglas 0,2 ml -Isonitrosopropiophenon pipettiert. Anschließend werden die Überstände zugegeben. Zuletzt wird die Säuremischung aus einem Dispenser zugemischt. Die Säuremischung sollte zum Schluss zugegeben werden, weil dadurch eine bessere Durchmischung der Lösungen erreicht wird. Schutzbrille tragen! Pipettierplan 2 (Angaben in Mikrolitern µl, bzw. Millilitern ml) Reagenzien Reagenzglas Nr. Lw 1 - 10 Isonitrosopropiophenon*) 200 µl je 200 µl H2O dest. 400 µl - Überstand - je 400 µl 5 ml je 5 ml Säuremischung **) Lw = Leerwert *) 4% ige ethanolische Lösung **) Die Säuremischung enthält konz. H2SO4, konz. H3PO4 und H2O im Verhältnis 1 : 3 : 6. Sie wird mit einem Dispenser (automatische Pipette) zugegeben. Die Reagenzgläser werden 45 min im Thermoblock bei 100°C inkubiert. Nach 45 min werden die Gläser aus dem Thermoblock genommen. Man lässt sie kurz abkühlen. (Bei längerem Abkühlen entsteht ein Niederschlag, der die Messungen stört). Anschließend werden die Extinktionen der Proben bei 540 nm im Photometer gegen den Leerwert gemessen. Schutzbrille tragen! 14 QUANTITATIVE PROTEINBESTIMMUNG MIT DER BIURETREAKTION Schutzbrille tragen! Pipettierplan 3 (Angaben in Millilitern ml) Reagenzglas Nr. ml NaCl (0,9%) Lw 1 2 3 5 4,9 4,9 4,8 ml Standardserumalbumin (50 mg/ml) 0,1 ml Leberextrakt - - 0,1 0,2 ml Biuretreagenz* 5 5 5 5 * 1 Liter Biuretreagenz enthält: 45 g Kalium-Natrium-Tartrat, 5 g Kupfersulfat und 5 g Kaliumjodid gelöst in Natronlauge (0,2 mol/l) Die Ansätze werden sorgfältig gemischt und dann mindestens 30 min bei Zimmertemperatur stehen gelassen. Danach wird die Extinktion bei 540 nm gegen den Leerwert gemessen. 15 AMINOTRANSFERASEN a) Lösungen 10 mmol/l Natriumphosphatpuffer pH 7,6 100 mmol/l Glutamat 100 mmol/l Pyruvat 100 mmol/l Alanin 100 mmol/l -Ketoglutarat Alanin-Aminotransferase aus Schweineherz b) Pipettierplan Probe 1 Probe 2 Probe 3 Probe 4 Phosphatpuffer 150 µl 150 µl 150 µl 150 µl Glutamat 50 µl 50 µl Pyruvat 50 µl 50 µl Alanin 50 µl 50 µl 50 µl 50 µl -Ketoglutarat Die angegebenen Lösungen in Eppendorf Gefäße pipettieren und gut mischen. Dann die Reaktion durch Zugabe von Alanin50 µl 50 µl Aminotransferase H2O 50 µl 50 µl starten (gut mischen) und die Proben in einem 37oC Wasserbad mindestens 45 min. inkubieren. Anschließend werden die Proben auf Cellulosefolie aufgetragen. c) Dünnschichtchromatographie der Aminosäuren Für die Trennung und den Nachweis der Aminosäuren werden folgende Lösungen einzeln auf eine Cellulosefolie aufgetragen: 1) Glutamatstandard 2) Alaninstandard 3) Probe 1 4) Probe 2 5) Probe 3 6) Probe 4 Dafür wird die Cellulosefolie mit der breiten Seite in die Auftragschablone gelegt. Mit Kapillaren werden die Lösungen in den Kerben der Schablone solange aufgetragen, bis circa 3 mm große Flecken entstanden sind (Abb. 3). Die rechte untere Ecke der Folie wird mit einem weichen Bleistift markiert, damit später klar ist, an welcher Kante die Proben aufgetragen worden sind (Abb. 4). Die Folie wird unter dem Fön getrocknet und anschlie- 16 ßend so in die große Kammer der Chromatografiekammer gelegt, dass die Kante mit den Proben die poröse Platte berührt (Abb. 4). In die kleine Kammer werden 1,5 ml Laufmittel (1Propanol / 34% Ammoniaklösung 7 : 3) gefüllt. Die Chromatografiekammer wird sofort mit der Glasplatte verschlossen. Abb.3: Auftragschablone mit 6 Kerben ← Große Kammer mit Cellulosefolie ← Markierung ← Poröse Platte ← Kleine Kammer (1.5 ml Laufmittel einfüllen) Abb.4: Chromatografiekammer 17 Sobald die Laufmittelfront ca. 0,5 cm vom oberen Rand der Folie entfernt ist, wird die Folie herausgenommen. Dann wird die Folie unter dem Fön getrocknet und mit Ninhydrinreagenz (0,2% Ninhydrin in Aceton) besprüht. Nach erneutem Trocknen an der Luft wird das Chromatogramm vorsichtig auf der Heizplatte bis zum Erscheinen der violetten Flecken erhitzt. AUSWERTUNG UND FEHLERDISKUSSION Jeder Praktikumsteilnehmer erstellt ein schriftliches Protokoll in Form der Tabelle auf der übernächsten Seite. Berechnung der spezifischen enzymatischen Aktivität: Spezifische Enzymatische Aktivität: Die Menge an Substrat (µmol Harnstoff) die innerhalb einer bestimmten Zeit (Stunde) durch eine definierte Menge Protein (mg Protein) umgesetzt wird. Demnach benötigt man: a. Die Menge an Protein, die in 1ml Ansatz vorlag (1) b. Die Menge an Harnstoff, die in 1ml Ansatz entstanden ist Menge an Protein: 1) Hierfür benötigt man die Extinktion der Proteinbestimmung mit der Biuret-Reaktion Reaktionsansätze nach Pipettierplan 3 2) Es gilt: Die Extinktion (Ext) steigt proportional zur Proteinkonzentration (c). Durch den Vergleich der Probe unbekannter Konzentration mit einer bekannten standardisierten Probe kann die Proteinkonzentration errechnet werden. Die Konzentration an Standardserumalbumin (als Referenzprotein) ist im Skript nachzulesen. CProbe / ExtProbe = C Standard / ExtStandard CProbe = ExtProbe x CStandard / ExtStandard 3) Es wurde eine Doppelbestimmung durchgeführt, wobei bei der einen Probe die doppelte Menge Leberextrakt eingesetzt wurde. Das muss bei der Berechnung eines Mittelwerts beachtet werden. Die Menge an Protein in 1ml Ansatz beträgt: 0.45 ml x CProbe = ___________ mg Protein 18 Harnstoffmenge: Aus den Extinktionen der photometrischen Harnstoffbestimmung (Pipettierplan 2) wird mittels der hier gegebenen Eichkurve die Menge an Harnstoff, bezogen auf 1 ml Ansatz, bestimmt. Beachten Sie, dass die Eichkurve im Bereich der Extinktionen, die in diesem Versuch gemessen werden, nahezu linear verläuft. Deshalb gilt: mg Harnstoff = Extinktion x 0.125 Ansatz 19 Tabelle zur Berechnung der spezifischen enzymatischen Aktivität Reaktionsgefäß‐ Nummer zugesetzte Substrate gemessene Extinktion nach Pipettierplan 2 = X1 1 2 Carbamyl‐ L‐Arginin/ phosphat/ ‐ Leberextrakt ‐ Leberextrakt 3 L‐Arginin/ + Leberextrakt 4 5 6 7 8 9 10 L‐Ornithin/ Ammonium‐ L‐Ornithin/ hydrogen‐ Carbamyl‐ Carbamyl‐ carbonat/ L‐Citrullin/ phosphat/ L‐Ornithin/ phosphat/ N‐Acetylglutamat/ + Leberextrakt + Leberextrakt + Leberextrakt + Leberextrakt + Leberextrakt L‐Ornithin/ Ammonium+ hydrogen‐ carbonat/ + Leberextrakt + Leber‐ extrakt Harnstoff in mol: 1mol Harnstoff wiegt 60 g X2 x 1000/60 = X3 Harnstoff produziert pro Stunde: X3/0.5 hr = X4 Harnstoff pro Stunde pro mg Protein: X4/ Menge an Protein in 1ml Ansatz Harnstoff (mg) bezogen auf 1 ml Ansatz X1 x 0,125= X2 20 AMINOTRANSFERASEN Liegen in Proben 2 und 4 die Aminosäuren Glutamat und Alanin in Gleichgewichtskonzentrationen vor? Welche Aussagen kann man über das Gleichgewicht der Reaktion machen? Welche Bedeutung hat dies für den Stoffwechsel? SCHLUSSFOLGERUNGEN