Thermodynamische Relationen am idealen Gas, Rechnerei mit TD
Werbung
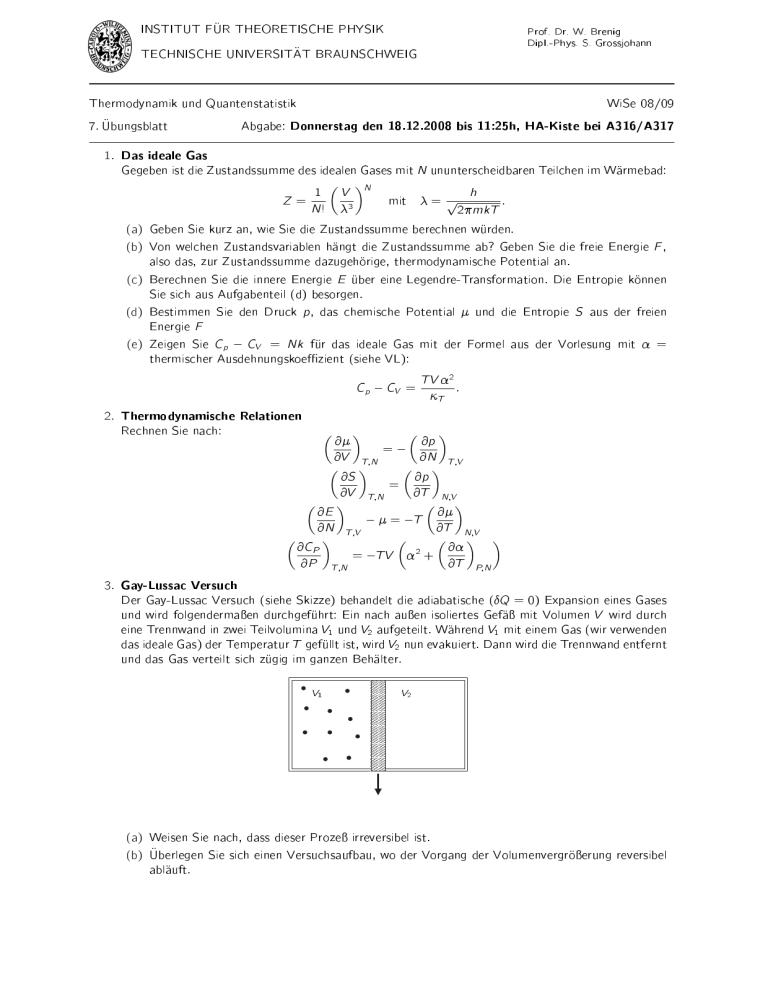
@ R THEORETISCHE PHYSIK INSTITUT FU Prof. Dr. W. Brenig Dipl.-Phys. S. Grossjohann T BRAUNSCHWEIG TECHNISCHE UNIVERSITA Thermodynamik und Quantenstatistik bungsblatt 7. U WiSe 08/09 Abgabe: Donnerstag den 18.12.2008 bis 11:25h, HA-Kiste bei A316/A317 1. Das ideale Gas Gegeben ist die Zustandssumme des idealen Gases mit N ununterscheidbaren Teilchen im Warmebad: 1 Z= N! (a) (b) (c) (d) (e) µ V 3 ¶N h : 2mkT Geben Sie kurz an, wie Sie die Zustandssumme berechnen wurden. Von welchen Zustandsvariablen hangt die Zustandssumme ab? Geben Sie die freie Energie F , also das, zur Zustandssumme dazugehorige, thermodynamische Potential an. Berechnen Sie die innere Energie E uber eine Legendre-Transformation. Die Entropie konnen Sie sich aus Aufgabenteil (d) besorgen. Bestimmen Sie den Druck p, das chemische Potential und die Entropie S aus der freien Energie F Zeigen Sie Cp CV = Nk fur das ideale Gas mit der Formel aus der Vorlesung mit = thermischer Ausdehnungskoezient (siehe VL): CV = Cp 2. Thermodynamische Relationen Rechnen Sie nach: µ mit = ¶ µ p T V 2 : T ¶ @ @p = @V T;N @N T;V µ ¶ µ ¶ @S @p = @V T;N @T N;V µ ¶ µ ¶ @E @ = T @N T;V @T N;V µ ¶ µ µ ¶ ¶ @CP @ 2 = TV + @P T;N @T P;N 3. Gay-Lussac Versuch Der Gay-Lussac Versuch (siehe Skizze) behandelt die adiabatische (Q = 0) Expansion eines Gases und wird folgendermaen durchgefuhrt: Ein nach auen isoliertes Gefa mit Volumen V wird durch eine Trennwand in zwei Teilvolumina V1 und V2 aufgeteilt. Wahrend V1 mit einem Gas (wir verwenden das ideale Gas) der Temperatur T gefullt ist, wird V2 nun evakuiert. Dann wird die Trennwand entfernt und das Gas verteilt sich zugig im ganzen Behalter. V1 V2 (a) Weisen Sie nach, dass dieser Proze irreversibel ist. berlegen Sie sich einen Versuchsaufbau, wo der Vorgang der Volumenvergroerung reversibel (b) U ablauft.






![1 Quickies [1 Punkt je Teilaufgabe]](http://s1.studylibde.com/store/data/020590559_1-49ea7971c46adadd85939f0c1ef4c681-300x300.png)



