Vorlesung Allgemeine Chemie: Komplexchemie/Kinetik II
Werbung

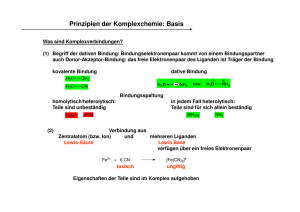
Vorlesung Allgemeine Chemie: Komplexchemie/Kinetik II Inhalte Komplexbegriff, allgemeine Eigenschaften von Komplexen, Konzept der sekundären Valenz nach Werner, die koordinative Bindung, Abgrenzung zur kovalenten Bindung, Koordinationszahl, cis/trans-Isomerie, VB-Methode, dn-Elektronenkonfiguration und Spinzustand (high spin, low spin), 18 Valenzelektronenregel, Ligandentypen nach Donorzentrum, Ladung, klassische Chelatliganden, Chelateffekt (edta), Ligandenaustauschreaktionen, Komplexgleichgewichte, Bruttokonstanten, Kopplung Komplex-GGW und Löslichkeits-GGW am Beispiel der Silberhalogenide, Nomenklatur, Koordinationspolyeder, Strukturisomerie, Bindungsisomerie, Faustregeln zur Koordinationszahl, Eeffekte der Koordination auf Ligandenazidität, Redoxpotanzial, Farbigkeit und Magnetismus Kinetik II: Geschwindigkeitsgesetze erster und zweiter Ordnung, pseudoerste Ordnung, Temperaturabhängigkeit der Geschwindigkeitskonstante k, Stoßmodell, Übergangszustand, Arrhenius-Gleichung, Bestimmung der Aktivierungsenergie, Ableitung von Reaktionsmechanismen aus Geschwindigkeitsgesetzen, Katalyse: Einfluss des Katalysators auf die kinetischen Parameter, heterogene Katalyse: 3-WegeAbgaskatalysator, homogene Katalyse Die folgenden Folien haben in der Vorlesung zur Veranschaulichung ausgewählter Fakten gedient, sie stellen keine umfassende Darstellung der betreffenden Themen dar. Prinzipien der Komplexchemie: Basis Was sind Komplexverbindungen? (1) Begriff der dativen Bindung: Bindungselektronenpaar kommt von einem Bindungspartner auch Donor-Akzeptor-Bindung: das freie Elektronenpaar des Liganden ist Träger der Bindung kovalente Bindung H3C CH3 H3 C CN dative Bindung H3 B NH3 bzw. H3B NH3 Bindungsspaltung homolytisch/heterolytisch: Teile sind unbeständig H3 C (2) in jedem Fall heterolytisch: Teile sind für sich allein beständig (BH3)2 CN NH3 Verbindung aus Zentralatom (bzw. Ion) und mehreren Liganden Lewis-Säure Lewis Base verfügen über ein freies Elektronenpaar Fe2+ + 6 CN- toxisch [Fe(CN)6]4- ungiftig Eigenschaften der Teile sind im Komplex aufgehoben Prinzipien der Komplexchemie: klassiche Beispiele Alfred Werner (1893): Begründung der modernen Komplexchemie Fähigkeit von Metallionen, über ihre Valenz hinaus Liganden zu binden Ausbildung regulärer Koordinationspolyeder Vielzahl stöchiometrischer Verbindungen aus CoCl3 und Ammoniak: Verbindung CoCl3· 6 NH3 CoCl3· 5 NH3 CoCl3· 4 NH3 CoCl3· 4 NH3 Farbe Luteosalz Purpureo Praseo Violo mit Ag+ fällbares Cl3 AgCl 2 AgCl 1 AgCl 1 AgCl NH3 H3N H3N Co NH3 Formulierung [Co(NH3)6]Cl3 [Co(NH3)5Cl]Cl2 [Co(NH3)4Cl2]Cl Was liegt hier vor? Cl Cl H3N Cl H3N Co Cl NH3 NH3 Isomerie als Beweis der oktaedrischen Koordination Prinzipien der Komplexchemie: VB-Theorie Valenzbindungstheorie – valence bond theory dative Bindung eines besetzten Donororbitals in ein leeres Orbital des Zentralions 18 Valenzelektronenregel: „Edelgas“-Konfiguration für Übergangsmetallkomplexe [Co(NH3)6]3+ ist diamagnetisch: alle 3d Elektronen sind gepaart [CoF6]3- ist paramagnetisch: die 3d-Orbitale sind entsprechend der HUND-schen Regel gefüllt Warum? Eine Erklärung liefert erst die Ligandenfeldtheorie Prinzipien der Komplexchemie: Liganden Donorzentren: verfügen über freie Elektronenpaare rechte Seite des PSE wichtigster Ligand: H2O alle Metallionen liegen in Wasser als Aqua-Ionen vor es gibt keine „nackten“ Metallionen Effekt der Koordination: Acidität des Wasser wird erhöht [Fe(H2O)6]3+ [Fe(H2O)5(OH)]2+ + H+ pKa = 2,2 anionische Donoren: VII. Gruppe: VI. Gruppe: V. Gruppe: Neutrale Donoren: F–, Cl–, Br–, I– RO– (aus ROH), RS– (aus RSH), O2– (aus H2O) Alkoholato Thiolato Oxo – 2– R2N (aus R2NH), auch RN (aus RNH2) Amido Imido VI. Gruppe: O R V. Gruppe: R S Ether R R N R Sulfide Amine P RR R Phophine RR spezielle anorganische Liganden: CN–, CO, NO, NO2–, NO3–, SCN–, N3– R' spezielle organische Liganden: H N N Pyridine N Imidazole O- O R C N Nitrile R Carboxylate N O R R Ketone R R Imine Prinzipien der Komplexchemie: Nomenklatur [CoCl(NH3)5]Cl2 Pentaamminchlorocobalt(III)-chlorid Na[PtBrCl(NO2)(NH3)] Natrium-amminbromochloronitrito-N-platinat(IV) [CrCl2(en)2]NO3 Dichlorobis(ethylendiamin)chrom(III)-nitrat [Ni(H2O)2(NH3)4]SO4 Tetraammindiaquanickel(II)-sulfat Regeln für die Formeln der Verbindungen: (1) (2) (3) (4) bei salzartigen Verbindungen: erst das Kation, dann das Anion im Komplexteil: erst das Metall, dann die Liganden rrst anionische Liganden, dann neutrale Liganden danach Liganden in alphabetischer Reihenfolge Regeln für die Namen der Verbindungen: (1) (2) (3) (4) (5) (6) bei salzartigen Verbindungen: erst das Kation, dann das Anion im Komplexteil: erst die Liganden dann das Metall mit Oxidationsstufe Liganden in alphabetischer Reihenfolge Anzahl der Liganden: (mono), di, tri tetra anionische Liganden enden auf o (chloro, thiolato, aber nicht aquo) Komplexanionen enden auf –at Prinzipien der Komplexchemie: Mehrzähnige Liganden einige „Klassiker“ unter den Liganden Prinzipien der Komplexchemie: Chelatliganden tren Tris-2-aminoethylamin nta Nitrilotriacetat edta Ethylendiamintetraacetat Prinzipien der Komplexchemie: Chelateffekt O OH HO O O N HO OH H4edta H O O O O N H O O O 2- O O N Ni O O O N O O H O Ni(H2O)4 N O O O N [Ni(H2O)6]2+ N O O N Ni O O O O O H Ursache der erhöhten Stabilität: Entropiegewinn durch die Freisetzung einzähniger Liganden (thermodynamisch) Konzept der erhöhten lokalen Konzentration bei Dissoziationsvorgängen (kinetisch) Prinzipien der Komplexchemie: Struktur Koordinationszahl: Zahl der Ligandenatome, die an das Zentralion gebunden sind 2 bis 12, häufig 4 und 6 Polyeder: geometrische Figur, in der sich die Liganden um das Zentralion ausrichten Koordinationszahl 4 Koordinationszahl 5 Koordinationszahl 6 Koordinationszahl 7 Koordinationszahl 8 Prinzipien der Komplexchemie: Koordinationszahlen KooZ 2: KooZ 3: KooZ 4: Cu+, Ag+, Au+, Hg2+: d10-Ionen, gefüllte d-Schale H3 N Ag NH3 + eher selten, Metallionen wie KOOZ 2, oft durch raumerfüllende Liganden erzwungen NC Au CN _ SiMe3 Me3Si N M Me3Si N SiMe3 SiMe3 N M = Mn(III) Fe(III) Co(III) SiMe3 sehr häufig, besonders d0- und d10-Ionen oder mit großen Liganden tetraedrisch: z. B. Oxo-Anionen, MnO4– , [Zn(OH)4]2– quadratisch planar, Ni2+ (mit starken Liganden), Pd2+, Pt2+, Rh+, Ir+: d8-Ionen [(Ph3P)3RhCl], [PtCl2(NH3)2] KooZ 5: weniger häufig, oft durch die Ligandentopologie vorgegeben trigonal bipyramidal quadratisch pyramidal P Ph2P Ni Br + PPh2 PPh2 O O O V O O beide Strukturen haben vergleichbare Energien, leichte Umwandlung ineinander (Berry-Rotation) in [Ni(CN)5]3– sind beide Geometrien in einem Kristall vertreten Prinzipien der Komplexchemie: Koordinationszahlen KooZ 6: überragend: Oktaeder, auch als gestauchtes/gestrecktes Oktaeder O O O Fe O O O KooZ 7: KooZ 8 pentagonale Pyramide: [V(CN)7]4– überdachtes Oktaeder: [Zr(acacPh2)3Cl] überdachtes trigonales Prisma: Mo(CN)7]2– quadratisches Antiprisma: [Mo(CN)8]3– Faustregeln: eher selten: trigonal prismatisch Ph S Ph S S S Re S S Ph Ph Ph Ph vornehmlich frühe Übergangsmetalle wenig eigene Elektronen kleine Liganden späte Übergangsmetalle: kleine Koordinationszahlen frühe Übergangsmetalle: große Koordinationszahlen große Liganden: kleine Koordinationszahlen kleine Liganden: große Koordinationszahlen Prinzipien der Komplexchemie: Ligandenaustauschreaktionen UV-vis-Spektroskopie: Beweis konsekutiver Koordination Verbindungen sind farbig! Die Verbindung erscheint in der Komlementärfarbe der Absorption. Cuaq2+ + x NH3 Kinetik der Komplexchemie: Reaktionsverfolgung UV-vis-Spektroskopie willkürliches Beispiel (kein Chromkomplex) [Cr(H2O)5(Cl)]2+ [Cr(H2O)6]3+ Lambert-Beersches Gesetz Absorption A = – lg I1/I0 = ελ · c · l Vorlesung Allgemeine Chemie: Katalyse 3-Wege-Katalysator Vorlesung Allgemeine Chemie: Katalyse 3-Wege-Katalysator Problem der Oberflächenvergrößerung Vorlesung Allgemeine Chemie: Elektrochemie Lamdasonde als elektrochemische Zelle