Regulation der Nahrungsaufnahme
Werbung

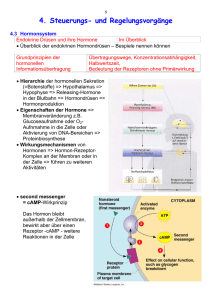
Regulation der Nahrungsaufnahme Die biologische Steuerung von Hunger und Sättigung ist im Hypothalamusbereich des Gehirns lokalisiert. Dabei wirken neurale und humorale Vorgänge zusammen, er nimmt auch metabolische Signale auf und integriert diese. Als weitere Sensoren und Vermittler des Energiestatus dienen: o Neurotransmitter: z.B. Serotonin, Noradrenalin o Hormone: Insulin-Glucagon, CCK, Sekretin, Gastrin, Somatotropin, o Nucleoside und Neuropeptide o Orosensorik: Aussehen, Geruch, Geschmack, Speichelfluss, Füllung des Verdauungstraktes... o Chemo- und Osmosesensoren. Besonders efferente Ausgänge besitzt der Hypothalamus zur Hypophyse: Ausschüttung von Hypophysenhormonen (ACTH, TSH, STH, ADH; durch diese werden periphere hormonproduzierende Drüsen geregelt.) Der laterale Hypothalamus kann als Hunger-, oder Appetitzentrum bezeichnet werden, während der ventromediale Hypothalamus als Sättigungszentrum bezeichnet werden kann. Der Anblick, Geruch oder Gedanke an Nahrung löst Signale auf kognitiver Ebene aus, bei der Hunger und verstärkte Symphatikusleistung stimuliert werden. Die Folge davon ist eine Steigerung metabolischer Prozesse (Speichelfluss, Magensaftsekretion, Hormontätigkeiten, usw.) die den Organismus für die Nahrungsaufnahme vorbereiten. Im Magen-Darm-Kanal befinden sich Rezeptoren, die auf Dehnung und chemische Veränderungen reagieren und somit an der Regulation der Nahrungsaufnahme beteiligt sind. Die Regulation erfolgt über afferente, parasympathische Fasern (Nervus vagus), die von den Dehnungsrezeptoren in der Magenwand ausgehen und auch einen Einfluss auf die Magenentleerungsrate haben. 1 Eine Dehnung des Magens bewirkt eine Steigerung der Magensaftsekretion und Aktivierung des Sättigungszentrums über den Nervus vagus der mit dem Hypothalamus in Beziehung steht. Chemorezeptoren in der Darmschleimhaut werden durch Aminosäuren und Glucose angeregt; dadurch, dass sie das ZNS über die Anwesenheit von Nährstoffen im Verdauungstrakt informieren, können sie für die Regulation der Nahrungsaufnahme von Bedeutung sein. 2 Aufbau und Funktion der Zellmembran, Transportsysteme Bau und Funktion der Zellmembran: 7 – 10 nm Dicke Die Zellmembran besteht aus einer weitgehend flüssigen, bimolekularen Lipidschicht, die von globulären Proteinen mosaikartig durchsetzt wird (integrale Proteine). Ein Teil der Proteine liegt der Außen- oder Innenseite der Lipidschicht an (periphere Proteine). In der Lipiddoppelschicht, die vor allem aus Phospholipiden aufgebaut ist, sind die hydrophilen Gruppen nach beiden Seiten der Membran ausgerichtet. Die hydrophoben Enden weisen ins Innere. Zweiwertige Ionen (vor allem Ca2+) dienen zur Stabilisierung der Membran. Zellmembrane unterliegen ständigen Ein- und Umbauvorgängen. Zellmembrane bilden weiterhin die strukturelle Basis der gewebespezifischen Rezeptoren für Hormone und andere Botenstoffe sowie zur Erkennung fremder Zellen. Mit Hilfe exponierter Kohlenhydrate, können Zellen andere erkennen bzw. sich an diese anlagern. Die Zellmembran kann durch Ausstülpungen oder Einfaltungen der Zelloberfläche durch Mikrovilli vergrößert werden. Eine wichtige Eigenschaft von Zellmembranen ist ihre selektive Durchlässigkeit. Diese wird zum Teil von integralen Transportproteinen, Kanälen, Carrier, Pumpen gesteuert. Lipophile Stoffe können solche Membranen leicht passieren. Auch für andere Stoffe, wie Wasser, O2, CO2, Ethanol und Harnstoff, bilden diese nur ein geringes Diffusionshindernis. Transportproteine können die Permeabilität maßgeblich beeinflussen. Kanäle: Kanalproteine bilden jeweils einen wassergefüllten Kanal, durch den bei Öffnung (gating) kleine Molekühle diffundieren können. Antreibende Kraft sind dabei ein Konzentrationsgradient und evt. Auch eine Potentialdifferenz. In fast allen Zellmembrane befinden sich Wasserkanäle, die permanent geöffnet sind. Es handelt sich um einen passiven Transportvorgang. Es gibt z.B. Na, Ca, K und Cl-Kanäle 3 Carrier: sie dienen ebenfalls dem passiven Transport Man unterscheidet Symporter, die mehrere Teilchenarten in gleicher Richtung transportieren und Antiporter , die verschiedene Teilchenarten jeweils in entgegengesetzter Richtung befördern. Die einfachen Carrier nennt man Uniporter. Pumpen: auch ATPasen, Sie hydrolisieren an der Innenseite der Membran ATP zu ADP und P und nutzen die freiwerdende Energie für den aktiven Transport. Wichtigster aktiver Transporter ist die Na+/K+-ATPase. 4 Mitochondrien Mitochondrien und Energiegewinnung: Die Mitochondrien sind unter anderem der Ort der Kohlenhydrat- und Lipidoxidation zu CO2 und H2O unter O2- Verbrauch. Der Zitronensäurezyklus, die Atmungskette und die damit verknüpfte ATP- Bildung laufen u. a. dort ab. Mitochondrien stellen also separate Räume für den Energiestoffwechsel dar. Die hierfür erforderlichen Enzyme sind in den Mitochondrienstrukturen angeordnet. Reich an Mitochondrien sind stoffwechsel- und transportintensive Zellen, z. B. Leberzellen bzw. Darm- und Nierenepithelzellen. Die Mitochondrien sind von einer glatten äußeren Membran und einer inneren Membran umgeben, die zur Oberflächenvergrößerung tief gefaltet ist (Cristae) und wichtige Transportaufgaben hat. Die Mitochondrien gehen stammesgeschichtlich wahrscheinlich auf eingewanderte aerobe Bakterien zurück, die ursprünglich mit der ansonsten anaeroben Zelle in Symbiose lebten (Symbiontenhypothese). Ein Relikt sind die (bakterielle) DNA und die Doppelmembran der Mitochondrien. Auch sie besitzen Ribosomen zur Proteinsynthese. 5 Aufgaben des Zellkerns Der Zellkern ist das Steuerungszentrum der Zellfunktion sowie der Träger der genetischen Information. DNA: Der Zellkern enthält Chromatin mit den Trägern der erblichen Information, den Desoxyribonukleinsäuren (desoxyribonucleic acids, DNA). Die DNA- Doppelstränge (Doppelhelix; bis zu 7 cm Länge) sind so gerollt und gefaltet, dass die mikrometerlangen Chromosomen entstehen. Der Mensch besitzt davon 46, nämlich 22 Autosomen- Paare sowie 2 XChromosomen (Frau) bzw. 1 X- und 1 Y- Chromosom (Mann). Die DNA besteht aus einer Kette dreiteiliger Moleküle, den Nukleotiden, die je eine Pentose, Phosphat und eine Base enthalten: Am Zucker des monotonen Zucker- Phosphat- „Rückgrats” (... Desoxiribos- Phosphat- Desoxiribose... ) hängt je eine von vier verschiedenen Basen. Das Muster der Basenfolge stellt den genetischen Code für je eines der rund 100 000 unterschiedlichen Proteine dar, die eine einzige Zelle während ihres Lebens synthetisiert (Genexpression). Zwei solcher DNA- Stränge sind in der Doppelhelix über die sich jeweils gegenüberliegenden Basen verbunden, immer Adenin (A) mit Thymin (T) und Guanin (G) mit Cytosin (C). Die Basenfolge des einen DNA Bandes ist daher stets ein „Spiegelbild” des anderen. Somit kann ein Strang als Matrix zur Neusynthese eines komplementären Stranges mit identischem Informationsgehalt dienen, was vor jeder Zellteilung zur Verdoppelung der Erbinformation genutzt wird (Replikation) 6 Glucosemetabolismus, Energiebereitstellung, ATP-Synthese Glucose dient den Zellen vieler Organe als wichtige Energiequelle. Das Gehirn und die Erythrozyten sind fast ausschließlich auf die durch den Glucoseabbau freigesetzte Energie angewiesen. Daher wird die Glucosekonzentration im Blut durch einen komplexen Regelkreis konstant gehalten. Der Abbau der Glucose führt letztendlich zur Synthese der energiereichen Verbindung Adenosintriphosphat. ATP ist Kosubstrat zahlreicher biochemischer Synthesereaktionen und liefert die Energie für die Muskelkontraktion sowie für die aktiven Membrantransporte. Die erste Phase des Glucoseabbaus erfolgt im Zytosol ohne den Verbrauch von Sauerstoff. Man nennt diesen Prozess anaerobe Glykolyse. Sie zerlegt Glucose in Pyruvat. Bei den Abbaureaktionen kommt es bereits zu einem Gewinn von 2 Mol ATP pro Glucose-Molekühl. Außerdem entsteht NADH+ H+ aus NAD+. Da NAD+ nur in geringer Menge in der Zelle zur Verfügung steht muss dieses wieder aus NADH+ H+ oxidiert werden. Dies erfolgt entweder aerob während der Vorgänge der Atmungskette oder Pyruvat wird unter Sauerstoffmangel zu Laktat hydriert. Zitratzyklus: Der oxidative Abbau von Pyruvat zu Kohlendioxid und Wasser erfolgt in den Mitochondrien. Koenzym A hat dabei eine Schlüsselstellung. Pyruvat wird im Matrixraum durch Dekarboxylierung und Dehydrierung zu AzetylCoA oxidiert. Azetyl-CoA und Oxalacetat bilden Zitrat und damit beginnt eine geschlossener Reaktionskreis, der Zitratzyklus. Die Essigsäure wird dabei in CO2 und Coenzym-gebunden Wasserstoff überführt. Atmungskette: Das im Zitratzyklus entstandene NADH+H+ gelangt zur inneren Mitochondrienmembran und wird dort durch FMN zu NAD+ dehydriert. Die Elektronen des dabei freigesetzten Wasserstoffs werden über eine Transportkette von Enzymen weitergeleitet und schließlich auf molekularen Sauerstoff übertragen. Es entsteh Wasser und es wird Energie freigesetzt die zum 7 Teil an der inneren Mitochondrienmembran gespeichert wird und zur enzymatischen Phosphorilierung von ADP zu ATP dient. Die an den Reaktionen der oxidativen Phosphorylierung beteiligten Enzyme nennt man Atmungskette. Der vollständige Abbau eines Glucosemoleküls zu CO2 und H2O liefert somit insgesamt 38 Molekühle ATP. 8 Translation, Transkription, Proteinbiosynthese Zur Bereitstellung von Proteinen (Enzyme, Sekreteiweiße, Strukturproteine...) laufen in vielen Zellen ständig Proteinsynthesen ab. Dazu ist es Vorraussetzung, dass: - die benötigten Aminosäuren aktiviert sind, da dies Voraussetzung für eine Peptidbindung ist - die Abfolge der Aminosäuren durch ein genetisches Programm festgelegt ist. Die einem bestimmten Protein zugrundeliegende Aminosäurensequenz ist durch den genetischen Code festgelegt. Die Basenabfolge ist in der DNA verschlüsselt. Transkription: Die DNA eines Gens enthält zwar die vollständige Information für die Synthese, sie ist aber nicht die direkte Matrize für dessen Bildung. Die genetische Information muss erst in eine RNA übertragen werden. Anstelle von Desoxyribose enthält diese Ribose, und anstelle von Thymin enthält sie Uracil. Die Überschreibung der Basensequenz der DNA in die der RNA bezeichnet man als RNA. Die Transkription beginnt an Promotorsequenzen. Das zunächst entstandene Primärsequenz wird durch Spleißen (entfernt Introns, nicht kodierte Sequenzen) in eine reife Arbeitskopie überführt, diese nennt man mRNA. Die mRNA ist transportable, für ein bestimmtes Protein und kann mehrmals verwendet werden. Translation: Es folgt schließlich eine Übersetzung der mRNA enthaltenen Informationen in die tatsächliche Aminosäuresequenz eines Proteins. Ort dieser Synthese sind die Ribosomen. Es erfolgt eine Verknüpfung der aktivierten Aminosäuren an der tRNA nach Vorlage der mRNA. Für jede Aminosäure existieren spezifische tRNAMolekühle. Auf der mRNA kodieren je 3 Basen eine Aminosäure. Das komplementäre Gegenstück auf der tRNA ist das Antikodon. Beim Ablesen der mRNA wird mit dem Startkodon AUG begonnen und mit einem Stopkodon das fertige Peptid vom Ribosom freigesetzt. 9 Signaltransduktion Der Funktionszustand von Zellen kann durch extrazelluläre Signalstoffe (z.B. Neurotransmitter, Hormone, Vitamine...) gesteuert werden. Die Signalstoffe binden dabei an intrazelluläre oder membranständige Rezeptoren. Intrazelluläre Rezeptoren: Sie befinden sich im Zytoplasma oder im Zellkern (z.B. T3) Nach Bildung eines Ligand-Rezeptor-Komplexes bindet dieser im Zellkern an DNA und verändert dadurch die Genexpression. Die Folge ist eine gesteigerte oder reduzierte mRNA-Bildung und deren Folgen. Membranständige Rezeptoren: Einfach membrangängige Rezeptoren: Nach Bildung eines Ligand-Rezeptor-Komplexes kommt es intrazellulär zu einer Phosphorylierung von Proteinen. Dieser Vorgang stellt ein Signal dar und führ zu Zellwachstum und Zelldifferenzierung. Die Komplexe werden außerdem zum Teil ins Zellinnere transportiert. (z.B.: Aufnahme von LDL) Ionenkanalrezeptoren: Der Ligand-Rezeptor-Komplex führt zu einer Erhöhung oder Erniedrigung der Öffnungswahrscheinlichkeit bzw. der Dauer und dadurch zu einem veränderten Einstrom des Ions. ZB. Azetylcholin bindet an einen Natriumkanal, öffnet diesen und löst dadurch eine Depolarisation aus. G-Protein-gekoppelte Rezeptoren: Ein Ligand (first messenger) dockt an seinen Rezeptor an der Zellmembran und aktiviert dadurch ein G-Protein. Dieses kann einen Ionenkanal beeinflussen oder gemeinsam mit einem Enzym (cAMP, IP3) die Bildung eines 2ten Botenstoffes (second messenger) hemmen oder fördern. 10 Veränderung der Membranpotentiale, Aktionspotential, Funktion der Ionenkanäle Spezialisierte Zellen für Erregungsprozesse sind: Rezeptorzellen, Nervenzellen und Muskelzellen Rezeptoren haben die im gesamten Organismus vorkommen haben die Aufgabe, innere oder äußere Zustandsänderungen in Erregungen umzusetzen. Die erregbaren physiologischen Rezeptoren – im Gegensatz zu den molekularen Rezeptoren – werden als Sensoren bezeichnet. Nervenzellen bzw. Neurone sind die funktionellen Einheiten des Nervensystems. Sie leiten Erregungen über kürzere oder weitere Strecken und sie dienen im ZNS der Informationsverarbeitung. Die Neurone stehen über Synapsen (Verbindungsstellen) im Kontakt. Muskelzellen sind ebenfalls erregbar. Dies ist Voraussetzung für die Aufrechterhaltung ihres Spannungszustandes und die Auslösung von Kontraktionen. Ruhepotential Die ständige Aufrechterhaltung einer Potentialdifferenz zwischen Außen- Innenseite der Membran ist die Vorraussetzung für die Erregbarkeit von Nerven- und Muskelfasern. Das Ruhepotential beruht darauf, dass außen und innen verschiedene Ionen vorherrschen und diese durch Kanalproteine ihre Position ändern können. Das innere einer Zelle weißt gegenüber der Außenseite ein negatives Potential (~70 mV) auf. Die Na+/K+-ATPase sorgt ständig dafür, dass im Extrazellularraum eine hohe Na+-Konzentration und im Zellinneren eine hohe K+-Konzentration vorliegt (3 Na <-> 2 K) Das Ruhepotential wird im wesentlichen durch die Diffusion von K-Ionen bestimmt. 11 Aktionspotential Die Erregung einer Nerven- oder Muskelzelle besteht in einer kurzzeitigen Veränderung des Membranpotentials. Das Aktionspotential entsteht dann, wenn der stabile Zustand des Ruhepotentials gestört ist und dadurch eine partielle Depolarisation eintritt. Wird eine definierte Schwelle an Veränderung überschritten so laufen die weiteren Vorgänge von selbst ab. Die Konstanz des Aktionspotentials wird als „Alles-oder-Nichts-Gesetz“ der Erregung bezeichnet. Ionenströme während des Aktionspotentials Die Permeabilität für Na+ nimmt plötzlich stark zu, Na strömt ein (Aufstrichphase) Die Membran wird depolarisiert. Dadurch werden die Na-Kanäle wieder zunehmend inaktiviert. Die K-Leitfähigkeit steigt verübergehend und langsam an und K+ tritt verstärkt aus der Zelle aus. Das Gleichgewichtspotential wird langsam wieder erreicht (Repolarisation) Die Na/K-ATPase sorgt wieder für den Anfangszustand. Kanalproteine Der Na-Einstrom erfolgt über selektive Ionenkanäle. Das Kanalprotein erfährt durch die Depolarisation eine Konformationsänderung, wodurch der Kanal wie ein Tor geöffnet wird. Ein 2tes Tor verschließt in der Repolarisationsphase den Kanal wieder. Diese sind zunächst nicht wieder aktivierbar. Die K-Kanäle öffnen und schließen sich mehrfach nacheinander mit zunehmender Öffnungstendenz in der Repolarisationsphase, so bleiben sie während der ganzen Aktionspotentialdauer aktivierbar. In den Membranen von Dendriten und Axonen existieren außerdem Ca-Kanäle, die bei Depolarisation einen Ca-Einstrom ermöglichen. Eine Erniedrigung der CaKonzentration führt weiters zu einer erhöhten Erregbarkeit der Zelle (schnellere Depolarisation) Ca-Ionen fördern die Freigabe und Verschmelzung von Vesikel die eine Freisetzung von Transmittern in Synapsen bewirken. 12 Hämostase Primäre Hämostase Kommt es an einem Blutgefäß zu einer Verletzung der Endothelauskleidung, lagern sich Blutplättchen an Kollagen an. Man nennt diese Phase die Plättchenadhäsion. Ein großmolekulares Glykoprotein vermittelt dies. Es bildet eine Brücke zwischen Membranrezeptoren der Plättchen und den Kollagenfasern. Das subendotheliale Kollagen leitet auch die reversible Plättchenaggregation ein. Gefördert wird dies durch ADP und den plättchenaktivierenden Faktor. Außerdem wird die Vasokonstriktion durch in den Plättchenmembranen gebildetes Thromboxan und freigesetztes Serotonin veranlasst. Durch das inzwischen entstandene Thrombin verschmelzen die Blutplättchen zu einer homogenen Masse, zu einem irreversiblen Thrombozytenpfropf Fibrinogen vernetzt die Plättchen untereinander. Sekundäre Hämostase Der Thrombozytenpfropf kann den Endotheldefekt nicht stabil verschließen. Das zur selben Zeit aktivierte Gerinnungssystem kommt muss mitwirken. An der verletzten Stelle entsteht ein Fasernetz aus Fibrin. Dies wird gebildet aus Fibrinogen. Katalysiert wird der Vorgang durch Thrombin, welches aus Prothrombin nach einer Reihe an Aktivierungsschritten unter Beteiligung zahlreicher Gerinnungsfaktoren. Der Gerinnungsprozess kann entweder auf exogenem (sehr schnell) Weg oder auf endogenem Weg erfolgen. Der endogene Weg wird auch Intrinsic-System genannt und erfolgt über mehrere Zwischenstufen und dauert daher längere Zeit. 13 In der Regel sind beide Systeme ineinander übergreifend daran beteiligt. Die Endstrecke ist bei beiden Systemen gleich: Prothrombin (alpha-Globulin) wird unter Mitwirkung von Vitamin K (gebildet in Leber) in Thrombin umgewandelt. Es ist ein proteolytisches Enzym, spaltet Fibrinogen (ebenfalls in der Leber gebildet) und löst die Bildung von Fibrin aus. Faktor XIII fördert die Quervernetzung des noch instabilen Fibrin. Zuletzt ziehen sich die Fibrinfäden zusammen und ein Gerinnsel (Thrombus) entsteht unter Einschluss zahlreicher Erythrozyten. 14 Immunabwehr – unspezifisch, spezifisch Unspezifische humorale Abwehr Komplementsystem = ein in Blut und Gewebe vorhandenes komplexes Enzymsystem, das sowohl unspezifische als auch Immunreaktion-abhängige Funktionen erfüllt. Die einzelnen Komponenten werden von Makrophagen und Leberzellen synthetisiert. Eine Aktivierung erfolgt durch Antigen-Antikörper-Komplexe oder durch körperfremde Stoffe. Einige Aufgaben bestehen z.B. durch die Aktivierung von Phagozyten oder in der Zytolyse (Zerstörung) von mit Antikörpern besetzten Zielzellen. Lysozom Kommt in Körpersekreten vor. Es handelt sich um ein Enzym, welches in der Lage ist die Wandstrukturen bestimmter Bakterien zu spalten. Interferone Die speziesspezifischen Interferone sind hochaktive, körpereigene Proteine mit einem breiten Wirkungsspektrum. Es wird von infizierten Zellen freigesetzt. Es hemmt die Virus-Replikation in Zellen, stimuliert oder hemmt immunologische Reaktionen und aktiviert Killerzellen. Unspezifische zelluläre Abwehr Bestimmte Gruppen der weißen Blutkörperchen (neutrophile und eosinophile Granulozyten, Monozyten) können schädliche Stoffe oder Zellen phagozytieren. Die Phagozyten werden von Bakteriengiften, Zellzerfallsstoffen und fremden Zellen angelockt. Chemische Reize locken diese aus dem Blut zum Ort der Schädigung. Dazu gehören auch Faktoren des Komplementsystems. Die Phagozyten besitzen an ihrer Oberfläche Rezeptoren mit derer sie sich an Mikroorganismen anlagern können. Der Phagozyteninhalt (Phagosom) wird schließlich von Lysozomen abgebaut. Natürliche Killerzellen (große granulierte Lymphozyten) können durch ihrer sauren Hydrolasen Tumor und virusinfizierte Zellen unspezifisch zerstören. 15 Spezifische humorale Abwehr Die spezifische humorale Abwehr wird durch einen Antigenkontakt ausgelöst und durch B-Lymphozyten vermittelt. Sie entstehen in den Stammzellen des Knochenmark und unterliegen einer speziellen Prägung, d. h. sie weisen bestimmte Oberflächenmerkmale auf und sind damit für ein einziges spezifisches Antigen zuständig. Antikörper entstehen etwa 5-7 Tage nach Kontakt eines Antigens mit immunologisch kompetenten B-Lymphozyten. Antikörper stellen streng spezifische Antigenkomplementäre Reaktionsprodukte des Organismus dar (Schlüssel-Schloss-Prinzip) Immunkompetente B-Lymphozyten tragen auf ihrer Oberfläche monomere Immunglobuline als Antigen-spezifische Rezeptoren. Ein erster Kontakt mit einem passenden Antigen führt zur Ausbildung von Zellklonen und Differenzierung in Plasmazellen, die wiederum eine große Anzahl von identischen Antikörpermolekühlen derselben Spezifität synthetisieren. Bei einer Erstbegegnung eines B-Lymphozyten mit einem Antigen entstehen neben Plasmazellen (Effektorzellen) auch langlebige Gedächtniszellen, ebenfalls im Blut kreisen und die bei der nächsten Infektion schneller reagieren. Die gebildeten Antikörper bilden mit den Antigenen einen Antigen-AntikörperKomplex. Die schädliche Wirkung geht dadurch meist verloren, die Antigene werden neutralisiert und abgebaut. Spezifische zelluläre Abwehr Eine zweite Lymphozytenpopulation, die T-Lymphozyten, die ihren Ursprung ebenfalls in den Stammzellen des Knochenmarks hat, erhält ihre immunologische Prägung im Thymus. Sie verlassen dieses Organ als immunologisch kompetente Zellen mit spezifischen Oberflächenmerkmalen. Sie besitzen an ihrer Oberfläche antigenspezifische Rezeptoren, die sogenannten TZellrezeptoren, die Antigene nur dann erkennen, wenn sie auf der Oberfläche von Zellen gemeinsam mit MHC-Molekühlen vorkommen. 16 Wie bei den B-Lymphozyten entwickelt sich nach dem Erstkontakt mit einem Antigen eine bestimmte Familie (Klon) der T-Lymphozyten. Einige der neugebildeten Tochterzellen stellen langlebige Gedächtniszellen dar, und lösen bei einem späteren Kontakt eine schnellere und heftigere Reaktion aus. Subpopulationen und Funktionen der T-Lymphozyten Die T-Effektorzellen – ebenfalls Tochterzellen – nehmen direkt an der Immunreaktion teil. Es finden sich dabei sehr viele Subpopulation mit unterschiedlichen Funktionen. T-Killer-Zellen binden an die Zielzelle und lysieren diese durch Stimulation von den T-Helferzellen, die Zytokine abgeben. T-Helferzellen, die nach Antigenpräsentation aktiviert werden und eine Reihe von Zytokinen abgeben, aktivieren sich selbst, andere T- und B-Zellen, Makrophagen, Neutrophile, Eosinophile und Endothelzellen. 17 Herz Erregungsprozesse im Herzen Das Herz hat die Aufgabe, das ihm aus den Körpern und Lungenvenen zufließende blut in das arterielle System des kleinen bzw. großen Kreislaufs auszutreiben. Die entsprechenden Drücke werden durch rhythmische Erschlaffung und Kontraktion der Kammern entwickelt. Die Erschlaffungsphase wird als Diastole, die Kontraktionsphase als Systole bezeichnet. Autorhytmie Herzmuskelfasern besitzen die Eigenschaft der Erregbarkeit. Bestimmte anteile der Herzmuskulatur, die Fasern des Erregungsbildungs- und Erregungsleitungssystems, können spontane Erregungen bilden. Normalerweise entstehen diese im Sinusknoten, laufen dann über den AV-Knoten, die His-Bündel und die Purkinje-Fasern, die über gap junctions schnell miteinander verbunden sind. Der Sinusrhythmus in Ruhe beträgt 60-80 Erregungsbildungen/min. Fällt dieser aus, übernimmt der AV-Rhythmus die Erregungsbildung – mit einer Frequenz von 4060/min. Aktionspotential im Arbeitsmyokard Es kommt zunächst zu einem raschen Potentialanstieg (Aufstrichphase). Dem folgt die Repolarisationsphase, die hier einem Plateau gleicht. Dies ist darauf zurückzuführen, dass langsame Ca-Kanäle für längere Zeit geöffnet sind und die Leitfähigkeit für K-Ionen in dieser Phase erniedrigt ist. Während des Erregungsvorgangs ist die Herzmuskelfaser nicht erregbar, was vor einer Störung der Herzaktion schützt. Ionale Einflüsse auf Erregung und Kontraktion Eine Erhöhung der extrazellulären K+Konzentration (Hyperkaliämie) führt zu einer Depolarisation des Ruhepotentials. Eine mäßige Erhöhung der extrazellulären Ca-Konzentration steigert geringgradig die Kontraktionskraft des Herzens durch Verstärkung der elektromechanischen Kopplung, Adrenalin und Noradrenalin verstärken ebenfalls den Ca-Einstrom während des Aktionspotential und damit auch die Kontraktionskraft. 18 Nervale Beeinflussung der Herzaktion Efferente Herznerven (vegetatives NS) können die Herzaktionen modifizieren und den Bedürfnissen des Gesamtorganismus anpassen. Insbesondere beeinflussen sie die Herzfrequenz, die atrioventrikuläre Erregungsüberleitung und die Kontraktionskraft. Der Sympathikus hat einen fördernden Effekt auf diese Größen. Als Überträgersubstanzen dienen dabei Noradrenalin und Adrenalin. Der Parasympathikus übt dagegen einen hemmenden Einfluss aus, seine Überträgersubstanz ist Azetylcholin. Anpassung der Herzaktion Das Schlagvolumen eines Herzschlages beträgt etwa 70 ml, die Frequenz beträgt durchschnittlich 70/min, das ergibt ein Herzzeitvolumen von 5l/min im Ruhezustand. Dieses kann jedoch bei gesteigerter Tätigkeit durch Einfluss der Herznerven sehr schnell ansteigen. Der wichtigere extrakardiale Anpassungsmechanismus führt bei gesteigerten Belastung, zu einer Aktivierung des Sympathikus und in Folge zu einer verstärkten Kontraktionskraft. Dies geschieht durch den Einstrom von Ca in die Muskelfasern, die zu verstärkten Aktin-Myosin-Interaktionen führen. Weiters kommt es bei körperlicher Belastung durch Zunahme des Sympathikustonus, aber vor allem durch Abnahme des Vagustonus zu einer Steigerung der Herzfrequenz. 19 Gefäßsystem und Blutkreislauf: Weiterleitung und Kontraktion, Zusammenhang zwischen Kreislaufsystem und Lungenkreislauf, Blutdruckregulation, Regulation der Pumpleistung, Organdurchblutung, Vasokonstriktion und –dilatation. Neuronale Kontrolle des Gefäßtonus Bereits unter Ruhebedingungen besteht in den Blutgefäßen ein gewisser Spannungszustand der Gefäßwände, den man als Ruhetonus bezeichnet. Eine Abnahme führt zu einer Vasodilatation, eine Zunahme zu einer Vasokonstriktion. Der Ruhetonus setzt sich zusammen aus dem basalen Tonus und dem neurogenen Tonus. Der basale Tonus wird durch rhytmische Spontanentladungen von Schrittmacherzellen in der glatten Gefäßmuskulatur hervorgerufen. Der neurogene Tonus, der sich dem basalen Spannungszustand überlagert, ist auf die ständige Einwirkung von Impulsen des sympathischen Nervensystems zurückzuführen. Die Reizübertragung erfolgt in synaptischer Verbindung der Sympathikusfasern mit den glatten Muskelzellen und der Übertragung durch Noradrenalin. Noradrenalin löst vorwiegend eine Reaktion mit postsynaptischen alpha1Adrenorezeptoren eine Kontraktion der Gefäßmuskulatur aus. Die Freisetzung von Noradrenalin kann durch lokale Einwirkung von Angiotensin II gefördert oder von NO gehemmt werden. Bei Sympathikusaktivierung nimmt die Durchblutung am stärksten in der Haut und in der Skelettmuskulatur zu, weniger in Nieren, Intestinaltrakt. Die Lungendurchblutung wird kaum beeinflusst. 20 Myogene Autoregulation Die rasche Erhöhung des Gefäßinnendrucks führt in den terminalen Arterien und Arteriolen zahlreicher Gewebe zu einer Kontraktion der glatten Gefäßmuskulatur. Es handelt sich dabei um eine myogene Reaktion ohne Mitwirkung von Gefäßnerven. Durch die Dehnung der Gefäße wird ein Ca-Einstrom in die glatten Muskelzellen ausgelöst, der auf der Öffnung spannungsabhängiger oder dehnungsabhängiger CaKanäle beruht. Besonders ausgeprägt ist diese Autoregulation im Bereich der Nieren- und Hirnarterien. Lokal-chemische und hormonale Durchblutungsregulation Eine Vasodilatation kann bewirkt werden durch einen lokalen Anstieg des CO2Partialdrucks und der Protonenkonzentration, durch stärkere Abnahme des O2Partialdrucks. Noradrenalin ruft immer eine Vasokonstriktion hervor. Adrenalin teils eine konstriktorische, teils eine dilatatorische Wirkung. Dies erklärt sich dadurch, dass in den Gefäßmuskelmembranen 2 verschiedene Rezeptortypen vorkommen. Alpha1 bewirken eine Vasokonstriktion und Beta1 eine Vasodilatation. Angiotensin II und Adiuretin wirken ebenfalls vasokonstriktorisch. Atriopeptin wirkt vasodilatatorisch. Ebenfalls NO. Histamin und Serotonin sind Gewebehormone und haben ebenfalls bei der Durchblutungsregulation eine Rolle. 21 Regulation des Blutkreislaufs Kurzfristig Sie reagieren auf veränderte Kreislaufanforderungen innerhalb weniger Sekunden, verlieren jedoch bei dauernder Belastung nach einigen Tagen ihre Wirksamkeit . Pressorezeptorenreflexe Pressorezeptoren befinden sich im arteriellen Gefäßsystem, vor allem im Aortenbogen und im Karotissinus. Sie schicken ständig Impulse zum „Kreislaufzentrum“ im Stammhirn, die Information über den Druck und dessen Änderungen liefern. Kommt es zu einer Drucksenkung, so wird der Sympathikus aktiviert und der Parasympathikus gehemmt. Dadurch wird die Herzfrequenz heraufgesetzt und der periphere Widerstand durch Vasokonstriktion erhöht. Bei Aktivierung des sympathischen Systems infolge eines Blutdruckabfalls werden aus dem Nebennierenmark vermehrt Katecholamine ausgeschüttet, die vorwiegend Vasokonstriktion auslösen. Dehnungsrezeptorenreflexe Sie befinden sich im Herzen und in den großen intrathorakalen Venen. Sie sind in der Lage, den Füllungszustand des Gefäßsystems und damit das zirkulierende Blutvolumen ständig zu kontrollieren. Mittelfristig Die mittelfristigen Regulationen setzen bei plötzlicher Blutdruckänderung nach einigen Minuten ein und erreichen erst nach einer gewissen Zeit ihre volle Wirksamkeit. Renin-Angiotensin-System Kommt es zu einer Einschränkung der Nierendurchblutung durch dortigen Blutdruckabfall so wird in verstärktem Maß Renin aus der Niere freigesetzt. Daraufhin wird auch Angiotensin II vermehrt gebildet, was zu einem starken Anstieg der arteriellen Widerstandsgefäße führt, sodass der periphere Widerstand und damit auch der Blutdruck ansteigen. Es fördert ferner die ADH-Freisetzung und steigert das Durstgefühl. 22 Transkapilläre Flüssigkeitsverschiebung Eine Blutdrucksteigerung führt automatisch zu einer Zunahme des effektiven Filtrationsdruck. Dies führt zu einer vermehrten Filtration in den interstitiellen Raum. Das Blutvolumen und sekundär auch der arterielle Blutdruck nehmen ab. Langfristig Renin-Angiotensin-Aldosteron-System Angiotensin II stimuliert die Aldosteronsekretion durch die Nebennierenrinde. Unter dem Einfluss von Aldosteron wird die Na+ Rückresorption aus dem Tubulussystem der Niere gefördert und damit weniger Flüssigkeit ausgeschieden. Das Blutvolumen wird dadurch erhöht und der Blutdruck erhöht. Adiuretin Die afferenten Impulse von den Dehnungsrezeptoren der Vorhöfe beeinflussen auch bestimmte Regionen im Hypothalamus, in denen ADH gebildet wird. Eine verstärkte Erregung der Vorhofrezeptoren bewirkt nach 10-20 min eine Hemmung der ADHFreisetzung, so dass die renale Flüssigkeitsausscheidung ansteigt. Natriuretische Peptide Atriopeptin, das bei verstärkter Dehnung der Vorhöfe dort freigesetzt wird, bewirkt eine Reduktion des Blutvolumens und –drucks. Es hemmt die Freisetzung von Renin und Aldosteron und steigert die renale Natriumund Flüssigkeitsausscheidung. 23 Atmung Die Vitalkapazität stellt ein Maß für die Ausdehnungsfähigkeit von Lunge und Thorax dar. Sie beträgt im Durchschnitt 4 – 5 l und reicht vom max. inspiratorischen Volumen bis zum max. expiratorischen Volumen. Das Residualvolumen ist jenes Volumen, das nach maximaler Exspiration noch in der Lunge zurückbleibt. Ca. 1,5 – 2 l Unter dem Atemzeitvolumen versteht man das in der Zeiteinheit eingeatmete oder ausgeatmete Gasvolumen. Es ist das Produkt aus Atemzugvolumen (~ 0,5 l) und Atmungsfrequenz (14 Atemzüge/min in Ruhe) Das Volumen des Atemwegssystem (Nase, Rachen, Kehlkopf – Bronchiolen) wird als anatomischer Totraum bezeichnet, weil dort kein Gasaustausch stattfindet. Von dem bei ruhiger Atmung ventilierten Atemzeitvolumen von 7l/min entfallen 2l/min auf die Totraumventilation und 5l/min auf die alveoläre Ventilation. Diffusion der Atemgase In den Lungenalveolen wird ein hoher O2-Partialdruck aufrechterhalten, während das venöse mit einem niedrigeren O2-Partialdruck in die Lungenkapillaren eintritt. Für CO2 besteht eine Partialdruckdifferenz in entgegengesetzter Richtung. Diese Partialdruckdifferenzen stellen die „treibende Kräfte“ für die Diffusion dieser Gase und damit den pulmonalen Gasaustausch dar. Ein kleiner Teil des aufgenommenen Sauerstoffs bleibt physikalisch gelöst im Blutplasma, während der überwiegende Anteil in den Erythrozyten an Hämoglobin gebunden wird. CO2 diffundiert in entgegengesetzter Richtung aus den Erythrozyten in den Alveolarraum, nachdem es aus seinen chemischen Bindungen freigesetzt wurde. Zentrale Rhythmogenese und Atmungsregulation Die Atmungsbewegungen von Thorax und Zwerchfell werden durch die rhythmische Tätigkeit von respiratorischen Neuron in der Medulla oblongata gesteuert, dessen Neurone als ventrale respiratorische Gruppe (VRG) angeordnet sind. 24 Die chemische Atmungsregulation sichert die Anpassung der Atmung an die Stoffwechselleistungen des Organismus. Eine Erhöhung des arteriellen CO2-Partialdrucks, führt zu einer Steigerung des Atemzeitvolumens. Ein Absinken des arteriellen pH-Werts unter 7,4 wird durch eine Hyperventilation, ein Ansteigen über die Norm durch eine Hypoventilation beantwortet. Die Blutgas- und pH-Wirkungen werden z.T. über periphere Chemorezeptoren vermittelt. Dies sind Nervenzellansammlungen liegt an der Halsschlagader und in der Nähe des Aortenbogens. Auch im Hirnstamm befinden sich sehr chemosensible Strukturen im Hirnstamm, die auf Änderungen der CO2- und H+-Spiegel sofort reagieren. Die Atemwege und das Lungenparenchym sind mit spezifischen Rezeptoren ausgestattet, deren Reizung die Atmung reflektorisch über den N. vagus beeinflusst. 25 Atemgastransport des Blutes Sauerstoff und Kohlendioxid werden im Blut sowohl in physikalisch gelöster als auch in chemisch gebundener Form transportiert. Stickstoff und die anderen Gase, die am Stoffwechsel nicht beteiligt sind, liegen im Blut ausschließlich in physikalischer Lösung vor. Der weitaus größte Teil des mit dem Blut transportierten Sauerstoffs ist an das Hämoglobin gebunden. Eine Affinitätsabnahme, findet man bei Zunahme... - der H+-Konzentration - des CO2-Partialdrucks - der Temperatur Kohlendioxid, das als Endprodukt des oxidativen Stoffwechsels in den Körperzellen entsteht, wird zu einem geringen Teil in physikalisch gelöster, überwiegend jedoch in chemisch gebundener Form zur Lunge transportiert. CO2 diffundiert in die Kapillaren und wird dort über Kohlensäure zu HCO3-Ionen und H+ dissoziiert. Diese Reaktion läuft in den Erythrozyten sehr viel schneller ab. Danach wandern die HCO3- ihrem Diffusionsgefälle entsprechend wieder in den Plasmaraum. Cl- treten zum Ausgleich der Ladung in die Erythrozyten ein. 26 Vitamine Vitamine sind lebensnotwendig und schon in niedriger Dosis physiologisch wirksam. Sie können im menschlichen Organismus nicht oder nur unzureichend gebildet werden. Sie müssen daher entweder als solche oder als Vorstufen zugeführt werden. Aufgrund ihrer verschiedenen Löslichkeit werden Vitamine in 2 Gruppen, die fettlöslichen und wasserlöslichen Vitamine unterteilt. Fettlösliche Vitamine können ferner nur dann resorbiert werden, wenn die Fettresorption intakt ist, d.h. wenn genügend Galle sezerniert wird. Vitamin A Bei Bedarf wird es aus den Speichern durch Biohydrolyse freigesetzt und ins Plasma abgegeben, wo es an Globulin oder Albumin gebunden transportiert wird. Das wichtigste Provitamin ist beta-Karotin, aus dem 2 Molekühle Vitamin A entstehen können. Provitamin wird bei erhöhter Aufnahme im Gewebe gespeichert. Vitamin A ist notwendig für das Wachstum des gesamten Körpers. Es schützt Epithelzellen der Schleimhaut vor Verhornung und fördert an der restlichen Haut diese. Außerdem ist es für den Sehvorgang notwendig. Der Retinol-Komplex wird an ein Membranprotein der Zielzelle gebunden, welches dann die Aufnahme bewirkt. Im Zytoplasma bindet es an seinen Rezeptor, mit dem es dann in den Zellkern wandert und die Genexpression und Proteinsynthese bewirkt. Vitamin D Cholekalziferol entsteht in der Haut durch Spaltung von 7-Dehydrocholesterin, das in der Leber aus Cholesterin gebildet wird, durch Einwirken von UV-Strahlen. Bei Kleinkindern und Säuglingen verursacht ein Mangel Rachitis durch Kalkarmut und abnorme Weichheit des Knochensystems und anschließende Deformierungen des Skeletts. 27 Aus Cholekalziferol entsteht in der Niere Kalzitriol. Dies steigert die Resorption von Ca2+ und P im Dünndarm und fördert eine Mineralisation der Knochenmatrix. Vitamin E Tocopherole ist an Oxidations-Reduktions-Vorgängen im Stoffwechsel beteiligt. Es vermeidet als Radikalfänger die Peroxidbildung höher ungesättigter Fettsäuren in Membranlipiden, in die es aufgrund seiner langen Seitenkette integriert wird. Wie Vitamin C hemmt es weiters die Nitrosaminbildung. Vitamin K Menachinon ist für die Synthese mehrerer Blutgerinnungsfaktoren sowie von Protein C und S in der Leber erforderlich. 28 Einflüsse auf den Magen-Darm-Trakt, Mobilität und Regelung der Sekretion Ausschließlich dem Transport dienen er Oropharynx und die Speiseröhre, Reservoirfunktion haben vor allem Magen, Gallenblase und Rektum. Der Dünndarm ist der Hauptort für die Verdauung und Resorption. Gesteuert werden diese Funktionen durch eine große Zahl von Hormonen, gastrointestinalen Peptiden und Neuropeptiden, durch die intrinsische Aktivität der glatten Muskulatur, durch das vegetative NS, einschließlich der viszeralen Afferenzen, und durch das Darmnervensystem. Aktivitäten der quergestreiften Muskulatur am Anfang und Ende des Gastrointestinaltraktes stehen unter der Kontrolle des somatischen Nervensystems. Der Gastrointestinaltrakt verfügt über ein eigenes enterisches Nervensystem, das die elementaren motorischen und sekretorischen Funktionen von Magen und Darm in enger Kooperation mit den gastrointestianalen Hormonen steuert. Sympathikus und Parasympathikus des vegetativen NS wirken modulierend auf das Darmnervensystem. Grundsätzlich fördert der Parasympathikus Motilität und Sekretion. Als Neurotransmitter der Parasympathischen Fasern dient hier Azetylcholin. Es finden sich aber auch hemmend wirkende Fasern; sie benutzen wahrscheinlich das Neuropeptid VIP, ATP, Somatostation und NO als Transmitter. Der Sympathikus führt zu einer Abnahme der Durchblutung, steigert jedoch den Tonus der gastrointestinalen Sphinkteren. Bei den Sympathikusfasern dient Noradrenalin als Überträgersubstanz an den Effektorzellen. Die Wirkung des Sympathikus liegt vor allem in einer Hemmung erregender Neurone. Gastrointestinale Hormone und Peptide steuern und koordinieren die Motilität, die Sekretion und das Schleimhautwachstum. Darüber hinaus sind sie an der Regulation der Resorption und der lokalen Durchblutung beiteiligt. Die klassischen gastrointestinalen Hormone sind Gastrin, Sekretin, Cholezystokinin und GIP. Freisetzungsreize für diese sind eine Vagusaktivierung und Rezeptoren an 29 gastrointestinalen endokrinen Zellen, die auf bestimmte Substanzen im Darmlumen reagieren und dann eine Freisetzung bewirken. Die gastrointestinale Motilität wird von Schrittmacherzellen gesteuert. Sie regulieren die Magenperistaltik. Der Ösophagus unterliegt einer nervalen Steuerung, und der Dünndarm wird durch das enterische Nervensystem gesteuert. Der Colon besitzt eigene Schrittmacherzellen die Kontraktionswellen in beide Seiten aussenden, und damit die Reservoirfunktion unterstützen. Myogene Autonomie Spezielle glatte Muskelzellen des Magen-Darm-Trakts weisen rhythmische Spontandepolarisationen auf, denen jeweils eine Repolarisation folgt, so dass langsame Potentialwellen im Sekunden- oder Minutenrhythmus entstehen, die keine oder nur sehr schwache Kontraktionen auslösen können. Motilitätsmuster Nach der Nahrungsaufnahme treten in der Verdauungsphase lokale, ringförmige Kontraktionswellen, lokale Einschnürungen und Pendelbewegungen auf. Dies wird durch lokale Reflexe hervorgerufen. Die Reizung von Dehnungsrezeptoren durch den Darminhalt führt zunächst über afferente Fasern am Ort der Dehnung zu einer lokalen Relaxation, dann zu einer Kontraktion der Ringsmuskulatur rund alle 2 mm und einer Erschlaffung der Längsmuskulatur. Diese Kontraktion der Ringmuskulatur setzt sich wellenförmig über den Magen und im Darmrohr fort. Durch tonische Dauerkontraktion (Sphinkteren) sind verschieden Räume funktionell voneinander getrennt. Z.B. Ösophagus vom Magen 30 Sekretion im Verdauungstrakt Speichel Die Zusammensetzung des Speichels durch den Einfluss des vegetativen Nervensystems variiert. Eine Aktivierung des Parasympathikus bewirkt in allen Drüsen eine erhebliche Steigerung der Sekretion eines dünnflüssigen, glykoproteinarmen Speichels. Eine Durchblutungszunahme der Drüsen wird durch VIP vermittelt. Eine Erregung des Sympathikus liefert geringe Mengen eines viskösen, Glykoprotein-, K+- und HCO-3-reichen Speichels. Magen Die Magenmukosa sezerniert täglich 2-3 l Magensaft. Dieser enthält hauptsächlich Salzsäure, Intrinsic-Faktor, Pepsinogene, Muzine und Bikarbonat. Die von den Belegzellen gebildeten H+-Ionen werden mit Hilfe einer H+/K+-ATPase in das Darmlumen abgegeben. Die Energiequelle für den aktiven Transport von Protonen aus den Belegzellen in den Magensaft ist ATP. Die Salzsäure des Magensaftes aktiviert die Pepsinogene, tötet Mikroorganismen ab und denaturiert noch native Proteine. Der Intrinsic-Faktor – ebenfalls in den Belegzellen gebildet – ist für die Resorption von Vitamin B12 verantwortlich. Er bindet Vit. B12 im oberen Dünndarm und wird schließlich im Ileum durch rezeptorvermittelte Endozytose in die Mukosa aufgenommen. In den Hauptzellen wird ein Gemisch von Proteasevorstufen gebildet. In den Oberflächenzellen wird Schleim (Saccharid-reiche Glykoproteine) produziert. Außerdem wird Bikarbonat aktiv mit einem HCO3-/Cl- - Antiporter sezerniert. 31 Die Magensaftsekretion wird nerval und hormonal gesteuert. Man unterscheidet die kephale, gastrale und intestinale Phase. Die kephale Phase wird durch die Orosensorik ausgelöst; die Sekretion erfolgt vom ZNS aus, von dem Nervenimpulse über den N. vagus zum Magen geleitet werden. Die gastrale Phase wird durch die Dehnung des Magens und durch chemische Reize bestimmter Nahrungsbestandteile ausgelöst. Sie stimulieren die Magensaftsekretion reflektorisch bzw. wirken über die Freisetzung von Gastrin sekretionsfördernd. In der intestinalen Phase kann die Magensaftsekretion vom Duodenum her sowohl fördernd als auch hemmend beeinflusst werden. Eiweißabbauprodukte fördern die Magensaftsekretion in geringem Maße. Saurer stark fetthaltiger Chymus fördert die Freisetzung von Sekretin, das die HClSekretion hemmt, die Pepsinogensekretion dagegen stimuliert. Dünndarm Die Sekretion im Dünndarm wird sowohl neuronal als auch humoral reguliert. Die Submukosa enthält Chemo- und Mechanorezeptoren, die auf Änderungen der Zusammensetzung des Darminhalts und auf Berührung reagieren. Über lokale Reflexwege werden die Drüsenzellen aktiviert. Mittels VIP als Neurotransmitter innervieren sie glatte Muskelzellen und stimulieren über ins Gewebe freigesetzte Transmitter Immun- und Abwehrzellen, endokrine und parakrine Zellen sowie kleine Blutgefäße. Sekretionssteigernd bei den Darmdrüsen wirken Entzündungsmediatoren (Zytokine...), gastrointestinale Hormone (Sekretin, Gastrin und CCK), Neurotransmitter (Azetylcholin, VIP) und eine Vagusaktivierung. Sekretionshemmend wirken Somatostatin und Noradrenalin. 32 Galle Bei der Bildung der Galle durch die Leberzellen wirken zwei Mechanismen zusammen, die gallensäureabhängige und die –unabhängige Sekretion. Es besteht eine enge Korrelation zwischen der Menge der ausgeschiedenen Gallensäuren und dem Gallenfluss. Bei der gallensäurenabhängigen Sekretion werden die in den Hepatozyten aus Cholesterin synthetisierten primären Gallensäuren und die durch Rezirkulation über den enterohepatischen Kreislauf in die Leber gelangten sekundären Gallensäuren (Na+-abhängiger Symporter) vor allem durch ATP-verbrauchenden aktiven Transport in die Gallenkanälchen sezerniert. Je höher die Gallensäurenkonzentration im Pfortaderblut, desto intensiver ist ihre Aufnahme in die Hepatozyten und ihre anschließende Sekretion in die Gallenkanälchen. Außerdem steigt dadurch die Gallensekretion (durch Gallensäuren). Bilirubin, das im wesentlichen aus dem Hämoglobinabbau stammt, erreicht, an Albumin gebunden, die Leberzellen und wird durch aktiven Transport aufgenommen. Dort wird es modifiziert, in eine wasserlösliche Form überführt und in die Galle ausgeschieden. Auch Cholesterin und Phospholipide werden in die Gallenkanälchen sezerniert. Die treibende Kraft für die gallensäureunabhängige Sekretion ist die sekundäraktive HCO3-Sekretion in die Gallenkanälchen. Die isotone Lebergalle ist durch den Gallenfarbstoff Bilirubin goldgelb gefärbt. In den Verdauungsphasen fließt die Lebergalle direkt in das Duodenum ab. In den interdigestiven Phasen gelang die Lebergalle in ein Reservoir, die Gallenblase, wo die Galle zur Blasengalle konzentriert wird. Diese bleibt dabei durch die Resorption von Elektrolyten plasmaisoton. Während der Verdauungsphase wird die Blasengalle ins Duodenum entleert. Die Gallenblase kontrahiert sich unter dem Einfluss von Cholezystokinin, das vor allem 33 unter Einwirkung von fetthaltigem Chymus aus der Duodenummukosa freigesetzt wird. Der N. vagus bzw. Parasympahomimetika steigern ebenfalls die Motilität der Gallenblase. 34 Eisenresorption, Transport, Speicher und Hämoglobinabbau Von der täglichen Nahrung werden im Durchschnitt 5-10 % im oberen Dünndarm resorbiert. Bei Eisenmangel können bis zu 25 % aufgenommen werden. Eisen wird ausschließlich in der Ferro (2+)-Form resorbiert. Es liegt jedoch ein Großteil des Nahrungseisens in der Ferri (3+)-Form vor, daher muss es im sauren Milieu des Magens erst zum 2-wertigen Eisen reduziert werden. Hierzu dienen die reduzierenden Substanzen in der Nahrung (Vit. C, SH-Gruppen von Proteinen) Eisen wird an ein Rezeptorprotein in der luminalen Zellmembran gebunden, das zusammen mit intrazellulären eisenbindenden Proteinen die Resorption reguliert. Sowohl der Eintritt als auch der Austritt von Eisen aus den Enterozyten sind wahrscheinlich aktive Prozesse. In den Enterozyten wird Eisen dicht unterhalb der Bürstensaum-Membran an mukosales Transferrin gebunden, an der basolateralen Membran durch Vermittlung eines Transferrinrezeptors schnell auf das Plasma-Transferrin übertragen und auf dem Blutweg zu den Zielzellen gebracht. Überschüssiges Eisen wird in der Darmschleimhaut an Ferritin gebunden und steht damit als langsam austauschbarer Speicher zur Verfügung. Beim Abbau des Hämoglobins entstehen Porphyrine, die nicht weiter verwertet werden können. Der dabei entstehende Gallenfarbstoff Bilirubin ist in Wasser praktisch unlöslich und wird daher im Blut an Albumin gebunden und transportiert. Letztendlich wird es von den Leberzellen nach Abspaltung aufgenommen. Bilirubin wird als Urobilin über die Niere und Sterkobilin über den Darm ausgeschieden. 15-20% des Bilirubin und seiner Metabolite werden im unteren Ileum und im Dickdarm resorbiert, über die Pfortader der Leber zugeleitet und dort erneut in die Gallenkanälchen ausgeschieden (Rezirkulation im enterohepatischen Kreislauf) 35 Pankreas (exokrine Sekretion) Die Sekretion von Enzymen in der digestiven Phase wird vor allem durch den N. vagus und durch Cholezystokinin stimuliert. In der basolateralen Membran sind Rezeptoren für Azetylcholin und CCK lokalisiert, deren Stimulation die Exozytose der Proenzyme bzw. Enzyme bewirkt. Die Hauptanionen des Pankreassekrets sind Cl und HCO3. Die Hauptkationen sind Na und K. Während die Kationenkonzentrationen bei Stimulationen konstant bleiben, ändern sich die Konzentrationen von HCO3 und Cl in Abhängigkeit von der Sekretionsrate gegenläufig zueinander. (HCO3-Anteil steigt bei Zunahme der Sekretion) Diese Veränderungen in der digestiven Phase erfolgen unter dem Einfluss von Sekretin auf die Epithelien der Ausführungsgänge. In der kephalen Phase (Orosensorik) kommt es bereits zu einem Anstieg der Bikarbonatsekretion und des Enzymausstoßes. Diese Phase wird vom N. vagus gesteuert. In der gastralen Phase (Eintritt von Speisen in den Magen) sind die Dehnung der Magenwand, vago-vagale Reflexe und vermutlich auch eine Gastrinfreisetzung für die Sekretionssteigerung verantwortlich. In der intestinalen Phase (Eintritt in den Darm) wird Sekretin bei Ansäuerung des Duodenums von der Schleimhaut sezerniert. Die durch Sekretin stimulierte Sekretion kann die für die Dünndarmmukosa potentiell schädliche Säure schnell zu neutralisieren und den idealen pH-Bereich (6-8) für die Enzyme herzustellen. Cholezystokinin, das die Abgabe der Pankreasenzyme fördert, wird aus endokrinen Zellen der Dünndarmmukosa freigesetzt. Stimulierend wirken hierbei Ca2+-Ionen, Abbauprodukte von Eiweißen und Fette. 36 Verdauung und Resorption der Kohlenhydrate Die -Amylase des Speichels und Pankreassekrets spaltet im Stärkemolekül die -14-Bindung. Zellulose weist eine -1-4-glykosidische Verknüpfung ihrer Glukosebausteine auf und wird deshalb von der -Amylase nicht verdaut. Die Zellulosespaltung erfolgt teilweise durch bakterielle Glykosidasen im Kolon. Die Speichelamylase kann bereits bis zu 50% der Stärke spalten. Im Duodenum läuft die Stärkeverdauung außerordentlich schnell ab, da Pankreasamylase im Überschuß gebildet wird. Kohlenhydrate können nur in Form von Monosacchariden resorbiert werden. In der Bürstensaummembran sind Oligosaccharidasen lokalisiert, die die vorverdauten Oligosaccharide bewirken. Die Aktivität der membrangebundenen Enzyme ist so groß, dass nicht die Spaltung der Kohlenhydrate deren Aufnahme begrenzt, sondern die Resorption der Monosaccharide. Glukose und Galaktose werden aktiv im Symport mit Na an der apikalen Seite resorbiert. Die Enterozyten verlassen sie über Glucosetransportproteine durch erleichterte Diffusion. Fructose wird sowohl apikal als auch basolateral über Glucosetransportproteine durch erleichterte Diffusion resorbiert. 37 Verdauung und Resorption der Proteine Im Magen werden Proteine zunächst durch die Salzsäure denaturiert. Nur ein geringer Anteil wird durch Pepsin hydrolisiert. Im Dünndarm ist die proteolytische Aktivität außerordentlich hoch. Die Bildung der Pankreaspeptidasen setzt 10-20 min nach dem Essen ein und bleibt solange bestehen, wie sich Proteine im Darm befinden. Die Endo- und Exopeptidasen im Pankreassekret spalten das Eiweiß in vorwiegend Oligopeptide aber auch Aminosäuren. Diese werden durch Enzyme des Bürstensaum (Aminopeptidasen, Oligopeptidasen) zu ca. 1/3 in Aminosäuren und 2/3 in Di- und Tripeptide zerlegt. Die Resorption erfolgt als H+-Kotransport. In den Epithelzellen werden Di- und Tripeptide enzymatisch in L-Aminosäuren hydrolysiert. Durch erleichterte Diffusion gelangen sie ins Interstitium. Im Duodenum werden rund die Hälfte des Nahrungseiweißes resorbiert. Bis zum Ileum sind rund 90% resorbiert. 10% gelangen in das Colon und werden dort bakteriell abgebaut. 38 Verdauung und Resorption von Lipiden 90 % der Nahrungslipide sind Triglyzeride mit hauptsächlich langkettigen Fettsäuren. 10% fallen auf Phospholipide, Cholesterinester und fettlöslicheen Vitaminen. Zur Verdauung werden die Nahrungslipide zunächst im wässrigen Chymus fein emulgiert. Bei alkalischem pH-Wert des Dünndarms werden sie unter Anwesenheit von Proteinen, Fettabbauprodukten, Lizithin und Gallensäuren und Scherkräften zu einer sehr feinen Emulsion umgewandelt. Die enzymatische Spaltung beginnt bereits im Magen durch Lipase. Langkettige Fettsäuren stimulieren die Pankreasenzymsekretion und Gallenblasenkontraktion durch Freisetzung von Cholezystokinin. Die Pankreaslipase spaltet Fettsäurenreste an C1 und C3 von den Triglyzeriden hydrolytisch ab, Monoazylglyzerol bleibt übrig. Neben der Lipase sind noch andere lipidspaltende Pankreasenzyme wirksam, die so wie die Lipase durch Trypsin aktiviert werden. Phospholipase A spaltet unter Anwesenheit von Ca und Gallensäuren eine Fettsäure von Lezithin ab. Cholesterinesterase spaltet die Cholesterinester in Cholesterin und Fettsäuren. Da die Produkte der Lipolyse im wässrigen Chymus schwer transportierbar sind werden sie in Mizellen hydrophil verpackt. Nach Passage durch die Zellmembran werden langkettige Fettsäuren und Monoazylglycerole im Enterozyten von einem fettsäurebindenden Protein zum ER transportiert. Hier erfolgt die Resynthese zu Triazylglyzerolen und anderen Lipiden. Phospholipide und Cholesterinester werden ebenfalls resynthiert. Diese resynthetisierten Fette werden im Enterozyten gemeinsam mit einer besonderen Proteinhülle umgeben. Die so entstanden Partikel nennt man Chylomikronen. 39 Diese werden im Golgi-Apparat in sekretorische Vesikel verpackt, die mit der basolateralen Membran fusionieren und durch Exozytose in den Extrazellularraum ausgestoßen. Von dort gelangen sie über den zentralen Lymphweg in das Blut. Kurz- und mittelkettige Fettsäuren sowie Glyzerol diffundieren direkt, ohne Mi-Zellen, ind die Enterozyten und dann in das Pfortaderblut. 40 Aufgabe und Funktion der Niere, Harnkonzentrierung, Nierenhormone Im Glomerulus wird zunächst der Primärharn aus dem durchfließenden Blutplasma abgepresst. Während der anschließenden Blutplasma abgepresst. Durch Autoregulation ist eine Konstanz des Filtrierdrucks gewährleistet. Wie in anderen Gefäßregionen führt eine Zunahme der Wandspannung in den Arteriolen durch myogene Reaktionen zu Vasokonstriktion. Während der anschließenden Passage durch den Tubulus und das Sammelrohr wird das Filtrat durch Resorptions- und Sekretionsprozesse stark in Volumen und Zusammensetzung verändert. Der größte Teil der gelösten Bestandteile und mehr als 99% des Wasservolumens werden durch Resorption der Tubulusflüssigkeit entzogen und gelangen wieder ins Blut. Einige Stoffe gelangen durch Sekretion vom Epithel in die Tubulusflüssigkeit. Die Niere erfüllt mehrere Aufgaben gleichzeitig: o Exkretion: Ausscheidung von Endprodukten des Stoffwechsels (z. B. Harnstoff) und Fremdstoffen (z. B. Giften) o Konservierung: Filtration unter Zurückhaltung von Blutzellen und Plasmaproteinen, sowie Resorption wichtiger Substrate (z. B. Glukose) o Kontrolle des Wasser- und Elektrolythaushalts: Geregelte Ausscheidung von Wasser und Elektrolyten o Kontrolle des Säure-Basen-Haushalts: Geregelte Ausscheidung von Protonen und Bikarbonat. o Außerdem sind die Nieren zur Produktion von Hormonen befähigt. 41 Harnkonzentrierung und –verdünnung Bei Wassermangel kann der Endharn bis auf die 4fache Osmolarität konzentriert werden. Ursachen: Im dicken Teil der aufsteigenden Henleschleife wird Na+ und Cl- aktiv resorbiert. Da die Na-Konzentration dadurch im Interstitium zu nimmt, entzieht es dem gegenüberliegenden absteigenden Schenkel Wasser. Die Gegenstrommultiplikation hat zur Folge, dass in der strömenden Tubulusflüssigkeit die Osmolarität im absteigenden Schenkel laufend zunimmt und nach der Schleife im aufsteigenden Schnekel in gleichem Masse wieder zunimmt. Im Bereich der inneren Markzone haben die aufsteigenden Schenkel der HenleSchleife einen dünnen Teil, der wasserpermeabel ist. Trotzdem nimmt die Konzentrierung auch in diesem Bereich zu. Ursache hierfür ist der Harnstoffkreislauf. Er diffundiert aus dem unteren Sammelrohr ins Interstitium. Dann wird er vom dünnen Teil der Henle-Schleife aufgenommen und gelangt im Tubulus wieder zum Sammelrohr. Dadurch wird ein osmotischer bedingter Wasserausstrom in diesem Schleifenteil bewirkt. In das Sammelrohr tritt letztendlich nach Wasser- u. Elektrolytaufnahme ein isotoner Harn. Adiuretin, das übers Blut zu den Epithelzellen gelangt, steigert nach Bindung an spezifische Rezeptoren die Wasserpermeabilität durch Einbau von Aquaporin-2. 42 Nierenhormone In den Nieren werden einerseits Hormone gebildet oder metabolisiert, andererseits beeinflussen renal oder extrarenal freigesetzte Hormone die Nierenfunktion. Hormone, die in den Nieren gebildet werden: Erythropoietin Es dient zur Differenzierung und Proliferation von erythroiden Vorläuferzellen im Knochenmark. Renin Siehe Wasser- und Elektrolythaushalt; Förderung der Angiotensin I Bildung Angiotensin II Siehe Wasser- und Elektrolythaushalt; Aldosteronfreisetzung, Vasokonstriktion Kalzitriol Siehe Hormone, Ca- und Phosphat-Hömostase Eikosanoide Bewirkt eine Vasodilatation, Steigert die Renin-Sekretion, Hemmt die ADH-Wirkung, Vasokonstriktion (Thromboxan A2) Extrarenal gebildete Hormone, die tubuläre Transportprozesse beeinflussen: Adiuretin: Fördert die Wasserresorption Aldosteron: Fördert die Na+-Resorption und K+- und H+-Sekretion. Parathormon: Förderung der Ca2+-Resorption, Hemmung der Phosphatresorption Kalzitonin: Hemmung der Ca2+- und Phosphatresorption 43 Regulation des Wasser- und Elektrolythaushalts Für die Funktionsfähigkeit der Organe und Gewebe ist es von entscheidender Bedeutung, dass innerhalb und außerhalb der Zellen die Konzentrationen der einzelnen Stoffe konstant bleiben. Osmoregulation Regelgröße ist die osmotische Gesamtkonzentration in der extrazellulären Flüssigkeit. Eine Regulation ist durch durstinduzierte Flüssigkeitsaufnahme und die ADH-geregelte Wasserausscheidung gewährleistet. Im vorderen Hypothalamus befinden sich durstauslösende Neuronenpopulationen. Hier sind auch Osmoserezeptoren lokalisiert, die auf eine Änderung der Osmolarität im Blutplasma sehr empfindlich reagieren. Von diesen Neuronen wird auch die renale Wasserausscheidung kontrolliert. Sie beeinflussen die Bildung und Freisetzung von Adiuretin und somit die Wasserausscheidung durch die Niere. Regulation des Extrazellularvolumens Änderungen des zentralen Blutvolumens werden von Volumenrezeptoren (in Herzhöfen und herznahen Venen) registriert. Sie senden ihrer Impulse zum hypothalamischen Regelzentrum. So führt zum Beispiel eine Abnahme des zentralen Blutvolumens zu einer Steigerung der Durstempfindung. Das Volumen der extrazellulären Flüssigkeit hängt sehr stark von ihrer Na+Konzentration ab. Dies wird durch das Renin-Angiotensin-Aldosteron-System geregelt. Blutdruckabfall bewirken eine verstärkte Freisetzung von Renin in der Niere. Renin ist eine Protease und spaltet aus Angiotensinogen (in der Leber gebildet) Angiotensin I ab. Dieses wird durch ein converting enzyme, dass vor allem von Endothelzellen der Lungenstrombahn gebildet wird und ins Blut abgegeben wird, in Angiotensin II umgewandelt. Dieses stimuliert wiederum die Freisetzung von Aldosteron. 44 Angiotensin II steigert die Durstempfindung, Aldosteron vermindert die renale Na+und Wasserausscheidung. Atriopetin, das bei Vorhofdehnung freigesetzt wird, hat den gegenteiligen Effekt. Die Kontrolle der Extrazellulären K+-Konzentration erfolg über die renale Ausscheidung unter Mitwirkung von Aldosteron, wobei die Ausscheidung dem Angebot zweckmäßig angepasst wird. An der Kontrolle der Ca2+-Phosphat-Homöostase sind Parathormon, Kalzitriol und in geringerem Maße Kalzitonin beteiligt. An der Magnesium-Homöostase ist insbesondere Kalzitonin beteiligt, das die Resorption reduziert. 45 Säure-Basen-Haushalt Physiologische Puffersysteme bestehen aus einer schwachen Säure und ihrer korrespondierenden Base. Unter dem Puffersystem des Blutes ist das Bikarbonat-System an erster Stelle zu nennen. In diesem System ist H2CO3 die Säure und HCO3- ihre korrespondierende Base. Die Puffereigenschaften der Proteine im Blut werden durch die ionisierbaren Gruppen ihrer Baustein, der Aminosäuren, bestimmt. Es tragen sowohl Plasmaproteine (besonders Albumin) als auch das Hämoglobin in den Erythrozyten bei. Der Hauptbestandteil der Pufferkapazität entfällt auf das Hämoglobin. Neben der Pufferfunktion des Blutes sind die Atmung, die Nierenfunktion und der Leberstoffwechsel an der Regulation des Säure-Basen-Gleichgewichts beteiligt. Durch Anpassung der o Respiratorischen CO2-Abgabe o Renalen H+-Sekretion und HCO3- Resorption o Hepatischen HCO3—Freisetzung und NH4+-Elimination wird der ph-Wert des Blutplasmas und damit der Extrazellularflüssigkeit weitgehend konstant gehalten. Beim oxidativen Abbau von Aminosäuren in der Leber fallen CO2 bzw. HCO3- und NH3 bzw NH4+ an, die normalerweise bei der Harnstoffsynthese verbraucht werden. Ist dieser Verbrauch unvollständig, so wird der Überschuss über die Glutaminsynthese und die Niere eliminiert. 46 Thermoregulation Die Thermoregulation hat die Aufgabe, die Körpertemperatur trotz Schwankungen der Wärmebildung, -aufnahme und –abgabe auf einem vorgegebenen Sollwert konstant zu halten. Messfühler dafür sind sowohl in der Haut (kutane Warm- und Kaltsensoren) als auch in bestimmten Orten des Körperinneren lokalisiert. Die in den Sensoren durch Warm- oder Kaltreize ausgelösten Impulsfolgen, werden zum hinteren Hypothalamus geleitet. Der Messung der Kerntemperatur dienen thermosensitive Strukturen im Körperinnerne – vor allem im vorderen Hypothalamus konnten kälte- und wärmeempfindliche Neurone nachgewiesen werden. Die thermische Informationsverarbeitung ist im hinteren Hypothalamus lokalisiert. Da kutane Rezeptoren auf Änderungen schnell ansprechen, können Abwehrreaktion bereits vor einer Änderung der Kerntemperatur ausgelöst werden. Afferente Impulse von den Kaltsensoren aktivieren Effektoneurone, welche die Wärmebildung fördern, und hemmen gleichzeitig die für die Wärmeabgabe zuständigen Neurone. Bei einer abweichenden Messwerten, werden bestimmte Faktoren der Thermoregulation aktiviert. Dies sind Vasomotorik der Hautgefäße, die Schweißsekretion und die Wärmebildung. Bei äußerer Wärmebelastung reagiert der Körper mit einer Dilatation der Hautgefäße und in einer vermehrten Schweißsekretion. Die Kältebelastung werden die Hautgefäße konstriktiert und die Wärmebildung durch Zunahme des Muskeltonus bzw. durch Muskelzittern gesteigert. 47 Hormone der Neurohypophyse Von der Neurohypophyse (Hypophysenhinterlappen) werden zwei Hormone abgegeben: Adiuretin und Oxytozin. Diese wirken effektorisch, d. h. sie beeinflussen Organfunktionen direkt. Die Hormone werden in Form von Vorläuferhormonen gebildet. Diese Peptidvorstufen des Adiuretins und Oxytozins gelangen über die marklosen Nervenfasern zum Hypophysenhinterlappen. In den Transportgranula erfolgt ihre enzymatische Spaltungin je ein Transportprotein und Adiuretin bzw. Oxytozin. Die Hormonabgabe an das Blut durch Ca2+-abhängige Exozytose erfolt immer dann, wenn Aktionspotentiale an den Faserendigungen einlaufen. Adiuretin wirkt in höheren Konzentrationen in der Haut und Skelettmuskulatur vasokonstriktorisch und dadurch Blutdrucksteigernd. Die physiologische Wirkung besteht vorrangig in der Wasserrückresorption in der Niere zu steigern und damit die Harnkonzentrierung zu fördern. Die Kontrolle der Hormonwirkung erfolgt vor allem über - Volumenrezeptoren (in Vorhöfen und Lungenvenen) - Osmorezeptoren (in Hypothalamus) - Pressorezeptoren (im Karotissinus und Aortenbogen) Oxytozin Die Funktion besteht u. a. darin, die rhythmische Kontraktion der glatten Uterusmuskulatur am Ende der Schwangerschaft zu fördern. Außerdem bewirkt es durch das Saugen an der laktierenden Brust eine Mehrproduktion, das dann das Auspressen der Milch fördert (Milchejektionsreflex) 48 Hormone der Adenohypophyse (Hypophysenvorderlappen) Effektorische Hormone Somatotropin Wachstumshormon. Es besitzt ein sehr weites Wirkungsspektrum, welches über Somatomedine (Wachstumsfaktoren aus der Leber) ausgelöst wird. Es - mobilisiert Fettsäuren aus den Fettdepots - erhöht den Blutzuckerspiegel durch Förderung der Gluconeogenese und Insulin-antagonistische Wirkung) - steigert die Proteinsynthese im Muskelgewebe - fördert indirekt (über Somatomedin C) das Knochen-, Knorpel-, und Muskelwachstum) Somatomedin C steigert durch vermehrte Proteinsynthese die Zellteilung und hat weist sogar eine insulinartige Wirkung auf. Reguliert bzw erhöht wird die Somatotropin-Sekretion durch Hypoglykämie, Anstieg der Aminosäurenkonzentration im Plasma, Dopamin- und Katecholaminausschüttung bei Belastungszuständen. Voraussetzung für die Sekretion ist die Ausschüttung vom Somatotropin-ReleasingHormon und einer gleichzeitigen Einschränkung der Somatostatin-Freisetzung. Prolaktin Stimuliert während er Schwangerschaft das Brustwachstum und fördert die Milchproduktion nach der Geburt. Mechanische Reize an den Brustwarzen fördern über nervale Afferenzen die Freisetzung des Prolaktin-Releasing-Hormon im Hypothalamus. 49 Glandotrope Hormone (steuern die Hormonausschüttung peripherer Drüsen) - TSH bewirkt die Abgabe von Schilddrüsenhormonen - ACTH bewirkt die Abgabe von Nebennierenhormonen - FSH wirkt Folikel-stimulierend - LH bewirkt die Abgabe von Sexualhormonen. Releasing-Hormone (Liberine) und Release-Inhibiting-Hormone (Statine) fördern oder hemmen die Freisetzung und Produktion der glandotropen Hormone und stammen aus dem Hypothalamus. 50 Schilddrüsenhormone Von der Schilddrüse werden - Thyroxin und Triiodthyronin (stoffwechselsteuernd) und - Kalzitonin (Ca2+-Haushalt beeinflussend) abgegeben. Zwar werden von der Schilddrüse Thyroxin und Triiodthyronin freigesetzt. In den Zielzellen wird jedoch Thyroxin und Iodabspaltung in Triiodthyronin, das eigentlich wirksame Hormon umgewandelt. Triiodthyronin bindet nach dem Durchtritt durch die Zellmembran an ein Kernrezeptorprotein. Der aktivierte Hormon-Rezeptor-Komplex ist nach Bildung an spezifische DNA-Sequenzen durch Beeinflussung der Genexpression ein wichtiger Regulator der Transkription und der Proteinsynthese. Insbesondere werden die Na/K-ATPase und mitochondriale Enzyme aktiviert. Es bewirkt eine - Steigerung des Energieumsatzes, - des Sauerstoffverbrauchs und - der Thermogenese im gesamten Körper. In der Leber steigert es die Glykogenolyse und Glukoneogenese. Die Konzentrationen der Schilddrüsenhormone im Blut werden durch ein Regelzentrum im Hypothalamus kontrolliert. Ein Abfall bewirkt die verstärkte Abgabe des Thyreotropin-Releasing-Hormons, welches weiters die Ausschüttung von Thyreotropin (TSH) in der Adenohypophyse stimuliert. TSH fördert cAMP-vermittelt die Iodaufnahme in der Schilddrüse, setzt Hormone aus der Speicherform frei und bewirkt ihre Ausschüttung in die Blutbahn. 51 Nebenschilddrüsen und hormonale Kalzium- und Phospahtregulation An der Regulation des Kalzium- und Phosphat-Haushalts sind hauptsächlich 3 Hormone beteiligt: - Parathormon aus der Nebenschilddrüse - Kalzitonin aus der Schilddrüse - Kalzitriol aus der Niere Ziel ist die Konstanz der Kalziumkonzentration im Extrazellularraum. Parathormon Das Hormon sorgt cAMP-vermittelt, dafür, dass die Plasmakonzentration des Gesamt-Kalziums gehalten wird. In der Niere fördert PTH o die Kalzium- um Magnesiumresorption, o die Ausscheidung von Phosphorsäure und o die Synthese von Kalzitriol. Im Knochen bewirkt es eine Osteolyse, die auf einer Aktivierung der Osteoklasten beruht. Osteoblasten füllen durch Mineralisation den Defekt wieder auf; somit wird der Knochen beim Erwachsenen ständig umgebaut. Die Gesamtwirkung des Parathormons besteht in einer raschen Konzentrationsanhebung des ionisierten Kalziums im Blut und in einer Senkung des Phosphatspiegels. Ein niedriger Ca-Spiegel im Extrazellularraum, fördert die Sekretion. Kalzitonin Im Knochen antagonisiert es der Wirkung des Parathormons. CAMP-vermittelt hemmt es die Osteoklastenaktivität und senkt auf diese Weise die Ca-Konzentration im Blut. In der Niere steigert es geringgradig die Phosphat- und 52 Kalziumausscheidung. Die Regulation wird auch durch den Ca-Spiegel im Extrazellularraum gesteuert. Kalzitriol Es entsteht aus Cholekalziferol (Vit D3). Die Synthese wird durch Parathormon gefördert. Es bewirkt eine Steigerung der Resorption von Ca und P im Dünndarm und dadurch eine Mineralisation der Knochenmatrix. Es kommt insgesamt zu einem Anstieg der Plasmakonzentrationen. 53 Nebennierenrindenhormone Die Nebenniere stellt eine endokrine Drüse mit einem besonders breiten Funktionsspektrum dar. In den 3 morphologische abgegrenzten Zonen werden Hormone gebildet, die sich in ihren Wirkungen grundlegend voneinander unterscheiden. Es handelt sich jedoch immer um Steroide, die sich vom Cholesterin ableiten. Glukokortikoide Der wirksamste Vertreter ist Kortisol. Wie alle Steroidhormone, reagiert es mit spezifischen zytoplasmatischen Rezeptoren. Nach Bildung des Hormon-Rezeptor-Komplexes und Translokation in den Zellkern, aktiviert es die Transkription und Protein- bzw. Enzymsynthese. Glukokortikoide beeinflussen den Kohlenhydrat- Fett- u. Proteinstoffwechsel. In Notfallsituationen dienen sie der raschen Bereitstellung von Energie an Gehirn und Herz. Sie fördern die Gluconeogenes und die Glykogensynthese in der Leber. Und bauen in Muskulatur, Fettgewebe, lymphatischen Geweben, Haut und Knochen Substanz ab. Bestandteile werden für die Gluconeogenese verwendet. Außerdem haben sie eine entzündungshemmende Wirkung. Aufgrund des Blutspiegels an freiem Kortisol, erfolgt die Regelung. Bei einer Abnahme wird im Hypothalamus das Releasing-Hormon sezerniert, das über das Pfortadernsystem in die Adenohypophyse gelangt und dort – cAMP – vermittelt – die Freisetzung von ACTH bewirkt. Dies stimuliert – wieder cAMP-vermittelt – die Ausschüttung der Glucokortikoide in der Nebennierenrinde. Streß Eine wesentliche Reaktion des Organismus auf die Einwirkung von Stressoren besteht im Anstieg der Glucokortikoidkonzentrationen. Anfänglich kommt es im Streß zu einer gesteigerten Sympathikusaktivität und als Folge zu einer verstärkten Ausschüttung der Hormone des Nebennierenmarks. Durch die Glucocorticoide wird die Empfindlichkeit der Gefäße für Katecholamine gesteigert, wodurch in einer 54 Stresssituation der arterielle Blutdruck ansteigt und Blut in die Skelettmuskulatur umgeleitet wird. Mineralkortikoide Ihr wichtigster Vertreter ist Aldosteron. Sie sind speziell am Elektrolyt- und Wasserhaushalt beteiligt. Aldosteron steigert nach Bindung an einen spezifischen zytoplasmatischen Rezeptor und anschließender Bindung an DNA-Sequenzen die Biosynthese der Na/K-ATPase und von Na- bzw K-Kanalproteinen. Es bewirkt dadurch eine vermehrte Resorption von Na und folglich Wasser. K und H wird vermehrt ausgesschieden. Die Steuerung der Hormonfreisetzung erfolgt entweder direkt über die Zellen der Nebennierenrinde oder über die Niere infolge Freisetzung von Renin, Angiotensin I und II... Androgene Durch hohe ACTH-Konzentrationen im Blut wird die Androgenproduktion gesteigert. Sie stellen Geschlechtshormone dar. 55 Nebennierenmark und Katecholamine In bestimmten Zellen des Nebennierenmarks, die in enger Beziehung zum Sympathikus stehen, werden die Katecholamine, Adrenalin und Noradrenalin gebildet. Die Katecholamine gehören durch ihre Wirkung sowohl zu den Hormonen als auch zu den neuronalen Transmittern. Beide Hormone beeinflussen vor allem das Herz-Kreislauf-System. Beim Adrenalin überwiegen die Regulation der Blutverteilung und des Herzzeitvolumens. Adrenalin hat einen weitaus größeren Einfluss auf die Erweiterung der Bronchiolen und die Hemmung der Magen-Darm-Trakt-Motilität. Außerdem fördert es spziell den Glykogenabbau in der Leber und im Muskel, dies steigert die Blutzuckerkonzentration im Blut und letztendlich wirkt es stimulierend aufs ZNS. Beim Noradrenalin steht die Steigerung des peripheren Gefäßwiderstands im Vordergrund, was zu einer Erhöhung des arteriellen Blutdrucks führt. Die Abgabe der Katecholamine aus dem Nebennierenmark steht unter der Kontrolle der vegetativen Zentren im Hypothalamus. Durch Aktivierung des Sympathikus führt zu einer erhöhten Leistungsbereitschaft und –fähigkeit. Adrenalin und Noradrenalin fungieren als Informationsvermittler. Eine Blutdrucksenkung steigert vor allem die Noradrenalinausschüttung. Blutzuckerabfall steigert die Adrenalinabgabe. 56 Pankreashormone und Blutzuckerregulation Das Pankreas bildet einerseits den Pankreassaft (exkretorische Funktion), andererseits erfolgt in den Langerhans-Inseln die Synthese von 4 Hormonen, die direkt an das Blut abgegeben werden. (inkretorische Funktion). 2 Haupthormone: Die B-Zellen bilden Insulin. Die A-Zellen produzieren Glucagon. Der Reiz für die Insulinfreisetzung ist ein Anstieg des Blut-Glucosespiegel. Außerdem rufen eine Erhöhung der Plasmakonzentration verschiedener Aminosäuren, freier Fettsäuren und gastrointestinaler Hormon (Gastrin, CCK) eine Insulinausschüttung. o Das Ausmass der Freisetzung wird vom vegetativen Nervensystem moduliert. Parasympathische Impulse bzw. Azetylcholin, o eine Erregung sympathischer 2-Rezeptoren und o Glucagon in hohen Dosen steigern die Sekretion. o 2-Rezeptoren und o Adrenalin hemmen diese. Bei der durch Glucose ausgelösten Insulinfreisetzung wird im ersten Schritt infolge einer gesteigerten Glukoseoxidation in der B-Zelle vermehrt ATP gebildet. Durch den ATP-Anstieg werden ATP-gesteuerte K+Kanäle geschlossen, was zu einer Depolarisation führt. Hierdurch werden spannungsabhängige Ca-Kanäle aktiviert, wodurch Ca-Ionen aus dem Extrazellularraum einströmen und den Exozytosevorgang auslösen. Insulin ist lebenswichtig, wachstumsfördernd und anabol. Es fördert die Aufnahme von Glukose und Aminosäuren in Zellen und stimuliert den Aufbau von Glykogen und Fett. 57 Glukagon Das Zielorgan ist die Leber. Es stellt bei der Regulation der Glucosekonzentration des Blutes einen Gegenspieler zum Insulin dar. Es mobilisiert die Energiereserven bei gesteigerten Energiebedarf und drohender Hypoglykämie. Wie Adrenalin steigert es den Glykogenaubbau, jedoch nur in der Leber. Außerdem fördert es dort die Glukoneogenese aus Aminosäuren und Laktat. Der Blutzuckerspiegel wird so erhöht. Es fördert die Lipolyse im Fettgewebe und in der Leber und die Proteolyse zur Bereitstellung von AS für die Gluconeogenese. Der Körper ist sehr gut in der Lage durch Ausschüttung dieser Hormone den Blutzuckerspiegel konstant zu halten. Die Insulinausschüttung fördert... - ein erhöhter Blutzuckerspiegel - GIP - Wachstumshormon Adrenalin und Glukagon fördern die Freisetzung von Glukose aus den Depots und schaffen durch die Freisetzung von Glucose die Voraussetzung zur gesteigerten Verwertung. Somatotropin hemmt die Glucoseaufnahme. 58 Elekrtomechanische Kopplung und Kontraktion Die einlaufende Erregung wird in das Innere der Muskelfaser geleitet. Die Depolarisation des Sarkolemms aktiviert in der Wand liegenden spannungsabhängigen Ca-Kanal. Hierduch wird ein benachbarter Ca-Kanal geöffnet und es werden schlagartig Ca-Ionen aus dem intrazellulären Speicher ins Sarkoplasma freigesetzt. Diese lösen dan den Kontraktionsvorgang in der Muskulatur aus. Der Kontraktionsprozeß besteht darin, dass sich die Myosin- und Aktinfilamente teleskopartig ineinanderschieben, ohne dass sich die Länge der Filamente verändert. Dieser Vorgang wird durch eine Interaktion zwischen Myosin, Aktin und ATP bewirkt. Durch die Bindung von Ca-Ionen an die Troponineinheit der Aktinfilamente kommt es zu einer Konformationsänderung der Regulatorproteine Troponin und Tropomyosin. Die Haftstelle für den Myosinkopf am Aktinfaden wird frei. Dadurch kann sich der Myosinkopf an die Aktinfilamente anheften. Zyklische, ruderschlagähnliche Strukturveränderungen von den dicken Filamenten abstehenden Myosinköpfen, die mit den dünnen Aktinfilamenten Querbrücken bilden, sind für die Muskelkontraktionen verantwortlich. Energiequelle ist ATP. Der Kontraktionsvorgang wird dadurch beendet, dass Ca mittels einer Ca-ATPase aus dem Sarkoplasma in das sarkoplasmatische Retikulum gepumpt wird. Troponin C setzt das gebundene Ca frei und der Tropomyosin-Troponin-Komplex blockiert nach einer Konformationsänderung wieder die Bindungsstelle für den Myosinkopf am Aktinfaden. 59