Untersuchungen zur Diagnostik und Prävalenz von Infektionen
Werbung

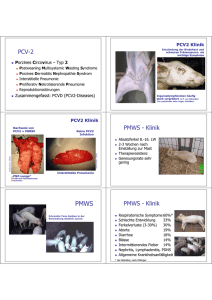
Literaturrecherche A review of porcine circovirus 2-associated syndromes and diseases C. Chae The Veterinary Journal 169, 2005, 326-336 Seit 1996 zum ersten Mal PCV-2 Infektionen bei Schweinen mit PMWS in West-Kanada nachgewiesen wurden, sind die Coronaviren bei verschiedenen anderen Krankheitsbildern isoliert worden. Häufig kann jedoch nicht gesagt werden, in wieweit die PCV2 Viren in die Pathogenese involviert sind. Bei den Syndromen handelt es sich um: - Porcine Dermatitis and Nephropathy Syndrome (PDNS) - Porcine Respiratory Disease Complex (PRDC) - Reproduktionsstörungen - Granulomatöse Enteritis - Exsudative Epidermitis - Nekrotisierende Lymphadenitis - Kongenitaler Tremor Da die Erscheinungsbilder von PMWS und PDNS bereits früher besprochen wurden, werden für diese beiden Komplexe nur noch die zusammenhängenden Beobachtungen erwähnt. Es gibt mehrere Studien, in denen alleinige Ausbrüche von PDNS oder PMWS beschrieben wurden. In neuerer Zeit jedoch konnten auch gleichzeitige Ausbrüche von beiden Syndromen in derselben Herde beobachtet werden. Tiere, die an PMWS erkrankten entwickelten bisher jedoch nie anschliessend PDNS und umgekehrt. Weiters konnten in Nieren von Tieren mit PDNS häufiger PCV2 Viren nachgewiesen werden als in Tieren mit PMWS. Dasselbe gilt für Tiere mit PMWS und deren Lymphknoten verglichen mit den Lymphknoten der PDNS Jager. Es wird vermutet, dass die verschiedenen PCV2 Stränge unterschiedliche Gewebetropismen besitzen. Das heisst, dass die Stränge, die eine hohe Affinität zu Nierengewebe haben PDNS induzieren könnten und diejenigen, die eine hohe Affinität zu Lymphknoten haben PMWS hervorrufen können. Der Nachweis von PCV2 Antigen und Nukleinsäuren in Nieren- und Hautveränderungen bei PDNS Jagern lässt die Vermutung zu, dass PCV-2 das ätiologische Agens dieses Syndroms darstellt. Es sollte beachtet werden, dass PDNS bei Hauterkrankungen einen immer grösseren Anteil ausmacht. Als Differentialdiagnosen werden Rotlauf, Actinobacillus suis, Exsudative Epidermitis und Schweinepocken genannt. Die Veränderungen der Nieren sollten von Salmonellose abgegrenzt werden. Weiters wird angeführt, dass sowohl die klassische als auch die afrikanische Schweinepest als Differentialdiagnosen in Frage kommen. Porcine Respiratory Disease Complex (PRCD): Bei PRCD handelt es sich um eine Erkrankung, die vor allem Jager im Alter von 16-22 Wochen betrifft. Sie ist charakterisiert durch langsames Wachstum, erniedrigte Futterverwertung, Lethargie, Anorexie, Fieber, Husten und Dyspnoe. Pneumonien in Schweinen mit PRCD sind bedingt durch Mischinfektionen mit PCV2, PRRS, Schweineinfluenza, M. hyopneumoniae, A. pleuropneumoniae und P. multocida. Die Identifizierung von PCV2 in Fällen von proliferativer nekrotisierender Pneumonie lässt darauf schliessen, dass PCV2 ein wichtiger Faktor von PRCD ist, jedoch immer andere Erreger mit einbezogen sind. Typisch für die Läsionen ist eine bronchointerstitielle Pneumonie mit peribronchaler und peribronchiolarer Fibrose. Die alveolären Septen sind deutlich verdickt durch Infiltrate von Makrophagen und kleineren Mengen von Lymphozyten und Plasmazellen. Zudem sind die Septen gesäumt von hypertrophierten Typ 2 Pneumozyten und im Alveolarraum können reichliche Mengen an nekrotischem Gewebe gesehen werden. In den interstitiellen Makrophagen können mittels Hybridisierung PCV2 nachgewiesen werden. Wegen möglicher Überschneidungen in der Diagnostik von PCV2 assoziierter PRDC und PMWS müssen 4 Kriterien für PRDC erfüllt werden: - Vorhandensein von respiratorischen Symptomen wie verlängerte Atemnot, die nicht auf Antibiotika ansprechen - Vorhandensein von typischen mikroskopischen Läsionen - Präsenz von PCV2 in den Läsionen - Fehlen von für PMWS charakteristischen Läsionen im lymphatischen Gewebe. Ersteller : Riccarda Ursprung Datum : 31.08.2005 Seite 1 von 3 Jedes dieser 4 Kriterien für sich alleine ist für PRDC nicht diagnostisch. Reproduktionsstörungen: Bisher gab es verschiedene Berichte über PCV2 assoziierte Reproduktionsstörungen. Regelmässig werden dabei folgende klinischen Erscheinungen beschrieben: Vermehrte Aborte, Totgeburten und Mumifikationen. Eine experimentelle Ansteckung von Feten mit PCV2 führte zu Totgeburten, Mumien und lebensschwachen Ferkeln nebst der Geburt von normal entwickelten lebenden Ferkeln. Der Nachweis von grossen Mengen PCV2-Antigen und Nukleinsäuren in Totgeburten, welche in utero infiziert wurden sprechen dafür, dass eine vertikale ErregerÜbertragung eine grosse Rolle spielt. Histopathologisch gibt es keine typischen Veränderungen in PCV2 assoziierten abortierten Feten. Bei manchen Feten konnten Pneumonien mit Infiltraten von mononuklären Zellen im Alveolarraum nachgewiesen werden. Bei anderen wiederum wurden extensive Gebiete von myokardialen Degenerationen oder Nekrosen mit Ödemen und milden Fibrosen sowie diffusen Infiltrationen von Lymphozyten und Makrophagen gefunden. In anderen Organen konnten keine histologischen Läsionen nachgewiesen werden. Die Tatsache, dass PCV2 in Abortmaterial aller Stadien gefunden werden konnten weist darauf hin, dass sich die Pathogenese von derjenigen von PRRSV unterscheidet, da die PRRSV nur während der späteren Trächtigkeit die Plazenta durchdringen können. Die Konsequenzen einer PCV2 Infektion von Sauen zu unterschiedlichen Trächtigkeitszeitpunkten spiegeln die Fähigkeiten des Feten wieder, eine Virusvermehrung zu ermöglichen. Die diagnostischen Tests um eine PCV2 Infektion bei Aborten nachzuweisen sind: Virusisolation, PCR, Immunohistochemie und in situ Hybridisierung. Am besten geeignet für den Virusnachweis in Feten sind Milz und Lymphknoten. Da aber PCV2 auch bei klinisch gesunden Tieren nachgewiesen werden können muss noch abgeklärt werden, ob für den PCV2 Nachweis bei Aborten gleiches gilt wie bei der Diagnostik von PMWS. Nämlich, dass ein Virusnachweis alleine noch nicht ausreicht, um die Ursache für einen Abort zu kennen. Auch im Sperma können grosse Mengen von PCV2 nachgewiesen werden, wobei die meiste DNA in der Samenflüssigkeit und in den nicht-Spermazellen gefunden werden kann. Es ist jedoch noch nicht völlig geklärt, wie infektiös diese Viren sind. Granulomatöse Enteritis: Die granulomatöse Enteritis ist eine weitere klinische Manifestation von PCV2 Infektionen. In acht Schweineherden wurden bisher 10 solcher Fälle diagnostiziert. Es trifft meist Tiere im Alter von 40-70 Tagen. Die klinischen Anzeichen sind Durchfall, welcher zuerst gelb ist und anschliessend schwarz wird und therapieresistent für Antibiotika ist, zusammen mit WachstumsDepression. Die häufigsten histopathologischen Veränderungen sind granulomatöse Entzündungen mit Infiltraten von Epitheloidzellen und mehrkernigen Riesenzellen sowie lymphoide Depletionen der Peyerschen Platten im Dünn- und Dickdarm. Eine weitere typische Veränderung sind die traubenförmigen, basophilen oder amphiphilen intrazytoplasmatischen Einschlusskörperchen, die vor allem in Histiozyten und mehrkernigen Riesenzellen zu finden sind. Die Basis für die Diagnose einer PCV2 assoziierten granulomatösen Enteritis bilden: - Durchfall - typische histologische Veränderungen in den Peyerschen Platten, aber keine Veränderungen in Lymphknoten - Nachweis von PCV2 in diesen Läsionen. Es kann schwierig sein PMWS klinisch und histologisch von PCV2 assoziierter Enteritis zu unterscheiden. Wenn jedoch für PMWS typische Läsionen in den Lymphknoten gefunden werden können sollte die Diagnose PMWS lauten. Exsudative Epidermitis: Die exsudative Epidermitis ist eine akute, progressive, oft fatal verlaufende oberflächliche Pyodermie. Staph. hyicus ist der auslösende Erreger. Es wird jedoch angenommen, dass noch weitere prädisponierende Faktoren mitbeteiligt sind. Untersuchungen haben gezeigt, dass bei Tieren mit exsudativer Epidermitis gleichzeitig auch PCV2 und/oder PPV nachgewiesen werden können. Obwohl in den untersuchten Schweinen keine Anzeichen für PMWS gefunden werden konnten, zeigten diejenigen mit exsudativer Epidermitis eine hohe Anzahl an PCV2 und PPV infizierter Zellen in Hautläsionen aber nur kleine Mengen von PCV2 im lymphatischen Gewebe. In experimentellen Reproduktionen von exsudativer Epidermitis konnten PCV2 und PPV als Kofaktoren identifiziert werden, welche in die Entstehung der Läsionen involviert sind und/oder zu deren Verstärkung führen. Nekrotisierende Lymphadenitis: Bei der nekrotisierenden Lymphadenitis handelt es sich um ein neues Erscheinungsbild von PCV2 Infektionen. Vom Autor wurden bisher fünf Fälle aus unterschiedlichen Ersteller : Riccarda Ursprung Datum : 31.08.2005 Seite 2 von 3 Betrieben beschrieben. Zwei der Tiere wurden untersucht wegen Kümmern und Durchfall, zwei mit leichter Inkoordination und Fieber und ein Tier starb plötzlich ohne klinische Anzeichen. Auffällig waren bei diesen Tieren vor allem die inguinalen Lymphknoten bei denen mikroskopisch zentrale follikuläre Nekrosen gesehen werden konnten. Die nekrotischen Bezirke in den prominenten Follikeln von 1-10 Zellen zeigten Pyknose und Karryorrhexis, während die Veränderungen in den umliegenden lymphoretikulären Geweben seltener waren. Die nekrotischen Zellen zeigten Zellschrumpfung, Zytoplasma- und Chromatin-Kondensation und einige von ihnen enthielten Kernfragmente. Granulomatöse Inflammation und intrazytoplasmatische Einschlusskörperchen, wie sie für PMWS typisch sind, konnten in den Lymphknoten nicht nachgewiesen werden. Mittels Immunohistochemie und in situ Hybridisierung konnte PCV2 DNA in den nekrotischen Zellen und den Nachbarzellen nachgewiesen werden. Die Ursache für die Apoptose ist bisher unklar. Es kann nicht ganz ausgeschlossen werden, dass PCV2 zufälligerweise im nekrotischen Lymphgewebe nachgewiesen wurde. Da jedoch in allen betroffenen Regionen PCV2 gefunden werden konnten scheint PCV2 mit der nekrotischen Lymphadenitis assoziiert zu sein. Kongenitaler Tremor: Kongenitaler Tremor geht einher mit der Demyelinisierung des Hirns und des Rückenmarks. Mögliche Ursachen für kongenitalen Tremor sind: Schweinepest, Aujeszky, unbekannte Virusinfektionen, genetische Erkrankungen und Intoxikationen. Die Verbindung von PCV2 und kongenitalem Tremor ist umstritten. Es konnten jedoch in Hirn- und Rückenmarkproben von erkrankten Tieren mittels verschiedenen Nachweismethoden bereits PCV2 nachgewiesen werden. Das klinische Erscheinungsbild von PCV2 kann sehr unterschiedlich sein. Zum aktuellen Zeitpunkt gibt es hierfür jedoch noch keine plausible Erklärung. Es kann eingewendet werden, dass der häufige Nachweis von PCV2 mit der ubiquitären Verbreitung des Virus zusammenhängt und nicht mit seiner Pathogenität. - - - - - - Bei den Krankheitssyndromen, bei denen bisher PCV2 nachgewiesen werden konnten handelt es sich um: PRCD: Tritt v. a. bei Jagern im Alter von 16-22 Wochen auf. Die Pneumonien sind bedingt durch Mischinfektionen mit PCV2, PRRS, Schweineinfluenza, M. hyopneumoniae, A. pleuropneumoniae und P. multocida. Reproduktionsstörungen: Häufig beschriebene, klinische Erscheinungsbilder sind vermehrte Aborte, Totgeburten und Mumifikationen. Da PCV2 in Abortmaterial aller Stadien gefunden werden konnten, wird vermutet, dass eine Infektion der Feten in allen Trächtigkeitsstadien stattfinden kann. Weil PCV2 auch bei klinisch gesunden Tieren nachgewiesen werden können muss noch abgeklärt werden, ob ein Virusnachweis alleine genügt, um die Abortursache ausfindig zu machen, oder ob zusätzlich auch noch die entsprechenden Läsionen vorhanden sein müssen. Granulomatöse Enteritis: Meist sind Tiere im Alter von 40-70 Tagen betroffen. Der Durchfall ist erst gelb und wird dann schwarz, gegenüber AB therapieresistent, Wachstumsdepression. Um die granulomatöse Enteritis von PMWS abzugrenzen müssen die typischen Läsionen in den Peyerschen Platten gefunden werden, nicht aber in den Lymphknoten. Exsudative Epidermitis: Nebst dem Primärerreger Staph. hyicus können bei Exsudativer Epidermitis in den Zellen der Hautläsionen PCV2 und/oder PPV nachgewiesen werden. In experimentellen Reproduktionen konnten PCV2 und PPV als Kofaktoren identifiziert werden, welche in die Entstehung der Läsionen involviert sind und/oder zu deren Verstärkung führen. Nekrotisierende Lymphadenitis: Bisher fünf Fälle beschrieben. Auffällig waren vor allem die inguinalen Lymphknoten, bei denen mikroskopisch zentrale follikuläre Nekrosen gesehen werden konnten. Es konnten keine intrazytoplasmatischen Einschlusskörperchen, wie sie für PMWS typisch sind gefunden werden. Es kann nicht ganz ausgeschlossen werden, dass die PCV2 zufällig in den betroffenen Regionen gefunden wurden. Kongenitaler Tremor: Die Verbindung von PCV2 und kongenitalem Tremor ist umstritten. Es konnten jedoch in Hirn- und Rückenmarkproben von erkrankten Tieren mittels verschiedenen Nachweismethoden bereits PCV2 nachgewiesen werden. Ersteller : Riccarda Ursprung Datum : 31.08.2005 Seite 3 von 3