Cytoskelett II: Molekulare Motoren
Werbung

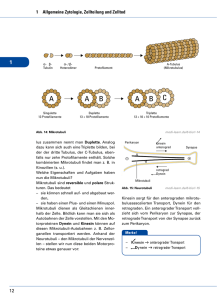
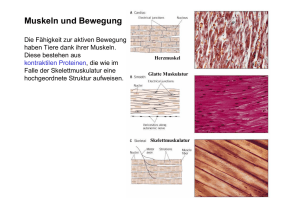
Cytoskelett II: Molekulare Motoren (Alberts 4th edition, S 949 – 968) Motorproteine MP binden an polare Filamente (entweder Aktin oder Mikrotubuli) und nutzen die Energie der ATP-Hydrolyse für Fortbewegung. Ihre Funktion besteht in den meisten Zellen darin, Vesikel und membranumschlossene Organellen zu transportieren, aber auch Muskelkontraktion und die Ausbildung des Spindelapparates bei der Zellteilung ist auf Motorproteine zurückzuführen. Jedes Motorprotein besitzt eine Kopfregion, wo die motor domain liegt. Hier wird ATP gebunden und hydrolysiert und die Bewegungsrichtung vorgegeben. In der Schwanzregion befinden sich je nach Motorprotein verschieden lange tails mit sehr unterschiedlichen AS-Sequenzen, die die Art der Fracht bestimmen. Aktin-assoziierte Motorproteine: Myosin-Familie Myosin II ist das erste Motorprotein, welches identifiziert wurde. Es besitzt 2 heavy chains und je 2 x 2 light chains. Die heavy chains besitzen eine globuläre Domäne am N-Terminus und eine lange coiled-coil Domäne bildet den tail. Durch Interaktionen der tails miteinander entstehen bipolare, dicke Filamente, die aus mehreren 100 Myosinfilamenten bestehen. Die Köpfe stehen an beiden Enden nach außen weg, in der Mitte ist die kopffreie Zone (= bare zone). Myosin I wurde in den 70er Jahren entdeckt. Es besitzt eine Motordomäne wie Myosin II, aber einen anderen tail und nur einen Kopf (deshalb Myosin I). Danach wurden mehrere Myosintypen entdeckt, fast alle mit der Motordomäne am N-Terminus, aber mit unterschiedlichsten tails. Der Mensch besitzt ca. 40 unterschiedliche Myosin-Gene. Alle Myosintypen bis auf einen bewegen sich zum positiven Ende des Aktinfilaments. Mikrotubuli-assoziierte Motorproteine: Kinesine und Dyneine Kinesin bewegt sich zum positiven Ende des Mikrotubulus. Es ist strukturell ähnlich wie Myosin, da es 2 heavy chains mit 2 globuläre Motordomänen (meist am N-Terminus) und coiled-coil tails besitzt. Es gibt mindestens 10 Familien von Kinesin-related-proteins (KRPs). Nur eine davon bewegt sich zum negativen Ende und hat die Motordomäne am C-Terminus. Einige KRPs spielen eine Rolle beim Ausbilden des Spindelapparates und bei der Chromosomenseparation bei der Zellteilung. Kinesine haben je eine Bindestelle für membranumschlossene Organellen (z.B. Mitochondrien) und eine Bindestelle für Mikrotubuli. Dyneine wandern zum negativen Ende des Mikrotubulus und sind mit Kinesinen nicht verwandt. Sie sind die größten und schnellsten Motorproteine und bestehen aus 2 bis 3 heavy chains (mit der Motordomäne) und vielen light chains. Die 2 Hauptgruppen sind cytoplasmatsiche Dyneine und axonemale Dyneine. Cytoplasmatische Dyneine befinden sich in allen eukaryotischen Zellen und sind für die Lokalisierung des Golgi-Apparates und für Vesikeltransport zuständig. Axonemale Dyneine sind auf die Bewegungen der Mikrotubuli spezialisiert, durch die Wimpern und Geißeln schlagen. Fortbewegung der Motorproteine Myosin: ATP-Hydrolyse wird an eine Konformationsänderung gekoppelt und durch einen Zyklus aus binden (am Aktinfilament), loslösen und an neuer Stelle wieder binden kommt es zur Fortbewegung. Am Start des Zyklus ist der Myosinkopf fest an das Aktinfilament gebunden. Wird nun ATP gebunden, wird der Myosinkopf kurzfristig freigegeben und durch die Hydrolyse des ATPs ändert sich die Stellung des Kopfes. Das bei der Hydrolyse entstehende Phosphat wird abgegeben und der Kopf bindet wieder fest mit dem Aktinfilament, allerdings an einer anderen Stelle als zuvor. Letztendlich wird das ADP abgegeben und es kommt zum sogenannten power stroke, wobei der Myosinkopf seine ursprüngliche Position wieder einnimmt und das Myosinfilament sich vorwärts bewegt. Kinesin: Der vordere Kopf des Kinesindimers, das leading Kinesin, ist an den Mikrotubulus gebunden. Dabei ist wichtig, dass die sog. linker region (verbindet den Kopf mit der coiledcoil dimerisierter Domäne) unstrukturiert ist und erst andockt wenn ATP gebunden wird. Dadurch ändert sich die Konformation und der zweite Kinesinkopf wird vorwärts bewegt. Das An- und Abdocken der linker region wird durch kleine Bewegungen von swich loops reguliert. Die Bewegung des Kinesins erinnert an eine schrittweise Hand-über-HandBewegung. Kinesin, das sich „rückwärts“ bewegt (zum negativen Ende) unterscheidet sich in der Orientierung der Köpfe. Befestigung der Fracht am Motorprotein Kinesin: ER-Membranen besitzen membran-assoziierte Rezeptoren für Kinesin, die direkt oder indirekt mit den tails von Kinesin interagieren. Dynein: Viele akzessorische Proteine sind notwendig, um die Fracht zu befestigen. Dynaktin ist ein Proteinkomplex, der an Dynein bindet. Er besteht im Wesentlichen aus einem kurzem Aktin-ähnlichen Filament aus Arp1 (aktin-related-protein). Ankyrin und Spektrin sind Proteine, die mit Dynaktin assoziieren und an Glykoproteine in der Golgi-Membran binden und so die Fracht befestigen. Regulation der Motorproteine Bsp.: Einige Fischarten können eine sofortige Änderung der Hautfarbe erzielen, indem Pigmente schlagartig ihre Position in der Zelle ändern. Die Pigmente bewegen sich entlang der Mikrotubuli. Sie sind entweder in der ganzen Zelle verteilt oder im Zentrum versammelt. Die Bewegung nach Innen geht schnell und reibungslos, Bewegung nach außen findet nur stockend und langsam statt. Das kommt daher, dass im Normalzustand Kinesin und Dynein beide mit dem Pigment assoziiert sind. So kommt eine langsame Bewegung nach außen zustande (Kinesin setzt sich gegenüber Dynein durch). Durch hormonelle Signale werden die light chains des Kinesins phosphoryliert, Kinesin wird inaktiv und Dynein transportiert das Pigment schnell zum Zentrum, wodurch sich die Hautfarbe ändert. Myosin wird ebenfalls durch Phosphorylierung reguliert. Es liegt in der Zelle in 2 Formen vor: extendet state (= aktiv) und bent state (= inaktiv). Die Myosin light chain Kinase (MLCK) phosphoryliert die sogenannte regulatory light chain, wodurch der tail seine Struktur ändert, polymerisieren kann und somit aktiv wird. Muskelkontraktion entsteht durch ATP-getriebenes Ineinandergleiten von Aktinfilamenten und Myosin II Filamenten. Die Muskelfaser eines Skelettmuskels ist eine riesige Zelle, die durch Fusion von mehreren Zellen entsteht. Im Inneren befinden sich Myofibrillen, kontraktile Elemente der Zelle. Sie haben eine zylindrische Struktur und sind meist so lang wie die Zelle selbst. Eine Myofribrille besteht aus einer Kette von sich wiederholenden kontraktilen Untereinheiten, den Sarcomeren. Ein Sarcomer besteht aus parallel angeordneten und sich teilweise überlappenden dünnen Aktinfilamenten und dicken bipolaren Myosinfilamenten. Am positiven Ende sind die dünnen Filamente mit der Z-Scheibe verbunden. Die dicken Filamente bestehen aus polymerisiertem bipolarem Myosin II (ca. 300 Köpfe pro Filament).Sie sind hexagonal um die Aktinfilamente angeordnet. Zur Sarkomerverkürzung kommt es, wenn sich die dicken Myosinfilamente zum positivem Ende der Aktinfilamente bewegen somit zwei Aktinfilamente zusammen ziehen. Außer den beiden Filamenten befinden sich in einem Sarcomer noch viele akzessorische Proteine. Die Z-Scheibe z.B. besteht aus a-Aktinin und CapZ. Sie trennt die Sarcomere voneinander und bindet das positive Ende der Aktinfilamente. Nebulin ist ein riesiges Protein, das die Länge der Aktinfilamente bestimmt. Es befindet sich in der Furche der Aktin-Helix. Tropomodulin capped und stabilisiert das negative Ende der Aktinfilamente. Titin positioniert die Myosinfilamente, es wirkt wie eine molekulare Feder und sorgt dafür, dass das Sarkomer nach der Verkürzung wieder in den Ursprünglichen Zustand gelangt. Initiierung der Muskelkontraktion An der Nervenendplatte wird das Aktionspotential des Nervs an die Plasmamembran des Muskels weitergeleitet. Von dort wird ein Signal an die t-Tubuli (transversal-Tubuli, Einstülpungen der Plasmamembran der Muskelfaser) gesendet. Proteine in der Membran verändern ihre Position, wodurch vom sarkoplasmatischem Retikulum Ca2+-Kanäle geöffnet werden und Ca2+ ins Cytosol gelangt. Es kommt zur Muskelkontraktion. Eine ATPgetriebene Ca2+-Pumpe befördert Ca2+ zurück ins SR. Auf den Aktinfilamenten befinden sich die akzessorischen Proteine Tropomyosin und Troponin. Tropomyosin bindet in der Furche der Aktin-Helix. Troponin ist ein Komplex aus Troponin I, T und C. Troponin I bindet an Aktin und Troponin T. Der Troponin I, T-Komplex verhindert im Ruhezustand, dass Myosinköpfe binden, weil die Bindestelle durch Tropomyosin blockiert wird. Bei Ca2+-Anstieg tritt Troponin C in Wechselwirkung mit Ca2+, wodurch der Troponin I, T-Komplex nicht mehr an Tropomyosin bindet, welches seine Position ändert und somit die Bindestelle für Myosin freigibt. Die 2 Prozesse, die sehr viel Energie verbrauchen sind zum einen die Ca2+-Pumpe, und zum anderen die ATPase vom Myosin-Motor. Herzmuskel Das Herz ist mit ca. 3 x 109 Kontraktionen im Leben der meist beanspruchteste Muskel. Hier sind spezielle Isoformen von Myosin und Aktin vorhanden. Schon geringe Abweichungen (Punktmutationen) sind meist schwerwiegend. Familial hypertrophic cardiomyopathy kann durch verschiedene Punktmutationen in der Motordomäne des Myosins ausgelöst werden. Diese Krankheit löst eine verdickte Vorkammerwand und übermäßiges Wachstum im Herzen aus. FHC führt bei Athleten manchmal ohne jede Vorwarnung zum Tod. Wimpern & Geißeln bestehen aus Mikrotubuli und Dynein. Sie können gezielt bewegt werden. Im Inneren befindet sich das Axonem. Es besteht aus 9 speziellen Doppelmikrotubuli ( = 1 kompletter Mikrotubulus und ein inkompletter MT), die ringförmig um 1 Paar einzelne Mikrotubuli angeordnet sind. In bestimmten Abständen verbinden akzessorische Proteine die Mikrotubuli miteinander. Ciliary Dynein verbindet benachbarte Doppelmikrotubuli. Es sorgt für die schlagende Bewegung der Geißel. Dynein will zum Ende des Mikrotubulus wandern und damit zwei Mikrotubuli gegeneinander bewegen, diese Bewegung wird jedoch durch linking proteins verhindert und die Kraft wird zur Biegung verwendet.