Vorlesung: Zellbiologie 2008
Werbung

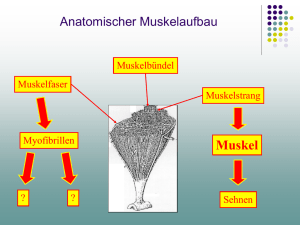
Vorlesung: Zellbiologie 2008 Markus Gütlich [email protected] Das Cytoskelett von Fäden, Schläuchen und steifen Röhren Bilder aus: "kleinem Alberts" Lehrbuch der Molekularen Zellbiologie Alberts et al., Kapitel 17 Komponenten des Cytoskeletts die Fäden die Schläuche die Röhren Aufbau des Zytoskeletts - mechanisches Gerüst der Zelle - verantwortlich für die Form der Zelle - ermöglicht - Zellwanderung - Zellteilung - Muskelkontraktion - Transport der sekretorischen Vesikel 3 Zytoskelettsysteme in der Zelle ⇒ Mikrofilamente (Aktin) ⇒ Intermediärfilamente Intermediärfilamente (Keratine (Keratine ⇒ Mikrotubuli Mikrotubuli (Tubulin) (Tubulin) etc. etc. )) Intermediärfilamente • "intermediär" dick (~10 nm) • hohe Zugfestigkeit • Schutz gegen mechanischen Stress Intermediärfilamente • bleiben erhalten, wenn die Zellen mit – konz. Salzlösungen oder – nichtionischen Detergenzien behandelt werden. – Andere Teile des Cytoskeletts werden dabei zerstört. • umringen den Zellkern – bilden die Kernlamina – Verstärkung unterhalb der Kernhülle • enden oft an Desmosomen – Zell/Zell Kontaktpunkten) Ein starkes, haltbares Netzwerk grün = Keratin widerstandsfähig und seilartig • • • • hohe Zugfestigkeit N- und C-Terminus sind globulär Mittelteil ist stäbchenförmig bildet verdrillte Stränge Monomere, Dimere, Tetramere • α-Helix im Monomer • Supercoiled Helix im Dimer • nichtkovalente Teramere Polymere • verdrillt zum "Seil" • mehrer Gene • "Mittelteile" sind alle ähnlich – gleicher Durchmesser • Kopfgruppen unterscheiden sich – Kontakt zu anderen Proteinen Vorkommen und Bedeutung • Nervenzellen – verstärken Axone von innen • Muskelzellen, Epithelzellen (Haut, Blutgefäße) mechanische Stabilität bei Wachstum und Bewegung mit Intermediärfilamenten → Fasern werden gestreckt ohne Intermediärfilamenten → Zellen zerreißen mechanische Stabilität • punktuell auftretende Kräfte werden verteilt • "Faserverbundwerkstoff" – GFK – Stahlbeton – Holz Gruppen von Intermediärfilamenten 1. 2. 3. 4. Keratinfilamente Vimentin (und vimentinverwandte) Filamente Neurofilamente Kernlamine (bei Tieren) Keratine • sehr heterogene Klasse – – – – – Darm Haut Fingernägel Haare (α-Keratin) Federn (β-Keratin) Plectin • quervernetzendes Hilfsprotein – bes. für Vimentin • Verknüpft auch I.F. mit Actin und Tubulinfasern grün = Plektin, blau = Intermediärfilament, rot = Mikrotubuli Krankheiten im Zusammenhang mit Intermediärfilamenten • Epidermolysis bullosa simplex – Ausbildung der Keratinfilamente ist gestört – Haut ist sehr empfindlich gegen Verletzungen – schon leichter Druck kann sie zerreißen lassen • Mutationen im Plectingen – – – – Merkmale wie Epi. bullosa und Muskeldystrophie (reißen der I.F. im Muskel) Nervendegeneration (reißen der Neurofilamente) Mäuse sterben nach wenigen Tagen Bild: http://www.netzwerkeb.de/e14/e310/e527/index_ger.html Kernlamina: Unterstützung der Kernhülle Die Kernlamina eines Froscheies ist besonders regelmäßig (quadratisch) Unterstützung der Kernhülle • Lamine bilden ein 2D-Netzwerk – Lamin ≠ Laminin – Laminin = extrazelluläres Matrixprotein • Laminnetzwerk zerfällt bei jeder Zellteilung • Zerfall und Aufbau werden durch Kinasen und Phosphatasen gesteuert Phosphorylierung Konformationsänderung schwächere Interaktion der Tetramere Zerfall des Netzweks Mikrotubuli • die steifen Röhren Mikrotubuli • radial angeordnet • wichtig für die Organisation der Zelle • zerfallen vom Ende her und werden wieder aufgebaut • in tierischen Zellen entspringen Microtubuli am "Zellzentrum" (Centrosom) • "Schienensystem" für Transport von Vesiklen, Organellen u. a. Zellbestandteilen • bestimmen die Lage membranumhüllter Organellen Rolle der Microtubuli • Interphasezelle – cytoplasmatische Microtubuli geben der Zelle Struktur • Mitose – cytoplasmatische M. zerfallen – M. bilden Mitosespindeln – ziehen die Chromosomen auseinander Microtubuli brauchen einen Ursprung • Microtubuli brauchen ein organisierendes Zentrum – Centrosom – Spindelpol – Basalkörper Microtubuli in Fagellen und Cilien • Flagellen und Cilien – – – – sind stabile Strukturen überdauern eine Zellteilung sitzen auf der Zelloberfläche sorgen für Bewegung (Flagellen) oder Flüssigkeitstransport (Cilien) – in der Mitte tragen sie ein Bündel aus Microtubuli – (bakterielle Falgellen sind völlig anders aufgebaut) Struktur der Microtubuli • bestehend aus Tubulin ( α und β ) • α und β sind globulär und strukturell sehr ähnlich • nicht kovalent verknüpft • stapelbar • α und β wechseln sich ab • polarer Aufbau, – β-Ende = ⊕-Ende – α-Ende = Ө-Ende • polarere Aufbau → Richtung der Schiene Microtubuli sind Hohlröhren • zu seitlichem Kontakt fähig • 13 parallele Protofilamente bilden eine Röhre • zuerst ein Initialring • dann werden immer neue Dimere angebaut • in vitro geht's an beiden Enden • aber am ⊕-Ende geht's schneller – daher der Name Microtubuli im EMI Bildung der Microtubuli • in speziellen Zentren • bei Tieren am Centrosom (meist nahe am Zellkern) • von hier aus strahlenförmig • am Centrosom Ringe aus γ-Tubulin • jeder γ-Tubulinring ist Ausgangspunkt für eine α/β-Tubulinröhre Centriolen • Centrosom ≠ Centriolen • Centriolen nur bei Tieren • Funktion noch unbekannt • ähneln den Basalkörpern der Cilien Wachstum in vivo • Ө-Ende im Centrosom • Wachstum nur noch am ⊕-Ende • ohne γ-Tubulin keine Polymersiation in vivo • in vitro geht's bei sehr hoher Konzentration dennoch dynamische Instabilität • zuerst nur Wachstum am ⊕-Ende • dann spontan stop – weiteres Wachstum – Schrumpfung (vom ⊕-Ende aus) – vollständiger Abbau • gesteuert durch GTP GTP als Steuerung • jedes Tubulindimer kann GTP oder GDP binden • Tubulin ist eine GTPase • GTP haltige Dimere haben höhere Tendenz zur Multimerisierung • sind dichter gepackt Kinetik der Polymerisation • es gibt immer Monomere im Cytosol • bei schneller Polymerisation ist das Wachstum schneller als die Hydrolyse • ⊕-Ende ist immer GTP beladen • (GTP-capping) • Microtubulus wächst immer weiter aber: • durch statistische Schwankungen ist manchmal die Hydrolyse schneller • ⊕-Ende ist jetzt GdP beladen • kann nicht mehr weiter wachsen • Mikrotubulus schrumpft Störung des Gleichgewichts • Colchicin (aus der Herbstzeitlose) verhindert die Polymerisation • Taxol (aus Eiben) verhindert die Depolymerisation • verschiedene Ursache, gleiche Wirkung: keine Zellteilung mehr Colchicin Taxol selektive Stabilisierung • • • • Anheftung von "capping"-Proteinen Zelle wird polarisiert "wenn Fisch anbeist" bleibt die Schnur im Wasser ansonsten wird sie schnell wieder eingeholt Microtubuli: die "Schienen" der Zelle • Nervenzellen benutzen Tubulin als Transportweg • bis zu 10 cm/Tag • Diffusion wäre viel zu langsam (Jahre) Bewegung sekretorischer Vesikel nicht: durch Diffusion im Zytoplasma sondern: gerichtet entlang des Zytoskeletts ATP-verbrauchende „molekulare Motoren“ Vesikel bewegen sich entlang der Mikrotubuli anterograd: zur Zellperipherie hin (Richtung Plasmamembran) retrograd: zum Zellinneren hin (Richtung ER) retrograd wie kommt die Gerichtetheit zustande?? anterograd Motorproteine je 400 msec • Mitochondien bewegen sich entlang der Mikrotubuli • hierzu dienen die Motorproteine Bewegung eines Motorproteins Bewegung braucht ATP • Wanderung entlang der Mikrotubuli • Bewegungsenergie aus ATP Spaltung Bewegungsmechanismus Motorproteine: Kinesin und Dynein • • • • je zwei globuläre Kopfgruppen binden ATP hydrolysieren ATP (ATPasen) Bindung an Mikrotubuli ist gerichtet (vektoriell) Kinesine und Dyneine • Kinesin wandert zum ⊕-Ende – vom Centromer weg – auswärts gerichtet – anterograd • Dynein wandert zum Ө-Ende – einwärts gerichtet – retrograd Frachttransport • Für jeden Zweck der richtige Transporter Bewegungen sichtbar machen • Riesenaxon eines Tintenfisches • Cytoplasma auspressen • ATP zugeben • Bewegungen verfolgen in vitro Bewegungstest je 1 sec • Mikrotubuli wandern auf dem Objektträger • Kinesine ziehen sie vorwärts in vitro Bewegungstest je 30 sec • ein einzelnes Kinesinmolekül bewegt eine SiO2–Kugel • Kraftmessungen möglich Strukturierung der Zelle Mikrotubuli ER Golgi Kern Cilien und Flagellen • Transport von Schleim (mit Staub) nach oben • im Eileiter: Transport des Eis zum Uterus Epitheloberfläche des menschlichen Respirationstrakts (1 Mrd Cilien / cm²) zwei Bewegungsmuster • Kraftschlag – Cilie ist gestreckt • Erholungsschlag – Cilie ist gebogen • ergibt eine gerichtete Bewegung – Transport von Flüssigkeiten oder Staub über die Zellen Flagellen bei der Arbeit • Spermien und Protozooen werden durch Flagellen angetrieben • Flagellen sind meist länger als Cilien • Bewegung erfolg symetrisch in beide Richtungen 400 Aufnahmen / sec – wellenförmig – als Antrieb geeignet Topologie der Mikrotubuli in Flagellen • 9+2 Anordnung von Microtubuli Dimeren • Ciliendynein sorgt für eine Verbiegung des Flagellums Bewegung durch Verbiegung • freies Tubulin: – Dynein verschiebt die Microtubuli • arretiertes Tubulin – mit Proteinbrücken – Dynein verbiegt die Microtubuli Actinfilamente • die "dünnen Fäden" Actinfilamente: Wir sorgen für Bewegung • • • • Mikrovilli am Bürstensaum des Darmepithels kriechen von Zellen auf Oberflächen Muskelbewegung kontaktiler Ring bei der Zellteilung Entstehung der Aktinfilamente G(lobuläres)-Aktin = monomer ATP-abhängige Polymerisierung F(ilamentöses)-Aktin = polymer Aktinfilament sind polar: ⊕-Ende und Ө-Ende + Aufbau Abbau Topologie des Aktins • Durchmesser 7 nm • dünner als Mikrotubuli • meist kürzer • aber ca. 30 x mehr • ⊕ und Ө-Ende • bilden häufig quervernetzte Netzwerke Polymerisation von Aktin • Aktinmonomere im Cytosol tragen stets ATP oder ADP • die ATP haltige Form polymerisiert • ATP Hydrolyse veringert die Stabilität des Aktin Polymers Aktin und seine Partner Thymosin Profilin Gelsolin Myosin Filamin Fodrin Quervernetzung durch: - Filamin - Fodrin - etc. 3-D Netzwerk Beeinflussung der Aktinpolymerisation • Inhibitoren der Polymerisierung – Aktin-Bindeproteine • Thymosin • Profilin – Cytochalasine (Pilzgifte) • Inhibitoren des Abbaus – Aktin-Bindeproteine • Capping Proteine – Jasplakinolide (Schwammgifte) Phalloidin aus: http://www.cytoskeleton.com/ products/buffers/phdr1.html grüner Knollenblätterpilz aus: http://www.giftpflanzen.com/amanita_phalloides.html • Phalloidin bindet an F-Actin • inhibiert die Depolymerisation Aktin • ca. 5% der Gesamtproteinmenge • davon ½ in polymerer Form • die Konzentration an freiem Aktin ist viel höher als KD – warum polymerisiert es nicht spontan? ¾ Thymosin und Profilin regulieren die Polymerisiation – Thymosin bindet an Aktinmonomere und verhindert deren Polymerisation ¾ Gelsolin kann Aktinnetze zerteilen und löslich machen Kriechbewegung von Zellen • aktiv kriechende Zellen – Amöben (Dictyostelium discoideum), Makrophagen – neutrophile Granulocyten • an der Vorderseite stülpt der Leitsaum Fortsätze aus (Filopodien) • die Fortsätze haften am Substrat an • die Zelle zieht sich darüber hinweg Der Cellcortex • ist ein Aktinnetzwerk • sitzt unterhalb der Membran • stabilisiert diese • vernetzt Spectrin und Ankyrin (Erythrocyten) Lamellipodien und Filopodien • Lamellipodien – blattartig • Filopodien – – – – – – – aus 10 -20 Aktinfilamenten ⊕-Ende zeigt nach außen 0,1 µm breit 5-10 µm lang (bei Nervenzellen bis 50 µm lang) bilden die Spitze des Wachstumskegels am Axon Zelle "tastet" damit die Umgebung ab Filopodium können umgebaut werden und sich zurückziehen Aktinfilamente in einem Lamellipodium capping Y-Verbindungen TEM Bild von Aktinfasern aus einem Frosch-Keratinocyten (sehr beweglich) ARPs, Integrine und Myosin • ARPs: – actin-related proteins – binden an vorhandene Aktinfilamente – bilden Keime für neue Stränge • Integrine – Ankerpunkte für Aktingerüst in der Zellmembran • Myosine – Motorproteine für Aktin Leitsaum eines Lamellipodiums • neue Aktinfilamente entstehen durch Vermittlung des ARPKomplexes • an vorhandenen Filamenten wird seitlich angebaut • wachsende Filamente schieben die Plasmamembran vorwärts rot = neuer Actinstrang orange = ARP-Komplexe blau = Capping-Protein grün = depolymerisierendes Protein • am hinteren Ende erfolgt ATP Hydrolyse und Depolymerisation Die Enden von Actinfasern • A) Reflexions-Interferenzmikroskopie Aufnahme • B) anti-Aktin-Antikörper • Aktinfilamente enden dort, wo die Zelle an der Oberfläche haftet (→ Integrine) Das Motorprotein: Myosin-I • Myosin bindet und hydrolysiert ATP • Energie sorgt für Bewegung am Aktin entlang zum ⊕-Ende • Aktin + Myosin → Muskel Die Myosine • Myosin-I – – – – – – kommt in allen Zelltypen vor hat einen Kopf und einen Schwanz Kopfdomäne bindet an Aktin Kopfdomäne bindet und hydrolysiert ATP Schwanzdomänen unterscheiden sich jeder Schwanz bindet an einen bestimmten Zellbestandteil (z. B. Membranvesikel), der gezogen wird • Myosin-II – in Muskelzellen G-Proteine steuern das Aktingerüst a) ruhender Fibroblast b) Mikroinjektion von aktiviertem Rac ¾ blattartige Lamellipodium c) Mikroinjektion von aktiviertem Cdc42 (Cell division cycle 42 homolog, GTP bindendes Protein, 25kDa) ¾ Bündelung des Aktingerüsts zu Filopodien Muskeln • glatte Muskeln – Darm – Blutgefäße • quergestreifte Muskeln – Skelettmuskeln • Herzmuskeln Myosin-II • • • • zwei Köpfe, zwei Schwänze coiled-coil Struktur im Dimer bipolare Struktur im Polymer nackte Zone in der Mitte besteht nur aus Schwänzen Actin / Myosin Bindung • jeder Myosinkopf bindet an Actin in Richtung ⊕-Ende • Myosinfasern werden gegeneinander verschoben Muskelzellen • riesige Zellen (Muskelfasern) • entstehen durch Verschmelzung viele einzelner Muskelzellen • viele Zellkerne in einer Hülle • im Cytoplasme vor allem Myofibrillen – zylinderförmig – 1-2 µm Durchmesser – bestehen aus Ketten von Sarkomeren Das Sarkomer • ca. 2.2 µm lange Einheit • dünnes Filament – Actin • dickes Filament – Myosin – ca. 300 Myosinköpfe pro Filament • Z-Scheibe – Ankerpunkt für Actinstränge Kontraktion eines Sakomers Muskelkontraktion • gleichzeitiges Verkürzen der Sarkomere • Actin und Myosin – – – – – – gleiten aneinader vorbei behalten ihre unrsprüngliche Länge Bewegung erfolgt unter ATP Verbrauch ca. 5 nm/Einzelschritt bis zu 15 µm/sec ein Sarcomer • voll entspannt ca. 3 µm • voll kontrahiert ca. 2 µm • in weiger als 1 µsec voll kontrahiert Bewegung des Myosinkopfes 1) angeheftet - ohne ATP rigor Konfiguration 2) frei - mit ATP 3) aufgerichtet - nach ATP Hydrolyse 4) vor dem Kraftschlag - Pi wird freigesetzt 5) Kraftschlag - ADP wird freigesetzt Vermeidung einer Überdehnung Alberts et al. Molecular Biology of the Cell 4th Edn., Seite 963 • Titin – verhindert das "heraus springen" der Filamente – bindet an der Z-Scheibe an Teletonin – ist aus zahlreichen Doänen aufgebaut – der Titan unter den Proteinen • • • • • 2 Mio bp Gen 363 Exons 82 KB mRNA 38131 Aminosäuren 4200 kDa Steuerung durch Ca2+ • T-Tubuli (transversal) durchziehen jede Muskelfaser quer • stellen Verbindung zum Sarcoplasmatischen Retikulum her Sarcoplasmatischen Retikulum • • • • spezialisierte Form des ER kommt nur in Muskelzellen vor enthält eine sehr hohe Konzentration an Ca2+ setzt nach membrandepolarisation Ca2+ ins Cytosol frei Ca2+-Kanäle im SR • regieren auf Depolarisation in den T-Tubuli • Ca2+ wird aus dem SR freigesetzt • Ca2+ wird unter ATP Verbrauch wieder ins SR gepumpt Steuerung der Kontraktion durch Ca2+, Troponin und Tropomyosin • Tropomyosin – – – – ist stäbchenförmig lagert sich seitlich an Actin an überspannt 7 Actin Monomere verhindert die Bindung von Myosin Steuerung der Kontraktion durch Ca2+, Troponin und Tropomyosin • Troponin – sitzt am Kopfende von Tropomyosin – bindet Ca2+ – verursacht ein Konformationsänderung von Tropomyosin Nervenzelle "feuert" Plasmamembran der Muskelzelle wird depolarisiert T-Tubuli werden depolarisiert Ca2+ wird aus dem SR freigesetzt Muskel relaxiert Myosin lässt Actin im nächsten Zyklus los und kann nicht erneut binden Tropomyosin verhindert Myosin Bindung Ca2+ Spiegel im Cytosol steigt Ca2+ bindet an Troponin Tropomyosin bindet fest an Actin Troponin bewirkt Änderung der Struktur von Tropomyosin Troponin bewirkt Änderung der Struktur von Tropomyosin Tropomyosin gibt Myosinbindestelle frei Troponin lässt Ca2+ frei Myosin bindet an Actin Ca2+ Spiegel sinkt Muskel kontrahiert Ca2+ wird ins SR zurück gepumpt Mensch tot Ca2+ "blutet" aus dem SR aus Ca2+ Spiegel im Cytosol steigt Ca2+ bindet an Troponin Troponin bewirkt Änderung der Struktur von Tropomyosin Tropomyosin gibt Myosinbindestelle frei Totenstarre (rigir mortis) Muskel bleibt kontrahiert Ca2+ Spiegel sinkt nicht mehr Myosin bindet an Actin Muskel kontrahiert Ca2+ wird nicht mehr ins SR zurück gepumpt