Vgl. Abb. 1.67 Reaktionsfolge der Nitratreduktase
Werbung

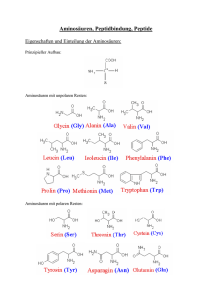
Pflanzenphysiologie Ionenaufnahme 5. Stickstoff-Metabolismus 5.1 Stickstoff-Aufnahme - Stickstoff wird bevorzugt als Nitrat (NO3-), aber auch als Ammonium (NH4+) von höheren Pflanzen aufgenommen; nur Bakterien und Blaualgen können den Stickstoff der Luft (N2) aufnehmen. Pilze sind in der Lage, organisch gebundenen Stickstoff aufzunehmen. - Pflanzenverfügbare N-Quellen im Boden: NO3-, NH4+, Harnstoff sowie Harnsäure (ein Purinderivat) Harnstoff: Harnsäure: Vgl. Abb. Formel H2N-C-NH2 O In der Pflanze muß Nitrat zu Ammonium reduziert werden. Die dem Boden durch landwirtschaftliche Nutzung entzogene Stickstoffmenge muß ihm wieder über organische Verbindungen (oder anorganische Salze) zugeführt werden. Harnsäure ist N-Endprodukt der Vögel, Reptilien und Insekten; sie entsteht beim Purinabbau, z.B. beim Abbau von DNS oder RNS. - Für viele Kulturpflanzen ist N Mangelfaktor, daher Düngung zur Ertragssteigerung; Düngesalze: (natürlich) Chilesalpeter, (synthetisch) Kalkammonsalpeter, Ammoniumnitrat (NH4NO3); zur Erzeugung von 1t mineralischem N-Dünger werden 1t Erdöl verbraucht; organische Dünger: Stallmist (Harnstoff), Vogelexkremente (Harnsäure): Guano, Humus. 5.2 Assimilatorische Nitratreduktion Vgl. Abb. 2.1.117 Kompartimentierung der einzelnen Schritte der photosynthetischen Nitratreduktion der grünen Pflanzenzelle - Pflanzen können N nur in Form von NH4+ in ihre Biomasse einbauen; deshalb muß aufgenommenes Nitrat zunächst zu Ammonium reduziert werden. - Sowohl Pilze als auch grüne Pflanzen reduzieren in 2 enzymkatalysierten Schritten: +5 +3 -3 NO3- Nitratreduktase NO2- Nitritreductase NH4+ -------------- = ----------= 2e 6e Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 1 Pflanzenphysiologie Ionenaufnahme 5.2.1 Nitratreduktase: - - cytoplasmatisches Enzym (Aspergillus: Mr = 190 000, Chlamydomonas: Mr = 500 000); - - prosthetische Gruppen: FAD, Fe und Mo, - - Reduktionsmittel (Elektronenlieferant): NADH + H+, das beim Abbau von Glucose (Glycolyse) anfällt - - Molybdän-Cofaktor: O C / \ H-N H2-N-C \\ N H N / \ OH O H- CCH2 O – P- O C CC = C O C C S S / \ / \ / N Mo / \ H Pteridinringsystem -- Das im Cytoplasma gebildete NO2- ist das Anion einer schwachen Säure. Es hat deshalb das Bestreben, in die undissozierte Säureform (HNO2) überzugehen (über die Chloroplastenmembran wird undissozierte salpetrige Säure transportiert), hierbei entstehen OH- -Ionen, d.h. das Cytoplasma wird alkalisch: NO2- + H2O = HNO2 + OH-- In Kulturpflanzen wird Nitrat in den Blättern reduziert -- Findet die Nitratreduktion in der Wurzel statt (viele Bäume), so wird das bei der Nitratreduktion anfallende OH- bzw. HCO3- (OH- + CO2 = HCO3-) aus der Wurzel ausgeschieden; Alkalisierung des Rhizosphärenbereichs bei überwiegender NO3-Ernährung -- Nitratreduktase ist ein induzierbares Enzym (Pilze und grüne Pflanzen), d.h. ihre Synthese wird durch Nitrat ausgelöst; NH4+ hemmt die Synthese der Nitratreduktase +5 +3 HNO3 Nitratreduktase HNO2 + = 2e Salpetersäure H2O- Salpetrige Säure Die Elektronen stammen vom NADH + H+ Vgl. Abb. 1.67 Reaktionsfolge der Nitratreduktase Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 2 Pflanzenphysiologie Ionenaufnahme 5.2.2 Nitritreduktase - - plastidäres Enzym (Chloroplasten der Blätter, Plastiden der Wurzel) HNO2 Salpetrige Säure Nitritreduktase NH4+ + H2O + OH--------------------- = 6 e , 6 H+ Ammonium Die Elektronen stammen aus dem Ferredoxin (oder : HNO2 + 6 e + 2 H+ = NH3 + O2 (weniger Energie notwendig)) -- Nitrit-Reduktase, ein Enzym, das eine Polypeptidkette mit Sirohäm (Hämgruppe, die an eine Aminosäurekette gebunden ist) und einem tetranuclearen (4) Eisen-Schwefel- Komplex enthält. -- Ferredoxin wird in der Photosynthese reduziert. Wo die Nitritreduktion in nichtgrünen Pflanzenteilen stattfindet, wird vermutlich Ferredoxin mit NADPH2 zu Ferredoxinred. reduziert. Die Zellen enthalten mehr Nitrit als Nitrat-Reduktase-Aktivität; bei Überdüngung kann es deshalb zur Nitratanreicherung kommen (Blattsalat, Rote Beete). -- Wird Nitrat in den Wurzeln reduziert, so werden aus NH4+ Aminosäuren gebildet und vornehmlich die Aminosäure Asparagin über das Xylem in die Blätter transportiert. 5.2.3 Einbau von NH4+ in organische Verbindungen Vgl. Abb. 335 A Aspartat und Glutamat als Ausgangsverbindung für die Synthese verschiedener Aminosäuren, Innerhalb der Chloroplasten wird NH4+ in organische Verbindungen eingebaut: - - Glutaminsynthetase: Glutaminsäure + ATP + NH4+ = Glutamin + AMP + 2 Pi Vgl. Abb. 1.71 NH3-Assimilation mittels Glutaminsynthese und GOGAT-System - - Glutamatsynthase (= GOGAT = Glutamat-Oxalacetat-Glutamin-Aminotransferase bzw. Glutamin-Oxo-Glutamat-Aminosäure-Transferase): Glutamin + -Ketoglutarsäure + (Ferredoxin, 2e + 2H+) = 2 Glutaminsäure Vgl. Abb. 1.71 NH3-Assimilation mittels Glutaminsynthese und GOGAT-System, Abb. ohne Nummer aus Strasburger, Abb. Glutamat-Synthase (GOGAT) - - Glutamat-Oxalacetat-Transaminase: Glutaminsäure + Oxalacetat = -Ketoglutarat + Aspartat Vgl. Abb. ohne Nummer aus Strasburger Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 3 Pflanzenphysiologie Ionenaufnahme - - Aspartat-Familie Aspartat Asparagin, Threonin, Isoleucin; Cystein, Methionin; -Alanin, Lysin Glutamat Glutamin, Prolin; Ornithin, Citrullin, Arginin; gamma-Aminobuttersäure, Lysin - - Synthese weiterer Aminosäuren im Pyruvat-, Serin-, Shikimat- u.a. Stoffwechselwegen. 5.2.4 Stickstofftransport in der Pflanze - - NO3- : Glutaminsäure, Asparaginsäure und Glutamin, Asparagin (Spargel) sowie Serin und Arginin (Apfel, Saxifragaceae) - - Nichtproteinogene Aminosäuren: Citrullin (Betulaceen, Junglandaceen), Canavalin (Leguminosen) - - Formeln nicht proteinogener Aminosäuren Citrullin, Canavalin; Allantoin, Allantoinsäure - - Allantoin und Allantoinsäure sind Harnstoffderivate, die beim Abbau von Purinen entstehen. Sie werden im Phloem und Xylem von Acer-, Platanus- und Aesculus-Arten als Transportsubstanzen benutzt. - - Harnstoff, das Diamid der Kohlensäure spielt nur bei Pilzen als Stickstoff-Speicher bzw. als Entgiftungssubstanz eine Rolle. - - Ammoniumsalze organischer Säuren treten bei Pflanzen mit stark sauren Zellsäften auf (Rheum) (N-Entgiftung, N-Speicherung). - - N-Transportform in den Boraginaceae (z.B. Symphytum). 5.3 Abbau von Aminosäuren Glutamat Dehydrogenase: (Glutaminsäure + H2O + NAD+ (GDH) = 2-Oxoglutarat + NH3 + NADH2 + H+) (Formeln vgl. Abb. Glutamat Synthase (GOGAT)) 5.4 Stickstoffspeicherung - - keine N-Exkretion, da N normalerweise Minimumfaktor in Pflanzen - - Glutaminsäure, Asparaginsäure bzw. deren Amide; Serin, Arginin (Rosaceae, Apfelbaum, Saxifragaceae) Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 4 Pflanzenphysiologie Ionenaufnahme 5.5 Ladungserhaltung im Zuge der Stickstoffassimilation 5.5.1 Beispiel Tomate Hier ist die NO3--Aufnahme von einer entsprechenden K+-Aufnahme begleitet. Mit steigender Nitrataufnahme nimmt in der Tomate die Summe der Kationen sowie der Gehalt an organischen Anionen (Malat) zu, der Gehalt an anorganischen Anionen nimmt ab. Im Verlauf der Nitrat/Nitrit-Reduktion entstehen OH--Ionen in den Mesophyllzellen: Zytoplasma NO3- + 2 e- + 2 H+ = NO2- + H2O NO2- + H2O = HNO2 + OH- Chloroplasten HNO2 + 6 e- + 6 H+ = NH3 + 2H2O NH3 + H2O = NH4+ + OH| | C-OH + NH4+ + ATP = C-NH2 + ADP + Pi + H+ || || O O Nur ein Teil der OH--Ionen wird von den Wurzeln abgeschieden. Die restlichen OH--Ionen werden im PEP/Malat-System der Tomate metabolisiert: OH- + CO2 = HCO3HCO3- + PEP = Oxalacetat + Pi Oxalacetat + NADH + H+ = Malat + NAD+ Aus je einem OH--Ion wird somit ein Carboxylat-Anion gebildet. Dieses dient dem Ladungsausgleich von K+. Vgl. Abb. 2.21 Einfluß steigender Nitratkonzentration auf den Gehalt an Kationen, organischen und anorganischen Anionen bei Tomate 5.5.2 Gramineae Bei den Gramineae wird NO3- im Austausch mit HCO3- aufgenommen. Dieses entsteht durch Decarboxylierung von Malat in der Wurzel. Dementsprechend weisen Gramineae niedrige Gehalte an organischen Anionen auf. Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 5 Pflanzenphysiologie Ionenaufnahme 5.5.3 Bedarfsgerechte Düngung Im Getreideanbau ist man dazu übergegangen, die Aufwandsmenge an N dem Bedarf der Pflanzen anzupassen. Dazu wird im Frühjahr die Menge NH4+-N und NO3--N im Boden bestimmt (Istwert) und die Differenz (Düngerempfehlung) zum Bedarf (Sollwert) (Winterweizen in Mitteleuropa: 120-140 kg N/ha) gedüngt. Beispiel für eine Düngerempfehlung für Winterweizen in Mitteleuropa: Sollwert 120 - 140 kg N/ ha - Istwert 70 - 90 kg N/ ha ---------------------------------------------------Düngerempfehlung ca. 50 kg N/ ha Vgl. Abb. N-Angebot im Frühjahr, Abb. 2.41 Einfluß der N- und K-Konzentration der Nährlösung auf den Kornertrag der Gerste, Tab. Einfluß des pH-Wertes und der P-Düngung auf den Kornertrag der Gerste Tab. 31 Notwendigkeit von mineralischen Elementen für verschiedene Pflanzen 5.5.4 Pflanzenschädigung durch Überdüngung -- zu hohe Konzentration an Düngesalze -- induzierter Nährelementmangel durch einseitige Zufuhr eines anderen: Salz in hoher Konzentration Mangelkrankheit K+ und NH4+ Mn2+ NH4+ Mg Fe Bodenversauerung auf Ca-Mangel-Böden -- Hohe Düngergaben führen zu üppigem Wachstum besonders bei N-Überschuß. Anfälligkeit gegen Krankheiten und Schädlinge wird begünstigt. Vgl. Abb. Wuchs und Blütenbildung von Senfpflanzen in Beziehung zum N-Angebot -- Besonders bei Gewächshauskulturen steigen bei hohem N-Gaben die NO3- -Gehalte im Blattgemüse. -- Der Ertrag von Tomaten, Bohnen, Mais und Porree ist von dem NH4+/ NO3- - Verhältnis im Boden abhängig. Vgl. Abb. 2 Relativertrag -- Symptome überhöhter N-Versorgung. Vgl. Tab. 2 Symptome überhöhter Stickstoffversorgung von Pflanzen Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 6 Pflanzenphysiologie Ionenaufnahme 5.6 Reduktion von molekularem Stickstoff 5.6.1 N2- Fixierer Nur wenige Organismen können den gasförmigen Stickstoff der Luft fixieren. Sie alle gehören den Prokaryoten an. Prokaryoten, die N2 assimilieren: - einige freilebende heterotrophe Bakterien-Arten Azotobacter-Arten Klebsiella pneumoniae Clostridium pasteurianum - das freilebende photoautotrophe Bakterium Rhodospirillum rubrum - einige Blaualgen (Cyanophyceen) Gloeocapsa-, Anabena-, Anabenopsis-, Cylindrospermum-, Nostoc-, Aulosira-, CalothrixTolypothrix-, Mastigocladus-Arten (Heterocysten ausbildende Hormogonales) - symbiotische Blaualgen in Flechten, Cycadeen - symbiotische Bakterien in Leguminosen (Wurzelknöllchen, Rhizobium spec.) Vgl. Fig. 13.3 Wurzelknöllchen - symbiotische Actinomyceten in Angiospermen (Wurzelknöllchen, Actinomyces) Die Blaualge Anabena spec. kommt endophytisch in einem tropischen kleinen Wasserfarn namens Azolla caroliniana vor, wo sie N2 fixiert. Deshalb kann Azolla zur Düngung von Reisfeldern benutzt werden; diese Art von Gründüngung liefert ca 50 kg N/ ha a. Insgesamt kommen N2-Fixierer in sechs von acht Blaualgenfamilien vor. Actinomyceten („Strahlenpilze“) können ebenfalls in Symbiose mit höheren Pflanzen N2 fixieren. Beispiele hierfür sind die Wurzelknöllchen von Erlen (Actinomyces alni) und die Wurzelknöllchen des Sanddorns (Actinomyces eleagni). Eine „synthetische Symbiose“ gelang durch Infektion von Karotten-Zellkulturen mit dem N2fixierenden Azotobacter vinelandii. 5.6.2 Enzyme der N2-Fixierung Die biologische N2-Fixierung liegt bei ca. 100 106 t/ a weltweit (Industrie ca. 30 10 6 t/ a weltweit). Biologisch erfolgt die N2-Reduktion mit dem Enzym Nitrogenase. Es wandelt (ohne Freisetzung von Zwischenprodukten) N2 in NH4+ um, wobei 6 Elektronen (Ferredoxinred), 6 H+ und 6 bis 14 ATP verbraucht werden. N2 + 6 e- + 6 H+ + n ATP = 2 NH3 + n ADP + nPi Vgl. Abb. 12.6 Nitrogenase-System, Abb. 1.69 Reduktion von N2 zu NH3 am Nitrogenasekomplex. Das Enzym Nitrogenase besteht aus 2 Proteinuntereinheiten, einem Eisen-Protein und einem Molybdän-Eisen-Protein. Für die Bereitstellung von 1 mg gebundenem N werden 3-19 mg Kohlenhydrate verbraucht. Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 7 Pflanzenphysiologie Ionenaufnahme Bei Blaualgen werden ATP und Ferredoxinred durch den lichtgetriebenen Elektronentransport bereitgestellt. Die nicht-photosynthetisch aktiven N2-Fixierer bilden ATP in der Atmung und Ferredoxinred mit Hilfe des Enzyms Hydrogenase: Ferredoxin (ox.) + H2 = Ferredoxin (red.) + 2 H+ Die Substratspezifität der Nitrogenase ist relativ gering: Azid (N3-) => N2 + NH3 N2O => N2 + H2O H+ => ½ H2 Acetylen => C2H6 5.6.3 Freilebende N2-fixierende Bakterien Freilebende, in humusreichen Böden vorkommende Bakterien sind z.B. Clostridium pasteurianum, Bacillus amylobacter sowie Azotobacter chroococcum. Als heterotrophe Organismen sind sie auf organisches Material angewiesen. Günstige Wuchsbedingungen finden sie im Rhizosphärenraum, wo sich Wurzelexudate befinden und der O2-Partialdruck gering ist. Hohe Gehalte an mineralischem NH4+ und NO3- im Boden hemmen die Nitrogenasebildung aller N2-Fixierer. 5.6.4 Bindung von N2 durch Knöllchenbakterien Wichtigster N2-bindender Symbiot einiger Nutzpflanzen aus der Gruppe der Hülsenfrüchtler (Leguminosen) ist die Bakterien-Gattung Rhizobium (Knöllchenbakterien) Rhizobien-Arten R. leguminosarum R. trifolii R. phaseoli R. meliloti R. lupinii R. japonicum Wirtspflanzen Pisum, Vicia Trifolium Phaseolus Medicago (Luzerne), Melilotus Lupinus Soja Es handelt sich hier um eine Ernährungssymbiose; die Pflanze liefert den Bakterien Kohlenhydrate und -Ketosäuren, die Bakterien geben der Pflanze im Gegenzug Aminosäuren ab. Die Symbiose verläuft in groben Zügen folgendermaßen: - Die Gattung Rhizobium kommt freilebend im Boden vor; die Bakterien sind polytrich begeißelt. - Durch Lektine auf den Wurzelhaaren vermittelt, erkennen die Bakterien Wurzelhaare ihres Wirtes. - Die Bakterien nisten sich in eine von den Wurzeln abgeschiedene Schleimschicht ein und werfen die Geißeln ab (Zoogloea). Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 8 Pflanzenphysiologie Ionenaufnahme - Die Wurzelhaare reagieren als erstes mit einer Krümmung an der Wurzelspitze, wobei eine oder mehrere Bakterien zwischen die Krümmung eingeschlossen werden. Die Reaktion der Wurzelhaare wird durch Rhizobiengene (nod-Gene) ausgelöst. Diese werden ihrerseits durch Wurzelexudate aktiviert, z.B. dem Luteolin (R. meliloti). - Die Bakterien lösen die Wurzelzellwand an der Spitze der Wurzelhaare punktförmig auf und dringen in das Plasma vor. Die Wurzelhaarzelle reagiert mit Zellwandbildung, in Folge entsteht ein Infektionsschlauch. - Der Infektionsschlauch dringt in die Rindenzellen vor, endet aber vor der Endodermis. - Die Rindenzellen vergrößern sich unter dem Einfluß der Infektion partiell und werden polyploid; es entstehen die Wurzelknöllchen. - Die Infektionsschläuche öffnen sich an der Spitze und die Bakterien treten in das Plasma der Rindenzellen über. - Die Bakterien verändern ihre Gestalt; sie wachsen um das 40-fache und nehmen eine Yförmige Gestalt an (Bacteroide). Die Zahl der Bakterien pro Rindenzelle beträgt ca. 10000. - Die Rindenzellen bilden ein rotes Protein, das O2 transportiert (Leghämoglobin). Es hält damit den O2 von der Nitrogenase fern. - Die Bakterien benötigen für die N2-Fixierung Oxalacetat, NH4+ (von der Pflanze), NO3- oder Glutamin; sie setzen N2 zu NH3 um und liefern den Pflanzen Aminosäuren. - Im Endstadium lösen sich die Knöllchen auf und die Zerfallsprodukte werden teilweise von der Pflanze resorbiert. Die Bakterien (jetzt zahlreicher als bei der Infektion) gelangen in den Boden zurück. vgl. Abb. Luteolin: z.B. in: Richter, G.: Biochemie der Pflanze, Thieme-Verlag, 1996, S. 423. 5.6.5 Stickstoff-Kreislauf Neben der Atmosphäre enthält die Lithosphäre die größten Mengen an anorganischem N: Lithosphäre Atmosphäre Hydrosphäre Biosphäre 19 . 1015 4 . 1015 2 . 1013 2 . 1012 t t t t Zwischen diesen Reservoiren besteht ein lebhafter Austausch (N-Kreislauf). Die wichtigsten Prozesse dieses Kreislaufes sind: - Die Bindung (Fixierung) von molekularem N - Der mikrobiologische Abbau von organischem N im Boden (N-Mineralisation) und - Die Reduktion von Nitrat zu gasförmigen Verbindungen (Denitrifikation). Die Stickstoff-Fixierung erfolgt a) durch N2-fixierende Prokaryoten und b) technisch über das Haber-Bosch-Verfahren Die Mineralisierung des Stickstoffs erfolgt im Boden, wo organische N-Verbindungen in Nitrat umgewandelt werden. Die Mineralisierung des N beginnt mit der Ammonifikation, d.h. mit der Bildung von NH4+ aus organischen N-Verbindungen. NH4+ wird von anderen Mikroorganismen über Nitrit zu Nitrat oxidiert. Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 9 Pflanzenphysiologie Ionenaufnahme - Nitrit-Bildner: Nitrosomonas-, Nitrosolobus- und Nitrospira-Arten. Unter pH 4.0 sind diese Bakterien inaktiv; sie benötigen O2: 2 NH3 + 3 O2 = 2 NO2- + 2 H2O + 2 H+ (ca. – 272 kJ) - Nitrat-Bildner: Nitrobacter-Arten, sie oxidieren NO2- zu NO3-. Sie müssen für den gleichen Energiegewinn mehr NO2- oxidieren als die Nitrit-Bildner NH4+ zu NO2- oxidieren: 2 NO2- + O2 = 2 NO3- (ca. 75 kJ). Beide Arten bilden eine Parasymbiose. Denitrifikation verläuft unter anaeroben Bedingungen wobei die Denitrifikanten (Pseudomonas-, Bacillus-Arten) Wasserstoff auf NO3- übertragen und N2 freisetzen. Die Zwischenstufen sind: NO3- => NO2- => NO => N2O => N2. Aus alkalischen Böden kann Stickstoff als NH3 entweichen. Vgl. Abb. Stickstoffkreislauf 5.7 Schwefelbakterien Farblose Schwefelbakterien finden sich z.B. in nährstoffreichen Tümpeln, vor allem aber in Rieselfeldern (Abwasserreinigung). Sie vermögen S-Verbindungen, wie Schwefelwasserstoff (H2S) zu oxidieren: S2- entsteht bei der Zersetzung organischen Materials oder bei der Sulfatreduktion (z.B. durch Bakterien in den tiefen, sauerstoffarmen Zonen des Schwarzen Meeres) 2 S2- + 4 H+ + O2 = 2 S + 2 H2O (ca. -209 kJ) Diese Reaktion wird z.B. von der Blaualge Beggiatoa und dem Bakterium Thiothrix durchgeführt, die vorübergehend auch Schwefelkugeln in den Zellen ablagern. Arten der Gattung Thiobacillus oxidieren die verschiedensten S-Verbindungen bis zur Stufe des Sulfats: 2 S + 2 H2O + 3 O2 = 2 SO42- + 4 H+ (ca. -498 kJ) Neben Sulfiden (S2-), und Schwefel (S) werden auch Sulfit (SO32-), Thiosulfat (S2O32-), Dithionat (S2O62-), Thrithionat (S3O62-) und Tetrathionat (S4O62-) sowie Thiocyanat (SCN-) oxidiert. Thiobacillus thiooxidans, der größere Mengen Schwefelsäure (H2SO4) produziert, verträgt bis zu 1 N H2SO4. Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 10 Pflanzenphysiologie Ionenaufnahme 5.8 Eisen- und Manganbakterien Arten der Gattung Ferrobacillus (z.B. F. ferrooxydans) oxidieren zweiwertiges Eisen: 4 Fe2+ + 4 H+ + O2 = 4 Fe3+ + 2 H2O (ca. -67 kJ) Die Eisenoxidation liefert nur wenig Energie, deshalb werden enorme Mengen an Substrat benötigt; Eisenbakterien waren z.B. bei der Bildung von Raseneisenerz beteiligt. Manganbakterien oxidieren entsprechend Mn2+ zu Mn4+. Im Boden kommen ferner die Knallgasbakterien vor, die im Gegensatz zu den nitrifizierenden Bakterien nur fakultativ autotroph sind. Sie können auch mit organischen Verbindungen wachsen. Arten der Gattung Hydrogenomonas oxidieren Wasserstoff (Knallgasreaktion): Hydrogenase Reaktion: H2 + ½ O2 = H2O (ca. –239 kJ) Methanbakterien oxidieren Methan zu CO (Methanomonas), Kohlenmonixidbakterien (Hydrogenomonas carboxydovorans) CO zu CO2. Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 11 Pflanzenphysiologie Ionenaufnahme 5.9. Aminosäuren, Peptide, Proteine 5.9.1 Aminosäuren - Proteinogene Aminosäuren sind -Aminocarbonsäuren, es gibt 20 Arten davon - Sie alle haben (mit Ausnahme des Prolins) folgenden Aufbau: COOH H2N C H R Nur beim Prolin ist der Rest R mit der Aminogruppe verbunden (Iminosäure). - Der Rest R ist variabel; man unterscheidet: -- Aminosäuren mit unpolarem Rest Glycin (Gly bzw. G), Alanin (Ala, A),Valin (Val, V), Leucin (Leu, L), Isoleucin (Ile, I), Phenylalanin (Phe, F) und Prolin (Pro, P) -- Aminosäuren mit polarem, aber undissoziiertem Rest Serin (Ser, S), Threonin (Thr, T), Cystein (Cys-SH, C), Cystin (Cys-S-S-Cys), üblicherweise nicht als eigenständige Aminosäure betrachtet, Methionin (Met, M), Tryptophan (Trp, W) und Tyrosin (Tyr, Y). -- Aminosäuren mit polarem, dissoziiertem Rest Säureamide: Asparagin (Asn, N), Glutamin (Gln, Q) saure Aminosäuren: Asparaginsäure (Asp, D), Glutaminsäure (Glu, E) und basische Aminosäuren: Lysin (Lys, K), Arginin (Arg, R), Histidin (His, H) (Asparagin oder Asparaginsäure (Asx, B) (Glutamin oder Glutaminsäure (Glx, Z) Vgl. Abb. 1.1.14 Formeln der 20 proteinogenen Aminosäuren - Funktion der Aminosäuren in Pflanzen -- proteinogene Aminosäuren dienen der Synthese von Peptiden und Proteinen (Enzyme, Membranproteine, Reserveeiweiß) -- die Aminosäuren Glutamin und Asparagin (sowie einige nicht-proteinogene Aminosäuren) dienen dem Stickstofftransport in der Pflanze bzw. der Stickstoffspeicherung -- die Aminosäuren Phenylalanin und Tyrosin sind auch Ausgangsverbindungen für die Phenol- und Ligninsynthese, Phenylalanin, Tyrosin, Tryptophan und Lysin werden für die Alkaloidsynthese (Arzneistoffe) verwendet. Methionin ist Methylgruppen-Lieferant. 5.9.2 Peptide Peptide entstehen durch Kondensation weniger Aminosäuren (Mr 5000 Dalton). Formal kann die Synthese von Peptiden (und Proteinen) als Kondensationsreaktion (Abspaltung von Wasser) gedacht werden. Formal deshalb, weil das Reaktionsgleichgewicht der Reaktion Aminosäure + Aminosäure => Peptid + Wasser auf der linken Seite liegt; d.h. nur die Hydrolyse ist eine endergone Reaktion unter zellulären Bedingungen. Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 12 Pflanzenphysiologie Ionenaufnahme COOH COOH H2N C H + H2NC H = H2N C H + H2O R1 R2 R1 Aminosäure 1 Aminosäure 2 N- Terminus Formale Synthese eines Dipeptids O H COOH C N C H R/2 C-Terminus Beispiele für Peptide - Glutathion = Glutaminsäure-Cystein-Glycin 2 x Gluthation-SH + NADP = Gluthation-S-S-Gluthation + NADPH2 Diese Reaktion dient der Aufrechterhaltung eines bestimmten Redoxpotentials in der Zelle und zum Schutz freier SH-Gruppen in Enzymen. - Penicillin (aus dem Pilz Penicillium notatum) Schädigt die bakterielle Zellwand und bringt die empfindlichen Arten zum Absterben. Penicillin ist ein Dipeptid aus Valin-Cystein-(Säure). CH2 S H3C C H HOOC C H Valin CH CH NH CO R N C O Cystein Säure Vgl. Abb. Peptidkette 5.9.3 Proteine Proteine entstehen (formal) durch Kondensation von ca. 100 bis 10000 Aminosäuren (Mr =104 – 106 Dalton) zu kettenförmigen Molekülen. Diese haben (wie die Peptide) ein Nterminales und ein C-terminales Ende. Charakteristisch ist die Wiederholung folgender Struktur: H — N C C H R O n Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 13 Pflanzenphysiologie Ionenaufnahme sowie die Peptidbindung H C N O = H C = N + O- Sie entsteht, wenn Aminosäuren über die Carboxyl- bzw. Aminogruppe miteinander verknüpft werden: H O N C C H R1 H O H O N C C N C C H R2 H R3 Die Reihenfolge der Aminosäuren vom N-terminalen Ende zum C-terminalen Ende heißt Primärsequenz. Heute kennt man die Sequenz von einigen Tausend Proteinen. Die Reihenfolge der Aminosäuren in einem Protein ist in den kodierenden Regionen der DNS festgelegt. Die Proteinsynthese findet an den Ribosomen statt. Die Peptidkette jedes Proteins ist in einer bestimmten Weise im Raum angeordnet. Hierfür verantwortlich ist die Reihenfolge der Aminosäureseitenketten und ihre Wechselwirkungen untereinander. Cysteinreste können zu Cystin unter Ausbildung einer Disulfidbrücke covalent verbunden sein (Es gibt spezielle Enzyme, die für die Knüpfung dieser Bindung verantwortlich sind). Daneben wird die Anordnung der Peptidkette im Raum durch nicht-covalente Bindungen zwischen den Aminosäure-Resten stabilisiert (Wasserstoffbrücken, Salzbindungen, Van der Waals sche Kräfte, hydrophobe Wechselwirkungen). Die räumliche Anordnung der Peptidkette nennt man Konformation (Faltung der Peptidkette). - Sekundärstruktur Häufig sind Teile der Peptidkette in regelmäßig sich wiederholende Elemente gefaltet, die -Helix und die -Faltblatt-Struktur. -- -Helix Die -Helix hat eine stabförmige Struktur, wobei das Rückgrad der Peptidkette zu einem Zylinder aufgewunden ist, von dem die Seitenreste der Aminosäuren nach außen abstehen. Diese Struktur wird durch H-Brücken zwischen den –NH und –C=O-Gruppen der Peptidbindungen stabilisiert. Dazu wird eine H-Brücke zwischen der –C=O-Gruppe einer Aminosäure n und der -NH-Gruppe einer in linearer Sequenz liegenden Aminosäure n+4 gebildet. Eine volle Umdrehung der Helix entspricht 3,6 Aminosäureresten, wenn 10 Aminosäuren beteiligt sind (3,610 –Helix). In Proteinen findet man nur rechtsgängige -Helices. Glutaminsäure, Alanin, Leucin und Methionin sind starke -Helixbildner. Vgl. Abb. 2.31 – 2.32 -Helix Fig. 3.26 und 3. 26 a) -Helix Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 14 Pflanzenphysiologie Ionenaufnahme -- -Faltblatt Im Gegensatz zur -Helix sind an der -Faltblatt-Struktur verschiedene Teile (Stränge) der Peptidkette beteiligt. Die -Faltblatt-Struktur wird ebenfalls durch H-Brücken stabilisiert, jedoch werden diese zwischen den –C=O und –NH-Gruppen unterschiedlicher Kettenabschnitte gebildet. Die Stränge können in derselben Richtung verlaufen (paralleler Verlauf der Ketten) oder sie können entgegengesetzt verlaufen (antiparalleler Verlauf der Ketten). Das Seidenfibroin besteht z.B. fast ganz aus antiparalleler -Faltblatt-Struktur. Tyrosin, Valin und Isoleucin sind starke Faltblattbildner. Vgl. Fig. 3.27 Part of the ß-sheet structure of carboxypeptidase A, Fig. 3.28 Diagrammatic illustration of a Type I ß-turn in a protein -- -Schleife (loop) Die Richtungsumkehr einer Peptidkette bezeichnet man als -Schleife. - Tertiärstruktur Ca. 50-60 % der Aminosäure-Bausteine liegen als Faltblatt- und -Helixstruktur vor. Die Anteile sind proteinabhängig. Häufig konzentrieren sich die Faltungsmuster (Proteine mit mehr als 180 Aminosäure-Resten) auf zwei oder mehrere Bereiche (Domänen). - Quartärstruktur Die meisten Proteine lagern sich zu Einheiten von 2 bis 8 zusammen. Dabei sind diese Einheiten meist gleich groß, man nennt sie Untereinheiten. Das Innere von Proteinen besteht häufig aus unpolaren Aminosäureresten wie Leucin, Valin, Methionin und Phenylalanin. Die polaren Reste findet man bevorzugt auf der Außenseite, sie bestimmen seine (pH-abhängige) Ladung. Disk.: Pflanzenphysiologische Vorlesung – Kurzfassungen File : PFLA-5K.doc 15